三种荧光定量PCR检测方法比较
荧光定量PCR检测技术

如果检测到荧光信号超过域值被认为是 真正的信号,它可用于定义样本的域值 循环数(Ct)。 Ct值的含义是: 每个反应管内的荧光信号达到设定的域
值时所经历的循环数。
什么是C(t)值
C(t)
Threshold(域值)
为什么要引入C(t)值
Endpoin
96 replicates of B7 gene molecular beacon
1 、采用闭管检测,不需 PCR 后处理, 并采用dUTP-UNG酶的防污染系统,扩 增和检测一次同时完成。不需开盖,不
产生污染,避免了假阳性。
FQ-PCR与普通PCR的区别
2 、探针与被检 DNA 序列特异杂交, 增强了特异性。
A、上下游引物和探针三道关卡控制其 特异性; B、引物和探针都比较长,退火温度较 高,非特异性扩增几率减少。
FQ-PCR与普通PCR的区别
5、可以多重检测。
如果检测两种以上的基因片断,可以对各个 基因分别设计探针和引物,在不同的反应管 中进行TaqMan检测,或者将各自的探针分 别标记不同的荧光信号,在同一个反应体系 中检测多个基因片断。
二、SYBR荧光染料原理
在PCR反应体系中,加入过量SYBR荧 光染料,SYBR荧光染料特异性地掺入 DNA双链后,发射荧光信号,而不掺入 链中的SYBR染料分子不会发射任何荧 光信号,从而保证荧光信号的增加与 PCR产物的增加完全同步。
FQ-PCR与普通PCR的区别
3、可定量结果,准确灵敏地反应了 病原体的感染和治疗恢复情况。
FQ-PCR与普通PCR的区别
4、光谱分析仪直读结果,自动分析, 增强了 灵敏性和客观性。能够实时检测,即一边PCR, 一边检测PCR的结果,而不需要在PCR结束之 后进行核酸电泳来显示PCR反应的结果,(因 此实时荧光PCR检测技术操作更简单;也避免 了核酸电泳非常难以回避的化学污染和核酸污 染等严重问题);
荧光定量PCR办法探针法VS染料法

荧光定量PCR办法探针法VS染料法精⼼整理荧光定量PCR⽅法:探针法VS染料法?荧光定量PCR⼜称qPCR,是⼀项⾮常常见的分⼦⽣物学实验技术。
荧光定量PCR 荧光为基础对核酸进⾏定量分析,其应⽤⾮常⼴泛,可以⽤于检测基因的表达量(RNA 的丰度),验证表达谱芯⽚或转录组测序的数据,确定病原体的载量,对⽚段的拷贝数(CNV)进⾏分析,对基因进⾏分型等等。
⼤部分研究者主要的应⽤是对基因的表达量进⾏测定,其原理为通过监控反应体系中荧光强度的变化,记录检测荧光达到阈值时的循环数(Ct值)。
从理论上说,起始模板量和Ct值密切相关,因此我们通过判读Ct值从⽽对样本进⾏定量。
在进⾏荧光定量PCR时,从技术和产品来说,我们往往会有许多选择,尤其是⽅法的选择,对最终结果的准确性⾄关重要。
荧光定量PCR从⽅法上来说可以分为染料法和探针法两种。
探针法?染料法⼀、染料法在国内,染料法⼀般采⽤DNA染料SYBRGreenⅠ,染料法使⽤简单,成本也相对较低,因此会有很多国内研究者会选择使⽤染料法进⾏后续实验。
在染料法荧光定量PCR实验中,染料能够与双链结合,从⽽发光,⽽在游离状态下,SYBRGreenI发出微弱的荧光。
所以,⼀个反应发出的全部荧光信号与出线的双链DNA量呈⽐列,且会随扩增产物的增加⽽增加。
但是染料法检测的是体系中的所有双链DNA,因此⼀些⾮特异性扩增或者引物⼆聚体的出现,会极⼤的影响真实结果的准确性。
为此,⼀些⼚商提供ROX作为内部荧光参考标准,⽤来校正背景,但是即便如此,染料法是否只有⼀种。
⼆、TaqMan探针法光探针。
FAM 或Hex扩增时(在延伸阶段),Taq酶的5'-3'链,就有⼀个荧光分⼦形成,实现了荧光信号的累积与PCR产物形成完全同步,这也就是探针法定量的原理。
探针法与染料法的最⼤区别在于,理论上探针法中的荧光信号只来源于⽬标序列,也就是不受⾮特异性扩增及引物⼆聚体的影响。
除此之外,⼈们还可以利⽤不同探针,在⼀个体系中使⽤不同的荧光标记同时检测多种指标,达到节省实验成本的⽬的。
定量PCR基本原理及方法

FRET 定量分析,熔解曲线分析,基因型分析
Ampliflour Probe,LUX 定量分析
➢ 基因型分析
利用扩增信号的种类来分型 —— Taqman 根据熔解曲线的不同来分型 —— FRET, Molecular Beacon
➢ 荧光定量PCR的定量原理
RePaCl-Rti的m理e论C方he程m:isYt=rxie×s(1+ Ev)n
Y:扩增物数量; X :起始模板数量;Ev:扩增效率;n:扩增循环数
1. 终点法定量原理 前提:在最佳实验、循环次数n一定、Ev相同 原理:根据扩增产物的量计数反应物中原始分子数,即: lnx=lnY-n×ln(1+Ev)=lnY - b (b为常数)
R
3’
3’
3’
5’
QQQ
Q
5’
分子信标(Molecular Beacon Probe)
R ExcitatEiomnission Q
Excitation
荧光共振能量传递(FRET Probe)
Oligo 1: Fluorescein Excitation
Transfer
Oligo 2: LC Red 640 Emission
2. 实时检测法定量原理 前提:在最佳实验、相同Ev以、扩增产物量相同 原理:反应物中原始分子数(X)与其所需要的扩增循环次数(n)成反比, 由此计算出标本中靶分子的准确含量,即: LgX=LgY–n×Lg(1+Ev)=b - n×a (a、b为常数)
✓ n: 扩增循环数的确定
PCR efficiency =[10(-1/slope)]-1 Where slope=1/m
诺如病毒检测方法

诺如病毒检测方法
一、实时荧光定量PCR法。
实时荧光定量PCR法是一种高灵敏度、高特异性的诺如病毒检测方法。
该方法利用PCR技术检测样本中的诺如病毒RNA,通过实时荧光信号来定量检测病毒载量。
实时荧光定量PCR法能够在短时间内准确检测出诺如病毒,是目前常用的检测方法之一。
然而,该方法需要昂贵的设备和专业的操作技能,不适合于一般的实验室条件。
二、免疫层析法。
免疫层析法是一种简便快速的诺如病毒检测方法。
该方法利用特异性抗体与诺如病毒抗原结合,形成免疫复合物,通过色素或荧光信号来检测病毒的存在。
免疫层析法操作简单,无需昂贵的设备,适合于基层医疗单位和野外应急检测。
然而,免疫层析法的灵敏度和特异性较PCR法稍逊,可能存在假阳性或假阴性结果。
三、电子显微镜法。
电子显微镜法是一种直接观察诺如病毒颗粒的检测方法。
该方法通过对样本进行浓缩和纯化处理,然后利用电子显微镜观察样品中的病毒颗粒。
电子显微镜法能够直接看到诺如病毒的形态特征,具有极高的特异性。
然而,该方法需要昂贵的设备和专业的操作技能,且不能进行病毒载量的定量分析,因此在实际应用中较少使用。
综上所述,针对诺如病毒的检测,实时荧光定量PCR法具有高灵敏度和高特异性的优势,但需要昂贵的设备和专业的操作技能;免疫层析法操作简单,适合基层医疗单位和野外应急检测,但灵敏度和特异性较PCR法稍逊;电子显微镜法具有极高的特异性,但设备昂贵且不能进行定量分析。
在实际应用中,应根据实际情况选择合适的检测方法,以确保诺如病毒的及时检测和有效控制。
荧光定量pcr两步法和三步法

荧光定量pcr两步法和三步法
荧光定量PCR(qPCR)是一种高效、灵敏、特异性强的PCR技术,可以用于检测和定量DNA或RNA。
在qPCR中,荧光信号与PCR 产物的数量成正比,因此可以通过荧光信号的强度来定量PCR产物的数量。
qPCR有两种常见的方法:两步法和三步法。
两步法是最常用的qPCR方法之一。
在两步法中,反应分为两个步骤:第一步是反转录,将RNA转录成cDNA;第二步是PCR扩增,使用荧光探针或SYBR Green等荧光染料来检测PCR产物。
两步法的优点是简单易行,适用于大多数qPCR应用。
但是,两步法需要使用反转录酶来合成cDNA,这可能会引入反转录酶的偏差和不确定性。
三步法是另一种qPCR方法,它将反应分为三个步骤:第一步是反转录,将RNA转录成cDNA;第二步是前置扩增,使用特定的引物对目标序列进行前置扩增;第三步是PCR扩增,使用荧光探针或SYBR Green等荧光染料来检测PCR产物。
三步法的优点是可以减少反转录酶的偏差和不确定性,提高PCR的特异性和灵敏度。
但是,三步法需要进行前置扩增,增加了实验的复杂性和成本。
无论是两步法还是三步法,qPCR都是一种非常有用的技术,可以用于检测和定量DNA或RNA。
qPCR在医学、生物学、环境科学等领域都有广泛的应用,例如检测病原体、基因表达分析、环境污染监测等。
随着技术的不断发展,qPCR将会在更多的领域得到应用,
并为科学研究和临床诊断提供更加精确和可靠的数据。
荧光 定量 pcr仪 对比 方法

荧光定量 pcr仪对比方法荧光定量PCR(qPCR)是一种用于检测和定量特定DNA序列的技术,而PCR仪是用于进行PCR反应的仪器。
下面我将从荧光定量PCR和PCR仪的原理、优势、应用以及操作方法等方面进行对比。
首先,荧光定量PCR是一种在PCR过程中实时监测DNA扩增的技术,通过在PCR反应体系中加入荧光探针或染料,可以在PCR反应过程中实时监测DNA的扩增情况。
而PCR仪是用于进行PCR反应的仪器,它提供了恒温环境和PCR反应所需的温度变化,使得PCR 反应能够进行。
其次,荧光定量PCR相较于传统的终点PCR具有明显的优势,包括更高的灵敏度、更广的动态范围和更准确的定量能力。
荧光定量PCR还可以实现多重PCR反应,用于同时检测多个靶标。
而PCR 仪则是用来提供PCR反应所需的温度变化,保证PCR反应的进行。
在应用方面,荧光定量PCR广泛应用于基因表达分析、病原体检测、基因型分析等领域,尤其在医学诊断和生物学研究中有重要应用。
而PCR仪则是用于进行PCR反应的仪器,广泛应用于科研实验室、医学诊断等领域。
在操作方法上,荧光定量PCR需要在PCR反应体系中加入荧光探针或染料,并通过荧光定量PCR仪实时监测PCR反应过程中的荧光信号,从而获得DNA扩增的实时数据。
而PCR仪的操作相对简单,一般需要设置PCR反应的温度程序和时间,然后将反应混合液加入反应管中放入PCR仪中进行反应。
总的来说,荧光定量PCR和PCR仪在原理、优势、应用和操作方法上有明显的不同。
荧光定量PCR是一种用于实时监测DNA扩增的技术,具有更高的灵敏度和定量能力,广泛应用于基因表达分析、病原体检测等领域;而PCR仪是用于提供PCR反应所需的温度变化,操作相对简单,广泛应用于科研实验室、医学诊断等领域。
希望这些信息能够帮助你更好地了解荧光定量PCR和PCR仪。
转染效率的测定方法

转染效率的测定方法
一、实时定量PCR检测
实时荧光定量PCR (Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法。
通过内参或者外参法对待测样品中的特定DNA序列进行定量分析的方法。
Real-time PCR是在PCR扩增过程中,通过荧光信号,对PCR进程进行实时检测。
由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。
但是,荧光定量PCR所检测的是转染后细胞中待测基因的mRNA的表达水平,对于目的基因的蛋白表达水平不能够检测;
二、Wester Blot检测
Western Blot又称蛋白质免疫印迹(免疫印迹实验),其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或者生物组织样品进行着色,并通过分析着色的位置和着色的深度获得特定蛋白在所分析的细胞或者组织中表达情况的信息。
Western Blot所检测的是组织或者细胞中蛋白质的表达水平。
三、流式细胞术
流式细胞术(Flow Cytometry,FCM)是一种在功能水平上对细胞或者其他生物粒子进行定量检测和分析的检测手段,它可以高速分析上万个细胞,并能同时从一个细胞中检测得到多个参数,与传统检测方法相比具有更加快速、准确以及定量等特点。
使用流式细胞术检测转染效率可以更加精que的确定转染的效率,对转染效率进行量化。
四、荧光显微镜观察
当我们转染的质粒DNA含有荧光蛋白基因是,可以通过荧光显微镜观察的方法来确定转染的效率,在荧光显微镜下,可以观察到荧光的强弱以及荧光的效率。
相对荧光定量PCR三种常用方法、注意事项
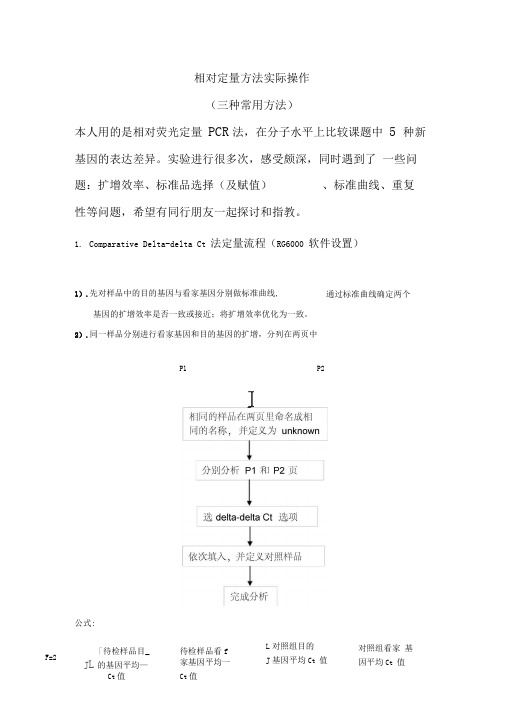
相对定量方法实际操作(三种常用方法)本人用的是相对荧光定量PCR法,在分子水平上比较课题中5 种新基因的表达差异。
实验进行很多次,感受颇深,同时遇到了一些问题:扩增效率、标准品选择(及赋值)、标准曲线、重复性等问题,希望有同行朋友一起探讨和指教。
parative Delta-delta Ct 法定量流程(RG6000 软件设置)1).先对样品中的目的基因与看家基因分别做标准曲线,基因的扩增效率是否一致或接近;将扩增效率优化为一致。
2).同一样品分别进行看家基因和目的基因的扩增,分列在两页中P1 P2公式:通过标准曲线确定两个F=2「待检样品目_待检样品看fJ L的基因平均—家基因平均一Ct值Ct值L对照组目的J基因平均Ct 值对照组看家基因平均Ct 值IComparative Delta-delta Ct 法的特点、注意事项及实际应用1). Comparative Delta-delta Ct法是很常用的一种相对定量方法,其最大特点是,当优化的体系已经建立后,在每次实验中无需再对看家基因和目的基因做标准曲线,而只需对待测样品分别进行PCR扩增即可。
2).其缺点是,每次实验都默认目的基因和看家基因的扩增效率一致,而并非真实扩增情况的反映,这里势必存在一定的误差。
3). Comparative Delta-delta Ct法展开定量实验前,在预实验中,必需对目的基因和看家基因做两组标准曲线。
Rotor-Gene的软件会自动给出两组标准曲线的R值、扩增效率等信息,如果两组标准曲线的斜率,即M值的差小于0.1,那么后续实验中就可以用Comparative Delta-delta Ct法进行相对定量分析。
反之,如果M差值大于0.1,就无法用该方法进行相对定量分析。
此时的解决方法有两种,一是优化实验,使两组标准曲线的斜率差值小于0.1,二是换用其它的相对定量方法。
应用实例:如上图,将标准品进行梯度稀释后,分别对目的基因( Gene of Interest )和看 家基因(Housekeeper Gene )做标准曲线。
荧光定量PCR中探针法与染料法的区别

荧光定量PCR中探针法与染料法的区别:一、荧光定量PCR中探针法与染料法的描述:1.荧光定量PCR探针法:探针法即除了引物外另外设置一个探针,在探针的两端分别带上发光集团和淬灭集团,这个时候,两个平衡不发光,但是当DNA 通过引物合成的时候,探针被折断,释放出发光集团和淬灭集团,两个距离较远,发光集团产生荧光,被机器收集到信号,从而检测基因的量2、荧光定量PCR SYBR Green 染料法:染料能够与双链结合,当PCR扩增的时候,染料结合到DNA上,从而发光,单个的染料不发光,这样就能收集到信号,我们可以看出,染料法特异性不强,只要是双链的DNA都回结合发光。
二、荧光定量PCR中探针法与染料法的优缺点1、探针法通过探针可以增加反应收集信号的特异性,只有探针结合的片段上发生扩增才能收集到信号,能够用多重体系反应的方法,能够预测和提前进行反应条件的优化,缺点是要合成探针,成本高2、染料法经济实惠,可以做溶解曲线,分析全部PCR产物的TM值,缺点就是特异性没有探针法好【分享】定量pcr仪选则宝典:各自精彩的选择如何选择合适的定量PCR仪定量PCR仪主要由两部分组成,一个是PCR系统,一个是荧光检测系统。
选择定量PCR仪的关键——由于定量PCR必需借助样本和标准品之间的对比来实现定量的,对于定量PCR系统来说,重要的参数除了传统PCR的温控精确性、升降温速度等等,更重要的还在于样品孔之间的均一性,以避免微小的差别被指数级放大。
至于荧光检测系统,多色多通道检测是当今的主流趋势——仪器的激发通道越多,仪器适用的荧光素种类越多,仪器适用范围就越宽;多通道指可同时检测一个样品中的多种荧光,仪器就可以同时检测单管内多模版或者内标+样品,通道越多,仪器适用范围越宽、性能就更强大。
荧光检测系统主要包括激发光源和检测器。
激发光源有卤钨灯光源、氩离子激光器、发光二极管LED光源,前者可配多色滤光镜实现不同激发波长,而单色发光二极管LED价格低、能耗少、寿命长,不过因为是单色,需要不同的LED才能更好地实现不同激发波长。
定量PCR基本原理及方法

✓ Ct值与起始模板的关系
logN=log N0 +nlogE n=Ct 每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系。利用已知起始拷贝数 的标准品作出标准曲线,根据未知样品的Ct值,即可计算出该样品的起始拷贝数。
Y轴—Ct值
6
X—起始拷贝数的对数
✓ 绝对定量——未知浓度的样品与标准曲线相比较
Excitation
R
3’
11
3’
3’
5’
QQQ
Q
5’
分子信标(Molecular Beacon Probe)
R ExcitatEiomnission Q
Excitation
12
荧光共振能量传递(FRET Probe)
Oligo 1: Fluorescein Excitation
Transfer
野生型 突变型 杂合型
21
利用熔解曲线检测基因突变 FRET探针进行熔解曲线分析确定基因型
FRET探针与模板结合时,因共振能量的传递而信号增强,而当在Tm 值时, FRET探针与PCR产物分开,荧光信号减弱。通过实时捕捉到的PCR产物在熔解过程 中荧光信号的变化,得到PCR产物的熔解曲线。因为发生基因突变的PCR产物有特定 的Tm 值,通过测定探针与PCR产物分开时的熔解温度Tm值,就能确定样品的基因型。
8
内掺式染料 SYBR-Green I
Excitation
5’
3’
SG
Emission
SG
SG
3’
SG
5’
SG
9
内掺式染料 SYBR-Green I
Excitation
SG
5’
3’
染料法和探针法荧光定量PCR(RT-qPCR)的优缺点比较

染料法和探针法荧光定量PCR(RT-qPCR)的优缺点比较一、荧光染料法(SYBR Green)其原理是:在PCR反应体系中加入过量荧光染料,DNA扩增的过程中,荧光染料特异性地掺入DNA双链,发射荧光信号,随着反应的进行,荧光强度逐渐增强,并且可以实时测量。
如果你要扩增你的目标样品40个循环,在最后一个循环结束时检测到的荧光会比在第10个循环测得的荧光强很多。
优点:1、成本较低,适合大规模的实验。
2、在实验设计阶段非常省时,因为它只需要合适的引物设计。
缺点:1、特异性不是很高。
染料可以插入任何双链DNA,包括引物二聚物和非特异性产物。
2、如果引物二聚体存在或者产物受到污染,得到的结果会不可靠。
3、更容易与低丰度的目标产生非特异性荧光。
需要更多的时间进行结果分析。
二、寡核苷酸探针(Taqman)这种方法涉及使用荧光标记的寡核苷酸(短DNA分子),探针通常在5 端和3 端都被标记。
在探针的5’端有报告基团,3’端设计淬灭基团,当报告基团接近淬灭基团时,不会检测到荧光信号。
RT-qPCR反应时,寡核苷酸两个基团分离,即可检测到荧光信号,并与PCR产物同步。
使用这种方法的荧光检测依赖于两个过程:1)引物与目标序列的结合(2)探针与引物下游互补序列的结合。
优点:1、更有可能只放大所需的产物,由于引物和探针的结合具有特异性。
2、不需要解离曲线,只有探针与正确的目的序列结合时才能检测到荧光。
3、由于具有特异性,数据更可靠。
4、数据分析时节省时间。
缺点:1、需要大规模实验时耗费成本高。
2、需要更长的时间来设计实验,因为需要好的引物和探针。
总的来说,这两种荧光检测方法都很有效,但对于你的具体实验,可以选择适合的方法。
3种荧光定量PCR试剂检测HBV-DNA结果比较

方 法 ) 和 上 海 科 华 生 物 工 程 股 份 有 限公 司 ( c方 法 )提 供 ,在有 效期 内使用 。 2 3 检 测 方法 . 采用 F Q—P R 方 法 ,严 格 按 照 C 说 明书进行 操作 ,仪器 及操 作人 员一 致 ,根据 试剂 供应 来 源及操 作 条件不 同 ,分 为 3种 方法 。深圳 匹
下。
材 料 与 方 法
1 标本来 源
1 1 患 者 标 本 2 0 . 4 0份 患 者 血 清标 本 均来 自本
院 20 0 9年 1 7月住 院和 门诊 乙肝 患者 。采 血用 真 —
本 采用 A方 法检 测 ,检 出 H V—D A 阴性 或 阳性 B N
标 本用 B、C方 法 复 核 ;对 照 标 本 采 用 A B 、 、C 方 法检 测 。
作者单位 :永康市第一人 民医院,浙江 永康 3 10 230
HB c阳 性 的 患 者 共 4 8份 ,阳 转 率 为 2 .0 , 50 %
其他 类型 病毒 血 清 学标 志 的患 者 4 8例 ,阳转 率 为
1 . 0 。A方 法 检 出的 9 25% 6份 H V —D A 阳性Байду номын сангаас标 B N
基基 因诊断技术有限公 司试剂盒为 A方 法 ,其扩 增 条件 为 3 ℃ 3mi,9 o n 2C 5s 0C 7 n 2C 1mi;9 o ,6 o
3 ,4 0s 0个 循 环 ;4  ̄ 0 ,1个 循 环 。上 海 科 华 0C 1s 生物 工程 股 份 有 限公 司试 剂 盒 为 B方 法 ,其 扩增 条件 为 3 q i,9 o n 2C 5s 0 7C 3 mn 2C 1mi;9 o ,6 ℃ 3 s 0个循 环 ;4 ℃ 1 ,1个 循 环 。 广 州 中 山 0 ,4 0 0s 大学 达安 基 因股 份 有 限公 司试 剂 盒 为 c方 法 ,其
3种荧光定量PCR试剂检测HBV-DNA结果比较

限公 司 、广 州中山大学 达安基 因股份有 限公 司和上 海 申友
基 因技 术诊断公 司提 供 , 在效期 内使用 。
3 检测方法 采用 r -Ct ' P r 方法 ,操作严 格按 照说 明书进 Q
行 ,仪器及操作人 员一致 。根据试剂 供应来 源及操 作条 件
不同 ,分 为 3种方 法 。病 人标 本 采 用 A方 法 检测 ,检 出
肝患者 23 33份血清标本 ,均未 经抗病毒 药物治疗 ,其 血清 病毒学标志检测用 时 间分辨荧 光免疫 法 ,结果为 H s s阳 BA
性、邸 eg A 阳性、抗 H e阳性。采血用 5 DA抗凝管, B %E T
分离血清至 4U冰箱 内保 存。3 ' d内检测完 毕。其 中检 出 4 8
35 1 ;2 100 .宁 波 市 传 染 病 医院
在的可能 ;也非由于病 毒数 量较少 的原 因 , 4 份 阴性 标 在 8
维普资讯
・
2 ・ 0
浙江预防医学 20 07年第 l 9卷第 1 期 0
Ze agPe e ,O t e 20 ,V l 9 hj n rvM d c br 07 o 1 i o
—
,
N .1 o 0
—
3种 荧 光 定量 P R试 剂 检 测 HB — N C V D A结果 比较
是反 映 H V复制的程度 ,考核抗病毒 药物治疗 效果 的重 要 B
依据 。用 P R检测 H VD A是最常用 的检测方法 ,由于该 C B .N 法受一系列的技术 以及人 为 因素影 响 ,易使 检测结 果产 生 误差 ,甚 至造成假 阴性 的结果 。为 此 ,我 们对 4 8份 H V B. D A检测 阴性标本 ,用 多种不 同厂家生产 的 P R试剂进 行 N C
pcr应用中确认RNA的质量常用的三种方法

pcr应用中确认RNA的质量常用的三种方法实时荧光定量PCR技术是通过测定RNA的转录水平来评估基因的活力。
RNA样本提取的质量直接影响基因表达分析。
影响RNA品质的因素有以下三种:RNA浓度、RNA纯度和RNA完整性。
检测RNA浓度、纯度和完整性的方式主要有以下几种:紫外分光光度计法:测量260nm吸收值计算RNA浓度,测量260nm/280nm吸收值的比值,用于评估RNA纯度。
需要注意的是:在检测核酸物质时应该在固定的PH溶液中进行。
260nm/280nm的比值范围在 1.9~2.1之间。
<1.9,说明有蛋白质残留;>2.1,说明RNA 可能发生降解。
琼脂糖凝胶电泳:完整的RNA通常有三条带,最亮的是28S条带,其次是18S条带,最淡的是5S条带(部分试剂盒提取时会过滤掉5S条带)。
通过琼脂糖凝胶电泳可以检测28S和18S的比值。
该方法主要用于检测RNA的纯度和完整性。
如果28S和18S条带明亮、清晰、条带锐利,28S的亮度在18S条带的两倍以上,我们认为RNA的质量好。
若RNA条带出现弥散,原因可能:RNA被核酸酶降解、电压或电流过大、上样量过高或过低等。
上述两种方法在实验室比较常用,此外还有几种检测方式供大家选择。
荧光染料检测:通过荧光染料和RNA结合,荧光活性增强。
此方法的灵敏度较高,主要用于检测RNA的浓度。
微毛细管电泳:可使用软件的RIN(RNA Integrity Number)分数评估,10为RNA完整性好,0为最差。
此方法的灵敏度和分辨率较高,可用于检测RNA浓度、纯度和完整性。
3’-5’完整性检测:是在一个RNA样本中检测GAPDH mRNA的完整性来代表所有RNA的完整性,主要用于检测RNA 的完整性。
得到高品质RNA的小建议:1、尽量避免RNA酶污染,使用无RNA酶的耗材和试剂,建议将扩增前后的场所分开。
2、尽量减少采样时间,样品处理后快速冷冻,可以加入RNA保护剂。
3、RNA提取过程中可以使用RNA酶抑制剂。
realtimePCR和RT-PCR详解及其区别要点

real-time PCR技术的原理及应用摘要:一、实时荧光定量PCR原理(一)定义:在PCR反应体系中加入荧光基团,利用荧光信号累积实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
(二)实时原理 1、常规PCR技术:对PCR扩增反应的终点产物进行定量和定性分析无法对起始模板准一、实时荧光定量PCR原理(一)定义:在PCR反应体系中加入荧光基团,利用荧光信号累积实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
(二)实时原理1、常规PCR技术:对PCR扩增反应的终点产物进行定量和定性分析无法对起始模板准确定量,无法对扩增反应实时检测。
2、实时定量PCR技术:利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,通过Ct值和标准曲线的分析对起始模板进行定量分析3、如何对起始模板定量?通过Ct值和标准曲线对起始模板进行定量分析.4、几个概念:(1)扩增曲线:(2)荧光阈值:(3)Ct值:CT值的重现性:5、定量原理:理想的PCR反应: X=X0*2n非理想的PCR反应: X=X0 (1+Ex)nn:扩增反应的循环次数X:第n次循环后的产物量X0:初始模板量Ex:扩增效率5、标准曲线6、绝对定量1)确定未知样品的 C(t)值2)通过标准曲线由未知样品的C(t)值推算出其初始量7、DNA的荧光标记:二、实时荧光定量PCR的几种方法介绍方法一:SYBR Green法(一)工作原理1、SYBR Green 能结合到双链DNA的小沟部位2、SYBR Green 只有和双链DNA结合后才发荧光3、变性时,DNA双链分开,无荧光4、复性和延伸时,形成双链DNA, SYBR Green 发荧光,在此阶段采集荧光信号。
PCR反应体系的建立及优化:1、SYBR Green 使用浓度:太高抑制Taq酶活性,太低,荧光信号太弱,不易检测2、Primer:引物的特异性高,否则扩增有杂带,定量不准3、MgCl2的浓度:可以降低到1.5mM,以减少非特异性产物4、反应Buffer 体系的优化5、反应温度和时间参数:由酶和引物决定6、其他与常规PCR相同(二)应用范围1、起始模板的测定;2、基因型的分析;3、融解曲线分析:可以优化PCR反应的条件,对常规PCR有指导意义,如对primer的评价;可以区分单一引物、引物二聚体、变异产物、多种产物。
三种荧光定量PCR检测方法比较

三种荧光定量PCR检测方法比较定量pcr:以参照物为标准,对PCR终产物进行分析或对PCR过程进行监测,从而达到评估样本中靶基因的拷贝数,称为定量PCR。
定量PCR的可行性定量一般是在PCR扩增的指数期进行的。
常见荧光定量PCR检测方法可分为以下几类:<1> SYBR Green I 检测模式SYBR Green I 是一种能与双链DNA 结合发光的荧光染料。
其与双链DNA 结合后, 荧光大大增强。
因此, SYBR Green I 的荧光信号强度与双链DNA 的数量相关,可以根据荧光信号检测出PCR 体系存在的双链DNA 数量。
SYBR Green I 的最大吸收波长约为497nm,发射波长最大约为520nm。
PCR 扩增程序一般为94℃~55℃~72℃三步法,40 个循环。
SYBR Green I 的缺点:由于SYBR Green I 没有特异性,不能识别特定的双链,只要是双链就会结合发光,对PCR 反应中的非特异性扩增或引物二聚体也会产生荧光,通常本底较高,所以在临床上使用可能会有假阳性发生。
SYBR Green I 的优点:SYBR Green I 的优点是因为其缺点产生,由于它能所有的双链DNA相结合,所以对不同模板不需特别定制不同的特异性探针,通用性较好,并且价格相对较低。
这对科研是很有利的,因此国内外在科研中使用比较普遍。
<2> 水解探针模式<taq man探针>TaqMan 探针是一种寡核苷酸探针,荧光基团连接在探针的5’末端, 而淬灭剂则在3’末端。
当探针与靶序列配对时,荧光基团发射的荧光因与3’端的淬灭剂接近而被淬灭。
在进行延伸反应时,聚合酶的5’外切酶活性将探针切断,使得荧光基团与淬灭剂分离,发射荧光。
一分子的产物生成就伴随着一分子的荧光信号的产生。
随着扩增循环数的增加,释放出来的荧光基团不断积累。
因此Taqman 探针检测的是积累荧光。
PCR 扩增程序通常是:94℃~60 ℃40 个循环。
三重SYBRGreenI实时荧光定量PCR与ELISA检测弓形虫的比较

I卖 时 荧 光定 量 P C R 特 异 性试 验 表 明 , 5 2 9 b p 、 I TS 1和 B 1有 特 异 性 的 溶 解 曲线 峰 值 分 别 是 8 6 . 2。 C、 7 8 . 9。 C和 8 3 . 3℃ , 阴
性 对 照 无 扩增 曲线 ; 敏感性试验表明 , 5 2 9 b p 、 I T S - 1和 B 1 序 列最 低 检 出 限分 别 为 1 7 3 c o p i e s / / x I 1 2 3 c o p i e s / / A 一和 1 3 5 c o p i e s / M I ; T m 值 的 批 内、 批 间重 复 试 验 的 变 异 系 数 均 小 于 0 . 1 3 ; E l I S A 检 测 绪 弓形 虫 I g G 抗体 的 阳性 率 4 1 . 7 2 , E I I S A 与荧光 定量 P C R检测核酸阳性符合率为 5 3 . 4 4 ( P %0 . 0 1 ) 。结 论 建 立 弓形 虫 三 重 S Y B R Gr e e n I荧 光定 量 P C R检测技术具有高 特异性和敏感性 , 可 为 临床 弓形 虫 的 诊 断提 供 科 学依 据 关键词 : 三重; RH 株 弓形 虫 ; 溶 解 曲线 , 重 组 质 粒 中 图 分类 号 : R 3 8 2 文献 标 识 码 : A 文章 编 号 : 1 0 0 2 —2 6 9 4 ( 2 0 1 3 ) 0 2 —0 4 7 6 —0 6
an d Fo r e s t r y Un i ve r s i t y ,F u Zh ou 35 0 00 2,Chi na;
2 . S c h o o l o f Li f e S c i e n c e,Lo n g y a n C o l l e g e,Lo n g y a n 3 6 4 0 1 2 ,C h i n a )
荧光定量pcr两步法和三步法

荧光定量pcr两步法和三步法1 荧光定量PCR简介荧光定量PCR是一种检测DNA样本中特定目标序列数量的方法,它结合了聚合酶链式反应(PCR)技术和荧光探针的使用。
相对于传统PCR技术,荧光定量PCR能够给出更加准确的目标序列数量结果,并且可以在一个反应管中同时检测多个目标序列。
荧光定量PCR分为两步法(Two-Step qPCR)和三步法(Three-Step qPCR),它们的反应机理有所区别,适用于不同的实验需求。
2 两步法2.1 反应机理两步法荧光定量PCR,又称为逆转录荧光定量PCR(RT-qPCR),是通过逆转录将RNA转化为cDNA,再将cDNA参与PCR反应,并通过荧光探针实时监测反应过程中目标序列数量变化的方法来定量RNA的表达水平。
具体过程:先用一个专门的逆转录酶II将RNA转化为cDNA,然后将cDNA加入到PCR反应中,PCR反应过程中,荧光探针会与目标序列结合并荧光发射,PCR反应的进程中,荧光探针完全分解之前,荧光信号增强,通过分子探测器检测荧光信号的数量,即可以得到目标序列的数量。
2.2 应用场景两步法荧光定量PCR通常被用于研究转录调控、RNA可变剪接的研究,以及疾病诊断中的病原体检测,包括HIV、乙肝病毒、H1N1流感病毒等等。
3 三步法3.1 反应机理三步法荧光定量PCR,又称为普通荧光定量PCR或SYBR-green染料荧光定量PCR,是利用SYBR-green染料的荧光信号实时监测PCR反应过程中DNA目标序列数量变化的方法来定量DNA的含量。
具体过程:PCR反应体系中加入SYBR-green染料,在PCR反应过程中,荧光信号随着PCR扩增产物的增加而增大,通过检测荧光强度的变化,可以计算出PCR扩增产物的数量。
3.2 应用场景三步法荧光定量PCR通常被用于基因表达、基因定量、基因型鉴定以及SNP分析等实验中。
4 两步法和三步法的区别两步法和三步法的主要区别在于荧光信号的来源不同。
生物信息学中的基因定量分析方法研究

生物信息学中的基因定量分析方法研究生物信息学是一门涉及生命科学和计算机科学的交叉学科,通过整合生物学、统计学和计算机科学,以提取、存储、分析和解释生物信息为目标。
在生物信息学研究中,基因定量分析是一个重要的领域,用于研究基因的表达水平和变异性,从而揭示基因与生物过程的关系。
基因定量分析是通过测量基因在不同样本中的表达水平,来研究基因功能和其调控机制的一种方法。
下面将介绍三种常用的基因定量分析方法。
1. 基于荧光定量PCR的基因定量分析方法荧光定量PCR(qPCR)是一种常用的基因定量分析方法,其基本原理是通过PCR技术检测和量化目标基因在不同样本中的拷贝数。
在qPCR实验中,首先通过逆转录反应将RNA转录为cDNA,然后利用引物和荧光探针扩增目标基因,在PCR反应过程中,荧光信号与目标基因的拷贝数呈正相关。
通过比较不同样本中的荧光信号强度,可以定量分析基因在样本中的表达水平。
2. 基于RNA测序的基因定量分析方法RNA测序(RNA-seq)是近年来快速发展的一种高通量测序技术,可以对转录组中的所有RNA进行定量测量。
与传统的杂交芯片或荧光定量PCR相比,RNA-seq具有更高的灵敏度和全面性。
在基于RNA-seq的基因定量分析中,首先需要将RNA 转录为cDNA,并通过逆转录反应扩增,然后进行高通量测序。
通过比对测序数据到参考基因组,可以计算出基因在样本中的表达水平。
此外,RNA-seq还可以捕获到转录本的剪接变异、SNP等信息,从而更全面地了解基因功能和调控机制。
3. 基于微阵列芯片的基因定量分析方法微阵列芯片是一种常用的基因表达谱分析技术,可以同时检测上千个基因的表达水平。
在这种方法中,DNA或cDNA探针被固定在芯片上,然后将荧光标记的样本与芯片结合,通过荧光信号的检测来定量分析基因表达水平。
基于微阵列芯片的基因定量分析方法适用于研究特定的基因组区域或已知基因集的表达水平。
通过比较不同样本中的荧光信号强度,可以定量分析基因在样本中的表达水平和差异。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三种荧光定量PCR检测方法比较定量pcr:以参考物为标准,对PCR终产物进行分析或对PCR过程进行监测,从而达成评定样本中靶基因拷贝数,称为定量PCR。
定量PCR可行性定量通常是在PCR扩增指数期进行。
常见荧光定量PCR检测方法可分为以下几类:(1) SYBR Green I 检测模式SYBR Green I 是一个能和双链DNA 结合发光荧光染料。
其和双链DNA 结合后,荧光大大增强。
所以,SYBR Green I 荧光信号强度和双链DNA 数量相关,能够依据荧光信号检测出PCR 体系存在双链DNA 数量。
SYBR Green I 最大吸收波长约为497nm,发射波长最大约为520nm。
PCR 扩增程序通常为94℃~55℃~72℃三步法,40 个循环。
SYBR Green I 缺点:因为SYBR Green I 没有特异性,不能识别特定双链,只要是双链就会结合发光,对PCR 反应中非特异性扩增或引物二聚体也会产生荧光,通常本底较高,所以在临床上使用可能会有假阳性发生。
SYBR Green I 优点:SYBR Green I 优点是因为其缺点产生,因为它能全部双链DNA 相结合,所以对不一样模板不需尤其定制不一样特异性探针,通用性很好,而且价格相对较低。
这对科研是很有利,所以中国外在科研中使用比较普遍。
(2) 水解探针模式(taq man探针)TaqMan 探针是一个寡核苷酸探针,荧光基团连接在探针5’末端,而淬灭剂则在3’末端。
当探针和靶序列配对时,荧光基团发射荧光因和3’端淬灭剂靠近而被淬灭。
在进行延伸反应时,聚合酶5’外切酶活性将探针切断,使得荧光基团和淬灭剂分离,发射荧光。
一分子产物生成就伴伴随一分子荧光信号产生。
伴随扩增循环数增加,释放出来荧光基团不停积累。
所以Taqman 探针检测是积累荧光。
PCR 扩增程序通常是:94℃~60 ℃40 个循环。
常见荧光基团是FAM,TET,VIC,HEX。
(3) 杂交探针模式(Beacon、FRET)分子信标是一个呈发夹结构茎环双标识寡核苷酸探针,两端核酸序列互补配对,所以标识在一端荧光基团和标识在另一端淬灭基团紧紧靠近。
荧光基团被激发后产生光子被淬灭剂淬灭,由荧光基团产生能量以红外而不是可见光形式释放出来。
分子信标茎环结构中,环通常为15-30 个核苷酸长,并和目标序列互补;茎通常5-7 个核苷酸长,并相互配对形成茎结构。
荧光基团标识在探针一端,而淬灭剂则标识在另一端。
在复性温度下,因为模板不存在时形成茎环结构,当加热变性会互补配正确茎环双链解开,假如有模板存在环序列将和模板配对。
和模板配对后,分子信标将成链状而非发夹状,使得荧光基团和淬灭剂分开。
当荧光基团被激发时,因淬灭作用被解除,发出激发光子。
因为是酶切作用存在,分子信标也是积累荧光。
常见荧光基团:FAM ,Texas Red 。
PCR 扩增程序通常是:94~55~72 ℃三步法,40 个循环。
FRET 探针又称双杂交探针,FRET 探针由两条相邻探针组成,在一条探针5`端标识FAM 荧光基团,另一探针3`端标识Red 640 荧光基团。
当复性时,探针结合在模板上,FAM 基团和Red640 基团相邻,激发FAM 产生荧光,作为Red640 基团激发光被吸收,使Red640发出波长为640 荧光。
当变性时,探针游离,两基团距离远,不能产生640 波长荧光。
因为FRET 探针是靠近发光,所以检测信号是实时信号,非累积信号。
常见荧光基团是:LC-Red640,LC-Red705。
能用于实时荧光PCR 定量方法很多,各有优缺点,应依据试验需要和目前试验条件选择适合自己方法。
下面为多种方法比较:试验中部分好习惯:加入试剂之前,把它混匀一下,以免放置时间长了浓度不均;移液枪用完以后要归到最大计量位置,预防久而久之弹簧失去弹性。
一定要记着关水浴箱,切记切记;多和大家讨论,同时多关注她人讨论经验,这几乎是最快提升捷径了;全部试剂全部自己配,出了问题才好找原因。
预防RNA酶污染方法:1. 全部玻璃器皿均应在使用前于180℃高温下干烤6h或更长时间。
2. 塑料器皿可用0.1% DEPC水浸泡或用氯仿冲洗(注意:有机玻璃器具因可被氯仿腐蚀,故不能使用)。
3. 有机玻璃电泳槽等,可先用去污剂洗涤,双蒸水冲洗,乙醇干燥,再浸泡在3% H2O2室温10min,然后用0.1% DEPC水冲洗,晾干。
4. 配制溶液应尽可能用0.1% DEPC,在37℃处理12h以上。
然后用高压灭菌除去残留DEPC。
不能高压灭菌试剂,应该用DEPC处理过无菌双蒸水配制,然后经0.22μm滤膜过滤除菌。
5. 操作人员戴一次性口罩、帽子、手套,试验过程中手套要勤换。
6. 设置RNA操作专用试验室,全部器械等应为专用。
常见RNA酶抑制剂:1. 焦磷酸二乙酯(DEPC):是一个强烈但不根本RNA酶抑制剂。
它经过和RNA酶活性基团组氨酸咪唑环结合使蛋白质变性,从而抑制酶活性。
2. 异硫氰酸胍:现在被认为是最有效RNA酶抑制剂,它在裂解组织同时也使RNA酶失活。
它既可破坏细胞结构使核酸从核蛋白中解离出来,又对RNA酶有强烈变性作用。
3. 氧钒核糖核苷复合物:由氧化钒离子和核苷形成复合物,它和RNA酶结合形成过渡态类物质,几乎能完全抑制RNA酶活性。
4. RNA酶蛋白抑制剂(RNasin):从大鼠肝或人胎盘中提取得来酸性糖蛋白。
RNasin 是RNA酶一个非竞争性抑制剂,能够和多个RNA酶结合,使其失活。
5. 其它:SDS、尿素、硅藻土等对RNA酶也有一定抑制作用。
因为DEPC不加选择修饰蛋白质和RNA,所以在分离和纯化RNA过程中不能使用,而且它和部分缓冲液(比如Tri)不能相容在全部RNA试验中,最关键原因是分离得到全长RNA。
而试验失败关键原因是核糖核酸酶(RNA酶)污染。
RNA酶可耐受多个处理而不被灭活,如煮沸、高压灭菌等。
研究人员造成污染RNA酶最关键潜在污染源是研究人员手。
所以进行RNA试验时应勤换手套。
但DEPC能和胺和巯基反应,所以含Tris和DTT试剂不能用DEPC处理动植物总RNA提取-Trizol法:Trizol法适适用于人类、动物、植物、微生物组织或培养细菌,样品量从几十毫克至几克。
用Trizol法提取总RNA绝无蛋白和DNA污染。
RNA可直接用于Northern斑点分析,斑点杂交,Poly(A)+分离,体外翻译,RNase封阻分析和分子克隆。
1. 将组织在液N中磨成粉末后,再以50-100mg组织加入1ml Trizol液研磨,注意样品总体积不能超出所用Trizol体积10%。
2. 研磨液室温放置5分钟,然后以每1mlTrizol液加入0.2ml百分比加入氯仿,盖紧离心管,用手猛烈摇荡离心管15秒。
3. 取上层水相于一新离心管,按每ml Trizol液加0.5ml异丙醇百分比加入异丙醇,室温放置10分钟,120XXg离心10分钟。
4. 弃去上清液,按每ml Trizol液加入最少1ml百分比加入75%乙醇,涡旋混匀,4℃下7500g离心5分钟。
5. 小心弃去上清液,然后室温或真空干燥5-10分钟,注意不要干燥过分,不然会降低RNA溶解度。
然后将RNA溶于水中,必需时可55℃-60℃水溶10分钟。
RNA可进行mRNA分离,或贮存于70%乙醇并保留于-70℃。
[注意]1. 整个操作要带口罩及一次性手套,并尽可能在低温下操作。
另外,提取上清这步一定要小心,靠近沉淀部分一定要舍得不要,要不然会有蛋白质污染,影响比值2. 加氯仿前匀浆液可在-70℃保留30天以上,RNA沉淀在70%乙醇中可在4℃保留一周,-20℃保留十二个月。
总mRNA提取经验:一、相关Trizol Reagent需要试剂1. Chloroform:氯仿(分析纯)2. Isoproplyl alcohol:异丙醇(分析纯)3. 75% Ethanol(in DEPC-treated water):75%乙醇。
要求用分析纯无水乙醇并用0.01%DEPC处理过无Rnase水稀释。
4. RNase-free water:无Rnase水。
方法是:将DEPC按0.01%(V/V)加在d H2O中500ml(50ul),在37℃过夜,并高压灭菌即得(150℃3小时)5. 一次性塑料手套6. 注意:DEPC有致癌之嫌二、相关Trizol Reagent使用过程:1. Homogenization(匀浆)a. Tissues:组织每100mg组织匀浆加1mlTrizol试剂,样品体积不能超出Trizol试剂10%。
b. Cells Grown in monolayer(单层细胞接毒后出现病变)针对JEV细胞总RNA抽提法:BHK21细胞长成单层后,接毒0.5-1ml(采取大瓶),37℃吸附1h,倒掉,加维持液(含2%血清和HEPE8MEM)约5ml,维持天。
出现75%-100%病变时,以PBS(预冷)冲洗细胞两次,直接在细胞瓶中加入Trizol试剂1ml/10cm2,吹吸几次,以裂解细胞(细胞瓶有两种常见规格:大约45cm2,小约30cm2,故所用Trizol试剂分别约为4.5ml和3ml。
Trizol试剂加入是依细胞瓶而定,以盖满瓶底为度,而不是依据细胞数量,不然可造成DNA污染)具体方法以下:(样品一定要新鲜)(1) 组织接入预冷EP管中,加入Trizol试剂1ml/10cm2(量一定要加足,不然易污染),混匀,吹吸几次,以破裂细胞,置室温5min,以使核蛋白复合物根本分离。
(2) 加氯仿0.2ml(每1ml Trizol试剂加入氯仿0.2ml),盖好,猛烈震荡15s,置室温2-3分钟。
(3) 4℃离心,10000g×15min,离心后,混合物将分离为底层为浅红、中层为酚-氯仿相、上层为无色水相。
RNA包含在水相中,水相体积约相当于所加Trizol试剂量60%。
(4) 仔细吸收上层水相,移至另一EP管中。
(5) 加0.5ml异丙醇,以沉淀RNA(每1ml Trizol试剂加入0.5ml异丙醇),置室温10min。
(6) 4℃离心,10000g×10min。
RNA沉淀为一层如凝胶样透明小块附在管底和管壁。
(7) 弃上清液,加入预冷75%乙醇1ml(每1ml Trizol试剂加入75%乙醇最少1ml),震荡,充足洗涤沉淀,4℃离心,5500g×5min。
弃上清液,空气干燥(或真空干燥)后,沉淀重悬于无Rnase dH2O中,吹吸几次,55℃-60℃作用10分钟以溶解RNA,-70℃保留备用。
(8) 抽提出细胞总RNA干燥后加水50ul,取10ul加无Rnase水990ul,稀释100倍成1ml。
