物质的聚集状态
第一章 物质的聚集状态

vap H m
为液体的摩尔蒸发热(摩尔汽化焓)
只要知道p1、p2、T1、T2和 vap H m 五个量 中任意4个,就能求出另外一个物理量。
1.2.3 液体的沸点 液体在蒸发过程中,随着外加温度的升高, 蒸气压也在逐渐增大,当外加温度增加到液体 的饱和蒸气压等于外界(环境)压力时,在整 个液体中的分子都能发生气化作用,液体开始 沸腾,此时的温度就是该液体在该压力下的沸 点(boiling point)。 液体的沸点随外压而变化,压力越大, 沸点也越高。当外压为标准情况的压力(即 101.325kPa)时的沸点,为正常沸点。一般我 们所说的沸点都是正常沸点。
理想气体分子之间没有相互吸引和排斥, 分子本身的体积相对于气体所占有体积完全可 以忽略。
pV = nRT
R---- 摩尔气体常量
在STP下,p =101.325kPa, T=273.15K
n=1.0 mol时, Vm=22.414L=22.414×10-3m3
pV R nT 3 3 101325Pa 22.414 10 m 1.0mol 273.15K 8.314 J mol 1 K 1
定量的气体,当压力一定时,气体的体积 V与热力学温度T成正比。 数学式可表示为 或 或 V = V0T/T0 V∞T V1/V2 = T1/T2
查理-盖· 吕萨克定律也可以用图形来表示, 称为等压线—— 直线。如图1.2 所示。
3. 阿伏加德罗定律 在相同的温度和压力下,相同体积的不同 气体均含有相同数目的分子。 1.1.2 理想气体的状态方程 人们将符合理想气体状态方程式的气体, 称为理想气体。
R=8.314 kPaLK-1mol-1=8.314Pa· 3 · -1mol-1 m K
物质的聚集状态

• (3)胶体的应用:自来水厂用含铝或含铁的化合 物做净水剂,其实是利用胶体吸附水中的悬浮 颗粒并沉降,从而到达净水的目的。
3.溶液的导电性
• 为什么溶液会NaCl、NaOH、盐酸发生 导电而酒精、蔗糖溶液不导电?溶液导电 的本质原因是什么? • 【分析】水溶液中的化合物在水分子的 作用下发生电离,生成了自由移动的水合 离子,从而使溶液具有导电性。
点燃
H2 + Cl2 ==== 2HCl 化学计量数γ之比 1 :1 : 2 微粒个数之比 1 :1 : 2 扩大NA倍 1×NA :1×NA : 2×NA 物质的量之比 1mol :1mol : 2mol 22.4L :22.4L : 44.8L 相同条件下气体体积比 1体积 : 1体积 : 2体积 结论:对于气体物质,因为相同条件下分子数相等,物质的量相等、物 质的体积也相等,所以化学反应中物质的系数之比等于相同条件下气体的体积比,即 1LH2和1LCl2完全反应生成2LHCl气体。
• 钠、镁、铝与过量的盐酸反应,在相同状况下产生H2 的体积相等,则钠、镁、铝三种金属的物质的量之比 是_______________________ • 问题表征:已知:生成的H2的体积相等 求 解目标:三种金属的物质的量之比 • 思路分析:此题容易一般用方程式来解,但比较繁, 可以采用关系式法求解。 • 钠、镁、铝建立关系,关系依据是“反应生成H2的体 积相等”。产生H2的体积相等,即是金属化合价变化 总数相等。 • 6Na ~ 3Mg ~ 2Al ~ 6H ~ 3H2
• 5.______g 硫酸铝溶于水可得使溶液中所 含铝离子刚好为amol。 • 问题表征:已知Al3+的物质的量 求解目 标: Al2(SO4)3的质量 • 思路分析:可根据Al3+与Al2(SO4)3的关系列 比例式解决。 • 解答: Al2(SO4)3 → 2Al3+ • 342g 2mol • m Al2(SO4)3 amol
大学化学物质的聚集状态

04 固态物质
晶体结构
1 2 3
晶体结构定义
晶体是由原子、分子或离子按照一定的规律在三 维空间内周期性重复排列形成的固体物质。
晶体分类
根据晶体内部原子、分子或离子的排列方式,晶 体可以分为离子晶体、原子晶体、分子晶体和金 属晶体等。
晶体性质
晶体具有规则的几何外形、固定的熔点和各向异 性的特点。
非晶体结构
高分子溶液的特性与应用
特性
高分子溶液的特性主要包括溶液粘度较高、稳定性较好、不易结晶等。这些特性使得高分子化合物在 许多领域都有广泛的应用,如塑料、橡胶、涂料、粘合剂等。
应用
高分子溶液在工业生产和科学研究中具有广泛的应用,如制备高分子材料、改善材料性能、制备高分 子复合材料等。此外,高分子化合物在生物医学领域也有广泛应用,如制备药物载体、组织工程支架 等。
胶体的性质
胶体具有丁达尔效应、布朗运动、电泳和电渗等性质。这些性质与胶体粒子的大 小和带电性质密切相关,是胶体区别于其他分散体系的重要特征。
大分子溶液的定义与性质
大分子溶液的定义
大分子溶液是由高分子化合物溶解于溶剂中形成的均一、透 明、稳定的溶液。
大分子溶液的性质
大分子溶液具有粘度较大、扩散系数较小、不易渗透等性质 ,这是因为高分子化合物在溶液中能够形成较大的分子链, 对溶剂分子产生较大的阻力。
大学化学物质的聚集状态
contents
目录
• 物质的聚集状态简介 • 气态物质 • 液态物质 • 固态物质 • 溶液的聚集状态 • 胶体与大分子溶液
01 物质的聚集状态简介
聚集状态的定义
聚集状态是指物质在一定条件下所呈 现的空间形态,包括单个分子、分子 间相互作用形成的聚集集体以及更大 尺度的物质结构。
物质的聚集状态

物质的聚集状态
物质的聚集状态主要有气态、液态、固态和等离子态等。
气态是物质的一种聚集状态,特点是分子间的距离较大,分子间的相互作用力很微弱,分子可以自由运动。
液态是物质的一种聚集状态,特点是分子间的距离较小,分子间的作用力较大,分子可以有限制地运动。
固态是物质的一种聚集状态,特点是分子间的距离很小,分子间的作用力很大,分子只能在平衡位置附近振动。
此外,还有等离子态、超固态和玻色-爱因斯坦凝聚态等其他聚集状态。
当气体中分子运动更加剧烈,成为离子、电子的混合体时,称为等离子态;当压强超过百万大气压时,固体的原子结构被破坏,原子的电子壳层被挤压到原子核的范围,这种状态称为超固态;有些原子气体被冷却到纳开(10-9K)温度时,被称为气体原子(玻色子)都进入能量最低的基态,称为玻色–爱因斯坦凝聚态。
物质的四种聚集状态

物质的四种聚集状态
物质存在四种不同的聚集状态,包括固体、液体、气体和等离子体。
这些状态的区别在于原子或分子之间的相互作用和排列方式。
固体是一种最密实的聚集状态,其中原子或分子紧密排列在一起。
它们的形状和体积都是固定的,不像液体或气体那样随着温度或压力的变化而改变。
例子包括冰、岩石和金属。
液体是一种聚集状态,其中原子或分子之间的相互距离比固体稍大,但比气体小。
液体的形状是不稳定的,而体积是固定的。
液体的分子之间存在相互作用,因此液体可以流动。
例子包括水、牛奶和汽油。
气体是一种聚集状态,其中原子或分子之间的距离比液体和固体更大。
气体的形状和体积都是不稳定的,可以根据温度和压力的变化而变化。
气体的分子之间的相互作用很弱,因此气体可以自由流动。
例子包括氧气、氮气和二氧化碳。
等离子体是一种高能状态下的物质,其中原子或分子被剥离电子,形成带正电荷的离子。
等离子体存在于极端条件下,如太阳表面、闪电和等离子体切割器中。
它们通常表现出高温、高压和高电流的特性,因此在工业和科学中具有广泛的应用。
- 1 -。
第2章 物质的聚集状态

第2章物质的聚集状态(3学时)2.1 概述2.2 理想气体2.3 溶液2.4 固体—晶体物质的聚集状态:气体、液体、固体以及超临界液体等物质的聚集状态物质由分子组成,在通常情况下,物质呈固态、液态和气态。
固体:有一定的体积和一定的形状液体:有一定的体积气体:没有固定的体积和形状。
组成物质的分子是不停地运动的,并且分子间存在着相互作用力(引力和斥力)。
固体内部粒子的相互作用力最强,液体次之,气体最弱。
2.1 概述1. 相态(phase):是物质的状态(或简称相,也叫物态)指一个宏观物理系统所具有的一组状态。
一个态中的物质拥有单纯的化学组成和物理特性(如密度、晶体结构、折射率等)。
2.相图表达一系列温度压力下的相平衡关系右图区:液相区,固相区,气相区和超临界区线:两相平衡区,S-L线(BD),S-G线(AB),L-G线(BC)点:三相共存点:B点,临界点:C点,Tc:临界温度,Pc:临界压力✧三相点:273.16K,610.75Pa ✧临界点:647.29K, 22.09MPa水的相图临界点与超临界态✧在临界点以下,气态和液态之间具有显著区别✧在临界点以上,这种区别将不复存在✧这种状态称为:超临界流体(supercritical fluid,简称SCF)如:水的临界点为T= 374.3℃,P c = 22.09MPa,c在此临界点以上,就处于超临界状态,该状态的水就称为超临界水。
超临界流体特点:具有液体和气体的优点,密度大,粘稠度低,表面张力小,有很强的溶解能力。
CO2:临界温度较低(Tc=364.2K),临界压力也不高(Pc=73.8MPa),无毒,无臭,不污染环境,实际工作中使用较多的事超临界流体。
如:用超临界CO:2从咖啡豆中除去咖啡因从烟草中脱除尼古丁大豆或玉米胚芽中分离甘油酯轻易穿过细菌的细胞壁,在其内部引起剧烈氧化反应,杀死细菌。
超临界流体在绿色化工工艺的开发研究中具有重要的价值。
其他聚集态当温度足够高时,外界提供的能量足以破坏分子中的原子核和电子的结合,气体就电离成自由电子和正离子,即形成物质的第四态——等离子态(plasma),电离气体。
第一章 物质的聚集状态

R 单位:8.314Pam3 mol-1K-1; 8.314 Jmol-1K-1
3. 理想气体状态方程式的应用
计算p,V,T,n四个物理量之一
pV = nRT
气体摩尔质量的计算
m pV RT M
M mRT pV
气体密度的计算
M ρ RT p
RT ρ pM
难点:单位处理
例1-1 :一学生在实验室中,在73.3kPa和25℃下收集
(2) b(蔗糖) = 0.05/0.1 = 0.5 (mol/kg)
(3) n水 = 100/18.02 = 5.55 (mol)
X(蔗糖) = 0.05/(0.05+5.55) = 0.0089
3.几种浓度之间的转换关系 (1).物质的量浓度与质量分数
溶液密度ρ;B的质量分数wB
nB mB mB w B cB V M BV M Bm / M B
65.2 (2) 2.03 32.07
硫蒸气的化学式为S2
1.2.2 道尔顿分压定律
体积不变:5L 298K先通入2molH2 再通入2molN2 混合后H2的体积?混合后N2的体积?容器内压力有何变化? 分压力:在相同温度下,混合气体中某组分气体单独 占有混合气体的容积时所产生的压力。
1.道尔顿分压定律
2、分散系的分类 按聚集状态分
气-气(空气)
气-液(汽水)
气-固(浮石)
液-气(云、雾)
液-液(牛奶)
液-固(肉冻)
固-气(烟、)
固-液(溶液) 固-固(合金)
按粒子大小分
分 散 相 粒 分散系类型 分散相粒子的 子直径 组成 小于1nm 实 例
分子分散系 小分子或小离 生 理 盐 水 、 葡 子 萄糖溶液
大学基础化学课件之物质的聚集状态

白色无水CuSO4溶于水
NaOH溶于水
NH4NO3溶于水 50升的水与 50升的纯乙醇混合 50升苯与 50升醋酸混合
蓝色 放热 吸热 体积<100升
体积>100升
溶液既不是溶质和溶剂的机械混合,也不是 两者的化合物。溶解过程是一个特殊的物理-化学 过程,常伴随着能量、体积、颜色的变化。
溶解实际包括两个过程:
2、查理-盖•吕萨克Charles-Gay-Lussac定律 V/T =常量(P, n 恒定)
3、阿佛伽德罗Avogadro定律
在相同温度和压力下,相同体积的不同气 体均有相同数目的分子。
V/n =常量(T, P 恒定)
2.理想气体的状态方程
pV nRT
其中,R为摩尔气体常数。
R pV 101325Pa 22.414 103 m3
摩尔分数(mole fraction)
定义:某种组分的物质的量与混合物的物质的量之比
xB nB (单位1) n总
nB : 溶质B的物质的量,mol n总 : 溶液中所有物质的物质的量的总和,mol
质量分数(mass fraction)
定义:溶质B的质量与溶液总质量之比
wB
mB(单位1) m总
原因:溶剂的部分表面被溶质所占 据,因此在单位时间内逸出液面的 溶剂分子数就相应减少,使得溶液 的蒸发速率降低。
实验测定25℃: 水的饱和蒸气压为: p(H2O)=3167.7Pa; 0.5 mol ·kg-1 糖水的蒸气压则为: P(H2O)=3135.7Pa; 1.0 mol ·kg-1糖水的蒸气压为: P(H2O)=3107.7Pa
设溶质的摩尔分数为xB
xA+xB=1 p=p0·(1-xB) p0 -p=p0·xB △p=p0·xB
教学课件:第一章-物质的聚集状态

气态物质如空气中的水蒸气、二氧化碳等,用于气象观测和气候变 化研究,对环境保护和气候预测具有重要意义。
THANKS FOR WATCHING
感谢您的观看
气体定律与状态方程
1 2 3
理想气体定律
理想气体遵循玻意耳定律、查理定律和盖吕萨克 定律,这些定律描述了气体在不同条件下的状态 变化。
状态方程
理想气体的状态方程为PV=nRT,其中P表示压 强,V表示体积,n表示摩尔数,R表示气体常数, T表示温度。
实际气体近似
对于压强较大或温度较低的气体,实际气体可以 近似为理想气体。
04 气态物质
气体分子运动论
01
分子运动论的基本假设
气体由大量做无规则运动的分子组成,分子之间相互作用力可以忽略。
02
分子平均动能
气体分子的平均动能与温度成正比,温度越高,分子运动越剧烈。
03
分子分布
气体分子在空间的分布是均匀的,但在单位时间内与器壁碰撞的分子数
与气体分子速率大小有关,呈现出“中间多、两头少”的分布规律。
流动性
液体具有一定的流动性,可以流动 和变形。
液体的相变与热力学性质
熔点和沸点
熔点和沸点是液体物质的重要热 力学性质。
热容量和导热性
液体的热容量和导热性与温度有 关,不同液体有不同的热容量和
导热性。
相变过程
液体在一定条件下可以发生相变, 如蒸发或凝固。
液体中的溶解与扩散
溶解度
不同物质在液体中的溶解度不同。
气体的相变与热力学性质
相变
01
气体在一定条件下可以发生相变,例如液化、凝华等。相变过
程中气体的热力学性质会发生显著变化。
物质的聚集状态

同温同压下,1mol任何气体的体
积都相等,但未必等于22.4L。
使用气体摩尔体积时应注意
(1)只适用于气态物质,对于固态物质 和液态物质来讲,都是不适用的。 (2)可适用于混合气体 (3)并不是只有标准状况下气体摩尔体 积是22.4 L·mol-1 ,非标准状况下也有 可能,当把22.4 L·mol-1 用于计算时必 须是标准状况。
决定气体体积 的主要因素
粒子的数目
粒子的大小
可以忽略 可以忽略
粒子的间距
二、决定气体体积的因素
1. 粒子的数目
2. 粒子间的距离 思考:气体分子间的距离和什 么有关?
温度越高,
气体分子
间距越大; 体积越大;
压强越大,
气体分子
间距越小; 体积越小;
思考:气体分子间的距离 和什么有关?
当粒子数目一定时:
物质的聚集状态
物质有固、液、气三种状态,三种状态有何差异? 从微观角度解释这三种状态存在差异的原因。
Fe
固体
H2O
液体
H2
气体
物质的聚集状态主要有气态、液态、固态三
种,这是宏观的;
其微观原因就是原子或分子聚集结构不同。
那么气态、液态、固态在宏观性质和微观结 构上到底有何差别呢?
不同聚集状态物质的结构与性质
气 态
Fe
H2O
Pb
H2SO4
1mol 任何物质所含的微粒数
目都相同,1mol 物质的质量往往
不同。1mol 物质的体积是否相同 呢?
表一
(表中所列物质的密度均为293K下的测定值) 物质 Al 物质的 质量 量(mol) (g) 1 27 密度 体积 (g· cm-3) ( cm-3 ) 2.7
物质的聚集状态课件

等离子态是指气体中的 原子或分子在受到足够 的能量激发时,电子被 电离出来形成自由电子 和离子,呈现出一种高 度离解的状态,如太阳 和其他恒星。
物质聚集状态转变
物质聚集状态的转变是由于温度、压力、磁场等外部条件的变化而引起的。
聚集状态的转变通常伴随着物质物理性质和化学性质的显著变化。
在实际应用中,物质的聚集状态转变具有重要的意义,如工业生产中的结晶、升华、 熔化和凝固等过程,以及自然界中的天气变化、生命活动等过程。
理想气体定律
理想气体定律是描述气体压力、温 度和体积之间关系的一个基本定律, 它指出在一定温度下,气体的压力 与体积成反比。
03
液体
液体的分子运 动
分子运动
液体中的分子不断进行无 规则运动,这种运动受到 分子间相互作用力的影响。
分子间相互作用力
液体分子间存在相互作用 力,这种力使得分子在液 体状态下保持聚集状态。
晶格结构参数
描述晶体结构中原子或分子的间距和排列方式。
固体的基本性 质
1 2 3
热膨胀性 固体在温度变化时,体积发生改变。
电导率 固体材料中电子的迁移率,反映材料的导电性能。
光学性质 固体材料对光的吸收、反射和透射等性质。
固体的力学性 质
弹性
01
固体在外力作用下发生形变,形变与外力成正比,外力撤去后
工业生产 在工业生产中,研究物质的聚集状态有助于优化生产工艺 和提高产品质量,例如通过控制物质的聚集状态改善金属 的加工性能和机械性能。
THANKS
感谢您的观看
物质的聚集状态课件
目录
CONTENTS
• 物质的聚集状态研究的意义和应
01
物质的聚集状态简 介
物质的聚集状态定义
物质的四种聚集状态

物质的四种聚集状态
物质存在四种聚集状态:固态、液态、气态以及可用来形容等离
子体的离子态。
这四种状态的物质的大小、形状和行为都是不同的,
它们以各自不同的方式去占据空间,并且最大程度地影响着物质之间
的交互。
固态是指物质在固定位置上形成团聚体并固定着的状态。
固体不
受外力扰动,形状固定,并且拥有一定的强度,不容易改变状态,通
常拥有有形外形,如晶体、砂粒、金属、岩石等。
液态是指物质具有流动形态的状态,流动性好,容易受外力变形,但不易蒸发,常见的液体有水、油等。
气态是指物质的状态,其散布非常广泛,易受任何因素的影响,
在大气中可占据全部空间无约束,由此形成的气体常常是无形的,且
具有质量但没有实质的容器,常见的气体有水蒸气、氧气等。
等离子体是由原子或分子连续交替负荷分布的物质状态,具有电
离性。
它不仅含有分子和原子离子,而且还包括全电子,全电子由内
部形成等离子体状态,等离子体在理想条件下也可以存在固体,液体
或气体状态。
四种聚集状态主要受温度、压力和其他外界因素的影响,如果受
到外界因素的影响,任何物质都会由其中一种聚集状态转变为另一种,从而受到外界因素的影响。
以温度的变化为例,当温度升高时,固体
会融化、液体蒸发,当温度降低时,液体凝固,气体液化。
总而言之,物质存在着四种不同状态:固态、液态、气态、等离
子体,这四种状态的物质的大小、形状和行为都是不同的,它们以各
自不同的方式占据空间,并且可以受外界因素的影响而相互转化。
《物质的聚集状态》课件

液体分子热运动相对 较弱,具有一定的热 容量和导热性。
液体分子排列相对松 散,具有一定的密度 和粘度。
液体的相变
液体与气体的相变
当温度升高到沸点时,液体开始蒸发变成气体。
液体与固体的相变
当温度降低到凝固点时,液体开始凝固变成固体。
物质聚集状态的变化
01
02
03
04
熔化
固态物质变为液态物质,需要 吸收热量。
凝固
液态物质变为固态物质,需要 释放热量。
汽化
液态物质变为气态物质,需要 吸收热量。
液化
气态物质变为液态物质,需要 释放热量。
物质聚集状态的特点
固态
具有固定的形状和体积,不易流 动。
液态
具有一定的流动性,形状随容器改 变。
04
气态物质
气体的结构与性质
气体分子之间的距离较大,相互 作用力较小,因此气体分子可以
自由移动,且运动速度较快。
气体的密度较小,占据的空间较 大,因此气体可以充满整个容器
。
气体的扩散速度较快,可以迅速 地扩散到整个空间。
气体的相变
当温度降低到一定程度时,气体分子之间的热运动速度减 缓,分子之间的碰撞频率降低,气体分子之间的距离逐渐 减小,最终气体分子会凝聚成液体或固体。
相变过程中的能量变化
液体的相变过程中需要吸收或释放能量,以维持相变平衡。
液态物质的应用
01
02
03
工业生产
许多工业生产过程中需要 使用液体物质,如冷却剂 、润滑剂、溶剂等。
日常生活
液体物质在日常生活中也 广泛应用,如饮用水、饮 料、食用油等。
科学实验
在科学实验中,常常需要 使用各种液体物质进行实 验,如化学试剂、生物培 养基等。
物质的聚集状态
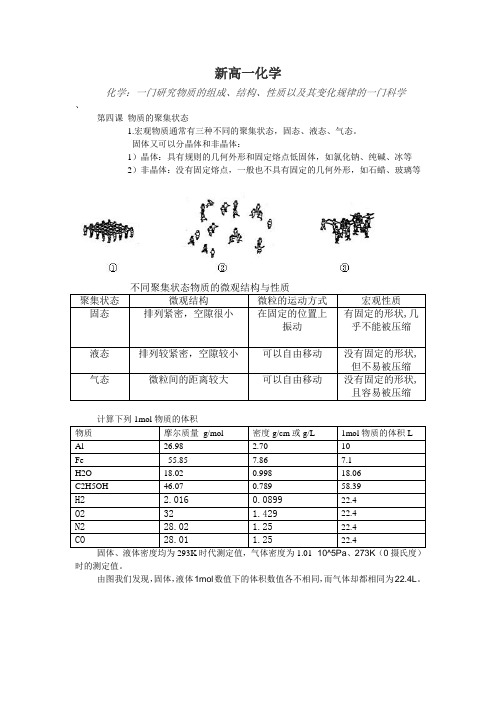
新高一化学化学:一门研究物质的组成、结构、性质以及其变化规律的一门科学、第四课物质的聚集状态1.宏观物质通常有三种不同的聚集状态,固态、液态、气态。
固体又可以分晶体和非晶体:1)晶体:具有规则的几何外形和固定熔点低固体,如氯化钠、纯碱、冰等2)非晶体:没有固定熔点,一般也不具有固定的几何外形,如石蜡、玻璃等不同聚集状态物质的微观结构与性质聚集状态微观结构微粒的运动方式宏观性质固态排列紧密,空隙很小在固定的位置上振动有固定的形状,几乎不能被压缩液态排列较紧密,空隙较小可以自由移动没有固定的形状,但不易被压缩气态微粒间的距离较大可以自由移动没有固定的形状,且容易被压缩计算下列1mol物质的体积物质摩尔质量g/mol 密度g/cm或g/L 1mol物质的体积LAl 26.98 2.70 10Fe 55.85 7.86 7.1H2O 18.02 0.998 18.06C2H5OH 46.07 0.789 58.39H2 2.0160.089922.4O232 1.42922.4N228.02 1.2522.4CO28.01 1.2522.4固体、液体密度均为293K时代测定值,气体密度为1.01×10^5Pa、273K(0摄氏度)时的测定值。
由图我们发现,固体,液体1mol数值下的体积数值各不相同,而气体却都相同为22.4L。
2.阿伏加德罗定律:影响物质体积大小的因素主要有三个:物质所含微粒的数目,微粒的大小和微粒之间的距离。
而气体由于其微粒间距离远大于其微粒直径,所以气体体积主要由微粒数目和微粒间距离决定。
取决于微粒的大小固体、液体的体积体积微粒的数目微粒间距离气体的体积而气体微粒间的距离取决于外界温度(T),压强(p)阿伏加德罗定律:内容同温同压下,相同体积的任何气体具有相同的分子数注意点对象任何气体,可以是单一气体,也可以是混合气体条件同温同压同体积结论分子数目相同公式:pV=nRTP为压强,V为气体体积,n为气体的物质的量,R为气体常数(所以气体的气体常数都一样),T为绝对温度3.气体摩尔体积我们将单位物质的量的气体所占的体积称为气体摩尔体积,用符号V m表示,常用单位为L·mol^-1或m^3·mol^-1 。
第一章 物质的聚集状态

式中nB表示溶液中溶质B的物质的量,其SI单位为mol;V为 溶液的体积,其SI单位为m3,在分析化学中,体积的常用单 位为L或mL;浓度cB常用单位为mol/L。
分散质
分散剂
实 例
气 液 固 气 液 固 气 液 固
气 气 气 液 液 液 固 固 固
空气 云、雾 烟灰尘 泡沫 牛奶、酒精的水溶液 糖水、油漆 泡沫塑料 珍珠(包藏着水的碳酸钙) 有色玻璃、合金
液态分散系(分散介质是液态)
分散相粒 子直径 /nm <1 分散系类型 分散相 主要性质 实例
低分子或离子分 散系 胶 体 分 散 系 粗 分 散 系 高分子溶液
611
T/K
从图中可以看出,
1) 随着温度的升高,水,水溶液,冰的饱和蒸气压都升高。
其中冰的曲线斜率大,随温度变化显著。 2) 同一温度,水溶液的饱和蒸气压低于水的饱和蒸气压。
p/Pa 1.013 10
611
5
A B
l1
l2 A′
l3
B′ T2 273 373 T1 T/K
3) 373 K时,水的饱和蒸气压等于外界大气压强,如图中 A 点,故 373 K 是水的沸点。大气压强 1.013 10 5 Pa 。
若 p 固 > p 液, p 固 < p 液, 饱和蒸气压图
则平物质的饱和蒸气压 p,对温度 T 做图,即得到物质饱和蒸气
压图。下面是水,水溶液,冰体系的饱和蒸气压图。
p/Pa 1.013 10 5 A
第一章物质的聚集状态

第一章 物质的聚集状态
• 当温度足够高时,外界提供的能量足以破坏分子 中原子核和电子的结合,气体就电离成自由电子和 正离子,即形成物质的第四态——等离子态。
气体、液体和等离子态都可在外力场作用下流动, 所以也统称为流体 • 物质的第五态——超固态,压力达几百万大气压 时,原子结构被破坏,原子的电子壳层被挤压到原 子核周围,此时物质密度非常大。
• 液态溶液按组成的溶质与溶剂的状态可分为三种 类型:气态物质与液态物质组成的溶液,常把液 态物质看成 溶剂 ,气态物质看成溶质;
固态物质与液态物质组成的溶液,常把液态物质看 成溶剂,固态物质看成溶质; 液态物质与液态物质组成的溶液,常把含量较多的 组分称为溶剂,含量较少的称为溶质。
1.3 溶液
• 1.3.1 溶液浓度的表示方法
溶剂分子从一个液相通过半透膜向另一个液相扩散的过程叫渗透。
达到了渗透平衡时,半透膜两边的水位差所表示的静水压就称为 称为该溶液的渗透压。
蒸气压下降引起的直接后果之三 渗透压(osmotic pressure)
若在溶液液面上施加一定的外压可阻止渗透进行,外压等于 渗透压时两液面持平。外压大于渗透压则水分子由溶液向纯溶 剂扩散,纯溶剂液面上升,产生反渗透现象。
问题:为什么盐碱地难以生长农作物?
1.4 气体的液化
• 1.4 气体的液化——实际气体的等温线
降低温度或增加压力,气体会 变成液体,称为气体的液化。
• 1.4 气体的液化——实际气体的等温线
气体能够液化的最高温度称为该气体的 临界温度Tc 。高于临界温度时,无论施加多 大压力也不会使之液化。
在临界温度下使气体液化所需的最低压 力称为临界压力pc。
物质的聚集状态

物质的聚集状态一、物质的聚集状态物质的聚集状态主要有气态、液态和固态三种。
不同聚集状态物质的特性为:【知识拓展】①固体的构成粒子(分子、原子或离子)不能自由移动,但在固定的位置上会发生振动。
②溶液中的粒子及在一定空间范围内的气体粒子能自由移动。
③固体可以分为固体可以分为晶体和非晶态物质。
二、1mol不同物质体积的比较三、影响物质体积大小的因素1.物质体积的大小取决于构成这种物质的粒子数目、粒子的大小和粒子间的距离三个因素。
1mol任何物质中的粒子数目大致相同的,即为6.02×1023。
因此1mol物质的体积大小主要决定于构成物质的粒子大小和粒子间距离。
2.固体和液体物质:①内部紧密堆积,体积主要由粒子大小决定;②内部紧密堆积,改变温度、压强对体积影响不大;③1mol不同固体、液体的体积不相等。
3.气态物质:①分子间的距离比分子本身的体积大得多(约相差10倍),气体的体积主要由分子间的距离决定;②体积受温度、压强影响大;③同温同压下,同物质的量的气体体积基本相等。
【例1】下列有关气体体积的叙述中,正确的是()A.一定温度和压强下,各种气态物质体积的大小是由构成气体的分子大小决定B.一定温度和压强下,各种气态物质体积的大小是由构成气体的分子数决定C.不同的气体,若体积不同,则他们所含的分子数也不同D.气体摩尔体积指1mol任何气体所占的体积约为22.4L【解析】一定温度和压强下,各种气态物质体积的大小由气体分子数目决定,A错B对;C 中未指明温度和压强,不能确定;D应在标况下【答案】B四、气体摩尔体积1.定义:单位物质的量气体所占的体积,符号Vm ,单位是L/mol(L ·mol -1)或m 3/mol 。
2决定气体摩尔体积大小的因素是 气体分子间的平均距离 ;影响因素是 温度、压强 。
3.标准状况是指 0℃、101kPa 时 的状况,标准状况下1mol 任何气体所占体积都约为22.4L 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
摩尔分数 5 10-7 8.710-8 1 10-6 1 10-7 2 10-8 1 10-8 1 10-8 1 10-8 1 10-8
大气成分的演变
• 第一阶段(距今40~45亿年前):CH4和H2 (含有少量H2O、H2S、NH3、N2、Ar和He)
• 第二阶段(距今20~40亿年前):N2(含有 少量H2O、CO2、Ar、He、Ne和CH4)
波义耳定律:一定温度下,一定量气体的体积与压
强成反比。 PV = 常数
P1V1 = P2V’
(1)
(2)等压变化
查理-盖•吕萨克定律:一定压强下,一定量气体的体
积与绝对温度成正比(热力学温标)。 V/T = 常数
V’/T1 = V2/T2 (2)
V’ = V2T1/T2
(3)
(3)带入(1):P1V1/T1 = P2V2/T2
• 第三阶段(20亿年前至今):N2和O2 • [成因]火山喷发、雷电作用、大气光化学反
应、轻气体逃逸、植物光合作用等; 可能 由于化学惰性和溶解度低使N2的含量不断 累积提高,水的光化学分解和植物光合作用 有可能导致O2的增加,形成今天的大气。
• 生命起源的化学进化观点,即认为在原始地球的条件下,无机物 可以转变为有机物,有机物可以发展为生物大分子和多分子体系, 直到演变出原始的生命体。
(阿伏加德罗定律)
阿伏加德罗定律:等温等压下,气体的体积和 它的物质的量成正比
(2)单位和单位的匹配 单位:SI制和非SI制 P:Pa (SI)
kPa,atm,mmHg,torr,bar 1 atm = 760 mmHg = 760 torr = 101.3 kPa = 1.013105 Pa 1 bar = 1000 mbar = 100 kPa = 105 Pa
• 为论证生命起源的化学进化过程,1953年美国芝加哥大学研究生 米勒(ler)在其导师尤利(H.C.Urey)指导下完成了著名 的米勒模拟实验(Miller’s simulated experiment)。
实验步骤:将水注入左下方的500毫升烧瓶 内。先将玻璃仪器中的空气抽去。泵入 CH4、NH3和H2的混合气体(模拟还原性 大气)。再将500毫升烧瓶内的水煮沸,使 水蒸汽(H2O)和混合气体同在密闭的玻 璃管道内不断循环,并在另一容量为5升的 大烧瓶中,经受火花放电(模拟雷鸣闪电) 一周,最后生成的有机物,经过冷却后, 积聚在仪器底部的溶液内(模拟原始大气 中生成的有机物被雨水冲淋到原始海洋 中)。 实验结果:共生成20种有机物,其中11种 氨基酸中有4种(即甘氨酸、丙氨酸、天冬 氨酸和谷氨酸)是生物的蛋白质所含有的。
假定终态为:P3 V3 T3,….,Pi Vi Ti
P1V1 P2V2 P3V3 .... PiVi
T1
T2
T3
Ti
PV 常数 T
写成为一般形式
PV = KT K为常数 若取 1 mol 气体,V用Vm、K用R(摩尔气体常数)代 替,上l 气体,V= nVm,则上式写作:
一. 气 体
成份
N2 O2 Ar CO2 Ne He CH4 Kr H2
海平面上干燥空气的组成
摩尔分数 0.7808 0.2095 0.00934 0.00033 1.8210-5 5.2410-6 2 10-6 1.1410-6 5 10-7
成份
N2O Xe SO2 O3 NO2 I2 NH3 CO
任何一种物质:V = f (T, P, n) 对于液体和固体,该关系式非常复杂。但是不同的气 体在一定的条件下(高温低压)都符合同一个关系式
PV = nRT
理想气体状态方程
理想气体: (a)气体分子有质量但没有体积 (b)气体分子间除了弹性碰撞外,无其它相互作用力
真正的理想气体是不存在的,但在高温低压条件下, 实际气体接近于理想气体。
V:m3(SI) dm3(L),cm3(mL) 1 m3 = 103 dm3 = 106 cm3
简单推导:假设一定量的某种气体,由始态(P1 V1 T1) 变到终态(P2 V2 T2),n保持不变,分两步进行,每步 只涉及两个变量。
始态
P1 V1 T1
等温
P2 V’ T1
P2 V2 T2
终态
等压
等温过程 T1: P1, V1 P2, V’ 等压过程 P2: V’, T1 V2, T2
(1)等温变化
第一章 物质的聚集状态
气体(Gas)
液体(Liquid) 固体(Solid)
物质的聚集状态 (物质的三态)
三种物态之间可随温度或压强变化而互相转化
第四态:等离子体(Plasma)。当温度足够高,外界提供的能 量打破了气体分子中的原子核和电子的结合,气体就电离成由 自由电子和正离子组成的电离气体,即等离子体。等离子体的 意思是指其中粒子所带的正、负电量是相等的。例:等离子电 视(依靠高电压来激活显像单元中的特殊气体,使它产生紫外 线来激发磷光物质发光);电感耦合等离子体(ICP)光谱分 析技术。
液体与固体之间的过渡状态:液晶(Liquid crystal)。液晶既 具有液体的性质(流动性),也具有晶体的性质(光学和电学 性质与液体不同,很象晶体,是各向异性)。例:液晶显示器、 液晶电视(LCD通过电流来改变液晶面板上的薄膜型晶体管内 晶体的结构,使它显像 )。
本章介绍的内容:气体、液体、溶液和固体
气体的特性: 具有可扩散性和可压缩性 无固定形状 密度很小 可以以任何比例混合
不同的气体化学性质不同(H2、O2),但它们表现 出来的宏观性质(P、T、n、V)却非常相似。
气体的状态变量:P、T、n、V P 压强,T 温度,n 化学量(物质的量), V 体积
1. 理想气体状态方程
PV = nRT
在实际运用理想气体状态方程时,要注意两点:
(1)在不同的条件下,它有不同的表现形式
a) n一定时, P1V1 P2V2
T1
T2
b) n和T一定时,P1V1 = P2V2 (波义耳定律)
c) n和P一定时, V1 V2 (查理-盖•吕萨克定律) T1 T2
d) T和P一定时,
n1 V1 n 2 V2
