2014化工原理实验复习提纲(下册):
化工原理下册知识点总结

化工原理下册知识点总结化工原理是化学工程专业的基础课程之一,也是化学工程学生的必修课程。
化工原理下册主要涵盖了热力学基础、动力学基础、质量平衡、能量平衡、动量平衡、传质平衡等内容。
本篇将对化工原理下册的重点知识点进行总结,以帮助学生更好地掌握这门课程。
热力学基础热力学是研究能量、热量和动力学过程的学科。
在化工原理下册中,我们学习了热力学的基本概念和原理,包括热力学系统、热力学过程、热力学状态方程等内容。
另外,我们还学习了热力学中的三大定律,即热力学第一定律、热力学第二定律和热力学第三定律。
这些内容对于理解化工过程中的能量转化和热力学平衡至关重要。
动力学基础动力学是研究化学反应速率和反应机理的学科。
在化工原理下册中,我们学习了动力学基础知识,包括反应速率、反应动力学方程、活化能等内容。
我们还学习了不同类型的反应动力学,如一级反应、二级反应和三级反应,以及反应速率的影响因素。
这些知识对于设计和优化化工反应过程至关重要。
质量平衡质量平衡是化工过程中最基本的平衡之一,它是指在化工过程中物质的转移和转化情况。
在化工原理下册中,我们学习了质量平衡的基本原理和方法,包括质量平衡的基本概念、质量平衡方程、质量平衡计算等。
我们还学习了不同类型的化工过程中的质量平衡,如连续流程、静态过程和动态过程,以及不同状态下的物质平衡。
能量平衡能量平衡是化工过程中另一个重要的平衡之一,它是指在化工过程中能量的转移和转化情况。
在化工原理下册中,我们学习了能量平衡的基本原理和方法,包括能量平衡的基本概念、能量平衡方程、能量平衡计算等。
我们还学习了不同类型的化工过程中的能量平衡,如绝热过程、绝热稳态过程和非绝热过程,以及不同状态下的能量平衡。
动量平衡动量平衡是化工过程中液体或气体流动的平衡,它是指在化工过程中动量的转移和转化情况。
在化工原理下册中,我们学习了动量平衡的基本原理和方法,包括动量平衡的基本概念、动量平衡方程、动量平衡计算等。
化工原理实验水平测试复习提纲

《化工原理实验》水平测试复习提纲 2014.12一、处理工程实际问题的方法理论:1、工程问题实验研究方法论的作用:由此及彼。
由小见大2量纲分析理论方法的优缺点和步骤:优点:方法简单,不需要对过程机理深刻理解;实验结果可‘由此及彼,由小见大’。
缺点:不能对过程机理规律进行分析判断;结果不能外推,仅可在实验范围内应用。
步骤:参见教材P10—量纲分析方法一节。
3、建立数学模型的一般步骤:参见教材P17-18—建立数学模型的一般步骤一节。
1)对过程进行观测研究,概括过程的主要特征;2)抓住过程主要特征,对过程作适当简化,建立过程物理模型;3)根据物理模型建立数学模型。
4、处理工程问题实验方法的典型应用1)阻力实验—量纲分析理论方法2)离心泵实验—直接实验的方法3)过滤实验---数学模型方法4)传热实验—过程分解与合成的方法;量纲分析方法。
二、实验数据处理1、实验数据误差来源:系统误差、随机误差、过失误差---P382、观测的准确度和精确度:准确度是指观测数据的系统误差大小,系统误差小就称数据的准确度高;精确度是指观测数据的随机误差大小,随机误差小就称数据的精确度高。
在实验研究中,应首先要求数据的准确性大,其次考虑数据的精确性。
3、实验数据的处理方法:列表法:表头的设计图示法:坐标纸的选择数学模型法:目标函数的表达式;最小二乘法4、坐标纸系的适用场合:直角坐标纸:线性关系;一般场合;双对数坐标纸:幂函数关系;两变量数量级相差较大场合半对数坐标纸:指数函数关系。
5、直角坐标纸应用中坐标分度(亦称坐标比例尺)的计算方法---误差计算:实例:p56(例7)请掌握该例题的计算方法。
三、阻力实验实验流程实验操作步骤实验需测定哪些数据,分别采用什么仪表?数据处理方法和结果问题:1)压差传感器上平衡阀的作用是:在开车或结束时联通,在此二阶段防止传感器两端脉冲压差多大,损坏传感器2)流量测量采用涡轮流量计,该流量计要水平安装,其前后要有一定的稳定段长度。
化工原理下册复习

化工原理(下册)复习一、回答题/简述题1•在填料塔的Ig.ip〜lgu曲线图上,有哪两个转折点?2•精馏操作中,全回流的特点是什么?全回流通常适用于那些情况?3. 什么是有效膜理论?4•在凉水塔中,塔上部气液两相传热方向如何?传质方向如何?塔下部气液两相传热方向如何?传质方向是如何?5.总压1atm下,20C相对湿度55%,饱和蒸汽压为4.24 kPa的某湿空气,其绝对湿度是多少?若在其他条件不变的情况下将空气升温至40C,则其绝对湿度有无变化?6•已知湿空气的两个参数,可利用H-I图查得其他未知参数,试举三个例子。
7•作为干燥介质的湿空气的预热目的是什么?8•什么是理想干燥过程?9•低浓度溶质的气液平衡系统,当温度和压力不变,而液相总浓度增加时,其溶解度系数H将如何变化?10. 常压下用水吸收空气中的CO2,如用水量增大,贝畑塔的气体和液体中的CO2含量将如何变化?11. 完成某分离任务需理论板数为N T = 7(包括再沸器),若E T = 50%,则塔内所需的实际板数为多少?12 .用于真空精馏的高效低压降塔板是何种塔板/筛板?13. 在连续精馏塔中,若X f, X D, R, q, D/F相同,塔釜由直接蒸汽加热改为间接蒸汽加热,则所需的理论塔板数如何变化?塔底流出液浓度如何变化?14. 在恒定干燥条件下,将湿物料内可通过干燥除去的水分称为什么?15. 恒速干燥阶段,物料的表面温度等于空气的什么温度?16. 影响降速干燥阶段干燥速率的主要因素是什么?17. 某种气体在水中的溶解度很低,当用水吸收时,此吸收过程属于何种控制?为什么?18. 填料塔设计时,空塔气速一般取液泛气速的多少?在填料塔的g巾〜lgu曲线图上,有哪两个转折点?19. 低浓度气体逆流吸收时,当入塔液体量增大而其他条件不变时,液相传质单元数与气体出塔浓度将会如何变化?20. 对于低浓度气体吸收,当系统压力升高时,亨利系数如何变化?相平衡常数如何变化?21. 设计精馏塔时,增加塔板开孔率,会使漏液线发生什么变化?22. 什么是理论板数?什么是塔效率?23 观察塔板负荷性能图,若在较低的液气比L/V 下操作时,板式塔的生产能力将由哪条线控制?若在很高的液气比L/V 下操作时,板式塔的生产能力将由哪条线控制?24. 什么是干燥物料的临界含水量?它受哪些因素影响?25. 在其他条件不变的情况下将空气升温,则其绝对湿度将如何变化?26. 湿空气的干球温度、湿球温度、绝热饱和温度及露点温度之间有何关系?27. 什么是理想干燥?28. 什么是恒速干燥阶段?什么是降速干燥阶段?影响降速干燥阶段干燥速率的主要因素是什么?根据不同干燥阶段,如何强化干燥过程,具体可采用那些措施?29. 干燥操作和产品质量与干燥器出口空气的湿度或温度有何关系?为什么?30. 板式塔的塔板负荷性能图是由哪几条线构成的?其含义为何?正常操作的范围如何?31. 气液传质设备板式塔的主要构件是什么,它主要包括那些部分,各部分的作用是什么?32. 默弗里板效率的意义及其与干球温度和湿度的关系式是什么,默弗里板效率与点效率的区别是什么?33. 什么是结合水分?什么是非结合水分?二者的区别为何?34. 什么是平衡水分?什么是自由水分?二者的区别为何?35. 什么是填料塔的等板高度HETP?二、计算题1. 用填料塔逆流吸收混合气体中所含的苯。
化工原理(下册)复习

18. 某二元混合物,其中A为易挥发组分,液相组成x =0.5相应的泡点为t1, 与之相平衡的汽相组成y =0.7,相应的露点为t2,则:( c ) A. t1>t2 B. t1<t2 C.t1=t2 D. 不能判断 19.在化工生产中,要提高吸收的效果,可以设法提 A 高吸收总传质系数,必须采取( ) A. 降低气膜和液膜厚度 B. 提高气膜和液膜厚度 C. 减少流体流动速度 20.下列各项中属于物性参数的是 ( B ) A.气膜吸收系数 B.分子扩散系数D C.涡流扩散系数 D.脱吸因数S
8.当空气的温度一定时,不饱和湿空气的湿球温度 总是低于干球温度,那么空气的干球温 度和湿球 温差越小,表明空气( B ) A 越干燥 B 越潮湿 C 焓值越高 D 焓值越低 9.在干燥过程中,新鲜空气在预热器中所经历的状 态变化属于( D )。 A 等焓过程 B 等相对湿度过程 C 绝热过程 D 等湿过程 10.萃取是利用各组分间的( C )差异来分离液体 混合物的。 A 挥发度 B 离散度 C 溶解度 D 密度
• 干燥过程的物、热衡算--干燥静力学 1、物料水份量表示法: • 湿、干基含水量 2、物料衡算 ①新鲜干空气用量 ②干燥产品流量 3、热量衡算 ①连续干燥系统的预热器及干燥器热量计算 ②干燥系统热效率
干燥过程的平衡关系干燥速率计算--干燥动力学
• 1、湿物料中水份存在形式 • Ⅰ)分类原则 • Ⅱ)平衡水份与自由水份 • Ⅲ)结合水份与非结合水份 • Ⅳ)四者之间互相关系 • 2、干燥时间计算 • ①恒定干燥 Ⅰ)干燥实验及曲线:X~τ, X~t • Ⅱ)干燥速率曲线 等速干燥、降速干燥,临界含水量 • Ⅲ)干燥时间 • ②变动干燥 • Ⅰ)与恒定干燥过程的比较
• 吸收塔的设计计算 1、吸收塔的物料衡算与操作线方程 ①物料衡算:全塔衡算,任意塔段衡算与操作线方程 ②吸收剂用量的决定:最小液--气比 实际液--气比确定的原则:经济性与技术性综合考虑 ③关于并流吸收:操作线方程过程特点 2、填料吸收塔高度计算方法之一 ①填料塔高度计算公式 ②传质单元数与传质单元高度 ③传质单元数的求取 Ⅰ)图解积分法 Ⅱ)解析法:解吸因子法、对数平均浓度法 Ⅲ)直接图解梯级法(Baker法)
《化工原理》(下)复习提要

《化工原理》(下)复习提要1各章要点1.1传质概论与吸收基本概念:分子扩散及对流扩散的概念,菲克定律,一维定常分子扩散速率,等分子反向扩散,单向扩散,总体流动、漂流因素;传质速率与扩散通量,浓度的不同表示法及其关系,膜模型,相内传质速率式;相平衡关系,吸收和解析得传质方向、限度,推动力及其不同得表示形式,双膜模型及传质理论简介;相际传质速率式,传质阻力及表示,气膜控制、液膜控制;吸收操作的基本概念,典型吸收设备与流程,吸收过程的相平衡关系(溶解度曲线,亨利定律),影响平衡的主要因素;吸收过程的物料衡算,操作线方程,吸收剂的选择及用量的确定,最小溶剂用量的概念;传质单元数及传质单元高度的概念,吸收因子(解吸因子)的概念,理论板与等板高度;低浓吸收填料层高度的计算(平衡线为直线及曲线两种情况);传质系数的测定、准数与准数关联式;高浓度吸收的特点及计算的主要方程及步骤。
基本公式: 气液平衡:mX Y mx y Hc Ex p ====***对稀溶液: 传质速率:)()()()(**x x k y y k X X K Y Y K N i x i y X Y A -=-=-=-= 物料衡算:max1*21max 1212121)()(ηηϕηη=-=-=-=-Y Y Y Y Y Y Y Y V X X L 吸收剂的用量:min 2*121min 2~1.1L L X X Y Y V L =⇒⎪⎪⎭⎫ ⎝⎛--= 填料层高度:HETP N N H N H Z T O L O L O G O G ===mOL m OG X OL Y OG X X X N Y Y Y N a K LH a K VH ∆-=∆-=Ω=Ω=2121 ()⎪⎪⎭⎫ ⎝⎛+----=⇒=S Y Y Y Y S S N L mV S OG *22*211ln 11 ()⎪⎪⎭⎫ ⎝⎛+----=⇒=A Y Y Y Y A A N mV L A OL *11*211ln 11 2121ln 1lnX X Y Y A A A N T N T ∆∆=∆∆=--=ϕϕ 1.2精馏基本概念:两组分物系的汽液平衡关系,t-x-y 图, x-y 图,拉乌尔定律,泡点与露点,泡点方程与露点方程,挥发度与相对挥发度及其影响因素;精馏原理;双组分连续精馏塔的物料衡算,恒摩尔流假设,理论板的概念,操作线方程,进料热状况,q 的意义及计算,最小回流比的概念及确定,回流比对精馏过程的影响,理论板数的确定;(图解法,逐板计算法及简捷法);点效率、板效率和塔效率的概念,实际塔板数的确定;精馏装置的热衡算;平衡蒸馏、简单蒸馏的特点及计算;精馏塔全塔效率及点效率的测定方法。
化工原理(下)复习各章知识点及复习题
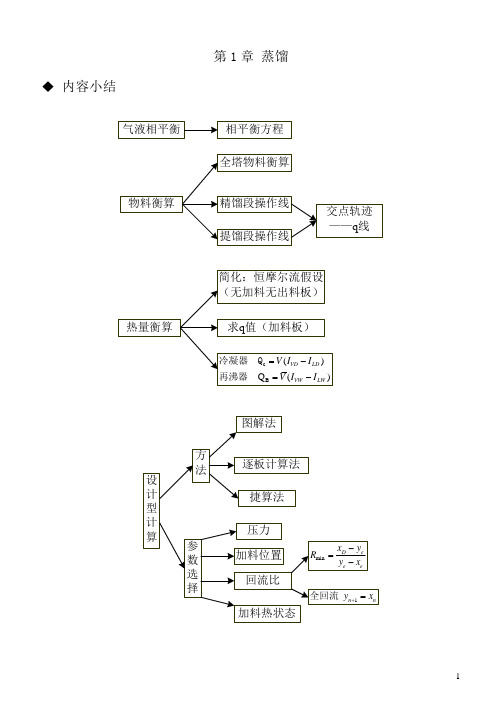
第1章蒸馏 内容小结复习题1 蒸馏概述蒸馏操作是借混合液中各组分挥发性的差异而达到分离目的。
轻组分:混合物中的易挥发组分;重组分:混合物中的难挥发组分例:蒸馏是分离的一种方法,其分离依据是混合物中各组分的,分离的条件是。
答:均相液体混合物,挥发性差异,造成气液两相系统精馏操作压力的选择减压蒸馏:降低了液体的沸点。
应用场合:分离沸点较高的热敏性混合液,混合物沸点过高的物系(避免采用高温载热体)。
加压蒸馏:提高冷凝温度避免使用冷冻剂。
应用场合:分离常压下呈气态的物系,馏出物的冷凝温度过低的物系。
举例:脱丙烷塔操作压力提高到1 765kPa时,冷凝温度约为50℃,便可使用江河水或循环水进行冷却,石油气常压呈气态,必须采用加压蒸馏。
2 双组分溶液的气液相平衡例:当混合物在t-x-y图中的气液共存区内时,气液两相温度,但气相组成液相组成,而两相的量可根据来确定。
答: 相等,大于,杠杆规则例:当气液两相组成相同时,则气相露点温度液相泡点温度。
答:大于例:双组分溶液的相对挥发度α是溶液中的挥发度对的挥发度之比,若α=1表示。
物系的α值愈大,在x-y图中的平衡曲线愈对角线。
答:易挥发组分,难挥发组分,不能用普通蒸馏方法分离,远离理想溶液的含义例:理想溶液满足拉乌尔定律,也满足亨利定律;非理想稀溶液满足亨利定律,但不满足拉乌尔定律;服从亨利定律并不说明溶液的理想性,服从拉乌尔定律才表明溶液的理想性例:精馏塔分离某二元物系,当操作压强降低时,系统的相对挥发度 ( ),溶液的泡点( ),塔顶蒸汽冷凝温度( )。
答:增大,减小,减小3 平衡蒸馏与简单蒸馏4 精馏例:精馏塔的作用是。
答:提供气液接触进行传热和传质的场所。
例:在连续精馏塔内,加料板以上的塔段称为,其作用是;加料板以下的塔段(包括加料板)称为_____,其作用是。
答:精馏段提浓上升蒸汽中易挥发组分提馏段提浓下降液体中难挥发组分例:离开理论板时,气液两相达到 状态,即两相 相等,____互成平衡。
【精品】化工原理(下)复习.doc

吸收过程基本方程H = H OG N OG 对数平均推动(Ji -mx 1)-(y 2 -mx ) ln Zi 一叫 y 2 -mx 2传质速率方程式 N A =K y (y-y e ) = K x (x e -x)吸收因数法“ 1 , mG x j. - mx, mG 、 N OG = ln[(l )J1 2+ ] 1 mU L y 2 -mx 2 L 最小液气比(L).=儿一儿 G x le - x 2 物料衡算式 G (J 1-J 2) = ^(X 1-X 2)问题1.吸收的目的和基本依据是什么?吸收的主要操作费用花费在哪?问题2.选择吸收溶剂的主要依据是什么?什么是溶剂的选择性?问题3.E,m,H 三者各自与温度、总压有何关系?问题4.扩散流J A ,净物流N,主体流动N M ,传递速率N A 相互之间有什么联 系和区别? 问题5.漂流因子有什么含义?等分子反向扩散时有无漂流因子?为什么? 问题6.气体分子扩散系数与温度、压力有何关系?液体分子扩散系数与温度、 粘度有亨利定律pe = Ex , p e = HC ; 相平衡 y e = mx 费克定律 j _ D dC A J A ~ “AB , az传递速率 D C N A =J A + NX A ;N A = --^(C A1 -C A2)b C Bm 厂 _ CB2 ~ CBlJ Bin 一 厂In 沁C B\对流传质N R =k g (p- p i ) = k L (C ! -C) = k y (y-y i ) = k x (x i - x) 总传质系数K yG G 儿-儿K y a 勺”何关系?问题7.修伍德数、施密特数的物理含义是什么?问题&传质过程中,什么时侯气相阻力控制?什么时侯液相阻力控制?问题9.低浓度气体吸收有哪些特点?数学描述中为什么没有总物料的衡算式?问题10.吸收塔高度计算中,将N OG与H OG分开,有什么优点?问题11.建立操作线方程的依据是什么?问题12.什么是返混?问题13.何谓最小液气比?操作型计算中有无此类问题?问题14. X2max与①/⑵讪是如何受到技术上的限制的?技术上的限制主要是指哪两个制约条件?问题15.有哪几种N OG的计算方法?用对数平均推动力法和吸收因数法求N OG 的条件各是什么?问题16. H OG的物理含义是什么?常用吸收设备的H°G约为多少?问题17.吸收剂的进塔条件有哪三个要素?操作中调节这三要素,分别对吸收结果有何影响?问题1&高浓度气体吸收的主要特点有哪些?问题19.化学吸收与物理吸收的本质区别是什么?化学吸收有何特点?1、在填料塔中用清水吸收混合气体中的氨,当水量增大时,气相总传质单元数“。
化工原理复习提要(下)

总复习第七章1、相组成()RTp M c Vn c V m AA AA AA AA ====ρρ度质量浓度与物质的量浓1()BA M M M M x m 2BAAAAA BB A A AA AA AA x M x M x nn x m ωωωωω+=+===质量分数与摩尔分数()AAA A AA AAA A AA AAA A AA X X X X x X x x X m m m X n n n X +=+=-=-=-=-=11113ωωω质量比与摩尔比例题:含丙酮%(质量分数)的水溶液,其密度为m 3,试计算丙酮的摩尔分数、摩尔比及物质的量浓度。
x A =、X A =、c A =2、质量传递(1)等分子反方向传递(摩尔汽化潜热相等的蒸馏)()()2121A A AB AA A ABA p p zRT D N c c z D N -∆=-∆=(2)一组分通过另一停滞组分(吸收操作)()()⎪⎪⎭⎫ ⎝⎛+=-=-∆=-=-∆=221112122112122121ln ln M M c x x x x x x x zx RT c D N p p p p p p p zP RT P D N B B B B BMA A BM AB A B B B B BMA A BM AB A ρρ总总总液相中例题:在直径为、长度为的圆管中CO 2气体通过N 2的温度为383K ,总压为,管两端CO 2的分压分别为和。
试计算CO 2的扩散通量。
已知该条件下CO 2在N 2中的扩散系数为×10-4m 2/s 。
N A =×10-6kmol/(m 2·s) 3、对流传质()Ab Ai L A c c k N -=例题:在常压下,30℃的空气从厚6mm 、长度为500mm 的萘板的上下表面沿水平方向吹过。
在30℃下,萘的饱和蒸汽压为 pa ,固体萘的密度为1152kg/m 3,空气与萘板间的对流传质系数为s 。
化工原理下册复习提纲(修改)

αx y= 1 + (α − 1) x
相平衡方程
α的大小可作为用蒸馏分离某一物系的难易程度标志。 的大小可作为用蒸馏分离某一物系的难易程度标志。
P ↓, α ↑ ,两相区扩大,有利于分离
液相组成x对应的y值愈大, α愈大则同一 液相组成x对应的y值愈大, α=1时 y=x,则汽液两相组成相同即y α=1时,y=x,则汽液两相组成相同即yA=xA,yB=xB, 这时用一般精馏方法无法分离。 这时用一般精馏方法无法分离。
二
气液相平衡
1、溶解度曲线 •吸收剂、温度T、p 一定时,不同物质的溶解度不同。 温度、溶液的浓度一定时,溶液上方分压越大的物质越难溶。 •对于同一种气体,分压一定时,温度T越高,溶解度越小。 •对于同一种气体,温度T一定时,分压pA越大,溶解度越大。 •加压和降温对吸收操作有利,而减压和升温则有利于解吸操作 加压和降温对吸收操作有利, 加压和降温对吸收操作有利 溶解度仅取决于溶质分压。
三、四线及最小回流比
L D R 1 y n +1 = xn + xD = xn + xD V V R +1 R +1 L W RD + qF F −D yn +1 = xn − xw = xn − xw ( R + 1) D − (1 − q ) F ( R + 1) D − (1 − q ) F V V
2、亨利定律 相平衡关系数学描述 (1) y e = mx (2) pe = HC (3)
pe = Ex
(1)三种表达形式
E、m、H的数值越小,溶质的溶解度越大 E≈ Hρ s Ms E m= P m除与温度有关外,还与总压有关
E = f(t) H = f(t) t↓ ↓
化工原理(下)复习整理

1. 吸收传质速率方程
气相
液相
两相间
两相间
NA kY Y Yi kX Xi X KY Y Y* KX X * X
NA ky y yi kx xi x Ky y y* Kx x* x
NA kG pA pi kL ci cA KG pA pA KL cA cA
二. 亨利定律的其它形式
当气、液相溶质浓度用其它组成表示法表示时,通过浓度换算可得其它 形式的亨利定律,常用的形式有:
y* mx
相平衡常数,无因次
式中:
pA*
cA H
溶解度系数, kmol/(m3kPa)
y*——液相组成为x呈平衡的气相中溶质的摩尔分数; cA ——液相中溶质的摩尔浓度,kmol/m3; m —— 相平衡常数; H —— 溶解度系数;kmol/(m3kPa);
S
1
1 0.67
ln1
0.67
0.02 0.36 0.0002 0.0002 0.36 0.0002
0.67
11.98
设计型问题计算
ya
xa=0.02%
=99%
h0 HOG NOG 1.03 11.98 12.4m
D=1.1m
溶剂用量 为最小用 量的1.5倍
课后练习:用“平均推动力法”解答。
KY kY kX
1 11
K X mkY kX
mKY K X
气膜控制KY kY
注意:
液膜控制KX kX
1. 传质系数的单位:kmol/(m2·s·单位推动力)
2. 传质系数与传质推动力的正确搭配,即传质系数的表达形式与推动力的表
达形式一一对应。
汇总:
习题课
yb
L G
化工原理下册总结知识点

化工原理下册总结知识点第一章:化工原理的基本概念本章主要介绍了化工原理的定义、研究对象、基本问题和基本概念。
化工原理是揭示化学工艺生产过程中涉及的物质和能量转化规律的科学原理。
化工原理的研究对象是化学工艺生产过程。
化工原理的基本问题包括反应动力学、传质和传热、流体力学等。
化工原理的基本概念包括物质平衡、能量平衡、反应速率、传质速率、传热速率、动量传递等。
第二章:物质的热力学性质本章主要介绍了物质的热力学性质,包括物质的状态函数、状态方程、状态图,热力学基本定律,热力学函数等。
物质的状态函数包括内能、焓、熵等。
物质的状态方程包括理想气体状态方程、克拉珀龙方程等。
物质的状态图包括P-V图、P-T图、T-S图等。
热力学基本定律包括热力学第一定律、热力学第二定律等。
热力学函数包括焓、自由能、吉布斯函数等。
第三章:理想气体混合物的平衡本章主要介绍了理想气体混合物的平衡,包括平衡态条件、混合物的平衡常数、Gibbs函数和反应平衡常数等。
平衡态条件包括稳定平衡态和不稳定平衡态。
混合物的平衡常数包括形成常数、平衡常数、活度等。
Gibbs函数和反应平衡常数包括Gibbs自由能、反应平衡常数等。
第四章:液体混合物的平衡本章主要介绍了液体混合物的平衡,包括液体混合物的正则方程、活度系数、汽液平衡和液-液平衡等。
液体混合物的正则方程包括盖丁方程、运动方程等。
活度系数包括活度系数的概念、求取方法等。
汽液平衡包括汽液平衡的条件、汽液平衡的计算等。
液-液平衡包括液-液平衡的条件、液-液平衡的计算等。
第五章:化工动力学本章主要介绍了化工动力学,包括化工反应动力学基本概念、速率方程和反应机理等。
化工反应动力学基本概念包括化学反应动力学的研究对象、动力学方程等。
速率方程包括速率常数、速率表达式等。
反应机理包括反应机理的确定方法、反应过程中的化学反应类型等。
第六章:传质基本概念和传质作用本章主要介绍了传质基本概念和传质作用,包括传质的基本概念、Fick定律、传质系数、传质规律等。
化工原理复习2014(下册)选择题答案版

化工原理复习2014(下册)选择题答案版化工原理复习题(下册)吸收与精馏一.选择题1.吸收操作的依据是(B)。
A.挥发度差异B.溶解度差异C.温度差异D.密度差异2.在逆流吸收塔中,增加吸收剂用量,而混合气体的处理量不变,则该吸收塔中操作线方程的斜率会____A_____。
A.增大B.减小C.不变D.不能确定3.在吸收系数的准数关联式中,反映物性影响的准数是( B )A.ShB.ReC.CaD.Sc4.已知SO2水溶液在三种温度t1、t2、t3下的亨利系数分别为E1=0.35kPa、E2=1.1kPa、E3=0.65kPa 则(A)A.t1<t2< bdsfid="98" p=""></t2<>B.t3>t2C.t3 <t1< bdsfid="101" p=""></t1<>D.t1>t25.在吸收塔中,随着溶剂温度升高,气体在溶剂中的溶解度将会( C )。
A.增加B.不变C.减小D.不能确定6.下述说明中正确的是( D )。
A.用水吸收氨属液膜控制B.常压下用水吸收二氧化碳属难溶气体的吸收,为气膜阻力控制C.用水吸收氧属难溶气体的吸收,为气膜阻力控制D.用水吸收二氧化硫为具有中等溶解度的气体吸收,气膜阻力和液膜阻力都不可忽略7.下述说法错误的是(B )。
A.溶解度系数H很大,为易溶气体B.亨利系数E值很大,为易溶气体C.亨利系数E值很大,为难溶气体D.相平衡系数m值很大,为难溶气体8.扩散系数D是物质重要的物理性质之一,下列各因数或物理量与扩散系数无关的是(D)A.扩散质和扩散介质的种类B.体系的温度C.体系的压力D.扩散面积9.吸收塔的操作线是直线,主要基于如下原因(D)。
A 物理吸收B 化学吸收C 高浓度物理吸收D 低浓度物理吸收10.吸收操作的作用是分离(A)。
化工原理(下)复习

当α>1时,表示组分A较B容易挥发, α愈大,挥发度差异
愈大,分离愈容易。
当α=1时,气相组成与液相组成相同,不能用普通精馏方法
加以分离。
y
x
1 ( 1 ) x
α=1,相平衡关系为对角线; α越大,偏离对角线越远, 同一液相组分x对应的y值越 大,可以得到浓度较高的轻 组分,分离越容易;
全塔效率(总板效率) 达到指定分离效果后,理论塔板数NT 与实际塔板数NR 之比 称为塔板效率,用ET表示。
ET NT N
p
NT:理论板数; Np:实际板数; 单板效率(默弗里Murphree板效率) 汽相单板效率:
E mV y n y n 1 y n y n 1
,n
(10-35)
二、理论塔板的概念( Ideal plate or tray )
理论板是指离开该塔板的蒸汽和液体呈平衡状态的塔板。
yn
xn
1 ( 1 ) x n
在理论板上,两相温度相等,组成互成平衡。 理论板不存在的原因:气液间接触面积和接触时间是有限
的,难以达到平衡状态。
理论板可作为衡量实际板分离效率的依据和标准。
y n 1
R R 1
xn
1 R 1
xD
上式即为精馏段操作线方程。它描述了任一板(第n层板)的液体组成与自相
邻的下一塔板(第n+1层)上升的蒸汽组成之间的关系,为一线性关系,其中,
斜率为R/(R+1), 截距为xD/(R+1)。
y m 1
L qF L qF W
xm
kB yB xB
kA yA xA
式中
y A、 B y
化工原理下册概念复习

化工原理下册概念复习化工原理下册概念复习第五章气体吸收气体吸收操作的主要目的是分离气体混合物的组分。
气体吸收是气体溶解于液体的过程。
解吸操作中溶质气体的转移方向是自液相至气相。
吸收?解吸对一定的气、液体系,温度升高,气体溶解度减小。
有利于吸收有利于解吸五、溶剂的选择p229吸收操作对吸收剂的要求是对欲吸收的溶质气体的溶解度大,选择性好,溶解度随温度改变的变化大,挥发度小,无毒,价廉易得。
5.2气液相平衡亨利定律稀溶液p *=Exp *=c/Hy *=mxm=E/P如总压1atm (绝压),20℃的空气与水长期接触,则水中O 2的摩尔分数x=5.24×10-6,E=4.01×104atm ,空气中O 2的摩尔分数y= 0.21如含有79%(体积)N 2的空气与水接触,温度为25℃,总压为100kP a ,查得亨利系数E =8.76×105kP a ,则液相中N 2的平衡浓度C *=↓↑t p ↑↓t p5.01×10-4 kmol/m 3。
5.2.2 相平衡与吸收过程的关系(y -y *)以气相浓度差表示的吸收推动力;若相平衡常数为m ,塔内某截面的气液相含易溶组分的摩尔分数为y 及x ,当以y-y*表示总推动力,y*= mx 。
(x *-x )以液相浓度差表示的吸收推动力。
对塔内任一气液浓度分别为y,x 的截面,相际传质推动力为(x*-x),x*=y/m5.3 分子扩散费克定律T 、P 一定的一维定态:对于二元物系,设A 为溶质气体,B 为惰气,二者摩尔浓度之和为常量,C A +C B =恒值,则分子扩散系数D AB 与D BA 的关系是D AB =D BA ,由费克定律算出A 与B 的分子扩散速率J A 与J B 。
二者关系是= 。
非电解质稀溶液,液相分子扩散系数DAB 与绝对温度的1次方成正比对非电解质稀溶液,液相分子扩散系数D 与黏度的1次方成反比。
化工原理下复习总结

四、热量衡算
空气预热器传给气体的热量为
Q p L( I H 1 I H 0 )
Q QP QD 1.01L(t2 t0 ) W ( 2490 1.88t2 ) Gcm ( 2 1 ) QL W ( 2490 1.88t2 ) 100% Q
x y 1 1x
相图表示的气液平衡关系(t-x-y, x-y)
1
y
D N t/C
两相区 露点
气相区
y1
露点线
泡点 泡点线
0
x1
1
x
0
液相区
xA
xf x(y)
yA
1.0
• 线和区的意义,汽液两相组成变化的关系。
二、蒸馏 了解简单蒸馏、平衡蒸馏(操作及特征) 三、精馏 1、精馏原理和流程 t-x-y相图表示的精馏过程 x-y相图表示的精馏过程 y3
V
L
1
Y1
X1
图表示的吸收过程
Y Y1
Y*=f(X)
B
Y2
T
X2
X1
X1
*
吸收剂用量的确定,最小吸收剂用量
L (Y1 - Y2 ) ( ) min Y1 V X2 m
2、填料层高度计算 • 掌握对低浓度气体吸收的计算(填料层高度的计 算),传质单元高度,传质单元数的概念,重点是 以平均推动力法和吸收因数法为主计算传质单元高 度,并引入吸收的操作型问题的解法。了解吸收的 塔板数及解吸操作。 V,Y2 L,X2 • 基本公式: dG A VdY LdX
dY * Y 2 Y Y X1 L dX Z K X a X 2 X * X V Z KY a
Y1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一部分 实验基础知识
1、 如何读取实验数据
2、 如何写实验报告
3、 数据处理
一、实验数据的误差分析
1. 真值
2、平均值及其种类
3、误差的分类
4、精密度和精确度
5、实验数据的记数法和有效数字
错误认识:小数点后面的数字越多就越正确,或者运算结果保留位数越多越准确。
二、实验数据处理
实验数据中各变量的关系可表示为列表式,图示式和函数式。
第二部分 实验内容
a
log log log log ln ln ln ln ln 1212=--+=⇒=+=⇒=截矩直线的斜率=真值,双对数坐标半对数坐标x x y y x b a y ax y bx
a y ae y
b bx Θ
每个实验的原理、操作方法、仪表的使用、实验记录、数据处理、思考题
一、精馏实验:
物系、实验原理、流程图、数据处理(用公式表示)、思考题
1)测定指定条件下的全塔效率或等板高度
2)操作中可调节可控制的量
3)物料浓度的测定方法
4)操作步骤,先全回流,再确定一定回流比操作,为什么
5)实验中出现异常现象(液泛,无回流),如何判断?如何处理?
6)进料状态对精馏塔的操作有何影响?确定q线需要测定哪几个
量?查取进料液的汽化潜热时定性温度应取何值?
7)什么是全回流?全回流操作的标志有哪些?在生产中有什么实际
意义?
8)其他条件都不变,只改变回流比,对塔性能会产生什么影响?
9)进料板位置是否可以任意选择,它对塔的性能有何影响?
10)为什么酒精蒸馏采用常压操作而不采用加压蒸馏或真空蒸馏?
11)将本塔适当加高,是否可以得到无水酒精?为什么?
12)影响精馏塔操作稳定的因素有哪些?如何确定精馏塔操作已达
稳定?本实验装置能否精馏出98%(质量)以上的酒精?为什么?
13)各转子流量计测定的介质及测量条件与标定时的状态不同,应如
何校正?。
