蛋白质分子量测定:凝胶过滤层析法
凝胶层析法(凝胶过滤)脱盐和分离蛋白质-1

凝胶层析法(凝胶过滤)脱盐和分离蛋白质-1原理凡盐析所获得的粗制蛋白质(盐析得到的IgG)中均含有硫酸铵等盐类,这类将影响以后的纯化,所以纯化前均应除去,此过程称为“脱盐”(desalthing)。
脱盐常用透析法和凝胶过滤法,这两种方法各有利弊。
前者的优点是透析后析品终体积较小,但所需时间较长,且盐不易除尽;凝胶过滤法则能将盐除尽,所需时间也短,但其凝胶过滤后样品体积较大。
所以,要根据具体情况选择使用。
凝胶达滤后样品体积不会太增加,所以选用凝胶过滤法。
凝胶过滤(gel filtration),又称为凝胶层析(gel chromatograph y)、分子筛过滤(molecularsieve filtration)、凝胶渗透层析(gel osmotic chromatography)等。
它是20世纪60年代发展起来的一种层析技术。
其基本原理是利用被分离物质分子大小不同及固定相(凝胶)具有分子筛的特点,将被分离物质各成分按分子大小分开,达到分离的方法。
凝胶是由胶体粒子构成的立体网状结构。
网眼里吸满水后凝胶膨胀呈柔软而富于弹性的半固体状态。
人工合成的凝胶网眼较均匀地分布在凝胶颗粒上有如筛眼,小于筛眼的物质分子均可通过,大于筛眼的物质分子则不能,故称为“分子筛”。
凝胶之所以能将不同分子的物质分开是因为当被分离物质的各成分通过凝胶时,小于筛眼的分子将完全渗入凝胶网眼,并随着流动相的移动沿凝胶网眼孔道移动,从一个颗粒的网眼流出,又进入另一颗粒的网眼,如此连续下去,直到流过整个凝胶柱为止,因而流程长、阻力大、流速慢;大于筛眼的分子则完全被筛眼排阻而不能进入凝胶网眼,只能随流动相沿凝胶颗粒的间隙流动,其流程短、阻力小、流速快,比小分子先流出层析柱;小分子最后流出。
分子大小介于完全排阻不能进入或完全渗入凝胶筛眼之间的物质分子,则居中流出。
这样被分离物质即被按分子的大小分开。
用于凝胶层析的凝胶均为人工合成的产品,主要有交联葡聚糖(商品名为Sephadex)、琼脂糖(商品名为Sepharose)、聚丙烯酰胺凝胶(商品名为Bio–gel)及具有一定网眼的细玻璃珠等和这些凝胶的衍生物。
根据分子大小分离蛋白质的方法

根据分子大小分离蛋白质的方法蛋白质是生命体中非常重要的分子,它们在细胞的结构和功能中起着关键作用。
为了研究蛋白质的特性和功能,科学家们经常需要对蛋白质进行分离和纯化。
分离蛋白质的一个重要方法是根据蛋白质的分子大小进行分离。
本文将介绍几种常用的根据分子大小分离蛋白质的方法。
一、凝胶过滤层析法凝胶过滤层析法是一种基于分子大小的常用分离技术。
其原理是利用孔径大小不同的凝胶材料,将大分子蛋白质滞留在凝胶中,而小分子溶质可以顺利通过凝胶。
常用的凝胶材料有琼脂糖和聚丙烯酰胺凝胶等。
根据需要选择不同的凝胶孔径,可以实现对不同分子大小的蛋白质进行分离。
二、聚丙烯酰胺凝胶电泳聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离技术。
它利用电场作用将蛋白质分子按照大小进行分离。
在聚丙烯酰胺凝胶中,较大的蛋白质分子迁移速度较慢,而较小的蛋白质分子迁移速度较快。
通过调整电场强度和时间,可以实现对不同分子大小的蛋白质进行分离。
三、尿素聚丙烯酰胺凝胶电泳尿素聚丙烯酰胺凝胶电泳是一种常用的变性凝胶电泳方法。
尿素是一种强变性剂,可以使蛋白质分子解离成单体,并且具有较好的可溶性。
在尿素聚丙烯酰胺凝胶电泳中,蛋白质分子的迁移速度主要取决于它们的电荷和分子大小。
通过调整电场强度和时间,可以实现对不同分子大小的蛋白质进行分离。
四、尺寸排阻色谱尺寸排阻色谱是一种利用固定相孔径大小进行分离的色谱技术。
在尺寸排阻色谱中,较大的蛋白质分子无法进入固定相孔径,因此会以较快的速度从色谱柱中洗脱,而较小的蛋白质分子则会在固定相中发生多次扩散,从而保留更长的时间。
通过调整固定相的孔径,可以实现对不同分子大小的蛋白质进行分离。
五、离心过滤法离心过滤法是一种简便快速的蛋白质分离方法。
它利用离心力将大分子蛋白质沉淀在滤膜上,而小分子蛋白质则通过滤膜被洗脱出来。
通过选择不同孔径的滤膜,可以实现对不同分子大小的蛋白质进行分离。
根据分子大小分离蛋白质的方法有凝胶过滤层析法、聚丙烯酰胺凝胶电泳、尿素聚丙烯酰胺凝胶电泳、尺寸排阻色谱和离心过滤法等。
凝胶过滤层析实验报告

凝胶过滤层析实验报告凝胶过滤层析实验报告引言:凝胶过滤层析是一种常用的生化分离技术,广泛应用于蛋白质纯化、分析和富集等领域。
本实验旨在通过凝胶过滤层析的方法,对混合蛋白样品进行分离和纯化,探究其原理和应用。
材料与方法:1. 凝胶过滤层析柱:选择合适的分子量截留范围,如10 kDa。
2. 混合蛋白样品:包含多种蛋白质,分子量范围从10 kDa到100 kDa。
3. 缓冲液:选择适当的缓冲液,如PBS。
4. 装载样品:将混合蛋白样品与缓冲液按比例混合,使其浓度适当。
实验步骤:1. 准备凝胶过滤层析柱:将柱子连接到系统中,并进行预洗,以去除残留物和杂质。
2. 样品装载:将装载样品注入凝胶过滤层析柱中,注意不要过载。
3. 层析过程:使用缓冲液进行层析,使样品在柱子中通过,并收集出流液。
4. 收集样品:根据需要,可以分别收集不同分子量范围的样品。
结果与讨论:通过凝胶过滤层析实验,我们成功分离并纯化了混合蛋白样品。
在层析过程中,不同分子量的蛋白质通过凝胶过滤层析柱时,会受到凝胶孔径的限制,从而分离出不同大小的蛋白质。
较大分子量的蛋白质无法通过凝胶孔径,会在柱中滞留,而较小分子量的蛋白质则能够通过凝胶孔径,从柱中流出。
通过收集不同分子量范围的样品,我们可以得到纯化后的蛋白质。
这些蛋白质可以进一步进行质谱分析、酶活性检测等实验,以获取更多关于蛋白质的信息。
凝胶过滤层析方法具有许多优点。
首先,它是一种快速、简单且高效的分离技术。
其次,凝胶过滤层析柱具有较高的容量和稳定性,可以处理大量样品。
此外,凝胶过滤层析适用于多种样品类型,包括细胞裂解液、培养基和体液等。
然而,凝胶过滤层析也存在一些局限性。
首先,凝胶孔径的选择需要根据样品的分子量范围来确定,如果样品中存在分子量相近的蛋白质,则可能无法完全分离。
其次,凝胶过滤层析无法去除溶液中的小分子物质,如盐离子和小分子有机物,这些物质可能对后续实验产生影响。
结论:凝胶过滤层析是一种常用的生化分离技术,通过分子量选择性分离和纯化蛋白质。
蛋白质层析法

蛋白质层析法是一种用于分离和纯化蛋白质的技术,它基于蛋白质在不同条件下在固定相和流动相中的分配系数不同来实现分离。
层析技术的基本原理是将混合物中的各组分根据其物理或化学性质(如分子大小、电荷、亲和性等)在不同相中的不同分布和迁移速率来实现分离。
以下是一些常见的蛋白质层析技术:
1. **凝胶过滤层析(Gel Filtration Chromatography)**:
- 也称为分子筛层析,利用凝胶的多孔结构将分子按大小分离。
小分子可以进入凝胶内部的孔隙,而大分子则被排阻在外部,因此迁移速度不同。
2. **离子交换层析(Ion Exchange Chromatography)**:
- 根据蛋白质的电荷性质(如阴离子或阳离子交换树脂)来分离蛋白质。
带正电的蛋白质可以与阴离子交换树脂结合,而带负电的蛋白质则与阳离子交换树脂结合。
3. **亲和层析(Affinity Chromatography)**:
- 利用蛋白质与特定配体(如金属离子、生物大分子等)的特定相互作用来分离蛋白质。
4. **反相层析(Reverse Phase Chromatography)**:
- 基于蛋白质在不同极性溶剂中的不同保留行为来实现分离。
通常使用非极性固定相(如C-18柱)和极性流动相。
5. **尺寸排阻层析(Size Exclusion Chromatography,SEC)**:
- 也称为凝胶渗透层析,分离蛋白质混合物中的不同分子量蛋白质。
6. **疏水作用层析(Hydrophobic Interaction Chromatography,HIC)**:
- 利用蛋白质与固定相之间的疏水作用来分离蛋白质。
生化实验报告凝胶过滤

一、实验目的1. 理解凝胶过滤的原理和操作步骤。
2. 掌握凝胶过滤在蛋白质分离纯化中的应用。
3. 通过实验验证凝胶过滤的分离效果。
二、实验原理凝胶过滤,又称分子筛层析,是一种基于分子大小差异的分离技术。
层析柱内填充带有小孔的凝胶颗粒,凝胶颗粒的孔径大小不同。
当含有不同大小蛋白质的混合溶液通过层析柱时,小分子蛋白质能够进入凝胶颗粒的孔隙中,从而在层析柱中停留时间较长;而大分子蛋白质则无法进入孔隙,在层析柱中的停留时间较短。
因此,不同大小的蛋白质得以分离。
三、实验材料1. 蛋白质混合样品(如血红蛋白、肌红蛋白等)2. 凝胶过滤柱(如Sephadex G-75)3. 缓冲液(如磷酸盐缓冲液)4. 离心机5. 分光光度计6. 移液器7. 玻璃棒8. 实验记录表格四、实验步骤1. 柱的制备:将凝胶过滤柱垂直放置,用缓冲液充分洗涤,去除凝胶颗粒表面的杂质。
2. 样品的制备:取一定量的蛋白质混合样品,用缓冲液稀释至适当的浓度。
3. 样品的加载:将样品缓慢加入层析柱的顶部,使其自然流下。
4. 洗脱:用缓冲液以恒定流速(如1 mL/min)洗脱层析柱,收集洗脱液。
5. 检测:使用分光光度计检测洗脱液中的蛋白质含量,记录不同洗脱峰的位置和峰面积。
6. 收集:根据蛋白质含量变化,收集不同洗脱峰的蛋白质溶液。
五、实验结果与分析1. 洗脱曲线:根据洗脱曲线,可以观察到不同大小的蛋白质在层析柱中的洗脱顺序。
通常,小分子蛋白质先被洗脱,而大分子蛋白质后被洗脱。
2. 蛋白质分离效果:通过比较不同洗脱峰的峰面积,可以评估凝胶过滤的分离效果。
峰面积越大,说明蛋白质含量越高,分离效果越好。
六、实验讨论1. 凝胶过滤是一种高效、简便的蛋白质分离纯化方法,广泛应用于生物化学和分子生物学领域。
2. 凝胶过滤的分离效果受到凝胶类型、柱径、流速等因素的影响。
在实际应用中,需要根据具体实验目的和样品特性选择合适的凝胶类型和操作条件。
3. 凝胶过滤可以与其他分离技术(如SDS-PAGE、电泳等)联合使用,进一步提高蛋白质的分离纯化效果。
蛋白质分子量测定方法的比较

蛋白质分子量测定方法的比较梁永达(复旦大学药学院,上海)摘要:分子量是蛋白质主要的特征参数之一,近年来其测试方法发展十分迅速。
该文概述了目前蛋白质分子量测定中最常用的几种方法,包括粘度法、凝胶过滤层析法、凝胶渗透色谱法、SDS-凝胶电泳法、渗透压法、电喷雾离子化质谱技术、基质辅助激光解吸电离质谱技术、光散射法、超速离心沉降法,并比较了这几种方法的优缺点。
关键词:蛋白质分子量粘度法凝胶过滤层析法凝胶渗透色谱法SDS-凝胶电泳法渗透压法电喷雾离子化质谱技术基质辅助激光解吸电离质谱技术光散射法超速离心沉降法Comparison of the methods of molecular weightdetermination of proteinsLiangYongda(School of Pharmacy in Fudan University, Shanghai)Abstract: Molecular weight is one of the most important characteristic parameters of proteins,which leads the methods to determine protein molecular weight to develope rapidly in recent years. In this paper,the mechanism and application are briefly overviewed for the most widely used technologies including viscosity method, gel filtration chromatography, gel permeation chromatography, SDS-gel electrophoresis, osmotic pressure method, electrospray ionization mass spectrometry, matrix-assisted laser desorption ionization mass spectrometry, light scattering, ultracentrifugation sedimentation. Plus, we compare these methods’advantages and disadvantages.Key words:molecular weight determination of proteins, viscosity method, gel filtration chromatography, gel permeation chromatography, SDS-gel electrophoresis, osmotic pressure method, electrospray ionization mass spectrometry, matrix-assisted laser desorption ionization mass spectrometry, light scattering, ultracentrifugation sedimentation分子量是蛋白质的主要特征参数之一,当发现一种新的蛋白质时,首先应准确测定其分子量。
凝胶层析法测定蛋白质分子量

凝胶层析法测定蛋白质的分子质量【实验原理】凝胶层析法(即凝胶过滤法,gel filtration)是利用凝胶的分子筛作用把分子大小不同的物质分离开的一种方法,又称为分子筛层析法(molecular sieve chromatography),排阻层析法(exclusion chromatography)。
凝胶本身是一种分子筛,可以把分子按不同大小进行分离,好象过筛可以把大颗粒与小颗粒分开一样。
但这种“过筛”与普通的过筛不一样。
将凝胶颗粒在适宜的溶剂中浸泡,使充分吸液膨胀,然后装入层析柱中,加入欲分离的混合物,再以同一溶剂洗脱。
在洗脱过程中,大分子不能进入凝胶内部而沿凝胶颗粒间的空隙最先流出柱外,而小分子可以进入凝胶内部,流速缓慢,以致最后流出柱外,从而使样品中分子大小不同的物质得到分离。
凝胶是由胶体溶液凝结而成的固体物质,不论是天然凝胶还是人工合成凝胶,它们的内部都具有很微细的多孔网状结构。
凝胶层析法常用的天然凝胶是琼脂糖凝胶(agarose gel,商品名Sepharose);人工合成的凝胶是聚丙烯酰胺凝胶(商品名为Bio-gel-P)和葡聚糖(dextran)凝胶(商品名称为Sephadex)的各种交联凝胶,它们是具有不同孔隙度的立体网状结构的凝胶,不溶于水。
这种聚合物的立体网状结构,其孔隙大小与分离物质分子的大小有相应的数量级。
在凝胶充分溶胀后,交联度高的,孔隙小,只有相应的小分子可以通过,适于分离小分子物质。
相反,交联度低的孔隙大,适于分离大分子物质。
利用这种性质可分离不同M r的物质。
为了说明凝胶层析的原理,将凝胶装柱后,柱床体积称为“总体积”,以V t(total volume)表示。
实际上V t是由V O,V t与V g三部分组成,:V t=V O+V t+V gV o称为“孔隙体积”或“外体积”(outer volume)又称“外水体积”,即存在于柱床内凝胶颗粒外面空隙之间的水相体积,相当于一般层析法中柱内流动相的体积;V i为内体积(inner volume),又称“内水体积”,即凝胶颗粒内部所含水相的体积,相当于一般层析法中的固定相的体积,它可从干凝胶颗粒重量和吸水后的重量求得;V g为凝胶本身的体积,因此V t-V o.等于V i+V g。
测定蛋白质分子量的常用方法

测定蛋白质分子量的常用方法测定蛋白质分子质量常用的方法有三种:沉降分析法、凝胶过滤法和SDS-聚丙烯酰胺凝胶电泳法。
其基本原理如下:(1)沉降分析法:又叫超速离心法。
蛋白质溶液经高速离心分离时,在离心场的作用下蛋白质分子下沉,沉降速度与蛋白质颗粒大小成正比,应用光学方法观察离心过程中蛋白质颗粒的沉降行为,可判断出蛋白质的沉降速度。
根据沉降速度求出沉降系数(以s表示),即单位离心场的沉降速度。
将沉降系数代入公式,即可计算出蛋白质的相对分子质量。
M=RTs/D(1-Vρ)式中:R——气体常数(8.314×107);T——绝对温度;D——扩散系数;V——蛋白质分子的偏微比容(即无限大体积的溶液中加入1g蛋白质时溶液所增加的体积);ρ——溶剂密度[20℃时每毫升的质量(g)];s——沉降系数;M——蛋白质的相对分子质量。
(2)凝胶过滤法:又称分子筛层析法。
此法是在层析柱中装入葡聚糖(如Sephadex)凝胶,这种凝胶颗粒具有大量微孔,这些微孔只允许较小的分子进入,而大于胶粒微孔的分子则不能进入胶粒而被排阻。
当用洗脱液洗脱时,被排阻的分子量大的蛋白质先被洗脱下来,分子量小的后下来。
将已知分子量的标准蛋白质混合物上柱,洗脱,根据洗脱峰位置量出各种蛋白质的洗脱体积,然后用分子量的对数为横坐标,以洗脱体积为纵坐标,制作标准曲线。
测定时,根据紫外检测洗脱峰位置,量出待测样品的洗脱体积,由标准曲线可查出其分子质量。
(3)SDS聚丙烯酰胺凝胶电泳法:蛋白质在普通聚丙烯酰胺凝胶中的电泳速度取决于蛋白质分子大小、形状和所带的电荷。
而SDS(十二烷基硫酸钠)聚丙烯酰胺凝胶电泳与此不同。
SDS是一种阴离子去污剂,可使蛋白质变性并解离成亚基。
当蛋白质样品中加入SDS后,SDS与蛋白质分子结合,使蛋白质分子带上大量的负电荷,并且使蛋白质分子形状都变成长椭圆棒状,从而消除了蛋白质分子之间原有电荷和形状的差异。
这样电泳的速度只取决于蛋白质分子质量的大小。
不同分子量蛋白质的分离—凝胶过滤层析法

不同分子量蛋白质的分离—凝胶过滤层析法一、实验目的1. 了解凝胶柱层析的原理及应用。
2. 掌握凝胶柱层析的基本操作技术。
二、实验原理凝胶层析又称凝胶过滤,是一种按分子量大小分离物质的层析方法。
该方法是把样品加到充满着凝胶颗粒的层析柱中,然后用缓冲液洗脱。
大分子不能进入凝胶颗粒中的静止相中,只留在凝胶颗粒之间的流动相中,因此以较快的速度首先流出层析柱,而小分子则能自由出入凝胶颗粒中,并很快在流动相和静止相之间形成动态平衡,因此就要花费较长的时间流经柱床,从而使不同大小的分子得以分离。
凝胶过滤柱层析所用的基质是具有立体网状结构、筛孔直径一致,且呈珠状颗粒的物质。
这种物质可以完全或部分排阻某些大分子化合物于筛孔之外,而对某些小分子化合物则不能排阻,但可让其在筛孔中自由扩散、渗透。
任何一种被分离的化合物被凝胶筛孔排阻的程度可用分配系数Kav(被分离化合物在内水和外水体积中的比例关系)表示。
Kav值的大小与凝胶床的总体积(Vt)、外水体积(Vo)及分离物本身的洗脱体积(Ve)有关,即:Kav= (Ve-Vo)/(Vt-Vo)在限定的层析条件下,Vt和Vo都是恒定值,而Ve值却是随着分离物分子量的变化而变化的。
分离物分子量大,Kav值小;反之,则Kav 值增大。
通常选用蓝色葡聚糖2000作为测定外水体积的物质。
该物质分子量大(为200万),呈蓝色,它在各种型号的葡聚糖凝胶中都被完全排阻,并可借助其本身颜色,采用肉眼或分光光度仪检测(210nm或260nm或620nm)洗脱体积(即Vo)。
但是,在测定激酶等蛋白质的分子量时,宜用蓝色葡聚糖2000测定外水体积,因为它对激酶有吸附作用,所以有时用巨球蛋白代替。
测定内水体积(Vi)的物质,可选用硫酸铵、N-乙酰酪氨酸乙酯,或者其它与凝胶无吸附力的小分子物质。
本实验使用血红蛋白(分子量64,500左右)和二硝基氟苯-鱼精蛋白(DNP-鱼精蛋白分子量12,000左右)的混合物,通过Sephadex G-25层析后达到分离。
凝胶过滤层析纯化蛋白的步骤

凝胶过滤层析纯化蛋白的步骤凝胶过滤层析(Gel filtration chromatography)是一种常用的蛋白纯化方法,可以根据蛋白的分子大小以及形状,将不同分子量的蛋白分离和纯化。
下面将详细介绍凝胶过滤层析纯化蛋白的步骤,并探讨其中一些关键的因素。
1.实验准备:准备所需的层析柱、缓冲液、样品和标准品。
选择合适的层析柱是非常重要的,根据需要选择合适的分离范围和流速。
2.柱填充:将经过活化、平衡的凝胶填充到柱中。
凝胶通常是由多孔的聚合物材料制成,如琼脂糖或聚丙烯酰胺。
选择适当的凝胶类型和粒径主要根据目标蛋白的分子大小来决定。
常见的凝胶类型有Sephadex,Sephacryl和Superdex等。
3.前处理样品:前处理样品通常包括去除杂质和减少非特异性结合。
通过串联多个柱,可以实现前处理样品,如亲和柱或离子交换柱。
4.平衡柱子:使用适当的缓冲液洗涤和平衡填充的柱子,以提前去除杂质和干扰物。
5.样品加载:将待纯化的样品加载到填充好的层析柱中。
样品应根据需要进行浓缩和稀释,使其适合填充层析柱。
6.层析运行:选择恰当的流速和缓冲液来进行层析运行。
在层析过程中,缓冲液会逐渐在凝胶中通过,较大分子的蛋白会随着缓冲液流动而快速通过,而较小分子的蛋白则会受到凝胶孔径限制而在凝胶中滞留更长时间。
这样就实现了蛋白的分离和纯化。
7.收集洗脱分数:根据纯化目标的大小和形状,选择适当的分数收集。
较大分子的蛋白会在前期的分数中被洗脱,而较小分子的蛋白会在后期的分数中被洗脱。
8.分析和纯化评价:通过检测分析,如SDS-或Western blot等技术,评估样品纯度和目标蛋白的丰度。
如果需要更高的纯度,可进行进一步的步骤,如再层析或其他纯化方法。
在凝胶过滤层析纯化蛋白的过程中-选择适当的缓冲液:缓冲液的pH值和离子强度应根据目标蛋白的理化性质进行优化,以保持蛋白稳定性和纯化效果。
-选择合适的流速:流速的选择应根据柱子的尺寸和样品的需求进行调整。
凝胶过滤层析方法检测蛋白质分子量的原理

凝胶过滤层析方法检测蛋白质分子量的原理以《凝胶过滤层析方法检测蛋白质分子量的原理》为标题,写一篇3000字的中文文章凝胶过滤层析是一种常见的分子分析方法,用于测量物质分子量。
常用于检测蛋白质分子量。
凝胶过滤层析方法有助于化学和生物分子之间的相互作用以及研究分子大小的变化。
本文将阐述凝胶过滤层析检测蛋白质分子量的原理。
凝胶过滤层析是一种基于密度的分子分析方法。
该方法将样品加入非常浓缩的凝胶层,并在低压下过滤。
较小的分子可以通过凝胶而更大的分子则被滤波。
根据滤失的部分,可以推测出样品中分子的大小。
该方法最重要的特点是它可以检测出均一分子的情况,而其他分子的尺寸分析方法则无法实现此目的。
凝胶过滤层析可以用来测量蛋白质分子量。
在该实验中,研究者使用难溶性的聚苯乙烯凝胶,在某种pH和温度的环境中,将蛋白质进行溶解和混合,然后将它们加入凝胶层,并且在低压下进行过滤。
从最终收集的滤失液中检测到溶解物的体积,然后根据滤失液的量来推算出蛋白质分子量。
凝胶过滤层析可以制备多种蛋白质,包括低分子量的蛋白质和高分子量的蛋白质。
在此方法中,凝胶的分子比例(DC)可以用来确定受试蛋白质的种类,例如低DC的混合物可能包含低分子量的蛋白质。
此外,还可以利用凝胶过滤层析方法找出蛋白质的变性情况,从而识别蛋白质间的结构变化。
凝胶过滤层析方法有许多优点。
它可以检测出多种蛋白质,是一种高灵敏度的技术。
此外,它不依赖于某个特定的化学反应,可以快速,灵敏地检测各种蛋白质的分子量。
另外,凝胶过滤层析方法也可以用来检测各种其他复杂的分子,包括糖,多肽,抗体和小分子化合物,以及多种大分子组装体。
凝胶过滤层析是一种实用的研究和应用分子大小的方法,它可以用来快速检测出蛋白质和其他分子的分子量。
该方法为研究蛋白质的种类和变性提供了一种有效手段。
本文详细论述了凝胶过滤层析检测蛋白质分子量的原理,以及这种方法的优点和缺点。
凝胶过滤层析是一项日益重要的分析方法,可以帮助研究者更好地了解蛋白质的构造和作用,以及蛋白质分子量的变化。
凝胶过滤层析实验报告

一、实验目的1. 了解凝胶过滤层析的原理及操作步骤。
2. 掌握利用凝胶过滤层析法分离混合物中不同分子量蛋白质的方法。
3. 通过实验验证凝胶过滤层析法在蛋白质分离中的应用。
二、实验原理凝胶过滤层析法,又称分子筛层析法或凝胶过滤法,是一种根据分子大小进行分离的层析技术。
该技术利用凝胶的分子筛特性,将混合物中的不同分子量的物质分离。
凝胶是一种具有多孔结构的物质,孔径大小不一,当混合物通过凝胶层析柱时,大分子物质由于无法进入凝胶孔径,将直接通过层析柱;而小分子物质则可以进入凝胶孔径,从而在层析柱中停留较长时间,实现分离。
三、实验材料与仪器1. 实验材料:- 蛋白质混合物(含有已知分子量的标准蛋白质和未知分子量的蛋白质)- 凝胶层析柱(Sephadex G-75)- 洗脱液(磷酸盐缓冲液,pH 7.4)- 标准蛋白质(如牛血清白蛋白、卵清蛋白等)- 未知蛋白质样品2. 实验仪器:- 凝胶层析柱架- 凝胶层析柱- 量筒- 离心机- 分光光度计四、实验步骤1. 准备凝胶层析柱:将凝胶层析柱垂直放置于凝胶层析柱架上,用洗脱液平衡凝胶层析柱,直至洗脱液颜色清澈。
2. 加样:取一定量的蛋白质混合物,加入凝胶层析柱的顶部,用洗脱液冲洗,直至混合物完全进入层析柱。
3. 洗脱:用洗脱液缓慢冲洗层析柱,收集各部分洗脱液,分别测定其蛋白质含量。
4. 分离:根据洗脱液的蛋白质含量,绘制洗脱曲线,分析不同分子量蛋白质的分离情况。
5. 结果分析:根据标准蛋白质的分子量和洗脱曲线,推测未知蛋白质样品的分子量。
五、实验结果与分析1. 凝胶过滤层析柱平衡后,洗脱液颜色清澈,说明凝胶层析柱已准备就绪。
2. 洗脱过程中,标准蛋白质和未知蛋白质样品的洗脱曲线如下:- 标准蛋白质洗脱曲线:在洗脱曲线中,标准蛋白质的洗脱峰呈对称状,峰面积较大,说明分离效果较好。
- 未知蛋白质样品洗脱曲线:在洗脱曲线中,未知蛋白质样品的洗脱峰位置与标准蛋白质的洗脱峰位置不同,峰面积较小,说明分离效果较差。
蛋白质分子量测定

蛋白质分子量测定方法目前,蛋白质分子量测定的常用方法主要有四种:年度法、凝胶过滤层析法、凝胶电泳法和凝胶渗透色谱(GPC)法。
一、粘度法一定温度条件下,高聚物稀溶液的粘度与其分子量之间呈正相关性,随着分子量的增大,聚合物溶液的粘度增大。
通过测定高聚物稀溶液粘度随浓度的变化,即可计算出其平均分子量(粘均分子量)。
该方法操作简单、设备价格较低,通常不需要标准样品,但无法测定聚合物的分子量分布。
粘度法所需设备:恒温槽、乌倍路德粘度计。
二、凝胶过滤层析法在凝胶色谱柱中,分子量不同的聚合物分子,由于其渗入凝胶微孔的能力不同而在柱中得以分离。
分子量较大的分子,渗入凝胶微孔较浅,随洗脱液流动速度较快,因而先流出色谱柱;相反,分子量较小的聚合物分子后流出。
通过测定从进样到聚合物分子流出色谱柱期间流过凝胶柱的洗脱液的体积,并与标准样品比较,即可计算聚合物的分子量,并估算其分子量分布。
凝胶层析技术操作方便,设备简单,样品用量少,而且有时不需要纯物质,用一粗制品即可,目前已得到相当广泛的应用。
凝胶层析法测定分子量也有一定的局限性,在pH6—8的范围内,线性关系比较好,但在极端pH时,一般蛋白质有可能因变性而偏离。
糖蛋白在含糖量超过5%时,测得分子量比真实的要大,铁蛋白则与此相反,测得的分子量比真实的要小。
凝胶过滤层析法所需设备:层析柱、紫外分光光度计。
三、SDS-凝胶电泳法SDS是十二烷基硫酸钠的简称,它是一种阴离子表面活性剂,加入到电泳系统中能使蛋白质的氢键和疏水键打开,并结合到蛋白质分子上(在一定条件下,大多数蛋白质与SDS的结合比为1.4gSDS/1g蛋白质),使各种蛋白质-SDS复合物都带上相同密度的负电荷,其数量远远超过了蛋白质分子原有的电荷量,从而使其电泳迁移率只取决于分子大小这一因素,于是根据标准蛋白质分子量的对数和迁移率所作的标准曲线,可求得未知物的分子量。
SDS-凝胶电泳法是目前蛋白质分子量测定中使用最广泛的方法,实验成本较低,仪器设备也相对很简单,一套电泳装置即可。
凝胶过滤法分离蛋白质实验报告

凝胶过滤法分离蛋白质一、实验目的了解凝胶层析的基本原理,并学会用凝胶层析分离纯化蛋白质。
二、实验原理凝胶过滤其基本原理是利用被分离的分子大小不同及固定相(凝胶)具有分子筛的特点:本实验使用交联葡聚凝胶,其具有一定孔径的网络结构。
高亲水,在水溶液里吸水可膨胀。
当其填充完成后,加入混合分子大小不同的分离液。
由于大分子物质只能沿着胶粒之间的间隙向下流动,所经路短,最先流出;而涌入胶粒内部的小分子物质,受迷宫效应的影响,要经过层层扩散向下流动,所经路程长,最后流出,通透性居中的分子则后于大分子而先于小分子流出。
从而按大到小的顺序流出实现分离的目的。
三、试剂与仪器0.1mol/L磷酸缓冲液(PH7.0),0.4%K3Fe(CN)6,交联葡聚凝胶,鸡的抗凝全血1.5*20cm的层析柱,试管,量筒,大烧杯,玻璃棒四、实验步骤1.凝胶溶胀2.装柱:从层析柱加入缓冲液,打开出口,将气泡赶走,关闭下端开口,然后加入约6cm的缓冲液,灌注凝胶,打开下端开口。
使其自然沉降高度约17cm,并使其床面覆盖缓冲液,关闭出口盖上小形圆形滤纸。
待凝胶形成后,再用缓冲液洗脱2~3次。
3.样品处理4.上样和过滤:吸取约0.5ml混合液,在距离床面1mm处沿管内壁轻轻加入样品。
打开出口,让样品溶液慢慢浸入凝胶内。
凝胶柱面加上一层磷酸盐缓冲液,并用1~2倍体积的此缓冲洗脱。
5.部分收集:控制速度为0.5ml/min左右,用试管收集洗脱液。
并观察柱上的色带,待黄色的0.4%完全脱下来后,再继续收集两管透明洗脱液作对照,关闭出口。
6.凝胶回收:收集样品后,凝胶柱用3~5倍体积洗脱液继续洗脱,从回收凝胶留给下一组。
五、实验现象结果及其讨论颜色:开始时为无色透明,但时间过去,试管中收集的红褐色开始变深,到最后,试管的颜色为深褐色,接着溶液的颜色开始变浅,红褐色几乎要消失。
接着又开始出现浅黄色,再到黄色,再黄色开始慢慢变浅,最后又变成无色透明。
原因:1.开始时,由于先加进缓冲液,而加入的全血扩散没有那么快,所以白色透明液体为缓冲液。
实验十七 蛋白质分子量测定——凝胶过滤层析法

实验十七蛋白质分子量测定——凝胶过滤层析法一、目的:(1)初步掌握利用凝胶层析法测定蛋白质分子量的原理。
(2)学习用标准蛋白质混合液制作V e,K av对1gM r的“选择曲线”以及测定未知蛋白质样品分子量的方法。
二、原理:凝胶层析法(即凝胶过滤法,gel filtration)是利用凝胶把分子大小不同的物质分离开的一种方法,又叫做分子筛层析法(molecular sieve chromatography),排阻层析法(exclusion chromatography)。
凝胶本身是一种分子筛,它可以把分子按大小不同进行分离,好象过筛可以把大颗粒与小颗粒分开一样。
但这种“过筛”与普通的过筛不一样。
将凝胶颗粒在适宜溶剂中浸泡,使充分吸液膨胀,然后装入层析柱中,加入欲分离的混合物后,再以同一溶剂洗脱,在洗脱过程中,大分子不能进入凝胶内部而沿凝胶颗粒间的空隙最先流出柱外,而小分子可以进入凝胶内部,流速缓慢,以致最后流出柱外,从而使样品中分子大小不同的物质得到分离。
分离过程中的示意见图17-1。
凝胶是由胶体溶液凝结而成的固体物质,不论是天然凝胶还是人工合成凝胶,它们的内部都具有很微细的多孔网状结构。
凝胶层析法常用的天然凝胶是琼脂糖凝胶(agarose gel,商品名Sepharose),人工合成凝胶是聚丙烯酰胺凝胶(商品名为Bio-gel-P)和葡聚糖(dextran)凝胶,后者的商品名称为Sephadex型的各种交联葡聚糖凝胶,它是个有不同孔隙度的立体网状结构的凝胶,不溶于水,其化学结构式如图17-2所示。
这种聚合物的立体网状结构,其孔隙大小与被分离物质分子的大小有相应的数量级。
在凝胶充分溶胀后,交联度高的,孔隙小,只有相应的小分子可以通过,适于分离小分子物质。
相反,交联度低的孔隙大,适于分离大分子物质。
利用这种性质可分离不同分子量的物质。
为了说明凝胶层析的原理,将凝胶装柱后,柱床体积称为“总体积”,以V t(total volume)表示。
凝胶过滤层析实验报告

凝胶过滤层析实验报告凝胶过滤层析实验报告一、引言凝胶过滤层析是一种常用的生物分离和纯化技术,广泛应用于生物医学研究、生物制药等领域。
本实验旨在通过对凝胶过滤层析的研究,探讨其原理、方法和应用。
二、凝胶过滤层析原理凝胶过滤层析是利用凝胶材料的孔隙结构,通过分子的大小和形状选择性地分离混合物中的组分。
凝胶材料通常是多孔的,具有不同大小的孔隙,通过调整凝胶材料的孔隙大小,可以选择性地分离分子。
三、实验步骤1. 准备凝胶柱:将凝胶材料装入柱中,并将柱与收集容器连接。
2. 样品处理:将待分离的混合物样品处理,去除杂质和大分子。
3. 样品加载:将处理后的样品加载到凝胶柱上。
4. 洗脱:用缓冲液洗脱凝胶柱上的目标分子。
5. 收集:将洗脱液收集于容器中,得到纯化后的目标分子。
四、实验结果与讨论本实验使用了凝胶过滤层析技术对蛋白质混合物进行分离和纯化。
实验结果显示,凝胶过滤层析能够有效地分离目标蛋白质,并具有较高的纯度。
在实验过程中,我们发现凝胶材料的孔隙大小对分离效果有重要影响。
较大的孔隙可以让较大分子通过,而较小的孔隙则只允许较小分子通过。
因此,在选择凝胶材料时,需要根据目标分子的大小来选择合适的凝胶。
此外,凝胶过滤层析还可以用于去除杂质和浓缩目标分子。
在洗脱过程中,通过调整洗脱缓冲液的成分和pH值,可以更好地控制目标分子的洗脱效果。
凝胶过滤层析技术的应用非常广泛。
在生物医学研究中,它常用于蛋白质纯化和分析,可以帮助研究人员获取纯度较高的蛋白质样品,从而进行后续的功能研究。
在生物制药领域,凝胶过滤层析可以用于制备药物和疫苗,提高产品纯度和质量。
然而,凝胶过滤层析也存在一些局限性。
例如,对于较大的分子,凝胶材料的孔隙可能不够大,导致无法通过。
此外,凝胶过滤层析的操作相对较慢,需要较长的时间来完成分离和纯化过程。
综上所述,凝胶过滤层析是一种有效的生物分离和纯化技术,具有广泛的应用前景。
通过对凝胶过滤层析的实验研究,我们深入了解了其原理、方法和应用,并对其优缺点有了更清晰的认识。
“凝胶过滤层析法分离纯化蛋白质”生化实验报告
凝胶过滤层析法分离纯化蛋白质操作人:XXX 时间:XXXX 地点:XXXX 温度:20℃实验目的:①理解凝胶过滤层析的原理。
②掌握装柱、平衡、上样、柱效检验的方法。
③学会分析洗脱峰峰型。
试验方法与过程:1.装柱①固定层析柱,柱内装1/2双蒸水,双蒸水下降到1/4时,关闭出口。
②搅拌凝胶浆液,用玻璃棒引流缓慢倒入层析柱,打开出口,让凝胶沉降。
③装至柱内有2/3凝胶,上层保留至少0.5cm的水。
2.平衡双蒸水平衡柱,管口上接恒流泵、下管接检测仪入口,控制流速。
观察紫外检测仪平衡后A280应小于0.01.然后调整流速为2ml/min,暂停恒流泵。
3.加样吸取5%丙酮溶液500ul,沿柱壁缓慢加入,控制出水口管的高度使使样品缓缓进入胶内,用1ml双蒸水冲洗壁上的样品,在加入3-4ml双蒸水后关闭盖子。
4.洗脱凝集打开恒流泵开关,监视紫外检测仪的情况,待丙酮全部流出后加入,加入蛋白质混合物,监视紫外检测仪情况,开始出现上升即开始收集流出液。
蛋白质样品全部流出后,用双蒸水冲洗凝胶。
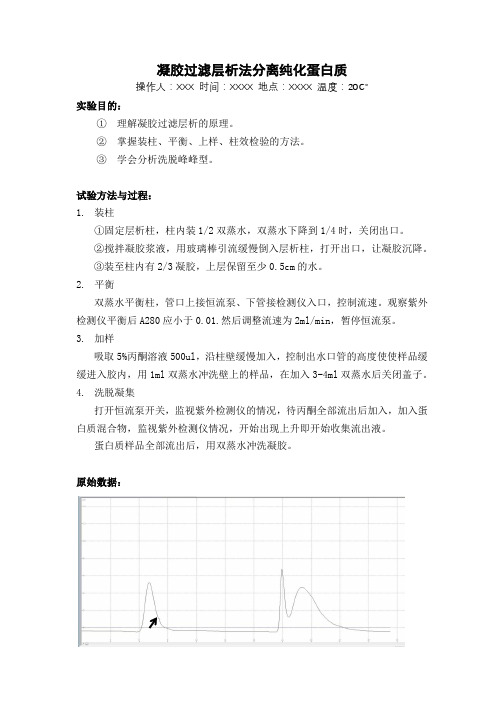
原始数据:图一:从左到右第一个峰为丙酮,第二第三个峰分别为混合物中的两种蛋白质。
结果处理与分析:①根据图像得As略大于1,说明装柱压力不足,可能滤网内有空气进入。
②由于是先加入丙酮再打开色谱分析软件,所以不能分析到分配系数Kd。
③在图一黑色箭头所指处色谱曲线出现了抖动,可能是因为在丙酮洗脱过程中打开了层析柱上口,导致空气进入。
④加入样品后出现两个峰,说明混合样品中有两种大小不同的物质被分离出来。
讨论:1.注意事项:一定要保证凝胶柱上层有液体覆盖,不能使之暴露于空气中;保证所灌凝胶中没有气泡,当有气泡和凝胶有明显分层时3,应在灌胶过程中及时用玻璃棒搅拌去除气泡及使不均匀的凝胶重悬后重新沉淀。
2.经验和心得:用滴管向凝胶柱内加入双蒸水和样品时,一定要沿管壁边旋转边缓慢加入,防止加入时产生压力太大,使凝胶柱上表面不平整;用滴管比用移液枪加样品好,因为滴管产生的压力小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质分子量测定:凝胶过滤层析法一、目的:(1)初步掌握利用凝胶层析法测定蛋白质分子量的原理。
(2)学习用标准蛋白质混合液制作Ve,Kav对1gMr的“选择曲线”以及测定未知蛋白质样品分子量的方法。
二、原理:凝胶层析法(即凝胶过滤法,gel filtration)是利用凝胶把分子大小不同的物质分离开的一种方法,又叫做分子筛层析法(molecular sieve chromatography),排阻层析法(exclusion chromatography)。
凝胶本身是一种分子筛,它可以把分子按大小不同进行分离,好象过筛可以把大颗粒与小颗粒分开一样。
但这种“过筛”与普通的过筛不一样。
将凝胶颗粒在适宜溶剂中浸泡,使充分吸液膨胀,然后装入层析柱中,加入欲分离的混合物后,再以同一溶剂洗脱,在洗脱过程中,大分子不能进入凝胶内部而沿凝胶颗粒间的空隙最先流出柱外,而小分子可以进入凝胶内部,流速缓慢,以致最后流出柱外,从而使样品中分子大小不同的物质得到分离。
分离过程中的示意见图17-1。
凝胶是由胶体溶液凝结而成的固体物质,不论是天然凝胶还是人工合成凝胶,它们的内部都具有很微细的多孔网状结构。
凝胶层析法常用的天然凝胶是琼脂糖凝胶(agarose gel,商品名Sepharose),人工合成凝胶是聚丙烯酰胺凝胶(商品名为Bio-gel-P)和葡聚糖(dextran)凝胶,后者的商品名称为Sephadex型的各种交联葡聚糖凝胶,它是个有不同孔隙度的立体网状结构的凝胶,不溶于水,其化学结构式如图17-2所示。
这种聚合物的立体网状结构,其孔隙大小与被分离物质分子的大小有相应的数量级。
在凝胶充分溶胀后,交联度高的,孔隙小,只有相应的小分子可以通过,适于分离小分子物质。
相反,交联度低的孔隙大,适于分离大分子物质。
利用这种性质可分离不同分子量的物质。
为了说明凝胶层析的原理,将凝胶装柱后,柱床体积称为“总体积”,以Vt(total volume)表示。
实际上Vt是由Vo,Vi与Vg三部分组成,即:Vt=Vo+Vi+VgVo称为“孔隙体积”或“外体积”(outer volume)又称“外水体积”,即存在于柱床内凝胶颗粒外面空隙之间的水相体积,相应于一般层析法中柱内流动相的体积;Vi为内体积(inner volume),又称“内水体积”,即凝胶颗粒内部所含水相的体积,相应于一般层析法中的固定相的体积,它可从干凝胶颗粒重量和吸水后的重量求得;Vg为凝胶本身的体积,因此Vt—Vo等于Vi+Vg 。
它们之间的关系可用图17-3表示。
洗脱体积(Ve,elution Volume)与Vo及Vi之间的关系可用下式表示:Ve=Vo+KdVi式中Ve为洗脱体积,自加入样品时算起,到组分最大浓度(峰)出现时所流出的体积;Kd为样品组分在二相间的分配系数,也可以说Kd是分子量不同的溶质在凝胶内部和外部的分配系数。
它只与被分离物质分子的大小和凝胶颗粒孔隙的大小分布有关,而与柱的长短粗细无关,也就是说它对每一物质为常数,与柱的物理条件无关。
Kd可通过实验求得,上式可改写成:上式中Ve为实际测得的洗脱体积;Vo可用不被凝胶滞留的大分子物质的溶液(最好有颜色以便于观察,如血红蛋白,印度黑墨水,分子量约200万的蓝色葡聚糖-2000等)通过实际测量求出;Vi可由g·WR求得(g为干凝胶重,单位为克;WR为凝胶的“吸水量”,以毫升/克表示)。
因此,对一层析柱凝胶床来说,只要通过实验得知某一物质的洗脱体积Ve,就可算出它的Kd值。
以上关系可用图17-4表示。
Kd可以有下列几种情况:有颜色以便于观察,如血红蛋白,印度黑墨水,分子量约200万的蓝色葡聚糖-2000等)通过实际测量求出;Vi可由g·WR求得(g为干凝胶重,单位为克;WR为凝胶的“吸水量”,以毫升/克表示)。
因此,对一层析柱凝胶床来说,只要通过实验得知某一物质的洗脱体积Ve,就可算出它的Kd值。
以上关系可用图17-4表示。
Kd可以有下列几种情况:1、当Kd=0时,则Ve=Vo。
即对于根本不能进入凝胶内部的大分子物质(全排阻),洗脱体积等于空隙体积(图中组分Ⅰ)。
2、当Kd=1时,Ve=Vo+Vi。
即小分子可完全渗入凝胶内部时,洗脱体积应为空隙体积与内体积之和(图中组分Ⅲ)。
可以看出,对某一凝胶介质,两种全排出的分子即Kd都等于零,虽然分子大小有差别,但不能有分离效果。
同样两种分子如都能进入内部空隙,即Kd都等于1,它们既使分子大小有不同,也没有分离效果。
因此不同型号的凝胶介质,有它一定的使用范围。
3、当0<Kd<1时,Ve=Vo+KdVi。
表示内体积只有一部分可被组分利用,扩散渗入,Ve即在Vo+Vi之间变化(图中组分Ⅱ)。
4、有时Kd>1,表示凝胶对组分有吸附作用,此时Ve>Vo+Vi。
例如一些芳香族化合物的洗脱体积远超出理论计算的最大值,这些化合物的Kd>1。
如苯丙氨酸,酪氨酸和色氨酸在Sephadex G-25中的Kd值分别为1.2,1.4和2.2。
在实际工作中,对小分子物质也得不到Kd=1的数值,特别是交联度大的凝胶差别更大,如用G-10型得Kd值0.75左右,用G-25型得0.8左右。
这是由于一部分水相与凝胶结合较牢固,成为凝胶本身的一部分,因而不起作用,小分子不能扩散入内所致。
此时Vi即不能以g·WR 计算,为此也常有直接用小分子物质D2O,NaCl等通过凝胶柱而由实验计算出Vi值的。
另一个解决的办法是不使用Vi与Kd,而用Kav(有效分配系数)代替Kd,其定义如下:已知在这里实际上将原来以水作为固定相(Vi)改为水与凝胶颗粒(Vi—Vo)作为固定相,而洗脱剂(Ve—Vo)作为流动相。
Kav与Kd对交联度小的凝胶差别较小,而对交联度大的凝胶差别大。
在一般情况下,凝胶对组分没有吸附作用时,当流动相流过Vt体积后,所有的组分都应该被洗出来,这一点为凝胶层析法的特点,与一般层析方法不同。
Ve与分子量的关系:对同一类型的化合物,洗脱特性与组分的分子量有关,流过凝胶柱时,按分子量大小顺序流出,分子量大的走在前面。
Ve与分子量的关系可用下式表示:V e=K1—K2logMrK1与K2为常数,Mr为分子量,Ve也可用Ve—Vo(分离体积),Ve/Vo(相对保留体积),Ve/Vt(简化的洗脱体积,它受柱的填充情况的影响较小)或Kav代替,与分子量的关系同上式,只是常数不同。
通常多以Kav对分子量的对数作图得一曲线,称为“选择曲线”,如图17-5所示。
曲线的斜率是说明凝胶性质的一个很重要的特征。
在允许的工作范围内,曲线愈陡,则分级愈好,而工作范围愈窄。
凝胶层析主要决定于溶质分子的大小,每一类型的化合物如球蛋白类,右旋糖酐类等都有它自己的特殊的选择曲线,可用以测定未知物的分子量,测定时以使用曲线的直线部分为宜。
用凝胶层析法测定蛋白质的分子量,方法简单,技术易掌握,样品用量少,而且有时不需要纯物质,用一粗制品即可。
例如在一粗酶制剂中,为了测定某一酶组分的分子量,只要测定洗脱液中具有该酶最大活性的部分,然后确定其洗脱体积,即可从标准曲线中查出其分子量。
凝胶层析法测定分子量也有一定的局限性,在pH6—8的范围内,线性关系比较好,但在极端pH时,一般蛋白质有可能因变性而偏离。
糖蛋白在含糖量超过5%时,测得分子量比真实的要大,铁蛋白则与此相反,测得的分子量比真实的要小。
有一些酶底物是糖,如淀粉酶,溶菌酶等会与葡聚糖凝胶形成络合物,这种络合物与酶-底物络合物相似,因此在葡聚糖凝胶上层析时表现异常。
用凝胶层析法所测分子量的结果,要和其它方法的测定相对照,由此才可作出较可靠的结论。
凝胶层析技术操作方便,设备简单,周期短,重复性能好,而且条件温和,一般不引起生物活性物质的变化,目前已得到相当广泛的应用,例如可用于脱盐,浓缩高分子物质的溶液,生化物质的分离提纯,去除热源物质以及用于测定高分子物质的分子量。
下面实验是用葡聚糖凝胶层析法测定蛋白质的分子量。
三、试剂及器材:1、试剂:(1)标准蛋白质混合液(各2—3mg·ml-1,用氯化钾-乙酸溶液配制),牛血清清蛋白(Mr67000),鸡卵清蛋白(Mr43000),胰凝乳蛋白酶原A(Mr25000)和结晶牛胰岛素(PH2时为二聚体Mr12000)等均需层析纯。
(2)蓝色葡聚糖-2000(8—10mg·ml-1),N-乙酰酪氨酸乙酯(或硫酸铵或重铬酸钾)(8—10mg·ml-1)。
(3)0.025mo·L-1氯化钾-0.2mol·L-1乙酸溶液,Sephadex G—75(或G—100),5%Ba (Ac)2。
(4)待测蛋白质样品液。
2.器材:层析柱:柱管(直径1.0~1.3cm;管长90~100cm),核酸蛋白检测仪或紫外分光光度计,自动部分收集器,恒压瓶,下口瓶。
四、操作步骤:1、一般操作方法:(1)凝胶的选择和处理凝胶颗粒最好大小比较均匀,这样,流速稳定,结果较好。
如果颗粒大小不匀,用倾泻法倾去不易沉下的较细颗粒。
将称好的干粉倾入过量的洗脱液(一般多用水,盐溶液或缓冲溶液)中,室温下放置,使之充分溶胀。
注意不要过分搅抖,以防颗粒破碎。
溶胀时间因凝胶交联度不同而异为了缩短溶胀时间,可在沸水浴上加热将近100℃,这样可大大缩短溶胀时间至几小时,而且还可以杀死细菌和霉菌,并可排除凝胶内气泡。
种类凝胶溶胀时间请查阅葡聚糖凝胶的技术数据表。
(2)装柱装柱前,必须用真空干燥器抽尽凝胶中空气。
装柱方法与一般柱层析法相似。
层析柱可以自制或外购,目前已有各种规格层析柱商品(图17-6)。
装柱前须将凝胶上面过多的溶液倾出。
关闭层析柱出水口,并向柱管内加入约1/3柱容积的洗脱液,然后在搅拌下,将浓浆状的凝胶连续地倾入柱中,使之自然沉降,待凝胶沉降约2—3cm 后,打开柱的出口,调节合适的流速,使凝胶继续沉集,待沉集的胶面上升到离柱的顶端约5cm 处时停止装柱,关闭出水口。
接着再通过2—3倍柱床容积的洗脱液使柱床稳定,然后在凝胶表面上放一片滤纸或尼龙滤布,以防将来在加样时凝胶被冲起,并始终保持凝胶上端有一段液体。
新装好的柱要检验其均一性,可用带色的高分子物质如蓝色葡聚糖-2000(又称蓝色右旋糖,商品名为Blue dextran-2000)、红色葡聚糖或细胞色素C等配成2mg/ml的溶液过柱,看色带是否均匀下降,或将柱管向光照方向用眼睛观察,看是否均匀,有无“纹路”或气泡。
若层析柱床不均一,必须重新装柱。
(3)加样要照顾到浓度与粘度两个方面。
分析用量:1—2ml/100ml柱床容积(1—2%);制备用量:20—30ml/100ml柱床容积。
加样方法与一般柱层析相同。
夹紧上、下进、出水口夹子,为防止操作压改变,可将塑料管下口抬高至离柱上端约50cm处(Sephadex G-75,选用50cm液柱操作压),打开柱上端的塞子或螺丝帽,吸出层析柱中多余液体直至与胶面相切。
