第二节_环烷烃
第二章 环烷烃

一 环烷烃的分类、同分异构和命名
(一)分类 根据环碳原子的数目分类:
小环C3~C4 常见环C5~C6 中等环C7~C12 大环>C12
根据环的多少和骨架分类
环 烷烃 单环 环 烯烃 脂环 烃 桥环 多环 螺环
CnH2n CnH2n -2
(二)命名
1. 单环烷烃的命名 当环外侧链比较简单时,把环作为母体来 命名 环丙烷 甲基环己烷
H H
a-型构象
C
CH3 CH3
97%
3%
异丙基环己烷
C(CH3)3 HH CH3
e-型构象 a-型几乎没有
C
CH3 CH3
叔丁基体积很大,被称为环己烷的构象 确定基团,一旦出现叔丁基 ,必须将叔 丁基放置到e键。
十氢萘的构象
顺式十氢萘 ea稠合,顺式稠合,不稳定
反式十氢萘 ee稠合,反式稠合,稳定
红色 (直立键,竖键)
3. 环的翻转作用—构象翻转,ae互换
H 5 4 H H 3 H6 2 H H 1
4 5 3 2 6
1
(二)环己烷取代衍生物的构象
取代基处于 a 键位置时会和周围 a 键的 H 距 离过近产生斥力。故一取代环己烷的优势 构象是取代基在e编号从一个桥头碳开始,从最长的桥编到第二个桥 头碳(即先大环再小环),再沿次长桥回到第一个 桥头碳,再依次编号。将除桥头碳的桥内原子从 多到少写在方括号内,用圆点间隔,写在母体前
编号时兼顾取代基最小
1-甲基-2-乙基-7-氯代 二(双)环[4.2.1]壬烷
十氢萘 双环[4.4.0]癸烷
从十氢萘的例子可以看出,短桥碳原子数 是可以为0的。
1-甲基-3-乙基环戊烷
取代基较复杂环烷烃,命名时可将环作为取 代基。
第二章烷烃和环烷烃

第二章第一节
2-甲基丁烷
烷烃
一、烷烃的结构、分类和命名
当超过1个取代基时,若取代基相同则合并,不同则 先简单后复杂。
2,2,4-三甲基戊烷
第二章第一节
3-甲基-4-乙基己烷
烷烃
二、烷烃的物理性质
物理性质通常包括物质的存在状态、颜色、气味、相 对密度、熔点、沸点和溶解度等。
烷烃一般常温为无色、无味、难溶于水、密度比空气 轻的气体、或低熔沸点的液体和固体。
后无其他分支称“异”某烷;主链第2个碳原子上有2个 甲基,后无其他分支称“新”某烷
第二章第一节
烷烃
一、烷烃的结构、分类和命名
H3C CH2 CH2 CH2 CH3
正戊烷
H3C CH2 CH CH3
CH3
异戊烷
CH3 CH3 C CH3
CH3 第二章第一节
新戊烷
烷烃
一、烷烃的结构、分类和命名
常见基团名称: -CH3 甲基 -CH2-CH3 乙基 -CH2-CH2-CH3 正丙基
熔沸点一般随分子中碳原子的增加而逐渐升高:烷烃 为弱极性物质,难溶于强极性溶剂水,而易溶于弱极性或 无极性的有机溶剂,这个规律称“相似相溶”。
第二章第一节
烷烃
三、烷烃的化学性质 烷烃分子中原子间均以稳定的共价单键连接,
且为非极性或弱极性共价键,因而十分稳定,但在 特定条件下也能发生化学反应。
(1)取代反应 –烷烃分子中氢原子被替换的反应 反应对象:卤素单质(氯气、溴) 反应条件:光照或高温(一般400度以上) 反应机理:自由基反应
第二章第一节
烷烃
一、烷烃的结构、分类和命名
3.分类 根据烷烃碳链上有无分支,可将烷烃分为直 链烷烃和支链烷烃。也可以根据碳原子数的多少分为低 级烷烃和高级烷烃。
02-环烷烃的命名课件
5-甲基螺[2.4]庚烷
(B) 双桥环化合物的命名
(a) 都有两个“桥头”碳原子(即两个环共用的碳
原子)和三条连在两个“桥头”上的“桥”.
(b) 组成环的碳原子总数命名为某烷,加词头双环.
(c) 各“桥”所含碳原子数目,按由大到小的次序
写在“双环”和“某烷”之间的方括号里.
例1:
桥头碳
双环[2.2.1]庚烷
环戊烯
环辛炔
A) 若只有一个不饱和碳上有侧链,该不饱和碳编号为1;
(B) 若两个不饱和碳都有侧链或都没有侧链,则碳原子编 号顺序除双键所在位置号码最小外,还要同时以侧链位 置号码的加和数为最小.
CH3
1
6
2
H3C 3 2 1
5
3
4
4
6
5
1-甲基-1-环己烯
3-甲基-1-环己烯
带有侧链的环烯烃命名:
CH3
6 CH3
5
1
4
2
3
1,6-二甲基-1-环己烯
CH3
5
4
1
3
2
5-甲基-1,3-环戊二烯
(3) 双环化合物--分子中含有两个碳环.
• 其中两个碳环共用一个碳原子的叫螺化合物. • 共用两个或以上碳原子的叫桥环化合物.
螺原子
螺[2.4]庚烷
桥桥头头碳碳
双环[2.2.1]庚烷
螺原子桥头碳桥头碳再把连接于螺原子的两个环的碳原子数不含螺原子按由小到大的次序写在螺和某烷之间的方括号里数字用圆点分开
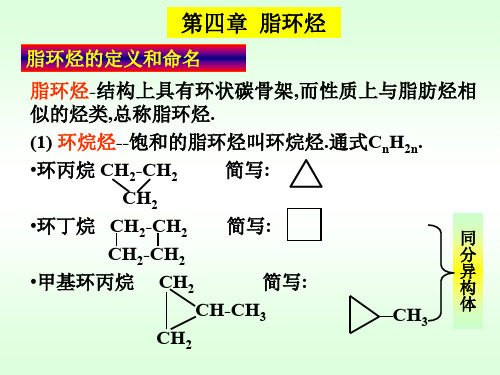
第四章 脂环烃
脂环烃的定义和命名
脂环烃-结构上具有环状碳骨架,而性质上与脂肪烃相 似的烃类,总称脂环烃.
(1) 环烷烃--饱和的脂环烃叫环烷烃.通式CnH2n.
第二章烷烃和环烷烃
(1)乙烷的构象
H3C CH 3
当C-C键旋转时, 可产生无数个构象
有两种典型conformation:
乙烷的两种典型构象的表示方法
优势构象
交叉式 staggered
H
重叠式 eclipsed
作业:P130 /1, 6, 7 ,8; P105 / 8(3) (4) *C2-C3键旋转 阅读Section 1. Alkanes and Cycloalkanes 全文
翻译 1.1第一段,1.2.2第一段,1.2.3 第四段
CH3 CH3 CH C Br
CH3 CH3
四、环烷烃的异构现象
1. 顺反异构 cis-trans isomer (P84) 环烷烃环中C-C单键受环约束不能自由旋转,导致产生顺反异构
HH
H
CH 3
CH 3 CH 3
顺-1,2-二甲基环丙烷
CH 3 H
反-1,2-二甲基环丙烷
练习:写答出案: 1-甲基-3-乙H基环己烷的顺反异构体CH 3
伯碳(1°):一级碳原子,只与1个其他碳原子直接相连
仲碳(2°):二级碳原子,只与2个其他碳原子直接相连
叔碳(3°):三级碳原子,只与3个其他碳原子直接相连
季碳(4°):四级碳原子,只与4个其他碳原子直接相连
CH3
CH3
H3C
C CH2
3° 2°
H
伯氢(1°H):伯碳上的H
仲氢(2°H):仲碳上的H
练习:预测2-甲基丁烷在室温下进行氯代反应所得的一氯代物
Cl
答 案 : C3 C H H C2C H H 3 +C 2l 光 C3 C H C2 C H H 3
第二章 第二节环烷烃
纽曼投影式
透视式
环己烷的椅型构象
(2) 船型构象
• 所有键角也接近 所有键角也接近109.5°,故也没有角 ° 故也没有角 张力.但相邻 但相邻C-H键却并非全是交叉 张力 但相邻 键却并非全是交叉 以及C-5和 的.C-2和C-3上的 C-H 键,以及 和 上的 以及 和 C-6上的 C-H键都是重叠式的 键都是重叠式的. 上的 键都是重叠式的 • C-1和 C-4上两个向内伸的 由于距 上两个向内伸的H由于距 和 上两个向内伸的 离较近而相互排斥,也使分子的能量 离较近而相互排斥 也使分子的能量 有所升高. 有所升高
取代基在e键上的构象较稳定 取代基在 键上的构象较稳定. 键上的构象较稳定 • 若有多个取代基 往往是 e 键取代基最多的构象最稳 若有多个取代基,往往是 取代基最多的构象最稳 定. • 若环上有不同取代基 则体积大的取代基连在 e键上 若环上有不同取代基,则体积大的取代基连在 键 的构象最稳定. 的构象最稳定 二甲基环己烷, 例1: 1,2-二甲基环己烷,顺式如下: 二甲基环己烷 顺式如下: •同一平面上的比较 同一平面上的比较. 同一平面上的比较 •在同侧为顺, a,e 在同侧为顺 在同侧为 •在异侧为反.a,a;e,e. 在异侧为反 在异侧为 •反式 反式(e,e)比顺式的稳定 (a,a)实际上不存在(能量太高) 比顺式的稳定. 反式 比顺式的稳定 )实际上不存在(能量太高)
5 2 3 4
1,2-二甲基环戊烷 二甲基环戊烷
• 例2:
例3:
1-甲基 乙基环己烷 甲基-3-乙基环己烷 甲基
1,1,4-三甲基环己烷 三甲基环己烷
**小取代基为 位. 小取代基为1位 小取代基为
环烷的顺反异构: 环烷的顺反异构 由于碳原子连接成环,环上 单键不能自由旋转. 由于碳原子连接成环 环上C-C单键不能自由旋转 环上 单键不能自由旋转 只要环上有两个碳原子各连有不同的原子或基团, 只要环上有两个碳原子各连有不同的原子或基团 就有构型不同的顺反异构体. 就有构型不同的顺反异构体 例: 1,4-二甲基环己烷 二甲基环己烷
有机化学课件第-二-章烷烃和环烷烃_图文

烷烃熔点的特点 (1) 随相对分子质量增大
而增大。 (2) 偶数碳烷烃比奇数碳
烷烃的熔点升高值 大 (如右图)。 (3)相对分子质量相同的烷 烃,叉链增多,熔点 下降。
偶数碳 奇数碳
(二) 沸点
沸点大小取决于分子间的作用力
烷烃沸点的特点
(1)沸点一般很低。 (非极性,只有色散力)
H2O2 + Fe2+
RCOO-
-e-
电解
HO• + HO- + Fe3+ RCOO •
自由基的稳定性
均裂 H=359.8kJ/mol (88kcal/mol) 共价键均裂时所需的能量称为键解离能。 键解离能越小,形成的自由基越稳定。
苯甲基自由基
稀丙基自由基 三级丁基自由基 异丙基自由基
乙基自由基 甲基自由基 苯基自由基
Hammond假设:过渡态总是与能量相近 的分子的结构相近似。
甲烷氯代反应势能图
甲烷氯代反应势能图的分析
1、第一步反应的活化能比较大,是速控步骤。 2、第二步反应利于平衡的移动。 3、反应 1 吸热,反应 2 放热,总反应放热,所以反应 只需开始时供热。 4、过渡态的结构与中间体(中间体是自由基)相似, 所以过渡态的稳定性顺序与自由基稳定性顺序一致。 推论:3oH最易被取代,2oH次之,1oH最难被取代。
甲烷氯代反应的适用范围
1、 该反应只适宜工业生产而不适宜实验室制备。 2 、该反应可以用来制备一氯甲烷或四氯化碳,不适 宜制备二氯甲烷和三氯甲烷。 3、无取代基的环烷烃的一氯代反应也可以用相应方法 制备,C(CH3)4的一氯代反应也能用此方法制备。
(2) 甲烷卤代反应活性的比较
环烷烃

第二部分:环烷烃2.7环烷烃主要内容分类和命名脂环烃的化学性质Baeyer张力学说影响环状化合物稳定性的因素 环状化合物的构象环己烷的构象取代环己烷的构象十氢化萘的构象2.7.1 分类脂环烃的定义:碳原子相互连接成环的烃 多数脂环烃性质和开链的饱和烃及不饱和烃类似•分类:饱和脂环烃(环烷烃)脂环烃环烯烃不饱和脂环烃环炔烃环戊二烯顺反异构体顺(Cis ): 相似基团位于环平面的同一边反(Trans ):相似基团位于环平面的两边顺-1,2-二甲基环戊烷反-1,2-二甲基环戊烷环烷烃的分类单环烷烃--只含一个环的环烷烃桥环烷烃--共用两个或两个以上碳原子的多环烷烃环烷烃螺环烷烃--单环之间共用一个碳原子的多环烷烃集合环烷烃--环与环之间用单键相连的多环烷烃多环烃是指环之间有共同碳原子的多环化合物。
根据环中共有碳原子的不同可分为:螺环烃稠环烃桥环烃螺环烃(spiro hydrocarbons):脂环烃中两个碳环共有一个碳原子。
螺〔3,3〕庚环spiro〔3,3〕heptane螺环化合物命名时,在螺环化合物的名称前加一个螺(spiro)字,表示类型,用方括号中的阿拉伯数字表示每个环中碳的数目(共有原子除外),数字间用小黑点隔开,并按由小到大的顺序排列,母体名称由环中所含碳原子的总数表示。
3个碳的一边4个碳的一边螺原子螺〔3.4〕辛烷spiro〔3.4〕octane•编号从螺原子(共用原子)旁的一个碳原子开始,首先沿较小的环编号(如果存在),然后通过螺原子从第二个还编号。
在此编号规则基础上使取代基及官能团编号较小。
CH 3CH 31,5-二甲基螺〔3.5〕壬烷1,5-demethyspiro 〔3.5〕nonane123456789稠环烃(fused polycyclic hydrocarbons):脂环烃中两个碳环共有两个碳原子。
双环〔4,4,0〕癸烷十氢化奈(decalin)桥环烃的命名1)词头双环(bicyclo)有时也称二环,表示它含有两个环,环数根据一个环状化合物转变成开链化合物时需断开的碳碳键数来确定。
大学有机化学课件 第 2 章 第二节 环烷烃
CH3 COOH
2013-8-20
(3)顺反异构体的命名
相同或相近的基团处于刚性结构的同侧为顺式;异侧为反式。
CH3 CH3 CH3
顺反-
HOOC CH3 HOOC COOH COOH
反-1,4-环己二甲酸
顺-1,4-环己二甲酸
CH3 CH3 H
2013-8-20
H H3C
CH3 H
H
顺-1,2-二甲基环丙烷
2013-8-20
三、单环环烷烃的结构
(一)Baeyer张力学说(1885年)
碳原子键角应为109 28', 任何与此正常键角的偏差, 都会引起分子的张力,这种张力具有力图恢复正常键角的趋 势。我们把这种张力叫角张力。 sp3
120。
。
60
。
90。
108。
角偏差 49。28' 19。28'
1。28'
(4)编号 (5)名称书写:同烷烃
2013-8-20
4 5 1
3
螺原子
2
1-甲基螺[4.5]-2-癸烯 6 5 1 2 4 7 3 8
螺[2.4]庚烷
CH3
2-甲基-6-乙基螺[3.4]辛烷 4-甲基螺【2,4】庚烷
2013-8-20
3、桥环脂环烃的命名
以桥环中含环的数目为词头。如双环 、三环等。
H3C H
CH3 H
-87
刚性结 构
H H3C
-37
CH3 H
119.4
熔点/℃
沸点/℃ 124.3
2013-8-20
(2)环烷烃顺反异构体的判断
A、必须含有不能自由旋转的结构,即刚性结构。 B、刚性结构上必须有两个原子(或两个以上)各自 连有两个不同的原子或原子团。
第二节 环烷烃

第二节
环烷烃
一 、环烷烃的分类、异构和命名
二、环烷烃的物理性质
三、环烷烃的化学性质
四、环烷烃的分子结构
《有 机 化 学》
第二节 环 烷 烃
本节学习要求
熟练掌握环烷烃的结构和化学性质,环 的张力,无张力环的结构;环已烷的一元、 二元取代物的 优势构象;掌握多环烷烃的 命名.
《有 机 化 学》
一、 环烷烃的分类、异构和命名
分类
环烷烃:小环(3-4)、普通环(5-7)、 中环(8-11)、大环(≥12) 单环 环烷烃 螺环 二环 桥环
多环
异构现象 如 C5H10
异构现象复杂 单环烷烃的通式为: 2n CnH 构造异构:5种环烷烃+ 5种烯烃
《有 机 化 学》
顺反异构:
《有 机 化 学》
注意:环己烷构象的书写!
《有 机 化 学》
第二章作业(p47)
1 的(1)、(3)、(5)、(7)、 (9)、 3、 5、6、 7
环已烷
← → → ←
室温 1000:1
《有 机 化 学》
环己烷***
椅式构象稳定?
船式构象稳定?
※椅式构象稳定!
《有 机 化 学》
直立键 a键(axial bond) 平伏键 e键(equatorial bond)
环已烷
请推定环已烷上的取代基在什么键(a键?e键?) 上分子 最稳定??
《有 机 化 学》
a 、 e键的关系: a键6个e键6个,均是3个向上3个向下。
《有 机 化 学》
甲基环已烷 —甲基在?键上稳定?
《有 机 化 学》
总结:
(1)、环己烷及其衍生物的椅式构象比船式构象稳定。常 温以椅式构象存在为主; (2)、环己烷的二元或多元取代物最稳定的构象是e键取代 最多的构象; (3)、环上有不同的取代基时,大的取代基在e键的构 象更稳定。
第二节_环烷烃

环烷烃2.1环烷烃的定义和命名分子中具有碳环结构的烷烃称为环烷烃,单环烷烃的通式为C n H2n,与单烯烃互为同分异构体。
环烷烃可按分子中碳环的数目大致分为单环烷烃和多环烷烃两大类型。
1.单环烷烃最简单的环烷烃是环丙烷,从含四个碳的环烷烃开始,除具有相应的烯烃同分异构体外,还有碳环异构体,如分子式为C5H10的环烷烃具有五种碳环异构体。
为了书写方便,上述结构式可分别简化为:当环上有两个以上取代基时,还有立体异构。
单环烷烃的命名与烷烃基本相同,只是在“某烷”前加一“环”字,环烷烃若有取代基时,它所在位置的编号仍遵循最低系列原则。
只有一个取代基时“1”字可省略。
当简单的环上连有较长的碳链时,可将环当作取代基。
如:2.多环烷烃含有两个或多个碳环的环烷烃属于多环烷烃。
多环烷烃又按环的结构、位置分为桥环、螺环等。
(1)桥环两个或两个以上碳环共用两个以上碳原子的称为桥环烃,两个或两个以上环共用的叔碳原子称为“桥头碳原子”,从一个桥头到另一个桥头的碳链称为“桥”。
桥环化合物命名时,从一个桥头开始,沿最长的桥编到另一个桥头,再沿次长的桥编回到起始桥头,最短的桥最后编号。
命名时以二环、三环作词头,然后根据母体烃中碳原子总数称为某烷。
在词头“环”字后面的方括号中,由多到少写出各桥所含碳原子数(桥头碳原子不计入),同时各数字间用下角圆点隔开,有取代基时,应使取代基编号较小。
例如:1,2,7-三甲基-双环[2.2.1]庚烷双环[4.4.0]癸烷双环[2.2.1]庚烷(2)螺环脂环烃分子中两个碳环共用一个碳原子的称为螺环烃,共用的碳原子为螺原子。
命名时根据成环的碳原子总数称为螺某烷,编号从小环开始,经过螺原子编至大环,在“螺”字之后的方括号中,注明各螺环所含的碳原子数(螺原子除外),先小环再大环,数字间用下角圆点隔开。
有取代基的要使其编号较小。
例如:5-甲基螺[3.4]辛烷 1,6-二甲基螺[3.5]壬烷2.2环烷烃的物理性质在常温常压下,环丙烷与环丁烷为气体,环戊烷、环己烷为液体。
第二章环烷烃

97%
C(CH3)3
C(CH3)3
3%
> 99.9% 从上述三个实验事实可看出:取代基体积越大, 取代占的 从上述三个实验事实可看出:取代基体积越大, e取代占的 比例越大。 比例越大。
2). 多取代环己烷的构象 结论: 多取代环己烷, 取代基最多的构象最稳定 取代基最多的构象最稳定。 结论:①. 多取代环己烷, e取代基最多的构象最稳定。 多取代环己烷, 体积较大的取代基为e型的构象 ②. 多取代环己烷, 体积较大的取代基为 型的构象 最稳定。 最稳定。 二甲基环己烷的最稳定构象。 例1:写出顺 :写出顺-1,2-二甲基环己烷的最稳定构象。 二甲基环己烷的最稳定构象
1-甲基 叔丙基环己烷 甲基-4-叔丙基环己烷 甲基
CH3 CH3
顺-1,2-二甲基环丙烷 二甲基环丙烷
H H
H CH3
CH3
反- 1,3-二甲基环戊烷 二甲基环戊-3-叔丙基环戊烷 反-1-乙基 叔丙基环戊烷 乙基 2). 多环烃 螺环烃: 确定母体:螺某烷(由螺环中总碳数确定)。 螺环烃 ①. 确定母体:螺某烷(由螺环中总碳数确定)。 编号:先编小环后编大环。 ②. 编号:先编小环后编大环。从小环中和螺碳相 邻的碳开始编号,使取代基位次最小。 邻的碳开始编号,使取代基位次最小。 写法: ③.写法: 写法
02-环烷烃的结构和构象课件
5 十氢化萘的结构 • 是双环[4.4.0]癸烷的习惯名称.
(1) 平面结 构式
顺十氢化萘
(2) 构象
反十氢化萘
•顺式异构体--不稳定.
• --环下方几个 a 键上的氢原子比较靠拢,有些拥 挤,故分子能量较高,比较不稳定.
2 环丁烷的结构
• 内角90°. • 四个碳原子不在一个平面上.
环丁烷中的键
折叠式构象 环丁烷的构象
3 环戊烷的结构 • 不是平面结构.因C-H键的重叠,有较大扭转张力. • 实际构象:折叠环的形式--“信封式”构象.
•分子张力不大,因此环戊烷的化学性质比较稳定.
4 环己烷的结构
• 环己烷不是平面结构,较为稳定的构 象为折叠的椅型构象和船型构象.
为 a键
为e键
椅型构象的翻转
•两种椅型构象是等同的分子.
(6) 甲基环己烷椅型构象的翻转
•同一平面 上的比较
•两种椅型构象是两种不同结构的分子. •甲基连在a键上的构象具有较高的能量,比较不稳定 •平衡体系中e键甲基环己烷占95%,a键的占5%
取代基在e键上的构象较稳定. • 若有多个取代基,往往是 e 键取代基最多的构象最稳
环烷烃的结构
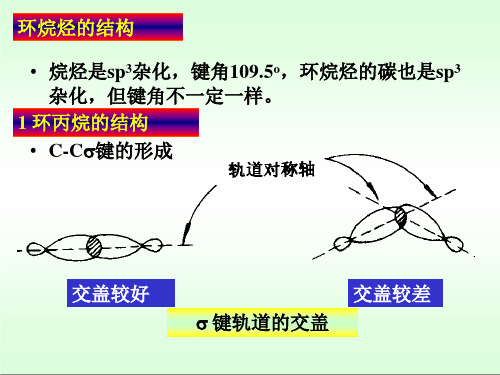
• 烷烃是sp3杂化,键角109.5o,环烷烃的碳也是sp3 杂化,但键角不一定一样。
1 环丙烷的结构 • C-C键的形成
交盖较好
交盖较差 键轨道的交盖
•这样的键与一般的键不 一样,它的电子云没有轨道 轴对称,而是分布在一条曲 线上,故常称弯曲键.
内角60°
•弯曲键比一般的 键弱,并且具有较高的能量. •这种因键角偏离正常键角而引起的张力叫角张力. •由于构象是重叠式而引起的张力叫扭转张力.
• C-1和C-4上两个向内伸的H由于距 离较近而相互排斥,也使分子的能量 有所升高.
第二章环烷烃

邻的碳开始编号,使取代基位次最小。
③.写法:
螺[a . b]某烷
( 半 取代基位置 字 线 用 ) 阿 拉 伯 数 字 , 数 字 间 用 逗 号 隔 开 位次 取代基名称 相 同 的 取 代 基 合 并 起 来 , 用 一 、 二 、 三 表 示 除 螺 碳 外 每 个 环 中 的 碳 原 子 数 。 a 为 小 环 中 的 , 为 大 环 中 的 。 b
2 3 4
1
Cl
7
7,7-二氯二环[4.1.0]庚烷
6
5
Cl
三. 环烷烃的稳定性 (Stability of Cycloalkanes) 为什么三元环不稳定易发生加成?
为什么五元环、六元环较稳定不易发生开环加成,而易
发生取代? 1. 拜尔(Baeyer) 张力学说要点
①. 形成环的碳原子都在同一平面上,并排成正多边形。
1 (109o28/-90o)=9o44/ 2
1 (109o28/-108o)=0o44/ 2
108
o
120o
1 (109o28/-120o)=-5o16/ 2
a.可看出:小环:三元、四元环张力很大。 常见环:五、六环张力很小。
b. 环丙烷的键角偏转大于环丁烷,因此环丙烷反应活性大于
环丁烷。 拜尔张力学说的不足之处:
由拜尔张力学说,比六元环大的环都有偏转角,并且环越
大,偏转角越大,张力越大。这一推论不正确。这是由于 张力学说前提不合理,即环中碳原子在同一平面内不合理, 拜尔张力学说存在于小环中。 2. 燃烧热与环烷烃的稳定性 燃烧热—纯粹的化合物完全燃烧所放出的热。 化合物的燃烧热越大,化合物越不稳定。见课本P47
有机化学教案—第二章
环 烷 烃 (Cycloalkanes)
第二章 第二节 环烷烃
难
2 与HBr加成 加成
+ HBr
室温
CH3CH2CH2Br
易
+ HBr
CH3 H 3C H3C
加热
不反应 难
CH3 CH Br C CH2
+ HBr
CH3 CH3 H
3 卤素加成
+ Br2 + Br2 + Br2 + Br2
室温
BrCH2CH2CH2Br
易
加热
BrCH2CH2CH2CH2Br
(不发生加成) (不发生加成) 难
1 H2
H
3 4
H 9 8 5 6 7
10
H
顺式
H
e,a
H
H
H
反式
•
e,e
稳定
4 5 6 1 3 2
甲基环己烷
有时链比较复杂, 有时链比较复杂,环作取代基
4-甲基环己烯
6 7 5 4
3
2 1
3-甲基-4-环丁基庚烷
环烷烃有顺反异构,有时需要表明“ 环烷烃有顺反异构,有时需要表明“顺、反”构 型
顺(cis): 两个取代基在环同侧 反(trans): 两个取代基在环异侧
CH3 H3C H CH3 H H3C H H CH3 CH3 H3C H H CH3
船式 环戊烷 环己烷
椅式
环戊烷是近近无张力环,环己烷是无张力环 稳定 环戊烷是近近无张力环 环己烷是无张力环,稳定 环己烷是无张力环
(2) 环己烷的构象
H H 1 H H 2H H 0.18nm 6 5 3 H H 4 H H
船式构象
直立键 H
0.25nm
H 5 H 3 H H
环烷烃
H
H
H
2.49Å
H
2.49Å
H~H之间距离均大于 H的Van der Waal’s 半径之和(2.40Å )
船式构象
H
2 5
重叠式 (有扭转张力)
H 1 H
6
H 4 C3-C2 H
3
H H
H H
4 3 2
1 5
6
HH
H C5-C6
H H
H H
1.84Å
H H
H H
旗杆键
H H H H H
H H H H
优势构象
2 CH3 1
结论:
(1)环己烷多元取代物的最稳定的构 象是e-取代最多的构象。
(2)环上有不同取代基时,大的取代
基在e-键的构象最稳定。
顺或反十氢萘的构象
H H
H
H
trans 较稳定
cis
H
反式十氢萘的构象
H
H
6 5 8 9 1 2 10 4 3
H H H H
C2-C3
H
8 10 1 9 5 4
直立键(a键)
平伏键(e键)
翻环
H
3
H
5
H
2 6
H
1
翻转
H H
H
4
H
3 5
H H
6 2
H
4
H
H
H H
H
H
H H 1 H
H H
H
翻转后,原来的a键转变 为e键,而e键转变为a键
3、取代环己烷的优势构象
一取代环己烷平伏键与直立键构象 间的位能差(范德华斥力 strain ) 基团 位能差 基团 位能差 .1 .0 7 1 CH3 F .1 .5 Cl 2 C2H5 7 .1 .8 2 Br (CH3)CH 8 2 .2 HO 4 (CH3)C 21 3 CN 0.8 C6H5 13 .3 .9 6 H2N COOH 5
有机化学-环烷烃

1、单环烷烃
单环烷烃是指分子结构中含有一个环的饱和烃类化合物。最简单的脂环烃是 环丙烷。
脂环烃是不少重要药物的主要成份。
2、分类和命名
2.1环烷烃的分类: (1)按碳数的多少分 环上碳原子数为3~4时, 称为小环;为5~6时,称为普通环;为7~12时,称为 中环;大于12时,称为大环。 (2)按环的多少分 分子中只有一个环的称为单 环;两个环的称为双环;有三个或以上环的称为多环。 (3)按环的结合方式分 两个环共用一个碳原 子——螺环;两个环共用两个碳原子——稠环;两个 环共用两个以上碳原子——桥环。
2.2 命名:
单环 在相应的开链烃名称前加一个“环”字即可,若有官能 团就使其位次号最小或尽可能的使取代基有最低的系列编号。
练习
环戊烷 甲基环丁烷 乙基环丙烷 1.1-二甲基环丙烷 1.2-二甲基-1-乙基环丙烷
二、环烷烃的物理性质பைடு நூலகம்1、在常温常压下,环丙烷与环丁烷为气体,环戊烷、环己烷为 液体。 2、环烷烃不溶于水,易溶于有机溶剂,比水轻。环烷烃的沸点、 熔点、相对密度都比同碳原子数的烷烃高
第二节 环烷烃
一、环烷烃 环烷烃(huán wán tīng),含有脂环结构的饱和烃。 有单环脂环和稠环脂环。 含有1个脂环且环上无取代烷基的环烷烃,
。环戊烷、环己烷及它们的烷基取代衍生物是石 油产品中常见的环烷烃。稠环环烷烃存在于高沸点石油 馏分中。环烷烃有很高的发热量,凝固点低,抗爆性介 于正构烃和异构烃之间。化学性质和烷烃相似。其中以 五碳脂环和六碳脂环的性质较稳定。
三、环烷烃的化学性质
乙二酸是合成尼龙的单体
第二节 环烷烃

例如: 例如:
CH3 H H CH3
6 5
COOH
1 2 3 4
CH3
trans-1,2-二甲基环己烷
3-甲基环己烷甲酸
6/77
练习: 练习:
CH3
C2H5 CH3
C2H5
CH2CH3 H H
Cl
CH(CH3)2
1-甲基-2-乙基甲基- 乙基5-异丙基环己烷
CH3
1-甲基-3-已基-4 甲基- 已基氯环己烷
HOOC( CH 2 ) 4 COOH
18/77
四、环烷烃的结构
三、四元的小环化合物不稳定,易发生开环的反应。 四元的小环化合物不稳定,易发生开环的反应。
环烷烃的燃烧热与环的稳定性有关。 环烷烃的燃烧热与环的稳定性有关。
燃烧热( 测定数据表明:链状烷烃分子每增加一个燃烧热(△Hc)测定数据表明:链状烷烃分子每增加一个-CH2-, 其燃烧热数值的增加基本上是一个定值658.6 kJ· 其燃烧热数值的增加基本上是一个定值658.6 kJ·mol-1。
偏转角度= 偏转角度= 2
N = 3 偏转角度
24° 24°44’
4
9°44’
5
4°4’
6
-5°16’
7
-9°33’
从偏转角度来看,五员环应最稳定, 从偏转角度来看,五员环应最稳定,大于五员环或小于五 员环都将越来越不稳定。但实际上,五员, 员环都将越来越不稳定。但实际上,五员,六员和更大的环型 化合物都是稳定的。这就说明张力学说存在缺陷。 化合物都是稳定的。这就说明张力学说存在缺陷。
烃 的 分 类
n = 7,8,9,10,11 7, 10, n ≧12
大 环
2/77
螺环烃
第二章 环烷烃

5.取代基按次序规则,写在前面。
2,8,8- 三甲基 - 二环[3.2.1] 辛烷
8
1 7
6
5
4
2
3
9
第9页,本讲稿共21页
三. 环烷烃的结构与稳定性
为什么小环化合物容易开环并且三元环比四元环更容易开环,而五元环
、六元环相对稳定?
角张力(拜尔张力):与正常键角偏差而引起的张力。(同平面)
CH2 CH2 + Br2
hv
CH2-CH-Br
CH2
21
第21页,本讲稿共21页
CH2-CH2-CH2
H
Br
H3C— CH CH2 + HBr CH2
CH2 CH2
加热
CH2
+ CH2
Br2
CH3-CH-CH2-CH2
Br
H
CH2-CH2-CH2-CH2
Br
Br
20
第20页,本讲稿共21页
3.环丙烷对氧化剂稳定 KM nO4 / H+
COOH
环丙烷在光照下也能与卤素发生游离基取代反应:
第二章 环烷烃
1
第1页,本讲稿共21页
二、 命 名
1. 单环烃的命名
①按成环碳原子数目称为环某烷。
CH2 CH2 CH2 环丙烷
CH2 CH2
CH2 CH2 环丁烷
CH2 CH2 CH2
CH2 CH2
环戊烷
② 若环上有多个取代基时,编号从较小的取代基开始, 且使取代基的位次最小。(最低系列、次序原则)
构
5 6
象
1
翻
第二章 第二节环烷烃
构象越稳定; 环上取代基不同时,大的取代基占据e键的构
象稳定
2.8 环烷烃的物理性质
脂环烃的物理性质:环烷烃的分子结构比链烷烃 排列紧密,所以,熔点、沸点、相对密度比相 应的烷烃高
大环、中环化合物的化学性质与相应的链烷烃 类似
2.9 环烷烃的化学性质 一、催化氢化
+ Ni
H2 80℃ CH3CH2CH3
Ni
+ H2 200℃ CH3CH2CH2CH3
+ H2
Pt 300℃
CH3CH2CH2CH2CH3
四元环比三元环稳定,五元以上的环烷难于开环
二、加卤素或卤化氢,常温限于三元环反应,加 成符合不对称加成规则
+ CCl4
Br2
BrCH2CH2CH2Br
+ H2O
环烃
II 环烷烃
2.6 环烷烃的命名
环烷烃的分类
单环烷烃
环烷烃
桥环烷烃 螺环烷烃
脂环烃 环烯烃 集合环烷烃
环炔烃
单环芳烃
芳烃 多环芳烃 非苯芳烃
多苯代脂烃 联苯 稠环芳烃
性质与脂肪烃相似的环烃,叫做脂环烃
环烷烃命名的规则
以碳环为母体,侧链为取代基 母体的名称同直链烷烃,不同在于前加一“环” 取代基的位置用阿拉伯数字表示 编号以取代基的位置最小为原则 连有不同取代基时,根据次序规则,较优基团给以较
环己烷的船式构象
180 pm
• 碳原子的键角近四面体,但船头的氢原子存在较大的 van der Waals (范德华)力.
• 一般情况下,以椅型存在
环己烷的12个键可划分 为两组
直立键(axial)-a键
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环烷烃2.1环烷烃的定义和命名分子中具有碳环结构的烷烃称为环烷烃,单环烷烃的通式为C n H2n,与单烯烃互为同分异构体。
环烷烃可按分子中碳环的数目大致分为单环烷烃和多环烷烃两大类型。
1.单环烷烃最简单的环烷烃是环丙烷,从含四个碳的环烷烃开始,除具有相应的烯烃同分异构体外,还有碳环异构体,如分子式为C5H10的环烷烃具有五种碳环异构体。
为了书写方便,上述结构式可分别简化为:当环上有两个以上取代基时,还有立体异构。
单环烷烃的命名与烷烃基本相同,只是在“某烷”前加一“环”字,环烷烃若有取代基时,它所在位置的编号仍遵循最低系列原则。
只有一个取代基时“1”字可省略。
当简单的环上连有较长的碳链时,可将环当作取代基。
如:2.多环烷烃含有两个或多个碳环的环烷烃属于多环烷烃。
多环烷烃又按环的结构、位置分为桥环、螺环等。
(1)桥环两个或两个以上碳环共用两个以上碳原子的称为桥环烃,两个或两个以上环共用的叔碳原子称为“桥头碳原子”,从一个桥头到另一个桥头的碳链称为“桥”。
桥环化合物命名时,从一个桥头开始,沿最长的桥编到另一个桥头,再沿次长的桥编回到起始桥头,最短的桥最后编号。
命名时以二环、三环作词头,然后根据母体烃中碳原子总数称为某烷。
在词头“环”字后面的方括号中,由多到少写出各桥所含碳原子数(桥头碳原子不计入),同时各数字间用下角圆点隔开,有取代基时,应使取代基编号较小。
例如:1,2,7-三甲基-双环[2.2.1]庚烷双环[4.4.0]癸烷双环[2.2.1]庚烷(2)螺环脂环烃分子中两个碳环共用一个碳原子的称为螺环烃,共用的碳原子为螺原子。
命名时根据成环的碳原子总数称为螺某烷,编号从小环开始,经过螺原子编至大环,在“螺”字之后的方括号中,注明各螺环所含的碳原子数(螺原子除外),先小环再大环,数字间用下角圆点隔开。
有取代基的要使其编号较小。
例如:5-甲基螺[3.4]辛烷 1,6-二甲基螺[3.5]壬烷2.2环烷烃的物理性质在常温常压下,环丙烷与环丁烷为气体,环戊烷、环己烷为液体。
环烷烃不溶于水,易溶于有机溶剂,比水轻。
环烷烃的沸点、熔点、相对密度都比同碳数的烷烃高,2.3环烷烃的化学性质环烷烃的化学性质与烷烃类似,可发生取代和氧化反应,但由于碳环的存在还具有一些与烷烃不同的特性。
如三元和四元环烷烃由于分子中存在张力,所以表现在化学性质上比较活泼,它们与烯烃相似,可以发生开环加成反应生成链状化合物。
1.开环反应环烷烃中环丙烷和环丁烷能与氢气、溴、卤化氢等试剂发生开环反应,而环戊烷和环己烷却不易发生或不能发生类似的开环反应。
(1)催化加氢小环烷烃的性质与烯烃类似,在催化剂存在下能发生加氢反应,生成烷烃。
环戊烷需要用活性高的铂为催化剂在300℃以上才能加成。
环己烷、环庚烷在此条件下不发生加氢反应。
(2)加溴环丙烷在室温下与溴发生加成反应生成1,3-二溴丙烷。
在加热条件下环丁烷与溴发生加成反应,生成1,4-二溴丁烷。
(3)加卤化氢环丙烷、环丁烷与卤化氢发生加成反应生成卤代烷。
环戊烷、环己烷不易发生反应。
2.取代反应环戊烷、环己烷等在光或热的作用下可发生取代反应。
环丙烷与溴在光照下反应,除生成少量取代产物外,主要得到的却是加成产物。
3.氧化反应常温下环烷烃与一般氧化剂不起作用,即使环丙烷也不起反应,因此可用高锰酸钾鉴别环烷烃和烯烃。
当加热或在催化剂作用下,用空气中的氧气或硝酸等强氧化剂氧化环己烷等,则发生环的破裂生成二元酸。
己二酸是合成尼龙的单体。
2.4环烷烃的分子结构从环烷烃的化学性质可以看出,环的稳定性与组成环的碳原子数密切相关,环的稳定性的大小反映了分子内能的不同,内能越大,环越不稳定。
据测定,环丙烷分子中C-C-C键角为105.5°,H-C-H键角为114°。
可见,相邻碳原子的sp3杂化轨道为形成环丙烷必须将正常键角压缩成105.5°,这就使分子本身产生一种恢复正常键角的角张力。
角张力的存在是环丙烷不稳定的重要原因。
此外,轨道重叠程度越大,形成的键越牢固。
显然在形成105.5°键角时,其轨道重叠不及正常的109.5°大,实际上呈弯曲状,所以人们常把这种键称为弯曲键或香蕉键。
环丁烷与环丙烷类似,分子内也存在角张力,但比环丙烷小些。
为降低扭转张力(由于C-C间处于重叠式构象引起的张力),环丁烷通常呈折叠状构象,这种非平面结构可减少C-H键的重叠,其稳定性比环丙烷大一些。
环戊烷、环己烷分子中的碳原子不在一个平面上,碳碳σ键的夹角接近或保持109.5°,分子中既无角张力,又无扭转张力,所以都比较稳定。
2.4.1环的张力拜尔张力学说由上面化学性质可看出,环的稳定性与环的大小有关。
小环不稳定,大环较稳定。
为了解释这一事实拜尔在1885年提出了张力学说。
要点是:环烷烃中碳原子(饱和,SP3杂化),与其他原子结合时,任何两键角都是109028,。
但环丙烷是三角形,其夹角是60,环丁烷是四方形,夹角是900,这样环中的C-与-C键角不能是109028,,必须压缩到600,900以适应环的几何形状。
这种由于与正常键角的偏差,引起分子的张力,称角张力。
这样的环称张力环。
张力环为减小张力,有生成更稳定的开链化合物的倾向。
与正常键角偏差越大,环张力越大,越易起开环反应。
书中给出了几种环烷烃键角偏转大小,正值表示键角向内压缩,负值表示键角向外扩张。
根据张力学说,环己烷以上因键角向外扩张而存在张力,且环越大,键角扩张越大,环越不稳定,而事实上,它的都是稳定的。
拜尔张力学说对小环的结论是正确的,但无法解释负环以上大环的稳定性,其原因是成环碳原子都处于同平面这个假设是错误的,它们实际上不是共平面!环烷烃的燃烧热上章我们学过,利用燃烧热可以判断异构体的稳定性,在化学上,我们说某化合物不稳定,意思是说分子的内能较高,易起化学反应。
小环烷烃不稳定,内能较高,可以从其燃烧热数据得到证实。
开链烷烃,不论含碳较少,每个CH2的燃烧热都接近658.6KJ/MOL,而环烷烃每个CH2的燃烧热则因环的大小而不同,大多数都大于开链烷烃的658.6KJ/MOL。
这高出的能量叫张力能。
例如:环丙烷:CH2燃烧热697.1KJ/MOLCH2张力能697.1-658.6=38.5KJ/MOL分子总张力能3*38.5=115.5KJ/MOLP50 表中给出了多种环烷烃的有关数据。
可见张力越大,环越不稳定,张力越小,环越稳定,环己烷,及大环烷烃几乎为无张力环,都很稳定。
若被氧化,角很大,能量升高。
张力能在有机化合物中,有四种因素不产生张力能。
1.非键作用分子中两非键合原子或基因由于几何原因互相靠近,当其间距小于两者范德华半径之和时,这两个原子或基团就强烈的排斥,引起体系能量升高,且升高的数值最大。
E nb2.键长变化分子中由于几何原因,必须使某一个键伸长或缩短(象弹簧),体系能量随之升高,EL,升高数值越大,但〈E nb3.键角变化分子中由于几何原因要使键角的大小发生变化,就引起的体系的能量升高,E 其升高数值越大,但〈E l4.扭转角变化分子中由于几何原因,使扭转角发生变化就引起能量升高,E,其数值高升最小。
比如:一个分子由于几何原因使两非键合原子或基团靠的太近时,因相互排斥,体系能量升高,为降低能量,扭转角发生变化,以使它们彼此分开。
如果扭转角变化还不是以使两个原子或基团分开,这时某些键角,键长就会发生必要的变化,使其分开并能够容纳在有限的空间内,而范德华半径很少变化。
近代结构理论的解释从近代价键理论观点来看,两个原子轨道重迭越多则键越稳定。
烷烃碳为SP3杂化,键角为109028,,而在环丙烷分子中,键角为600,故SP3杂化轨道很难头对头重叠,即重叠角较少,形成的键也较不稳定,易开环。
根据量子化学计算,认为环丙烷分子中C-C键是弯曲的,键角为1050,形如香蕉,又称香蕉键,不仅重叠程度较少,且电子云分布4在C-C 键连线外侧,易受试剂进攻而起开环反应。
1.环烷烃的顺反异构环烷烃中由于环的存在限制了C-Cσ键的自由旋转,如果有两个或两个以上的环碳原子连有不同取代基时,就会得到不同构型,产生顺反异构。
例如1,2-二甲基环丙烷就有两种异构体。
取代基在环平面同侧的称为顺式,在异侧的称为反式。
2.环己烷及其衍生物构象(1)船式构象和椅式构象在环己烷分子中碳原子以sp3杂化,六个碳原子不在同一个平面上,可以有如下两种典型的构象:比较环己烷的船式构象和椅式构象:船式构象中两个船头碳原子C1和C4上的氢原子相距很近,只间隔0.183nm,比它们的范德华半径之和0.25nm小得多,因此相互之间斥力较大;而在椅式构象中相邻的两个碳原子上的氢都处于邻位交叉式;船式构象中,C2-C3和C5-C6上的C-H是全重叠式,因而具有扭转张力。
所以船式构象不如椅式构象稳定,环己烷及其衍生物在一般情况下都以椅式构象存在,椅式构象为环己烷的优势构象。
环己烷的船式构象和椅式构象之间能相互转换,通常的环己烷就处于这两种构象的转换平衡中。
由于船式构象远没有椅式构象稳定,环己烷几乎都是以椅式构象存在,因此在讨论环己烷结构时通常只考虑椅式构象。
(2)平伏键和直立键环己烷椅式构象中的十二个C-H键可分为两类:与分子对称轴平行的六个C-H键称为直立键或a键(axial的简写),其中三个朝上三个朝下;另外六个键与对称轴成109.5°的角度称为平伏键或e键(equatorial的简写)。
(3)椅式构象环的翻转椅式构象也有两种构象,由于分子的热运动,在常温下,通过C-C键的不断扭动,环己烷的一种椅式构象可以转变到另一种椅式构象,而且这种翻转进行得非常快。
翻转以后原来的e键变为a键,a键变为e键。
(4)取代环己烷的构象一元取代环己烷中,取代基处于e键上的构象较稳定。
对于多元取代环己烷,一般说来最稳定的构象应是取代基在e键上最多的椅式构象,尤其是大的取代基处于e键上更为稳定。
