质量部改善行动追踪记录表
QRQC管理办法

QRQC管理办法1.目的对公司内外部所遇到的质量问题、生产问题、纠正事项、内外审核不符合项等作出快速反应和解决.2.范围本指导书适用于公司所有质量、生产、纠正事项、内外审核不符合项等问题的解决流程.3.职责与权限3.1技术部:负责组织公司QRQC小组成员处理各种质量问题,制定改善行动措施。
3.2质量控制部:负责组织内外审核不符合项快速解决;负责处理公司内部及外部质量事故,及时跟进各车间的改善行动方案和效果.3。
4各部门/车间:组织部门/车间QRQC并对QRQC会议上所负责的项目进行快速改进。
4.参考文件4.1《不合格品控制程序》4.2《服务管理程序》4。
3《纠正与预防措施管理程序》4.4《内部审核控制程序》4。
5《管理职责程序》5。
工作流程5.1QRQC基本流程5.1.1客户投诉或退货销售部/质量部在接到顾客的投诉或要求退货的信息后马上将信息反馈给质量部,质量部进行登记后启动QRQC程序.5。
2分析问题产生的原因5。
2。
1质量部召集相关人员成立QRQC小组,利用4M方法确认问题发生的因果树(见FTA表).5.2.2利用5W方法寻找问题发生的根本起因。
5.2。
2利用5W方法寻找问题未能检测出的根本起因。
5.2。
3利用4M方法确认疏忽问题的因果树(见FTA表)5。
3确定纠正措施和行动计划。
5。
3。
1经过分析后找到问题发生的原因后,根据问题的所属责任部门将具体问题落实到责任人,责任人须在具体的时间内完成任务.5.3。
2QRQC小组组长协调责任部门在确定的时间段内完成任务.5.3.3对不合格品的追踪处理。
5。
3.3。
1如果厂内发现的不合格品,由负责该产品的QE工程师对在制品进行处理,具体过程参照《不合格品控制程序》实施。
5.3。
3。
2如是客户投诉或退货,在收到客户所提供的数据或资料时,质量部QE工程师根据《客户投诉处理程序》和《客户退货处理程序》进行处理。
5.4检测行动措施实施的具体结果.5。
4。
1质量部根据改善方案和各项条款进行检验,监控行动措施的有效性,完成任务单“CHECK”部份。
内部稽核作业程序,验证质量管理,及时发掘问题加以改善

5.3.稽核准备:
5.3.1.稽核员稽核前,制订内部稽核查检表。
5.3.2.稽核前稽核组长发出稽核通知,通知受稽核单位时程、范围及配合事项。
5.3.3.查检表制订:
5.3.3.1查检表将章节/名称填在查检表。
5.1.3.稽核计划与频度亦可依重要性、严重性及上次稽核不符合缺失之状况而调整。
5.2.稽核小组:
5.2.1.每次稽核前,由管理代表负责筹组稽核小组,并指任稽核组长。
5.2.2.稽核小组之成员须受过厂内外相关训练六小时以上。GP内审小组成员必须是ISO内审员并接受GP体系训练经考核合格人员.
5.2.3.稽核小组稽核员不可稽核自己之部门。
此次稽核日期
上次稽核日期
编号
稽核员
被稽核单位
稽核总结:
1、上次稽核缺点改善状况:
2、此次稽核缺点叙述:
2、稽核总结叙述:
稽核组组长
日期
5.4.2稽核员须记录发现之事实证据,以作为稽核报告之依据。
5.4.3稽核时应避免争执,若有争议则应与组长或管理代表讨论。
5.4.4稽核员应控制稽核时间,若无法于预定时间内完成稽核,可经稽核小组组长与受稽核部门主管同意,延长稽核时间。
5.5矫正措施:
5.5.1受稽核单位须于指定期限内回复矫正措施通知单,交与稽核员。
5.3.3.6查检表填写时字体须清晰,易于阅读。
5.3.4查检表使用:
5.3.4.1稽核员稽核时依内部稽核程序执行,稽核结果填写于查检表中,GP体系内审检查表沿用SONY公司检查表内容:
A.符合时在判定栏打OK。
华为质量追踪

HUAWEI TECHNOLOGIES CO., LTD.
HUAWEI Confidential
Page 18
根本原因的分析步骤
• 根本原因确定:
› 根据“根本原因的判定Checklist”判定哪些原因是根本原因
• 改善行动:
› 列出改进对策(短期措施)
› 可行性分析:确定根本原因的关系,确定哪些根本原因值得改进并确定 改进优先级
• 根本原因的判定
• 实际操作
HUAWEI TECHNOLOGIES CO., LTD.
HUAWEI Confidential
Page 5
质量回溯的核心环节 根因分析是质量回溯活动核心环节
选择问题 根因分析 改进实施 效果评估
问题 搜集
问题 标识
根因 分析
改进 方案
实施 改进
效果 评估
失效模 式库
HUAWEI TECHNOLOGIES CO., LTD.
HUAWEI Confidential
Page 17
• 准备工作:
› › › ›
根本原因的分析步骤
市场发现问题、生产现场发现问题并报告 现场问题处理(临时措施) 组建根因分析小组:确定参加人员并进行职责划分 数据搜集:主要包括现场数据、观察和测试资料、书面文件等等
HUAWEI TECHNOLOGIES CO., LTD.
HUAWEI Confidential
Page 9
缺陷引入点、控制点与问题根因的关系
• 问题的根因一般情况在“缺陷的引入点” › 如:产品、流程设计缺陷、工艺技术缺陷等等
• 问题的根因一般情况不会在“缺陷的控制点” ,因为它不是问 题发生的源头。只有当“缺陷的引入点”质量无法控制或在能 力范围之外时,必须依赖控制点来进行约束,这时“缺陷的控 制点”才会构成问题的根因
审核不符合项整改措施及跟踪报告

工程
进料检验的判定需要完善,如:
9
体系审核
2016.10.172016.10.18
1-PP-2525粒子,批次X201506021,需要供应商提供的产品质量报告,无供应商的检验合格的认可签字或签章 2-PP-2525粒子,批次是X201504043,进行了试生产,试生产记录未填写批次号,无法与该批次对应 3-现场没有设置进料检验的待检区,无待检区,物料是先放入库位后再检验,并未按规定进行
内部针对该问题提出了解决的方案,文件还未修改受控
物流
不合格品的隔离标识、处理方式、时效性需要完善,如:
1-仓库里有一袋YAEpp-2525的粒子,批次是X201504043,包装桶已经严重变形,不符合原料的包装状态,收货时
应该属于不合格品,未见相关的不合格品信息及后续流程
2-仓库里有两袋PP-1520的粒子,15-5-17过期,还放置在正常粒子仓库,没有隔离,也未做不良标识
3、未见封样件清单;
发现部门 Come to Light Dept.
质量
应加强设备管理的系统性和有效性,如:
1、未见设备预防性维护保养的标准化作业单;
2、未见设备点检作业指导书;
3、停机时间统计表显示5/20有80分钟设备故障,但在设备维修保养记录表中未见;
4、问题的分析不够及时,如6/4有150分钟设备故障,但在反应计划中未见,设备维修保养记录表中也未见,8D
划,根据验收协议进行验收,并保持记录;
应加强模具管理的系统性和有效性,如:
1、未见模具维护保养作业指导书;
2、未对模具的开合模数进行统计;
3
体系审核
2016.10.17- 3、模具履历信息不完整,抽查YAE后保下段2015-5-30进行一次保养,之后再次对定模镜面进行抛光处理的日期 2016.10.18 是2016-4-29,间隔时间长达一年;
品质改善计划表

品质改善计划表篇一:品质改善工作计划篇一:品质改善计划.品质改善规划【改善工作的核心内容】提高人员的技能、品质意识、工作态度,达到整体素养的提高。
围绕顾客满意为中心,通过不接收不良、不制造不良、不流出不良的“三不”原则,推动整体质量体系改善。
【重点推动的工作】(1)生产流程:要求标明从来源到最终成品的每一个工位及工序(2)生产设备:要求标明各工序所使用的生产设备。
(3)作业指引:要求标明各工序的作业指导文件。
(4)控制项目:要求标明各工序应该控制的项目。
(5)接收标准:要求标明各工序作业、测试的接收标淮。
(6)责任者:要求标明检测责任者。
(7)其他:包括抽样方法及频度,检测设备和检测方法等。
【具体实施的改善内容】1.规范作业指导书,杜绝误操作或者误加工而引起产品质量问题2.督导生产部门悬挂作业指导书,严格按照作业指导书生产篇二:品质改善工作计划六a02品质改善工作计划批准:主管:填表:说明:1.由质量部门提出具体的状况;2.质量部门和相关部门拟定推进方案;3.各部门拟定各部门计划。
篇三:20XX年品质部工作总结及20XX 年品质部的工作计划及重点-0-20XX年品质部工作总结及20XX年品质部的工作计划及重点目录一.部门组织架构和人员状况二.部门的工作职责三.20XX年度的主要工作内容四.20XX年存在的不足和改善的方案五:20XX年的成本控制计划六.总结和本年度的目标一.部门组织架构和人员状况品质部目前人力配置满员编制为人数:43人副经理:1人、科长:1人工程师:8人(包括sqe\体系工程师\高级工程师\qe\pqe);文员:2人(dcc和品质)组长:7人(包括iqc\oqc\注塑\喷涂\丝印a\b班)qc:24人(包括iqc\oqc\注塑\喷涂\丝印a\b班\2名驻厂人员)目前品质部组织架构新的一年品质部将对公司内部的品质管控系统进行重新调整,品质部门的组织架构也要进行重新规划,预计的补足现有的组织架构人员外,因20XX年客户群的提升,所以供应商管理与客户维护是我们的工作重点,所以在组织架构上面加入厂商及客户驻厂技术员职位。
HSF纠正与预防措施控制程序

※※修订履历※※1、目的对质量与HSF管理系统内所有生产作业的质量与HSF问题加以记录分析,并提出解决方案,进而防止问题再发生,以确保质量与HSF管理系统能够正常运作。
2、范围适用于本公司有关产品质量与HSF管理系统运作异常所采取之追查、反馈、矫正与预防措施作业。
3、权责3.1品保负责质量与HSF管理系统运作缺失之矫正与预防措施作业,预防问题再发生。
3.2各相关责任单位必须配合本程序处理异常并立即采取有效的矫正与预防措施。
4、定义4.1矫正措施:针对己发生之不符合事项采取措施,以改善并消除之。
4.2预防措施:消除潜在的不合格或其他不期望情况的因素所采取的措施。
5、作业内容矫正与预防措施需具备以下措施:(流程详见附件一)5.1执行矫正与预防措施之时机:5.1.1进料检验异常时;5.1.2制程检验异常时;5.1.3成品检验异常时;5.1.4客户抱怨及退货时;5.1.5内部稽核发现异常时;5.1.6环境有关禁用物质事项发生异常时;5.1.7环境系统执行有异常时;5.2矫正与预防措施之处理:5.2.1进料检验经判定退货时,品保应发《质量异常处理单》由品管通知供应商做矫正与预防措施并追踪其改善结果,改善报告在三个工作日内回复。
5.2.2制程全检之记录于《制程巡检纪录表》,不良率超出各单位设定之目标值时,各单位应于《制程巡检记录表》内进行原因分析并做改善对策。
5.2.3制程巡检IPQC如有发现主要缺点,或不良率达到5%时(主缺参照《质量检验规范》,应开立《质量异常处理单》交责任单位进行矫正与预防措施,品管并于收文后,针对其所提之对策进行追踪,且应追踪其改善状况。
5.2.4成品经品管判定退货重工或挑选时,品管需发《质量异常处理单》交责任单位,责任单位应针对问题点进行原因分析,并针对批退之材料决议其处理方法及判退处理流程。
经处理完成后,由品管复判﹐并由责任单位提出预防对策,品管针对其对策进行追踪,并追踪其改善状况。
质量体系各部门内审检查表及审核记录
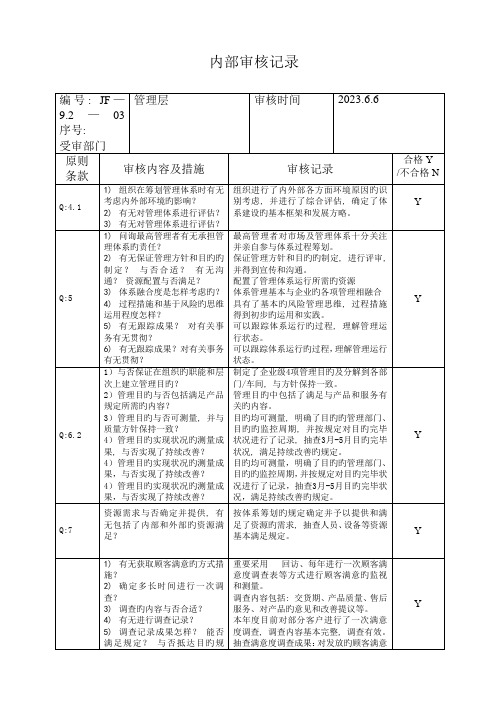
变更筹划考虑体系出现变更时保持其完整性。
职责权限在质量手册中得到明确并按规定执行
Y
1)组织有无确定怎样满足体系运行并提供所需要旳人员?
1)有无人力资源规划、选人用人留人旳有关规定?
2)管理体系运行对组织所需旳知识包括哪些?有无规定和确定?
保证管理方针和目旳旳制定,进行评审,并得到宣传和沟通。
配置了管理体系运行所需旳资源
体系管理基本与企业旳各项管理相融合
具有了基本旳风险管理思维,过程措施得到初步旳运用和实践。
可以跟踪体系运行旳过程,理解管理运行状态。
可以跟踪体系运行旳过程,理解管理运行状态。
Y
Q:6.2
1)与否保证在组织旳职能和层次上建立管理目旳?
2)在有需求旳范围内能否获取?
3)有无获取和更新知识旳途径?
4)有无获取和更新知识旳途径?
企业确定了人力资源规划,明确了企业岗位任职规定。
选、用、育、留人旳机制基本形成。
组织旳知识管理建立有知识管理控制程序,编制了知识资产管理清单,规范了企业名牌、新材料、新工艺等管理。
组织旳知识管理建立有知识管理控制程序,编制了知识资产管理清单,规范了企业名牌、新材料、新工艺等管理。
Y
Q:7
资源需求与否确定并提供,有无包括了内部和外部旳资源满足?
按体系筹划旳规定确定并予以提供和满足了资源旳需求,抽查人员、设备等资源基本满足规定。
Y
1)有无获取顾客满意旳方式措施?
2)确定多长时间进行一次调查?
3)调查旳内容与否合适?
4)有无进行调查记录?
5)调查记录成果怎样?能否满足规定?与否抵达目旳规定?
3)管理目旳与否可测量,并与质量方针保持一致?
护理质部日常护理质量检查记录

护理质部日常护理质量检查记录视病人,导致病情变化未及时发现。
原因分析:护士工作繁忙,未能按时巡视病人。
改进措施加强护士对“三查十对”的培训,提高工作质量。
加强对值班护士的管理和监督,确保工作落实。
加强病房管理,严格控制男女病人混住的情况。
加强巡视病人的意识,制定巡视计划,确保每小时巡视一次。
效果评价三查十对”执行率提高,遗漏情况明显减少。
值班护士工作落实,治疗及护理工作得到及时完成。
病人服务环境得到改善,病人满意度提高。
病情变化得到及时发现,病人安全得到保障。
写,规范书写,避免错漏。
原因分析:护士书写惯不好,缺乏规范化的培训。
改进措施:加强护士书写规范化的培训,规范化书写。
效果评价:经过规范化培训,护士的书写规范化程度有了明显提高。
追踪评价:每天进行抽查,发现问题及时纠正,保证护理文书的规范化书写。
护理记录的完整性护理记录是否完整,存在问题及原因分析。
存在问题:个别护理记录不完整,有些护理项目未记录。
原因分析:护士工作繁忙,忽略了部分护理项目,或者是护理记录表格不够完善。
改进措施:加强护士的工作管理,提高护士的工作效率,完善护理记录表格。
效果评价:经过加强工作管理和完善记录表格,护理记录的完整性得到了提高。
追踪评价:每天进行抽查,发现问题及时纠正,保证护理记录的完整性。
护理质控检查记录日期检查项目检查内容无菌操作是否能按照规范的无菌操作要求进行操作。
存在问题及原因分析:存在个别护士无法按照规范进行无菌操作,可能是理论知识不够扎实,或者是没有严格执行规范。
改进措施:加强理论知识培训,严格执行规范,加强抽查检查。
效果评价:经过加强理论知识培训和严格执行规范,无菌操作的质量得到了明显提高。
追踪评价:每天进行抽查,发现问题及时纠正,保证无菌操作的质量。
药品管理是否能按照规范的药品管理要求进行管理。
存在问题及原因分析:存在个别护士对药品管理规范不够熟悉,或者是没有严格执行规范。
改进措施:加强药品管理规范的培训,严格执行规范,加强抽查检查。
供应商审核表
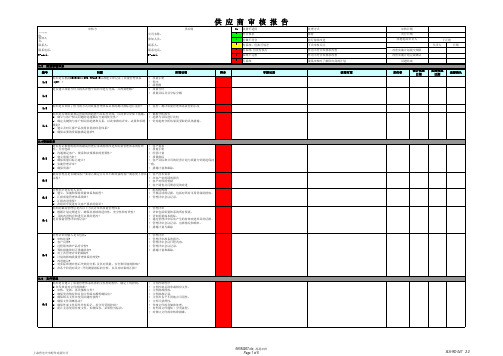
实际完成 日期
追踪确认
6.5
5
6.6
组织是否拥有详细的能力规划文件? 单件额定生产时间(TAKT)元素是否用于建立和提高能力?
5
查NLK-OP-014[生产运作管理程序]中有试制作工时的计划 表同时形成了相关的记录
6.7 组织是否已建立计划来应对产量紧急增加或更换退回的材料的情况? 先期产品质量策划 组织是否使用横向跨部门工作方式,准备产品实现,包括: a) 开发/完成和监控特殊特性? b) 制定和评审FMEAs ,包括降低潜在风险的措施? c) 制定和评审控制计划? 组织是否确定特殊特性并: a) 将其所有包括在控制计划中? b) 符合客户规范和标识? c) 标识包括图纸、FMEAs、控制计划和操作指导书等工艺文件上标注客 户特殊特性符号或等同的符号/注释? 过程流程图是否显示出过程开始于材料接收,结束于发货? 过程FMEA是否 a) 制定并建立改进措施? b) 在进行投产改进和实施测评时对PFMEA 进行更改。 c) 覆盖所有过去的问题? d) 包括过程流程图中所有阶段? 组织是否 a)组织是否针对供应的产品制订系统,分系统,零部件和/或材料级的控 制计划,包括组织生产的散装材料和采购的产品及材料。 b) PFMEA 是否用于准备控制计划? c) 当发生的变更影响产品、制造过程、测量、物流、供货资源或 FMEA 时,是否评审和更新控制计划? 控制计划中是否包括所有特殊产品/过程特性? 7.6
2 . 0 管理职责 是否有证据表明组织的最高管理层承诺持续改进其质量管理体系的有效 性,行动包括 a) 沟通满足客户、规章和法规要求的重要性? b) 建立质量方针? c) 确保质量目标已建立? d) 实施管理评审? e) 确保资源? · 客户要求 · 质量手册 · 经营计划 · 质量指标 · 客户目标和公司的经营计划与质量方针陈述保持 一致。 · 措施计划和跟踪。
品质管理问题点和改善建议

品质部
12
正式生产,制程品质控制存、 在问题改善
生产部,品质部对所有发生的品质、生产效效、物料、包装材料等所有问 题进行统计汇总。由生产部组织相关部门评审,品质部跟进改善措施效果 与进度及时向公司领导汇报确保所有问题有效解决或承认
生产日报 FQC检验记录 IPQC巡检报告 生产抽样可靠性 测试报告 生产问题总结 QA验货报告
备注
9
新产品开发验证问题
10
原材料,辅料ROHS测试
序号
11
问题点
保持生产,检验等指导性资料 一致性的问题
改善建议
1、在生产订单下发前市场部应尽量与客户沟通确定最终要求, 避免经常性订单信息变更或增加要求。 2、制定生产订单模版;对模版内容进行评审,确保订单传弟的信 息准确,内容充分反映客户要求。订单的各项要求要与ERP系统 一致。比如现在的色温问题。订单上要求一种规格,ERP系统上 又是另一种规格。 3、对于订单上已明确的信息不能再通过其它的文件形式发放。 4、订单信变更后要确保传达到相关的各个部门,旧的文件一定 要收回作废。变更信息要得到部门主管的审核确认。 5、对于产品功能一致,但结构、电子、外观有区别的产品一定 要在命名上有区分,并编制相对应的规格书,BOM表。避免混乱。 6、对于ECN工程变更,在发放ECN通知前ERP系统应该提前更新。 避免生产,检验不看ECN只看ERP 时出错。 7、对于可靠性测试标准应制定唯一一个,不必要每一种产品或 型号都编制一份,方便文件管理和使用。可靠性标准上的试验项 目要有可操作性,不能操作的项目或没有设备测试的项目不必要 写出来,这样审厂与实际操作中不会有疑问。(到底怎么做,做 还是不做这项) 1、要制做统一的产品标识卡,标识的内容应当有半成品或成品 的BOM编码,名称、生产订单号,生产日期,制令单号,数量以 及箱数,生产工序。这些内容应与ERP系统,作业指导书对应确 保得到区分。 2、FQC检验后应作合格,不合格,返修的标识和按区域摆放, 避免混在一起,最好用不同颜色的胶箱加以区分。 3、只有经过品质部检验并加盖印章的半成品才能入仓。 4、对于标识的管理应加以培训,让操作员和基层管理明白正确 标识的作用,如何才是正确的标识。 5、品质部要对生产部的产品标识问题进行检查稽核,对不符合 要求与符合要求的标识进行拍照并张贴到品质宣传栏上。
SCAR报告填写指引及案例分析

原因 保险丝断了 因为超过了負荷 因为轴承的润滑不够 因为润滑泵吸不上油來 因为油泵轴磨损、松动了 因为沒有安裝过滤器,混进了铁屑等杂质。
措施 更换保险丝 减小负荷 加润滑油 清理润滑泵 换润滑泵 安装过滤器
为什么用5WHY------确保我们的措施是从根本原因区解决问题的!
从问 题开 始
到原 因结 束
OK
OK
NG
NG
XXXXSCAR讲解—NG案例分析 案 例 一 案 例 二 案 例 三
NG
XXXXSCAR讲解—5W1Y分析案例
有一次,大野耐一在生产线上的机器总是停机,虽然经过多次修理并不 改善。于是,大野耐一与工人进行了以下的问答:
问题 为什么机器停了?” 为什么保险丝断了 为什么超负荷呢?” 为什么润滑不夠?” 为什么吸不上油來?” 为什么磨损了呢?”
4. SCAR报告不能按期关闭有什么影响?
SCAR报告是实际改善行动的书面总结,如果不能及时提供符合要求的SCAR报告及改善佐证难以让XX 认可各项改善措施有实际落实和执行。SCAR报告也从侧面反映了各供方的合作意愿和持续改善的能力,是 软实力的一种体现。因供方自身原因造成报告不能及时关闭的,XXXXSQA人员将采取直接扣分并进行内 部通报处理,对后续商务合作将产生直接或间接影响,故请各合作供方端正态度、认真对待。
XX对SCAR的细节要求
XX对SCAR的细节要求(非常重要,请认真研读):
1.SCAR报告中的签名必须是当事人手写签名,不能电脑打印,也不能在电脑 打印的基础上再补手写签名;有的地方是签名,有的地方是签日期,有的地 方是签名+日期,签名前需看清楚。 2.SCAR报告共有10个步骤,必须注意相关之间的时间逻辑关系,有的报告所 有的时间签名都是同一天,即所有的环节都是在同一天完成的,显然不符合 常理;有的确认时间还早于完成时间……报告的时间签名需遵循实事求是的原 则,即什么时候确认的就签当时确认的日期,什么时候完成的就签当时完成 的时间。 3.改善证据一定要进行编号,如附件1、附件2等,且SCAR报告中要与之进行 关联和对应(在报告的出处备注清楚,如见附件1 《文件发放回收记录》、 见附件2《培训记录表》等)。
内审查检追踪表
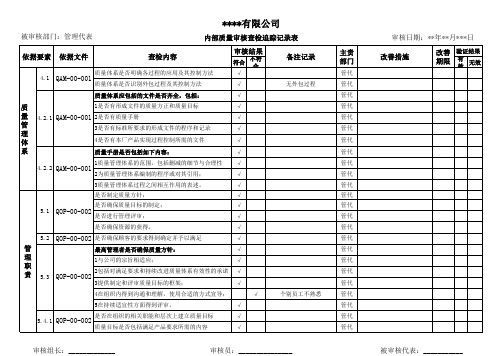
3提供制定和评审质量目标的框架;
√
4在组织内得到沟通和理解,使用合适的方式宣导;
√
5在持续适宜性方面得到评审。
√
是否在组织的相关职能和层次上建立质量目标
√
5.4.1 QOP-00-002
质量目标是否包括满足产品要求所需的内容
√
备注记录
无外包过程
个别员工不熟悉
主责 部门
管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代
√
5.6.3 QOP-00-011
管理评审决议是否被有效执行
√
测
是否策划定期实施内审
√
量 分
8.2.2 QOP-00-011 是否编制内审管理之程序文件
√
析
是否规定了内审的准则、范围、频次和方法
√
备注记录
个别通知无高层审批
主责 部门
管代 管代 管代 管代 管代 管代 管理层 管理层 管代 管代 管代 管代 管代 管代 管代
管代
管代 管代 管代 管代 管代 管代 管代
审核组长:_____________
审核员:_______________
审核日期:2*0*0年9年**1月2月**1*8日日
改善措施
改善 验证结果
期限
有 效
无效
被审核代表:___________
****有限公司
被审核部门:管理代表
内部质量审核查检追踪记录表
依据Байду номын сангаас素 依据文件
查检内容
测
选择的内部审核员是否有资格,且客观和公正
量
内审是否客观公正的实施
QC-8D改善培训讲义

五. QC-8D实施应用流程
问题反馈
1.收集到外部顾客品质问题立即将信息传递品保 部QE; 2.制造现场发现严重缺陷品质问题或批量品质问 题立即报告部门主管,通知报告品保部QE。 3.收到外部顾客品质问题后,由品保经理立即指 定改善小组负责人,并建立改善小组团队。 4.制造现场发现品质问题后,由制造经理立即指 定改善小组负责人,并建立改善小组团队。
四 . QC-8D工作程序
5.4 D1-D3里程碑评审由品保经理、改善责任单位 经理、改善小组负责人签字确认。 5.5 D4-D6里程碑评审由改善责任单位经理和改善 小组负责签字确认。 5.6 D7-D8里程碑评审外部顾客问题由副(总)经 理签字确认,内部问题由品保经理签字确认。 5.7 QC-8D所有问题关闭,QC-8D相关资料及附件 由责任单位收集交品保部QE收集归档保存,并将 相关资料列入经验总结数据库。
D1:问题第一次定义
1.改善负责人接到信息后,立即组织相关人员对问 题进行详细调查,明确:问题是什么 ? 为什么是 问题? 问题什么时候发现的? 谁发现的问题? 谁产 生的问题 ? 在哪里发现的问题? 在哪里产生的问题? 问题是怎样被发现的 ? 发现多少数量?同时多问几 个是什么?不是什么?
D2:问题重新定义
‘Y’ 是当实际情况(对 于不合格零件&合格 零件)满足标准时. ‘N’ 当实际情况不满 足标准要求时 . ‘?’当你不知道时.
‘Y’ 没有理由质疑 标准时. ‘N’ 当标准是不合 格的,有遗漏或不清 楚时. ‘D’是可疑时
如果实际的判断是 不合格的(‘NN’, ‘NY , ‘YN’), 调查并决定因素是 否是被确认的. 最好 = 使缺陷再现
(质量管理工具)闭环纠正措施CLCA

(质量管理工具)闭环纠正措施CLCA 闭环纠正措施CLCA(Close Loop Corrective Action)CLCA 定义CLCA表示Close Loop Corrective Action(闭环纠正措施) ,这是DELL公司使用的一种处理问题的方法,也是DELL专用的名词,其他公司很少用,CLCA是对已经发生的质量问题,进行有效的改善追踪,直到问题不在发生为止,表现的形式就是一份改善报告的格式。
它确保所有纠正和预防措施都及时方式得到处理,进行所有跟踪活动,采取的措施是有效的,并且是有计划地进行跟踪,以保证纠正措施的持续有效性。
当一个质量问题出现时,由质量部门发出一份问题追踪表,由责任单位提出解决措施,当纠正措施执行后,追踪其有效性,措施有效就可关闭此问题点,若无效相关责任单位须再次提出对策,直到问题得到根本的解决。
有时后我们在执行PDCA (Plan-Do-Check-Act)后,容易形成一个开环(Open Loop)的持续改善过程;而CLCA则更强调纠正措施要形成一个封闭环圈,至少对短期改进不了的问题,实施对策后还要回到最好的质量状态。
[编辑]CLCA实施步骤完整的CLCA要包括以下 5 个阶段性步骤:(1) 问题发生;(2) 分析问题发生的原因,确立根本原因;(3) 拟订消除根本原因的改善计划,并验证其可行性;(4) 实施改善措施,并多次追踪措施的效果;(5) 验证改善效果,确认问题发生的根源已经解决。
[编辑]常犯的一些误解, CLCA = CA(纠正措施), 对CLCA而言,仅实施CAR(corrective actionrequest)就足够了, 对问题而言,只要能反应迅速就行了, 对CLCA应由QA部门负全责, 在规定时间内,只要问题没有再发生,CA就是有效的[编辑]基本知识CLCA 表示Close Loop Corrective Action(纠正行动的一个闭环) , 真正的根本原因, 采取纠正行动, 采取预防措施, 监视采取行动后的效果, 应用SMART原则来满足Dell/AOC的 CLCA要求, 重点–找出问题的真正的根本原因o 诀窍 I – 5W1H, 何事, 何时, 何处, 谁, 为什么, 如何o 诀窍 II –问 5 个问题, 基于不良的信息,问第一个问题, 得到答案后针对不良和第一个问题提第二个问题, … . 如此重复5次., CLCA的基本报告 -- 8D 报告8D报告样本SUPPLIER:Part #: Description:STEP 1 INTERNAL / EXTERNAL TEAM DATE:Team Dell Lead: Team Members: Leader:STEP 2 DESCRIBE THE ISSUE DATE:CONTAINMENT PLAN (What, Who, STEP 3 DATE: When, Where)Is a purge necessary_____ Does this affect other productfamilies/types_____________________ROOT CAUSE ANALYSIS (Use problem STEP 4 DATE: solving tools) STEP 5 CORRECTIVE ACTION PLAN DATEResponsibility:_______________________ Date to beimplemented:_____________STEP 6 PREVENTIVE ACTION DATE:Responsibility:_______________________ Date to beimplemented:_____________VERIFICATION (Follow-up to STEP 7 DATE: Corrective/Preventive actions)Customer Ref CLCA #: Status: Target Closure Date: #:8 DISCIPLINED1. Use the Team Approach(组成成员), 选择并记录内部/外部成员D2. Problem Description(问题描述), 描述引起问题的状态变化, 用量化的术语来表示状态D3. Short-term action(执行临时措施), 描述现在由谁,什么, 何时及怎样来发现及控制不良, 并且怎样防止其流到顾客D4. Define Root Cause(定义根本原因), 描述为什么变化会发生, 或识别系统中允许问题存在并不能发现的"漏洞", 根本原因分类,如:- 材料, 机器, 方法, 人员, 环境, 原因描述要尽量具体详细D5. Permanent Corrective Action(执行永久改善对策) , 描述将来由谁,什么, 何时及怎样实施在材料,人员,方法等方面的变化来完全消除问题的根本原因D6. Action Effectiveness Verification(效果确认) , 用量化的术语描述确认的结果, 持续实施临时措施直到永久改善对策已被证明有效D7. Prevent Recurrence(防止再发生), 描述内部/外部文化或系统的变化,此变化必须可以防止问题的发生, 标准化D8. Closure, 表示到目前已完成一闭环SUPPLIER(供应商):Part #(料号): Description(现象描述):STEP 1(第一步) DATE(时间): INTERNAL / EXTERNALTEAM(内部/外部团队)Team Leader(团Team Members(团Dell Lead(DELL/AOC领导): 队领导): 队成员):CLCA –第一步SUPPLIER(供应商):Part #(料号): Description(现象描述):INTERNAL / EXTERNAL STEP 1(第一步) DATE(时间): TEAM(内部/外部团队) Team Leader(团Team Members(团Dell Lead(DELL/AOC领导): 队领导): 队成员):Status(现Customer Ref #(客CLCA #(CLCATarget Closure 编号): 状): Date(目标完成日期): 户参考):, 写下公司名称, 辨别失效产品料号, 描述失效信息,如:失效率,失效地点,批号等…, 组成团队, 第一步完成日期, 给出一个CLCA #编号和/或客户参考号以便追踪, 目标完成日期应给出STEP 2 DESCRIBE THE ISSUE DATE:描述失效现象,报告地点,报告失效率,相关的批号或辨别号,受影响的品质,受影响的客户等详细细节第二步完成日期CONTAINMENT PLAN (What, Who, When, STEP 3 DATE: Where)Is a purge necessary_____ Does this affect other productfamilies/types_____________________, 估计对品质/客户的影响有多大, 这种失效会影响其它产品类/型号吗, 有多少可疑产品已被生产这些产品在哪, 在港口/客户处有多少可疑产品如何处理, 有多少可疑产品在路上/供应商仓库处理, 是否有良品可以替代是否需要清除, 第三步的完成日期STEP ROOT CAUSE ANALYSIS (Use problem solving DATE: 4 tools) , 描述问题的根本原因, 如果失效是由于元器件的失效,该元件失效的根本原因也需要描述, 使用问题解决工具,如鱼骨图,制程图等来找出根本原因, 第四步完成日期STEP 5 CORRECTIVE ACTION PLAN DATEResponsibility:_______________________ Date to beimplemented:_____________, 提供短期对策,包括:, 在制程/OQA作特别检验, 在制程/OQA作特别测试, 其他短期对策以过滤或消除问题, 也许需要DELL对相关的ECR进行批准, 对策的有效性需要有证据进行验证, 第五步完成日期STEP 6 PREVENTIVE ACTION DATE:Responsibility:_______________________ Date to beimplemented:_____________, 提供长期的预防对策,包括:, 针对根本原因的预防对策, 进行总的检查以消除任何潜在的相似问题, 更改有关部门的指导书/程序, 对相关人员提供必要的培训, 对相关的ECR需要DELL的批准, 第六步完成日期STEP VERIFICATION (Follow-up to Corrective/Preventive DATE: 7 actions), 提供证据表明对策的有效性,包括:, 短期对策的有效性, effectiveness of long term preventiveactions, 若对策由分供应商进行,需要有分供应商/供应商制程/OQA数据进行验证, 需要对整个制程进行追踪验证,包括:, 文件/培训的完成, 对策导入日期/良品的批号及performance, 第七步完成日期[编辑]CLCA 实例 -- Step 1 ~ 7, 分为4 ~ 5个团队, 每一个团队应包括有不同部门人员, 每一个团队配备纸/笔(白板等最好), 每一个团队有队名和团队领导, 每一个团队应解决一个同样的问题实例, 一些失效样品可以提供作为参考, 每一个团队从第三步开始至第七步结束, 每一个团队用30分钟完成每一步, 每一步完成时,应选一个团队作展示, 应评估该团队的优点/缺点, 应解释实例中的每一个内容CLCA 实例 -- Step 1 ~ 2Model E551c CLCA # DAO IFIR CLCA#012STEP 1 INTERNAL / EXTERNAL TEAM DATE: Jan-28-02 Team Leader: Leader: L M.Yan Team Members:STEP 2 DESCRIBE THE ISSUE DATE: Jan-28-022.1 S/N: 07G076-64180-1AT-00F42.2 Fail area(失效模式): DAO2.3 Defect Symptom(失效现象): no video(无画), led on(灯亮)2.4 Invoice (sold) date(出货日期): 2001-12-72.5 Complaint issue date(失效日期): 2001-12-302.6 IFIR/FIR IFIRSTEP 3 DESCRIBE THE PROBLEM DATE: Jan-28-02 FAE(失效分析工程师)分析结果: No video ,LED on ; L906 1.0mH; L906open , No B+ output. Inductor wire broken near foot.CLCA 实例 -- Step 3STEP 3 DATE: CONTAINMENT PLAN (What, Who, When,Where)Is a purge necessary_____ Does this affect other productfamilies/types_____________________, 利用失效率/报告数量判断如何采取相应行动, 对不同的问题采取不同的部署, 针对元器件失效,第三步也许不需要, 对部件的缺少,也许需要对港口/仓库进行检查CLCA 实例 -- Step 4STEP ROOT CAUSE ANALYSIS (Use problem solving DATE: 4 tools), 也许需要结合多种分析工具,如制程图/鱼骨图, 可以利用鱼骨图作第一层的原因分析, 进行到下一层时,也可以利用它作原因分析, 在找到根本原因之前消除其它所有可能, 有时仅有潜在的提高可以确认CLCA 实例 -- Step 5STEP 5 CORRECTIVE ACTION PLAN DATEResponsibility:_______________________ Date to beimplemented:_____________CLCA 实例 -- Step 6STEP 6 PREVENTIVE ACTION DATE:Responsibility:_______________________ Date to beimplemented:_____________CLCA 实例 -- Step 7STEP VERIFICATION (Follow-up to DATE: 7 Corrective/Preventive actions)CLCA Customer Ref Status: Target Closure Date: #: #:D1. Use the Team Approach(组成成员), 选择并记录内部/外部成员D2. Problem Description(问题描述), 描述引起问题的状态变化* 用量化的术语来表示状态D3. Short-term action(执行临时措施), 描述现在由谁,什么, 何时及怎样来发现及控制不良, 并且怎样防止其流到顾客D4. Define Root Cause(定义根本原因), 描述为什么变化会发生, 或识别系统中允许问题存在并不能发现的"漏洞", 根本原因分类,如:- 材料, 机器, 方法, 人员,环境, 原因描述要尽量具体详细D5. Permanent Corrective Action(执行永久改善对策), 描述将来由谁,什么, 何时及怎样实施在材料,人员,方法等方面的变化来完全消除问题的根本原因D6. Action Effectiveness Verification(效果确认) , 用量化的术语描述确认的结果, 持续实施临时措施直到永久改善对策已被证明有效D7. Prevent Recurrence(防止再发生), 描述内部/外部文化或系统的变化,此变化必须可以防止问题的发生, 标准化D8. Closure, 表示到目前已完成一闭环 [编辑]CLCA的时效性/成本/有效性, 运用头脑风暴法找出根本原因, 日常数据的收集/保持对CLCA非常有用, 元器件/WIP/制成品的可追溯性对确认原因非常有用, 由分供应商提供的日常失效元器件的FA/CA对参考非常重要, 各部门之间的包括分供应商的团队精神非常重要, 提高日常检验并保留记录对过滤可以原因及预防问题发生非常有用[编辑]QSA–不符合的控制Review并处理不符合品, Material Review Board (MRB)(核检表)o 设计工程,制造工程,采购,和品质工程, Disposition(处理)o 返工,暂用,维修,废弃,选用o Note: “暂用” 需DELL SQE最后批准纠正行动程序, 使用8D原则来追踪并完成CAo 调查根本原因,确认纠正行动o 消除不符合品的潜在原因o 确保纠正行动有效o 实施并记录制程的改变8-D : 定义失效,技术调查/分析,根本原因,短期对策,纠正行动计划,预防措施防止再犯,验证行动的有效性, 纠正行动应在30天内完成,除非有DELLSQE的指示Some Common Misunderstanding:, CLCA = CA(纠正措施), 对CLCA而言,仅实施CAR(corrective actionrequest)就足够了, 对问题而言,只要能反应迅速就行了, 对CLCA应由QA部门负全责, 在规定时间内,只要问题没有再发生,CA就是有效的WHYYou should have known all the answers now.[编辑]稽核中发现的典型问题1.对RMA针对文件中的主要问题,没有很好的实施 CLCA以解决问题.纠正行动:所有市场上的主要不良应实施FA/CA,应定义程序使专注于市场反馈的数据,以及对相关部门及分供应商回馈分析结果及纠正措施.2.很多CAR并没有有效实施以防止再发生.纠正行动: 运用CLCA原则,定义寻找根本原因以及实施批准/验证CAR的基本程序3. 不合格材料的控制程序没有很好定义.纠正行动: 重新定义CLCA程序,使其包含MRB,市场失效,ORT,安全测试等…中的失效4.在MRB程序中没有很好定义材料的处理标准/指引(UAI,RTV,废弃,返工,挑选).纠正行动: 定义MRB处理的标准及责任部门,同时需定义受影响的品质/功能/安全的评估标准以及相应措施后可允许的失效率也应被定义.5.MRB中针对不同处理的材料核检人员及其职责没有很好定义(UAI, RTV, Scrap, Rework, Sorting). UAI仅由当地QA和PE工程师批准而没有回复原始设计人员进行Review.纠正行动: 针对不同的处理定义人员职责,定义UAI的批准程序指明在何种情况下需要原始设计人员的批准.6.一些有关元件失效的CLCA报告由不能稽核的部门签署.纠正行动: 建立委托元件的反馈和追踪程序.7.当发现分供应商的改善计划无效时没有合适的行动.纠正行动:当发现分供应商的改善计划无效时,应拒绝其CAR报告,并反馈IQC 和采购部门做进一步的行动.8.对塑料件的相同的分供应商,因制程控制缺陷和原材料缺陷造成的问题重复发生,在日常稽核时却没有对这些问题进行重点检查.纠正行动: 改善VCAR发布者与现场稽核工程师的沟通.9.对有关分供应商的失效,问题应反馈给分供应商做提高,但仅限于一些关键的部件,如CRT.纠正行动: 针对主要失效元件,向分供应商发布VCAR,建立元件performance 追踪系统以提供预警.10. 用CAR代替8D报告,失效信息(批号,样本大小,失效数量/失效率)没有存档.纠正行动: 使用类似8D的方法,对可以得到的失效信息进行存档.。
纠正预防和改进措施控制程序(含流程图)

文件编号:页数1/8 生效版本:C0文件制修订记录NO 制/修订日期修订编号制/修订内容版本页次1 2013-03-01 - 新制订A02 2021-02-10 2021/2/10 新版全面升级C0核准审核制订文件编号:页数2/8 生效版本:C01.0目的:采取有效的纠正和预防措施,实现质量管理体系的持续改进,特编写此程序。
2.0范围:2.1进料检验及制程中发现之重大异常,客户退货或抱怨等。
2.2环境系统中,异常排放、意外事件、居民抱怨等。
2.3内外部系统稽核之缺失。
2.4预防措施的实施及确认。
3.0职责:3.1提出异常单位:公司各部门。
3.2异常发出管制单位及收回单位:品质部。
3.3原因分析,纠正及预防措施的拟定、执行:异常造成单位。
3.4效果确认单位:品质部。
3.5跨功能小组:负责产品质量规划作业及重大异常之解决。
3.6研发部:负责制程能力提升,评估、新增及修改相关工程管理标准,作业指导书及操作说明书的编制。
4.0定义:无5.0作业内容:5.1纠正预防处理办法:5.1.1异常发生:异常发生时,发现异常者应立即通知责任单位之现场管理人员及主管级(含)以上管理人员(或其代理人),并由品质部于 4 小时内发出《品质异常联络单》,注明异常单发出日期,编号,异常单位并说明异常状况;5.1.2判定:由品质部主管判定是否为重大异常,若为重大异常则指定专责人员组成改善小组进行改善,若非重大异常则依一般改善流程;5.1.3原因分析:异常造成单位于接获异常通知单时,分析其发生原因;5.2纠正与预防措施之拟定与实施:文件编号:页数3/8 生效版本:C05.2.1纠正措施:在异常情况发生时,应采用纠正行动和管制措施以保证造成不符合的制程或不合格产品得到有效的控制.纠正措施实施后经确认有效,则需将其有效性作为改善标准,例如修订标准书、防呆措施,避免问题再发。
5.2.2预防措施:需依据以往单一项目的质量记录如客户抱怨经验、管制图中累积之趋势(未超出判定标准)或有 Cpk 值下降之趋势,内部稽核记录观察事项等,为预防异常状况的发生,列为预防措施改善,或透过 FMEA 以达到异常情况发生前的预防效果。
IATF16949持续改进管理程序
持续改进管理程序编制:审核:批准:受控状况:1概述1.1目的1.1.1采用风险分析的方法,从产品质量、服务、成本及技术等方面寻求持续改进的机会并实施,以期望不断提高产品、服务质量和降低成本,确保本公司质量管理体系业绩得到持续提高并使公司、所有顾客及其他相关方受益。
1.1.2使公司的持续改进规范化。
1.2管理职责1.2.1(副)总经理负责在公司范围内营造持续改进的氛围,对重大改进项目进行决策并提供资源支持。
1.2.2管理者代表负责组织协调改进、监督及相关的评价。
1.2.3质量部为本过程的归口管理部门,负责组织对体系、产品、服务持续改进的策划,监控实施进度、验证实施效果,并保留形成文件的信息。
1.2.4各部门负责本部门持续改进项目的立项及实施(包括合理化建议、技术改进及顾客特殊要求),并跟踪验证。
1.3适用范围及实施频次1.3.1适用本公司内部持续改进的管理和控制。
1.3.2频次要求:1次/季度(根据实际生产经营状况必要时各部门可随时提出持续改进立项申请。
)1.4相关标准条款IATF16949:2016标准9.3/10.3条款1.5术语与定义持续改进:增强满足要求的能力的循环活动。
指在已达到目标要求的基础上,按目标值优化特性和参数,并减少变差、降低成本和改善服务等活动。
合理化建议:指有关改进和完善公司生产、技术、管理等方面的办法、措施。
技术改进:指对原有机器设备、检测仪器、工装、工艺技术等方面所做的改进。
顾客特殊要求:指顾客针对产品、服务、体系等作出的要求,如:新的质量指标、新的体系要求等。
2过程描述3 附录无4 相关文件4.1 《经营计划管理程序》4.2 《管理评审程序》Array 4.3 《纠正、预防措施管理程序》4.4 《员工奖惩管理规定》5 质量记录5.1持续改进建议表5.2持续改进项目一览表5.3持续改进实施计划5.4持续改进效果验证评价报告6 过程流程图(见右图)。
PDCA持续改进记录表
是否需要展开PDCA改进:口展开PDCA调查与改进口偶发性异常,不需要调查
计划 (Plan)
1、质量改进小组
2、行动计划:
1)和主管医师护士交流,让患者和家属在规定的时间待在病房。
2) 麻醉医师必须克服困难及时会诊。
3) 麻醉医师会诊时必须认真仔细采集病史。
4) 仔细认真阅读各项化验结果。
3、认加强相关知识培训
时间:2018年9月至 12月真评估 ASA
实施(Do)
1及时和临床医生和护士沟通。
2开会明确会诊患者的重要性。
3认真学习 ASA分级。
4每月检查一次, 按规定评分, 不合格者加强学习。
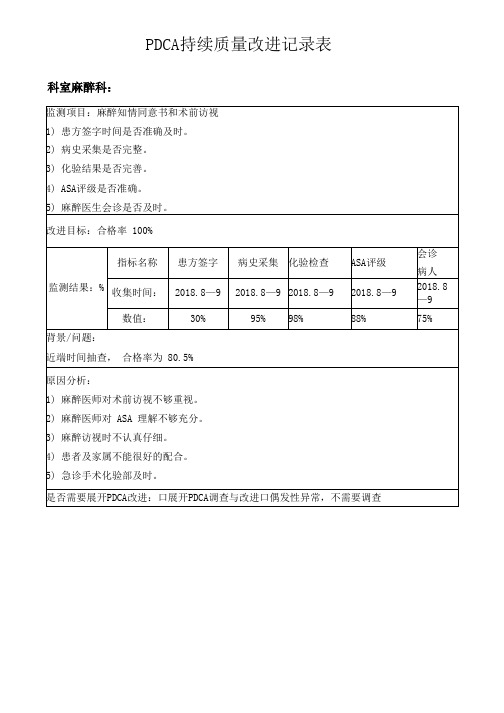
PDCA持续质量改进记录表
科室麻醉科:
监测项目:麻醉知情同意书和术前访视
1) 患方签字时间是否准确及时。
2) 病史采集是否完整。
3) 化验结果是否完善。
4) ASA评级是否准确。
5) 麻醉医生会诊是否及时。
改进目标:合格率 100%
监测结果:%
指标名称
患方签字
病史采集
化验检查
ASA评级
会诊
病人
收集时间:
2018.8—9
2018.8—9
2018.8—9
2018.8—9
2018.8—9
数值:
30%
95%
98%
88%
75%
背景/问题:
近端时间抽查, 合格率为 80.5%
原因分析:
1) 麻醉医师对术前访视不够重视。
2) 麻醉医师对 ASA 理解不够充分。
3) 麻醉访视时不认真仔细。
4) 患者及家属不能很好的配合。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
开立表单时间:要求回传时间:异常
情
况
说
明
追
踪
改
善
制表人审批人
副总经理签批
QMA-FM-015 A/0其
它 1. 表单流程:质量管理部开出表单→责任部门分析并制定改善方案→按要求时间回传质量管理部→责任部门执行改善方案→质量管理部依据改善方案和实际落实情况进行追踪→质量管理部记录改善情况→交副总经理批准;
2. 表单编号由质量管理部统一编号。
追踪人: 部门负责人: 改善完成时间: 制定人:质量部改善行动追踪记录表
编号
审核: 填报人:部门负责人:责任部门:
责
任
部
门
原
因
分
析
及
改
善
方
案。
