抗生素瓶用铝塑组合盖微生物方法验证方案2013.04.02
PTP铝箔微生物检验方法

药用PTP铝箔微生物检验方法的探讨中国包装网药品是保证人民身体健康不可缺少的必需品,为保持其质量和充分发挥其效用,必须严格控制并加强卫生管理,防止微生物污染。
由微生物污染的药品引起的感染性疾病在临床上是屡见不鲜的。
药品的污染来源是多方面的。
过去,我们在分析药品的污染时,多会从制药原料(例如原料药、水等);制造过程中的污染(例如人、空气环境、设备卫生状况等);药剂在使用和贮藏过程中的污染等方面来考虑,但却忽视了一个重要因素,那就是直接接触药品的包装材料给药品带来的污染。
药品包装用铝箔(Aluminum foils packaging for medicine)是适用固体药品(片剂、胶囊剂等)压穿式铝塑泡罩包装用铝箔,简称药用PTP铝箔,是直接接触药品的包装材料,执行国家标准GB12255 90,而该标准并未对微生物检验进行规定。
早在1995年,我厂即参照《中华人民共和国药典》1995年版二部微生物限度检查法对药用PTP铝箔进行微生物限度检查。
1998年接国家医药管理局文由我厂负责对GB12255 90进行修订。
经研讨,我们认为有必要将微生物限度检查作为药用PTP铝箔的检验项目写入国标。
因此,我们对卫生微生学物进行了深入细致的探讨和研究,提出了科学有效的药包材微生物限度检查方法。
一、检验项目的确定目前世界各国对药品或药包材微生物检查项目的确定尚无统一的规定。
在我国药品的微生物限度检查包括细菌总数的测定,霉菌和酵母菌数的测定及控制菌的检查。
细菌数是指规定单位的非规定灭菌药品制剂中污染细菌的数量,而不考虑种类,是判定药品受到细菌污染程度的标志,也是对生产单位的卫生状况进行卫生学评价的综合依据之一。
霉菌数是指规定单位非规定灭菌药品制剂中污染霉菌的活菌数量,固体制剂应报告霉菌数。
控制菌是药品中不得检出的特定微生物,控制菌除致病微生物还包括条件致病微生物。
控制菌的选定的应根据药品的治疗目的,应用部位等不同而异。
TSQB08-00 抗生素瓶用铝塑组合盖质量标准及检验操作规程

1 目的:建立抗生素瓶用铝塑组合盖的质量标准并规范抗生素瓶用铝塑组合盖检验操作。
2 范围:本规程适用于抗生素瓶用铝塑组合盖的质量检验及质量判定。
3 标准依据:《国家食品药品监督管理局国家药品包装容器(材料)标准(试行)》YBB00372003 4 内容:页脚内容14.1 类别:药用包材。
4.2 物料代码:B084.3 贮藏:密闭,干燥处保存。
4.4 质量要求:4.4.1 质量标准:注:其他项目由生产厂家进行检验,检验结果见厂家报告单。
4.4.2 规格尺寸表1 规格尺寸单位:mm页脚内容2页脚内容34.4.3 检验方法 4.4.3.1外观方法:取本品适量,在自然光线明亮处,正视目测。
4.4.3.2 凸边A)仪器与用具:游标卡尺。
B)方法:取瓶盖适量,用游标卡尺测量,精确至0.1cm 。
瓶盖铝件的凸边应不大于3%。
铝件边缘的凸边以百分率表示,按下式计算:%100%minminmax⨯-=H H H 凸边式中:maxH---为铝件外侧最大高度H---为铝件外测最小高度min4.4.3.3耐灭菌A)仪器与用具:YXQ-LS-50SⅡ立式压力蒸汽灭菌器。
B)方法:取瓶盖适量,封盖后置蒸汽灭菌器中,121℃±2℃30min(包含130℃±2℃5min),瓶盖经灭菌后塑料件能经受121℃(130℃)的蒸汽灭菌温度,无变形变色,铝件表面不应有任何明显变化。
瓶盖应不出现断裂和异常变形。
塑料件还应能短时间(最大5min)经受130℃的蒸汽灭菌温度无变形变色。
4.4.3.4规格尺寸A)仪器与用具:游标卡尺。
B)方法:用精确度为0.02mm的游标卡尺进行主要尺寸的检验。
4.5检验规则4.5.1 则规格尺寸的检验量为10个;4.5.2 规格尺寸合格率≥97.5%;4.5.3 外观质量合格率≥97%;4.5.4 凸边质量合格率≥97%。
5文件历史:无。
6附件:附件1:抗生素瓶用铝塑组合盖检验记录页脚内容4附件2:抗生素瓶用铝塑组合盖检验报告单附件1:页脚内容5抗生素瓶用铝塑组合盖检验记录R1-TSQB08-1[外观]取本品适量,在自然光线明亮处,正视目测。
抗生素铝塑瓶盖起封后消毒操作对瓶盖细菌数量的影响

护理操作情况
在以往的教科书和操作规范中,开启瓶盖后必须进行二次消毒 日常的护理工作中,一部分护士认为开启后的瓶内面是无菌的,并不需要实施消毒操作,但由
于一直没有可靠的实验数据支持,医院一直坚持消毒操作,认真执行护理操作的相关规定,按 照院内感染控制的规定来实施各项护理操作
国家相关内容
国家药品包装容器标准规定 输液的包装应按照分装→封口→灭菌→质量检查这样一个过程来完成的,也就是说,溶液是分装到瓶内
[4] (杨玉环, 蒋伟霞, 2000, 碘伏消毒剂致输液反应 7 例, 西北国防医学杂志, 21(1): 74-74)
铝塑瓶盖情况
徐寿海研究发现:现在临床上普遍使用的输液式易开式铝塑瓶盖粉针剂、袋装水剂以及瓶装水 剂等药物在生产过程中,都需按照国家相关规定使用不同方式的严格灭菌技术[5]
刘珉甬、陈泳、房丽等研究发现:在遵循这一技术的前提下,内面的瓶塞可以确保是无菌的。 临床护士在使用过程中只要严格执行无菌操作规范,打开铝塑瓶盖就不会对内面瓶塞造成微生 物污染,也不需要对瓶塞进行二次消毒。已有相关研究证明,在严格无菌操作条件下开启拉环 式输液装置后的接触面是无微生物污染的,不需要二次消毒[6]
并密封完好后才进行统一灭菌处理,然后经验收合格才能出厂投入使用 按照这一原理,只要具有检验合格证而且是在有效期内,其封口内面应该是无菌状态,且塑料瓶外的塑
料纸外包装完整、无破损,只要护士按照操作规程开启瓶盖,那么瓶塞表面就应该是无菌的
试验资料对比
本研究共纳入研究样本 300 例,其中实验组150 例,对照组 150 例 抗生素瓶存放时间,配药室空气和操作台面均保持一致,在抗生素种类、抗生素数量方面均无统 计学差异
对于铝塑瓶盖抗生素粉针剂,在无菌操作下开启后是否仍需按照要求消毒,目前相关报道较少
TSQB08-00 抗生素瓶用铝塑组合盖质量标准及检验操作规程
1 目的:建立抗生素瓶用铝塑组合盖的质量标准并规范抗生素瓶用铝塑组合盖检验操作。
2 范围:本规程适用于抗生素瓶用铝塑组合盖的质量检验及质量判定。
3 标准依据:《国家食品药品监督管理局国家药品包装容器(材料)标准 (试行)》 YBB 4 内容:4.1 类别:药用包材。
4.2 物料代码:B084.3 贮藏:密闭,干燥处保存。
4.4 质量要求:4.4.1 质量标准:注:其他项目由生产厂家进行检验,检验结果见厂家报告单。
4.4.2 规格尺寸表1 规格尺寸4.4.3 检验方法 4.4.3.1 外观方法:取本品适量,在自然光线明亮处,正视目测。
4.4.3.2 凸边A)仪器与用具:游标卡尺。
B)方法:取瓶盖适量,用游标卡尺测量,精确至0.1cm 。
瓶盖铝件的凸边应不大于3%。
铝件边缘的凸边以百分率表示,按下式计算:%100%minminmax⨯-=H H H 凸边式中:max H ---为铝件外侧最大高度minH ---为铝件外测最小高度4.4.3.3 耐灭菌A)仪器与用具:YXQ-LS-50S Ⅱ立式压力蒸汽灭菌器。
B)方法:取瓶盖适量,封盖后置蒸汽灭菌器中,121℃±2℃ 30min (包含130℃±2℃ 5min ),瓶盖经灭菌后塑料件能经受121℃(130℃)的蒸汽灭菌温度,无变形变色,铝件表面不应有任何明显变化。
瓶盖应不出现断裂和异常变形。
塑料件还应能短时间(最大5min )经受130℃的蒸汽灭菌温度无变形变色。
4.4.3.4 规格尺寸A)仪器与用具:游标卡尺。
B)方法:用精确度为0.02mm 的游标卡尺进行主要尺寸的检验。
4.5检验规则4.5.1 则规格尺寸的检验量为10个; 4.5.2 规格尺寸合格率≥97.5%; 4.5.3 外观质量合格率≥97%; 4.5.4 凸边质量合格率≥97%。
5 文件历史:无。
6 附 件:附件1:抗生素瓶用铝塑组合盖检验记录附件2:抗生素瓶用铝塑组合盖检验报告单附件1:抗生素瓶用铝塑组合盖检验记录检品名称抗生素瓶用铝塑组合盖批号T SQB06-00 3/6取本品适量,在自然光线明亮处,正视目测。
抗生素瓶用铝塑组合盖01设备工艺原理

抗生素瓶用铝塑组合盖01设备工艺原理
前言
随着科技的进步,医学领域中的抗生素瓶成为了人们生命中的重要物品。
而在抗生素瓶的生产中,组合盖是一个必不可少的部分。
本文将介绍抗生素瓶用铝塑组合盖01设备工艺原理,让大家了解铝塑组合盖的生产过程。
设备原理
铝塑组合盖是由铝箔和塑料片印刷形成的成品。
而这个过程需要通过专门的设备来完成。
在铝塑组合盖01设备中,主要包括以下几个部分:
1.铝箔装载机
2.铝箔拉伸、定位、剪切及排放机
3.塑料片装载机
4.塑料片断料、送入成型机
5.组合成品出料机
设备工艺流程
铝塑组合盖的生产工艺是一个非常复杂的过程。
下面是铝塑组合盖01设备的工艺流程:
1.铝箔装载机将铝箔从卷筒中将铝箔放入设备中。
YBB20282012抗生素瓶用铝塑组合盖
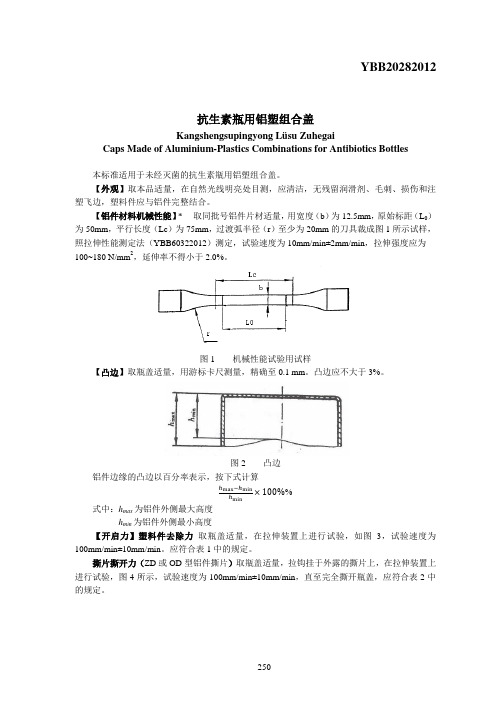
YBB20282012抗生素瓶用铝塑组合盖Kangshengsupingyong Lüsu ZuhegaiCaps Made of Aluminium-Plastics Combinations for Antibiotics Bottles本标准适用于未经灭菌的抗生素瓶用铝塑组合盖。
【外观】取本品适量,在自然光线明亮处目测,应清洁,无残留润滑剂、毛刺、损伤和注塑飞边,塑料件应与铝件完整结合。
【铝件材料机械性能】* 取同批号铝件片材适量,用宽度(b)为12.5mm,原始标距(L0)为50mm,平行长度(Lc)为75mm,过渡弧半径(r)至少为20mm的刀具裁成图1所示试样,照拉伸性能测定法(YBB60322012)测定,试验速度为10mm/min±2mm/min,拉伸强度应为100~180 N/mm2,延伸率不得小于2.0%。
图1 机械性能试验用试样【凸边】取瓶盖适量,用游标卡尺测量,精确至0.1 mm。
凸边应不大于3%。
图2 凸边铝件边缘的凸边以百分率表示,按下式计算ℎmax−ℎminℎmin×100%%式中:h max为铝件外侧最大高度h min为铝件外侧最小高度【开启力】塑料件去除力取瓶盖适量,在拉伸装置上进行试验,如图3,试验速度为100mm/min±10mm/min。
应符合表1中的规定。
撕片撕开力(ZD或OD型铝件撕片)取瓶盖适量,拉钩挂于外露的撕片上,在拉伸装置上进行试验,图4所示,试验速度为100mm/min±10mm/min,直至完全撕开瓶盖,应符合表2中的规定。
表1 开启力公称尺寸(mm)塑料件去除力最小值(N)塑料件去除力最大值(N)撕片撕开力最大值(N)13 6 25 3020 6 35 40图3 开启力图4 ZD或OD型铝件撕片撕开力测试装置【开口质量】取经开启力试验,去除塑料件的瓶盖适量,目视观察,铝件上的开口处不应受到损坏。
抗生素瓶用铝盖组合盖质量标准

目的明确抗生素瓶用铝塑组合盖质量标准,为其质量评价提供依据。
适用范围适用于公司生产技术部、质量管理部、化验室、物料部、仓库、车间等部门。
职责质量管理部对本技术标准制订、审核及执行负责。
规程目录1质量标准制订依据2经批准的供应商3规格和用途4取样及检验方法5定性和定量的限度要求6贮存条件和注意事项7复验期8附件9培训要求10文件变更历史正文1质量标准制订依据依据《国家药包材标准》YBB00372003-2015 抗生素瓶用铝塑组合盖制订。
2经批准的供应商经批准的供应商详见本公司“已批准物料采购供应商目录”现行文件。
采购人员不得向其它未经质量审计及批准的供应厂家进行采购。
3规格和用途3.1规格:20-ZB型,蓝色,物料代码 503004;13- ZB型,蓝色,物料代码 503005。
3.2用途:用于冻干粉针制剂的生产。
4取样及检验方法4.1取样件数4.1.1如在同等条件下生产出来的抗生素瓶用铝盖组合盖并于一次交付的货,可看作一个批号;如一次交付的货中有不同的生产批号或用不同批号材质制成,则每一个部分应看作一个单独批。
4.1.2当一个批号是以几个包装的形式交付的,则应按下表从一定数量包装中取样,每个包装的取样量应相接近。
4.2取样数量:从总件数中抽取100套作为该批物料的理化检验用样品,70 套作留样用。
4.3取样步骤:详见“SQC310003*物料取样程序”4.4检验方法:详见“TES 503004*抗生素瓶用铝盖组合盖检验操作规程”。
5定性和定量的限度要求注:1、厂家报告书需按质量标准及检验规则进行全检且结果符合要求;2.、质量标准中带“★”项及规格尺寸为企业进厂后每批次必检项目;3、更换生产厂家后,首批次应送样委托广东省医疗器械质量监督检验所包装材料容器检验中心进行全检。
附件一检验规则1、产品检验分为全项检验和部分检验。
2、有下列情况之一时,应按标准的要求进行全项检验。
(1)产品注册;(2)产品出现重大质量事故后重新生产;(3)监督抽验;(4)产品停产后重新恢复生产。
临床使用铝塑盖式注射剂免消毒的研究

临床使用铝塑盖式注射剂免消毒的研究目的验证临床使用铝塑盖式注射剂免消毒的客观依据。
方法生物监测与药物临床不良反应监测:①生物监测:a试验组将50份铝塑盖式注射剂瓶开启塑料盖后不进行消毒按无菌原则直接抽取瓶内液体、对照组将50份铝塑盖式注射剂瓶开启塑料盖后用碘伏消毒液消毒,待干按无菌原则抽取瓶内液体,分别进行48 h细菌培养;b试验组将铝塑盖式注射剂瓶开启塑料盖后不消毒与对照组消毒后待干两种方法各50份,分别用无菌棉签蘸无菌生理盐水涂抹瓶口塑料部分数次,放入无菌试管中,回实验室接种平板,将培养皿至37°恒温培养48 h,计算菌落数;②临床药物不良反应监测:对比2014年使用铝塑盖式注射剂瓶启封后进行消毒与2015年使用铝塑盖式注射剂瓶启封后不进行消毒的药物不良反应病例报告。
结果实验a和实验b中的试验组与对照组均无细菌生长,2014年与2015年2年的注射剂用药不良反应报告病例数无统计学意义。
标签:临床使用;铝塑盖式注射剂;免消毒;研究有文獻报道塑料瓶盖液体不需要常规消毒[1],而在输液操作过程中,按操作规程,开启输液瓶盖后要常规用碘伏消毒液消毒瓶塞[2],待消毒液干后再进行药液配制,2012年护理部查房时发现护士配铝塑盖式注射剂的药时也不消毒瓶口,直接加药和输液。
护理部将此情况向院感科汇报,院感科立即进行相关资料查询,医院院感科做出规定除塑料瓶盖液体不需要常规消毒外,其它工艺的注射用药一律常规消毒后使用。
2014年院感科开始用生物监测法来验证铝塑盖式注射剂免消毒的客观依据,得到有力的证据之后,院感科在2015年开始允许护士使用铝塑盖式注射药可以不消毒瓶口。
并将2014年和2015年的临床注射用药不良反应病例监测进行比较,结果不消毒与消毒的临床不良反应的病例数无统计学意义。
现将研究结果报道如下。
1 资料与方法1.1材料铝塑盖式盐酸氨溴索葡萄糖注射液100 ml(生产厂家:安徽双鹤药业有限责任公司,批号:131223,数量100瓶)2 ml一次性无菌注射器(生产厂家:江西庐乐医疗器械集团有限公司,批号:20130626,数量:100支)碘消毒液(生产厂家:江西草珊瑚消毒用品有限公司批号:20140102),一次性使用培养皿(泰兴市古溪玻璃仪器厂生产);营养琼脂培养基(宜兴市永信生物有限公司生产)高压灭菌后备用;隔水式电热恒温培养箱(上海跃进医用光学器械厂)。
SOP-QC-4104-01 抗生素瓶用铝塑组合盖检验标准操作规程

题目:抗生素瓶用铝塑组合盖检验标准操作规程文件编号:SOP-QC-4104-011 目的:制定抗生素瓶用铝塑组合盖的检验操作规程,确保检验按规范进行。
2 范围:适用于抗生素瓶用铝塑组合盖的检验。
3 引用标准:国家药用包装容器(材料)标准YBB00372003与双方约定尺寸标准;本规程所引用的文件未注明版本号均为现行有效版本。
4 责任者:检验人员对本规程的实施负责。
5 规程:5.1外观取本品适量(按取样规则所取的样品),在自然光线明亮处,正视目测:5.1.1 瓶盖应清洁,无残留润滑剂、毛刺、损伤和注塑飞边。
5.1.2 塑料件应与铝件完整结合。
5.2开口质量5.2.1去除塑料件后,铝件的开口处不应受到损坏。
5.3 配合性5.3.1 取瓶盖在相应的瓶子上,(含胶塞)用扎盖器扎盖,应配合适宜。
5.4 耐蒸气灭菌5.4.1 蒸气灭菌过程饱和蒸汽处理:加热121±2℃,保持时间30min。
5.4.2 瓶盖经蒸气灭菌后,塑料件应无变形、变色,铝件表面不应有任何明显的变化。
5.5 涂层牢固度铝盖(外表面有涂层)经过4.3项下蒸气灭菌试验后,去除塑料件,用浸有80%(V/V) 乙醇溶液的脱脂棉擦拭表面30秒,再用浸有70%(V/V)异丙醇溶液的脱脂棉擦拭表面,涂层应无任何涂层磨损的迹象。
5.6 规格尺寸:取本品20个,按用0.01㎜精度的游标卡尺测定铝盖内径、铝盖内题目:抗生素瓶用铝塑组合盖检验标准操作规程文件编号:SOP-QC-4104-01高度、组合高度、材料厚度,、铝盖外径、塑盖高度、组合盖高度,均应符合规定。
瓶盖尺寸(单位:mm)题目:抗生素瓶用铝塑组合盖检验标准操作规程文件编号:SOP-QC-4104-015.4 本规程使用的相关记录:5.5 变更历史。
PTP铝箔微生物检验方法

药用PTP铝箔微生物检验方法的探讨中国包装网药品是保证人民身体健康不可缺少的必需品,为保持其质量和充分发挥其效用,必须严格控制并加强卫生管理,防止微生物污染。
由微生物污染的药品引起的感染性疾病在临床上是屡见不鲜的。
药品的污染来源是多方面的。
过去,我们在分析药品的污染时,多会从制药原料(例如原料药、水等);制造过程中的污染(例如人、空气环境、设备卫生状况等);药剂在使用和贮藏过程中的污染等方面来考虑,但却忽视了一个重要因素,那就是直接接触药品的包装材料给药品带来的污染。
药品包装用铝箔(Aluminum foils packaging for medicine)是适用固体药品(片剂、胶囊剂等)压穿式铝塑泡罩包装用铝箔,简称药用PTP铝箔,是直接接触药品的包装材料,执行国家标准GB12255 90,而该标准并未对微生物检验进行规定。
早在1995年,我厂即参照《中华人民共和国药典》1995年版二部微生物限度检查法对药用PTP铝箔进行微生物限度检查。
1998年接国家医药管理局文由我厂负责对GB12255 90进行修订。
经研讨,我们认为有必要将微生物限度检查作为药用PTP铝箔的检验项目写入国标。
因此,我们对卫生微生学物进行了深入细致的探讨和研究,提出了科学有效的药包材微生物限度检查方法。
一、检验项目的确定目前世界各国对药品或药包材微生物检查项目的确定尚无统一的规定。
在我国药品的微生物限度检查包括细菌总数的测定,霉菌和酵母菌数的测定及控制菌的检查。
细菌数是指规定单位的非规定灭菌药品制剂中污染细菌的数量,而不考虑种类,是判定药品受到细菌污染程度的标志,也是对生产单位的卫生状况进行卫生学评价的综合依据之一。
霉菌数是指规定单位非规定灭菌药品制剂中污染霉菌的活菌数量,固体制剂应报告霉菌数。
控制菌是药品中不得检出的特定微生物,控制菌除致病微生物还包括条件致病微生物。
控制菌的选定的应根据药品的治疗目的,应用部位等不同而异。
抗生素瓶用铝塑组合盖微生物方法验证方案2013.04.02
项目人员I t e m P e r s o n n e l部门/岗位Dept./Position签名Signature日期Date方案起草Prepared by QC/检验员年月日(Y) (M) (D) QA/验证年月日(Y) (M) (D)方案审核Reviewed byQC/经理年月日(Y) (M) (D) QA/副经理年月日(Y) (M) (D) QA/经理年月日(Y) (M) (D)方案批准Approved by 质量受权人年月日(Y) (M) (D)颁发部门Issued by QA 生效日期Effective Date年月日(Y) (M) (D)分发部门Distributed to QC制作备份:1份Copies prepared: 1pcs目录1.概述 (3)2.目的 (3)3.依据及参考文件 (3)4.验证小组和各部门职责 (3)5.验证时间安排 (4)6.验证内容 (4)7. 偏差处理及变更控制 (7)8.验证结果评价内容 (7)附件1 :《培训确认》 (1)附件2:《文件检查确认》 (2)附件3 :《设备确认结果》 (3)附件4 :《试验器材确认结果》 (4)附件5 :《试验用菌种确认结果》 (4)附件6:《培养基确认结果》 (5)附件7:《试剂确认结果》 (5)附件8:《器皿确认结果》 (6)附件9:《总菌落数计数验证结果记录》 (7)附件10:《检验记录》 (8)1.概述抗生素瓶用铝塑组合盖是本公司注射剂的包装材料,规格有7.2mm、7.3 mm两种,来源:湖北银华药用包装材料有限公司。
新建的206车间(粉针剂车间)轧盖操作选择在C级背景A级送风环境下进行,A级送风环境应当至少符合A级区的静态要求。
为减少洁净区工序操作,现拟使用免消毒的铝塑组合盖用于生产,为避免铝塑组合盖对环境与产品质量的影响,需修订抗生素瓶用铝塑组合盖的质量标准,增加其微生物限度检查项,并同时进行微生物限度检查方法验证。
铝塑组合盖的检测技术

铝盖冲压成型→表面处理→筛屑→清洗→烘干→包装。 铝盖的冲压成型是通过冲床将铝片材在落料模和拉伸模
中经拉伸、成型、切边等过程。将铝片变为铝盖产品, 然后经过机械筛,筛去金属屑,用清水加一定量的洗涤 剂,洗去油污等杂质,烘干后,包装(或进入铆合工 序)。
铝塑组合盖的检测技术
湖北省药品检验所药包材室 章少祥
一、概念
铝塑组合盖由铝件部分和塑件部分组成 。主要分撕拉型 铝塑组合盖,二件套或三件的铝塑组合盖以及普通型铝塑组 合盖。 现行的药包材标准中收载的铝合金铝塑组合盖,为输液 瓶用铝塑组合盖(YBB00402003)和抗生素瓶用铝塑组合 盖(YBB00372003)。
二、生产工艺简介
2.塑盖的生产工艺 配料→混合→塑化→注射→吹型→脱盖→包装(或
进入铆合工序)
主要生产设备为注塑机,将塑料原料(PP)接配方
比例加入,混料,送到注吹机的料斗内,通过加热 和螺杆的转动输送、搅拌作用完成塑化,然后通过 注射,在模腔内制成瓶盖。
三、铝塑组合盖的检测技术
1.铝件材料机械性能
三、铝塑组合盖的检测技术
2.凸边
凸边是衡量铝盖部分高度均一的指标,凸边的质量对于 制药企业在使用时,对瓶口密封性影响很大。 标准中凸边是用瓶盖的最大高度与最小高度的差值与最 小高度的比值来衡量。
三、铝塑组合盖的检测技术
3.开启力 塑料件去除力
铝塑组合盖中塑盖的去除力的大小,直接影响到瓶口的 密封性以及使用者的方便程度。 本方法是拉伸试验机进行,故操作时严格按仪器操作规 程进行即可。 标准中的其它检测项目。如开口质量、配合性、耐灭菌、 涂层牢固度、按标准中的方法操作。
方法见GB228-2002金属材料拉伸试验方法。 要点: (1)供试品一定要用标准刀具裁制样品。
TSQB08-00 抗生素瓶用铝塑组合盖质量标准及检验操作规程

1 目 的:建立抗生素瓶用铝塑组合盖的质量标准并规范抗生素瓶用铝塑组合盖检验操作。
2 范 围:本规程适用于抗生素瓶用铝塑组合盖的质量检验及质量判定。
3 标准依据:《国家食品药品监督管理局国家药品包装容器(材料)标准 (试行)》 YBB00372003 4 内 容: 4.1 类别:药用包材。
4.2 物料代码:B084.3 贮藏:密闭,干燥处保存。
4.4 质量要求: 4.4.1 质量标准:项目 标准外观 应清洁,无残留润滑剂、毛刺、损伤和注塑飞边,塑料件应与铝件完全结合 凸边 应不大于3%耐灭菌 瓶盖应不出现断裂和异常变形 规格尺寸应符合表1的规定注:其他项目由生产厂家进行检验,检验结果见厂家报告单。
4.4.2 规格尺寸表1 规格尺寸公称 型式铝盖内塑片外径铝盖厚度 铝盖内高 瓶盖全高题 目 抗生素瓶用铝塑组合盖 质量标准及检验操作规程文件编码 TSQB08-00 制 定 人 制定日期 年 月 日 文件页数 共 6页 审 核 人 审核日期 年 月 日 生效日期 年 月 日 批 准 人批准日期 年 月 日 颁发部门质量部分发部门 质量部(QC 、QA )、物控部、采购供应部4.4.3 检验方法 4.4.3.1 外观方法:取本品适量,在自然光线明亮处,正视目测。
4.4.3.2 凸边A)仪器与用具:游标卡尺。
B)方法:取瓶盖适量,用游标卡尺测量,精确至0.1cm 。
瓶盖铝件的凸边应不大于3%。
铝件边缘的凸边以百分率表示,按下式计算:%100%minminmax⨯-=H H H 凸边式中:max H ---为铝件外侧最大高度minH ---为铝件外测最小高度4.4.3.3 耐灭菌A)仪器与用具:YXQ-LS-50S Ⅱ立式压力蒸汽灭菌器。
B)方法:取瓶盖适量,封盖后置蒸汽灭菌器中,121℃±2℃ 30min (包含130℃±2℃ 5min ),瓶盖经灭菌后塑料件能经受121℃(130℃)的蒸汽灭菌温度,无变形变色,铝件表面不应有任何明显变化。
抗生素铝塑瓶盖起封后消毒操作对瓶盖细菌数量影响护理课件

目录
• 引言 • 抗生素铝塑瓶盖的特性与使用 • 实验设计 • 结果分析 • 讨论 • 结论
ห้องสมุดไป่ตู้
引言
01
背景介 绍
01
抗生素铝塑瓶盖在医疗护理中广 泛应用,但其起封后的消毒操作 对细菌数量的影响尚未得到充分 研究。
02
了解这一影响对于保障患者安全 和减少医院感染具有重要意义。
06
主要发现
抗生素铝塑瓶盖在起封后,即 使经过消毒操作,仍有一定数 量的细菌残留。
消毒操作可以有效减少瓶盖表 面的细菌数量,但无法完全消除。
随着时间的推移,瓶盖表面的 细菌数量逐渐增加,建议在使 用前尽快完成消毒操作。
对护理实践的影响
在护理实践中,应重视抗生素铝 塑瓶盖的消毒工作,确保在使用 前瓶盖表面的细菌数量达到最低
支持。
实验结果对临床护理的意义
临床应用
实验结果提示,在临床护理中,对于使用抗生素铝塑瓶的患者, 应重视瓶盖的清洁和消毒工作,以减少细菌感染的风险。
护理实践
根据实验结果,护士在配药和给药过程中应采取有效的消毒措施, 确保瓶盖的清洁度符合标准,保障患者的用药安全。
患者教育
向患者和家属宣传瓶盖清洁和消毒的重要性,提高他们的自我保护 意识和参与度,共同维护医疗安全。
研究目的
探讨不同消毒方法对 起封后抗生素铝塑瓶 盖细菌数量的影响。
评估消毒操作的有效 性,提高医疗护理质 量。
比较不同消毒方法之 间的差异,为临床实 践提供依据。
抗生素铝塑瓶盖的特性与使用
02
抗生素铝塑瓶盖的构造与材料
抗生素铝塑瓶盖由铝、塑料等材料制 成,具有良好的密封性和耐腐蚀性, 能够保护药品不受外界污染。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
项目人员I t e m P e r s o n n e l部门/岗位Dept./Position签名Signature日期Date方案起草Prepared by QC/检验员年月日(Y) (M) (D) QA/验证年月日(Y) (M) (D)方案审核Reviewed byQC/经理年月日(Y) (M) (D) QA/副经理年月日(Y) (M) (D) QA/经理年月日(Y) (M) (D)方案批准Approved by 质量受权人年月日(Y) (M) (D)颁发部门Issued by QA 生效日期Effective Date年月日(Y) (M) (D)分发部门Distributed to QC制作备份:1份Copies prepared: 1pcs目录1.概述 (3)2.目的 (3)3.依据及参考文件 (3)4.验证小组和各部门职责 (3)5.验证时间安排 (4)6.验证内容 (4)7. 偏差处理及变更控制 (7)8.验证结果评价内容 (7)附件1 :《培训确认》 (1)附件2:《文件检查确认》 (2)附件3 :《设备确认结果》 (3)附件4 :《试验器材确认结果》 (4)附件5 :《试验用菌种确认结果》 (4)附件6:《培养基确认结果》 (5)附件7:《试剂确认结果》 (5)附件8:《器皿确认结果》 (6)附件9:《总菌落数计数验证结果记录》 (7)附件10:《检验记录》 (8)1.概述抗生素瓶用铝塑组合盖是本公司注射剂的包装材料,规格有7.2mm、7.3 mm两种,来源:湖北银华药用包装材料有限公司。
新建的206车间(粉针剂车间)轧盖操作选择在C级背景A级送风环境下进行,A级送风环境应当至少符合A级区的静态要求。
为减少洁净区工序操作,现拟使用免消毒的铝塑组合盖用于生产,为避免铝塑组合盖对环境与产品质量的影响,需修订抗生素瓶用铝塑组合盖的质量标准,增加其微生物限度检查项,并同时进行微生物限度检查方法验证。
A级区动态下表面微生物<1CFU/皿(Φ55mm的接触皿表面培养基面积约23.7cm2),而10个铝塑组合盖展开面积约94 cm2,约为1个接触皿面积的4倍,所以拟定抗生素瓶用铝塑组合盖的微生物限度标准为:总菌落数不得过10个。
由于初拟的微生物限度检查采用铝塑组合盖浸渍洗脱法,实际采样面积远大于展开面积,所以本次拟定的质量标准较为严格,可用于铝塑组合盖的微生物控制。
初步拟定其检验方法为:取供试品10个,加入100 ml的0.9%无菌氯化钠溶液中,手工震摇1分钟,使瓶盖与液体充分接触,制成供试液,将供试液用薄膜过滤器全部过滤,滤干后将滤膜菌面朝上贴于胰酪胨大豆琼脂培养基平板上培养,平行制备2皿;同法制备2膜置沙氏葡萄糖琼脂培养基上。
胰酪胨大豆琼脂培养基置30~35℃倒置培养3天;沙氏葡萄糖琼脂培养基置20~25℃倒置培养5天。
本次验证的抗生素瓶用铝塑组合盖使用的两个规格,其总表面积相差很小,分别约为31.1 cm2与31.3 cm2,根据库存情况选择三批(不分规格)抗生素瓶用铝塑组合盖进行三次独立验证。
2.目的通过微生物方法学验证建立抗生素瓶用铝塑组合盖的微生物限度检验标准操作规程。
3.依据及参考文件3.1《中国药典》2010年版二部附录XI J“微生物限度检查法”3.2《中国药品检验标准操作规范》2010年版“微生物限度检查法”3.3现行版《欧洲药典》:非无菌产品微生物检测:微生物计数试验3.4《药品GMP指南》2011年版“无菌药品”3.5 SOP-QC-0213-V01《微生物限度检查法》3.6 SOP-QA-017-V02《验证管理规程》4.验证小组和各部门职责职位姓名部门具体职责组长谢圣坤QC 验证总协调工作,并审核验证的数据组员许维雅QC 负责验证方案和验证报告的起草,负责验证数据的收集,负责检品的检测与验证记录的填写。
常磊QC 负责检品的检测与验证记录的填写。
辛海安朱利安刘利李艳姣彭艳妃QC监督验证过程实施及验证过程中的偏差及OOS处理。
吴东琴QA负责验证方案和验证报告的起草、归档保存。
监督验证过程实施及验证过程中的偏差及OOS处理。
姓名职务职责颜杰质量受权人1.负责验证方案及报告的批准;2.负责验证过程中出现的偏差/OOS的批准放行。
马立如QA经理 1.负责验证方案及报告的审核;2.负责验证过程中出现的偏差/OOS的评估。
张德志QA副经理5.验证时间安排时间工作内容2013年04月方案起草、审批2013年04月标准确认、检验方法确认2013年04月完成报告6.1验证前准备6.1.1培训确认本次验证内容是否已对相关人员进行培训,检查确认结果记录在附件1《培训确认》。
6.1.2文件确认本次验证前验证方案及相关指导的SOP是否已经批准。
检查确认结果记录在附件2《文件检查确认》。
如无相关文件,则需要增加发放。
6.1.3仪器设备确认检查所涉及的设备是否符合实验要求,确认结果填写在附件3 《设备确认结果》中。
可接受标准:设备应经验证,在校准有效期内。
6.1.4试验器材确认检查所涉用试验器材,确认结果填写在附件4《试验器材确认结果》中,可接受标准:试验器材各配件应齐全,无损坏。
6.1.5试验用菌种确认检查所涉及的试验用菌种是否符合实验要求,确认结果填写在附件5 《试验用菌种确认结果》中。
可接受标准:菌种形态特征应良好、菌种代数不得超过第五代。
6.1.6培养基确认检查所涉及的培养基是否符合实验要求,确认结果填写在附件6 《培养基确认结果》。
可接受标准:培养基应在有效期内。
6.1.7试剂确认检查所涉用试剂是否符合实验要求,确认结果填写在附件7《试剂确认结果》中。
可接受标准:试剂应在有效期内。
6.1.8器皿确认检查所涉用器皿是否符合实验要求。
确认结果填写在附件8《器皿确认记录》中。
可接受标准:一般玻璃器皿要求洁净,无破损,量器要进行校正。
6.1.9验证用培养基、缓冲液、平皿、刻度吸管应置121℃湿热灭菌30分钟。
6.2验证方法6.2.1 菌液制备:取金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、枯草芽孢杆菌接种至胰酪胨大豆琼脂培养基中经30~35℃培养18~24小时的新鲜培养物;白色念珠菌接种至沙氏葡萄糖琼脂培养基中经20~25℃培养24~48小时的新鲜培养物。
上述培养物分别加pH7.0氯化钠-蛋白胨缓冲液10ml洗下菌苔转移至空试管中作为菌悬液原液,用pH7.0氯化钠-蛋白胨缓冲液进行10倍梯度稀释至含菌数50~100cfu/ml的菌悬液。
取黑曲霉接种至沙氏葡萄糖琼脂培养基中经20~25℃培养5~7天的新鲜培养物,加入含0.05%(ml/ml)聚山梨酯80的pH7.0氯化钠-蛋白胨缓冲液10ml洗下孢子吸出,转移至空试管中作为菌悬液原液,用含0.05%(ml/ml)聚山梨酯80的pH7.0氯化钠-蛋白胨缓冲液进行10倍梯度稀释至含孢子数50~100cfu/ml的孢子悬液。
6.2.2菌液计数:分别取黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、铜绿假单胞菌的菌液1ml(50~100CFU)加入培养皿,注入不超过45℃胰酪胨大豆琼脂培养基15~20ml,每种菌液作平行2个平板,置30~35℃倒置培养3天,测定菌数。
分别取白色念珠菌、黑曲霉的菌液1ml加入培养皿,注入不超过45o C沙氏葡萄糖琼脂培养基15~20ml,每种试验菌平行制备2个平板,于20~25℃倒置培养。
6.2.3供试液制备:取供试品10个,加入100 ml0.9%无菌氯化钠溶液中,手工震摇1分钟,使瓶盖与液体充分接触,制成供试液。
6.2.4总菌落数回收率测定:验证试验至少应进行3次独立批次(3批样品均不同批号)的平行试验,并计算各试验菌每次试验的回收率。
要求回收率为50%~200%。
具体拟定方法如下:6.2.4.1试验组:将1ml验证用菌液(含50~100CFU试验菌)加入上述制备好的供试液中,混匀1分钟。
将20ml 0.9%无菌氯化钠溶液加入过滤器中,以润湿滤膜,再将含菌的供试液全部加入薄膜过滤器内,滤干后将滤膜菌面朝上贴于胰酪胨大豆琼脂培养基平板上培养,每种菌平行制备2皿;同法制备2膜置沙氏葡萄糖琼脂培养基上。
胰酪胨大豆琼脂培养基置30~35℃倒置培养3天(必要时可以延长至5天);沙氏葡萄糖琼脂培养基置20~25℃倒置培养5天(必要时可以延长至7天)。
6.2.4.2菌液组:测定所加的试验菌数。
6.2.4.3供试品对照组:制备方法同试验组,不加验证菌液。
6.2.4.4稀释剂对照组:用相应的稀释液替代供试品,按试验组的制备方法和菌落计数法测定菌数。
试验结果:结果见《总菌落数计数验证结果记录》6.2.4.5结果判断:稀释剂对照组的菌回收率均应不低于70%。
若试验组的菌回收率均不低于70%,则可按该供试液制备方法和计数法测定供试品的细菌、霉菌或酵母菌数;若任一次试验中试验组的菌回收率低于70%,采取加大冲洗量或其它方法重新验证。
注:试验组回收率(%)=(试验组平均菌落数—供试品对照组平均菌落数)÷菌液组平均菌落数×100%稀释剂对照组回收率(%)= 稀释剂对照组平均菌落数÷菌液组平均菌落数×100% 6.2.4.6结果统计实验结果填写在《总菌落数计数验证结果记录》。
7.偏差处理及变更控制确认过程中如果有任何偏差应及时记录,分析原因,评价是否是重大偏差,并提出整改措施。
偏差填写《偏差处理单》,并将偏差复印件附于确认报告中。
确认过程中是否有变更,如有变更将变更再确认报告中进行说明。
8.验证结果评价内容对验证结果进行综合评价,内容包括但不限于:确认实验是否有遗漏;确认验证过程中是否有偏差,偏差是否已经采取纠偏措施和预防措施;确认记录是否完整;是否需要进一步补充实验。
评价必须以书面形式写出报告。
抗生素瓶用铝塑组合盖微生物限度检查方法验证方案编码:R/QBV-13-T097-00页码:1/8附件1 :《培训确认》培训确认培训人/ 日期培训对象部门职责签名谢圣坤QC 验证总协调工作,并审核验证的数据彭艳妃QC监督验证过程实施及验证过程中的偏差及OOS处理。
常磊QC负责检品的检测与验证记录的填写。
辛海安QC朱利安QC刘利QC袁文静QC李艳姣QC吴东琴QA负责验证方案和验证报告的起草、归档保存。
监督验证过程实施及验证过程中的偏差及OOS处理。
评价:确认人/日期:QA复核人/日期:抗生素瓶用铝塑组合盖微生物限度检查方法验证编码:R/QBV-13-T097-00页码:2 / 8附件2:《文件检查确认》文件名称文件编号是否已批准生测室管理规程SOP-QC-005-V02 □是□否培养基管理规程SOP-QC-017-V01 □是□否菌种管理规程SOP-QC-012-V02 □是□否QC脉动真空灭菌柜使用、维护标准操作规程SOP-QC-377-V00□是□否培养箱使用和维护保养标准操作规程SOP-QC-303-V00 □是□否电子天平使用标准操作规程SOP-QC-317-V01 □是□否洁净工作台使用及维护保养标准操作规程SOP-QC-304-V00□是□否生物安全柜使用、保养标准操作规程SOP-QC-0386-V00 □是□否Haier 药品保存箱使用及保养标准操作规程SOP-QC-0395-V00□是□否红外电热灭菌器使用、保养标准操作规程SOP-QC-0389-V00 □是□否评价:确认人/日期:QA复核人/日期:抗生素瓶用铝塑组合盖微生物限度检查方法验证编码:R/QBV-13-T097-00页码:3 / 8附件3 :《设备确认结果》设备确认结果设备名称型号生产厂家及出厂编号有效期至编号霉菌培养箱MJ-300BS-II 上海新苗医疗器械制造有限公司(0812240005)霉菌培养箱MJ-300BS-II 上海新苗医疗器械制造有限公司(1005240001)生化培养箱SPX-300BS-II 上海新苗医疗器械制造有限公司(0405011)电热恒温培养箱DHP-9162 上海一恒科技有限公司(035184)脉动真空灭菌柜XG1.DTX-0.36B 山东新华医疗器械股份有限公司(20100955)脉动真空灭菌柜XG1.DTS-0.24B 山东新华医疗器械股份有限公司(20122024)生物安全柜BSC-1600ⅡA2 苏州安泰空气技术有限公司(J10060420)生物安全柜BSC-1600ⅡA2 苏州安泰空气技术有限公司(J10060421)生物安全柜BSC-1300ⅡA2 苏州安泰空气技术有限公司(J10050341)电子天平PB602-N 梅特勒-托利多仪器有限公司(1201130089)电子天平GF-200 日本AND(14678558)评价:确认人/日期:复核人/日期:附件4 :《试验器材确认结果》试验器材确认结果名称型号来源检查项目及标准检查结果微孔滤膜孔径0.45μm,直径50mm杭州高得泰林有限公司完整,无破损封闭式无菌检查薄膜过滤器STV2、STV3型浙江宁海白石药检仪器厂完整,洁净,无破损评价:确认人/日期:复核人/日期:附件5 :《试验用菌种确认结果》试验用菌种确认结果菌种名称及编号来源保存方法及条件菌种代数(不得超过第五代)/形态特征金黄色葡萄球菌[ATCC6538] 美国菌种收集中心培养基斜面2-8℃大肠埃希菌[ATCC8739] 美国菌种收集中心培养基斜面2-8℃铜绿假单胞菌[ATCC9027] 美国菌种收集中心培养基斜面2-8℃枯草芽孢杆菌[ATCC6633] 美国菌种收集中心培养基斜面2-8℃白色念珠菌[ATCC10231] 美国菌种收集中心培养基斜面2-8℃黑曲霉[ATCC16404] 美国菌种收集中心培养基斜面2-8℃评价:确认人/日期:复核人/日期:附件6:《培养基确认结果》培养基确认结果培养基名称来源检查项目及标准批号/有效期至/检查结果胰酪胨大豆琼脂培养基北京三药科技开发公司1.应在有效期内2.应做适用性检查沙氏葡萄糖琼脂培养基北京三药科技开发公司1.应在有效期内2.应做适用性检查评价:确认人/日期:复核人/日期:附件7:《试剂确认结果》试剂确认结果试剂名称规格来源检查项目及标准批号/有效期至pH7.0氯化钠-蛋白胨缓冲液250g/瓶北京三药科技开发公司应在有效期内氯化钠500g/瓶广州化学试剂厂应在有效期内新洁尔灭溶液500ml/瓶广东恒健制药有限公司应在有效期内洗必泰5kg/箱锦州九泰制药有限责任公司应在有效期内吐温80 500ml/瓶天津市大茂化学试剂厂应在有效期内评价:确认人/日期:复核人/日期:附件8:《器皿确认结果》器皿确认结果容器名称规格型号检查项目及标准检查结果培养皿Φ9cm洁净,无破损烧杯1000ml、500ml 洁净,无破损蓝盖瓶500ml、250ml、100ml 洁净,无破损试管18mm×180mm、30 mm×200mm洁净,无破损刻度吸管10 ml 、5 ml、2 ml、1ml 洁净,无破损量筒500ml、100ml 洁净,无破损应校准评价:确认人/日期:复核人/日期:抗生素瓶用铝塑组合盖微生物限度检查方法验证编码:R/QBV-13-T097-00页码:7 / 8附件9:《总菌落数计数验证结果记录》总菌落数计数验证结果记录试验菌种菌种编号菌液组(验证加菌数)试验组(检品+验证加菌数)稀释剂对照组(稀释剂+验证加菌数)供试品对照组(检品本底菌数)试验组菌回收率%稀释剂对照组菌回收率% 皿1 皿2 平均皿1 皿2 平均皿1 皿2 平均皿1 皿2 平均金黄色葡萄球菌大肠埃希菌铜绿假单胞菌枯草芽孢杆菌白色念珠菌黑曲霉备注:试验组的回收率(%)=(试验组平均菌落数—供试品对照组平均菌落数)÷菌液组的平均菌落数×100% 稀释剂对照组的回收率(%)=稀释剂对照组的平均菌落数÷菌液组的平均菌落数×100%回收率应不低于70%结果评定:附件10:《检验记录》品名:抗生素瓶用铝塑组合盖批号:来源:实验环境:℃、RH % 检验标准:《欧洲药典》——微生物限度检验法检验日期:年月日1.仪器细菌培养箱型号(编号):;校准有效期至:霉菌培养箱型号(编号):;校准有效期至:2.试液、培养基培养基名称:胰酪胨大豆琼脂培养基配制编号:有效期至:沙氏葡萄糖琼脂培养基配制编号:有效期至:试液名称:0.9%氯化钠溶液配制编号:有效期至:标准规定:总菌落数不得过4CFU/10个。
