新药监测期期限表说明除以下情形的新药不设立监测期
药品研发注册申报的法规要求及流程

一、药品研发及注册申报的法规依据二、药品申请的申报与审批三、药品的注册分类四、申报资料的内容五、药品的监测期六、药品补充申请注册事项七、其他配套法规八、药品研发时企业各部门的配合工作一、药品研发及注册申报的法规依据法规依据:《药品注册管理办法》(局令第28号),2007年10月1日起施行。
中国境内申请药物临床试验、药品生产和药品进口,以及进行药品审批、注册检验和监督管理,适用本办法。
药品注册:是指国家食品药品监督管理局(SFDA)根据药品注册申请人的申请,依照法定程序,对拟上市销售药品的安全性、有效性、质量可控性等进行审查,并决定是否同意其申请的审批过程。
国产药品注册申报主要环节:药品研究开发→申报资料的受理(省级药品监督管理局)→研制现场检查并抽取样品(省级/国家药品监督管理局)→抽样的复核检验(省级药检所/中检院)→审评(国家药品审评中心)→审批(国家食品药品监督管理局)。
药品注册申请人:法人机构药品注册申请分类:1)新药申请;2)仿制药申请;3)进口药品申请4)补充申请:药品申请经批准后,改变、增加或者取消原批准事项或者内容5)再注册申请:药品批准证明文件有效期满后二、药品申请的申报与审批1、研究内容及申报流程(新药两报两批)1.1临床前研究:包括药物的合成工艺、提取方法、理化性质及纯度、剂型选择、处方筛选、制备工艺、检验方法、质量指标、稳定性、药理、毒理、动物药代动力学研究等。
1.2申报临床:获得临床研究批件1.3临床试验:I、II、III、IV期。
I期:人体耐受程度和药代动力学,20至30例II期:初步评价治疗作用,100例III期:确证治疗作用,300例IV期:上市后应用研究,为2000例1.4申报生产:获得新药证书及生产批文2、审评审批的时限三、药品的注册分类药途径的制剂。
6.已有国家药品标准的原料药或者制剂。
四、申报资料的内容1、参照SFDA颁布的各类药品研究指导原则开展研究和撰写申报资料(120个)2、申报资料内容3、提交申请时应填写《药品注册申请表》五、药品的监测期定义:国家食品药品监督管理局根据保护公众健康的要求,可以对批准生产的新药品种设立监测期。
7药品质量标准制定修订与起草说明

第五条 药品注册专员应履行以下职责: (一)规范本企业药品注册申请过程的管理工作; (二)与药品监督管理部门进行沟通和协调; (三)参与企业下列药品注册申请工作: 1.药品注册申请各环节使用的药物、辅料和标 准物质的选择; 2.药品注册样品试制; 3.临床试验方案的核准; 4.药品注册申请资料的核准; 5.药品注册申请的申报; 6.药品注册现场核查的申请; 7.药品注册申请的撤回; 8.其他与药品注册申请有关的工作。
一、化药注册分类3、4、5和6的生产注册申请 的药学部分申报资料,可参照CTD格式提交, 同时提交电子版。 二、化药注册分类1和2的药学资料,暂不按 CTD格式提交资料。 三、为鼓励CTD格式提交,并稳步推进:
(一)按《药品注册管理办法》附件2申报资料要求 提交的生产注册申请申报资料仍予接收。 (二)技术审评部门将对提交CTD格式申报资料的 注册申请单独按序进行审评。
3.附有相关图谱
4.对照品、对照药材 符合要求
中药制剂定性鉴别项目选定的原则及方法:
确保中药制剂鉴别项目的规范合理。 鉴别项目的选定,可根据处方组成及研究资料确定建 立相应的鉴别项目,原则上处方各药味均应进行试验 研究,根据试验情况,选择列入标准中。首选君药、 贵重药、毒性药。 鉴别方法的依据,试验条件的选定(如薄层色谱法的吸 附剂、展开剂、显色剂的选定等)。 理化鉴别、色谱鉴别。 阴性对照-专属性 三批以上样品试验结果-重复性。 药典未收载的试液,应注明配制方法及依据
第四条 药品注册专员实行备案制度。企业可确 定本企业2名以上正式员工作为药品注册专员在省食 品药品监督管理局进行备案。备案应提交以下材料: (一)药学、医学、生物学等相关专业知识教育 的最高学历、学习经历证书、身份证复印件等证明材 料; (二)从事药品注册相关的药品研制、临床研究、 药品生产工作经历证明材料; (三)近1年内接受两次省级以上机构组织的药 品注册方面的培训情况及证明材料; (四)药品注册申请人授权书; (五)《广东省药品注册专员备案表》。 符合要求的由省食品药品监督管理局予以备案并 核发药品注册专员备案凭证。
新药保护期、过渡期、行政保护期、专利保护期、监测期、试行期

1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
生物药研发和注册专题分享-注册申报法规、程序、CTD和eCTD格式文件简介

生物药研发和注册专题分享-注册申报法规、程序、CTD和eCTD格式文件简介存储位置:\\10.0.0.10\PC\04 CI PROJECT(争力提升项目)\南京培训资料(2019-03)\01 分享资料-法规分享部门:项目协调部分享人:刘万磊分享时间:2019年5月8日版本号:V.7分享前的思考和倡议:项目立项再评价(含IV期临床试验)、变更、再注册药品注册申报、产品顺利获批临床或生产以法规以依据+文件管理和项目管理,非临床研究及临床试验符合相关的规范要求MR1MR4 MR3MR2MR5MR62Pharmaceutical Product Development Life Cycle3目录:A 药品注册法规体系及主要法规B CDE架构职责及注册工作法规、程序C 生物药注册CTD与eCTD格式文件•法规部门归属(横向)法律部门划分宪法民法行政法经济法社会法刑法程序法(诉讼与非诉讼)•法规层级归属(竖向)法规层级宪法法律部门规章地方法规地方政府规章国际政府间条约指导原则广义法规层面A 药品注册法规体系及主要法规1. 我国药品注册管理法规定位41978年1999年2005年卫生部、国家医药管理颁布《新药管理办法》(试行)修订发布《新药审批办法》、《仿制药品审批办法》、《进口药品管理办法》、GCP 和GLP 等《药品注册管理办法》(试行)及附件A 药品注册法规体系及主要法规卫生部发布《新药审批办法》1985年2016/2017年2. 药品注册法规发展趋势2007年《药品注册管理办法》及附件《药品注册管理办法》修订征求意见稿2002年修订颁布新《药品注册管理办法》《国家食品药品监督管理局药品特别审批程序》(局令第21号)20151108关于调整药物临床试验审评审批程序的公告(2018年第50号)20180724国务院办公厅关于印发药品上市许可持有人制度试点方案的通知国办发〔2016〕41号总局关于调整药品注册受理工作的公告(2017年第134号)20171107整体趋势:从无到有,逐步规范,但立法层次仍有待进一步梳理,目前正处在阶段变革期;已经并将继续有重大修订。
新药保护期、监测期解读

1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
新药监测期期限表
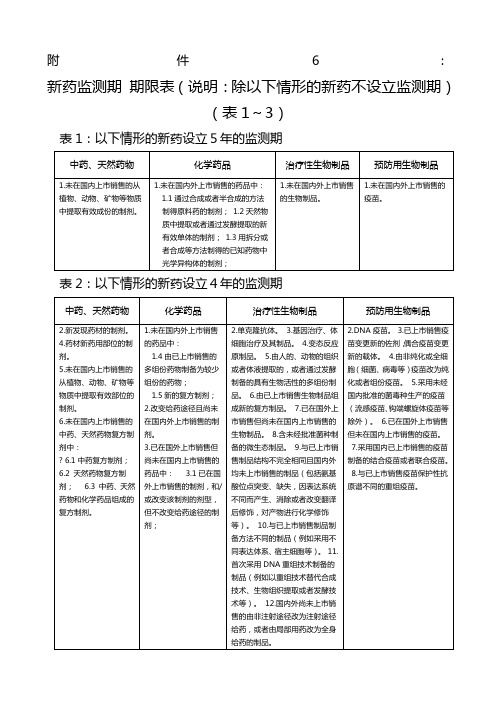
新药监测期期限表(说明:除以下情形的新药不设立监测期)(表1~3)
表1:以下情形的新药设立5年的监测期
中药、天然药物
化学药品
治疗性生物制品
预防用生物制品
1.未在国内上市销售的从植物、动物、矿物等物质中提取有效成份的制剂。
1.未在国内外上市销售的药品中:
1.1通过合成或者半合成的方法制得原料药的制剂;
6.由已上市销售生物制品组成新的复方制品。
7.已在国外上市销售但尚未在国内上市销售的生物制品。
8.含未经批准菌种制备的微生态制品。
9.与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。
10.与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。
2.改变给药途径且尚未在国内外上市销售的制剂。
3.已在国外上市销售但尚未在国内上市销售的药品中:
3.1已在国外上市销售的制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
2.单克隆抗体。
3.基因治疗、体细胞治疗及其制品。
4.变态反应原制品。
5.由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。
11.首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发酵技术等)。
12.国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的制品。
2.DNA疫苗。
3.已上市销售疫苗变更新的佐剂,偶合疫苗变更新的载体。
4.由非纯化或全细胞(细菌、病毒等)疫苗改为纯化或者组份疫苗。
10.改变灭活剂(方法)或者脱毒剂(方法)的疫苗。
关于发布新药监测期期限的通知关于发布新药监测期期限的通知
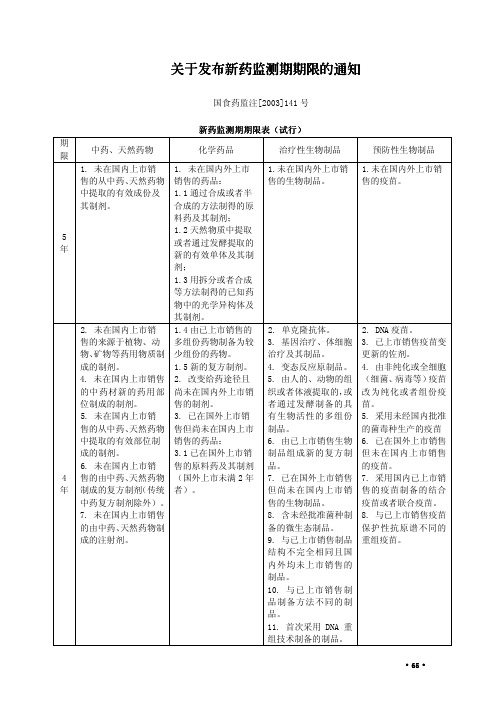
6. 未在国内上市销售 售但尚未在国内上市 制品的剂型但不改变 销售疫苗的剂型,但不
的由中药、天然药物制 销售的原料药(其制剂 给药途径的生物制品。 改变给药途径的疫苗。
成的复方制剂(传统中 已在国内上市销售)。
13. 改变免疫剂量或
不 设
药复方制剂)。
5. 改变国内已上市销
9. 改变国内已上市销 售药品的剂型,但不改
制剂。
(国外上市超过 2 年
细胞基质生产的疫苗。
9. 改变国内已上市 者)。
10. 改变灭活剂(方
销售药品剂型的制剂 3.2 已在国外上市销
法)或者脱毒剂(方法)
(工艺有质的改变者)。 售的复方制剂。
的疫苗。
10. 改变国内已上市 3.3 改变给药途径并
11. 改变给药途径的
销售药品工艺的制剂 已在国外上市销售的
位制成的制剂。
售的制剂。
者通过发酵制备的具 苗。
5. 未在国内上市销 3. 已在国外上市销 有生物活性的多组份 5. 采用未经国内批准
售的从中药、天然药物 售但尚未在国内上市 制品。
的菌毒种生产的疫苗
中提取的有效部位制 销售的药品:
6. 由已上市销售生物 6. 已在国外上市销售
成的制剂。 6. 未在国内上市销
65656565关于发布新药监测期期限的通知关于发布新药监测期期限的通知关于发布新药监测期期限的通知关于发布新药监测期期限的通知国食药监注2003141号新药监测期期限表新药监测期期限表新药监测期期限表新药监测期期限表试行试行试行试行期限中药天然药物化学药品治疗性生物制品预防性生物制品5年1
关于发布新药监测期期限的通知
物、矿物等药用物质制 少组份的药物。
治疗及其制品。
行政保护期、新药保护期、新药过渡期、新药监测期、中药保护期、专利保护期

何谓行政保护期、新药保护期、新药过渡期、新药监测期、中药保护期、专利保护期?行政保护期:为了扩大对外经济技术合作与交流,对外国药品独占权人的合法权益给予行政保护。
药品行政保护期为7年零6个月,自药品行政保护证书颁发之日起计算。
新药保护期:新药经国家药品监督管理局批准颁发新药证书后即获得保护。
各类新药的保护期分别为:第一类新药12年;第二、三类新药8年;第四、五类新药6年。
凡有试产期的新药,其保护期包含试产期。
新药的保护期自国家药品监督管理局批准颁发的第一个新药证书之日算起。
新药保护期满,新药保护自行终止。
新药过渡期:修订的《中华人民共和国药品管理法》(以下简称《药品管理法》)及《中华人民共和国药品管理法实施条例》(以下简称《实施条例》)分别于2001年12月1日和2002年9月15日施行。
《实施条例》修改了新药的定义,将“新药是指我国未生产过的药品”,修改为“新药是指未曾在中国境内上市销售的药品”。
随着新药定义的改变,新药注册管理制度将发生较大变化,新药的行政保护制度已被取消。
对于2002年9月15日以前我局已经批准临床研究但未批准生产的新药,仍按照原药品注册管理的有关规定审批。
批准生产后,按照原《新药审批办法》属于一类新药的,给予5年的过渡期;属于二类新药的,给予4年的过渡期;属于三类至五类新药的,给予3年的过渡期。
在过渡期内,其他药品生产企业不得生产相同品种的药品。
新药过渡期自发给新药证书之日起计算。
新药监测期:对于2002年9月15日以前我局已经受理但未批准临床研究的新药,以及2002年9月15日以后我局受理的新药,按照修订的《药品管理法》及《实施条例》的有关规定审批。
即:对未曾在中国境内上市销售的品种,按照新药审批,并且对批准药品生产企业生产的新药,设立不超过5年的监测期;自新药批准生产之日起计算。
中药保护期:中药一级保护品种分别为三十年、二十年、十年。
中药二级保护品种为七年。
专利保护期:发明专利权的期限为二十年,实用新型专利权和外观设计专利权的期限为十年,均自申请日起计算。
国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(2)

国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(2)文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.10.10•【文号】国食药监注[2003]278号•【施行日期】2003.10.10•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文续(1)┎────┬───────┬──┬────────────┬────┬────┬──────┬────┬──────────────┬────┬─────┒┃批准日期│新药名称│注册│保护期、过渡期或监测期│批件编号│药品批准│药品生产企业│新药证书│新药证书持有人│申请日期│受理号┃┃││分类│││文号││编号│││┃┃││││││││││┃┃││├───┬──┬─────┤││││││┃┃│││ 种类│期限│终止期│││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│卡维地洛│ 二│保护期│8年│至2005-4-2│2002H068│----│----│国药证字│湖南医药工业研究所,湖南维康│2001-3- │CXS01139┃┃23││││││5│││H2002047│制药有限公司│21│┃┃│││││││││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│卡维地洛片│ 二│保护期│8年│至2005-4-2│2002H068│国药准字│广州南新制药│国药证字│湖南医药工业研究所│2001-3- │CXS01140┃┃23││││││6│H2002070│有限公司│H2002047││21│┃┃│││││││7││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│清淋胶囊│ 四│过渡期│3年│至2005-12-│2002Z012│国药准字│吉泰安(四川│国药证字│吉泰安(四川)药业有限公司│2000-9- │CZS00079┃┃23│││││22│3│Z2002014│)药业有限公│Z2002009││27│┃┃│││││││5│司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│复方马其通胶囊│ 三│过渡期│3年│至2005-12-│2002Z012│国药准字│武汉联合药业│国药证字│中国人民解放军264医院,武汉│2000-10-│CZS00084┃┃23│││││22│6│Z2002014│有限责任公司│Z2002009│滋盛医药科技开发有限责任公│18│┃┃│││││││8││4│司,武汉联合药业有限责任公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│龟龙中风丸│ 三│过渡期│3年│至2005-12-│2002Z012│国药准字│沈阳中药制药│国药证字│沈阳中药制药有限公司│2000-11-│CZS00093┃┃23│││││22│5│Z2002014│有限公司│Z2002009││20│┃┃│││││││7││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│复方益母片│ 四│过渡期│3年│至2005-12-│2002Z012│国药准字│营口奥达制药│国药证字│山东省生物药物研究院,营口奥│2001-9- │CZS01040┃┃23│││││22│2│Z2002014│有限公司│Z2002009│达制药有限公司│19│┃┃│││││││4││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│天芪降糖胶囊│ 三│过渡期│3年│至2005-12-│2002Z012│国药准字│西安高科陕西│国药证字│长春市白山中药研究所│2001-10-│CZS01049┃┃23│││││22│1│Z2002014│金方药业公司│Z2002008││17│┃┃│││││││3││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│加味藿香正气软│ 四│过渡期│3年│至2005-12-│2002Z012│国药准字│江苏康缘药业│国药证字│江苏康缘药业股份有限公司│2002-4- │CZS2002002┃┃23│胶囊││││22│0│Z2002014│股份有限公司│Z2002008││15│4┃┃│││││││2││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│太子保心口服液│ 三│过渡期│3年│至2005-12-│2002Z011│国药准字│北京同仁堂科│国药证字│北京同仁堂科技发展股份有限公│2002-4- │CZS2002002┃┃23│││││22│5│Z2002013│技发展股份有│Z2002008│司制药厂│24│6┃┃│││││││5│限公司制药厂│3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│四季三黄胶囊│ 四│保护期│6年│至2007-6-│2002Z012│国药准字│宿州科苑药业│国药证字│宿州科苑药业有限公司│1997-8- │CZS98002┃┃23│││││28│4│Z2002014│有限公司│Z2002009││12│┃┃│││││││6││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│盐酸格拉司琼葡│ 四│保护期│6年│至2008-9-4│2002H068│国药准字│江苏扬子江药│国药证字│南昌弘益医药研究所│2001-5- │CXS01260┃┃28│萄糖注射液│││││7│H2002071│业集团有限公│H2002047││23│┃┃│││││││8│司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│马来酸氨氯地平│ 四│保护期│6年│至2005-12-│2003S000│国药准字│扬州奥赛康药│国药证字│南京海光应用化学研究所│2001-1- │CXS01013┃┃│││││29│05│H2003000│业有限公司│H2003000││10│┃┃│││││││5││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│马来酸氨氯地平│ 四│保护期│6年│至2005-12-│2003S000│国药准字│江苏联环药业│国药证字│南京海光应用化学研究所│2001-1- │CXS01014┃┃│片││││29│06│H2003000│股份有限公司│H2003000││10│┃┃│││││││6││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│氯雷他定│ 四│保护期│6年│ 至2008-5-│2003S000│国药准字│常州四药制药│国药证字│常州四药制药有限公司,上海医│2002-1- │CXS2002007┃┃│││││29│03│H2003000│有限公司│H2003000│药工业研究院│30│9┃┃│││││││3││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│氯雷他定片│ 四│保护期│6年│至2008-5-│2003S000│国药准字│常州四药制药│国药证字│常州四药制药有限公司,上海医│2002-1- │CXS2002008┃┃│││││29│04│H2003000│有限公司│H2003000│药工业研究院│30│0┃┃│││││││4││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│注射用还原型谷│ 四│保护期│6年│至2007-6-│2003S000│国药准字│山东绿叶制药│国药证字│北京红惠生物制药股份有限公司│2002-5- │CXS2002046┃┃│胱甘肽││││10│01│H2003000│股份有限公司│H2003000││28│2┃┃│││││││1││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│注射用还原型谷│ 四│保护期│6年│至2007-6-│2003S000│国药准字│山东绿叶制药│国药证字│北京红惠生物制药股份有限公司│2002-5- │CXS2002046┃┃│胱甘肽││││10│02│H2003000│股份有限公司│H2003000││28│3┃┃│││││││2││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-7│复方乳酸软膏│ 三│过渡期│3年│至2006-1-6│2003S000│国药准字│福建太平洋制│国药证字│福建太平洋制药有限公司│2002-8- │CXS2002072┃┃││││││07│H2003000│药有限公司│H2003000││12│6┃┃│││││││7││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-7│复方乳酸软膏│ 三│过渡期│3年│至2006-1-6│2003S000│国药准字│福建太平洋制│国药证字│福建太平洋制药有限公司│2002-8- │CXS2002072┃┃││││││08│H2003000│药有限公司│H2003000││12│7┃┃│││││││8││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│门冬氨酸鸟氨酸│ 四│保护期│6年│至2009-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00628┃┃17│││││16│17│││H2003001││11│┃┃│││││││││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用门冬氨酸│ 四│过渡期│3年│至2006-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00629┃┃17│鸟氨酸││││16│13│││H2003000││11│┃┃│││││││││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用门冬氨酸│ 四│过渡期│3年│至2006-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00630┃┃17│鸟氨酸││││16│18│││H2003000││11│┃┃│││││││││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│门冬氨酸鸟氨酸│ 四│保护期│6年│至2009-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00631┃┃17│颗粒剂││││16│19│││H2003001││11│┃┃│││││││││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│门冬氨酸鸟氨酸│ 四│保护期│6年│至2009-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00632┃┃17│颗粒剂││││16│20│││H2003001││11│┃┃│││││││││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│多糖铁│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│青岛国风高科│国药证字│青岛国风高科药业有限责任公│2002-4- │CXS2002032┃┃17│││││16│14│H2003003│药业有限责任│H2003001│司,青岛化工学院│18│3┃┃│││││││2│公司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│多糖铁胶囊│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│青岛国风高科│国药证字│青岛国风高科药业有限责任公│2002-4- │CXS2002032┃┃17│││││16│15│H2003003│药业有限责任│H2003001│司,青岛化工学院│18│4┃┃│││││││3│公司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│雷贝拉唑钠│ 二│保护期│8年│至2010-7-│2003S000│国药准字│峨眉山健康制│国药证字│峨眉山健康制药有限责任公司│2002-6-6│CXS2002047┃┃17│││││24│10│H2003000│药有限责任公│H2003000│││1┃┃│││││││9│司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│雷贝拉唑钠肠溶│ 二│保护期│8年│至2010-7-│2003S000│国药准字│峨眉山健康制│国药证字│峨眉山健康制药有限责任公司│2002-6-6│CXS2002047┃┃17│片││││24│11│H2003001│药有限责任公│H2003000│││2┃┃│││││││0│司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│双氢青蒿素哌喹│ 三│过渡期│3年│至2006-1-│2003S000│----│----│国药证字│广州华立健医药研究所,广州市│2002-7-3│CXS2002056┃┃17│片││││16│16│││H2003001│华立健药业有限公司││8┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│缬沙坦│ 四│保护期│6年│至2006-10-│2003S000│国药准字│哈药集团三精│国药证字│哈药集团三精制药有限公司,长│2001-1- │CXS01027┃┃24│││││23│23│H2003003│制药有限公司│H2003001│沙泓扬医药科技开发有限公司,│15│┃┃│││││││4││8│哈尔滨市宁宇药物研究所││┃┃││││││││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│缬沙坦胶囊│ 四│保护期│6年│至2006-10-│2003S000│国药准字│永信药品工业│国药证字│永信药品工业(昆山)有限公司,│2001-1- │CXS01028┃┃24│││││23│24│H2003003│(昆山)有限公│H2003001│哈药集团三精制药有限公司,长│15│┃┃│││││││5│司│9│沙泓扬医药科技开发有限公司,││┃┃││││││││││哈尔滨市宁宇药物研究所││┃┃││││││││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│辣椒碱│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│长春三九生物│国药证字│石家庄正光生物工程有限公司│2002-7-1│CXS2002055┃┃24│││││23│21│H2003003│制药股份有限│H2003001│││4┃┃│││││││0│公司│6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│辣椒碱软膏│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│长春三九生物│国药证字│石家庄正光生物工程有限公司│2002-7-1│CXS2002055┃┃24│││││23│22│H2003003│制药股份有限│H2003001│││5┃┃│││││││1│公司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│人类免疫缺陷病│ 二│无│││2003S002│国药准字│北京万泰生物│国药证字│北京万泰生物药业有限公司,厦│2001-6-5│CSS01022┃┃29│毒(HIV1+2型)抗│││││13│S2003000│药业有限公司│S2003000│门大学││┃┃│体诊断试剂盒││││││1││1│││┃┃│(金标法)│││││││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│羟苯磺酸钙│ 四│保护期│6年│至2006-12-│2003S001│国药准字│上海复星朝晖│国药证字│合肥医工医药研究所,南京长澳│2001-1- │CXS01025┃┃29│││││14│94│H2003008│药业有限公司│H2003009│制药有限公司,上海复星朝晖药│15│┃┃│││││││9││3│业有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│羟苯磺酸钙胶囊│ 四│保护期│6年│至2006-12-│2003S001│国药准字│上海复星朝晖│国药证字│合肥医工医药研究所,南京长澳│2001-1- │CXS01026┃┃29│││││14│93│H2003008│药业有限公司│H2003009│制药有限公司,上海复星朝晖药│15│┃┃│││││││8││2│业有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│羟苯磺酸钙片│ 四│过渡期│3年│至2006-1-│2003S001│国药准字│南京长澳制药│国药证字│合肥医工医药研究所,南京长澳│2001-3- │CXS01128┃┃29│││││28│92│H2003008│有限公司│H2003009│制药有限公司│19│┃┃│││││││7││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│肌苷葡萄糖注射│ 四│保护期│6年│至2008-3-5│2003S001│国药准字│石家庄四药股│国药证字│南昌弘益医药研究所│2001-5- │CXS01261┃┃29│液│││││98│H2003009│份有限公司│H2003009││23│┃┃│││││││2││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│甲磺酸多沙唑嗪│ 二│保护期│8年│至2008-7-│2003S000│----│----│国药证字│上海今科明光药业有限公司│2001-6- │CXS01317┃┃29│││││13│38│││H2003002││20│┃┃│││││││││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│甲磺酸多沙唑嗪│ 二│保护期│8年│至2008-7-│2003S000│----│上海今科明光│国药证字│上海今科明光药业有限公司│2001-6- │CXS01318┃┃29│片││││13│39││药业有限公司│H2003003││20│┃┃│││││││││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2003S001│国药准字│鲁南制药股份│国药证字│济南新力特科技有限公司,鲁南│2001-8-8│CXS01405┃┃29│射液││││18│85│H2003008│有限公司│H2003008│制药股份有限公司││┃┃│││││││3││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│氟尿嘧啶葡萄糖│ 四│监测期│不设││2003S001│国药准字│浙江一新制药│国药证字│浙江一新制药股份有限公司│2001-8- │CXS01452┃┃29│注射液│││││38│H2003005│股份有限公司│H2003004││30│┃┃│││││││5││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│法莫替丁氯化钠│ 四│保护期│6年│至2007-8-│2003S001│国药准字│重庆迪康长江│国药证字│南昌弘益医药研究所,重庆迪康│2001-9- │CXS01482┃┃29│注射液││││21│84│H2003008│制药有限公司│H2003008│长江制药有限公司│12│┃┃│││││││2││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│普仑司特│ 二│过渡期│4年│至2007-1-│2003S002│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司,上│2001-9- │CXS01484┃┃29│││││28│03│H2003009│股份有限公司│H2003010│海医药工业研究院│17│┃┃│││││││6││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│普仑司特胶囊│ 二│过渡期│4年│至2007-1-│2003S002│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司,上│2001-9- │CXS01485┃┃29│││││28│04│H2003009│股份有限公司│H2003010│海医药工业研究院│17│┃┃│││││││7││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│地红霉素│ 二│过渡期│4年│至2007-1-│2003S001│国药准字│广东万基药业│国药证字│山东省医药工业研究所,广东万│2001-9- │CXS01527┃┃29│││││28│82│H2003008│有限公司│H2003008│基药业有限公司│26│┃┃│││││││0││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│地红霉素肠溶片│ 二│过渡期│4年│至2007-1-│2003S001│国药准字│广东万基药业│国药证字│山东省医药工业研究所,广东万│2001-9- │CXS01528┃┃29│││││28│83│H2003008│有限公司│H2003008│基药业有限公司│26│┃┃│││││││1││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│硫酸庆大霉素氯│ 四│监测期│不设││2003S001│国药准字│沈阳志鹰制药│国药证字│沈阳市山日药物研究所,沈阳志│2001-10-│CXS01587┃┃29│化钠注射液│││││99│H2003009│厂│H2003009│鹰制药厂│30│┃┃│││││││3││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟│ 四│过渡期│3年│至2005-10-│2002S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-11-│CXS01649┃┃29│││││28│41│H2003004│药股份有限公│H2003003│州白云山化学制药厂│15│┃┃│││││││3│司广州白云山│2│││┃┃││││││││化学制药厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟胶囊│ 四│保护期│6年│至2008-9-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-11-│CXS01650┃┃29│││││11│42│H2003004│药股份有限公│H2003003│州白云山制药总厂│15│┃┃│││││││4│司广州白云山│3│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟颗粒│ 四│保护期│6年│至2008-9-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-11-│CXS01651┃┃29│││││11│43│H2003004│药股份有限公│H2003003│州白云山制药总厂│15│┃┃│││││││5│司广州白云山│4│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│盐酸西布曲明片│ 二│保护期│8年│至2008-11-│2003S001│国药准字│盐城制药有限│国药证字│江苏省药物研究所,盐城制药有│2001-11-│CXS01668┃┃29│││││1│97│H2003009│公司│H2003009│限公司│19│┃┃│││││││1││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用盐酸克林│ 四│监测期│不设││2003S001│国药准字│重庆药友制药│国药证字│重庆市莱美药物技术有限公司│2001-11-│CXS01687┃┃29│霉素│││││86│H2003008│有限责任公司│H2003008││28│┃┃│││││││4││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│醋酸甲地孕酮分│ 四│保护期│6年│至2007-1-│2003S002│----│----│国药证字│西安太明医药研究所│2001-11-│CXS01698┃┃29│散片││││21│02│││H2003010││28│┃┃│││││││││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟片│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-12-│CXS01782┃┃29│││││28│44│H2003004│药股份有限公│H2003003│州白云山制药总厂│27│┃┃│││││││6│司广州白云山│5│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟分散片│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-12-│CXS01783┃┃29│││││28│46│H2003004│药股份有限公│H2003003│州白云山制药总厂│27│┃┃│││││││8│司广州白云山│7│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟分散片│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-12-│CXS01784┃┃29│││││28│45│H2003004│药股份有限公│H2003003│州白云山制药总厂│27│┃┃│││││││7│司广州白云山│6│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│肌苷氯化钠注射│ 四│保护期│6年│至2008-7-│2003S000│国药准字│江西东亚药业│国药证字│江西东亚药业有限责任公司│2002-2-4│CXS2002010┃┃29│液││││23│40│H2003004│有限责任公司│H2003003│││0┃┃│││││││0││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│环酯红霉素│ 二│过渡期│4年│至2007-1-│2003S001│国药准字│昆山双鹤药业│国药证字│中国医学科学院医药生物技术研│2002-3- │CXS2002019┃┃29│││││28│39│H2003005│有限责任公司│H2003004│究所,北京双鹤药业股份有限公│19│4┃┃│││││││6││3│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│环酯红霉素片│ 二│过渡期│4年│至2007-1-│2002S001│国药准字│北京双鹤药业│国药证字│北京双鹤药业股份有限公司│2002-3- │CXS2002019┃┃29│││││28│40│H2003005│股份有限公司│H2003004││19│5┃┃│││││││7││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│环酯红霉素片│ 二│过渡期│4年│至2007-1-│2003S001│国药准字│北京双鹤药业│国药证字│北京双鹤药业股份有限公司│2002-3- │CXS2002019┃┃29│││││28│41│H2003005│股份有限公司│H2003004││19│6┃┃│││││││8││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│复方薄荷脑鼻用│ 四│过渡期│3年│至2006-1-│2003S018│国药准字│曼秀雷敦(中│国药证字│曼秀雷敦(中山)药业有限公司│2002-4- │CXS2002029┃┃29│吸入剂││││28│1│H2003007│山)药业有限│H2003008││11│8┃┃│││││││7│公司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用盐酸克林│ 四│监测期│不设││2003S001│国药准字│海南斯达制药│国药证字│海南欧化医药科技有限公司│2002-4- │CXS2002032┃┃29│霉素│││││42│H2003005│有限公司│H2003004││22│6┃┃│││││││9││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│肠内营养混悬液│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│纽迪希亚制药│国药证字│纽迪希亚制药(无锡)有限公司│2002-5- │CXS2002037┃┃29│(TPSPA)││││28│36│H2003003│(无锡)有限公│H2003002││14│3┃┃│││││││8│司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│肠内营养混悬液│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│纽迪希亚制药│国药证字│纽迪希亚制药(无锡)有限公司│2002-5- │CXS2002037┃┃29│(TPSPA)││││28│37│H2003003│(无锡)有限公│H2003002││14│4┃┃│││││││9│司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│齐多夫定│ 四│保护期│6年│至2008-8-5│2003S001│国药准字│河南天方药业│国药证字│河南师范大学,河南天方药业股│2002-6-3│CXS2002046┃┃29││││││56│H2003006│股份有限公司│H2003006│份有限公司││0┃┃│││││││1││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│齐多夫定胶囊│ 四│保护期│6年│至2008-8-5│2003S001│国药准字│河南天方药业│国药证字│河南天方药业股份有限公司│2002-6-3│CXS2002046┃┃29││││││57│H2003006│股份有限公司│H2003006│││1┃┃│││││││2││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│奈达铂│ 二│过渡期│4年│至2007-1-│2003S001│----│----│国药证字│中国医学科学院药物研究所,南│2002-7-4│CXS2002058┃┃29│││││28│49│││H2003005│京生物工程与医药科技发展有限││1┃┃│││││││││3│公司,南京东捷医药科技有限责││┃┃││││││││││任公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用奈达铂│ 二│过渡期│4年│至2007-1-│2003S001│----│----│国药证字│中国医学科学院药物研究所,南│2002-7-4│CXS2002058┃┃29│││││28│48│││H2003005│京生物工程与医药科技发展有限││2┃┃│││││││││2│公司,南京东捷医药科技有限责││┃┃││││││││││任公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│加替沙星│ 一│过渡期│5年│至2008-1-│2003S000│国药试字│江苏扬子江药│国药证字│南京圣和药业有限公司│2002-7- │CXS2002068┃┃29│││││28│31│H2003000│业集团有限公│H2003002││30│8┃┃│││││││4│司│3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│加替沙星片│ 一│保护期│12年│至2014-8-6│2003S000│国药试字│南京圣和药业│国药证字│南京圣和药业有限公司│2002-7- │CXS2002068┃┃29││││││33│H2003000│有限公司│H2003002││30│9┃┃│││││││6││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│加替沙星胶囊│ 一│过渡期│5年│至2008-1-│2003S000│国药试字│上海海尼药业│国药证字│南京圣和药业有限公司│2002-7- │CXS2002069┃┃29│││││28│32│H2003000│有限公司│H2003002││30│0┃┃│││││││5││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│加替沙星注射液│ 一│过渡期│5年│至2008-1-│2003S000│----│----│国药证字│南京圣和药业有限公司,上海海│2002-7- │CXS2002069┃┃29│││││28│34│││H2003002│尼药业有限公司│30│1┃┃│││││││││6│││┃。
新药监测期 期限表

12.国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的制品。
2.DNA疫苗。
3.已上市销售疫苗变更新的佐剂,偶合疫苗变更新的载体。
4.由非纯化或全细胞(细菌、病毒等)疫苗改为纯化或者组份疫苗。
5.未在国内上市销售的从植物、动物、矿物等物质中提取有效部位的制剂。
6.未在国内上市销售的中药、天然药物复方制剂中:
6.1中药复方制剂;
6.2 天然药物复方制剂;
6.3 中药、天然药物和化学药品组成的复方制剂。
1.未在国内外上市销售的药品中:
1.4由已上市销售的多组份药物制备为较少组份的药物;
1.5新的复方制剂;
10.改变灭活剂(方法)或者脱毒剂(方法)的疫苗。
11.改变给药途径的疫苗。
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药的制剂。
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
14.改变给药途径的生物制品(不包括12)。
9.更换其他已批准表达体系或者已批准细胞基质生产的疫苗;采用新工艺制备并且实验室研究资料证明产品安全性和有效性明显提高的疫苗。
7.改变国内已上市销售中药、天然药物给药途径的制剂。
8.改变国内已上市销售中药、天然药物剂型的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
3.已在国外上市销售但尚未在国内上市销售的药品中:
3.2已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
3.3改变给药途径并已在国外上市销售的制剂;
国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(1)

国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(1)文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.10.10•【文号】国食药监注[2003]278号•【施行日期】2003.10.10•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(国食药监注[2003]278号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),解放军总后卫生部:根据国家药品监督管理局《关于<中华人民共和国药品管理法实施条例>实施前已批准生产和临床研究的新药的保护期的通知》(国药监注[2003]59号)、我局《关于发布新药监测期期限的通知》(国食药监注[2003]141号)的有关规定,现就2002年9月15日以后批准新药的保护期、过渡期或监测期事宜通知如下:一、对2002年9月15日以来批准的新药,尚未确定保护期、过渡期或监测期的,按其申报与审批情况分别予以确定,并自该新药证书或生产批准之日起生效。
具体品种见附件。
二、对处于过渡期内的新药,我局不受理其他申请人同品种的新药或已有国家标准药品申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
三、对没有保护期、过渡期或未设监测期的新药,自其获得药品批准文号之日起,我局不再受理其他申请人同品种的新药申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
四、过渡期内新药技术转让的申报与审批,按照原国家药品监督管理局对新药保护期的相关规定办理。
特此通知附件:2002年9月15日以来尚未确定的新药保护期、过渡期或监测期确定表国家食品药品监督管理局二00三年十月十日附件:2002年9月15日以来尚未确定的新药保护期、过渡期或监测期确定┎────┬───────┬──┬────────────┬────┬────┬──────┬────┬──────────────┬────┬─────┒┃批准日期│新药名称│注册│保护期、过渡期或监测期│批件编号│药品批准│药品生产企业│新药证书│新药证书持有人│申请日期│受理号┃┃││分类│││文号││编号│││┃┃││││││││││┃┃││├───┬──┬─────┤││││││┃┃│││ 种类│期限│终止期│││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│克拉霉素胶囊│ 四│保护期││保护期已过│2002H052│国药准字│珠海润都制药│国药证字│珠海润都制药有限公司│2000-9- │CXS00570┃┃17││││││0│H2002048│有限公司│H2002034││18│┃┃│││││││8││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│克拉霉素胶囊│ 四│保护期││保护期已过│2002H052│国药准字│珠海润都制药│国药证字│珠海润都制药有限公司│2000-9- │CXS00571┃┃17││││││1│H2002048│有限公司│H2002034││18│┃┃│││││││9││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用己酮可可│ 四│监测期│不设││2002H052│国药准字│吉林省辉南长│国药证字│东北制药集团公司沈阳第一制药│2002-1-7│CXS2002000┃┃17│碱│││││2│H2002049│龙生化药业股│H2002035│厂,吉林省辉南长龙生化药业股││1┃┃│││││││0│份有限公司│0│份有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用烟酸占替│ 四│监测期│不设││2002H052│国药准字│吉林省辉南长│国药证字│东北制药集团公司沈阳第一制药│2002-1-7│CXS2002000┃┃17│诺│││││3│H2002049│龙生化药业股│H2002035│厂,吉林省辉南长龙生化药业股││2┃┃│││││││1│份有限公司│1│份有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用烟酸占替│ 四│监测期│不设││2002H053│国药准字│国药集团国瑞│国药证字│合肥恒星药物研究所│2001-4- │CXS01216┃┃22│诺│││││0│H2002050│药业有限公司│H2002035││23│┃┃│││││││7││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│复方苯佐卡因凝│ 三│过渡期│3年│至2005-9-│2002H053│国药准字│广西半宙制药│国药证字│广西半宙制药股份有限公司,南│2001-9-3│CXS01455┃┃22│胶││││21│1│H2002050│股份有限公司│H2002035│宁市安科新技术研究所││┃┃│││││││8││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│复方苯佐卡因凝│ 三│过渡期│3年│至2005-9-│2002H054│国药准字│广西半宙制药│国药证字│广西半宙制药股份有限公司,南│2001-9-3│CXS01456┃┃22│胶││││21│0│H2002051│股份有限公司│H2002035│宁市安科新技术研究所││┃┃│││││││7││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H053│国药准字│武汉久安药业│国药证字│北京德生堂医药卫生研究所│2001-12-│CXS01753┃┃24│钠注射液││││8│9│H2002051│有限公司│H2002036││18│┃┃│││││││6││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│过渡期│3年│至2005-9-│2002H055│国药准字│齐鲁制药厂│国药证字│山东省医药工业研究所,齐鲁制│2000-6-2│CXS00340┃┃26│磷酸二氢钠││││25│0│H2002054││H2002037│药厂││┃┃│││││││0││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│阿奇霉素枸橼酸│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│浙江康裕制药│国药证字│合肥医工医药研究所,浙江康裕│2001-11-│CXS01691┃┃26│二氢钠││││25│1│H2002033│有限公司│H2002036│制药有限公司│28│┃┃│││││││7││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│浙江康裕制药│国药证字│合肥医工医药研究所,浙江康裕│2001-11-│CXS01692┃┃26│枸橼酸二氢钠││││25│3│H2002033│有限公司│H2002036│制药有限公司│28│┃┃│││││││8││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│浙江康裕制药│国药证字│合肥医工医药研究所,浙江康裕│2001-11-│CXS01693┃┃26│枸橼酸二氢钠││││25│2│H2002033│有限公司│H2002036│制药有限公司│28│┃┃│││││││9││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│结核分支杆菌核│ 四│保护期│8年│至2008-9-│2002S006│国药准字│华美生物工程│国药证字│华美生物工程公司│2001-1-3│CSS01001┃┃30│酸扩增(PCR)荧││││22│1│S2002009│公司│S2002003│││┃┃│光检测试剂盒││││││5││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│阿奇霉素磷酸二│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│齐鲁制药厂│国药证字│山东省医药工业研究所、齐鲁制│2000-6-2│CXS00339┃┃30│氢钠││││29│9│H2002053││H2002037│药厂││┃┃│││││││9││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│保护期│6年│至2005-6-│2002H056│国药准字│辽宁天龙药业│国药证字│包头市千年健科技开发有限责任│2000-9- │CXS00559┃┃30│││││24│2│H2002055│有限公司│H2002038│公司,辽宁天龙药业有限公司│13│┃┃│││││││0││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│克林霉素磷酸酯│ 四│过渡期│3年│至2005-9-│2002H056│国药准字│华北制药集团│国药证字│华北制药集团制剂有限公司│2000-9- │CXS00565┃┃30│外用溶液剂││││29│3│H2002055│制剂有限公司│H2002038││18│┃┃│││││││1││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用高三尖杉│ 四│监测期│不设││2002H056│----│西安大唐制药│国药证字│西安新通药物研究有限公司│2001-4- │CXS01203┃┃30│酯碱│││││1││有限公司│H2002038││17│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用高三尖杉│ 四│监测期│不设││2002H056│----│西安大唐制药│国药证字│西安新通药物研究有限公司│2001-4- │CXS01204┃┃30│酯碱│││││0`││有限公司│H2002038││17│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│保护期│6年│至2005-6-│2002H054│国药准字│河南辅仁怀庆│国药证字│开封康诺生化制药厂│2001-4- │CXS01208┃┃30│││││24│8│H2002053│堂制药有限公│H2002037││18│┃┃│││││││0│司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│己酮可可碱葡萄│ 四│保护期│6年│至2007-10-│2002H056│国药准字│大连德泽制药│国药证字│大连天宇制药有限公司│2001-6- │CXS01302┃┃30│糖注射液││││24│4│H2002055│有限公司│H2002038││14│┃┃│││││││2││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H056│----│----│国药证字│安徽科苑药业有限公司│2001-11-│CXS01676┃┃30│钠注射液││││8│6│││H2002038││21│┃┃│││││││││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│烟酸占替诺氯化│ 四│保护期│6年│至2007-6-│2002H056│国药准字│大连德泽制药│国药证字│中国人民解放军第九八九二工│2001-11-│CXS01677┃┃30│钠注射液││││28│5│H2002055│有限公司│H2002038│厂,丹东市鸭绿江医药研究开发│23│┃┃│││││││3││6│中心││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│口服补液盐溶液│ 四│过渡期│3年│至2005-9-│2002H056│国药准字│上海强生制药│国药证字│上海强生制药有限公司│2002-2-5│CXS2002010┃┃30│││││29│7│H2002055│有限公司│H2002038│││9┃┃│││││││4││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│多西他赛│ 四│过渡期│3年│至2005-9-│2002H055│国药准字│江苏恒瑞医药│国药证字│中国医学科学院药物研究所,江│2002-4-8│CXS2002027┃┃30│││││29│3│H2002054│股份有限公司│H2002037│苏恒瑞医药股份有限公司││3┃┃│││││││2││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用多西他赛│ 四│过渡期│3年│至2005-9-│2002H055│国药准字│江苏恒瑞医药│国药证字│中国医学科学院药物研究所,江│2002-4-8│CXS2002027┃┃30│││││29│4│H2002054│股份有限公司│H2002037│苏恒瑞医药股份有限公司││4┃┃│││││││3││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│丁苯酞│ 一│过渡期│5年│至2007-9-│2002H055│国药试字│石家庄制药集│国药证字│中国医学科学院药物研究所│2002-5- │CXS2002045┃┃30│││││29│1│H2002000│团欧意药业有│H2002037││29│2┃┃│││││││8│限公司│4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│丁苯酞软胶囊│ 一│过渡期│5年│至2007-9-│2002H055│国药试字│石家庄制药集│国药证字│中国医学科学院药物研究所│2002-5- │CXS2002045┃┃30│││││29│2│H2002000│团欧意药业有│H2002037││29│3┃┃│││││││9│限公司│5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│司他夫定│ 四│保护期│6年│至2008-9-│2002H055│国药准字│东北制药总厂│国药证字│东北制药总厂│2002-9- │CXS2002098┃┃30│││││12│7│H2002054││H2002038││28│2┃┃│││││││7││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│司他夫定胶囊│ 四│保护期│6年│至2008-9-│2002H055│国药准字│东北制药总厂│国药证字│东北制药总厂│2002-9- │CXS2002098┃┃30│││││12│8│H2002054││H2002038││28│3┃┃│││││││8││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│司他夫定胶囊│ 四│保护期│6年│至2008-9-│2002H055│国药准字│东北制药总厂│国药证字│东北制药总厂│2002-9- │CXS2002098┃┃30│││││12│9│H2002054││H2002038││28│4┃┃│││││││9││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│小儿豉翘清热颗│ 三│过渡期│3年│至2005-9-│2002Z010│国药准字│江苏帝益药业│国药证字│天津药物研究院,江苏帝益药业│2001-9- │CZS01045┃┃30│粒││││29│5│Z2002009│有限公司│Z2002007│有限公司│26│┃┃│││││││6││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│小儿豉翘清热颗│ 三│过渡期│3年│至2005-9-│2002Z010│国药准字│江苏帝益药业│国药证字│天津药物研究院,江苏帝益药业│2001-9- │CZS01046┃┃30│粒││││29│6│Z2002009│有限公司│Z2002007│有限公司│26│┃┃│││││││7││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│丙型肝炎病毒分│ 一│无│││2002S006│----│----│国药证字│中国人民解放军军事医学科学院│2001-11-│CSS01064┃┃16│片段抗体检测试│││││0│││S2002003│放射医学研究所,深圳益生堂生│21│┃┃│剂盒(蛋白芯片)││││││││4│物企业有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢呋辛酯│ 四│保护期│6年│至2006-5-│2002H057│----│----│国药证字│南京海光应用化学研究所│2000-12-│CXS00733┃┃16│││││26│1│││H2002039││18│┃┃│││││││││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢呋辛酯片│ 四│保护期│6年│至2002-9-6│2002H057│----│----│国药证字│南京海光应用化学研究所│2000-12-│CXS00734┃┃16││││││2│││H2002039││18│┃┃│││││││││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│胸腺肽&A1│ 四│过渡期│3年│至2005-10-│2002H055│国药准字│四川源基制药│国药证字│四川源基制药有限公司,成都地│2001-3- │CXS01123┃┃16│││││15│5│H2002054│有限公司│H2002037│奥九泓制药厂│15│┃┃│││││││4││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用胸腺肽& │ 四│过渡期│3年│至2005-10-│2002H055│国药准字│成都地奥九泓│国药证字│成都地奥九泓制药厂│2001-3- │CXS01124┃┃16│A1││││15│6│H2002054│制药厂│H2002037││15│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│甲磺酸托烷司琼│ 二│过渡期│4年│至2006-10-│2002H057│国药准字│北京四环医药│国药证字│中国人民解放军军事医学科学院│2001-3- │CXS01129┃┃16│││││15│7│H2002056│科技股份有限│H2002039│毒物药物研究所│19│┃┃│││││││2│公司│6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│甲磺酸托烷司琼│ 二│过渡期│4年│至2006-10-│2002H057│国药准字│北京四环医药│国药证字│中国人民解放军军事医学科学院│2001-3- │CXS01130┃┃16│片││││15│8│H2002056│科技股份有限│H2002039│毒物药物研究所│19│┃┃│││││││3│公司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│甲磺酸托烷司琼│ 二│过渡期│4年│至2006-10-│2002H057│国药准字│北京四环医药│国药证字│中国人民解放军军事医学科学院│2001-3- │CXS01131┃┃16│注射液││││15│9│H2002056│科技股份有限│H2002039│毒物药物研究所│19│┃┃│││││││4│公司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2002H058│国药准字│河南天方药业│国药证字│河南天方药业股份有限公司│2001-9- │CXS01474┃┃16│射液││││18│0│H2002056│股份有限公司│H2002039││10│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│托吡酯片│ 四│过渡期│3年│至2005-10-│2002H056│国药准字│西安杨森制药│国药证字│西安杨森制药有限公司│2001-11-│CXS01701┃┃16│││││15│8│H2002055│有限公司│H2002038││28│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│托吡酯片│ 四│过渡期│3年│至2005-10-│2002H056│国药准字│西安杨森制药│国药证字│西安杨森制药有限公司│2001-11-│CXS01702┃┃16│││││15│9│H2002055│有限公司│H2002038││28│┃┃│││││││6││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│托吡酯片│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│西安杨森制药│国药证字│西安杨森制药有限公司│2001-11-│CXS01703┃┃16│││││15│0│H2002055│有限公司│H2002038││28│┃┃│││││││7││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H058│国药准字│济南三九益民│国药证字│山东九新医药科技开发有限责任│2001-12-│CXS01789┃┃16│钠注射液││││8│3│H2002056│制药有限责任│H2002040│公司,济南三九益民制药有限责│29│┃┃│││││││8│公司│2│任公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定│ 四│保护期│6年│ 至2008-5-│2002H057│国药准字│深圳海王药业│国药证字│南京臣功制药有限公司,深圳海│2002-1-7│CXS2002000┃┃16│││││29│3│H2002055│有限公司│H2002039│王药业有限公司││3┃┃│││││││8││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定颗粒剂│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│南京三锐药业│国药证字│南京臣功制药有限公司│2002-1-7│CXS2002000┃┃16│││││15│5│H2002056│有限公司│H2002039│││4┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定咀嚼片│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│深圳海王药业│国药证字│南京臣功制药有限公司,深圳海│2002-1-7│CXS2002000┃┃16│││││15│6│H2002056│有限公司│H2002039│王药业有限公司││5┃┃│││││││1││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定胶囊│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│深圳海王药业│国药证字│南京臣功制药有限公司,深圳海│2002-1-7│CXS2002000┃┃16│││││15│4│H2002055│有限公司│H2002039│王药业有限公司││8┃┃│││││││9││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│盐酸左布比卡因│ 四│过渡期│3年│至2005-10-│2002H058│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-1-7│CXS2002000┃┃16│││││15│4│H2002056│股份有限公司│H2002040│││9┃┃│││││││9││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│盐酸左布比卡因│ 四│过渡期│3年│至2005-10-│2002H058│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-1-7│CXS2002001┃┃16│注射液││││15│5│H2002057│股份有限公司│H2002040│││0┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H058│国药准字│武汉滨湖双鹤│国药证字│武汉滨湖双鹤药业有限责任公司│2002-1-9│CXS2002002┃┃16│钠注射液││││8│1│H2002056│药业有限责任│H2002040│││0┃┃│││││││6│公司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用己酮可可│ 四│监测期│不设││2002H058│国药准字│武汉海特生物│国药证字│湖北中远医药有限公司│2002-1- │CXS2002002┃┃16│碱│││││2│H2002056│制药股份有限│H2002040││14│5┃┃│││││││7│公司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢克洛缓释片│ 四│保护期│6年│至2005-12-│2002H058│国药准字│礼来苏州制药│国药证字│礼来苏州制药有限公司│2002-2-6│CXS2002012┃┃16│││││29│6│H2002057│有限公司│H2002040│││4┃┃│││││││1││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平│ 二│过渡期│4年│至2006-10-│2002H058│国药准字│安徽新力药业│国药证字│天津药物研究院,安徽新力药业│2002-8- │CXS2002072┃┃22│││││21│9│H2002057│股份有限公司│H2002040│股份有限公司蚌埠涂山分厂│12│8┃┃│││││││8│蚌埠涂山分厂│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平片│ 二│过渡期│4年│至2006-10-│2002H058│国药准字│安徽新力药业│国药证字│天津药物研究院,安徽新力药业│2002-8- │CXS2002072┃┃22│││││21│8│H2002057│股份有限公司│H2002040│股份有限公司蚌埠涂山分厂│12│9┃┃│││││││7│蚌埠涂山分厂│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│阿司待因片│ 三│过渡期│3年│至2005-10-│2002H058│国药准字│山东新华制药│国药证字│山东新华制药股份有限公司│2001-11-│CXS01662┃┃23│││││22│7│H2002057│股份有限公司│H2002040││16│┃┃│││││││6││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢呋辛钠│ 四│保护期│6年│至2005-5-│2002H059│国药准字│浙江永宁制药│国药证字│四川抗菌素工业研究所│2002-1- │CXS2002002┃┃23│││││13│2│H2002058│厂│H2002041││10│2┃┃│││││││1││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用头孢呋辛│ 四│保护期│6年│至2005-5-│2002H059│国药准字│浙江永宁制药│国药证字│四川抗菌素工业研究所│2002-1- │CXS2002002┃┃23│钠││││13│3│H2002058│厂│H2002041││10│3┃┃│││││││2││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用头孢呋辛│ 四│保护期│6年│至2005-5-│2002H059│国药准字│浙江永宁制药│国药证字│四川抗菌素工业研究所│2002-1- │CXS2002002┃┃23│钠││││13│4│H2002058│厂│H2002041││10│4┃┃│││││││3││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│奈韦拉平│ 四│监测期│不设││2002H059│国药准字│上海迪赛诺化│国药证字│上海迪赛诺生物医药有限公司│2002-10-│CXS2002104┃┃23││││││0│H2002057│学制药有限公│H2002040││18│8┃┃│││││││9│司│9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│奈韦拉平片│ 四│监测期│不设││2002H059│国药准字│上海迪赛诺生│国药证字│上海迪赛诺生物医药有限公司│2002-10-│CXS2002104┃┃23││││││1│H2002058│物医药有限公│H2002041││18│9┃┃│││││││0│司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平│ 二│过渡期│4年│至2006-10-│2002H059│国药准字│山西泰盛制药│国药证字│山西泰盛制药有限公司,北京克│2002-10-│CXS2002099┃┃24│││││21│5│H2002058│有限公司│H2002041│莱瑞科贸有限公司呼和浩特分公│16│7┃┃│││││││4││3│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平片│ 二│过渡期│4年│至2006-10-│2002H059│国药准字│山西泰盛制药│国药证字│山西泰盛制药有限公司,北京克│2002-10-│CXS2002099┃┃24│││││21│6│H2002058│有限公司│H2002041│莱瑞科贸有限公司呼和浩特分公│16│8┃┃│││││││5││4│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│复方平贝口服液│ 三│过渡期│3年│至2005-10-│2002Z010│国药准字│大连金泉生物│国药证字│大连金泉生物工程制药有限公司│2001-1- │CZS01003┃┃24│││││23│8│Z2002010│工程制药有限│Z2002007││10│┃┃│││││││0│公司│6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│琥乙红霉素分散│ 四│保护期│6年│至2005-7-│2002H060│国药准字│三九企业集团│国药证字│合肥新思达医药技术有限公司│2001-3- │CXS01159┃┃29│片││││28│9│H2002059│永安制药厂│H2002042││28│┃┃│││││││9││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│己酮可可碱葡萄│ 四│保护期│6年│至2007-10-│2002H061│国药准字│安庆制药有限│国药证字│安徽省安泰医药生物技术有限责│2001-4-2│CXS01172┃┃29│糖注射液││││24│6│H2002061│公司│H2002042│任公司││┃┃│││││││6││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H061│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01265┃┃29│││││28│7│H2002061│总厂│H2002043││29│┃┃│││││││7││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H061│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01266┃┃29│││││28│9│H2002061│总厂│H2002043││29│┃┃│││││││9││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H061│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01267┃┃29│││││28│8│H2002061│总厂│H2002043││29│┃┃│││││││8││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H062│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01268┃┃29│││││28│0│H2002062│总厂│H2002043││29│┃┃│││││││0││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│高三尖杉酯碱氯│ 四│保护期│6年│至2008-7-│2002H063│国药准字│陕西金裕制药│国药证字│陕西金裕制药股份有限公司│2001-6-4│CXS01286┃┃29│化钠注射液││││24│9│H2002063│股份有限公司│H2002044│││┃┃│││││││1││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2002H062│----│----│国药证字│山东省医药工业研究所│2001-7- │CXS01367┃┃29│射液││││18│4│││H2002043││18│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2002H063│国药准字│山东天福制药│国药证字│山东省医疗器械研究所│2001-8-8│CXS01403┃┃29│射液││││18│1│H2002062│厂│H2002043│││┃┃│││││││4││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用硫酸奈替│ 四│保护期│6年│至2007-11-│2002H064│----│----│国药证字│北京华睿鼎信科技有限公司,湖│2001-9-3│CXS01462┃┃29│米星││││6│0│││H2002044│北午时药业股份有限公司││┃。
国家食品药品监督管理局关于发布新药监测期期限的通知

国家食品药品监督管理局关于发布新药监测期期限的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.07.08•【文号】国食药监注[2003]141号•【施行日期】2003.07.08•【效力等级】部门规范性文件•【时效性】失效•【主题分类】药政管理正文*注:本篇法规已被:国家食品药品监督管理局关于废止和宣布失效的规范性文件目录(第二批)的公告(发布日期:2011年6月28日,实施日期:2011年6月28日)废止国家食品药品监督管理局关于发布新药监测期期限的通知(国食药监注[2003]141号)各省、自治区、直辖市药品监督管理局:根据《中华人民共和国药品管理法实施条例》和国家药品监督管理局《药品注册管理办法(试行)》关于新药监测期管理的规定,国家食品药品监督管理局对不同类别新药分别制定了监测期期限(见附件),并经局务会讨论通过,现予发布试行。
各有关单位和药品注册申请人应当按照《药品注册管理办法》的规定,做好新药监测期期间的各项工作。
执行中遇到的问题,请及时反馈我局药品注册司。
特此通知附件:新药监测期期限表(试行)国家食品药品监督管理局二00三年七月八日附件:新药监测期期限表(试行)┏━━┯━━━━━━━━━━━━━┯━━━━━━━━━━━━━━━━┯━━━━━━━━━━━━━━━━━━━━━━┯━━━━━━━━━━━━━┓┃期限│中药、天然药物│化学药品│治疗性生物制品│预防性生物制品┃┠──┼─────────────┼────────────────┼──────────────────────┼─────────────┨┃5年│1.未在国内上市销售的从中│1.未在国内外上市销售的药品:│1.未在国内外上市销售的生物制品。
│1.未在国内外上市销售的疫┃┃│药、天然药物中提取的有效成│1.1通过合成或者半合成的方法制││苗。
┃┃│份及其制剂。
│得的原料药及其制剂;││┃┃││1.2天然物质中提取或者通过发酵││┃┃││提取的新的有效单体及其制剂;││┃┃││1.3用拆分或者合成等方法制得的││┃┃││已知药物中的光学异构体及其制剂。
新药保护期过渡期监测期的区别

新药保护期、过渡期、监测期的区别
2008-11-27 15:21:42
1、新药保护期(1985~2002.9.15)
1985~1999/5/1 ,新药保护期如下:
1999/5/1~2002/9/15 ,新药保护期如下:
2、过渡期(适用于2002.9.15前批临床但未批生产的)
对于2002年9月15日以前我局已经批准临床研究但未批准生产的新药,仍按照原药品注册管理的有关规定审批。
批准生产后,按照原《新药审批办法》属于一类新药的,给予5年的过渡期;属于二类新药的,给予4年的过渡期;属于三类至五类新药的,给予3年的过渡期。
在过渡期内,其他药品生产企业不得生产相同品种的药品。
3、监测期
对于2002年9月15日以前我局已经受理但未批准临床研究的新药,
以及2002年9月15日以后我局受理的新药,按照修订的《药品管理法》及《实施条例》的有关规定审批。
即:对未曾在中国境内上市销售的品种,按照新药审批,并且对批准药品生产企业生产的新药,设立不超过5年的监测期;对已经在中国境内上市销售的品种,按照已有国家标准药品审批。
具体监测期限见下表
新药监测期期限表(试行).。
国家食品药品监督管理局印发关于药品注册管理的补充规定的通知

国家食品药品监督管理局印发关于药品注册管理的补充规定的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.12.23•【文号】国食药监注[2003]367号•【施行日期】2003.12.23•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局印发关于药品注册管理的补充规定的通知(国食药监注[2003]367号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):《药品注册管理办法(试行)》(以下简称《办法》),已于2002年12月1日起施行。
为做好《办法》的实施工作,原国家药品监督管理局先后下发了《关于实施〈药品注册管理办法(试行)〉有关事项的通知》(国药监注〔2002〕437号)和《关于发布新药监测期期限的通知》(国食药监注〔2003〕141号)。
为解决《办法》实施过程中发现的新问题,我局研究制定了药品注册管理的补充规定,现印发你们,请结合以上3个文件的实施,认真贯彻执行。
国家食品药品监督管理局二00三年十二月二十三日关于药品注册管理的补充规定一、关于药品注册的申请和受理问题根据我局《关于发布新药监测期期限的通知》,对于不设立监测期的新药,自批准注册之日起,不再受理同品种新药申请。
我局已受理的新药申请,继续按原程序和要求审批;各省级食品药品监督管理局(药品监督管理局)此前已收到,但我局尚未受理的同品种新药申请,由省局予以退回。
在该品种的试行标准转正后,申请人可以提出已有国家标准药品的注册申请。
二、关于药品商品名问题(一)新药拟使用商品名,应当由药品生产企业在申请新药注册时一并提出。
(二)设立监测期的新药,在监测期内,申请人可以按照补充申请的要求申请增加商品名;监测期已过的药品,不再批准增加商品名。
(三)不设立监测期的新药,自批准首家注册后,2年内申请人可以按照补充申请的要求申请增加商品名;超过2年不再批准增加商品名。
药品注册管理办法2007

目录第一章总则 (2)第二章基本要求 (3)第三章药物的临床试验 (7)第四章新药申请的申报与审批 (10)第一节新药临床试验 (11)第二节新药生产 (12)第五章仿制药的申报与审批 (15)第一节进口药品的注册 (17)第二节进口药品分包装的注册 (19)第七章非处方药的申报 (20)第八章补充申请的申报与审批 (21)第九章药品再注册 (23)第十章药品注册检验 (24)第十一章药品注册标准和说明书 (25)第一节药品注册标准 (26)第二节药品标准物质 (26)第三节药品名称、说明书和标签 (26)第十二章时限 (27)第十三章复审 (29)第十四章法律责任 (30)第十五章附则 (32)化学药品注册分类及申报资料要求 (35)生物制品注册分类及申报资料要求 (53)药品补充申请注册事项及申报资料要求 (75)药品再注册申报资料项目 (86)新药监测期期限表(说明:除以下情形的新药不设立监测期)(表1~3) (88)《药品注册管理办法》(局令第28号)《药品注册管理办法》于2007年6月18日经国家食品药品监督管理局局务会审议通过,现予公布,自2007年10月1日起施行。
局长:邵明立二○○七年七月十日药品注册管理办法第一章总则第一条为保证药品的安全、有效和质量可控,规范药品注册行为,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)、《中华人民共和国行政许可法》(以下简称《行政许可法》)、《中华人民共和国药品管理法实施条例》(以下简称《药品管理法实施条例》),制定本办法。
第二条在中华人民共和国境内申请药物临床试验、药品生产和药品进口,以及进行药品审批、注册检验和监督管理,适用本办法。
第三条药品注册,是指国家食品药品监督管理局根据药品注册申请人的申请,依照法定程序,对拟上市销售药品的安全性、有效性、质量可控性等进行审查,并决定是否同意其申请的审批过程。
第四条国家鼓励研究创制新药,对创制的新药、治疗疑难危重疾病的新药实行特殊审批。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
12.国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的制品。
2.DNA疫苗。
3.已上市销售疫苗变更新的佐剂,偶合疫苗变更新的载体。
4.由非纯化或全细胞(细菌、病毒等)疫苗改为纯化或者组份疫苗。
5.采用未经国内批准的菌毒种生产的疫苗(流感疫苗、钩端螺旋体疫苗等除外)。
6.已在国外上市销售但未在国内上市销售的疫苗。
7.采用国内已上市销售的疫苗制备的结合疫苗或者联合疫苗。
8.与已上市销售疫苗保护性抗原谱不同的重组疫苗。
表3:以下情形的新药设立3年的监测期
中药、天然药物
化学药品
治疗性生物制品
预防用生物制品
2.改变给药途径且尚未在国内外上市销售的制剂。
3.已在国外上市销售但尚未在国内上市销售的药品中:
3.1已在国外上市销售的制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
2.单克隆抗体。
3.基因治疗、体细胞治疗及其制品。
4.变态反应原制品。
5.由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。
6.由已上市销售生物制品组成新的复方制品。
7.已在国外上市销售但尚未在国内上市销售的生物制品。
8.含未经批准菌种制备的微生态制品。
9.与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。
10.与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。
附件6:
新药监测期期限表(说明:除以下情形的新药不设立监测期)(表1~3)
表1:以下情形的新药设立5年的监测期
中药、天然药物
化学药品
治疗性生物制品
预防用生物制品
1.未在国内上市销售的从植物、动物、矿物等物质中提取有效成份的制剂。
1.未在国内外上市销售的药品中:
1.1通过合成或者半合成的方法制得原料药的制剂;
7.改变国内已上市销售中药、天然药物给药途径的制剂。
8.改变国内已上市销售中药、天然药物剂型的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
3.已在国外上市销售但尚未在国内上市销售的药品中:
3.2已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
3.3改变给药途径并已在国外上市销售的制剂;
1.2天然物质中提取或者通过发酵提取的新有效单体的制剂;
1.3用拆分或者合成等方法制得的已知药物中光学异构体的制剂;
1.未在国内外上市销售的生物制品。
1.未在国内外上市销售的疫苗。
表2:以下情形的新药设立4年的监测期
中药、天然药物
化学药品
治疗性生物制品
预防用生物制品
2.新发现药材的制剂。
4.药材新药用部位的制剂。
5.未在国内上市销售的从植物、动物、矿物等物质中提取有效部位的制剂。
6.未在国内上市销售的中药、天然药物复方制剂中:
6.1中药复方制剂;
6ቤተ መጻሕፍቲ ባይዱ2天然药物复方制剂;
6.3中药、天然药物和化学药品组成的复方制剂。
1.未在国内外上市销售的药品中:
1.4由已上市销售的多组份药物制备为较少组份的药物;
1.5新的复方制剂;
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药的制剂。
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
14.改变给药途径的生物制品(不包括12)。
9.更换其他已批准表达体系或者已批准细胞基质生产的疫苗;采用新工艺制备并且实验室研究资料证明产品安全性和有效性明显提高的疫苗。
10.改变灭活剂(方法)或者脱毒剂(方法)的疫苗。
11.改变给药途径的疫苗。
