关于发布新药监测期期限的通知
国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(4)

国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(4)文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.10.10•【文号】国食药监注[2003]278号•【施行日期】2003.10.10•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文续(3)┎────┬───────┬──┬────────────┬────┬────┬──────┬────┬──────────────┬────┬─────┒┃批准日期│新药名称│注册│保护期、过渡期或监测期│批件编号│药品批准│药品生产企业│新药证书│新药证书持有人│申请日期│受理号┃┃││分类│││文号││编号│││┃┃││││││││││┃┃││├───┬──┬─────┤││││││┃┃│││ 种类│期限│终止期│││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│复方鱼腥草合剂│ 四│过渡期│3年│至2006-4-9│2003S006│国药准字│杭州尖峰德康│国药证字│杭州尖峰德康药业有限公司│2000-9- │CZS00078┃┃10││││││88│Z2003003│药业有限公司│Z2003002││20│┃┃│││││││3││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│茵栀黄颗粒│ 四│过渡期│3年│至2006-4-9│2003S006│国药准字│鲁南制药股份│国药证字│鲁南制药股份有限公司│2001-8-8│CZS01036┃┃10││││││75│Z2003002│有限公司│Z2003001│││┃┃│││││││8││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│五味沙棘颗粒│ 四│过渡期│3年│至2006-4-9│2003S006│国药准字│甘肃省河西制│国药证字│甘肃省河西制药厂│2001-7- │CZS01042┃┃10││││││77│Z2003003│药厂│Z2003001││24│┃┃│││││││0││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│乌鸡白凤颗粒│ 四│过渡期│3年│至2006-4-9│2003S006│国药准字│佛山德众药业│国药证字│佛山德众药业有限公司││CZS98044┃┃10││││││76│Z2003002│有限公司│Z2003001│││┃┃│││││││9││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│格列美脲胶囊│ 二│保护期│8年│至2008-12-│2003S005│国药准字│广西北生药业│国药证字│贵州天安药业有限责任公司,广│2001-9- │CXS01534┃┃16│││││14│90│H2003028│股份有限公司│H2003020│西北生药业股份有限公司│26│┃┃│││││││3││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│麻疹、腮腺炎二│ 四│过渡期│3年│至2006-4-│2003S008│国药准字│武汉生物制品│国药证字│武汉生物制品研究所│2001-7- │CSS01033┃┃23│联减毒活疫苗││││22│72│S2003003│研究所│S2003002││30│┃┃│││││││8││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│注射用重组人白│ 二│过渡期│4年│至2007-3-│2003S007│国药准字│成都地奥九泓│国药证字│成都地奥九泓制药厂│2001-10-│CSS01050┃┃23│介素11││││16│71│S2003003│制药厂│S2003002││25│┃┃│││││││4││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│补体因子C3定量│ 二│无│││2003S008│国药准字│上海科华生物│国药证字│上海科华生物工程股份有限公司│2001-10-│CSS01052┃┃23│测定试剂盒(免│││││74│S2003004│工程股份有限│S2003002││31│┃┃│疫比浊法)││││││0│公司│9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│补体因子C4测定│ 二│无│││2003S008│国药准字│上海科华生物│国药证字│上海科华生物工程股份有限公司│2001-10-│CSS01053┃┃23│试剂盒(免疫比│││││73│S2003003│工程股份有限│S2003002││31│┃┃│浊法)││││││9│公司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│免疫球蛋白IgA │ 二│无│││2003S008│国药准字│上海科华生物│国药证字│上海科华生物工程股份有限公司│2001-10-│CSS01054┃┃23│定量测定试剂盒│││││70│S2003003│工程股份有限│S2003002││31│┃┃│(免疫比浊法)││││││6│公司│5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│冻干滴眼用重组│ 四│过渡期│3年│至2006-4-│2003S008│----│----│国药证字│武汉市生物新制剂工程技术研究│2002-2-6│CSS2002001┃┃23│人干扰素&A1b││││22│68│││S2003002│中心,深圳科兴生物工程股份有││0┃┃│││││││││3│限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│人类免疫缺陷病│ 四│无│││2003S008│国药准字│英科新创(厦│国药证字│英科新创(厦门)科技有限公司│2002-8- │CSS2002004┃┃23│毒HIV(1/2)抗体│││││67│S2003003│门)科技有限│S2003002││12│4┃┃│诊断试剂盒(胶││││││5│公司│2│││┃┃│体金法)│││││││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸左旋氧氟沙│ 四│过渡期│3年│至2006-4-│2003S008│国药准字│江苏爱普森药│国药证字│盐城制药有限公司,江苏爱普森│2000-3- │CXS00174┃┃23│星滴眼液││││22│04│H2003039│业有限公司│H2003028│药业有限公司│22│┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│烟酸占替诺氯化│ 四│保护期│6年│至2007-6-│2003S007│国药准字│江西赣南海欣│国药证字│济南开发区科隆生物技术开发中│2000-9-4│CXS00539┃┃23│钠注射液││││28│91│H2003037│药业股份有限│H2003027│心,江西赣南海欣药业股份有限││┃┃│││││││8│公司│1│公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│阿司匹林肠溶缓│ 四│过渡期│3年│至2006-4-│2003S008│国药准字│山东新华制药│国药证字│中国医药研究开发中心,山东新│2000-12-│CXS00744┃┃23│释片││││22│10│H2003039│股份有限公司│H2003029│华制药股份有限公司│20│┃┃│││││││6││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│联苯苄唑喷雾剂│ 四│过渡期│3年│至2006-4-│2003S007│----│----│国药证字│上海九福药业有限公司│2001-1- │CXS01017┃┃23│││││22│92│││H2003027││10│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│硫酸奈替米星葡│ 四│保护期│6年│至2007-3-│2003S007│国药准字│江苏长江药业│国药证字│南京中西制剂研究所│2001-2-5│CXS01047┃┃23│萄糖注射液││││20│73│H2003036│有限公司│H2003025│││┃┃│││││││1││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│单硝酸异山梨酯│ 四│保护期│6年│至2007-1-│2003S008│国药准字│山东淄川制药│国药证字│济南新力特科技有限公司,山东│2001-3- │CXS01163┃┃23│葡萄糖注射液││││21│09│H2003039│厂│H2003028│淄川制药厂│28│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸班布特罗│ 四│保护期│6年│至2006-12-│2003S007│国药准字│湖南亚大制药│国药证字│湖南亚大制药有限公司│2001-4-9│CXS01183┃┃23│││││14│95│H2003038│有限公司│H2003027│││┃┃│││││││1││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸班布特罗片│ 四│保护期│6年│至2005-6-│2003S007│国药准字│湖南亚大制药│国药证字│湖南亚大制药有限公司│2001-4-9│CXS01184┃┃23│││││21│96│H2003038│有限公司│H2003027│││┃┃│││││││2││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│石杉碱甲胶囊│ 四│保护期│6年│至2005-12-│2003S007│国药准字│重庆药友制药│国药证字│中国科学院上海药物研究所,重│2001-5- │CXS01252┃┃23│││││29│85│H2003003│有限责任公司│H2003026│庆药友制药有限责任公司│21│┃┃│││││││73││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│马来酸氨氯地平│ 四│保护期│6年│至2005-12-│2003S008│国药准字│东北制药总厂│国药证字│东北制药总厂│2001-6- │CXS01336┃┃23│││││29│07│H2003039││H2003028││27│┃┃│││││││3││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│马来酸氨氯地平│ 四│保护期│6年│至2005-12-│2003S008│国药准字│东北制药总厂│国药证字│东北制药总厂│2001-6- │CXS01337┃┃23│片││││29│08│H2003039││H2003028││27│┃┃│││││││4││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│复方甘氨酸茶碱│ 四│过渡期│3年│至2006-4-│2003S008│国药准字│吉林省辉南长│国药证字│辽宁省医药工业研究院│2001-8-1│CXS01395┃┃23│钠片││││22│00│H2003038│龙生化药业股│H2003028│││┃┃│││││││6│份有限公司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│复方甘氨酸茶碱│ 四│过渡期│3年│至2006-4-│2003S008│国药准字│吉林省辉南长│国药证字│辽宁省医药工业研究院│2001-8-1│CXS01396┃┃23│钠胶囊││││22│01│H2003038│龙生化药业股│H2003028│││┃┃│││││││7│份有限公司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│右旋布洛芬│ 四│保护期│6年│至2007-9-5│2003S007│国药准字│苏州第四制药│国药证字│江苏省药物研究所,苏州第四制│2001-9-3│CXS01457┃┃23││││││86│H2003037│厂│H2003026│药厂││┃┃│││││││4││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│右旋布洛芬片│ 四│保护期│6年│至2007-9-5│2003S007│----│----│国药证字│江苏省药物研究所,苏州第四制│2001-9-3│CXS01458┃┃23││││││87│││H2003026│药厂││┃┃│││││││││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│右旋布洛芬胶囊│ 四│过渡期│3年│至2006-4-│2003S007│国药准字│苏州第四制药│国药证字│江苏省药物研究所,苏州第四制│2001-9-3│CXS01459┃┃23│││││22│88│H2003037│厂│H2003026│药厂││┃┃│││││││5││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│己酮可可碱葡萄│ 四│保护期│6年│至2007-10-│2003S007│国药准字│江苏鹏鹞药业│国药证字│江苏鹏鹞药业有限公司│2001-9- │CXS01492┃┃23│糖注射液││││24│75│H2003036│有限公司│H2003025││17│┃┃│││││││3││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│抑肽酶氯化钠注│ 四│监测期│不设││2003S007│国药准字│兰州大得利生│国药证字│兰州大得利生物化学制药(厂)有│2001-10-│CXS01550┃┃23│射液│││││97│H2003038│物化学制药( │H2003027│限公司│10│┃┃│││││││3│厂)有限公司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│抑肽酶氯化钠注│ 四│监测期│不设││2003S007│国药准字│兰州大得利生│国药证字│兰州大得利生物化学制药(厂)有│2001-10-│CXS01551┃┃23│射液│││││98│H2003038│物化学制药( │H2003027│限公司│10│┃┃│││││││4│厂)有限公司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│抑肽酶氯化钠注│ 四│监测期│不设││2003S007│国药准字│兰州大得利生│国药证字│兰州大得利生物化学制药(厂)有│2001-10-│CXS01552┃┃23│射液│││││99│H2003038│物化学制药( │H2003027│限公司│10│┃┃│││││││5│厂)有限公司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│腺苷│ 四│过渡期│3年│至2006-4-│2003S006│国药准字│沈阳光大制药│国药证字│沈阳市万嘉生物技术研究所│2001-10-│CXS01589┃┃23│││││22│98│H2003031│有限公司│H2003022││31│┃┃│││││││9││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│腺苷注射液│ 四│过渡期│3年│至2006-4-│2003S006│国药准字│沈阳光大制药│国药证字│沈阳市万嘉生物技术研究所│2001-10-│CXS01590┃┃23│││││22│99│H2003032│有限公司│H2003022││31│┃┃│││││││0││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│腺苷注射液(供│ 四│过渡期│3年│至2006-4-│2003S007│国药准字│沈阳光大制药│国药证字│沈阳市万嘉生物技术研究所│2001-10-│CXS01591┃┃23│诊断用)││││22│00│H2003032│有限公司│H2003022││31│┃┃│││││││1││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│异福酰胺片│ 三│保护期│6年│至2006-1-│2003S007│国药准字│南京恒生制药│国药证字│赤峰顺达医药化工研究所,南京│2001-11-│CXS01689┃┃23│││││12│81│H2003036│厂│H2003026│恒生制药厂│28│┃┃│││││││9││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸格拉司琼氯│ 四│保护期│6年│至2007-9-5│2003S007│国药准字│成都倍特药业│国药证字│山东省千佛山医院,成都倍特药│2001-11-│CXS01708┃┃23│化钠注射液│││││82│H2003037│有限公司│H2003026│业有限公司│30│┃┃│││││││0││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│壬二酸│ 四│过渡期│3年│至2006-4-│2003S007│国药准字│浙江金华康恩│国药证字│浙江康恩贝集团研究开发中心│2002-1-7│CXS2002000┃┃23│││││22│35│H2003032│贝生物制药有│H2003022│││6┃┃│││││││8│限公司│9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│壬二酸乳膏│ 四│过渡期│3年│至2006-4-│2003S007│国药准字│浙江康恩贝集│国药证字│浙江康恩贝集团研究开发中心│2002-1-7│CXS2002000┃┃23│││││22│36│H2003032│团养颜堂制药│H2003023│││7┃┃│││││││9│有限公司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│氟康唑注射液│ 四│保护期││保护期已过│2003S007│国药准字│山东鲁抗辰欣│国药证字│济南维瑞医药科技开发有限公│2002-1- │CXS2002007┃┃23││││││89│H2003037│药业有限公司│H2003026│司,山东鲁抗辰欣药业有限公司│30│3┃┃│││││││6││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│复方氢溴酸右美│ 四│过渡期│3年│至2006-4-│2003S008│国药准字│上海新亚药业│国药证字│上海新亚药业有限公司│2002-2-5│CXS2002011┃┃23│沙芬颗粒剂││││22│11│H2003039│闵行有限公司│H2003029│││0┃┃│││││││7││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸维拉帕米缓│ 四│保护期│6年│至2007-5-│2003S007│国药准字│黑龙江澳利达│国药证字│黑龙江省澳利达药物研究所,黑│2002-2- │CXS2002013┃┃23│释胶囊││││26│90│H2003037│制药有限公司│H2003027│龙江澳利达制药有限公司│20│6┃┃│││││││7││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│注射用紫杉醇脂│ 四│过渡期│3年│至2006-4-│2002S007│国药准字│南京思科药业│国药证字│江苏省药物研究所,南京康海医│2002-3- │CXS2002018┃┃23│质体││││22│68│H2003035│有限公司│H2003024│药开发有限公司│13│2┃┃│││││││7││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸氨溴索片│ 四│保护期││保护期已过│2003S007│国药准字│上海勃林格殷│国药证字│上海勃林格殷格翰药业有限公司│2002-3- │CXS2002021┃┃23││││││72│H2003036│格翰药业有限│H2003025││25│0┃┃│││││││0│公司│2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│更昔洛韦氯化钠│ 四│保护期│6年│至2008-7-│2003S007│国药准字│丽珠集团利民│国药证字│湖北丽益医药科技有限公司│2002-3- │CXS2002021┃┃23│注射液││││18│78│H2003036│制药厂│H2003025││26│7┃┃│││││││6││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│更昔洛韦氯化钠│ 四│保护期│6年│至2008-7-│2003S007│国药准字│丽珠集团利民│国药证字│湖北丽益医药科技有限公司│2002-3- │CXS2002021┃┃23│注射液││││18│79│H2003036│制药厂│H2003025││26│8┃┃│││││││7││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│美洛昔康│ 四│保护期│6年│至2007-1-│2003S008│国药准字│苏州中化药品│国药证字│合肥医工医药研究所,苏州中化│2002-3- │CXS2002022┃┃23│││││11│05│H2003039│工业有限公司│H2003028│药品工业有限公司│27│3┃┃│││││││1││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│美洛昔康片│ 四│保护期│6年│至2007-3-│2003S008│国药准字│苏州中化药品│国药证字│苏州中化药品工业有限公司,合│2002-3- │CXS2002022┃┃23│││││13│06│H2003039│工业有限公司│H2003028│肥医工医药研究所│27│4┃┃│││││││2││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│苦参素氯化钠注│ 四│监测期│不设││2003S007│国药准字│山东临淄制药│国药证字│济南隆格医药科技有限公司,山│2002-4- │CXS2002031┃┃23│射液│││││93│H2003037│厂│H2003027│东临淄制药厂│18│4┃┃│││││││9││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│多索茶碱葡萄糖│ 四│保护期│6年│至2008-9-│2003S007│国药准字│锦州九泰药业│国药证字│锦州九泰药业有限责任公司,山│2002-4- │CXS2002033┃┃23│注射液││││11│83│H2003037│有限责任公司│H2003026│东山大医药科技研究中心│24│7┃┃│││││││1││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│多索茶碱葡萄糖│ 四│保护期│6年│至2008-9-│2003S007│国药准字│锦州九泰药业│国药证字│锦州九泰药业有限责任公司,山│2002-4- │CXS2002033┃┃23│注射液││││11│84│H2003037│有限责任公司│H2003026│东山大医药科技研究中心│24│8┃┃│││││││2││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│替加氟氯化钠注│ 四│监测期│不设││2003S007│国药准字│山东华鲁制药│国药证字│山东华鲁制药有限公司│2002-4- │CXS2002034┃┃23│射液│││││74│H2003036│有限公司│H2003025││24│2┃┃│││││││2││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│奥硝唑氯化钠注│ 四│保护期│6年│至2008-1-│2003S007│国药准字│陕西金裕制药│国药证字│长沙市华美医药研究所,陕西金│2002-5- │CXS2002037┃┃23│射液││││24│42│H2003032│股份有限公司│H2003023│裕制药股份有限公司│13│0┃┃│││││││9││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸伊托必利│ 二│保护期│8年│至2009-3-│2003S007│国药准字│哈药集团制药│国药证字│武汉麒麟科技发展有限公司│2002-5- │CXS2002039┃┃23│││││13│33│H2003032│总厂│H2003022││15│0┃┃│││││││6││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸伊托必利胶│ 二│过渡期│4年│至2007-4-│2003S007│国药准字│哈药集团制药│国药证字│武汉麒麟科技发展有限公司│2002-5- │CXS2002039┃┃23│囊││││22│34│H2003032│总厂│H2003022││15│1┃┃│││││││7││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│烟酸占替诺氯化│ 四│保护期│6年│至2007-6-│2003S007│国药准字│锦州九泰药业│国药证字│沈阳药科大学,锦州九泰药业有│2002-5- │CXS2002041┃┃23│钠注射液││││28│77│H2003036│有限责任公司│H2003025│限责任公司│16│1┃┃│││││││5││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│苦参素氯化钠注│ 四│监测期│不设││2003S007│国药准字│哈药集团三精│国药证字│哈尔滨康信药物技术开发有限公│2002-5- │CXS2002045┃┃23│射液│││││76│H2003036│制药有限公司│H2003025│司│29│1┃┃│││││││4││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸伊托必利│ 二│保护期│8年│至2009-3-│2003S008│国药准字│江苏豪森药业│国药证字│江苏豪森药业股份有限公司,成│2002-6-4│CXS2002046┃┃23│││││13│02│H2003038│股份有限公司│H2003028│都圣奥医药科技开发有限公司││5┃┃│││││││8││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│盐酸伊托必利片│ 二│保护期│8年│至2009-3-│2003S008│国药准字│江苏豪森药业│国药证字│江苏豪森药业股份有限公司,成│2002-6-4│CXS2002046┃┃23│││││13│03│H2003038│股份有限公司│H2003028│都圣奥医药科技开发有限公司││6┃┃│││││││9││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│苦参素氯化钠注│ 四│监测期│不设││2003S007│国药准字│山东新华制药│国药证字│山东新华制药股份有限公司│2002-7-3│CXS2002056┃┃23│射液│││││94│H2003038│股份有限公司│H2003027│││5┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│磷酸川芎嗪氯化│ 四│监测期│不设││2003S006│国药准字│吉林省长源药│国药证字│吉林省长源药业有限公司│2002-8- │CXS2002078┃┃23│钠注射液│││││97│H2003030│业有限公司│H2003022││21│8┃┃│││││││3││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│更昔洛韦氯化钠│ 四│保护期│6年│至2008-7-│2003S007│国药准字│丽珠集团利民│国药证字│湖北丽益医药科技有限公司│2002-10-│CXS2002106┃┃23│注射液││││18│80│H2003036│制药厂│H2003025││22│2┃┃│││││││8││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│氯氧喹│ 一│过渡期│5年│至2008-4-│2003S007│国药准字│通化茂祥制药│国药证字│通化茂祥制药有限公司││CXS87092┃┃23│││││22│69│H2003035│有限公司│H2003025│││┃┃│││││││8││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│氯氧喹胶囊│ 一│过渡期│5年│至2008-4-│2003S007│国药准字│通化茂祥制药│国药证字│通化茂祥制药有限公司││CXS87092┃┃23│││││22│70│H2003035│有限公司│H2003025│││┃┃│││││││9││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│正元胶囊│ 三│过渡期│3年│至2006-4-│2003S008│国药准字│海南养生堂药│国药证字│海南养生堂药业有限公司│2000-10-│CZS00087┃┃23│││││22│15│Z2003004│业有限公司│Z2003002││30│┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│断血流口服液│ 四│保护期│6年│至2006-12-│2003S006│国药准字│大连珍奥药业│国药证字│安徽省安庆市第四制药厂,安徽│2002-8- │CZS95084┃┃23│││││27│96│Z2003003│有限公司│Z2003002│省安泰医药生物技术有限责任公│21│┃┃│││││││8││2│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│肌钙蛋白I/CK- │ 二│无│││2003S008│----│----│国药证字│北京亿利高科生物工程技术研究│2002-12-│X0200002┃┃23│MB联检胶体金法│││││69│││S2003002│所,亿利资源集团公司│16│┃┃│诊断试剂盒││││││││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│齐多夫定│ 四│保护期│6年│至2008-8-5│2003S007│国药准字│厦门迈克制药│国药证字│厦门迈克制药有限公司│2003-3- │X0301784┃┃23││││││67│H2003035│有限公司│H2003024││31│┃┃│││││││6││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│注射用重组改构│ 一│过渡期│5年│至2008-4-│2003S006│----│----│国药证字│中国人民解放军第四军医大学生│2002-7- │CSS2002004┃┃24│人肿瘤坏死因子││││23│92│││S2003001│物技术中心,上海赛达生物药业│31│2┃┃│││││││││9│有限公司,广东泰禾生物药业有││┃┃││││││││││限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│匹多莫德│ 四│保护期│6年│至2007-2-4│2003S007│国药准字│浙江仙琚制药│国药证字│浙江仙琚制药股份有限公司│2002-8- │CXS2002082┃┃25││││││31│H2003032│股份有限公司│H2003022││28│7┃┃│││││││4││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│匹多莫德颗粒剂│ 四│过渡期│3年│至2006-3-│2003S007│国药准字│浙江仙琚制药│国药证字│浙江仙琚制药股份有限公司│2002-8- │CXS2002082┃┃25│││││16│32│H2003032│股份有限公司│H2003022││28│8┃┃│││││││5││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│奥扎格雷钠葡萄│ 四│监测期│不设││2003S006│国药准字│丹东联盛制药│国药证字│淄博伊奥生物技术开发有限公│2001-10-│CXS01579┃┃28│糖注射液│││││91│H2003030│有限公司│H2003021│司,丹东联盛制药有限公司│24│┃┃│││││││7││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│硝酸舍他康唑│ 二│过渡期│4年│至2007-4-│2003S007│----│----│国药证字│河北省药物研究所│2001-11-│CXS01694┃┃28│││││27│29│││H2003022││28│┃┃│││││││││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-4-│硝酸舍他康唑软│ 二│过渡期│4年│至2007-4-│2003S007│----│----│国药证字│河北省药物研究所│2001-11-│CXS01695┃┃28│膏││││27│30│││H2003022││28│┃┃│││││││││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-5-6│盐酸格拉司琼│ 四│保护期││保护期已过│2003S007│国药准字│浙江海正药业│国药证字│浙江海正药业股份有限公司│2001-6- │CXS01306┃┃││││││51│H2003034│股份有限公司│H2003024││18│┃┃│││││││0││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-5-6│盐酸格拉司琼注│ 四│保护期││保护期已过│2003S007│国药准字│浙江海正药业│国药证字│浙江海正药业股份有限公司│2001-6- │CXS01307┃┃│射液│││││52│H2003034│股份有限公司│H2003024││18│┃。
新药保护期、过渡期、监测期

新药保护期、过渡期、监测期…一次说清楚1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
药品注册管理办法(17号令)

药品注册管理办法(17号令)2007-05-25 14:59:51国家食品药品监督管理局令第17号《药品注册管理办法》经国家食品药品监督管理局局务会审议通过,现予公布,自2005年5月1日起施行。
局长:郑筱萸二○○五年二月二十八日药品注册管理办法第一章总则第一条为保证药品的安全、有效和质量可控,规范药品注册行为,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)、《中华人民共和国药品管理法实施条例》(以下简称《药品管理法实施条例》),制定本办法。
第二条在中华人民共和国境内申请进行药物临床试验、药品生产或者进口、进行相关的药品注册检验以及监督管理,适用本办法。
第三条药品注册,是指国家食品药品监督管理局根据药品注册申请人的申请,依照法定程序,对拟上市销售的药品的安全性、有效性、质量可控性等进行系统评价,并决定是否同意其申请的审批过程。
第四条国家鼓励研究创制新药,对创制的新药、治疗疑难危重疾病的新药和突发事件应急所需的药品实行快速审批。
第五条国家食品药品监督管理局主管全国药品注册工作,负责对药物临床试验、药品生产和进口进行审批。
省、自治区、直辖市(食品)药品监督管理部门依法对申报药物的研制情况及条件进行核查,对药品注册申报资料的完整性、规范性和真实性进行审核,并组织对试制的样品进行检验。
第六条药品注册申请人(以下简称申请人),是指提出药品注册申请,承担相应法律责任,并在该申请获得批准后持有药品批准证明文件的机构。
境内申请人应当是在中国境内合法登记并能独立承担民事责任的机构,境外申请人应当是境外合法制药厂商。
境外申请人办理进口药品注册,应当由其驻中国境内的办事机构或者由其委托的中国境内代理机构办理。
办理药品注册申请事务的人员应当是相应的专业技术人员,并且应当熟悉药品注册管理法律、法规和药品注册的技术要求。
第二章药品注册的申请第七条药品注册申请包括新药申请、已有国家标准的药品申请、进口药品申请和补充申请。
2020年药品注册管理办法

2020年药品注册管理办法一、关于国产药品注册申请的受理、审查等工作(一)药品注册受理是药品注册审批工作的重要环节,我局依法委托各省级药品监督管理部门对国产药品实施受理。
按照《行政许可法》第二十四条的规定,省级药品监督管理部门不得再行委托其它任何组织实施。
省级药品监督管理部门应当严格按照我局药品注册司《关于全面开展省局药品注册受理试运行工作 ___》(食药监注函〔20xx〕30号,以下简称《省局受理通知》)的具体要求,使用《药品注册省局受理审查管理系统》软件及其表单,做好受理工作。
(二)自本通知发布之日起,国内药品注册申请人提出的申请正式由省级药品监督管理部门负责受理,我局不再对其办理受理事宜。
省级药品监督管理部门在受理药品注册申请后,应当提出审查意见,并按照《省局受理通知》附件对药品注册申请的寄送要求及时寄送指定部门。
请省级药品监督管理部门及时将其所开具的《药品注册审批缴费通知书》(交我局一联)寄送我局办公室预算管理处,对上述已经受理和审查的申请,不应再交申请人自行转送资料。
在开展受理试运行工作以前,省级药品监督管理部门按照《试行办法》收到的申请,已经开展审查工作的,暂按《试行办法》的要求完成审查工作,寄送我局药品注册司受理。
自20xx年7月1日起,应当全部改由省级药品监督管理部门受理,我局药品注册司不再办理这一类申请的受理事宜。
(三)药品注册申请受理后,省级药品监督管理部门经审查,认为符合《办法》第四十八条快速审批条件的,应当对该申请是否符合快速审批条件提出意见,在正常报送资料的同时,将该审查意见及其依据单独寄送我局药品注册司。
我局药品注册司确定对该申请实行快速审批后,通知我局药品审评中心。
(四)药品注册申请受理后,省级药品监督管理部门经现场核查、原始资料审查或者药品补充申请的注册检验等工作,认为不符合有关规定的,应当发给《审批意见通知件》,退回其申请,同时抄报我局药品注册司。
(五)省级药品监督管理部门接到申请人提出撤回药品注册申请的书面申请时,尚未完成相应审查和资料报送工作的,可直接向申请人出具《撤回药品注册申请意见书》,同意退回该申请,并将该意见书抄我局药品注册司和有关药品检验所;省级药品监督管理部门已经向我局寄送申报资料的,应向我局提出《撤回药品注册申请意见书》,由我局药品注册司负责办理。
新药监测期期限表

从植物、动物、矿物等物 中:
售的生物制品。
的疫苗。
质中提取有效成份的制 1.1 通过合成或者半合成的方法
剂。
制得原料药的制剂;
1.2 天然物质中提取或者通过发
酵提取的新有效单体的制剂;
1.3 用拆分或者合成等方法制得
的已知药物中光学异构体的制
剂;
表 2:以下情形的新药设立 4 年的监测期
中药、天然药物
者发酵技术等)。
12.国内外尚未上市销售的由
非注射途径改为注射途径给
药,或者由局部用药改为全身
给药的制品。
表 3:以下情形的新药设立 3 年的监测期
中药、天然药物制品
7.改变国内已上市销 3.已在国外上市销售但尚未 14.改变给药途径的生 9.更换其他已批准表达体
售中药、天然药物给药 在国内上市销售的药品中: 物制品(不包括 12)。 系或者已批准细胞基质生
复方制剂。
的制品(包括氨基酸位点突变、抗原谱不同的重组疫苗。
缺失,因表达系统不同而产生、
消除或者改变翻译后修饰,对
产物进行化学修饰等)。
10.与已上市销售制品制备方
法不同的制品(例如采用不同
表达体系、宿主细胞等)。
11.首次采用 DNA 重组技术制
备的制品(例如以重组技术替
代合成技术、生物组织提取或
途径的制剂。
3.2 已在国外上市销售的
产的疫苗;采用新工艺制备
8.改变国内已上市销 复方制剂,和/或改变该制剂
并且实验室研究资料证明
售中药、天然药物剂型 的剂型,但不改变给药途径
的制剂中采用特殊制 的制剂;
剂技术者,如靶向制 3.3 改变给药途径并已在
剂、缓释制剂、控释制 国外上市销售的制剂;
关于发布新药监测期期限的通知关于发布新药监测期期限的通知
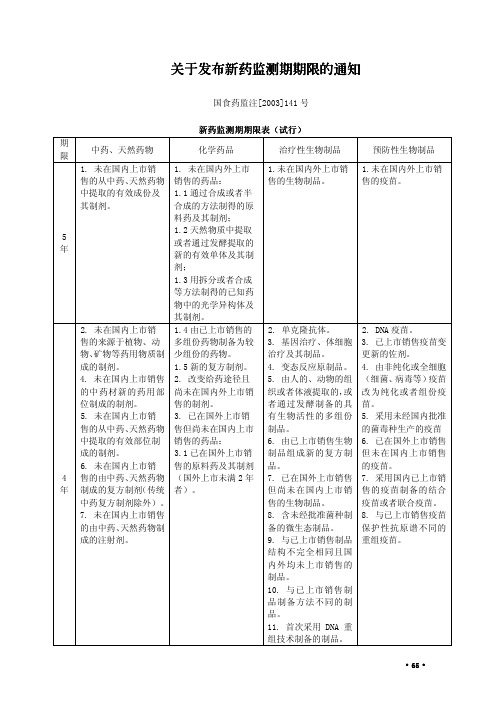
6. 未在国内上市销售 售但尚未在国内上市 制品的剂型但不改变 销售疫苗的剂型,但不
的由中药、天然药物制 销售的原料药(其制剂 给药途径的生物制品。 改变给药途径的疫苗。
成的复方制剂(传统中 已在国内上市销售)。
13. 改变免疫剂量或
不 设
药复方制剂)。
5. 改变国内已上市销
9. 改变国内已上市销 售药品的剂型,但不改
制剂。
(国外上市超过 2 年
细胞基质生产的疫苗。
9. 改变国内已上市 者)。
10. 改变灭活剂(方
销售药品剂型的制剂 3.2 已在国外上市销
法)或者脱毒剂(方法)
(工艺有质的改变者)。 售的复方制剂。
的疫苗。
10. 改变国内已上市 3.3 改变给药途径并
11. 改变给药途径的
销售药品工艺的制剂 已在国外上市销售的
位制成的制剂。
售的制剂。
者通过发酵制备的具 苗。
5. 未在国内上市销 3. 已在国外上市销 有生物活性的多组份 5. 采用未经国内批准
售的从中药、天然药物 售但尚未在国内上市 制品。
的菌毒种生产的疫苗
中提取的有效部位制 销售的药品:
6. 由已上市销售生物 6. 已在国外上市销售
成的制剂。 6. 未在国内上市销
65656565关于发布新药监测期期限的通知关于发布新药监测期期限的通知关于发布新药监测期期限的通知关于发布新药监测期期限的通知国食药监注2003141号新药监测期期限表新药监测期期限表新药监测期期限表新药监测期期限表试行试行试行试行期限中药天然药物化学药品治疗性生物制品预防性生物制品5年1
关于发布新药监测期期限的通知
物、矿物等药用物质制 少组份的药物。
治疗及其制品。
行政保护期、新药保护期、新药过渡期、新药监测期、中药保护期、专利保护期

何谓行政保护期、新药保护期、新药过渡期、新药监测期、中药保护期、专利保护期?行政保护期:为了扩大对外经济技术合作与交流,对外国药品独占权人的合法权益给予行政保护。
药品行政保护期为7年零6个月,自药品行政保护证书颁发之日起计算。
新药保护期:新药经国家药品监督管理局批准颁发新药证书后即获得保护。
各类新药的保护期分别为:第一类新药12年;第二、三类新药8年;第四、五类新药6年。
凡有试产期的新药,其保护期包含试产期。
新药的保护期自国家药品监督管理局批准颁发的第一个新药证书之日算起。
新药保护期满,新药保护自行终止。
新药过渡期:修订的《中华人民共和国药品管理法》(以下简称《药品管理法》)及《中华人民共和国药品管理法实施条例》(以下简称《实施条例》)分别于2001年12月1日和2002年9月15日施行。
《实施条例》修改了新药的定义,将“新药是指我国未生产过的药品”,修改为“新药是指未曾在中国境内上市销售的药品”。
随着新药定义的改变,新药注册管理制度将发生较大变化,新药的行政保护制度已被取消。
对于2002年9月15日以前我局已经批准临床研究但未批准生产的新药,仍按照原药品注册管理的有关规定审批。
批准生产后,按照原《新药审批办法》属于一类新药的,给予5年的过渡期;属于二类新药的,给予4年的过渡期;属于三类至五类新药的,给予3年的过渡期。
在过渡期内,其他药品生产企业不得生产相同品种的药品。
新药过渡期自发给新药证书之日起计算。
新药监测期:对于2002年9月15日以前我局已经受理但未批准临床研究的新药,以及2002年9月15日以后我局受理的新药,按照修订的《药品管理法》及《实施条例》的有关规定审批。
即:对未曾在中国境内上市销售的品种,按照新药审批,并且对批准药品生产企业生产的新药,设立不超过5年的监测期;自新药批准生产之日起计算。
中药保护期:中药一级保护品种分别为三十年、二十年、十年。
中药二级保护品种为七年。
专利保护期:发明专利权的期限为二十年,实用新型专利权和外观设计专利权的期限为十年,均自申请日起计算。
新药监测期 期限表

12.国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的制品。
2.DNA疫苗。
3.已上市销售疫苗变更新的佐剂,偶合疫苗变更新的载体。
4.由非纯化或全细胞(细菌、病毒等)疫苗改为纯化或者组份疫苗。
5.未在国内上市销售的从植物、动物、矿物等物质中提取有效部位的制剂。
6.未在国内上市销售的中药、天然药物复方制剂中:
6.1中药复方制剂;
6.2 天然药物复方制剂;
6.3 中药、天然药物和化学药品组成的复方制剂。
1.未在国内外上市销售的药品中:
1.4由已上市销售的多组份药物制备为较少组份的药物;
1.5新的复方制剂;
10.改变灭活剂(方法)或者脱毒剂(方法)的疫苗。
11.改变给药途径的疫苗。
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药的制剂。
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
14.改变给药途径的生物制品(不包括12)。
9.更换其他已批准表达体系或者已批准细胞基质生产的疫苗;采用新工艺制备并且实验室研究资料证明产品安全性和有效性明显提高的疫苗。
7.改变国内已上市销售中药、天然药物给药途径的制剂。
8.改变国内已上市销售中药、天然药物剂型的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
3.已在国外上市销售但尚未在国内上市销售的药品中:
3.2已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
3.3改变给药途径并已在国外上市销售的制剂;
关于印发药品技术转让注册管理规定的通知国食药监注[2009]518号
![关于印发药品技术转让注册管理规定的通知国食药监注[2009]518号](https://img.taocdn.com/s3/m/a18029ebaeaad1f346933f5d.png)
关于印发药品技术转让注册管理规定的通知国食药监注[2009]518号各省、自治区、直辖市食品药品监督管理局(药品监督管理局),总后勤部卫生部药品监督管理局:为规范药品技术转让注册行为,保证药品安全、有效和质量可控,根据《药品注册管理办法》的有关规定,我局组织制定了《药品技术转让注册管理规定》(以下简称《规定》),现予以印发,请遵照执行。
由于新药监测期是根据原《药品注册管理办法(试行)》于2002年12月1日设立,此前,根据原《新药保护和技术转让的规定》(1999年局令第4号)及《关于〈中华人民共和国药品管理法实施条例〉实施前已批准生产和临床研究的新药的保护期的通知》(国药监注〔2003〕59号)确定了新药保护期和过渡期的概念。
为保证新旧法规的顺利过渡和衔接,对于此类具有保护期、过渡期品种技术转让的有关事宜按照以下要求执行:一、对于具有《新药证书》,且仍在新药保护期内的品种,参照《规定》中新药技术转让的要求执行;二、对于具有《新药证书》,且新药保护期已届满的品种,参照《规定》中药品生产技术转让的要求执行;三、对于具有《新药证书》,且仍在过渡期内的品种,参照《规定》中新药技术转让的要求执行;四、对于具有《新药证书》,且过渡期已届满的品种,参照《规定》中药品生产技术转让的要求执行;本《规定》自发布之日起施行,原相关药品技术转让的规定同时废止。
国家食品药品监督管理局二○○九年八月十九日药品技术转让注册管理规定第一章总则第一条为促进新药研发成果转化和生产技术合理流动,鼓励产业结构调整和产品结构优化,规范药品技术转让注册行为,保证药品的安全、有效和质量可控,根据《药品注册管理办法》,制定本规定。
第二条药品技术转让注册申请的申报、审评、审批和监督管理,适用本规定。
第三条药品技术转让,是指药品技术的所有者按照本规定的要求,将药品生产技术转让给受让方药品生产企业,由受让方药品生产企业申请药品注册的过程。
药品技术转让分为新药技术转让和药品生产技术转让。
关于保护期、监测期、过渡期等几个新手困惑的问题

关于保护期、监测期、过渡期等几个新手困惑的问题自1998年国家药品监督管理局成立以来,对于注册法规修订较大,1999年4月22日颁布《新药审批办法》、《新生物制品审批办法》、《新药保护和技术转让的规定》、《仿制药品审批办法》和《进口药品管理办法》,启动了对药品注册审评模式的改革,逐步与国际接轨。
随着我国2001年加入WTO和新修订的《药品管理法》及其《实施条例》的颁布实施,原国家药品监督管理局对上述办法进行了修订,于2002年12月1日颁布实施《药品注册管理办法》(试行),以适应WTO关于知识产权的相关原则,适应《药品管理法实施条例》后对“新药”定义修改的新形势。
由于近几年注册规章的频繁修订,对于药品注册相关规章的理解发生偏差,使在药品注册申请过程中出现了许多问题,如新药类别、新药保护期、过渡期、监测期的理解等。
而实际上,当我们把目光不单单局限在《药品注册管理办法》上,回头看看老的注册法规、看看药品监管的“基本法”《药品管理法》,许多问题实际上并不难理解。
《药品管理法》作为药品监管行政执法的法律依据,对药品监管中许多问题都做出了原则性规定。
例如在第一章总则中对药品监管的目的、适用范围、执法部门等均做出了原则性规定,尤其是第一条“为加强药品监督管理,保证药品质量,保障人体用药安全,维护人民身体健康和用药的合法权益,特制定本法”,更是整个药品监管的核心——确保人民用药安全有效。
在第四章第25条规定了配制医疗机构制剂“应当是本单位临床需要而市场上没有供应的品种,并须经所在地省、自治区、直辖市人民政府药品监督管理部门批准后方可配制。
配制的制剂必须按照规定进行质量检验;合格的,凭医师处方在本医疗机构使用。
特殊情况下,经国务院或者省、自治区、直辖市人民政府的药品监督管理部门批准,医疗机构配制的制剂可以在指定的医疗机构之间调剂使用”,从这一条我们可以知道如果要申请医疗机构制剂,需要得到省级药品监督管理局的批准方可以配制。
新药保护期过渡期监测期的区别

新药保护期、过渡期、监测期的区别
2008-11-27 15:21:42
1、新药保护期(1985~2002.9.15)
1985~1999/5/1 ,新药保护期如下:
1999/5/1~2002/9/15 ,新药保护期如下:
2、过渡期(适用于2002.9.15前批临床但未批生产的)
对于2002年9月15日以前我局已经批准临床研究但未批准生产的新药,仍按照原药品注册管理的有关规定审批。
批准生产后,按照原《新药审批办法》属于一类新药的,给予5年的过渡期;属于二类新药的,给予4年的过渡期;属于三类至五类新药的,给予3年的过渡期。
在过渡期内,其他药品生产企业不得生产相同品种的药品。
3、监测期
对于2002年9月15日以前我局已经受理但未批准临床研究的新药,
以及2002年9月15日以后我局受理的新药,按照修订的《药品管理法》及《实施条例》的有关规定审批。
即:对未曾在中国境内上市销售的品种,按照新药审批,并且对批准药品生产企业生产的新药,设立不超过5年的监测期;对已经在中国境内上市销售的品种,按照已有国家标准药品审批。
具体监测期限见下表
新药监测期期限表(试行).。
总局关于发布化学药品注册分类改革工作方案的公告(2016年

总局关于发布化学药品注册分类改革工作方案的公告(2016年第51号)2016年03月04日根据2015年11月4日第十二届全国人民代表大会常务委员会第十七次会议审议通过的《关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》,国家食品药品监督管理总局制定了化学药品注册分类工作改革方案,已经国务院同意,现予以公告,并自公告发布之日起实施。
附件:化学药品注册分类改革工作方案食品药品监管总局2016年3月4日附件化学药品注册分类改革工作方案为鼓励新药创制,严格审评审批,提高药品质量,促进产业升级,对当前化学药品注册分类进行改革,特制定本工作方案。
一、调整化学药品注册分类类别对化学药品注册分类类别进行调整,化学药品新注册分类共分为5个类别,具体如下:1类:境内外均未上市的创新药。
指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2类:境内外均未上市的改良型新药。
指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。
该类药品应与原研药品的质量和疗效一致。
原研药品指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
4类:境内申请人仿制已在境内上市原研药品的药品。
该类药品应与原研药品的质量和疗效一致。
5类:境外上市的药品申请在境内上市。
表1 化学药品新注册分类、说明及包含的情形注:1.“已知活性成份”指“已上市药品的活性成份”。
2.注册分类2.3中不包括“含有未知活性成份的新复方制剂”。
二、相关注册管理要求(一)对新药的审评审批,在物质基础原创性和新颖性基础上,强调临床价值的要求,其中改良型新药要求比改良前具有明显的临床优势。
对仿制药的审评审批,强调与原研药品质量和疗效的一致。
(二)新注册分类1、2类别药品,按照《药品注册管理办法》中新药的程序申报;新注册分类3、4类别药品,按照《药品注册管理办法》中仿制药的程序申报;新注册分类5类别药品,按照《药品注册管理办法》中进口药品的程序申报。
[2022年药品注册管理办法]药品注册指导原则pdf
![[2022年药品注册管理办法]药品注册指导原则pdf](https://img.taocdn.com/s3/m/6193bd4e2f3f5727a5e9856a561252d380eb20f9.png)
[2022年药品注册管理办法]药品注册指导原则pdf关于实施《药品注册管理办法》有关事项的通知一、关于国产药品注册申请的受理、审查等工作(一)药品注册受理是药品注册审批工作的重要环节,我局依法委托各省级药品监督管理部门对国产药品实施受理。
按照《行政许可法》第二十四条的规定,省级药品监督管理部门不得再行委托其它任何组织实施。
省级药品监督管理部门应当严格按照我局药品注册司《关于全面开展省局药品注册受理试运行工作的通知》(食药监注函〔2022〕30号,以下简称《省局受理通知》)的具体要求,使用《药品注册省局受理审查管理系统》软件及其表单,做好受理工作。
在开展受理试运行工作以前,省级药品监督管理部门按照《试行办法》收到的申请,已经开展审查工作的,暂按《试行办法》的要求完成审查工作,寄送我局药品注册司受理。
自2022年7月1日起,应当全部改由省级药品监督管理部门受理,我局药品注册司不再办理这一类申请的受理事宜。
(六)对于省级药品监督管理部门按照《办法》受理的申请,药品检验所在完成了所要求的注册检验后,应当将药品注册检验报告按照《省局受理通知》附件对药品注册申请的寄送要求,分别寄送指定的部门。
(八)进口药品分包装获得批准以后,涉及进口药品注册证书变更的补充申请,由我局进行受理并审批;其它补充申请事项的受理、审查或者审批工作,由省级药品监督管理部门按照《办法》对国产药品补充申请的规定办理。
分包装期满后继续进行分包装的补充申请,由省级药品监督管理部门受理、审查后,报我局药品注册司审批。
(一)《办法》规定临床试验申请被批准后应当在3年内实施,《办法》实施前我局已经批准的药物临床试验亦按此执行。
三、关于按照新药申请管理的注册申请(一)增加新适应症的申请1、按照《办法》的规定,化学药品和生物制品增加新适应症属于按照新药申请管理。
《办法》实施前已经受理的化学药品和生物制品增加新适应症的补充申请,我局将按照《办法》审批,申请人无需提出变更申请。
新药保护期

新药保护期、过渡期、监测期…一次说清楚1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
国家食品药品监督管理局印发关于药品注册管理的补充规定的通知

国家食品药品监督管理局印发关于药品注册管理的补充规定的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.12.23•【文号】国食药监注[2003]367号•【施行日期】2003.12.23•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局印发关于药品注册管理的补充规定的通知(国食药监注[2003]367号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):《药品注册管理办法(试行)》(以下简称《办法》),已于2002年12月1日起施行。
为做好《办法》的实施工作,原国家药品监督管理局先后下发了《关于实施〈药品注册管理办法(试行)〉有关事项的通知》(国药监注〔2002〕437号)和《关于发布新药监测期期限的通知》(国食药监注〔2003〕141号)。
为解决《办法》实施过程中发现的新问题,我局研究制定了药品注册管理的补充规定,现印发你们,请结合以上3个文件的实施,认真贯彻执行。
国家食品药品监督管理局二00三年十二月二十三日关于药品注册管理的补充规定一、关于药品注册的申请和受理问题根据我局《关于发布新药监测期期限的通知》,对于不设立监测期的新药,自批准注册之日起,不再受理同品种新药申请。
我局已受理的新药申请,继续按原程序和要求审批;各省级食品药品监督管理局(药品监督管理局)此前已收到,但我局尚未受理的同品种新药申请,由省局予以退回。
在该品种的试行标准转正后,申请人可以提出已有国家标准药品的注册申请。
二、关于药品商品名问题(一)新药拟使用商品名,应当由药品生产企业在申请新药注册时一并提出。
(二)设立监测期的新药,在监测期内,申请人可以按照补充申请的要求申请增加商品名;监测期已过的药品,不再批准增加商品名。
(三)不设立监测期的新药,自批准首家注册后,2年内申请人可以按照补充申请的要求申请增加商品名;超过2年不再批准增加商品名。
国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有

国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(1)【法规类别】药品管理【发文字号】国食药监注[2003]278号【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)【发布日期】2003.10.10【实施日期】2003.10.10【时效性】现行有效【效力级别】部门规范性文件国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(国食药监注[2003]278号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),解放军总后卫生部:根据国家药品监督管理局《关于<中华人民共和国药品管理法实施条例>实施前已批准生产和临床研究的新药的保护期的通知》(国药监注[2003]59号)、我局《关于发布新药监测期期限的通知》(国食药监注[2003]141号)的有关规定,现就2002年9月15日以后批准新药的保护期、过渡期或监测期事宜通知如下:一、对2002年9月15日以来批准的新药,尚未确定保护期、过渡期或监测期的,按其申报与审批情况分别予以确定,并自该新药证书或生产批准之日起生效。
具体品种见附件。
二、对处于过渡期内的新药,我局不受理其他申请人同品种的新药或已有国家标准药品申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
三、对没有保护期、过渡期或未设监测期的新药,自其获得药品批准文号之日起,我局不再受理其他申请人同品种的新药申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
四、过渡期内新药技术转让的申报与审批,按照原国家药品监督管理局对新药保护期的相关规定办理。
特此通知附件:2002年9月15日以来尚未确定的新药保护期、过渡期或监测期确定表国家食品药品监督管理局二00三年十月十日保护期、过渡期或监测期确定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
关于发布新药监测期期限的通知
注:本文经过精心编辑,部分内容来源网络,如有疑议,请联系我们处理。
关于发布新药监测期期限的通知国食药监注[2003]141号各省、自治区、直辖市药品监督管理局:
根据《中华人民共和国药品管理法实施条例》和国家药品监督管理局《药品注册管理办法(试行)》关于新药监测期管理的规定,国家食品药品监督管理局对不同类别新药分别制定了监测期期限(见附件),并经局务会讨论通过,现予发布试行。
各有关单位和药品注册申请人应当按照《药品注册管理办法》的规定,做好新药监测期期间的各项工作。
执行中遇到的问题,请及时反馈我局药品注册司。
特此通知
附件:新药监测期期限表(试行)
国家食品药品监督管理局。
