蛋白质盐析和变性的比较ppt课件
高二蛋白质的性质课件

变性
颜色 反应
灼烧
蛋白质的性质————变性
【学以致用二】
▲ 临床上解救铜、汞、铅等重金属盐中毒
的病人时,要求病人服用大量含蛋白质丰 富的生鸡蛋、牛奶或豆浆等。为什么?
因为牛奶、鸡蛋清、豆浆中含有蛋白质, 可以跟重金属反应,形成不容于水的化合 物,从而减轻重金属对人体的伤害,起到 缓解毒性的作用。
蛋白质的性质————颜色反应
盐析
变性
实验关键:
一,盐的类型为轻金属盐或铵盐,不可用重金属盐;
二,盐析必须是浓的盐溶液。
颜色 反应 用途:分离,提纯蛋白质。
灼烧
特点:活性不变、可逆、物理变化。
蛋白质的性质————盐析
水解
【学以致用】
利用蛋白质盐析的性质调制美味蛋羹
制作家常蛋羹时常需先向生的鸡蛋中加 入氯化钠调味,这时蛋清可能会发生盐析 (和加入的氯化钠量有关),口味较重,然 后继续加水,凝结的蛋清又溶解,反复调和, 口味适中的蛋羹便可以上锅加热了。
变性 颜色 反应
重金属盐:重金属指的是原子量大于55
的金属的盐。重金属约有45种,一般都是 属于过渡元素。如铜、铅、锌、铁、钴、 镍、锰、镉、汞、钨、钼、金、银等的盐 溶液。
灼烧
蛋白质的性质————盐析
水解
盐析:少量的盐(轻金属盐、铵盐)能促进
蛋白质的溶解。当向蛋白质溶液中加入的盐 溶液达到一定浓度时,反而使蛋白质的溶解 度降低而从溶液中析出。
变性
颜色 反应
甲醛
再加水
加热
?
再加水
灼烧
蛋白质的性质————变性
水解 盐析
现象:
CuSO4 所加 溶液 试剂 白色沉淀 现 象 甲醛溶液 加热
蛋白质的盐析现象及原理

蛋白质的盐析现象及原理
在生物化学中,蛋白质的盐析现象是蛋白质分离的一种重要手段。
当溶液中的蛋白质浓度发生变化时,会影响蛋白质在水中的溶解度。
当溶液中的某一种物质浓度超过一定值时,就会析出该物质,这一现象就叫做盐析。
盐析现象可以用化学方式来解释,即溶液中存在着某种盐类时,其溶液会产生某种不可逆的变化,从而使蛋白质沉淀析出。
例如在蒸馏水中加入氯化钙或氯化钡后,蒸出液中就会含有大量的氯化钙和氯化钡。
再如,将牛奶煮沸时,可使其中的蛋白质沉淀析出。
一般来讲,盐析作用有三种:第一种是破坏蛋白质分子内的二硫键;第二种是降低蛋白质的溶解度;第三种是使蛋白质分子间形成空间位阻。
蛋白质的盐析现象与pH值有关:当溶液中存在某种盐类时,该盐类可改变溶液的pH值。
如果某一种盐的浓度比较低,它就会使溶液中的pH值升高;如果该盐浓度比较高,它就会使溶液中的pH值降低。
例如,在牛奶煮沸时,可以加入硫酸铵来降低牛奶中蛋白质沉淀所需的pH值。
—— 1 —1 —。
蛋白质盐析

蛋白质沉淀的速度可用 - —dS 对盐饱和度(P)
作图来表示:
dP
8 dS 6 – d—P 4
利用不同蛋白质盐析分布 曲线在横轴上的位置不同, 可采取先后加入不同量无 机盐的办法来分级沉淀蛋 白质。
2
0 20 30 40 50 60 70 P
蛋白质溶解度随(NH4)2SO4 饱和度而变化的速率
2.蛋白质浓度的影响 蛋白质浓度不同,沉淀所需无机盐用量也不同。 随浓度提高,盐用量减少。
采用间歇方式所需盐量比连续方式少; 间歇操作中,用1)优点: ① 室温下沉淀物在硫酸铵盐析溶液中长时间放
置不会失活,且无机盐不容易引起蛋白质变性失 活;
② 非蛋白的杂质很少被夹带沉淀; ③ 适用范围广,几乎所有蛋白质和酶都能采用 ④ 设备简单,操作方便。
K3PO4。 廉价
(NH4)2SO4 原因
在水中溶解度大,且溶解度随温度变 化小,低温下仍具有较大的溶解度
对大多数蛋白质的活力无损害
常用盐析剂在水中的溶解度(g/100ml水)
中性盐
温度(oC) 0 20 40 60 80 100
(NH4)2SO4 70.6 75.4 81.0 88.0 95.3 103
(防止溶液局部过浓,但加量较多时溶液会被稀释)
(三)影响盐析的各种因素
无机盐的加入量 蛋白质的浓度 温度 pH 操作方式
1.无机盐加入量的影响
蛋白质溶解度 2.5 2.0 1.5
lgS 1.0 0.5 0 -0.5
-1.0 -1.5
β S0
盐析
1 234 56 μ(离子强度)
蛋白质种类不同,盐析所用的无机盐量也不同
阳离子对盐析效果的影响:
Al3+ > H+ > Ba2+ > Sr2+ > Ca2+ > Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+
蛋白质的变性ppt课件

主讲人:白晓燕
精品课件
1
实教验 材探 分究析
本节课选自人教版普通高 中课程标准实验教科书 化学(选修1) 化学与生 活 第一章 第三节
精品课件
2
实学验 情探 分究析
根据生活经验对蛋白质的变性有一定 的感性认识,但对于变性的特点、条 件及其定义并不明确。
精品课件Biblioteka 3实教验 学探 理究念 建构主义理论代表人物
2、加热会使蛋白质变性,吃生鸡蛋会比 熟鸡蛋好吗?
精品课件
21
谢谢
THE END
精品课件
22
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
1、加入乙酸铅后有沉淀产生
2、向其中加入蒸馏水,沉淀不 溶解
变性
反应特点
有沉淀产生 沉淀不溶解
精品课件
13
想一想
(用类比的方法)
还有那些方法可以使蛋白质发生类似的反应?
精品课件
14
条件探索
精品课件
15
实验操作
无水 乙醇 15滴
实验现象
加热有沉淀生 成
加入蒸馏水沉 淀不溶解
加无水乙醇有 沉淀生成
加入蒸馏水沉 淀不溶解
精品课件
实验结论
发生了变性
发生了变性
16
归纳总结
变性反应的条件
物理因素:加热、加压、搅拌、振荡、紫外线照射、 超声波等
化学因素:强酸、强碱、重金属盐、三氯乙酸、尿素、乙 醇、丙酮等
定义:在某些物理因素和化学因素的影响下,蛋白质的理 化性质和生理功能发生改变的现象
蛋白质的性质实验(共13张PPT)

稳定蛋白质亲水胶体颗粒的因素
第八页,共13页。
蛋白质的变性
蛋白质的性质与它们的结构密切相关。某些物理或化学因素,能够破 坏蛋白质的结构状态,引起蛋白质理化性质改变并导致其生理活性丧失。 这种现象称为蛋白质的变性(denaturation)。
第九页,共13页。
蛋白质的变性
变性蛋白质通常都是固体状态物质,不溶于水 和其它溶剂,也不可能恢复原有蛋白质所具有 的性质。所以,蛋白质的变性通常都伴随着不 可逆沉淀。引起变性的主要因素是热、紫外光、 激烈的搅拌以及强酸和强碱等。
第五页,共13页。
蛋白质的等电点
当溶液在某一 pH 值时,蛋白质所带正、负电荷相等, 即总净电荷为零,此时溶液的 pH 称该蛋白质的等电 点(isoelectric point)。
第六页,共13页。
蛋白质是由AA组成的高分子化合物,具有许多游离的氨基、羧基、咪唑基、胍基、巯基、酚基等,因此与AA一样,能象酸一样解离,也能 象碱一样解离,也是两性电解质。 所以,蛋白质的变性通常都伴随着不可逆沉淀。 蛋白质的两性电离性质 三、实验操作 具体参见实验指导书 某些物理或化学因素,能够破坏蛋白质的结构状态,引起蛋白质理化性质改变并导致其生理活性丧失。 蛋白质的两性电离性质 3、加深对蛋白质胶体溶液稳定因素的认识。 引起变性的主要因素是热、紫外光、激烈的搅拌以及强酸和强碱等。 有机溶剂沉淀蛋白质 最混浊的一管的pH值即为酪蛋白的等电点。 引起变性的主要因素是热、紫外光、激烈的搅拌以及强酸和强碱等。 4、了解沉淀蛋白质的几种方法及其实用意义。 乙醇引起的变性与沉淀 引起变性的主要因素是热、紫外光、激烈的搅拌以及强酸和强碱等。 最混浊的一管的pH值即为酪蛋白的等电点。 变性蛋白质通常都是固体状态物质,不溶于水和其它溶剂,也不可能恢复原有蛋白质所具有的性质。 所以,蛋白质的变性通常都伴随着不可逆沉淀。 三、实验操作 具体参见实验指导书 2、蛋白质变性与沉淀的关系。 1、稳定蛋白质亲水胶体颗粒的因素有哪些?
4.2蛋白质 课件(共26张PPT)高二下学期化学人教版(2019)选择性必修3

(1)淀粉酶应用于食品、发酵、纺织、制药等工业;(2)蛋白酶应用于医药、制革等工业;(3)脂肪酶应用于脂肪水解、羊毛脱脂等;(4)酶还可用于疾病的诊断。
同学们再见!
授课老师:
时间:2024年9月15日
变化实质
物理变化(溶解度降低)
化学变化(蛋白质性质改变)
变化过程
可逆
不可逆
用途
分离、提纯蛋白质
杀菌、消毒
⑤显色反应 含有苯环的蛋白质遇浓硝酸会有白色沉淀产生,加热后沉淀变黄色。
实验操作
实验现象
结论
加入浓硝酸生成白色沉淀,加热后,沉淀变黄
含有苯环的蛋白质(天然蛋白质都含苯环)沾上浓硝酸会出现黄色,可用于检验蛋白质。
4.对映异构: α-氨基酸除甘氨酸外,一般均含有连接4个不同原子或原子团的手性碳原子,具有对映异构体。5.存在: 组成生物体内蛋白质的氨基酸一般只有20种,其中必需氨基酸有8种。6.命名:
H2N—CH2COOH
甘氨酸
丙氨酸
谷氨酸
氨基乙酸
2-氨基丙酸
2-氨基戊二酸
苯丙氨酸
⑥蛋白质灼烧有烧焦羽毛气味。
5.蛋白质的用途(1)食物(人类必须的营养物质)(2)工业原料:动物的毛、蚕丝 (纺织原料)动物的皮 (皮革)动物的骨、皮、蹄 (动物胶)牛奶中的酪素 (酪素塑料)
三.酶
1.定义: 酶是一类由细胞产生的、对生物体内的化学反应具有催化作用的有机化合物,其中绝大多数是蛋白质。2.来源:3.功能:
1.定义: 蛋白质是由多种氨基酸通过肽键等相互连接形成的一类生物大分子(天然有机高分子化合物)。2.元素组成: 蛋白质中主要含有C、H、O、N、S等元素,有些蛋白质还含有P、Fe、Zn、Cu等元素。其溶液具有胶体的某些性质。
人教版高中化学选修5-第四章章末复习:知识总结:盐析和变性的比较
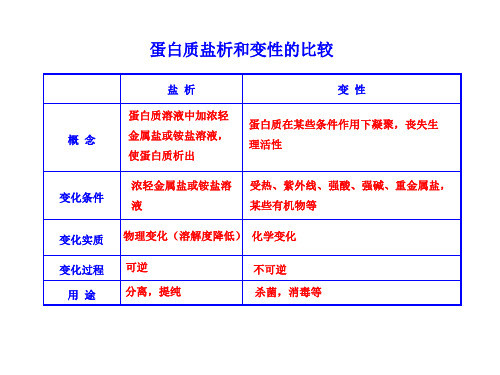
概念
盐析
蛋白质溶液中加浓轻 金属盐或铵盐溶液, 使蛋白质析出
变性
蛋白质在某些条件作用下凝聚,丧失生 理活性
变化条件
浓轻金属盐或铵盐溶 受热、紫外线、强酸、强碱、重金属盐,
液
某些有机物等
变化实质 物理变化(溶解度降低) 化学变化
变化过程 用途
可逆 分离,提纯
不可逆 杀菌,消毒等
盐析和变性的区别
杀菌,消毒
化学变化
Байду номын сангаас
不可逆
受热、紫外线、强酸、 强碱、重金属盐,某些 有机物等
蛋白质在某些条件作 用下凝聚,丧失生理 活性
变性
用途
过程 实质 条件 定义
分离提纯
可逆 物理变化
(溶解度降低) 一定浓度盐溶液
蛋白质溶液中加浓无 机盐溶液,使蛋白质 析出
盐析
第三节 蛋白质的理化性质 PPT课件

蛋白质具有稳定性。 原因:蛋白质与水亲和
蛋 白 质 亲水基团 分 子
羟基:-OH 水
溶于水 化
羧基:-COOH
膜
氨基:-NH2
稳定性增加
故蛋白质溶液具有胶体溶液的典型性 质,如
(1)稳定性 (2)丁达尔现象 (3)电泳现象 (4)布郎运动 (5)不能通过半透膜等。
3、蛋白质的沉淀作用
在适当的条件下,蛋白质能够 从溶液中沉淀出来。
作用: 蛋白质的两性解离性质使其成
为人体及动物体中的重要缓冲剂, 调节体液正常pH。
2、蛋白质具有胶体性质
• 蛋白质属于生物大分子,分子量可自1万至 100万之巨,其分子的直径可达1~100nm, 为胶粒范围之内。因此,它在水中能够形成
胶体溶液。
故蛋白质溶液具有胶体溶液的典 型性质,如
(1)稳定性 (2)丁达尔现象 (3)电泳现象 (4)布郎运动 (5)不能通过半透膜等。
蛋白质 酒精
蛋白质沉淀
高温会变性,低温不会。
3、酸类沉淀法
用硝酸 苦味酸、三氯乙酸、目酸、钨酸
蛋白质
浓硝酸
蛋白盐沉淀
蛋白质已经失去活性
应用:在临床检验中,除去血液中的干扰蛋白质
(三)重金属盐沉淀
重金属盐:Cu2+ 、Hg2+、Ag+、Pb2+
蛋白质 铜离子
蛋白盐沉淀
蛋白质已经失去活性
应用:重金属盐中毒的解毒
1、硝酸与蛋白质反应
硝酸+蛋白质
蛋白质变黄
这是蛋白质的特征反应之一。 常用来鉴别部分蛋白质。
2、双缩脲反应
尿素 + 尿素
双缩脲
双缩脲+Cu2+ 碱性 紫红色配合物
《蛋白质的变性》课件

细胞功能失调
细胞内的蛋白质相互作用 和功能依赖于其正确的构 象,变性导致这些相互作 用和功能失调。
免疫反应抑制
一些抗原性蛋白质变性后 ,其免疫原性减弱或消失 ,导致免疫反应受到抑制 。
对生物结构的影响
细胞器结构破坏
细胞内许多重要功能由细胞器完成, 而这些细胞器的结构主要由蛋白质构 成,因此蛋白质变性可破坏细胞器结 构。
蛋白质变性过程中的结构变化研究
蛋白质变性过程中,其结构会发生改变。未来研究将进一步探究这种结构变化与功能变化之间的关系,为理解 蛋白质的功能和调控提供更多线索。
蛋白质变性对生物的影响研究
蛋白质变性对生物体内平衡的影响
蛋白质在生物体内发挥着重要的功能,其变性可能会影响生物体内平衡,对生 物体的生长、发育和代谢等产生影响。未来研究将进一步探究这种影响及其机 制。
蛋白质变性的过程
01
02
03
初期
蛋白质分子中的次级键, 如氢键、疏水键等发生变 化,导致蛋白质的空间构 象开始变得不稳定。
中期
蛋白质的空间构象被破坏 ,导致其理化性质发生改 变。
后期
蛋白质的生物活性完全丧 失,成为变性蛋白。
03
蛋白质变性的影响
对生物活性的影响
酶活性丧失
蛋白质变性后,其空间构 象发生变化,导致酶的活 性中心被掩盖,从而失去 催化活性。
染色体畸变
膜结构破坏
生物膜的主要成分是蛋白质和脂质, 蛋白质变性可破坏膜的稳定性,导致 膜结构破坏。
在细胞分裂过程中,蛋白质参与染色 体的组装和分离,变性可能导致染色 体畸变。
对生物功能的影响
代谢紊乱
许多酶促反应在体内是连续进行的,蛋白质变性可导致这些酶促 反应受阻,从而导致代谢紊乱。
蛋白质变性说课终稿ppt课件

加强临 床知识 的学习
学习吸收 好的教学 方法
改进教学 方法
请各位领导、老师批评指正!
3 、呈色反应
特殊理化试剂反应
稳定因素
变性的条件 变性的本质 变性的结果
蛋白质的鉴定
水化膜 同种电荷
变性的实际应用
3 、沉淀、凝固
蛋白质的分离、纯化
教学反思
教 学 反 思 Text in
Text in
Text in
here
here
here
教学设计
蛋白质的变性
概 念:
变性的条件
变性的本质
变性的结果
热、紫外线、有机 溶剂、强酸强碱
空间结构的改变, 不涉及以一级结构
生物学活性的丧失 理化性质的改变
某些物理或化学因素,能够破坏蛋白质的空间结构,引起蛋白质理化性 质改变并导致其生理活性丧失,这种现象称为蛋白质的变性。
应 用:
蛋白制剂要避光,低温保存 高温高压灭菌,乙醇及紫外线的消毒灭菌
图示法阐述变性的本质
教学设计
蛋白质的变性
高温高压、紫外线、 乙醇、强酸强碱
N
空间结构的破坏
菌体蛋白、 毒素蛋白 变性失去 致病性
变性的蛋 白质易于 沉淀
C
教学设计
3、课堂小结
(板书内容)
蛋白质的理化性质及应用
一般理化性质
1 、两性解离 2 、紫外吸收
等电点(pI)
A 280
电泳方法分离蛋白质 分光光度法测定蛋白质
教学方法
教学方法
讲授法、举例法
图示法
归纳整合法
积极整合各种教学资源,采用信息化手段辅助教学
教材内容的设置 学生的知识背景
临床实用性
蛋白质盐析实验现象

蛋白质盐析实验现象
在进行蛋白质盐析实验时,经常会看到这样的现象:一些大分子蛋白质如蛋白质肽键、肽键上的巯基(-SH)和羧基(-COOH)等,在盐析过程中失去了活性而沉淀下来。
这是为什么呢?下面就来介绍一下。
在进行蛋白质盐析实验时,大分子蛋白质会发生如下的变化:
1.发生变性:这些大分子蛋白质,在与某些盐类(如NaCl)作用后,其肽键和巯基发生变性,生成无活性的盐析产物——蛋白质沉淀。
这是因为离子键遭到破坏,水分子进入蛋白质内部,致使肽键和巯基发生变化而变性。
2.形成可溶性离子:大分子蛋白的水溶性较好,盐析过程中可以析出可溶性的离子。
3.溶解度降低:这是因为大分子蛋白溶液在与NaCl作用后,水分子进入蛋白质内部,使蛋白质溶液的溶解度降低。
4.游离氨基酸减少:这些游离氨基酸(如组氨酸)在与NaCl作用后会发生变性。
5.形成无规则结构:这些游离氨基酸在盐析过程中会产生无规构象,如支链氨基酸(赖氨酸、精氨酸)、甘氨酸等。
—— 1 —1 —。
