GMP药厂(车间)设计
GMP车间设计

GMP车间设计标题:GMP车间设计引言概述:GMP(Good Manufacturing Practice)是指符合良好生产规范的制药生产标准,GMP车间设计是制药企业在生产过程中必须遵循的重要规范。
一个合理设计的GMP车间可以提高生产效率、确保产品质量、保障员工安全。
本文将详细介绍GMP车间设计的重要性及相关要点。
一、空间规划1.1 合理布局:GMP车间应根据生产流程合理布局,确保原料、半成品、成品流程顺畅。
1.2 空间利用:充分利用空间,避免交叉污染和混乱,确保生产过程有序进行。
1.3 通风系统:设计合理的通风系统,保持空气流通,减少微生物和颗粒物的积聚。
二、洁净度要求2.1 表面材料:选择易清洁、抗腐蚀、无尘积的表面材料,确保车间易清洁。
2.2 设备布局:设备之间的间距要合理,便于清洁和维护。
2.3 洁净区域:设立洁净区域,控制空气质量和微生物数量,确保产品质量。
三、设备选型3.1 符合标准:选择符合GMP标准的设备,确保生产过程符合规范。
3.2 易清洁性:设备易清洁、易维护,减少交叉污染和生产故障。
3.3 自动化程度:提高设备的自动化程度,减少人为操作对产品的影响。
四、环境控制4.1 温湿度控制:保持车间内恒定的温度和湿度,有利于生产过程的稳定。
4.2 照明设计:充分考虑照明设计,确保工作区域光线充足、均匀。
4.3 废物处理:建立合理的废物处理系统,减少对环境的污染。
五、人员流程管理5.1 培训计划:制定员工培训计划,确保员工具备GMP知识和操作技能。
5.2 人员通道:设立明确的人员通道,避免交叉感染和混乱。
5.3 人员卫生:加强员工卫生意识,保持个人清洁,减少对产品的污染。
结论:GMP车间设计是制药企业生产过程中必须严格遵守的规范,合理设计的GMP 车间可以提高生产效率、确保产品质量、保障员工安全。
通过空间规划、洁净度要求、设备选型、环境控制和人员流程管理等方面的细致设计,可以有效提升GMP 车间的生产效率和产品质量,确保符合GMP标准。
从生产管理理论看药厂洁净车间的GMP设计

1背景概述 为了提高药品质量,早日与国际医药贸易接轨,
国家药品监督管理局制定了全国推行GMP,分阶段 实行GMP认证的规划,为了符合GMP的要求,近 两年各制药企业纷纷进行GMP改造。而车间硬件 改造又是GMP改造的核心部分,现企业车间改造 主要由医药设计部门提供设计图纸,企业实施。
部 原因代号
分值
关系
门
总分
l
2
3
4
5
6
7
8
1
2
3
4
56 7 8
1
BDG E
FI
C
I
I
I
6
3
4
32 2 2
22
2
BDG
BDG
F
C
I
I
I
6
6
3
32 22
24
3
E
BDG
BDG C
I
I
I
3
6
6
32 22
24
Fl
F
BDG
BC
4
I
I
I
4
3
6
DG
6 22 2
25
B(=
5
C
C
C
BCD BCD BCD
3
3
3
6
55 5
(1)洁净室中人员和物料的出人口必须分设,原 辅料和成品的出人口分开;人员和物料进入洁净室 要有各自的净化用室和设施。
(2)生产区要减少生产流程的迂回往返,尽量减 少人员流动和动作。
(3)操作区只允许存放与操作有关的物料,设置 必要的工艺设备;用于制造、贮存的区域不得作非 域内人员的通道。
04 新GMP颁布后药厂的设计和改造-1030

概述
GMP是涉及整个药品生产过程的质量保证体系的规范,这是GMP 的本质,正确而全面的理解GMP很重要: 用一套严谨、科学、成文的管理来保证工厂能够 始终如一地生产 出符合规定标准的药品。 生产过程的质量保证体系一直是GMP的实质所在。 主要包含:组织机构、人员资质及培训、厂房设施、设备、物料、 卫生、验证、文件、生产管理、质量管理、产品销售和召回、投诉 处理 自检 处理、自检。
概述
国际上需参考的主要规范: ISO-14644
ISO-14644 -1-1999 Classifications of air cleanliness-空气洁净度等级划 分 ISO-14644 -2-2000 Specifications for testing and monitoring to prove continued compliance with ISO 14644-1-2000符合性连续认证所需的测试 和监测技术要求
15
概述
文件管理的实质是: 任何生产行为必须遵循经过科学验证的SOP进行。 每个过程的实际实施过程都有规定的记录所证实。 所有的生产过程参数均可追溯,不得“断链”。 过程中发生的任何偏差都必须进入偏差原因分析、防止再发生措 程中发 的任何偏 都 须 偏 原因分析 防 再发 措 施-CAPA的制定和考察、纠偏报告。 原料规格、工艺过程允许优化-变更控制,但是均需要事先经过 质量考察和新工艺验证并经过批准后方能替代原有原料或工艺。这 是一个独立于现行生产工艺的“外循环”。 如果这个改变设计产品原先申报的主要原材料规格和主要工艺路 线,则还有需要上报国家药监局从新审核并获批准后方可实施。
概述
中国的GMP
1988年第一版的《药品生产质量管理规范》 1998年第二版的《药品生产质量管理规范》 2010年第三版的《药品生产质量管理规范》--即将颁布
药厂固体制剂车间GMP设计的案例分析

药厂固体制剂车间GMP设计的案例分析厂房、设施等建设和改造是药品生产企业实施GMP的硬件基础。
一般由企业根据具体品种的生产工艺提出要求,由设计单位设计图纸,并征求企业意见,进行论证后交由企业实施。
而由于设计单位对企业生产工艺和GMP领悟不深刻,药品生产企业对设计过程不了解,很多设计方案虽然好像满足了GMP,但很多情况和实际生产过程或现场发生矛盾。
不少设计方案,以已有的车间模式为样本,进行套用修改,不能很好地与具体品种或企业现场实际相结合,在实际运行过程中,根本不能达到GMP要求,给企业GMP改造或建设留下硬伤,这不得不引起人们的高度注意。
1、企业剂型简介该企业车间为固体制剂综合车间,主要生产片剂、胶囊和颗粒3种剂型的产品,且3种剂型为不同成分的产品。
由于全为固体制剂,该企业希望可以通过合并相同工段等方式,降低建设成本。
根据我国新版GMP,由于该3种剂型所要求的生产洁净级别相同,都是D级,且其前段制颗粒工序即粉碎、过筛、造粒、干燥、总混工序相同,故可集中共用。
而后段工序压片、包衣、胶囊填充不同,需分块布置。
最后包装工序也有部分相同,也可集中设置。
由此可知在同一车间生产3种剂型具有可行性,并且可以通过整合共用工序设备从而提高设备使用率,减少洁净区面积,从而节约建设资金。
但主要问题在于如何合理设计,使其在节约资金的同时,也能够符合GMP,以保证药品质量。
本文通过分析该固体车间的特点和车间GMP设计的要求,得出设计草案。
2、固体制剂综合车间的特征分析2.1前段工序相同该车间主要生产片剂、胶囊和颗粒3种剂型的产品,这3种属于最常见的固体剂型,生产使用量大。
不论采用何种生产工艺,片剂、胶囊剂、颗粒剂的生产前段制粒工序都大体相同,如混合、制粒、干燥和整粒等,因此将片剂、胶囊剂、颗粒剂生产线布置在同一洁净区内,这样可提高设备使用率,减少洁净区面积,从而节约建设资金。
2.2涉及物料种类多由于该车间主要生产片剂、胶囊和颗粒3种剂型的产品,且3种剂型为不同成分的产品,可知,该车间涉及物料种类多,可以通过设置物料暂存和中转站,明确人物流分离,加强人员的管理等措施来避免物料混淆。
药品生产药量管理规范(GMP)与车间设计

2
洁净厂房应布置在厂区内环境清洁,人物流交叉又少的地方。并位于最大频率风向的上风侧,与市政主干道不宜少于50m。原料药生产区应置于制剂生产区的下风侧,青霉素类生产厂房的设置应考虑防止与其它产品的交叉污染。
添加标题
英文名:Good Manufacturing Practices for Drug 缩写GMP
添加标题
GMP的基本点:要保证药品质量,必须做到防止生产中药品的
添加标题
混批、混杂污染和交叉污染。
添加标题
GMP的中心指导思想是:任何药品质量形成是设计和生产出来的,
添加标题
而不是检验出来的。必须强调预防为主,
合适的——厂房、设施、设备
合格的——原辅料、包装材料
经过验证的——生产方法
可靠的——监控措施
完善的——销后服务
厂址选择 应在大气含尘、含菌浓度低、无有害气体、自然环境好的 区域。 应远离码头、铁路、机场、交通要道以及散发大量粉尘和有 害气体的工厂、贮仓、堆场等严重空气污染、水质污染、振 动或噪声干扰的区域。如不能远离严重空气污染区时,则应 位于其最大频率风向的上风侧,或全年最小频率风向的下风 侧,(市郊)
1
2
1993年中国医药工业公司修订《药品生产管理规范实施指南》
3
4
1998年,国家药品监督管理局颁布98修订版《GMP》
5
6
实施GMP工作与《许可证》换发及年检相结合顺规定期限内未取得“药品GMP证书”的企业或车间,将取消其相应生产资格。
2-2 GMP的主要内容
《药品生产质量管理规范》又称《最佳生产工艺规范》
国内
年产5200万瓶大输液(葡萄糖注射液)车间GMP工艺设计

课程设计说明书题目: 年产5300万瓶大输液(葡萄糖注射液)车间 GMP 工艺设计2 0 0 7 13 2 8 6张世平 江章应2011 年 1 月 6 日院 系: 专业班级: 学 号: 学生姓名: 指导教师:制药工程系 制药工程07-1班安徽理工大学课程设计(论文)任务书2010年12月20日目录第一章前言1.1 简介大输液为大容量注射剂,是我国医药行业五大类重要制剂之一,在临床上应用广泛。
随着我国医疗技术的进步和人民生活水平的提高,近十多年来,输液剂的研究取得了令人瞩目的成绩。
目前,我国经批准上市的新品种达100 余种;输液产量从1990 年的6.34 亿瓶增加到2003 年的35 亿瓶,输液剂的种类也发生了很大的变化,进一步满足了临床治疗的需要。
输液又名打点滴或者挂水。
是由静脉滴注输入体内的大剂量(一次给药在100ml 以上)注射液。
通常包装在玻璃或塑料的输液瓶或袋中,不含防腐剂或抑菌剂。
使用时通过输液器调整滴速,持续而稳定地进入静脉,以补充体液、电解质或提供营养物质。
由于其用量大而且是直接进入血液的,故质量要求高,生产工艺等亦与小针注射剂有一定差异。
1.2 输液的分类及临床用途1.电解质输液用以补充体内水分、电解质,纠正体内酸碱平衡等。
如氯化钠注射液、复方氯化钠注射液、乳酸钠注射液等。
2.营养输液用于不能口服吸收营养的患者。
营养输液有糖类输液、氨基酸输液、脂肪乳输液等。
糖类输液中最常用的为葡萄糖注射液。
氨基酸输液与脂肪乳输液将在后面专门论述。
3.胶体输液用于调节体内渗透压。
胶体输液有多糖类、明胶类、高分子聚合物类等,如右旋糖酐、淀粉衍生物、明胶、聚乙烯吡咯烷酮(PVP) 等。
1.3 输液的质量要求1、在无菌、澄明度及无热源这三项,应更加特别注意,它们也是输液生产中经常出现的主要问题。
2、含量,色泽,pH 也应符合要求。
pH 应在保障疗效和制品稳定的基础上,力求接近人体的pH,过高或过低都会引起酸碱中毒。
年产一千吨阿司匹林生产车间工艺设计

年产一千吨阿司匹林生产车间工艺设计年产1000吨阿司匹林生产车间设计摘要阿司匹林又名乙酰水杨酸,自1897年被首次合成之后,便被广泛使用。
它是历史上使用时间最长,用量最大的化学药物之一。
除去传统的温和的解热镇痛等药理作用外,随着科技的发展,并发现其还有防治癌症,治疗结膜炎、老年痴呆症、抗生素所致听力障碍、脚癣、白内障、偏头痛、艾滋病以及降血糖的作用。
这个上世纪最神奇的药物,已经焕发出了青春,科学工作者们正在探索它各种新的效用,将为这老药撰写新传。
鉴于其有广阔的发展空间和良好的市场前景,故大规模生产很有必要。
本文用醋酐和水杨酸为原料,以乙酸钠为催化剂生产阿司匹林。
工艺过程简单,产品纯度高,是阿司匹林生产的一条高产、优质、低成本的有效途径。
在此基础上设计了一个年产1000吨阿司匹林的GMP生产车间,并且根据工艺特点确定反应周期,通过物料衡算得到每一种所需原料的质量,而后根据衡算结果进行主要设备的选型和设计,再通过热量衡算对设备进行核算。
最后给出了生产工艺平面布置图、立面布置图、工艺管道流程图等附图。
关键词阿司匹林;车间设计;工艺流程;生产车间- -AbstractAspirin, also named acetylsalicylic acid, was first synthesized in 1897 to be extensively used as one of the longest-history and the largest-production chemical medicines. In spite of the traditional mild pharmacological effects of antipyrexia and abirritation, with the development of science and technology, it has also found the effects of preventing and treating cancer, conjunctivitis, alzheimer, hearing impairment caused by antibiotics, athletes foot, cataracts, migraine, AIDS and lowering blood sugar. The most amazing drug in the last century has shown its promise at wide development space and good market prospect for its new effects was exploring nowadays by scientific workers. Therefore it is necessary to large-scale production.This article gives a way of producing aspirin with acetic acid sodium as catalyst production by using acetic anhydride and salicylic acid as raw material. It is an aspirin production with high yield, good quality and low cost effective way of simple process, high purity. An annual output of 1,000 tons of aspirin GMP production workshop based on it is designed. And research has been done, such as to determine reaction cycle according to the technological characteristics, to get each needed heat raw material quality through the material balance, to obtain the required heat quantity through the heat balance in transformation, then to design axe body and pipeline according to the calculation, finally to present the production process layout and process piping flow chart.Keywords aspirin;process;production workshop;workshop design - I-目录摘要 (I)Abstract ................................................................................................. I I 年产1000吨阿司匹林生产车间设计................................................................... 第1章绪论 01.1 课题背景 01.2 厂址选择 (1)1.2.1 厂址选择原则 (1)1.2.2 建厂条件 (2)1.3 阿司匹林相关简介 (3)1.3.1 性质和特点 (3)1.3.2 阿司匹林药理作用 (3)1.3.3 阿司匹林临床新用途 (4)1.3.4 不良反应 (6)1.3.5 阿司匹林生产方法 (6)1.3.6 阿司匹林的包装要求 (7)1.3.7 阿司匹林生产情况 (7)1.4 研究课题概述 (8)第2章工艺流程确定 (9)2.1 生产合成方案 (9)2.2 生产工艺流程 (9)2.2.1 阿司匹林合成流程简述 (9)2.2.2 生产用水制备工艺 (11)2.3 本章小结 (11)第3章生产工艺流程计算 (12)3.1 生产规模 (12)3.2 物料衡算 (12)3.3 工艺设备型号选择 (17)3.3.1 工艺设备选型原则 (17)3.3.2 设备选择 (17)3.4 工艺计算 (19)3.4.1 罐体和夹套设计 (19)3.4.2 强度计算 (20)3.4.3 反应釜的其他附件 (23)- II-3.4.5 冷凝器规格确定 (28)3.4.6 储罐 (30)3.5 热量计算 (31)3.6 本章小结 (33)第4章车间设备布置 (35)4.1 药品生产质量管理规范(GMP) (35)4.2 GMP对药品生产企业厂房与设施的要求 (35)4.3 车间设备布置设计原则 (35)4.3.1 满足GMP的要求 (35)4.3.2 满足工艺要求 (35)4.4 厂房设计 (36)4.4.1 降低人为差错 (36)4.4.2 防止药品交叉污染和混杂 (36)4.5 车间布置方案 (37)4.6 管道设计 (39)4.6.1 管道材料、阀门和附件 (39)4.6.2 管道的安装、保温 (39)4.7 本章小结 (39)第5章公用工程系统 (41)5.1 排水系统 (41)5.2 电气和照明系统 (42)5.2.1 电气设计和安装 (42)5.2.2 照明设计和安装 (43)5.3 采暖通风及洁净净化系统 (43)5.3.1 采暖通风系统 (43)5.3.2 洁净净化系统 (44)5.4 筑物防雷设计 (45)5.5 防及火灾报警系统 (45)5.6 本章小结 (46)结论 (47)致谢 (48)参考文献 (49)附录A (50)附录B (61)附录C (67)- III-第1章绪论1.1课题背景阿司匹林,白色针状或板状结晶或粉末。
原料药厂设计GMP规范解读

阶段的操作要求。设施的设计应考虑到最大限度地控制可能的污染。当中间体或原料药有微生物控制标准 时,厂房的设计应减少微生物污染的风险。应关注下列因素:
选址对产品质量的影响; 原料药厂房设施的设计,在考虑最大限度地控制可能的污染时,应充分考虑不同地理位置、气候(包 括当地最高最低温度范围、最高最低湿度、风力风向数据等)、空气质量和水源质量的影响。 例如位于中国西北部某些区域的原料药厂可能要特别注意风沙乃至沙尘暴的影响,因此即使是非洁净 厂房,在必要时应能实现适当的密闭性;对于一般区通风设施的进风口,必要时应有适当的措施(如过滤) 防止细小沙尘对厂房内生产、质量控制和物料储存的影响;洁净区空调系统的设计,必要时应考虑细小沙 尘对空调系统净化能力和维护保养周期的影响。 例如位于中国东南部某些湿度比较大的区域的原料药厂(特别是有梅雨季节的区域),应特别考虑厂房 设施的防霉问题,必要时应有适当措施防止霉菌的滋生和污染,例如: 梅雨季节开始时应有适当的密闭功能以防止湿空气进人,并有适当的除湿措施; 厂房内表面应光滑,不利于霉菌牢固附着和生长,方便进行并且耐受清洗消毒; 可考虑采用瓷砖或耐受清洗消毒的防霉涂料; 应特别注意防止管道和表面的结露现象,管路应有保温层,各种管道和平面应有适当的倾斜角度,
应对当地的工艺用水水源质货进行评估,包括水源(市政饮用水或地下水/地表水)是否易受洪水等季 节性影响,及其对生产工艺的影响程度进行评估。
密闭和暴露系统的选择; 从前期生产到最终成品应逐步提高对产品的保护。原则上有两种方法可以选择:暴露系统(在敞开环 境下操作)或密闭系统。如果在敞开系统,产品可能短时暴露(如从容器中取样、离心机卸料等)或长时 间暴露(如磨粉、称量和包装操作、敞开过滤、干燥机卸料等)。这需要不同层次的保护。对于短时暴露的 产品,应采取额外的保护程序(“在产品暴露的同一区域内,只应进行同一产品的同一操作”,“适当的人员 着装要求”等)最大程度降低潜在污染(但应该严格保证符合中国 GMP 关于原料药生产的洁净度要求)。 对于长吋间暴露的产品,应安装适当的空气净化系统,确保其必要的防护。系统的安装和确认应符合 GMP 的要求,可参照 HVAC 系统 GMP 实施指南以及国际制药工程协会(ISPE )的《空调系统指南》和《调试和确 认指南》。 其他防护措施包括: • 空间隔离; • 在敞开系统中采用防护设施(遮盖物、隔离操作箱、隔离装置等); • 合理的管路设计(管道不直接位于敞开的人孔或出料口的上方,除非建立了适当的保护措施); • 过滤工乞气体和工艺溶剂。 推荐尽可能使用密闭系统。一般情况下密闭系统没有必要再建立额外的保护措施。自 身具有充分保护物料能力的设备(如密闭系统或可关闭的系统),可以在户外放置,尤其是精制阶段之前的 密闭设备。例如,如果不受天气影响,反应罐、发酵罐、结晶罐、蒸溜塔、储罐、储存容器或其他密闭设 备可置于室外。如果有足够的保护措施,一些非固定的设备(散装储罐等)也可置于室外。 对于置于室外的设备,不仅在静止状态下,也应有在操作过程中(如取样、清洁、消毒、维护保养、 设备或物料转移等,当适用时)防止污染的适当程序或措施。 不同原料药工艺对空间的不同要求; 厂房和设施应有足够空间,以便有序地放置设备和物料,防止混淆和污染。 对于多用途生产厂房并有可移动的设备时,充足的空间特别重要。专用的原料药生产设施,可以根据 特定种的具体性质,使工艺中不同生产步骤的生产能力和生产周期相互匹配,最大限度地减少工序间的等 待时间和物料滞留,因此需要的物料暂存空间相对较少;多用途生产厂房则相反,不问的原料药品种,由 于具体物料理化性质的不同,不同工序之间的生产能力和生产周期可能不能完全匹配(如不同品种的化学 反应时间长短不同,过滤难度不同,结晶周期不同,烘干周期不同),甚至于需要根据不同品种使用不同的 可移动设备,一般需要更多的物料和设备暂存空间。 人物流的设计; 厂房和设施的物流和人流的设计,应考虑到防止混料和污染的要求。 有时(特别是在旧厂房中)人流和物流的交叉不能完全避免,在这种情况下,应采取适当的管理措施 (例如 SOP )以防止混淆和污染。 特定的功能区域和辅助设施。 以下活动应有特定区域或控制系统:
最新GMP药厂(车间)设计PPT课件

总布置图与质量
▪ 生产要求:功能分区合理、避免污染;适 当建筑物及构筑物布景;人流、物流通道 协调、工程管道综合布置周密、较好的绿 化布置
▪ 安全要求:防火、防爆、卫生 ▪ 发展规划要求:近、远期规划
二、药厂(车间)工艺流程 设计
举例--固体制剂生产中新工艺路 线与设备
▪ 传统料筒混合、运输工艺路线所存在的问题: 固体制剂生产过程中会形成较多的中间品--粉末、 颗粒、素片、包衣片等。将这些中间品由上一个 生产工序转到下一个生产工序时,需要有一个容 器盛放并运输到位。
▪ 特点:符合GMP等法规和标准。
车间组成
▪ 生产部分:一般生产区和洁净区 ▪ 辅助生产部分 ▪ 行政-生活部分
车间的总体布置
▪ 厂房形式 ▪ 厂房平面布置 ▪ 厂房立面布置 ▪ 辅助车间及行政生活部分的布置 ▪ 质量控制区的布置 ▪ 无菌产品生产的隔离技术
车间布置设计的基本要求
▪ 满足GMP的要求 ▪ 满足工艺要求 ▪ 满足建筑要求 ▪ 满足安全和卫生要求
• 黄芩苷能降解内毒素,减轻内毒素对细胞 膜结构的损伤。
全部装入这一筒内,该筒移至总 混设备的机架上进行总混合,然 后再将筒移出,送至压片、充填 工序。
▪在这一过程中,仅有一个筒,一
次进料,一次出料。
新的料筒混合、运输工艺路线及 设备
▪ 新的料筒混合、运输工艺路线及设备:采用移动 式总混料筒的方法,可达到既总混又运输、加料 的目的,使整个过程均为一个筒作业,这的确不 失为一个较好的工艺路线。
管道布置设计的意义
▪ 关系到建设指标是否先进合理。 ▪ 关系到生产操作能否正常进行: 管道运转
的顺畅,设备运转的顺畅,整个车间的生 产操作的成效。 ▪ 关系到车间布置的整齐美观和通风采光良 好等问题。
(整理)GMP认证药厂固体车间及中药材提取车间平面图.
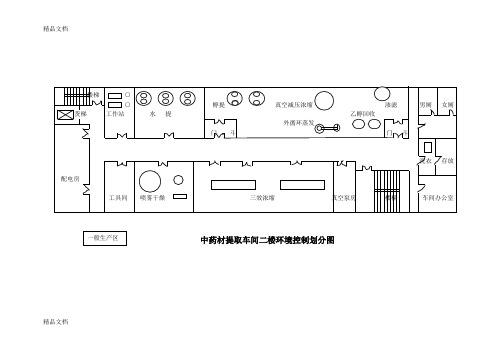
中药材提取车间二楼环境控制划分图
精品文档
精品文档
中药材提取车间二楼设备平面布置图
备注:
1、2真空泵 3、4、5多功能提取罐 6、7多功能醇提罐 8真空减压浓缩器 9渗滤罐 10外循环蒸发器 11、12乙醇回收罐 13 喷雾干燥机 14、15三效浓缩器 16洗衣机
精品文档
中药材提取车间三楼环境控制划分图
容器洗涤颗粒分装抛光胶囊充填除尘机房除尘过筛原辅料折包
风机整粒、总混湿法制粒暂存净容器脏容器内空心复称前室
存放存放包前室前室中间站制浆干燥配料
材胶囊
洁具
洁具存放中间站检验前室不合格品前室晾片内包材双铝包装气闸缓冲
洗手脱衣更衣手消毒整理冲模除尘包衣中间站半成品
换鞋洗手更衣洗烘衣压片压片风机铝塑包装暂存
制浆
固体制剂车间平面示意图
精品文档
精品文档
中药材提取车间二楼人流图 人流
精品文档
中药材提取车间二楼物流图 物流
精品文档
中药材提取车间三楼物流图 物流
精品文档
中药材提取车间三楼设备平面布置图
备注:
1、2、3水提投料口 4、5醇提投料口 6烘箱 7乙醇回收冷凝器 8拣选工作台 9润药池 10洗药机 11破碎机 12粉碎机 13切药机
精品文档
中药材提取车间三楼人流图 人流
精品文档
中药材提取车间一楼环境控制划分图
精品文档
中药材提取车间一楼物流图物流
精品文档。
药厂GMP管理及制药厂工艺设计概论(PPT115页)

第一节 GMP的概念
什么是GMP?
GMP是英文GoodManufacturingPractice的缩写,中文意思 是“药品生产质量管理规范”。
GMP是国家药品监督管理局为生产优良药品而制定的关于 原料、人员、设施设备、生产过程、包装运输、质量控制等方 面的标准规则,以帮助企业改善卫生环境,及时发现生产过程 中存在的问题并加以改善。
1978年,美国再次颁行经修改的GMP(cGMP)。
1988年,东南亚国家联盟也制订了自己的GMP,作为东南亚联盟各国实 施GMP的文本。
第二节 GMP的发展过程
Q7A指南发展情况:
2000年11月在欧洲医药产品评审局的网站上公布 2001年7月作为欧共体优良制造规程附录18发表 2001年9月25日联邦注册 (第66卷,第186号)公布有效性声明 (NOA) 2001年11月2日被日本卫生与劳动保障部(MHLW)采用
第二节 GMP的发展过程
最初药品的质量只要是通过放行前检测来保 证的,频繁发生的重大药物灾难使人们逐渐认识 到仅仅检测是不能完全确保产品的质量,还必须 对生产的整个过程进行有效控制。
第二节 GMP的发展过程
国外GMP发展
1962年,美国修改了《联邦食品药品化妆品法》(Federal Food Drug Cosmetic Act),此为美国GMP的初形。 1963年,由美国坦普尔大学6名教授编写制订,美国国会第一次颁布了第 一部GMP。 1967年,WHO(世界卫生组织)在《国际药典》的附录中收载了GMP。 1969年,第22届世界卫生大会上,WHO建议各成员国的药品生产采用 GMP制度,以确保药品质量。 1971年,英国制订了《GMP》(第一版),1977年又修订了第二版; 1983年公布了第三版,现已由欧共体GMP替代。
年产5200万瓶大输液(葡萄糖注射液)车间GMP工艺设计

课程设计说明书题目: 年产5300万瓶大输液(葡萄糖注射液)车间GMP工艺设计院系: 制药工程系专业班级: 制药工程07-1班学号: 2 0 07 1 328 6学生姓名: 张世平指导教师:江章应2011年1月6 日安徽理工大学课程设计(论文)任务书化学工程学院制药工程系学号200713286学生姓名张世平专业(班级) 制药工程07-1班设计题目年产5300万瓶大输液(葡萄糖注射液)车间GMP工艺设计设技术参数计(1)年工作日255天。
(2)生产班制一天两班,按每班6h生产计。
(3)产品规格500ml/瓶,玻璃瓶。
设计要求(1)根据上述条件设计一条完整的GMP生产线,写出完整的设计说明书,完成相关的附图。
(2)合理选择设计方案、工艺操作参数和计算公式,计算准确。
(3)设计计算说明书书写规范,文字准确简练,图标清晰规范。
(4)设备主要技术参数符合国家标准。
(5)前言、后记及参考文献。
工作量设计计算说明书一份,GMP工艺流程图一份。
工作计划设计时间二周2010年12月27日—布置设计任务;12月28日至12月31日)—完成设计方案的选定和初步设计计算;2011年1月4日至1月7日—完成设计计算说明书抄写及绘图、装订。
参考资料《制药工艺给水系统》、《制药工程课程设计》、《药厂反应工程与车间设计》等指导教师签字系主任签字2010年12月20日目录第一章前言1.1简介大输液为大容量注射剂,是我国医药行业五大类重要制剂之一,在临床上应用广泛。
随着我国医疗技术的进步和人民生活水平的提高,近十多年来,输液剂的研究取得了令人瞩目的成绩。
目前,我国经批准上市的新品种达100余种;输液产量从1990年的6.34亿瓶增加到2003年的35亿瓶,输液剂的种类也发生了很大的变化,进一步满足了临床治疗的需要。
输液又名打点滴或者挂水。
是由静脉滴注输入体内的大剂量(一次给药在100ml以上)注射液。
通常包装在玻璃或塑料的输液瓶或袋中,不含防腐剂或抑菌剂。
GMP对厂房与设施要求

(2)地下综合管沟:检修较易,造价高,不适宜于地下水位 高的地区 。
1. 不同的功能区 根据主流风向 合理布局,明 显分隔。
2. 动力区距离主 要用能车间较 近,有利于管 线的合理布置 和废能的综合 利用。
3. 人流和物流易 于分开。
污水 处理区
防爆区
绿化区
堆 动力 场区
辅助 生产区
非洁净 生产区
洁净 生产区
绿化区
仓贮 区
车
库 办公区
门卫
物流 人流
生活区
厂区建筑面积的一般分布
(11)洁净厂房周围应绿化,尽量减少厂区的露土面积,一 般制剂厂的绿化面积在30%以上,铺植草坪,不宜种花。
(12)厂区应设消防通道,医药洁净厂房宜设置环形消防车 道。如有困难可沿厂房的两个长边设置消防车道。
上风侧
厂前区
无菌生 产车间
非无菌 生产车间
原料 车间
锅炉房
下风侧
环保 中心
厂区合理布局的参考示例
(8)动力设施应接近负荷量大的车间,三废处理、锅炉房等严重污染的区 域应置于厂区的最大频率风向的下风侧。变电所的位置考虑电力线引入厂 区的便利。
(9)危险品库应设于厂区安全位置,并有防冻、降温、消防 措施。麻醉药品和剧毒药品应设专用仓库,并有防盗措施。
(10)动物房应设于僻静处,并有专用的排污与空调设施。
(3)干管宜布置在主要用户及支管较多的一边。 (4)尽量减少管线间及与道路的交叉。当必须交叉时,宜
药厂生产车间的GMP设计分析

药厂生产车间的GMP设计分析摘要:生产车间是药厂中的主要生产部门,药厂在进行生产车间工艺布局设计时,应当GMP合规性作为首要环节,充分保证药品的质量,以免造成重大的损失。
文章基于对制药企业生产车间GMP设计的相关研究分析,指出了药厂生产车间设计中存在的问题,并提出了相应的解决措施。
关键词药厂生产车间GMP设计引言随着我国社会经济的发展和科技水平的不断提高,有些设计单位在药厂生产车间设计中存在很多与工艺脱节的问题,这些问题最终会影响到制药企业的生产质量以及企业的经济利益,对药品的质量和安全性造成一定影响。
为确保药厂的产品品质和经济效益,有关工作人员应加强对药厂生产车间 GMP设计的重视。
1 GMP理解GMP最核心的是良好的生产质量管理。
基本理念是防止不合理的人、物流活动对药品质量产生不良影响,防止污染和交叉污染,防止混淆,保证生产过程的受控、稳定、可追溯,在药品生产过程中,确保药品质量符合国家的相关要求。
在生产管理上,不能再抱有“硬件不足软件补”的思想。
人都有惰性,有人参与的地方一定会有差错。
因此在做车间工艺布局设计时,不能留有缺陷,首先在硬件上解决问题,尽量减少员工出差错的概率,进而减少产品出差错的概率。
2 设计院选择笔者在工作中与国内大小设计有过多次的交流,在选择设计院时,应当选择有丰富药厂设计经验的设计院。
选定设计院后,整个车间或综合制剂车间及建筑的工艺布局和各专业设计,应该是设计院和药厂共同来完成。
这样设计出来的车间或综合制剂车间工艺布局,会很好的适合生产车间的生产需要。
3 车间工艺布局良好的工艺布局设计应以满足药品质量要求为原则,应根据不同生产车间的工艺特点,从厂房布局、洁净区设计、设备布局、物流布局及管理等方面综合考虑,力求简洁、实用和有效。
工艺布局设计时应考虑:建筑高度及层高;空调系统;工艺用水系统;排污系统;压缩空气系统;暖通系统;电气、自控系统;冷却水、冷冻水系统;工艺设备;人、物流;GMP 符合性;消防安全合规性等。
药厂车间设计重点知识

绪论:工艺过程:利用劳动工具改变劳动对象的大小、形状、大小、成分、性质、位置、或表面形状,使成为预期产品的过程。
机械与设备的区别:设备:主要过程与机械能无关,仅在物料输送和强化过程中需要机械能。
机械:用机械功改变劳动对象的形状、状态等设备。
机械代码结构:共六层,前两层为64.65,第三层为制药机械大类,第四层为区别各种剂型机械的代码,第五层为按功能分类的代码,第六层为型式、结构代码。
制药机械产品型号由主型号和辅型号组成。
主型号按照机械的分类名称,产品型式,功能及特征代号组成,辅助型号主要包括:主要参数、改进设计顺序号。
机械名称及代号:原料药机械及设备(L);制剂机械(Z);药用粉碎机械(F);饮片机械(Y);药用纯水设备(S);药用包装机械(B);药物检测设备(J);制药辅助设备(Q)。
药品GMP认证两种形式:药品企业(车间)GMP认证;药品品种GMP认证。
药品GMP认证的标准:《药品生产质量生产管理规范》《中华人民共和国药典》《中华人民共和国卫生部药品标准》《中国生物制品规范》验证:证明任何程序,生产过程,设备、物料、活动或系统能达到预期结果的有文件证明的一系列活动。
注射剂生产设备水针剂灭菌工艺:高压蒸汽灭菌、水浴式灭菌易折安瓿:色环易折安瓿、刻点痕易折安瓿安瓿洗涤设备:喷淋式安瓿洗瓶机组,不适宜曲颈安瓿;汽水喷射式洗瓶机组,经过二水二气的冲洗吹净。
安瓿灌封设备:LAG1-2拉丝灌封机主要执行机构是:送瓶机构、灌封机构、封口机构安瓿灌封机构:凸轮—杠杆机构;注射液机构;缺瓶止灌机构拉丝封口火焰:1400摄氏度左右,距离:10mm安瓿灌封问题及解决措施:冲液:将注射针头制成三角形开口,中间并拢的所谓梅花形针端;调节注射针头进入安瓿的位置恰到好处;改进提供针头托架运动的凸轮轮廓设计,使针头出液先急后缓,减缓冲液。
束液:改进灌液凸轮的轮廓设计,使其在注液结束时返回行程缩短,速度加快;设计使用有单孔的单向玻璃阀;在储液瓶和针管连接的导管加一只螺丝夹,靠乳胶管的弹性作用控制束液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20000
60000
500Байду номын сангаас
洁净厂房内采用何种等级的洁净空气主要取决于药品的类 型和生产工艺要求。GMP对不同等级洁净厂房的适用范围有明 确的规定。洁净等级的数值越大,空气的洁净度就越低。
五、车间布置设计应考虑的因素
1、本车间与其他车间及生活设施在总平面的位置上,力
求联系便捷。 2、满足生产工艺及建筑、安装和检修要求。 3、合理利用车间的建筑面积和土地。 4、车间劳动保护、安全卫生及防腐蚀措施。
5、人流、物流分别独立设置,避免交叉往返。
6、对原料药车间的精、烘、包工序以及制剂车间的设计, 应符合GMP要求。
7、要考虑车间发展的可能性,留有发展空间。
8、厂址所在区域的气象、水文、地质等情况。
六、制药车间布置设计的程序
收集有关的基础设计资料
1、直接资料
A、设计任务书;
包括车间外部资料和车间内部资料。
二、制药车间布置设计的特点
原料药工业包括化学合成药、抗生素、中草药和生物药
品的生产。原料药作为精细化学品,属于化学工业的范畴, 在车间布置设计上与一般化工车间具有共同特点。但制药产 品(原料药及制剂)是特殊商品,必须保证药品的质量。所 以,原料药生产的成品工序(精、烘、包工序)与制剂生产 的罐封、制粒、干燥、压片等工序一样,它的新建、改造必 须符合《药品生产质量管理规范》,这是药品生产特殊性的 方面。
D、工艺设计部分的说明书和工艺操作规程;
E、土建资料,主要是厂房技术设计图(平面图和剖面图)、 地耐力和地下水等资料;
F、劳动保护、安全技术和防火防爆等资料;
G、车间人员表(包括行管、技术人员、车间分析人员、岗 位操作工人和辅助工人的人数,最大班人数和男女的比例 ); H、其它资料。
2、设计规范和规定
设计依据包括中华人民共和国卫生部《药品生产质量 管理规范》(1998年修订)、国家医药管理局《医药工业洁净 厂房设计规范》(1997)、中华人民共和国国家标准《洁净厂 房设计规范》GBJ73-84、《建筑设计防火规范》、《工业 企业照明设计规范》、《工业企业采暖通风和空气调节设 计规范》、《建筑给排水设计规范》、《工业企业噪声卫 生标准》、《工业“三废”排放标准》等。在上述规范和 标准的指导下进行以下工作:
药厂(车间)布置设计的目的、 特点
目的:对厂房的配置和设备的排列做出合理 安排。 特点:符合GMP等法规和标准。
三、制药车间的组成
车间一般由生产部分(一般生产区及洁净区)、辅助生产 部分、行政—生活部分和通道四部分组成。对于制剂车间:
辅助生产部分包括物料净化用室、原辅料外包装清洁室、 包装材料清洁室、灭菌室;称量室、配料室、设备容器具清洁 室、清洁工具洗涤存放室、洁净工作服洗涤干燥室;动力室 (真空泵和压缩机室)、配电室、分析化验室、维修保养室、 通风空调室、冷冻机室、原料、辅料和成品仓库等。 行政—生活部分由人员净化用室(包括雨具存放间、管理 间、换鞋室、存外衣室、盥洗室、洁净工作服室、空气吹淋室 等)和生活用室(包括办公室、会议室、厕所、淋浴室与休息 室,保健室和吸烟室等)组成。
(1)车间外部资料包括:
B、设计基础资料,如气象、水文和地质资料;
C、本车间与其他生产车间和辅助车间等之间的关系;
D、工厂总平面图和厂内交通运输。
(2)车间内部资料包括:
A、生产工艺流程图; B、物料计算资料,包括原料、半成品、成品的数量和性 质,废水、废物的数量和性质等资料; C、设备设计资料,包括设备简图(形状和尺寸)及其操 作条件,设备一览表(包括设备编号、名称、规格型式、 材料、数量、设备空重和装料总重,配用电机大小、支撑 要求等),物料流程图和动力(水、电、汽等)消耗等资 料;
GMP药厂(车间)设计
第一节、概 述
一、制药车间布置的重要性和目的
目的是对厂房的配置和设备的排列作出合理的安排。
车间布置设计是车间工艺设计的重要环节之一,还是工 艺专业向其它非工艺专业提供开展车间设计的基础资料之一。
有效的车间布置将会使车间内的人、设备和物料在空间 上实现最合理的组合,以降低劳动成本,减少事故发生,增 加地面可用空间,提高材料利用率,改善工作条件,促进生 产发展。布置不合理的车间,基建时工程造价高,施工安装 不便;车间建成后又会带来生产和管理问题,造成人流和物 流紊乱,设备维护和检修不便等问题,同时也埋下了较大的 安全隐患。
一般化工车间的组成
生 产 区: 如 洁 净 区 或 洁 净 室 。 辅助生产区 : 如 物 料 净 化 室 、 包 装料 材清 洁 室 、 灭 菌 室 、量 称室 、 配 料 室 制药洁净车间 分 析 室 、 真 空 泵 室 、调 空机 室 、 变 电 配 电 室。 等 行 政 生 活 区 : 如 换 鞋 室 、 更 衣 室 、衣 存室 、 空 气 吹 淋 室 、公 办室 、 休 息 室 浴室、厕所等。
生 产 区: 如 原 料 工 段 、 生 产 工 、 段成 品 工 段 、 回 收 工、 段控 制 室 等 。 : 如 真 空 泵 室 、 压 缩 机、 室 变 电 配 电 室 、 车 间验 化室 、 机 修 室 、 辅 助 生 产 区 化工车间 通 风 空 调 室 、 原 材 料成 及品 仓 库 等 。 : 如 办 公 室 、 会 议 室 、息 休室 、 更 衣 室 、 浴 室厕 、所 等 。 行政生活区
5、通道、物流运输系统设计。
6、安装、操作、维修的平面和空间设计。
洁净厂房内空气的洁净等级
尘粒数 洁净等级/级 0.5m尘粒数/粒m-3 3500 350000 5m尘粒数/粒m-3 0 2000 活微生物数/个m-3
100 10000
5 100
100000
300000
3500000
制药洁净车间的组成
四、制药车间布置设计的内容
1、按《药品生产质量管理规范》确定车间各工序的洁净 等级和确定车间的火灾危险类别、爆炸与火灾危险性场所等级 及卫生标准。 2、生产工序、生产辅助设施、生活行政辅助设施的平面、 立面布置。 3、车间场地和建筑物、构筑物的位置和尺寸。 4、设备的平面、立面布置。
