全血多元素质控品产品技术要求bohui
全血成分血质量要求

全血及成分血质量要求Quality requirements for whole blood and blood components目次前言 (Ⅲ)1 范围 (1)2 规范性引用文件 (1)3 术语和定义 (1)4 血液安全性检测要求 (4)5 血液质量控制要求 (4)前言本标准的第 4 章为强制性的,其余为推荐性的。
本标准按照GB/T 一2009 给出的规则起草。
本标准代替GB 18469 一2001 《全血及成分血质量要求》,与GB 18469 一2001 相比,主要技术变化如下:―将英文名称由“Standards for whole blood and blood components quality ”修改为“Quality requirements for whole blood and blood components " ;―调整了标准的框架结构,对血液的要求分为血液安全性检测要求和血液质量控制要求两部分阐述;―增加了去白细胞全血、冰冻红细胞、病毒灭活新鲜冰冻血浆、冰冻血浆、病毒灭活冰冻血浆、混合浓缩血小板、辐照血液和速冻的定义;―将血液制剂、成分血、红细胞成分血、单采成分血、全血、浓缩红细胞、悬浮红细胞、洗涤红细胞、冰冻解冻去甘油红细胞、浓缩血小板、新鲜冰冻血浆、冷沉淀凝血因子、浓缩少白细胞红细胞、悬浮少白细胞红细胞、单采血小板、单采少白细胞血小板、单采新鲜冰冻血浆、单采粒细胞的定义进行修订;―将GB 1 8469 一2001 中少白细胞血液制剂的名称修订为去白细胞血液制剂;―增加了去白细胞全血、去白细胞悬浮红细胞、病毒灭活新鲜冰冻血浆、冰冻血浆、病毒灭活冰冻血浆、混合浓缩血小板的质量要求;―删除全血及成分血标签的相关内容,由其他相关国家标准衔接;―增加了300 ml 规格全血和相应成分血的质量要求;―将全血和成分血外观要求中“无黄疽”改为“无色泽异常”;―将全血和成分血外观要求中“储血容器无破损”改为“血袋完好”;―将全血外观要求中导管的长度由“20 cm ”调整至“35 cm " ;―将全血的容量要求的表述方式调整为“不包括保养液的容量”;―删除了全血中K +、Na +、pH 和血细胞比容的质量控制项目;―在全血中增加了“血红蛋白含量”的质量控制项目;―将全血中“血浆血红蛋白”质量控制项目调整为“储存期末溶血率”;―将悬浮红细胞外观要求中“上清呈无色透明”改为“无色泽异常”,并将导管的长度由“20 Cm " 调整至“35 cm " ;―在悬浮红细胞中增加了“血红蛋白含量”和“储存期末溶血率”的质量控制项目;―将洗涤红细胞外观要求中“保留注满洗涤红细胞的转移管”的内容改为“保留注满洗涤红细胞或全血经热合的导管”;―将洗涤红细胞中“红细胞回收率”质量控制项目调整为“血红蛋白含量”; ―删除了洗涤红细胞“白细胞清除率”质量控制项目;―将洗涤红细胞“血浆蛋白清除率”质量控制项目调整为“上清蛋白质含量”; ―在洗涤红细胞中增加“溶血率”要求;―在洗涤红细胞中增加“无菌试验”要求;―将冰冻解冻去甘油红细胞“红细胞回收率”质量控制项目调整为“血红蛋白含量”; ―删除了冰冻解冻去甘油红细胞“残留血小板”和“体外溶血试验”的质量控制项目;―在冰冻解冻去甘油红细胞中增加了“无菌试验”要求;―将浓缩血小板的pH 由“6 .。
血细胞分析仪用质控物(光学法)产品技术要求mairui

2.性能指标
2.1外观
a)质控物应为一种足够均匀的类血液物质,不得有凝块。
b)质控物的外包装应完整、标签标识清晰。
2.2装量
1.5mL 规格质控物每瓶装量应不小于 1.5mL。
3.5mL 规格质控物每瓶装量应不小于 3.5mL。
2.3均匀性
2.3.1瓶内均匀性
质控物的瓶内均匀性应符合表 2 的要求。
Eos%、Bas%的瓶内均匀性要求以绝对偏差或相对偏差表示,二者满足其一即可。
2.3.2瓶间均匀性
质控物瓶间均匀性应符合表 3 的要求。
表 3 质控物瓶间均匀性的要求
1
注: Neu%、Lym%、Mon%、Eos%、Bas%的瓶间均匀性要求以 CV 或SD 表示,二者满足其一即可。
其余参数的瓶间均匀性以 CV 表示。
2.4质控物定值及范围
2.4.1质控物的参考值
每批质控物均应提供本批质控物的参考值表。
2.4.2定值质控物的赋值程序
制造商需要提供参考值的赋值方法;确定参考范围的文件;并提供赋值程序文件及至少一个批次的赋值记录。
2.4.3定值质控物赋值的准确性
应符合表4的要求。
2
注:当参考值小于表 4 中该参数的允许变化范围时,允许变化范围定义为±参考值。
2.5生物安全性
质控物的乙型肝炎表面抗原(HBsAg)、艾滋病I型/II型(HIV-1/HIV-2)抗体、丙型肝炎(HCV)抗体、梅毒螺旋体(TP)抗体检测应为阴性。
3。
五元素(铜锌钙镁铁)质控液产品技术要求普析

五元素(铜锌钙镁铁)质控液
适用范围:与本公司的原子吸收光谱仪配套,用于临床机构体外测量人全血中铜、锌、钙、镁、铁元素含量时的质量控制。
1.1 产品规格:50mL×2瓶/盒(1号、2号)。
1.2 产品组成成分:铜、锌、钙、镁、铁、硝酸镧(0.0025%)、曲拉通(0.025%)、硝酸(0.5%)、牛血清(小于1%)、去离子水(大于95%)。
每套校准液由1号、2号两瓶不同浓度的溶液组成,具体浓度见表1。
表1质控液浓度表
2.1. 外观
a)质控液应澄清,无异物和絮状物;
b)质控液容器表面应光滑,无毛刺等缺陷;标签应字迹清晰。
2.2. 装量
各瓶溶液的装量应不少于50mL。
2.3. 赋值有效性
测量误差应不超过标称浓度±10%。
2.4. 均一性
变异系数CV≤10%。
2.5. 批间差
相对极差R≤10%。
2.6. 效期稳定性
质控液在0℃~30℃贮存条件下有效期为6个月,在过有效期后一个月内,质控液应符合2.1、2.3和2.4的要求。
生化多项质控品产品技术要求

生化多项质控品
结构组成:
本质控品是以人血清为基质,并添加了特定项目的生物源性物质和化学成分,具体内容见下
预期用途:,用于以下生化项目的室内质量控制:肌酸激酶MB同工酶、腺苷脱氨酶、天门冬氨酸氨基转移酶线粒体同工酶、5'-核苷酸酶、甘氨酰脯氨酸二肽氨基肽酶、前白蛋白、糖化血红蛋白、N-乙酰-β-D-氨基葡萄糖苷酶、血管紧张素转化酶、同型半胱氨酸、超氧化物歧化酶。
2.1 外观和性状
2.1.1 外包装完整无破损;中文包装标签应清晰、准确、牢固。
2.1.2 本质控品应为红色冻干粉;复溶后应为红色液体,无浑浊,无未溶解物。
2.2 可接受区间/值
各项目在其测量系统上的测定结果应在可接受区间内。
2.3 均匀性
2.3.1 瓶内均匀性
)应不大于10%。
各项目的瓶内均匀性变异系数(CV
瓶内
2.3.2 瓶间均匀性
)应不大于10%。
各项目的瓶间均匀性变异系数(CV
瓶间
2.4 稳定性
2.4.1 复溶稳定性
复溶后的质控品密封保存于2 ℃~8 ℃、避光环境中,可稳定3天;复溶后的质控品密封保存于不高于-18℃、避光环境中,可稳定10天。
在稳定期内赋值结果的变化趋势不显著。
2.4.2 效期稳定性
质控品保存于2 ℃~8 ℃,有效期为24个月。
在有效期内赋值结果的变化趋势不显著。
生化多项校准品产品技术要求zhongshengbeikong

生化多项校准品适用范围:本产品与本公司生化项目试剂盒配套使用,用于临床检验实验室中以下21个生化项目定量检测的系统校准,具体项目为:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰基转移酶(GGT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、α-淀粉酶(AMY)、葡萄糖(Glu)、尿素(Urea)、尿酸(UA)、肌酐(Cre)、总胆红素(T.Bili)、直接胆红素(D.Bili)、无机磷(IP)、钙(Ca)、铁(Iron)、镁(Mg)、胆固醇(CHO)、甘油三酯(TG)、总蛋白(TP)、白蛋白(Alb)。
1.1规格冻干粉型(复溶体积):1mL×3(1个浓度);1mL×10(1个浓度);3mL×3(1个浓度);3mL×10(1个浓度)。
1.2主要组成成分本产品以人血清为基质,并添加了特定项目的生物源性物质和25mmol/L氯化钠。
表1 校准品的主要成分及生物源性2.1 外观本校准品应为浅黄色冻干粉,复溶后应为浅黄色或浅褐色透明溶液,无混浊,无未溶解物。
2.2 准确度2.3瓶间差变异系数(CV)应≤5%。
2.4 含水量含水量应≤5%。
2.5稳定性2.5.1效期稳定性原包装校准品在2℃~8℃条件下避光贮存,有效期为18个月。
在有效期满后3个月内,校准品性能应符合2.1、2.2、2.3要求。
2.5.2复溶稳定性复溶后校准品在15℃~25℃密封避光保存,在稳定期满后2小时内,校准品性能应符合2.1、2.2、2.3要求。
复溶后校准品在2℃~8℃密封避光保存,在稳定期满后2小时内,校准品性能应符合2.1、2.2、2.3要求。
复溶后校准品在-25℃~-15℃密封避光保存,在稳定期满后8小时内,校准品性能应符合2.1、2.2、2.3要求。
2.6溯源性校准品溯源性应符合GB/T 21415-2008的要求,并提供相关溯源过程、测定值不确定度等内容,本校准品溯源情况详见附录A。
血站实验室质控品与校准品管理的质量要求

血站实验室质控品与校准品管理的质量要求在血站实验室中,质控品与校准品的管理是确保实验室准确可靠运行的关键环节。
质控品与校准品的选择、使用和储存直接影响到实验数据的准确性和可信度,因此在实验室管理中,对质控品与校准品的管理有着严格的质量要求。
本文将就血站实验室质控品与校准品管理的质量要求进行探讨。
质控品的管理质控品的选择质控品的选择应综合考虑实验室所做检测项目的特点、仪器设备的性能指标以及国家相关标准的要求。
质控品应具有代表性,稳定性好,用量适中,并且能覆盖实验的全过程。
质控品的使用在使用质控品时,应按照质控品厂家提供的说明书进行操作。
注意质控品的保存条件和有效期,避免使用过期的质控品。
在实验过程中,需要进行合理的校准和调整,确保质控品的使用效果。
质控品的储存质控品的储存应符合相关规定,注意避免污染和交叉感染。
在储存过程中定期检查质控品的状态,确保质控品的稳定性和可靠性。
校准品的管理校准品的选择校准品的选择应根据实验室所使用的仪器设备的特点和性能指标来确定。
校准品应具有准确的浓度值和良好的稳定性,能够满足实验室的校准需求。
校准品的准备在使用校准品时,应严格按照操作规程进行准备和操作。
注意校准品的储存条件和有效期,避免使用过期或不合适的校准品。
校准品的使用在使用校准品进行校准时,应考虑到环境因素的影响,确保校准的准确性和可靠性。
在校准过程中需要严格按照操作规程进行操作,避免人为因素对校准结果产生影响。
总结血站实验室质控品与校准品管理的质量要求至关重要,直接关系到实验数据的准确性和可信度。
通过合理选择、正确使用和有效管理质控品和校准品,可以保障实验室运行的准确可靠。
希望通过本文的介绍,能够增进对血站实验室质控品与校准品管理的了解,提高实验室管理水平和实验数据的质量。
定值多项质控血清产品技术要求jiuqiang

定值多项质控血清适用范围:该产品与本公司生产的试剂盒配套使用,用于临床实验室内部的质量控制。
本产品所含项目为:白蛋白、总蛋白、胆汁酸、直接胆红素、总胆红素、肌酐、葡萄糖、尿素、尿酸、总胆固醇、甘油三酯、碱性磷酸酶、γ-谷氨酰转肽酶、胆碱酯酶、谷丙转氨酶、谷草转氨酶、肌酸激酶、α-羟丁酸脱氢酶、乳酸脱氢酶、α-淀粉酶、二氧化碳、钙、磷、镁、锌、铁。
1.1 包装规格见表1表1 包装规格1.2主要组成成分以人血清为基质的由正常/水平I与异常/水平II组成的冻干质控品。
主要组成见表2(其中水平I中各控制成分的浓度和活性通常在正常或参考值范围内,水平II中各控制成分的浓度和活性通常在病理或医学决定性水平范围内。
)表2主要组成成分注:不同批号质控品赋值有差异2.1 外观外包装盒应平整、无破损、文字和标识清晰;质控品为冻干粉,应密封、无泄漏;质控品复溶后应为黄色澄清透明液体,目测不得有沉淀及絮状悬浮物。
2.2 含水量冻干物水分含量:<5%。
2.3 赋值有效性测试待检质控品各个项目,测试结果均应落在标示值范围内。
2.4 瓶间精密度各项目的瓶间精密度不大于3%(其中天门冬氨酸氨基转移酶不大于5%;二氧化碳不大于5%;无机磷不大于8%)。
2.5 稳定性2.5.1 复溶稳定性复溶后质控品在2℃~8℃密封保存8h),复溶后质控品在2℃~8℃保存7天(CO2在生化分析仪上同时测试保存期末的质控品和新鲜的质控品,测试结果间的相对偏差不大于5%(其中总胆汁酸不大于3%;肌酐不大于4%;碱性磷酸酶不大于8%;锌不大于10%。
二氧化碳复溶后质控品在2℃~8℃密封保存8 h,在生化分析仪上同时测试保存期末的质控品和新鲜的质控品两个浓度水平,测试结果应不大于20%。
总胆红素、直接胆红素具有光敏性,建议血清避光保存,复溶后尽快使用。
)。
2.5.2 实时稳定性质控品在2℃~8℃储存条件下可保存36个月,在保存期末,同时测试到效期的质控品和-20℃保存的同批号质控品,测试结果间的相对偏差要求见下表。
25-羟基维生素D测定试剂盒(酶联免疫吸附法)产品技术要求bohui

25-羟基维生素D测定试剂盒(酶联免疫吸附法)适用范围:该产品与中性电极共同作用为高频电刀的附件,在外科手术中进行切割和凝血。
用于体外定量测定人血清、血浆或耳指末梢全血中25-羟基维生素D的含量。
1.1产品规格96人份/盒、48人份×2/盒、48人份/盒。
1.2主要组成成分2.1 外观试剂盒外观应整洁,文字符号标识清晰;液体组分应澄清透明,无沉淀、无渗漏;包被的检测板密封完好,不得有破损。
2.2 装量实际装量不得低于标称量,且偏差不大于标称量的3%。
2.3 检测限不高于5μg/L。
2.4 线性在[5,120]μg/L内,线性相关系数(r)应≥0.990。
2.5 准确度与高效液相色谱法做对比试验,用线性回归方法计算两组结果的相关系数(r)及每个浓度点的相对偏差,其线性相关系数(r)≥0.975,且相对偏差≤15%。
2.6 重复性用质控品1、质控品2两个浓度水平的质控品各重复检测10次,变异系数(CV)应≤10%。
2.7 特异性测定浓度为100μg/L的维生素D,交叉反应率应≤10%。
32.8 微量全血处理液的pH值pH:7.4±0.03。
2.9 溯源性根据GB/T 21415-2008及有关规定提供所用校准品的来源赋值过程等内容,溯源至25-羟基维生素D标准品(美国NIST,SRM2972)。
2.10 质控品赋值有效性质控品测值,应在质控范围内。
2.11 批间差用三个批次的试剂盒检测同一份样品,三个批次之间的变异系数(CV)应≤15%。
2.12 效期稳定性2℃~8℃保存,有效期为12个月。
到期后三个月内应符合2.3、2.4、2.5、2.6的要求。
全血铅镉元素校准溶液产品技术要求bohui

全血铅镉元素校准溶液
适用范围:用于BH系列原子吸收光谱仪测定人体全血中铅镉元素含量时对仪器进行校正的标准溶液。
1.1产品规格
1.0g×4支(0号、1号、2号、3号);1.0g×2支(4号、5号)。
1.2 主要组成成分:牛血、铅、镉溶液,具体浓度见表1。
表1全血铅镉元素校准溶液浓度的标准值单位:µg /L
编号Pb Cd
0号0.0 0.0
1号10.0 0.4
2号20.0 0.8
3号30.0 1.2
4号40.0 1.2
5号50.0 1.6
2.1 外观
2.1.1 装入校准溶液的塑料瓶或离心管应光滑,无毛刺;标签清晰完整不能有破损等缺陷。
2.1.2 0号为无色液体;1、2、3、4、5号血红色液体,可有少量沉淀。
2.2 装量:≥1.0g。
2.3测量准确性:±20%。
2.4批内变异系数(CV):镉≤10%。
2.5稳定性:
2℃~8℃贮存环境下有效期为一年。
在有效期后一个月内测量其性能应符合2.1、2.2、2.3、2.4的要求。
全血七元素(铜、锌、钙、镁、铁、钾、钠)校准溶液产品技术要求bohui

全血七元素(铜、锌、钙、镁、铁、钾、钠)校准溶液
适用范围:用于BH系列原子吸收光谱仪测定人体全血中铜、锌、钙、镁、铁、钾、钠元素含量时对仪器进行校准的专用溶液。
1.1规格:
50 mL×4(液体)
1.2 主要组成成分:铜、锌、钙、镁、铁、钾、钠溶液,具体浓度见表1。
表1全血七元素(铜、锌、钙、镁、铁、钾、钠)校准溶液浓度的标准值单位:mg/L
编号铜(Cu)锌(Zn)钙(Ca)镁(Mg)铁(Fe)钾(K)钠(Na)0号0.00 0.00 0.0 0.0 0.0 0.0 0.0
1号0.10 0.10 1.0 0.5 5.0 20.0 20.0
2号0.20 0.25 2.0 1.0 10.0 40.0 40.0
3号0.30 0.40 3.0 2.0 20.0 60.0 60.0
2.1 外观
2.1.1 装入校准溶液的塑料瓶或离心管应光滑,无毛刺;标签清晰完整不能有破损等缺陷。
2.1.2 校准溶液为均匀无色液体。
2.2 装量:≥50mL。
2.3测量准确性:±10%。
2.4批内变异系数(CV):铜≤5%。
2.5稳定性:
0℃~30℃的贮存环境下有效期为一年;在有效期后一个月内测量其性能应符合2.1、2.2、2.3、2.4的要求。
全血七元素(铜、锌、钙、镁、铁、钾、钠)质控品产品技术要求bohui

全血七元素(铜、锌、钙、镁、铁、钾、钠)质控品
适用范围:用于BH系列原子吸收光谱仪测定人体全血中铜、锌、钙、镁、铁、钾、钠元素含量时对分析方法进行质量控制的专用溶液。
1.1规格:
0.5g×2支(3号、5号);0.5g×2支(2号、4号);0.5g×1支(1号)。
1.2主要组成成分:牛血、铜、锌、钙、镁、铁、钾、钠溶液,具体浓度见表1。
表1 全血七元素质控品浓度的
标称值(mg/L)
编号
铜
(Cu)
锌
(Zn)
钙
(Ca)
镁
(Mg)
铁
(Fe)
钾
(K)
钠
(Na)
1 1.6 3.1 45 15 465 310 1700
2 3.2 3.1 45 15 250 310 1700
3 4.6 4.6 60 30 350 620 1700
4 6.2 6.2 7
5 45 465 930 1700
5 1.0 3.0 42 10 250 260 1700 2.1外观
离心管应光滑,无毛刺等缺陷。
标签清晰完整不能有破损等缺陷,有少量沉淀或絮状物。
2.2装量:≥1.0g。
2.3准确性:±15%。
2.4批内差异:≤10%
2.5稳定性
质控品在冷冻环境(-20℃)下有效期为一年,在有效期后一个月内测量其性能应符合2.2、2.3、2.4的要求。
血细胞分析仪用质控物产品技术要求mairui

2.性能指标
2.1外观
A)质控物应为一种均匀的物质,不得有凝块。
B)质控物的外包装应完整、标签标识清晰。
2.2装量
质控物的装量应不少于标示量。
2.3均匀性
2.3.1瓶内均匀性
质控物瓶内均匀性应满足表2要求。
不低于适用的血细胞分析仪检测脑脊液、浆液和滑液等体液样本声称的重复性要求。
表 2 质控物瓶内均匀性
2.3.2瓶间均匀性
质控物瓶间均匀性应符合表3要求。
表 3 BC-BF 质控物瓶间均匀性
2.4质控物的定值及范围
2.4.1参考值
每批质控物均应提供本批产品的参考值和参考范围表。
2.4.2赋值程序
提供赋值程序文件及至少一个批次的赋值记录。
2.4.3赋值准确性
应符合表4的要求。
表 4 测定允许变化范围
2.5生物安全性
质控物的乙型肝炎表面抗原(HBsAg)、艾滋病I型/II型(HIV-1/HIV-2)抗体、丙型肝炎(HCV)抗体、梅毒螺旋体(TP)抗体检测应为阴性。
多项免疫质控品产品技术要求huaketai

多项免疫质控品
适用范围:本产品与本公司生产的试剂盒配套使用,用于对25-羟基维生素D
(25-OH-D)、25-羟基维生素D
3(25-OH-D
3
)、铁蛋白(Fer)、甲状旁腺激
素(PTH)、人N端中段骨钙素(N-MID Osteocalcin)测定项目的室内质量控制。
1.1规格
0.5mL/瓶×2瓶(冻干,复溶后体积)
1.2主要组成成分:
以人血清为基质的多项免疫质控品,包含项目、靶值范围见表1。
表1 组成及范围
注:质控品具体值见靶值单。
2.1 外观
质控品包装标签应清晰;
质控品呈淡黄色或黄色疏松体,复溶后无沉淀或絮状物。
2.2 赋值有效性
各项目测定结果应在质控范围内。
2.3 均匀性
2.3.1 瓶内均匀性
取高、低值质控品,分别重复检测10次,变异系数(CV)应≤15%。
2.3.2 瓶间均匀性
取同一批次高、低值质控品各10瓶,分别进行重复测试,变异系数(CV)≤15%。
2.4 稳定性
2.4.1开瓶复溶稳定性
开瓶复溶后-20℃~-70℃避光储存,可稳定14天,检测2.2、2.3.1项,其结果应符合各项要求。
2.4.2 效期稳定性
质控品原包装2℃~8℃储存,有效期12个月,效期后两个月内检测2.2,2.3.1项,其结果应符合各项要求。
生化多项质控品产品技术要求zhongshengbeikong
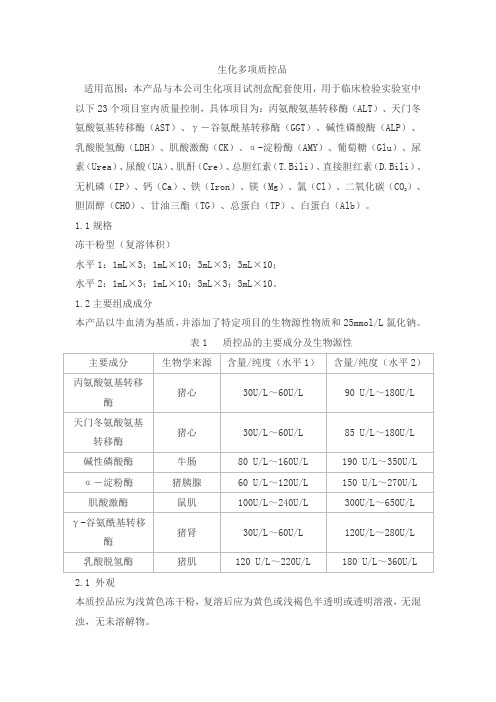
生化多项质控品适用范围:本产品与本公司生化项目试剂盒配套使用,用于临床检验实验室中以下23个项目室内质量控制,具体项目为:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰基转移酶(GGT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、α-淀粉酶(AMY)、葡萄糖(Glu)、尿素(Urea)、尿酸(UA)、肌酐(Cre)、总胆红素(T.Bili)、直接胆红素(D.Bili)、无机磷(IP)、钙(Ca)、铁(Iron)、镁(Mg)、氯(Cl)、二氧化碳(CO)、2胆固醇(CHO)、甘油三酯(TG)、总蛋白(TP)、白蛋白(Alb)。
1.1规格冻干粉型(复溶体积)水平1:1mL×3;1mL×10;3mL×3;3mL×10;水平2:1mL×3;1mL×10;3mL×3;3mL×10。
1.2主要组成成分本产品以牛血清为基质,并添加了特定项目的生物源性物质和25mmol/L氯化钠。
表1 质控品的主要成分及生物源性2.1 外观本质控品应为浅黄色冻干粉,复溶后应为黄色或浅褐色半透明或透明溶液,无混浊,无未溶解物。
2.2 赋值有效性测定本质控品,测定结果应在各项目质控范围内。
2.3瓶间差本质控品中铁项目瓶间差的变异系数(CV)应≤8%;本质控品中其余项目瓶间差的变异系数(CV)应≤5%。
2.4 含水量含水量应≤5%。
2.5稳定性2.5.1效期稳定性原包装质控品在2℃~8℃条件下避光贮存,有效期为18个月。
在有效期满后3个月内,质控品性能应符合2.1、2.2、2.3要求。
2.5.2复溶稳定性在15℃~25℃稳定期满后2小时内,质控品性能应符合2.1、2.2、2.3要求。
在2℃~8℃稳定期满后2小时内,质控品性能应符合2.1、2.2、2.3要求。
在-25℃~-15℃稳定期满后8小时内,质控品性能应符合2.1、2.2、2.3要求。
血细胞分析仪用质控物(阻抗法) 产品技术要求mairui

2.性能指标2.1外观a)质控物应为一种均匀的类血液物质,不得有凝块。
b)质控物的外包装应完整、标签标识清晰。
2.2装量质控物装量应不小于 3mL。
2.3均匀性2.3.1瓶内均匀性质控物瓶内均匀性应符合表 2 要求。
表 2 BC-3D 质控物瓶内均匀性(CV/%/SD)注:Lymph%,Mid%,Gran%的瓶内均匀性用SD 表示,其余参数的瓶内均匀性用CV 表示。
2.3.2瓶间均匀性质控物瓶间均匀性应符合表 3 要求。
表 3 BC-3D 质控物瓶间均匀性(CV)2.4质控物的定值及范围2.4.1参考值每批质控物均应提供本批产品的参考值和参考范围表。
2.4.2赋值程序制造商需要提供参考值的赋值方法;确定参考范围的文件;并提供赋值程序文件及至少一个批次的赋值记录。
赋值程序详见附录A。
2.4.3赋值准确性在用校准物校准后的血细胞分析仪检测系统上测试定值质控物,应符合表4的要求。
表 4 BC-3D 质控物赋值测定允许变化范围注:* P-LCC 仅适用于BC-30s、BC-31s、BC-30、BC-31、BC-3600、BC-3300、BC-3600CT、BC-3300CT;P-LCR 仅适用于BC-30s、BC-31s、BC-10、BC-11、BC-20、BC-21、BC-30、BC-31、BC-3600、BC-3300、BC- 3600CT、BC-3300CT。
2.5生物安全性质控物的乙型肝炎表面抗原(HBsAg)、艾滋病 I 型/II 型(HIV-1/HIV-2)抗体、丙型肝炎(HCV)抗体、梅毒螺旋体(TP)抗体检测应为阴性。
微量元素(铜、锌、铁、镁、钙)质控品(火焰原子吸收光谱法)产品技术要求东西

微量元素(铜、锌、铁、镁、钙)质控品(火焰原子吸收光谱法)
适用范围:与本公司生产的专用配套试剂联合使用,用于临床上采用原子吸收光谱法测定人体全血铜、锌、铁、镁、钙元素时的室内质量控制。
1.1 包装规格:
0.9 mL×2支 (1号、2
号)
1.2 主要组成组分
微量元素(铜、锌、铁、镁、钙)质控品主要组分为铜、锌、铁、镁、钙 (各元素浓度见表1 )、牛全血、纯化水。
表1:质控品浓度(mg/L)
2.1 外
观
2.1.1外包装盒应平整、无破损,文字和标识清晰。
2.1.2本质控品用具塞离心管包装,应密封,无泄漏。
2.2 装量误差
装样值不小于标示值。
2.3 瓶内均匀性
瓶内均匀性变异系数(CV)应≤15%。
2.4 瓶间差
瓶间变异系数(CV)应≤15%。
2.5 准确度
用国家标准物质GBW(E)080915-080917建立校准曲线, 测定本质控品1号和质控品2号, 测定值与目标浓度标示值的误差应满足以下偏差范围: 1号质控品应在±20%范围内; 2号质控品应在±15%范围内。
2.6 稳定性
本质控品于-15℃~-20℃冷冻储存,有效期6个月。
在质控品有效期末,检测结果应符合2.2、2.3和2.5项的要求。
全血及成分血质量控制

不同厂商的去白滤器的全血损耗量不同
国内一般去白滤器的红细胞回收率为90%
血液质量控制要求-3.浓缩红细胞
容量(mL) 200mL:120mL±12mL 300mL:180mL±18mL 400mL:240mL±24mL 200mL:≥20g 300mL:≥30g 400mL:≥40g
<红细胞总量的0.8%
• 定 义
1.保养液:以抗凝剂、葡萄糖等为主要成分的用于防止血液 凝固、维持血液内各种组分活性和生理功能的一类药剂。 2.血液制剂:将一定量符合要求的献血者的血液或血液成分 与一定量的保养液混合在一起形成的均一制品。 3.添加液:对某一种血液制剂进行再加工时,针对某一种血 液成分而加入的能保持和(或)营养该血液成分生物活性, 维持其生理功能的一类药剂。 4.成分血:在一定的条件下,采用特定的方法将全血中一种 或多种血液成分分离出而制成的血液制剂与单采成分血的统 称。 5. 标示量:在血液制剂的标签上表明该血液制剂容量的方 式,以毫升为单位,标示量根据当地实际情况自行制定。 6.速冻:血浆制品经过快速冷冻在1小时内使血浆核心温度 降低到-30℃以下。
血红蛋白含量(g)
白细胞残留量(个)
储存期末溶血率%
血液质量控制要求-5.悬浮红细胞
容量(mL) 血红蛋白含量(g) 标示量(mL)±10% 200mL:≥20g 300mL:≥30g 400mL:≥40g 白细胞悬浮红细胞
容量(mL) 血红蛋白含量(g) 标示量(mL)±10% 200mL:≥18g 300mL:≥27g 400mL:≥36g 200mL:≤2.5×106个 300mL:≤3.8×106个 400mL:≤5.0×106个 <红细胞总量的0.8%
血液安全性检测要求
ALT 1种试剂(速率法)进行1次检测合格(《血站技术规程》 规定献血前进行一次干化学法或速率法检测)
全血多元素校准溶液产品技术要求bohui
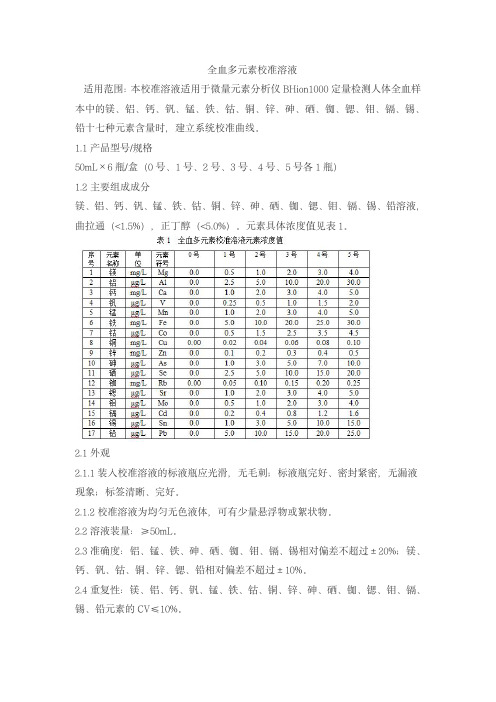
全血多元素校准溶液适用范围:本校准溶液适用于微量元素分析仪BHion1000定量检测人体全血样本中的镁、铝、钙、钒、锰、铁、钴、铜、锌、砷、硒、铷、锶、钼、镉、锡、铅十七种元素含量时,建立系统校准曲线。
1.1产品型号/规格50mL×6瓶/盒(0号、1号、2号、3号、4号、5号各1瓶)1.2主要组成成分镁、铝、钙、钒、锰、铁、钴、铜、锌、砷、硒、铷、锶、钼、镉、锡、铅溶液,曲拉通(<1.5%),正丁醇(<5.0%)。
元素具体浓度值见表1。
2.1外观2.1.1装入校准溶液的标液瓶应光滑,无毛刺;标液瓶完好、密封紧密,无漏液现象;标签清晰、完好。
2.1.2校准溶液为均匀无色液体,可有少量悬浮物或絮状物。
2.2溶液装量:≥50mL。
2.3准确度:铝、锰、铁、砷、硒、铷、钼、镉、锡相对偏差不超过±20%;镁、钙、钒、钴、铜、锌、锶、铅相对偏差不超过±10%。
2.4重复性:镁、铝、钙、钒、锰、铁、钴、铜、锌、砷、硒、铷、锶、钼、镉、锡、铅元素的CV≤10%。
2.5稳定性:校准溶液在0℃~30℃保存,有效期12个月,有效期后一个月内应符合2.1、2.2、2.3、2.4的要求。
2.6溯源性:根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质的计量学溯源性》的要求校准品溯源至钙GBW(E)080118、镁GBW(E)080126、铝GBW(E)080219、钒GBW(E)080216、锰GBW(E)080157、铁GBW08616、钴GBW08613、铜GBW08615、锌GBW08620、砷GBW(E)080117、硒GBW(E)080215、铷GSB04-2836-2011、锶GBW(E)080242、钼GBW(E)080218、镉GBW08612、锡GBW(E)080546、铅GBW(E)080129。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全血多元素质控品
适用范围:本质控品适用于微量元素分析仪BHion1000定量检测人体全血样本中的镁、铝、钙、钒、锰、铁、钴、铜、锌、砷、硒、铷、锶、钼、镉、锡、铅十七种元素含量时,对分析方法进行室内质量控制的专用溶液。
1.1产品型号/规格
1.0mL×2支/盒(1号、2号各1支)
1.2主要组成成分
牛血、镁、铝、钙、钒、锰、铁、钴、铜、锌、砷、硒、铷、锶、钼、镉、锡、铅溶液。
元素具体浓度值见表1。
2.1外观
2.1.1装入质控品的冻存管应光滑,无毛刺;无漏液现象;标签清晰、完好。
2.1.2质控品为血红色液体,可有少量悬浮物或絮状物。
2.2溶液装量:≥1.0mL。
2.3准确度:铝、锰、钴、铜、锌、硒、锶、钼、锡、铅相对偏差不超过±25%;铁、砷、铷、镉相对偏差不超过±20%;镁、钙、钒相对偏差不超过±15%。
2.4重复性:镁、铝、钙、钒、锰、铁、钴、铜、锌、砷、硒、铷、锶、钼、镉、锡、铅元素的CV≤15%。
2.5稳定性:质控品0℃~30℃保存,有效期6个月,有效期后一个月内应满足2.1、2.2、2.3、2.4的要求。
