理想气体的内能
物理学24-理想气体的内能

张宏浩
1
பைடு நூலகம்
三、理想气体的内能
分子间相互作用 可以忽略不计 分子间相互作用的势能=0
理想气体的内能=所有分子的热运动动能之总和
i i 1mol理想气体的内能为 E 0 N A ( kT ) RT 2 2
M i 一定质量理想气体的内能为 E RT M mol 2
温度改变,内能改变量为 E M
当温度极低时,转动自由度 r 也被“冻结”, 任何分子都可视为只有平动自由度。
4
刚性分子理想气体内能:
f E kT N 2 f R T N A 2 NA f RT 2
:气体系统的摩尔(mol)数
5
根据
求等体热容
小结:
练习 就质量而言,空气是由76%的N2,23%的O2 和1%的Ar三种气体组成,它们的分子量分别为28、 32、40。空气的摩尔质量为28.910-3kg,试计算1mol 空气在标准状态下的内能。
3
3
3 3 M 28 . 9 10 1 % 0 . 289 10 kg Ar质量 3
M3 0.289 摩尔数 n3 0.007 M mol 3 40 1mol空气在标准状态下的内能
i3 i1 i2 E n1 RT n2 RT n3 RT 2 2 2 1 ( i1 n1 i2 n2 i3 n3 )RT 2
内能: E N( k p) p ij
i j
E (T ,V )
(i>j)
由 T 决定
由 V 决定
3
对理想气体: p ij 0 , E E (T ) ;
对刚性分子(rigid molecule):v 0 ,i t r
理想气体的内能、热容和焓

4
(2)由图可以看出:
PaVa = PcVc ∴Ta = Tc ⇒ ΔU = 0
P (atm )
a 3
2
b
1
c
o 1 2 3 V(10−3m3)
(3)由热力学第一定律得:
Q = ΔU + A = 405.2J
5
二、理想气体的热容
1. 热容、比热容、摩尔热容
设系统温度升高 dT ,所吸收的热量为dQ
在等压过程中,dp=0,故 pdVm = RdT 将其代入 Cp,mdT = CV ,mdT + pdVm 得:
Cp,mdT = CV ,mdT + RdT 等式两边约去dT得:
迈耶公式 C p,m = Cv,m + R
表明:理想气体定压摩尔热容等于定体摩尔热容与普适
气体常量R之和。
C p,m > CV ,m
质量之比。
c
=
C m
=
1 m
⎛ ⎜⎝
dQ dT
⎞ ⎟⎠
M:摩尔质量
摩尔热容Cm:物质的量为v的该物质的热容C与v之比。
Cm
=
C
ν
=1
ν
⎛ ⎜⎝
dQ dT
⎞ ⎟⎠
=
cm
ν
=
Mc
或: c = Cm
M
单位: J·mol-1·K-1
(1)定体摩尔热容CV, m:
CV ,m
=1
ν
⎛ ⎜⎝
dQ dT
⎞ ⎟⎠V
(2)定压摩尔热容Cp, m:
热容:
C = lim ΔQ = dQ ΔT →0 ΔT dT
单位:J/K
(1)定体热容:
CV
ch.1-7 理想气体的内能
dH Cp dT
(1.7.6)
H
C dT H p 0
此即理想气体焓的积分表达式。
3.理想气体的迈尔公式
由式(1.7.4)、(1.7.2)和(1.7.7)可得
C p C V nR
(1.7.7)
上式称为迈尔公式,它给出了理想气体的定压热容 量与定容热容量之差。当年迈尔正是由这个关系最先得 到了热功当量。引入γ表示定压热容量与定容热容量的 比值:
§1.7
理想气体的内能
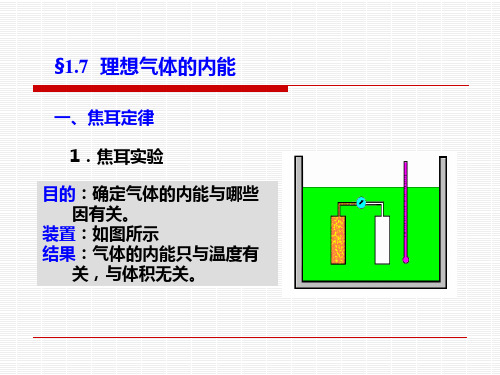
一、焦耳定律 1.焦耳实验 目的:确定气体的内能与哪些 因有关。 装置:如图所示 结果:气体的内能只与温度有 关,与体积无关。
2.焦耳定律
1845年,焦耳用自由膨胀实验研究了气体的内能,得 出气体内能仅仅是温度的函数而与体积无关这一重要结论。 这条结论称为焦耳定律,可表示为
U U U (T )或 0 V T
(1.7.3)
2.理想气体的焓 根据焓的定义(1.6.6)式和理想气体物态方程,可得理 想气体的焓为 H= U + pV = U + nRT (1.7.4)
可以看出, H也仅是T的函数,因此,对于理想气体, 式(1.6.7)的偏导数也可写成
dH Cp dT
(1.7.5)
(1.6.7)的偏导数也可写成 将上式积分,得
后来,人们发现焦耳实验的结果不够可靠。
(1.7.1)
于是,焦耳和汤姆逊在1852年用节流方法重新做了实 验,并发现实际气体的内能不仅是温度的函数而且还是体 积的函数。不过,焦耳定律在实际气体压强趋于零的极限 情形下是正确的,所以可认为它是理想气体所遵守的定律。 即,理想气体的内能只是温度的函数而与体积无关。 可表达为 U=U(T)
6.4X 能量均分定理 理想气体的内能

刚性近似下, s = 0, i = t + r, 分子的平均总能量:
3 2 kT(单原子分子) i tr 5 E Ek kT kT kT(双原子分子) 2 2 2 6 2 kT 3kT(多原子分子)
当温度极低时,转动自由度 r 也被“冻结”, 任何气体分子都可视为只有平动自由度 , 就如 同单原子分子。这时, r = 0, s = 0, i = t, i t 分子的平均总能量 E Ek kT kT 2 2
1.52102 ( J / m3 )
(4) 0.3 mol气体的内能
i 5 E RT 0.3 8.31 273 1.7 10 3 J 2 2
例2:贮存有氮气的容器以速度100米/秒运动。若该容 器突然停止,问容器中温度将升多少?
已知:u
100m / s, i 5, 28 10 kg / mol
常温下热运动能kt为0026ev故转动状态很容易被激发而振动状态很少被激发因此故转动状态很容易被激发而振动状态很少被激发因此在常温下理想气体分子可近似看成是刚性的在常温下理想气体分子可近似看成是刚性的只需考虑其平动和转动自由度而不必考虑其振动自由度
6.4 能量均分定理 理想气体的内能
引言:前面我们研究气体动能时,把分子看作弹性 小球的集合,人们发现用这一模型去研究单原子气体问 题时,理论与实际符合得很好,但是用这一模型去研究 多原子分子时,理论值与实验值相差甚远。 1857年克劳修斯提出:将理想气体模型稍作修改。 即不能将所有分子都看成质点,对结构复杂的多原子 分子,考虑分子的能量时,要考虑分子各种运动的能 量。即不但要考虑分子的平动,还要考虑其转动和分 子内原子之间的振动。 下面我们来考察包括平动、转动、及振动在内的理 想气体能量。
理想气体内能

解
kT 2π d2 p
1 2 π ( 3 1 .1 .3 1 1 0 8 1 2 0 ) 0 2 0 3 2 1 .0 7 1 1 3 5 m 3 0 8 .7 1 1 8 m 0
22 π (3 1 .1 .3 1 0 1 8 1 0 2 ) 0 0 2 3 2 1 .3 7 3 1 3 3 3 0 m 6 .6m 2
CV,m
CP,m
γ
He
12.61 20.953 20.90 1.67
H2
20.47 28.83 1.41
N2
20.78 20.09 1.40 20.56 28.88 1.40
O2
21.16 29.61 1.40
H2O
27.8 36.2 1.31
CH4 24.93 33.24 1.33 27.2 35.2 1.30
3R
25.1Jmol1 K1
§7-7 分子的平均碰撞次数和平均自由程
气体分子 平均速率
v 1.60 RT M mol
氮气分子在27°C时的平均速率为476m/s.
气体分子热运动平均速率高, 矛盾 但气体扩散过程进行得相当慢。
克劳修斯指出:气体分子的速度虽然很大,但前 进中要与其他分子作频繁的碰撞,每碰一次,分 子运动方向就发生改变,所走的路程非常曲折。
一、平均碰撞次数
假 每个分子都是有效直径为d 的弹性小球。
定 只有某一个分子A以平均速率 v运动,
其余分子都静止。
d
v
d
v
A
d
d
v
d
v
A
d
球心在圆柱 体内的分子
运动方向上,以 d 为半径的圆柱体内的分子都将
与分子A 碰撞
理想气体等温可逆内能公式

理想气体等温可逆内能公式
理想气体等温可逆内能公式是指在等温可逆过程中,理想气体内能的计算公式。
根据热力学第一定律,气体的内能变化等于对气体做功和气体所吸收的热量之和,即ΔU=W+Q。
在等温可逆过程中,气体所吸收的热量Q等于热力学温度T与气体所吸收的热量dQ 之积,即Q=TdS。
根据熵的定义S=nClnT+nRlnV+常数,可知等温可逆过程中熵的变化ΔS=nRln(Vf/Vi)。
在等温可逆过程中,气体所做的功W等于PdV,因为过程是可逆的,所以气体的压强始终等于外界压强P0。
根据理想气体状态方程PV=nRT,可得P=nRT/V。
将上式代入W=PdV中,可得W=nRTln(Vf/Vi)。
因此,在等温可逆过程中,理想气体内能变化ΔU=W+Q=nRTln(Vf/Vi)+nRTln(Vf/Vi)=nRTln(Vf/Vi)×2。
根据热力学第二定律,等温可逆过程中ΔS=Q/T=nRln(Vf/Vi),以及ΔS=
ΔU/T,可得ΔU=nRTln(Vf/Vi)。
因此,理想气体等温可逆内能公式为ΔU=nRTln(Vf/Vi)。
- 1 -。
热力学第一定律对理想气体的应用

热力学第一定律对理想气体的应用
热力学第一定律(也称为能量守恒定律)对理想气体的应用提供了重要的物理洞察和计算方法。
以下是热力学第一定律在理想气体中的一些应用:
1.内能变化计算:热力学第一定律表明,理想气体的内能变化等于吸收的热量减去对外界做的功。
根据该定律,我们可以计算理想气体的内能变化,即ΔU = Q - W,其中ΔU 表示内能变化,Q 表示吸收的热量,W 表示对外界做的功。
2.等容过程计算:等容过程是指理想气体在体积不变的条件下发生的过程。
根据热力学第一定律,对于等容过程,ΔU = Q,即内能变化等于吸收的热量。
这使得我们可以根据所吸收的热量计算内能的变化。
3.等压过程计算:等压过程是指理想气体在恒定压力下发生的过程。
根据热力学第一定律,对于等压过程,Q = ΔU + W,即吸收的热量等于内能变化加上对外界所做的功。
这使得我们可以根据所做的功和内能变化计算吸收的热量。
4.等温过程计算:等温过程是指理想气体在恒定温度下发生的过程。
根据热力学第一定律,对于等温过程,Q = W,即吸收的热量等于对外界所做的功。
这意味着在等温过程中,吸收的热量和所做的功相等。
第19讲能量均分定理理想气体的内能

教学要求了解速率分布函数、分子速率的实验测定、麦克斯韦速率分布律。
理解气体分子的方均根速率、刚性分子的自由度。
掌握气体的能量均分定理,理想气体的内能。
7.4 能量均分定理 理想气体的内能前面讨论分子热运动时,把分子视为质点,只考虑分子的平动。
气体的能量是与分子结构有关的,除了单原子分子可看作质点外,一般由两个以上原子组成的分子,不仅有平动,而且还有转动和分子内原子间的振动。
为了确定分子的各种运动形式的能量的统计规律,需要引用力学中有关自由度的概念。
7.4.1自由度完全描述系统在空间位置所需独立坐标的数目,称为系统的自由度。
考察分子运动的能量时,不能再把各种分子都当作质点处理,从而还要考虑其它运动形式(如转动和振动等)的自由度。
气体分子按其结构可分为单原子分子、双原子分子和三原子或多原子分子。
当分子内原子间距离保持不变(不振动)时,这种分子称为刚性分子,否则称为非刚性分子,对于非刚性双原子分子或多原子分子,由于在原子之间相互作用力的支配下,分子内部还有原子的振动,因此还应考虑振动自由度。
但是由于关于分子振动的能量,经典物理不能给出正确的说明,正确的说明需要量子力学;另外在常温下用经典方法认为分子是刚性的也能给出与实验大致相符的结果;所以作为统计概念的初步,下面只讨论刚性分子的自由度。
1 单原子分子如氦(He)、氖(Ne)、氩(Ar)等分子只有一个原子,可看成自由质点,所以有3个平动自图7-3 分子的自由度(a )单原子分子 (b )双原子分子(c )三原子分子zzzααγββθ由度[如图7-3(a )]。
2 刚性双原子分子如氢 (H 2)、氧( O 2)、氮(N 2)、一氧化碳(CO)等分子,两个原子间联线距离保持不变。
就像两个质点之间由一根质量不计的刚性细杆相连着(如同哑铃),确定其质心C 的空间位置,需3个独立坐标(x ,y ,z );确定质点连线的空间方位,需两个独立坐标(如α,β), 而两质点绕连线的的转动没有意义(因为相对该连线的转动惯量J 是非常小的,从而与该连线相应的转动动能212J ω可以忽略不计)。
理想气体热力学能

理想气体热力学能热力学能是描述系统热力学状态的重要物理量之一,它与系统的温度、体积和压强等因素有关。
对于理想气体而言,其热力学能可以通过内能和Helmholtz自由能两个方面来描述。
我们来讨论理想气体的内能。
内能是指系统内分子运动所具有的能量,是系统热力学能的一部分。
对于理想气体而言,内能主要包括分子的平动能、转动能和振动能。
分子的平动能是指分子在空间中运动所具有的能量,与分子的质量和速度有关。
由于理想气体中分子之间的相互作用力可以忽略不计,因此分子的平动能是理想气体内能的主要贡献。
分子的转动能是指分子绕其自身轴线旋转所具有的能量,与分子的转动惯量和角速度有关。
在高温下,分子的转动能可以与平动能相比拟,但在常温下,转动能相对较小。
分子的振动能是指分子内部原子之间相对运动所具有的能量,与分子的势能和振动频率有关。
在常温下,分子的振动能也相对较小。
我们来讨论理想气体的Helmholtz自由能。
Helmholtz自由能是指在恒温恒容条件下,系统可以做的最大非体积功。
对于理想气体而言,其Helmholtz自由能可以通过内能和熵两个方面来描述。
熵是系统的无序程度的度量,也是系统热力学能的一部分。
对于理想气体而言,熵与分子的排列方式有关。
在理想气体的熵计算中,可以使用统计力学的方法,通过计算气体分子的微观状态数来求解。
通过内能和熵的描述,我们可以得到理想气体的Helmholtz自由能表达式。
根据热力学基本关系式,我们知道Helmholtz自由能F与内能U和熵S之间的关系为F=U-TS,其中T为系统的温度。
理想气体的热力学能还可以通过其他物理量来描述。
例如,理想气体的焓是指在恒压条件下,系统可以做的最大非体积功。
对于理想气体而言,焓可以通过内能和压强来表示,即H=U+PV,其中P为系统的压强,V为系统的体积。
除了热力学能的描述,理想气体还有一些特征性质。
例如,理想气体的压强与体积成反比,即Boyle定律。
理想气体的温度与体积成正比,即Gay-Lussac定律。
理想气体的内能

理想气体的内能理想气体是在热力学中常见的模型之一,我们将通过本文探讨理想气体的内能及其基本特点。
一、内能的定义内能是指理想气体分子所具有的能量,其中包含了分子的动能和势能。
根据理想气体的模型,分子之间相互作用力非常小,因此认为分子间的相互作用可以忽略不计,只考虑分子自身的运动即可。
二、内能的计算方法理想气体的内能主要由分子的平动动能和转动动能组成。
下面我们将分别介绍这两种动能的计算方法。
1. 平动动能平动动能是指分子由于直线运动而具有的能量。
根据经典力学的定理,平动动能可以通过下式计算:平动动能 = 1/2 * m * v^2其中,m为分子的质量,v为分子的速度。
由于理想气体的分子非常微小,因此其质量可以取为一个标准值,例如1个摩尔的分子质量。
而速度则与温度相关,根据理想气体状态方程,我们可以得到分子速度与温度之间的关系。
2. 转动动能转动动能是指分子围绕其自身轴心旋转而具有的能量。
与平动动能类似,转动动能可以通过下式计算:转动动能= 1/2 * I * ω^2其中,I为分子的转动惯量,ω为分子的角速度。
对于理想气体分子而言,其转动惯量与分子的结构和质量密切相关。
根据分子的形状和对称性,我们可以计算出适用于不同分子的转动惯量的表达式。
三、理想气体的内能与温度的关系根据热力学理论,理想气体的内能与温度成正比。
内能可以通过温度的变化来计算,即:内能 = 3/2 * R * T其中,R为气体常数,T为温度。
从上式可以看出,理想气体的内能与温度成正比,并且与分子数目无关。
四、内能的变化理想气体的内能在物理过程中可能发生变化,下面我们来讨论一些主要的内能变化情况。
1. 内能的增加当理想气体吸收热量时,其内能会增加。
这是因为外界对气体分子做功,将能量转化为内能,使得分子的动能和势能增加。
2. 内能的减少当理想气体释放热量时,其内能会减少。
这是因为气体分子向外界做功,将内能转化为其他形式的能量,使得分子的动能和势能减少。
理想气体的内能、焓、比热容、熵介绍

3
对于实际气体可逆过程(reversible process )
q du pdv
u f (T ,v)
u T
dT v
u v T
dv
pdv
u T
dT v
u T
T
pdv
对定容过程dv=0
qv
u T
dT v
cv
qv
dT
u T v
同样用 q dh vd可p 得定压过程dp=0:
q p
h T
dT p
cp
q p
dT
h T p
因此有:ds du pdv du p dv
Rg p dh v dp
Rg
T
TT
p
由: du cV0dT
dh c p0dT
以及: pv RgT
dp dv dT pv T
取对数后 再微分
对微元过程(insensible process ):
352页附表2 求真实比热容(true specific heat) cv0 a0' a1T a2T 2 a3T 3
a0 a0' Rg
u1,2 u2 u1 12 du 12 cv0dT
h1,2 h2 h1 12 dh 12 c p0dT
适用范围:理想气体定比热工质的任意过程,1、2状 态为平衡状态。
标准状态熵:
当温度变化较大以及计算精度要求较高时, 可用标准状态熵来计算过程的熵变。
理想气体的内能和CV

将数据点绘制成图表,如温度-压力图、温度-加 热量图等。
3
结果分析
根据图表分析气体状态的变化趋势,验证理想气 体状态方程和内能、cv值的理论值是否一致。
05
理想气体内能与cv值的 应用
在热力学中的应用
热力学第一定律
理想气体的内能是气体系统最重要的热力学 参量之一,通过理想气体的内能可以推导出 热力学第一定律的表达式。
详细描述
内能是物体内部所有微观粒子(如分子、原子等)动能和势能的总和。这些微观粒子在不停地做无规则热运动, 具有动能;同时,它们之间也存在相互作用力,具有势能。内能是系统内部的一种状态函数,与系统的状态有关, 与系统所处的宏观条件无关。
理想气体内能的计算公式
要点一
总结词
理想气体的内能计算公式为E=n*i/2*kT^2。
cv值随温度升高而增大,因为高温下 分子运动更加剧烈,内能增加,等容 过程中所需的热量也相应增加。
在高温下,cv值趋近于cp值,因为等 压过程中的热量主要用来做功,而不 是增加内能。
cv值与热容量的关系
cv值越大,表示等容过程中的热容量 越大,即单位质量的理想气体在温度 升高时所需的热量越多。
cv值反映了理想气体在等容过程中对 温度变化的敏感程度,cv值越大,温 度变化对内能的影响越显著。
热力学第二定律
理想气体的cv值与熵的关系是热力学第二定 律的重要应用,cv值越大,熵越大,反应自 发进行的趋势越大。
在化学反应中的应用
反应热
理想气体的内能和cv值可以用来计算化学反 应的反应热,从而判断反应是否自发进行。
反应速率
理想气体的cv值可以用来计算化学反应的速 率常数,从而预测反应的速率。
理想气体假设
第三章 理想气体的内能、焓、比热容、熵

pV nRT
pV mRgT
m mi
i 1
混合物的质量等于各组成气体质量之和: n
m m1 m2 mi mn
混合物物质的量等于各组成气体物质的量之和:
n ni
i 1 n
n n1 n2 ni nn
3.4.1 分压力和分容积(partial pressure and partial volume)
显然
w1 w2 wn 1
V
w
i 1 n
n
i
1
y1 y2 yn 1 1 2 n 1
y
i 1
n i 1
i
1
1
i
混合物组成气体分数各种表示法之间的关系:
Vi ni RT p ni 由 i V nRT p n
T
)rev
对可逆过程(reversible
process)
q du pdv
q dh vdp
du pdv du p dv 因此有:ds T T T
Rg v
Rg p
dh vdp dh v ds dp T T T
由:
以及:
du cV 0dT
dh c p 0 d T
(dh) p (q ) p c pdT
dh c p 0 d T
h2 h1
2 c dT 1 p0
u cv dT T v q p h
cp
q v
dT T p
注意:以上结论对理想气体可用于任意过程
4
3.1.2
u q v dT T v u cv dT T v
理想气体的内能和热容关系

理想气体的内能和热容关系理想气体是研究热力学的基本模型,它在理论和实际领域中被广泛应用。
在探讨理想气体的内能和热容关系时,我们首先需要了解内能和热容的概念。
内能是指系统所拥有的热能和势能的总和。
对于理想气体而言,内能只与温度有关。
这是因为理想气体的分子之间没有相互作用,它们仅仅是在宏观尺度下表现出压力、体积和温度等性质,因此理想气体的内能仅仅与其温度有关。
理想气体的内能可以通过热容来描述。
热容是指单位质量或单位摩尔物质在吸收或放出热量时温度变化的程度。
理想气体的热容可以分为两种,即定容热容和定压热容。
定容热容是指在恒定体积下吸收或释放热量时单位质量或单位摩尔物质的温度变化。
对于理想气体而言,它的定容热容可以通过物态方程来推导得到。
根据物态方程的表达式pV=nRT,我们可以推导出对于理想气体,定容热容的表达式为:Cv=(∂U/∂T)v其中,Cv表示定容热容,U表示内能,T表示温度,v表示体积。
定压热容是指在恒定压力下吸收或释放热量时单位质量或单位摩尔物质的温度变化。
对于理想气体而言,它的定压热容也可以通过物态方程来推导得到。
根据物态方程的表达式pV=nRT,我们可以推导出对于理想气体,定压热容的表达式为:Cp=(∂H/∂T)p其中,Cp表示定压热容,H表示焓,T表示温度,p表示压力。
在理想气体中,焓的定义可表达为:H=U+pV通过对理想气体的内能和焓进行数学推导,我们可以得到Cv和Cp之间的关系式:Cp-Cv=R其中,R表示理想气体的气体常数,对于单原子分子而言,它的值约等于8.31J/(mol·K)。
这个关系被称为迈耳尔关系,它是热力学基本方程之一,表明了理想气体的定容热容和定压热容之间的关系。
迈耳尔关系告诉我们,对于理想气体而言,定容热容要小于定压热容,且它们之间的差值恰好等于气体常数R。
这是因为在定压条件下,气体除了吸收或释放热量之外,还需要对外界做功,因此定压热容要大于定容热容。
理想气体的内能、焓、比热容、熵

pV=nRT
n
V Vi i1
亚美格定律—理想气体混合物的容积等于各组成气体分容积之和
(amagat 's law)
对某一组成气体i,按分压力及分容积分别列出 其状态方程式,则有:
piVniRT pVi niRT
对比二式,有: p i V i pV
即组成气体的分压力与混合物压力之比,等于组 成气体的分容积与混合物容积之比。
dv v
dsdhTvdpcp0dTTvdpcp0dTTRg
dp p
dscv0dTTRg
dvvcv0dppdvvRg
dvvcv0dppcp0
dv
v
s
cv0
ln
T2 T1
Rg
ln
v2 v1
s
c
p0
ln
T2 T1
R g ln
p2 p1
s
c v 0 ln
p2 p1
c p 0 ln
v2 v1
T
M m m 1 m 2 m n n 1 M 1 n 2 M 2 n iM n
nn
n
又得: M y 1 M 1 y 2 M 2 y n M n
n
M yi Mi
i1
混合物的折合气体常数为:
R Rg M
R R gi M i
即得:R g R ( y 1 M 1 y 2 M 2 y n M n )
对定容过程dv=0
q v T u v dT
c v d q v T T u v
同样用 qdhvdp可得定压过程dp=0:
qp
h T
dT p
cp
qp
dT
h Tp
3
理想气体内能变化(Δu)的计算: 按定容过程(constant volume process):
8.5 理想气体的内能和CV ,Cp

1mol 理想气体的状态方程为 pV RT
两边对 T 求导,因 p = 常量,有
dV p( ) R dT
迈耶公式 比热容比
Cp CV R
C p / CV
大学物理 第三次修订本
5
第8章 热力学
几种分子的CV、Cp和γ
物理量
分子 单原子分子 刚性双原. 定体摩尔热容CV 在定体过程中,1mol 理想气体经吸热 Q, 温度变化 T Q CV lim ( ) T 0 T E dE CV lim ( ) Q E A T 0 T dT A0
大学物理 第三次修订本
3
第8章 热力学
2. 定压摩尔热容Cp 在等压过程中, 1mol 理想气体经吸热 Q, 温度变化 T
Q E A E pV
Q E pV Cp lim ( ) lim ( ) lim ( ) T 0 T T 0 T T 0 T dE dV dV ( ) p ( ) CV p ( ) dT dT dT
大学物理 第三次修订本
4
第8章 热力学
比热 容比
3R / 2
5R / 2
5R / 2
7R / 2
5/3 7/5 4/3
6
刚性多原子分子
3R
4R
大学物理 第三次修订本
1
第8章 热力学
E E (T )
气体的内能仅是其温度的单值函数。 说明
焦耳实验是在1845年完成的,当时温度计的 精度为 0.01 ℃,没有测出水温的微小变化。
通过改进实验或其它实验方法(焦耳 - 汤 姆孙实验),证实仅理想气体有上述结论。
大学物理 第三次修订本
2
第8章 热力学
1mol理想气体h2的内能

1mol理想气体h2的内能
理想气体H2的内能是指气体H2在一定温度和压力下的内能。
它是由气体H2的分子组
成的,由于H2分子的简单结构,它的内能可以用简单的方程式来表示。
理想气体H2的内能可以用下面的公式来表示:
U=3/2nRT
其中,U是H2的内能,n是H2的分子数,R是气体常数,T是温度。
由于H2是一种理想气体,它的分子间没有相互作用,因此它的内能只取决于温度和压力。
当温度和压力不变时,H2的内能也不变。
在常温常压下,H2的内能可以用下面的公式来计算:
U=3/2nRT
其中,R=8.314J/mol·K,T=298K,n=1mol。
因此,在常温常压下,1mol理想气体H2的内能为:
U=3/2×1mol×8.314J/mol·K×298K=1247.06J
从上面的计算结果可以看出,1mol理想气体H2的内能为1247.06J。
综上所述,理想气体H2的内能是指气体H2在一定温度和压力下的内能,它可以用简单
的方程式来表示,在常温常压下,1mol理想气体H2的内能为1247.06J。
计算内能的公式

计算内能的公式内能这个概念,在咱们物理学里可是个挺重要的家伙。
说到计算内能的公式,那咱可得好好唠唠。
先来说说啥是内能。
简单点说,内能就是构成物体的所有分子,它们热运动的动能和分子势能的总和。
这就好比一个班级里同学们的活力和他们之间的关系一样。
那计算内能的公式到底是啥呢?对于理想气体来说,内能只跟温度有关,其内能的计算公式就是 E 内 = n × (3/2) × k × T 。
这里的“n”是气体的物质的量,“k”是玻尔兹曼常数,“T”是热力学温度。
我给您举个例子啊。
比如说咱们有一罐氧气,咱知道了它的物质的量,还有当时的温度,那就能通过这个公式算出它的内能。
这就好像你知道了班级里同学的数量,还有大家的平均活跃程度,就能大概算出整个班级的活力值一样。
记得有一次,我在课堂上讲这个知识点的时候,有个小家伙一脸迷茫地看着我,问:“老师,这内能到底有啥用啊?”我笑着跟他说:“孩子,你想想,冬天的时候,为啥屋里比屋外暖和?这就是因为屋里空气的内能比屋外的大呀!”那孩子恍然大悟的表情,我到现在都还记得。
咱们再深入一点,对于固体和液体,内能的计算就稍微复杂一些了。
因为除了分子的动能和势能,还得考虑分子之间的相互作用。
但不管咋样,理解内能和它的计算公式,对于咱们理解很多物理现象都特别重要。
比如说,为啥加热能让物体膨胀?为啥有的物质容易吸热,有的就不容易?这里头都有内能在起作用。
而且啊,这内能的知识在实际生活中的应用可多了去了。
就像汽车发动机里燃料燃烧产生的能量,一部分就转化为了内能。
还有咱们家里的冰箱、空调,它们的工作原理也都和内能的变化有关。
总之,计算内能的公式虽然看起来有点复杂,但只要咱们好好琢磨,多联系实际,就能把它拿下。
就像攻克一道难题,只要有耐心,有方法,总能找到答案!希望通过我的讲解,能让您对计算内能的公式有更清楚的认识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
14、一定质量的理想气体状态变化过程如图所示,第1种变化是从A 到B ,第2种变化是从A到C ,比较两种变化过程( ).(A)A 到C 过程气体吸收热量较多 (B)A 到B 过程气体吸收热量较多 (C)两个过程气体吸收热量一样 (D)两个过程气体内能增加相同15、一定质量的理想气体,当它发生如图所示的状态变化时,哪一个状态变化过程中,气体吸收热量全部用来对外界做功( ).(A)由A 至B 状态变化过程 (B) 由B 至C 状态变化过程 (C) 由C 至D 状态变化过程 (D) 由D 至A 状态变化过程16、一定质量的理想气体可经不同的过程从状态Ⅰ(p 、V 1、T 1)变到状态Ⅱ(p 2、V 2、T 2),已知T 2>T 1,在这些过程中( ). (A)气体一定都从外界吸收热量(B)气体和外界交换的热量都是相等的 (C)外界对气体做的功都是相等的 (D)气体内能的变化量都是相等的 28、如图所示,是一定质量理想气体的p -V1关系图像(p 为气体压强,V 为气体体积),图中A 、B 、C 三点代表该气体的3个不同的状态,若气体先后沿两段直线AC 、BC 发生由A 经C 至B 的状态变化过程,那么在这整个过程中( ).(A)外界对气体做正功,气体内能增加 (B) 外界对气体做正功,气体内能减少 (C) 外界对气体做负功,气体内能增加 (D) 外界对气体做负功,气体内能减少31、如图所示为一定质量的理想气体的状态变化图像.A 、B 、C 三个状态的热力学温度分别为T A 、T B 和T C ,状态变化沿箭头所指的方向进行.那么,( ).(A) T B -T C =T B -T A ,且B →C 过程放出的热量等于A →B 过程吸收的热量. (B) T C -T B =T A -T B ,且B →C 过程吸收的热量等于A →B 过程放出的热量. (C) T C -T B =T A -T B ,且B →C 过程吸收的热量大于A →B 过程放出的热量. (D) T C -T B >T A -T B ,且B →C 过程吸收的热量等于A →B 过程放出的热量.33、一定质量的理想气体,从状态A 变化到状态B ,如图所示,AB 平行于Op 轴,由此可以断定,气体在状态变化过程中( ) (A )气体分子无规则热运动减缓 (B )气体内能增加 (C )气体分子热运动的平均动能不变 (D )气体体积增大36、一定质量的理想气体,在下列变化过程中,其分子无规则运动肯定加剧的是( ).(A)等温压缩(B)等压压缩(C)等温膨胀(D)等压膨胀37、一定质量的理想气体,经过如下状态变化后,其中气体内能可能增加的是()(A)先等温压缩,再等压压缩(B)先等压压缩,再等容升压(C)先等容压缩,再等温压缩(D)先等容降压,再等压膨胀39、一定质量的气体可经过不同的过程从状态(p1、V1、T1)变到状态(p2、V2、T2),已知T2>T1,则在这不同过程中()(A)气体一定都从外界吸收热量(B)气体和外界交换的热量都是相等的(C)外界对气体所做的功都是相等的(D)气体内能的变化量都是相等的40、一定质量的理想气体由状态a 变化到状态b ,经历不同的变化过程的图像如图所示,由图线可知()(A)图线(1)所示的过程中气体的内能不变(B)图线(4)所示的过程中气体不做功(C)图线(2)、(3)所示的过程中外界压缩气体做功(D)图线(2)、(3)、(4)所示的过程中气体向外界放热49、要使一定质量的理想气体由某一状态经过一系列变化,又回到初始状态,下列可能实现这一要求的过程是( ).(A)先等容吸热,再等温吸热,最后等压压缩(B)先等压升温,再等容吸热,最后等温放热(C)先等温膨胀,再等压升温,最后等容吸热(D)先等容放热,再等压降温,最后等温吸热58、一定质量的理想气体,封闭在带活塞的汽缸中,气体从状态a开始,经历ab、bc、cd、da四个状态回到a状态,如图所示,其中气体对外界做功的过程是________过程,从外界吸热的过程是________过程。
61、一定质量的理想气体从状态R出发,分别经历图所示的4种不同过程发生状态变化.其中气体从外界吸热并对外界做正功的过程是( ).(A)R→A(B)R→B(C)R→C(D)R→D63、如图所示,一定质量的理想气体从状态1到状态2,不论经历什么样的变化过程,这一定质量的气体必然(A)向外界放出热量;(B)从外界吸收热量;(C)对外界做功;(D)内能增加。
67、一定质量的理想气体经如图所示的一系列变化过程.过程AB、BC、CA的图像恰组成一个圆周.OA、OB为圆周的切线,C是圆周上离开原点O最远的点心.由图可以判定( )(A)在过程AB中气体体积不断增大(B)在过程BC中气体体积不断减小(C)在过程CA中气体对外做功(D)在过程BCA中气体吸热73、如图所示的绝热容器中间用隔板分成两部分.左侧存有理想气体,右侧是真空.把隔板抽掉,让左侧气体自由膨胀到右侧直至平衡.( ).(A)气体对外做功,内能减少,温度降低(B)气体对外做功,内能不变,温度不变(C)气体不做功,内能不变, 压强不变(D)气体不做功,内能不变,温度不变,但压强减小75、有一个氢气瓶,由于压强不大,可以把其中的氢气视作理想气体,瓶中氢气的p-T图线如图所示的1→2.则它( ).(A)正在灌气(B)正在用气(C)内能减少(D)内能增加76、一定质量的理想气体,其状态变化图线如图所示,1→2→3.那么这3个状态的温度T1、T2、T3以及吸、放热量的关系是( ).(A)T2-T1=T2-T3, 1→2吸收的热量等于2→3放出的热量(B)T2-T1=T2-T3, 1→2吸收的热量小于2→3放出的热量(C)T2-T1=T2-T3, 1→2吸收的热量大于2→3放出的热量(D)T2-T1>T2-T3, 1→2吸收的热量等于2→3放出的热量78、一定质量的理想气体,从某一状态开始经过若干个状态变化过程,最终又回到最初的状态。
则在这些状态变化的过程中()(A)在其中任一过程中,只要气体膨胀对外做功,就一定吸热(B)在其中任一过程中,只要气体吸热,它的温度就一定升高(C)无论变化到哪一个状态,它的状态参量总满足pV/T为一恒量(D)所变化到的状态pV乘积越大,气体在该状态的内能越大79、对于一定质量的理想气体,在下列各种过程中,可能发生的过程是( ) (A ) 气体膨胀对外做功,温度升高 (B ) 气体吸热,温度降低 (C ) 气体放热,压强增大 (D ) 气体放热,温度不变80、对于一定质量的理想气体,下述说法中正确的是(A)状态改变时,热力学能一定改变; (B)等温过程,气体不吸热也不放热; (C)气体放热时,温度不一定降低; (D)气体压缩时,热力学能一定增加.1 (2013徐州摸底)如图所示,一定质量的理想气体从状态A 变化到状态B ,已知在此过程中,气体内能增加100J ,则该过程中气体 (选填“吸收”或“放出”)热量 J .答案:吸收 300解析:一定质量的理想气体从状态A 变化到状态B ,体积增大,对外做功W=p △V=1.0×105×2.0×10-3J=2.0×102J..。
根据热力学第一定律,该过程中气体吸收热量300J 。
2(2013江苏常州模拟)一定质量的理想气体压强p 与热力学温度T 的关系图象如图所示,AB 、BC 分别与p 轴和T 轴平行,气体在状态A 时的压强为p 0、体积为V 0,在状态B 时的压强为2p 0,则气体在状态B 时的体积为 ;气体从状态A 经状态B 变化到状态C 的过程中,对外做的功为W ,内能增加了ΔU ,则此过程气体(选填“吸收”或“放出”)的热量为 .答案: V0/2 (1分) 吸收 (1分) △U+W (4分)(2)解析:对AB 过程,温度不变,由玻意耳定律可知,气体在状态B 时的体积为V= V 0/2;气体从状态A 经状态B 变化到状态C 的过程中,对外做的功为W ,内能增加了ΔU ,由热力学第一定律,此过程气体吸收的热量为△U+W .00p 2p6(9分)(2013长春市四模)一定质量的理想气体从状态A 变化到状态B 再变化到状态C ,其状态变化过程的p -V 图象如图所示。
已知该气体在状态A 时的温度为27℃。
求:①该气体在状态B 、C 时的温度分别为多少摄氏度?②该气体从状态A 到状态C 的过程中是吸热还是放热?传递的热量是多少?(9分)【参考答案】①-73℃;27℃ ②吸热;200J【命题立意】考查学生应用理想气体状态方程解决问题的能力。
【解 析】①气体从状态A 到状态B :得200B T =K 即73B t =-℃ (3分) 气体从状态B 到状态C :得300C T =K 即27C t =℃ (3分) ②气体从状态A 到状态C 过程中是吸热 (1分) 吸收的热量200Q P V =∆=J (2分)8(9分)(2013江西省金溪一中质检)一定质量的理想气体从状态A 变化到状态B ,再变化到状态C ,其状态变化过程的P-T 图象如图所示。
已知该气体在状态A 时的体积为1×10-3m 3。
求: ①该气体在状态C 时的体积;②该气体从状态A 到状态B 再到状态c 的过程中,气体与外界传递的热量解析:①A 、B 两状态体积相等,则有……①(2分)得:,从B 到C 压强相同,则:(2分);;又因:故:(2分)②由于A 到B 再到C 的过程中温度先向外散热,再温度升高从外界吸热,最后A 和C 的温度相同,因此气体内能相同,因为气体向外界传递的热量为零(3分) 10.(10分)(2013甘肃省兰州市模拟)如图所示,一定质量的理想气体,处在A 状态时,温度为t A =27︒C,气体从状态A 等容变化到状态M ,再等压变化到状态B ,A 、M 、B 的状态参量如图所示。
求:①状态B 的温度;②从A 到B 气体对外所做的功。
(取1atm =1.0⨯105P a )解析:①设A 状态和状态B 的温度、体积、压强分别为T 1、、V 1、P 1,T 2、、V 2、P 2,由已知可得T 1、=300K V 1=3m 3 P 1=2.5atm T 2=? V 2=6m 3 P 2=1atm ,从A 到B 由理想气体状态方程,222111T V P T V P =得 …………………① …………………② ②从A 到M 是等容变化,不做功;从M 到B 是等压变化,做的功为,J 100.3J 3100.1m 3atm 1553⨯=⨯⨯=⋅=∆=V P W ,…………………③所以从A 到B 气体对外做的功为J 100.3W 5AB ⨯=………………………………………………………④ ①②步每步3分,③④每步2分。
