理想气体内能 平均自由程
6.4X 能量均分定理 理想气体的内能

刚性近似下, s = 0, i = t + r, 分子的平均总能量:
3 2 kT(单原子分子) i tr 5 E Ek kT kT kT(双原子分子) 2 2 2 6 2 kT 3kT(多原子分子)
当温度极低时,转动自由度 r 也被“冻结”, 任何气体分子都可视为只有平动自由度 , 就如 同单原子分子。这时, r = 0, s = 0, i = t, i t 分子的平均总能量 E Ek kT kT 2 2
1.52102 ( J / m3 )
(4) 0.3 mol气体的内能
i 5 E RT 0.3 8.31 273 1.7 10 3 J 2 2
例2:贮存有氮气的容器以速度100米/秒运动。若该容 器突然停止,问容器中温度将升多少?
已知:u
100m / s, i 5, 28 10 kg / mol
常温下热运动能kt为0026ev故转动状态很容易被激发而振动状态很少被激发因此故转动状态很容易被激发而振动状态很少被激发因此在常温下理想气体分子可近似看成是刚性的在常温下理想气体分子可近似看成是刚性的只需考虑其平动和转动自由度而不必考虑其振动自由度
6.4 能量均分定理 理想气体的内能
引言:前面我们研究气体动能时,把分子看作弹性 小球的集合,人们发现用这一模型去研究单原子气体问 题时,理论与实际符合得很好,但是用这一模型去研究 多原子分子时,理论值与实验值相差甚远。 1857年克劳修斯提出:将理想气体模型稍作修改。 即不能将所有分子都看成质点,对结构复杂的多原子 分子,考虑分子的能量时,要考虑分子各种运动的能 量。即不但要考虑分子的平动,还要考虑其转动和分 子内原子之间的振动。 下面我们来考察包括平动、转动、及振动在内的理 想气体能量。
6.4 能量均分定理 理想气体的内能
3 首 页 上 页 下 页退 出
能量按自由度均分定理 上述结果可推广到转动和振动自由度( 上述结果可推广到转动和振动自由度(这是因为他们之 间都能通过碰撞而交换能量)。即得: )。即得 间都能通过碰撞而交换能量)。即得: 在平衡态下,分子无规则热运动碰撞的结果, 在平衡态下,分子无规则热运动碰撞的结果,使得没有那 一个自由度上的能量比其它自由度上的能量更占优势。 一个自由度上的能量比其它自由度上的能量更占优势。
6.4.3 理想气体的内能
1、什么是内能: 什么是内能: 内能是指系统内所有分子的热运动能和分子间相互作用势 内能是指系统内所有分子的热运动能和分子间相互作用势 之总和。 能之总和。 2、内能是态函数 的函数, E(P 内能是热力学状态参量P、V、T 的函数,即E=E(P、V、T), 是相对量。──因为状态参量是相对量 因为状态参量是相对量。 是相对量。──因为状态参量是相对量。 3、理想气体内能 由于理想气体模型不考虑分子间相互作用力,因此理想 (1) 由于理想气体模型不考虑分子间相互作用力,因此理想 气体的分子间不存在势能,其内能仅为热运动能之总和。 气体的分子间不存在势能,其内能仅为热运动能之总和。
M i i M ∆E = R∆T =ν R∆T (ν = ) Mmol 2 2 Mmol
单原子理想气体: 单原子理想气体:
3 E =ν ⋅ RT 2 5 双原子理想气体: 双原子理想气体: E = ν ⋅ RT 2 6 多原子理想气体: 多原子理想气体: E =ν ⋅ RT 2
8 首 页 上 页 下 页退 出
i εk = kT 2
4 首 页 上 页 下 页退 出
3 单原子分子( 单原子分子(i =3): εk = kT 为平均平动动能 2
双原子分子( 双原子分子(i=5)
14-4能量均分定理理想气体内能

14 – 4
内能:系统内部各种形式能量的总和。 内能:系统内部各种形式能量的总和。
{
动能:平动、转动和振动动能; 动能:平动、转动和振动动能; 势能:分子与分子之间, 势能:分子与分子之间,分子内各原子之间相互作 用的势能。 用的势能。
理想气体不计分子间的作用力, 理想气体不计分子间的作用力,所以分子间的势 能为零。 能为零。 刚性气体分子,分子内的振动能量不计。 刚性气体分子,分子内的振动能量不计。
能量均分定理(玻尔兹曼假设) 二 能量均分定理(玻尔兹曼假设) 气体处于平衡态时, 气体处于平衡态时,分子任何一个自由度的平
1 kT ,这就是能量按自由度 均能量都相等, 这就是能量按自由度 均能量都相等,均为 2
均分定理 . 分子的平均能量
i ε = kT 2
三 理想气体的内能和摩尔热容 理想气体的内能 :分子动能和分子内原子间的 势能之和 . 1 mol 理想气体的内能
ψ
θ
0
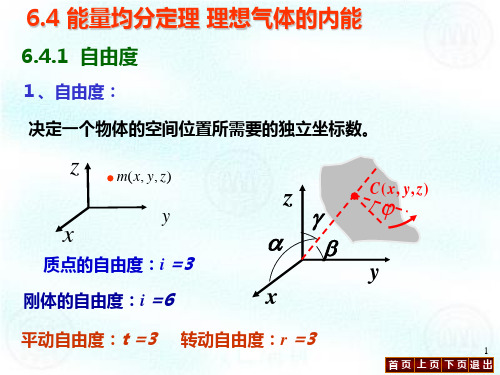
• C (x, y, z)
y
ϕ
x
14 – 4
能量均分定律 理想气体内能
自由度数目
i=t+r+v
平 动 转 动 振 动
自由度
自由度
t
3 3 3
r
0 2 3
i
3 5 6
14 – 4
能量均分定律 理想气体内能
二 . 能量按自由度均分原理( equipartition theorem) ) 1 2 3 由 w = mv = kT 及 t = 3 ,我们可以得知: 我们可以得知:
能量均分定律 理想气体内能
在温度为T 的平衡态下, 在温度为 的平衡态下,分子热运动 的每一个自由度所对应的平均动能都 1 等于 kT . 2 —— 能量均分原理
气体分子平均自由程表达式

气体分子平均自由程表达式在物理学中,气体分子的平均自由程(也称平均自由路径)是一个重要的物理量,它指的是气体分子在碰撞前后所移动的平均距离。
在理想气体中,分子之间的距离相对较小,因此自由程相对较长。
但是在实际气体中,气体分子之间的距离往往比较大,分子间的碰撞比较频繁,因此自由程也较短。
那么,气体分子平均自由程的表达式是什么呢?在这里,我们将详细讲解。
首先,我们需要确定一个基本概念——平均自由时间。
平均自由时间指的是气体分子运动中两次相邻碰撞之间的平均时间间隔。
与平均自由时间相关的是气体分子平均自由程,两者之间有如下关系:平均自由程=平均速度×平均自由时间接下来,我们需要进一步求解平均自由时间和平均速度。
首先,我们可以通过热力学的方法推导平均自由时间的表达式。
根据玻尔兹曼方程,假设气体分子的碰撞为完全弹性碰撞,即气体分子之间没有损失或转化的能量。
此时,可以得到分子平均自由时间的表达式:τ = [(1/√2)×π×d2×N]/(4π×d2×P×v)其中,τ为平均自由时间,d为分子直径,N为单位体积中的分子数,P为气体压强,v为分子平均速度。
接下来,需要对上式进行简单的推导。
我们可以通过分析气体中的分子运动状态,发现当分子的平均自由程大于等于分子直径时,分子之间的碰撞才可能发生。
因此,我们可以得到下式:π×(d/2)2×n×v×τ = 1其中,n为单位体积中的分子数。
通过上述推导过程,我们可以推导出平均自由程的表达式:λ = v×τ此时,将平均自由时间的表达式代入上式中,得到:λ = [(1/√2)×d2×N]/(4P)该公式是分子平均自由程的表达式。
根据该公式,可以发现分子平均自由程与分子直径、气体压强以及分子数等因素有关。
此外,还需要注意的是,该公式只适用于弹性碰撞情况下的气体分子。
06-6气体分子的平均自由程

我们需要探讨分子之间相互碰撞的规律! 我们需要探讨分子之间相互碰撞的规律!
任一个分子在什么时间与其他分子发生碰撞 以及与哪个分子碰撞都不是我们想关心的
1 平均碰撞频率 Z
单位时间内一个分子平均 碰撞的次数
如何计算分子的平均碰撞频率呢? 如何计算分子的平均碰撞频率呢? 追踪一个分子A, 追踪一个分子 ,计算单位时间内与该分 子相碰的分子数
σ = πd
σ u∆t
2
时间内,分子A走过的路程 在 ∆t 时间内,分子 走过的路程 相应圆柱体的体积
u∆t
在 ∆t 时间内,分子A与 时间内, , 设分子数密度n,该 设分子数密度分子 与 其他分子的碰撞次数 圆柱体内总分子数
nπd u ∆t
2
根据麦克斯韦速率分布 根据麦克斯韦速率分布 律,气体分子的平均相 对速率与分子的平均速率存在下列关系 平均碰撞频率
√
A. Z 和λ 都增大一倍 B. Z 和λ 都减为原来的一半 C. Z 增大一倍而 减为原来的一半 增大一倍而λ D. Z 减为原来的一半而 增大一倍 减为原来的一半而λ
u = 2 ⋅v
nπd
2
Z=
2 v ∆t 2 = nπd 2 v ∆t
2 分子的平均自由程 λ
一个分子在连续两次碰撞之间所经过的自 由路程的平均值 单位时间内分子走过的平均路程为 v 单位时间内分子与其他分子平均碰撞次数 Z 分子的平均自由程
1 v v = λ= = 2 2 2nπd Z nπd 2 v
追踪一个分子a计算单位时间内与该分子相碰的分子数分子间碰撞的简化模型把所有分子视为有效直径为d的刚性小球假设其他分子静止不动只有分子a在它们之间以平均相对速率运动以分子a的运动轨迹为轴线分子有效直为半径作一曲折圆柱体凡是分子中心在此圆柱体内的分子都会与分子a相碰圆柱体的截面积又称分子的碰撞截面设分子数密度n该圆柱体内总分子数时间内分子a与其他分子的碰撞次数根据麦克斯韦速率分布律气体分子的平均相对速率与分子的平均速率存在下列关系平均碰撞频率一个分子在连续两次碰撞之间所经过的自由路程的平均值分子的平均自由程nkt分子的平均自由程与平均速率无关与分子的有效直径及分子数密度有关当温度一定时分子的平均自由程与气体压强成反比
6-5能均分定理 理想气体的内能

1. 自由度
1. 自由度
确定一个物体的空间位置所需的独立坐标数, 确定一个物体的空间位置所需的独立坐标数, 常用i 表示。 常用 表示。 自由度确定的方法: 自由度确定的方法:按分子结构 (1)单原子分子可视为质点, 单原子分子可视为质点, 单原子分子可视为质点 确定其空间位置需三个独 立坐标, 立坐标, 故单原子分子自由度 为3(i=3),称为平动 ( ) 自由度 ,如He、Ne等。 、 等
M i M i RT E= NA kT = 2 Mmol 2 Mmol
理想气体内能公式,对于刚性分子, 理想气体内能公式,对于刚性分子,不计分 子间势能,内能仅是温度的单值函数, 子间势能,内能仅是温度的单值函数,与气体的 压强、体积无关。 压强、体积无关。
3. 理想气体的内能
内能:热力学系统的全部微观粒子具有能量总和, 内能:热力学系统的全部微观粒子具有能量总和, 包括大量分子热运动的动能、 包括大量分子热运动的动能、分子间的势 分子内原子内及核内的能量。 能、分子内原子内及核内的能量。这里特 指前两种, 表示。 指前两种,用 E 表示。 对于刚性分子,不计分子间势能, 对于刚性分子,不计分子间势能,内能仅包 括所有分子的平均动能之和。 括所有分子的平均动能之和。
2. 能量按自由度均分定理
椐理想气体温度公式, 椐理想气体温度公式,分子平均平动动能与温 度关系为
1 2 3 εk = mv = kT 2 2
2 z 2
2 x
v Q v +v +v = v , v = v = v = 3 1 1 1 1 2 2 2 ∴ mvx = mvy = mvz = kT 2 2 2 2
M i M i RT E= NA kT = 2 Mmol 2 Mmol
7-5 能量均分定理 理想气体内能要点
1 2
m vC2 y
1 2
m vC2 z
分子平均转动动能
kr
1 2
J
2 y
1 2
J
2 z
➢ 刚性分子平均能量
kt kr
7 – 5 能量均分定理 理想气体内能
非刚性双原子分子
y
m2
m1
* C
x
z
刚性分子平均能量
kt kr
非刚性分子平均振动能量
v
1 2
vC2x
1 kx 2 2
非刚性分子平均能量
7 – 5 能量均分定理 理想气体内能
一 自由度
kt
1 mv2 2
3 2
kT
v
2 x
v
2 y
v2z
1 v2 3
z
Oy
x
1 2
mv2x
1 2
mv
2 y
1 2
mv2z
1 kT 2
单原子分子平均能量 3 1 kT
2
7 – 5 能量均分定理 理想气体内能
刚性双原子分子
分子平均平动动能
kt
1 2
m
vC2 x
kt kr v
自由度 分子能量中独立的速度和坐标的二次方
项数目叫做分子能量自由度的数目, 简称自由度,用
符号 表i示.
7 – 5 能量均分定理 理想气体内能
自由度 分子能量中独立的速度和坐标的二次方项
数目叫做分子能量自由度的数目, 简称自由度,用符号
i 表示.
自由度数目
i t r v
平转振 动动动 刚性分子能量自由度
t r i 自由度
分子
平动
转动
总
热学气体分子平均自由程

气体分子的碰撞截面
碰撞截面
截面对平均自由程的影响
气体分子间的碰撞截面决定了分子间 的相互作用和碰撞概率。
碰撞截面越大,分子间的碰撞概率越 高,平均自由程越短。
截面大小
不同气体分子间的碰撞截面大小不同, 与分子间的距离和相互作用力有关。
气体分子的能量损失
能量损失
01
气体分子在碰撞过程中会损失能量,导致平均自由程的变化。
特性
与气体分子的速度、气体分子的分布、气体分子的碰撞频率等因素有关。
平均自由程与气体分子碰撞频率的关系
碰撞频率
气体分子在单位时间内所发生的碰撞 次数。
关系
平均自由程与气体分子碰撞频率成反 比,碰撞频率越高,平均自由程越小。
平均自由程在热学中的重要性
热传导
平均自由程是影响气体热传导的重要因素之一,通过 改变平均自由程可以调节气体的热传导性能。
总结词
在高温高压条件下,气体分子间的相互 作用力减弱,分子间的碰撞频率降低, 因此平均自由程较大。
VS
详细描述
在高温高压条件下,气体分子间的平均距 离增大,分子间的碰撞频率减少,导致气 体分子的平均自由程增大。这种情况下, 气体分子的运动受到的相互碰撞的限制较 小,运动路径较长。
04 气体分子平均自由程的影 响因素
探索气体分子平均自由程在极端条件下的行为
研究高温、高压、高密度等极端 条件下气体分子平均自由程的变 化规律,揭示其与温度、压力、
密度的关系。
探讨极端条件下气体分子与障碍 物的相互作用,以及气体分子间 的相互作用,以理解其行为特性。
研究极端条件下气体分子输运性 质的变化,为相关领域的应用提
供理论支持。
感谢您的观看
大学热学第七讲-平均自由程

sp
7 2
kT
气体内能——
U 1 M (t r 2s)RT
2
摩尔内能 Um
1 2
(t
r
2s)RT
单原子分子:
Um
3 2
RT
刚性双原子分子:
Um
5 2
RT
非刚性双原子分子:
Um
7 2
RT
Ut,m Ur,m Us,m
26, 27
CV ,m
dU m dT
CV ,m
dU m dT
至于为什么自由度会被“冻结”,为什么 随温度升高自由度会逐渐“解冻”,一切经典 理论对此都无法解释。 • 这需借助量子理论,其关键是转动动能与振 动能并不能连续变化,而是分能级的,即能量 是量子化的。
§3.4 能量按自由度均分定理
一. 自由度 二. 能量按自由度均分定理 三. 理想气体的内能 四. 理想气体的热容量 五. 经典理论的缺陷
•其解释是气体分 子的自由度会发 生冻结和解冻。 并且不是所有分 子同时冻结和同 时解冻。
振动自由度 解冻
转动自由度 冻结或解冻
H2分子:
T<102 K,
f =3
102 K < T< 103 K f =5
T> 103 K,
f =6
(平动) (+转动) (+振动)
1 Um 2 (t r 2s)RT
B 的质心恰在圆柱体内所 以被碰撞
E 的质心不 在圆柱体内,
不被碰撞
C 的质心在圆柱体 内被碰撞
•单位时间内 A 分子所扫出的“圆柱体”中的分子数, 就是分子的平均碰撞频率。
理想气体平均自由程与温度的关系

理想气体平均自由程与温度的关系我们来解释平均自由程的概念。
在理想气体中,气体分子随机运动并不断碰撞,这些碰撞决定了气体的宏观性质。
平均自由程是指在两次连续碰撞之间,气体分子自由运动的平均距离。
这个距离与气体分子的密度和分子直径有关。
当气体密度较高或分子直径较大时,分子之间的碰撞频率增加,平均自由程相应减小。
接下来,我们将讨论平均自由程与温度的关系。
根据理论分析和实验结果,平均自由程与温度呈反比关系。
具体来说,温度升高会导致气体分子的平均动能增大,分子运动速度加快。
这意味着分子之间碰撞的频率增加,从而平均自由程减小。
换句话说,高温下气体分子的自由运动距离较短。
这种反比关系可以通过以下解释得到更深入的理解。
在低温下,气体分子的动能相对较小,相互之间的吸引力较强,分子之间的碰撞更为频繁。
因此,在相同条件下,低温下的气体分子平均自由程较短。
而在高温下,气体分子的动能增大,相互作用力减弱,分子之间的碰撞频率减小,平均自由程相应增加。
平均自由程与气体的压力和浓度也有关系。
压力增大会使气体分子之间的碰撞频率增加,从而平均自由程减小。
而浓度的增加也会导致碰撞频率增加,进一步缩短平均自由程。
需要注意的是,上述描述是基于对理想气体的简化假设得出的。
在实际气体中,分子之间除了碰撞还存在其他相互作用力,这些作用力会影响平均自由程与温度的关系。
此外,不同气体的分子直径和相互作用力也会导致平均自由程与温度的关系存在差异。
总结起来,理想气体平均自由程与温度呈反比关系。
高温下气体分子动能增大,碰撞频率减小,从而平均自由程增加;低温下气体分子动能减小,碰撞频率增大,平均自由程减小。
这一关系对于理解气体行为和热力学性质具有重要意义。
同时,需要注意实际气体中存在其他相互作用力的影响,因此上述关系需要在具体情况下进行修正和进一步研究。
§3.6.4 气体分子平均自由程

vt Zt
vt v Zt Z
vt v Zt Z
平均自由程公式:
Z 2nv
1 2n
表示对于同种气体,平均自由程与n成反比,而与平均 速率无关。
kT 2p
表示同种气体在温度一定时,平均自由程与压强成
反比。
平均自由程公式应用于日ห้องสมุดไป่ตู้灯,显象管
•[例3.1] 试求标准状况下空气分子的平均自由程。
•[解] 标准状况下空气分子的平均速率为446 m.s-1 ,平
均碰撞频率为,
Z 6.5 10 s
9 1
v 6.9 108 m z
•空气分子有效直径 d = 3.5 10-10 m •可见标准状况下
200 d
讨论理想气体基本假定时的一个问题
§3.6.4 气体分子平均自由程
• 理想气体分子在两次碰撞之间可近似认为不受到其
它分子作用,因而是自由的。 • 分子两次碰撞之间所走过的路程称为自由程,以λ 表示。
• 任一分子任一个自由程长短都有偶然性,自由程平
均值由气体的状态所唯一地确定。 • 一个以平均速率运动的分子,它在 t 秒内平均走 过的路程和平均经历的碰撞次数分别为 平均两次碰撞之间走过 的距离即为平均自由程
气体的平均自由程

气体的平均自由程1.引言气体是一种物质的状态,其分子间距离较大,分子之间互相碰撞,从而导致气体的压力和体积的变化。
在气体中,分子的运动方式主要是直线运动,分子之间的相互碰撞也起到了调控气体性质的作用。
而气体的平均自由程指的是气体分子在连续碰撞之间所行走的平均距离。
2.气体分子的运动在气体状态下,分子以高速无规则运动,具有自由度较大的特点。
气体分子之间存在着各向异性的吸引力和排斥力,这是由分子之间的相互作用力所决定的。
在气体中,分子的运动可以分为两种,即传递运动和总动量守恒运动。
传递运动是指气体分子在各个方向上的直线运动,分子之间不停地互相碰撞。
这种运动是混沌的,难以预测,但总体上表现为均匀分布。
总动量守恒运动是指在两个分子碰撞时总动量守恒不变。
当两个分子相撞时,它们之间会发生弹性碰撞,即动能的转移,但总动量保持不变。
这种运动保证了气体分子的整体运动特性。
3.气体分子的平均自由程定义气体分子之间的碰撞是气体宏观性质(如压力、温度等)的基础。
气体分子的平均自由程是指在连续碰撞之间,气体分子在气体中走过的平均距离。
对于一般气体的分子,它们的平均自由程与气体分子的直径、气体分子的密度以及气体的压力有关。
可以通过下面的公式来计算气体分子的平均自由程(λ):λ = 1 / (2 * √2 * π * d^2 * N/V)其中,d是分子直径,N是纳瓦特数(即单位体积中分子的数量),V是气体的体积。
需要注意的是,以上公式仅适用于稀薄气体,即气体分子之间的平均距离远大于气体分子的直径的情况。
对于高密度气体(如气体接近液体状态),平均自由程的计算需要考虑分子之间的相互作用力。
4.气体分子的平均自由程与气体性质的关系气体分子的平均自由程是气体性质的重要参数,它与气体的压力、温度以及分子之间的相互作用力密切相关。
在相同温度下,当气体分子的平均自由程较小时,分子之间的碰撞频率较高。
这会导致气体的压力增大,因为分子碰撞对容器壁施加了较大的冲击力。
大学物理(热学知识点总结)

7、bca为理想气体绝热过程,b1a和b2a是任意过程,则上述两 过程中气体作功与吸收热量的情况是: A) b1a过程放热,作负功;b2a过程放热,作负功. B) b1a过程吸热,作负功;b2a过程放热,作负功. C)b1a过程吸热,作正功;b2a过程吸热,作负功. D) b1a过程放热,作正功;b2a过程吸热,作正功.
[1]、有一定量的理想气体,从初状态 a (P1 、V1 )开始, 经过一个等容过程达到压强为P1 / 4 的 b 态,再经过一个等 压过程达到状态C ,最后经过等温过程而完成一个循环, 求:该循环过程中系统对外作的功A 和所吸收的热量Q。 解:由已知可得: a( P 1 ,V1 )
循环过程
E 0 Q A V V1 1) a b A 0 2) b c A p1 (4V1 V1 ) / 4 3 p1V1 / 4 3) c a A p1V1 ln( V1 / 4V1 ) p1V1 ln4
p (105 Pa) 3 2 1 O A 1 2 C V (103 m3) B
解:(1) A→B:
A1
ΔE1= CV (TB-TA)=3(pBVB-pAVA) /2=750 J Q=A1+ΔE1=950 J. B→C: A2 =0 ΔE2 = CV (TC-TB)=3( PCVC-PBVB ) /2 =-600 J. Q2 =A2 +ΔE2 =-600 J. C→A: A3 = PA (VA-VC)=-100 J.
解( : 1) 等 容 过 程 , A 0, 外 界 对 气 体 作 功 A 0 M i Q E CV T RT M mol 2 0.02 3 8.31 ( 300 290 ) 623 ( J ). 0.004 2 (2)等压过程, E 与 ( 1) 同 。
理想气体的内能、能量按自由度均分定理(1)

理想气体的内能、能量按自由度均分定理(1) 题号:21011001分值:3分难度系数等级:11 mol 刚性双原子分子理想气体的内能为5757(A)(B)(C)(D) kTRTkTRT2222[ ]答案:( B )题号:21011002分值:3分难度系数等级:1根据能量均分定理,分子的每一自由度所具有的平均能量为(A)135 (B)(C)(D) kTkTkTkT222[ ]答案:( A )题号:21011003分值:3分难度系数等级:1质量为kg的理想气体,其分子的自由度为,摩尔质量为,当它处于温度为的MT,i平衡态时,该气体所具有的内能为MMii(A)RTRT (B)RT (C)(D) RT22,,[ ]答案:( D )题号:21012004分值:3分难度系数等级:2温度为027C时,1 mol 氧气所具有的平动动能和转动动能分别为,21,21E,6.21,10 J, J E,4.14,10平转,21,21(B)E,4.14,10 J, J E,6.21,10(A)平转33(C)E,2.49,10 J, J E,3.74,10平转33(D)E,3.74,10 J, J E,2.49,10平转[ ]答案:( D )题号:21012005分值:3分难度系数等级:21 mol 非刚性双原子分子理想气体的内能为(A)5577kTRT (B)(C)(D) kTRT2222[ ]答案:( D )题号:21012006分值:3分难度系数等级:2质量为kg的刚性三原子分子理想气体,其分子的摩尔质量为,当它处于温度为MT,的平衡态时,该气体所具有的内能为3MMMM753(A)RTRTRTRT (B)(C)(D) ,2,2,2,[ ]答案:( B )题号:21012007分值:3分难度系数等级:2若某种刚性双原子分子的理想气体处于温度为T的平衡状态下,则该理想气体分子的平均能量为(A)3535kTkTRTRT (B)(C)(D) 2222[ ]答案:( B )题号:21013008,气体分子的自由度为,则每个气体分子所具有T分值:3分 i的难度系数等级:3理想气体处于平衡状态,设温度为ii(A)动能为(B)动能为 kTRT22ii(C)平均动能为(D)1mol平均动能为 kTRT22[ ]答案:( D )题号:21013009分值:3分难度系数等级:3刚性多原子分子所具有的平均能量为(A)357kTkT (B)(C)(D) kT3kT222[ ]答案:( D )题号:21013010分值:3分难度系数等级:3非刚性双原子分子理想气体的摩尔热容比为(A)7597 (B)(C)(D) 5779[ ]答案:( C )题号:21013011分值:3分难度系数等级:3可视为刚性分子的氧气压强,23p,2.026 Pa,体积m,则其内能为 V,3.00,10 (A)0.061 J (B)0.091 J (C)0.152 J (D)0.213 J[ ]5答案:( A )E,pV 2题号:21013012分值:3分 ,2,35kg氢气装在m3的容器内,当容器内的压强为 Pa时,2.0,104.0,103.90,10难度系数等级:3氢气分子的平均平动动能为,22,22(A) J (B) J 3.89,106.48,10,22,22(C) J (D) J 7.77,109.07,10[ ]答案:( A )题号:21014013分值:3分难度系数等级:4质量为,摩尔质量为的单原子理想气体,经历了一个等压过程,温度增量为,M,T,则内能增量为M3M(A),E,R,T,E,R,T (B) ,,2M7M5(C),E,R,T,E,R,T (D) ,2,2[ ]答案:( B )题号:21014014分值:3分难度系数等级:4某理想气体的定压摩尔热容量为J/(mol*K),则该气体的自由度为 29.1(A)7 (B)6 (C)5 (D)3[ ]答案:( C )题号:21015015分值:3分难度系数等级:5用绝热材料制成的一个容器,体积为2V,被绝热板隔成A,B两部分,A内储1mol单0原子理想气体,B内储有2 mol刚性双原子理想气体,A,B 两部分压强相等均为p,两部0分体积均为V,则两种气体各自的内能分别为 05757 ,(B), E,pVE,pVE,pVE,pVA00B00A00B0022223553(C),(D), E,pVE,pVE,pVE,pVA00B00A00B00(A)2222[ ]答案:( C )题号:21021001分值:2分难度系数等级:1由于理想气体忽略了分子间的相互作用,因此理想气体的内能只是温度的单值函数。
第三讲 平均碰撞频率与平均自由程

5.试以气体为例,用分子热运动观点对内摩擦、 热传导、扩散现象做出微观定性解释。
答案
—— 热学 ——
真实气体 范德瓦斯方程
作业
P149:1.26
预习 第二章 1、2、3、4节
—— 热学 ——
气体分子的平均自由程
1、粘滞现象
河流中水流的流速分布:
河岸
河流 u
河岸
f
u2
下层对上层的阻力
u1
f
上层对下层的作用力
—— 热学 ——
真实气体 范德瓦斯方程
各层气流的流速不同 相邻两层气流之间产生阻碍气体流动的阻力 ——称为粘性力。(这种现象称为内摩擦现象)
du -----速度梯度 dy
平均碰撞频率
z
平均自由程
平均速率
—— 热学 ——
λυ z
气体分子的平均自由程
(实际上其它分子也在运动)
平均相对速率 u 2υ 分子有效直径:d
—— 热学 ——
气体分子的平均自由程
d
u u
d
A
d
引入: 碰撞截面
d 2
结论: z 2σnυ
1
kT
λ
2σn 2πd 2 p
注:实际平均自由程可能与容器线度有关。
迁移现象产生的原因: 流速、温度、密度不均匀
无外界干预时,系统要从非平衡态自发地向平衡态 过渡。亦称输运过程。 讨论气体在非平衡态下的三种特殊过程。 即:三种迁移现象:
粘 滞 现 象 ——分子动量迁移; 热 传 导 现 象——分子能量迁移; 扩 散 现 象 ——分子密度迁移;
—— 热学 ——
7-8----理想气体的平均自由程和碰撞频率
v 8RT M
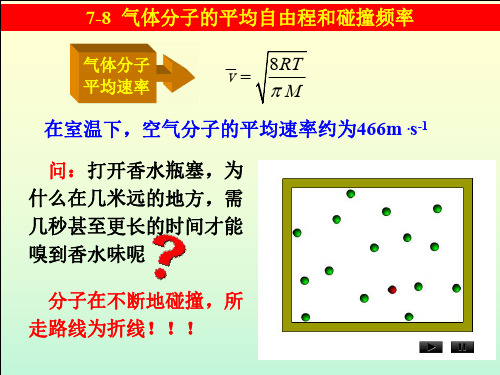
在室温下,空气分子的平均速率约为466m .s-1
问:打开香水瓶塞,为 什么在几米远的地方,需 几秒甚至更长的时间才能 嗅到香水味呢
分子在不断地碰撞,所 走路线为折线!!!
v自由程 free path : 分子两次相邻碰撞之间自由通过的路程。
2、只有一个分子A 在运动,其它分子都认为是静
止不动的,且A 运动的相对速率为 u 。
t 时间内A分子走过的路程为: s ut
V d2 u t
在体积V 内的所有 其它分子在t 时间 内都与A 碰撞 设分子数密度为n
A 分子在t 时间内与其它分子碰撞的次数: n d 2u t
分子平均碰撞频率
Z n d 2ut n d 2u
v平均自由程 mean free path :
分子在连续两次碰撞之间所经过的自由程的平均值。 v平均碰撞频率 mean collision frequency Z :
单位时间内一个分子和其它分子碰撞的平均次数。
假设
1、每个分子都是直径为d 的刚性小球(d 是两分 子碰撞时,质心间的最小距离的平均值,称为分子 的有效直径)。
t
考虑其它分子的运动,由统计理论可知: u 2 v
Z 2 d 2nv
vZ
一秒钟内分子走过的平均路程为 v
一秒钟内与其它分子发生碰撞的平均次数为 Z
平均自由程 v
Z
1 2 d 2n
p nkT
kT
2 d 2 p
——平均自由程与压强的关系
例题:已知空气的摩尔质量为 M= 29 ×10-3 kg·mol-1
分子的碰撞截面 =3.85 ×10-15 cm2 ,求在标准状态下,
气体平均自由程计算公式

气体平均自由程计算公式以气体平均自由程计算公式为标题,我们来探讨一下这个公式的含义和应用。
在研究气体分子运动时,平均自由程是一个重要的物理量。
它表示了气体分子在碰撞之间所能飞行的平均距离。
通过计算平均自由程,我们可以了解气体分子的运动规律,以及气体的输运性质。
那么,如何计算气体的平均自由程呢?在理想气体模型中,平均自由程的计算公式为:λ = (1 / (sqrt(2) * π * d^2 * n)),其中,λ表示平均自由程,d表示气体分子的直径,n表示气体分子的数密度。
这个公式的推导过程比较复杂,我们不详细展开。
但是,通过这个公式,我们可以得出一些有趣的结论。
平均自由程与气体分子的直径成反比。
这意味着,气体分子越大,其平均自由程就越小。
因为大分子的直径相对较大,分子之间的碰撞更加频繁,所以平均自由程就相对较短。
平均自由程与气体分子的数密度成反比。
数密度越大,分子之间的距离就越近,碰撞的概率就越高,所以平均自由程就越短。
通过平均自由程的计算,我们还可以推导出气体的输运性质。
例如,气体的导热性和电导率与平均自由程有关。
当气体的平均自由程很长时,分子之间的碰撞较少,热量和电流可以更迅速地传递,所以导热性和电导率就较高。
相反,当平均自由程较短时,热量和电流的传递速度就会减慢,导热性和电导率就会降低。
平均自由程还与气体的粘滞性有关。
粘滞性是指气体分子在流动中的阻力。
当气体的平均自由程较短时,分子之间的碰撞频率较高,气体的粘滞性就会增加。
而当平均自由程较长时,分子之间的碰撞较少,气体的粘滞性就会减小。
通过计算平均自由程,我们可以更好地理解气体的性质和行为。
这对于工程应用和科学研究都具有重要意义。
例如,在研究气体的输运过程中,我们可以通过计算平均自由程来估算气体的扩散速率和传质速度,从而指导工艺设计和环境保护。
平均自由程是一个重要的物理量,用于描述气体分子的运动规律和气体的输运性质。
通过计算平均自由程,我们可以更好地理解气体的特性,为工程应用和科学研究提供指导。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
推广:在温度为T 的平衡态下,分子的每一个转动自由度
上也具有相同的平均动能,大小也为kT/2。
能量按自由度均分定理:
在温度为T的平衡态下,气体分子每个自由度 的平均动能都相等,都等于kT/2。这就是能量 按自由度均分定理,简称能量均分定理。
k
i 2
k=3kT/2
说明:
kT
•是统计规律,只适用于大量分 子组成的系统。 •统计物理可给出严格证明。
b A(x,y,z) a
y
x
说明:一般来说,n≥3个原子组成的分子,共有3n个自由度,
其中3个平动自由度,3个转动自由度,(3n-6)个振动自由度。当 气体处于低温状态时,可把分子视为刚体。
二、能量均分定理:
一个分子的平均平动能为
k
2 x
kt
2 y
3 2
kT
1 2
mv
2
1 2
E= m i M 2 RT
E E 2 E1
m i M 2
R (T 2 T1 )
在相同的t时间内,分子由A到 B的位移大小比它的路程小得多
A
B
(路程/时间) (位移量/时间)
扩散速率 平均速率 气体分子两次相邻碰撞之间自由通过的路程。
分子自由程: 分子碰撞频率:
在单位时间内一个分子与其他分子碰撞的次数。
y
q
x
z
自由刚体
三个独立的坐标 x,y,z 决定转轴上一点 两个独立的a, b 决定转轴空间位置
一个坐标q 决定刚体转过的角度
i=6 3个平动 3个转动
b A(x,y,z) a
y
刚性杆:
x,y,z,α,β i=5
z
刚体定轴转动:
θ i=1
q
分子的自由度
单原子 i=3 自由质点 双原子 i=5 刚性杆 多原子 i=6 自由刚体
mv
2 x
1 2
mv
1 2
m Hale Waihona Puke z2v1 2
v
2 x
2 y
v
2 z
1 3
v
1 2
2
平方项的平均值
1 2
mv
1 2
mv
2 y
mv
2 z
kT
平动自由度
结论:分子的每一个平动自由度上具有相同的平均平动动
能,都是kT/2 ,或者说分子的平均平动动能3kT/2是均匀地 分配在分子的每一个自由度上
麦克斯韦(James Clerk Maxwell 1831——1879)
•他提出了有旋电场和位移电流概念,建 立了经典电磁理论,预言了以光速传播 的电磁波的存在。
•1873年,他的《电磁学通论》问世,这 是一本划时代巨著,它与牛顿时代的 《自然哲学的数学原理》并驾齐驱,它 是人类探索电磁规律的一个里程碑。 •在气体动理论方面,他还提出气体分子 按速率分布的统计规律。
m 6 . 62 m
大量分子的分子自由程与每秒碰撞次数服从统计 分布规律。可以求出平均自由程和平均碰撞次数。 一、平均碰撞次数 每个分子都是有效直径为d 的弹性小球。 假 定 只有某一个分子A以平均速率 v运动, 其余分子都静止。
d
v
v
A
d
d
d
v
v
A
d 球心在圆柱 体内的分子
d
运动方向上,以 d 为半径的圆柱体内的分子都将 与分子A 碰撞
平均自由程
v Z
1 2 d n
2
与分子的有效直径的平方和分子数密度成反比
p nkT
kT 2d p
2
当温度恒定时,平均自由程与气体压强成反比
在标准状态下,几种气体分子的平均自由程
气体
(m )
d (m )
氢
1.13 10
7
氮
0.599 10 3.10 10
7
氧
理想气体内能公式
理想气体内能是分子平动动能与转动动能之和
分子的自由度为i,则一个 说明: •理想气体的内能与温度和分子的 分子能量为ikT/2, 1摩尔理 自由度有关。 想气体,有个NA分子,内 •内能仅是温度的函数,即E=E(T), 能 i i 与P,V无关。 E = kT N A RT 2 2 •状态从T1→T2,不论经过什么过程, m/M摩尔理想气体,内能 内能变化为
1 . 38 10
23
kT 2π d p
273
2 5
2
1
2 π ( 3 . 10 10
10
) 1 . 013 10
23
m 8 . 71 10
8
m
2
1 . 38 10 2 π ( 3 . 10 10
273
2 3
10
) 1 . 333 10
19世纪伟大的英 国物理学家、数 学家。经典电磁 理论的奠基人, 气体动理论的创 始人之一。
7-4 能量均分定理 理想气体内能
一、自由度
定义:
确定一个物体的空间位置所需要的独 立坐标数目——自由度。
z O
质点的自由度
直线运动 x 一个自由度 平面运动 x,y 两个自由度 空间运动 x,y,z 三个自由度 i=1 i=2 i=3
0.647 10 2.90 10
7
空气
7.0 10
8
2.30 10
10
10
10
3.70 10
10
例 计算空气分子在标准状态下的平均自由程和碰 撞频率。取分子的有效直径d=3.510-10m。已知空气
的平均分子量为29。
解: 已知 T 273K , p 1.0atm 1.013 105 Pa,
448m / s
z
448 6.9 10
8
6.5 10 s
9
1
例 试估计下列两种情况下空气分子的平均自 由程 :(1)273 K、1.013 10 5 Pa 时 ; ( 2 ) 273 K 、 3 10 Pa 时. 1.333 (空气分子有效直径 : 3 . 10 10 10 m ) d 解
单原子分子 i=3 ε 双原子分子 i=5 ε
k=5kT/2 多原子分子 i=6 ε k=6kT/2
• 气体分子无规则碰撞的结果。
三、理想气体的内能和摩尔热容
1、理想气体的内能: 热力学系统的内能
热力学系统的内能是指气体分子各种形态的动能与势能的总 和。即系统所包含的全部分子的能量总和称为系统的内能。
d 3.5 10
10
m
kT 2d p
2
23
1.38 10
273
10
1.41 3.14 ( 3.5 10
) 1.01 10
5
6.9 10 m
8
空气摩尔质量为2910-3kg/mol
空气分子在标准状态下 的平均速率
v
v
8 RT
M mol
一秒钟内A 与其它分子 发生碰撞的 平均次数
一秒钟内: 分子A经过路程为 v 2 相应圆柱体体积为 d v 圆柱体内 分子数
d v n
2
Z d v n
2
Z d v n
2
一切分子都在运动
Z
2d v n
2
二、平均自由程
一秒钟内分子A经过路程为 v
一秒钟内A与其它分子发生碰撞的平均次数 Z
