第2讲.理想气体内能.教师版
热学课件 第2章 热力学第一定律

C Q
dT
常用的热容量是
① 定容热容量 Cv和定压热容量 Cp
Cv
Q
dT
v
Cp
Q
dT
p
②比热容 c:单位质量的热容量 . 单位: J mg1K 1
③摩尔热容 Cm :1 mol物质的热容. 单位: J mol1K 1
由此,系统在某一变化(n)过程中其传递热量则为
Qn
Tf Ti
CndT
由 PV RT
微分得:
p p1 1
p2 0V
1
PdV VdP RdT (1)
2
VV
2
对理想气体准静态绝热过程,根据笫一定律,有
Q dU - W CV ,mdT pdV 0 (2)
(1), (2)联立, 消去dT
绝热指数:
(CV ,m R) dV dp 0
CV ,m
V
p
C p,m CV ,m R
)T
V
( dp dV
)Q
p V
p p T
Q
0
>1, 绝热线比等温线陡.(为什么?)
A
等温线
绝热线
C
B
V
VV
1
2
归纳:多方过程的一般表示
对于一摩尔理想气体所进行的任一微小过程 , 有
dU CV ,mdT
Q CmdT 和 W pdV 代入热力学第一定律 Q dU pdV
得 (Cm Cv,m )dT pdV
U U (T ) --焦耳定律
实际上,焦耳实验及其得出焦耳定律对理想气体来说,作为 理想气体的定义条件是严格成立的。但对于实际气体,它的成 立不仅道理上无法接受,而且实验本身也是存在问题的。
九年级物理内能课教案

九年级物理内能优质课教案一、教学目标1. 让学生理解内能的概念,掌握内能的计算方法。
2. 让学生了解内能与温度、质量、状态等因素的关系。
3. 培养学生运用物理知识解决实际问题的能力。
二、教学内容1. 内能的概念及其单位2. 内能的计算公式:E=3/2nRT(理想气体)3. 内能与温度的关系:温度越高,内能越大。
4. 内能与质量的关系:质量越大,内能越大。
5. 内能与状态的关系:同种物质,气态内能大于液态内能,液态内能大于固态内能。
三、教学重点与难点1. 重点:内能的概念、计算方法及内能与温度、质量、状态的关系。
2. 难点:内能计算公式的应用,内能与状态关系的理解。
四、教学方法1. 采用问题驱动法,引导学生思考、探究内能的相关问题。
2. 利用实验、实例等直观手段,帮助学生理解内能的概念及内能与温度、质量、状态的关系。
3. 运用小组讨论、合作交流的方式,提高学生解决问题的能力。
五、教学过程1. 导入:通过一个实例,如烧水时水温升高,引导学生思考水的内能是否发生变化,从而引入内能的概念。
2. 讲解内能的概念:内能是指物体内部所有分子做无规则运动所具有的动能和分子势能的总和。
3. 讲解内能的单位:焦耳(J)。
4. 讲解内能的计算公式:E=3/2nRT(理想气体),并解释各符号的含义。
5. 讲解内能与温度、质量、状态的关系:a. 内能与温度的关系:通过实验或实例,展示温度升高,内能增大。
b. 内能与质量的关系:通过实验或实例,展示质量越大,内能越大。
c. 内能与状态的关系:通过实验或实例,展示同种物质,气态内能大于液态内能,液态内能大于固态内能。
6. 练习与应用:布置一些实际问题,让学生运用所学知识解决。
7. 总结:回顾本节课所学内容,强调内能的概念、计算方法及内能与温度、质量、状态的关系。
8. 作业布置:布置一些有关内能的练习题,巩固所学知识。
六、教学评估1. 课堂问答:通过提问学生,了解他们对内能概念、计算方法和内能与温度、质量、状态关系的掌握程度。
热力学第二章 理想气体性质

t2
t2
t1
(3)定值比热
CV ,m i R 2 C P ,m i 1 R 2
i 取值:单原子:3; 双原子: 5; 多原 子:7
一.比热力学能
d u=cvdt
1. cv const
理想气体、任何过程
u cv t
2. cv 为真实比热
3. cv 为平均比热
h是状态量,
h f (T , p )
h h dh ( ) p dT ( )T dp T p
h h q ( ) p dT [( )T v ]dp T p
定压状态下,dq=u,
由定义知:
h q p ( ) p dT T q p h Cp ( ) ( )v dT T
dT p2 s s2 s1 1 c p Rg ln T p1
2
s 1
2
2 dv dp cp 1 cv v p
s s2 s1 c p ln
T2 p Rg ln 2 T1 p1
v2 p2 s c p ln cv ln v1 p1
t2
1
u cv dt
T1
T2
u cv t (T2 T1 ) cv 0 t2 cv 0 t1
4. 查T-u表, 附表4 (零点规定: 0K, u=0, h=0 )
t2
t2
u u2 u1
二. 比焓
dh c p dT
利息气体、任何过程
1. c p const
1kg 工质温度
物理意义:表示在 p 一定时, 升高 1K ,焓的增加量 所以当作状态量 ;
说明: 1、对于cv、cp因为过程定容、定压,
第2讲热学_热力学第一定律、活塞过程.教师版

知识点睛热力学第一定律是能量守恒在热学中的体现,是解决所有涉及动力学过程的热力学题目 的基础。
“活塞”是连接两个互相分离的腔体的一种装置。
由于活塞通常可以自由移动,因此问 题会变得十分复杂。
然而,活塞题通常的特点是烦而不难,希望同学们能够耐心求解。
本讲 将向您介绍热力学第一定律以及一些活塞过程。
学完之后能给你的同学讲明白这几个问题,就算成功了:1) 为什么内能之和状态有关,做功和吸热与过程有关,为什么比热是与过程有关的,而不只是材料的属性。
2) 当活塞两边压强不一样的时候,算体积功,应当怎样选择用哪一边计算。
热力学第一定律:这是能量守恒在热力学过程中的体现。
当系统与外界间的相互作用既有做功又有热传递两种方式时,设系统内能增加量为 ∆E 。
在这一过程中系统从外界吸收的热量为 Q ,外界对系统做功为 W ,则 ∆E = Q + W 。
式中各量是代数量,有正负之分。
系统吸热 Q >0,系统放热 Q <0;外界做功 W >0,系统做功 W <0;内能增加。
△E>0,内能减少△E<0。
热力学第一定律是普遍的能量转化和守恒定律在热现象中的具体表 现。
活塞过程泛指容器中有活塞的气体过程。
通常气体过程是要求准静态的,因此活塞在任意时刻都受力 平衡。
这是沟通两个腔体中的气体的一个条件。
运用理想气体状态方程和热力学第一定律即可解决大部分 活塞问题。
还有一类特殊的活塞问题,是求解在平衡状态下,活塞偏离平衡位置的小振动。
通常,如果没有特殊 说明,那么我们取气体的绝热模型。
我们把满足 PV n=常量的过程称为多方过程,其中 n为多方系数。
n=1 时,即为等温过程,n=γ时为绝 热过程,n=0 为等压过程,n=∞为等体过程。
高二物理竞赛 第 2 讲 热力学第一定律与活塞运动本讲导学2通常,我们可以运用热学和力学来计算我们的大气层高度。
一个模型是等温模型,它假设各个高度的 大气是等温的,进而求解。
另一个模型是绝热模型,它假设气体的热交换是不充分的,不同高度的大气满足绝热关系:PV γ=C 。
高二物理竞赛课件:理想气体的内能(internal energy)

A→B
B
x→y
A
平动→转动
4. 由于热运动的无规则性,对大量分子而言,各种情况的碰 撞都会发生,哪一个自由度的能量都不可能始终高于或始终 低于其它自由度
9
三、理想气体的内能 (internal energy)
系统的内能:各种方式的动能(平动、转动、振动) 和势能(振动势能,分子力势能)之和
一个分子的总自由度 i = t + r + s ;
自由度:t =3
y
m
x
z
刚性双原子分子 例如:氧气(O2)、氮气 (N2)等为双原子分子气体。 其模型可用两个刚性质点模 型来代替。
自由度: t =3 r =2
y m1
z
m2 x
5
非刚性双原子分子 例:高温下氢气H2 ,室温Cl2 等 自由度:t =3 r =2 s =1
多原子分子n 3
自由度:t =3 r =3 s =3n-6
y m1
z
m2 x
例如:二氧化碳气体(CO2)、水蒸气(H2O)、甲烷 气体(CH4)等为多原子分子气体。其模型可用多个刚 性质点来代替。最多可以有 3n 个自由度
实际气体运动方式与温度有关 例:H2 低温 t 室温 t+r 高温 t+r+s
Cl2 室温 t+r+s
6
二 能量均分定理 (theorem of equipartition of energy)
经典统计物理给出严格证明,上面的结果可以推广到分子 运动的所有自由度,从而得到下面的结论
7
能量均分定理
处于温度为T的平衡态气体,分子的每一个自由
度都具有相同的平均动能:
1 2
教科版高中物理选择性必修第三册精品课件 第2章 固体、液体和气体 第2课时 理想气体状态方程

B.只要气体压强不是很高就可视为理想气体
C.一定质量的某种理想气体的内能与温度、体积都有关
D.在任何温度、任何压强下,理想气体都遵守气体实验定律
解析 理想气体分子除碰撞外,无相互作用的外力和斥力,故气体分子间的
分子势能可以忽略;理想气体在任何温度、任何压强下都遵守气体实验定
解析 如图所示。
对点演练3
一定质量的理想气体,在状态变化过程中的p-T图像如图所示,在A状态时的
体积为V0,试画出对应的V-T图像和p-V图像(标注字母和箭头)。
答案 见解析图
解析
0 0
根据理想气体状态方程,有
0
=
(3 0 )
0
=
(3 0 )
,解得
30
1
VB=3V0,VC=V0
学 习 目 标
1.了解理想气体的模型,并知道实际气体看成理想气体的条件。(物理观念)
2.掌握理想气体状态方程的内容和表达式,并能应用方程解决实际问题。
(科学思维)
3.掌握理想气体状态变化的图像问题的处理方法,能够解决相应图像问题。
(科学思维)
目录索引
基础落实•必备知识全过关
重难探究•能力素养全提升
结果与实验结果一致,为了使气体在任何温度、任何压强下都遵守气体实
验定律,引入了理想气体的概念。
知识归纳
理想气体
1.含义:
为了研究方便,可以设想一种气体,在任何温度、任何压强下都遵守气体实
验定律。
2.特点:
(1)严格遵守气体实验定律及理想气体状态方程。
(2)理想气体分子本身的大小与分子间的距离相比可以忽略不计,分子可视
B.理想气体的存在是一种人为规定,即它是一种严格遵守气体实验定律的
高中人教物理选择性必修二专题10 理想气体状态方程——教师版

专题10 理想气体状态方程(教师版)一、目标要求二、知识点解析1.气体的等温、等容和等压变化(1)气体实验定律气体的温度、体积和压强这三个状态参量之间存在一定的关系,我们从三个角度分别探讨它们之间的联系.图1、图2和图3分别表示气体在等温、等容和等压下的各状态参量之间的关系:注意:只有取开尔文温标时,等容变化和等压变化的正比关系才成立. 2.气体压强的微观解释①压强:从微观角度来看,气体对容器的压强是由于大量气体分子对容器的撞击引起的,气体的温度越高,气体分子的密集程度(单位体积内的分子数)越大,气体对容器的压强越大;注意:与气体对容器的压强不同,大气压强是由地球的吸引产生的; ②微观理解a .一定质量的气体温度不变时,平均动能不变,压缩体积使得气体分子密集程度增大,则压强增大;b .一定质量的气体体积不变时,升高温度使得气体分子的平均动能增加,在相同密集程度下撞击容器时的作用力更大,则压强增大;c .一定质量的气体压强不变时,升高温度,分子平均动能增大,为使气体的压强不变,气体只能减小分子的密集程度,即体积增大.3.理想气体状态方程 (1)理想气体①定义:气体实验定律只有在温度变化不大(相比室温)、压强变化不大(相比大气压)的情况下才成立,为研究方便,假设一种气体,在任何温度和任何压强下都符合实验定律,这种气体被称为理想气体;实际气体在温度变化不大(相比室温)、压强变化不大(相比大气压)时可以视作理想气体;②性质:理想气体中的分子忽略自身体积,可视作质点;不考虑分子间的作用力,即分子运动时做匀速直线运动,且不计分子势能;分子与分子、分子与容器的碰撞都是完全弹性的;(2)理想气体状态方程设一定质量的理想气体在1状态时的温度、压强和体积分别为T 1、p 1、V 1,在2状态时的温度、压强和体积分别为T 2、p 2、V 2,则有:112212p V p V T T理论表明,考虑理想气体的数量关系,理想气体状态方程为:pV=nRT 其中n 为理想气体的物质的量.三、考查方向图1图2图3题型1:气体压强的微观解释典例一:(2017•朝阳区二模)科学精神的核心是对未知的好奇与探究,小君同学想寻找教科书中“温度是分子平均动能的标志”这一结论的依据,他以氦气为研究对象进行了一番研究,经查阅资料得知:第一,理想气体的模型为气体分子可视为质点,分子间除了相互碰撞外,分子间无相互作用力;第二,一定质量的理想气体,其压强p 与热力学温度T 的关系式为p nkT =,式中n 为单位体积内气体的分子数,k 为常数。
人教版九年级物理下册第十三章内能第二节《内能》教案

内能教学目标1、知识与技能:让学生了解内能的概念;能简单描述温度和内能的关系;知道改变物体内能的方法。
2、过程与方法:通过探究找到改变物体内能的两种方法;通过学生查找资料,了解地球的“温室效应”。
3、情感态度与价值观:通过探究,使学生体验探究的过程,激发学生主动学习的兴趣。
同时鼓励学生自己查资料,培养学生自学能力和环保意识。
教学重难点重点:改变内能的两种方法。
难点:内能的概念。
教法学法教法:本节课在教学中通过演示实验,以学生观察、讨论为主,充分发挥学生的学习自主性。
教师借助于类比法,以旧知识带动新知识的学习,在学生讨论的基础上归纳总结,起到画龙点睛的作用。
学法:观察法(通过演示实验,观察现象,分析原因);讨论法(通过共同讨论,高度参与,路找原因);实例列举法(通过举例,理解改变内能的两种方式)。
总之,在整堂课中,把练习的机会留给学生,把说话的机会也尽量留给学生,达到完成本节教育教学目的。
教学过程导入新课:你见流星或者流星雨吗?每年的11月14日至21日左右天空就会出现流星或者流星雨,这些流星其实就是坠落到地面的陨石,陨石本身是不会发光,为什么我们在漆黑的夜里能见到它们呢?这节课我们一起探讨陨石下落过程为什么会发光。
教师板书课题:内能科学探究学生自主学习,阅读课本P127最后一段,回答下列问题。
比较 1 :运动的物体具有动能;而构成物质的每一个分子都在不停地做无规则运动,所以运动的分子也具有能。
比较2:弹簧受到拉伸或压缩时发生形变,从而使弹簧具有弹性势能;而构成物质的分子之间也存在引力或斥力,因此分子间还存在势能。
小结:⑴物体内部所有分子热运动的能与分子能的总和,叫做物体的内能。
⑵一切物体都有内能,内能的单位是,用字母表示。
练习1.0℃的冰块有没有内能?答:我们知道,物质是由分子构成的,固态的冰块是由分子按一定的稳定结构有规律地排列形成的晶体结构,由现象可知,一切物质的分子不停地做着的运动,运动着的分子具有,0℃的冰块也不例外。
(完整版)理想气体内能
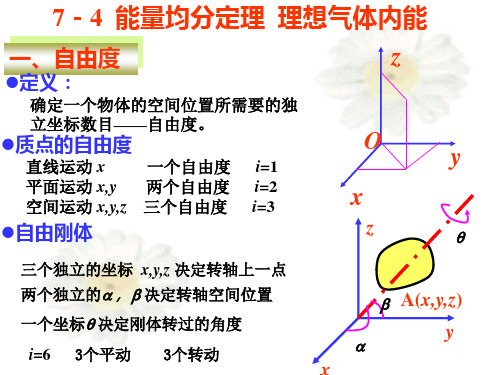
一、自由度
定义:
确定一个物体的空间位置所需要的独 立坐标数目——自由度。
质点的自由度
直线运动 x 一个自由度 i=1 平面运动 x,y 两个自由度 i=2 空间运动 x,y,z 三个自由度 i=3
自由刚体
三个独立的坐标 x,y,z 决定转轴上一点
两个独立的a, b 决定转轴空间位置
热力学系统的内能是指气体分子各种形态的动能与势能的总 和。即系统所包含的全部分子的能量总和称为系统的内能。
理想气体内能公式
理想气体内能是分子平动动能与转动动能之和
分子的自由度为i,则一个 说明:
分子能量为ikT/2, 1摩尔理 •理想气体的内能与温度和分子的想气体,有个NA分子源自内能 E= i 2kT
克劳修斯指出:气体分子的速度虽然很大,但前 进中要与其他分子作频繁的碰撞,每碰一次,分 子运动方向就发生改变,所走的路程非常曲折。
在相同的t时间内,分子由A到
B的位移大小比它的路程小得多
A• •B
扩散速率
平均速率
(位移量/时间) (路程/时间)
分子自由程: 气体分子两次相邻碰撞之间自由通过的路程。
C p,m
i
2 2
R
C p,m CV ,m
i2 i
对于单原子分子与双原子 分子,理论与实验符合得 很好,而对于多原子分子, 理论与实验相差较大。
气体
理论值
CV,m CP,m
γ
实验值
CV,m
CP,m
γ
He
12.61 20.95 1.66
12.47 20.78 1.67
Ne
12.53 20.90 1.67
一个坐标q 决定刚体转过的角度
2.3.2理想气体的状态方程(教学课件)高中物理(人教版2019选择性)

p1V1=p2V2
(1)宏观表现:一定质量的理想气体,在温度保持不变时,体积减小,压强增
大;体积增大,压强减小.
(2)微观解释:温度不变,分子的平均动能不变.体积减小,分子越密集,单
位时间内撞到单位面积器壁上的分子数就越多,气体的压强就越大.
用分子动理论解释查理定律
p1
p2
合理性及其物理意义.
小试牛刀
一定质量的理想气体,在某一平衡态下的压强、体积和温度分别为p1、V1、T1,
在另一平衡态下的压强、体积和温度分别为p2、V2、T2,下列关系可能正确的
是( D )
A.p1=p2,V1=2V2,T1= T2
B.p1=p2,V1= V2,T1=2T2
C.p1=2p2,V1=2V2,T1=2T2
当压强很大、温度很低时,由气体实验定律计算的结果与实际测量
结果有很大的差别.
不过,在通常的温度和压强下,很多实际气体,特别是那些不容
易液化的气体,如氢气、氧气、氮气、氦气等,其性质与实验定律的
结论符合的很好.
为了研究方便,可以设想一种气体,它在任何温度、任何压强下都
能严格地遵从气体实验定律,我们把这样的气体叫做“理想气体”.
在完全失重状态下将不再产生压强.
气体压强和大气压的区别
气体压强
①因密闭容器内的气体分子的密集程度
一般很小,由气体自身重力产生的压强
极小,可忽略不计,故气体压强由气体
分子碰撞器壁产生
区别
②大小由气体分子的密集程度和温度决
定,与地球的引力无关
③气体对上下左右器壁的压强大小都是
相等的
联系
大气压强
大学物理(12.4.1)--能量均分定理理想气体内能

一、自由度力学中要确定一个物体在空间的位置所需要的独立坐标数目,叫做这个物体的自由度。
在热力学中一般不涉及原子内部的运动,仍将原子当作质点而将分子当作是由原子质点构成的。
一个要确定一个自由运动质点的空间位置需要3个独立坐标,因此单原子分子的自由度是3,即它有3个平动自由度。
对于刚性(原子间的相对位置不变)双原子分子气体,可看作两个原子(质点)被一条直线连接,需要用3个坐标确定其质心的位置,再用2个坐标确定其连线的方位,因此刚性双原子分子气体的自由度为5。
对于刚性多原子分子,具有3个平移自由度和3个转动自由度,总自由度为6。
二、能量按自由度均分定理1.能量按自由度均分定理理想气体分子平均平动动能 kT k 23=ε 222221212121z y x k v m v m v m v m ++==ε 又 222231v v v v z y x === 有 kT v m v m v m z y x 21212121222===这表明,气体分子沿x 、y 、z 三个方向的平均平动动能都相等,且都等于kT /2。
因为在温度公式中的分子是看作质点的,它只有三个自由度,而这个结果说明,每个分子的平均平动动能是均匀地分配给每个自由度,即每个自由度都均匀地分配了kT /2的能量。
这个现象可以这样解释:气体平衡态的建立和维持,是靠分子无规则运动和频繁碰撞实现的,在碰撞过程中,能量可以从一个分子传到另一个分子,也可以由一种运动形式转化成另一种运动形式,也可以从一个自由度转移到另一个自由度,这些转变是无规则的,但总的趋势是各种形式的平均能量趋于相等,这一结论是否可以推广到转动和振动上呢?经典统计物理已经证明了这一点:在温度为T 的平衡状态下,分子的每一个自由度上都具有相同的平均能量,其大小都为kT /2。
2.说明:1)能量均分定理是统计规律,是大量分子的整体表现。
对单个分子而言,分子的能量并不一定是均分分配的,但由于分子间的相互碰撞,在相互碰撞中分子可以交换能量;对于某一自由度来说,其上的能量也不一定均匀的,但由于分子的无规则运动和分子间的相互碰撞,使得在各个自由度上的能量不断“搅拌”,最后达到均匀。
第二章理想气体性质

2 N pv=RT,R NB,N= 3 m 2 2 N 2N MR= MNB= M B= B 3 3 m 3 n0 m N n0= ,摩尔数,则 表示每摩尔物质所具有 M n0 N 的分子数,由阿佛家得罗定律可知, 为常数 n0 令MR=R 0,则R 0为常数。且与物质种类无关。
思考:
注意!
体积热容的容积是标准状态下的容积。 三种热容间的换算关系:
3种不同单位的比热的关系:
Mc c c 0 22.4
二、定容比热与定压比热
1、定容比热:定容情况下,单位物量的物体, 温度变化1k所吸收或者放出的热量,称为 该气体的定容比热。
cv
qv
dT
2、定压比热 定压比热:定压条件下,单位物量 的物体,温度变化1k所吸收或者放 出的热量,称为该气体的定压比热。
cp cv=R cp k cv
得到比热的计算式
R cv k 1 kR cp= k 1
验证,对于空气,按双原子气体
R 0.287 cv 0.72kJ / kg k k 1 1.4-1 5 8.314 Mcv 2 cv= 0.72kJ / kg k M 28.97
i2 k i
真实比热与平均比热
真实比热:
Mcp a0 aiT
i 1
n
i
Mcv Mcp R 0 a0 R 0 aiT
i 1
n
i
平均比热:
根据面积相等原理 q cdt cm t2 t1 t
t2
1
q cdt= cdt cdt c | -c |
实际气体( real gas)
实际气体: 如果气体有很高的密 度,以致气体本身的分子体积及分 子间作用力不能忽略不计时,就为 实际气体了。“制冷剂”或“蒸汽” 是实际气体。不能用简单的式子描 述.
初中物理人教版九年级第一单元第2课《内能》优质课公开课教案教师资格证面试试讲教案

初中物理人教版九年级第一单元第2课《内能》优质课公开课
教案教师资格证面试试讲教案
初中物理人教版九年级第一单元第2课《内能》优质课公开课教案教师资格证面试试讲教案
1教学目标
1、知识与技能
了解内能的概念,知道影响内能大小的因素。
知道改变内能的两种方式并能联系实际列举生活中内能改变的实例。
了解热量的概念,热量的单位是焦耳。
2、过程与方法
通过探究找到改变物体内能的多种方法。
通过演示实验说明做功可以使物体内能增加和减少。
通过学生查找资料,了解地球的“温室效应”。
3、情感态度与价值观
通过探究,使学生体验探究的过程,激发学生主动学习的兴趣。
通过演示实验,培养学生的观察能力。
鼓励学生自己查找资料,培养学生自学的能力。
2学情分析
1、通过回顾机械能引入内能,学生较易接受,但要避免学生将内能与机械能混淆。
2、通过演示实验探究做功对物体内能的改变,会激发学生的学习兴趣,但要注重引导学生对实验现象的观察以及对产生原因的分析。
3重点难点
重点:内能、热量概念的建立,改变物体内能的方法。
难点:内能与温度的关系;做功和热传递在改变物体内能上是等效的4教学过程
4.1第一学时
4.1.1教学活动。
高中物理内能教案范文

一、教学目标1. 让学生理解内能的概念,掌握内能的计算方法。
2. 让学生了解内能与温度、物质状态、分子运动等因素的关系。
3. 培养学生运用物理知识解决实际问题的能力。
二、教学内容1. 内能的概念及其单位。
2. 内能的计算方法:内能=3/2nRT(理想气体)。
3. 内能与温度、物质状态、分子运动等因素的关系。
4. 实际物体内能的测量方法。
三、教学重点与难点1. 内能的概念及其单位。
2. 内能的计算方法:内能=3/2nRT(理想气体)。
3. 内能与温度、物质状态、分子运动等因素的关系。
四、教学方法1. 采用问题驱动的教学方法,引导学生通过探究、发现、解决问题的方式掌握内能的概念、计算方法和影响因素。
2. 利用实验、图片、动画等教学资源,帮助学生形象直观地理解内能的概念和影响因素。
3. 采用小组讨论、自主学习等教学方式,培养学生的合作精神和自主学习能力。
五、教学过程1. 导入:通过一个实际例子(如冬天烤火取暖)引入内能的概念,引导学生思考什么是内能,为什么物体有内能。
2. 内能的概念及其单位:讲解内能的定义,让学生理解内能是物体内部所有分子动能和分子势能的总和,并介绍内能的单位(焦耳)。
3. 内能的计算方法:讲解理想气体内能的计算方法,让学生掌握内能=3/2nRT(其中n为气体物质的量,R为气体常数,T为气体的绝对温度)的公式,并通过例题让学生熟悉该公式的运用。
4. 内能与温度、物质状态、分子运动等因素的关系:讲解内能与温度、物质状态、分子运动等因素的关系,让学生了解温度越高,内能越大;物质状态不同,内能也不同;分子运动越剧烈,内能也越大。
5. 实际物体内能的测量方法:讲解实际物体内能的测量方法,如比热容法、热传导法等,让学生了解如何测量实际物体的内能。
六、教学评估1. 课堂问答:通过提问方式检查学生对内能概念的理解和内能计算公式的掌握情况。
2. 练习题:布置一些有关内能计算和影响因素的练习题,以便及时发现和纠正学生的错误。
理想气体的内能和功教案理想气体的内能和功的计算

理想气体的内能和功教案理想气体的内能和功的计算理想气体的内能和功教案理想气体是物理学中一个重要的概念,指的是分子之间几乎没有相互作用的气体。
在研究理想气体时,我们需要了解其内能和功的计算方法,这对于理解气体的性质和行为非常重要。
一、理想气体的内能理想气体的内能指的是气体中所有分子的动能之和,可以用如下公式进行计算:E = (3/2) * nRT其中,E表示气体的内能,n表示气体内分子的个数,R表示气体常数,T表示气体的温度。
从上面的公式中可以看出,气体的内能与温度有关,随温度的升高而增加。
二、理想气体的功理想气体的功指的是气体在体积变化时所做的功,可以用如下公式进行计算:W = - PΔV其中,W表示气体所做的功,P表示气体的压强,ΔV表示气体的体积变化量。
由于气体是理想气体,因此它的压强与体积之间存在着如下的关系:P * V = nRT由上式可以得到:P = (nRT) / V将上式代入到计算气体功的公式中,可以得到如下结果:W = - nRTln(Vf/Vi)其中,Vi和Vf分别表示气体的初始体积和末状态的体积。
三、理想气体的内能和功的关系根据热力学第一定律,气体的内能等于其所做的功和传递给它的热量之和。
因此,我们可以将理想气体的内能和功的公式结合起来,得到如下结果:ΔE = Q + W其中,ΔE表示气体内能的变化量,Q表示传递给气体的热量,W 表示气体所做的功。
如果气体在定压条件下,内能的变化量可以表示为:ΔE = (3/2)nRΔT + PΔV从上式中可以看出,在定压条件下,气体从温度Ti变化到温度Tf 时,气体内能的变化量可以表示为:ΔE = (5/2)nRΔT综上所述,理想气体的内能和功的计算方法需要结合热力学第一定律来进行理解。
研究理想气体的内能和功不仅有助于我们掌握气体这一物态的基本性质,还可以拓展我们对于热力学和物理学的认识和理解。
知识点:理想气体的内能和焓变化量的计算PPT.

h c pm t02 t2 c pm t01 t1
(7)
知识点:理想气体内能和焓变化量的计算
1.理想气体内能变化量的计算 对于理想气体的定容过程, w 0 ,于是由闭口系统能 量方程有 qv duv ,再由热量计算式 qv cv dT 合并两式可得 duv cv dT
对于理性气体,内能是温度的单值函数,理想气体的内 能变化量为 (1) du cv dT
合并两式可得 dhp c p dT
对于理性气体,焓是温度的单值函数,理想气体焓的变
知识点:理想气体内能和焓变化量的计算
化量为
dh c p dT
(5) (5a)
h c p dT12式(5)是通过定压过程推导得出焓变化值的计算公式, 但是,由于理想气体的焓仅是温度的单值性函数,与比容或 压力无关。因此,上式可用于计算理想气体任何过程的焓变 化。 若按定值比热计算,理想气体的焓变化为 (6) h c p (T2 T1 ) 若按平均比热计算,理想气体的焓变化为
知识点:理想气体内能和焓变化量的计算
为
wp pdv p (v2 v1 )
1
2
将其代入闭口系统能量方程
q p u wp u2 u1 p(v2 v1 )
再由焓的定义式h=u+pv,得 q p h2 h1 或 q p dhp 定压过程的吸热量,还可以用定压比热计算 q p c p dT
u cv (T2 T1 )
u cvm t02 t 2 cvm t01 t1
2.理想气体焓的变化量的计算
(3)
知识点:理想气体内能和焓变化量的计算
(1)工质的焓 前面讲过,对开口系统随物质流传递的能量有四种,即 内能、宏观动能、重力势能和流动功。对1kg工质,随物质流 传递的能量为 1 2 u c gz pv 2 其中u和pv取决于工质的热力状态,为了简化计算,热力 学中引入一个新的物理量—焓。 J H U pV 令 J/kg (4) h u pv 或 H称为总焓,h称为比焓,简称为焓,从上式中可得,由 于u和p、v都是工质的状态参数,所以焓也是工质的状态参数
知识点:理想气体的内能和焓变化量的计算PPT.

合并两式可得 dhp c p dT
对于理性气体,焓是温度的单值函数,理想气体焓的变
知识点:理想气体内能和焓变化量的计算
化量为
dh c p dT
(5) (5a)
h c p dT
1
2
式(5)是通过定压过程推导得出焓变化值的计算公式, 但是,由于理想气体的焓仅是温度的单值性函数,与比容或 压力无关。因此,上式可用于计算理想气体任何过程的焓变 化。 若按定值比热计算,理想气体的焓变化为 (6) h c p (T2 T1 ) 若按平均比热计算,理想气体的焓变化为
知识点:理想气体内能和焓变化量的计算 对于理想气体 h u pv u RT f (T ) 上式表明,对于理想气体的焓值和内能一样,也是温度 的单值函数。 焓在热力学中是一个重要而常用的状态参数,它的应用 对热力学问题的分析和求解带来很大的方便。对于开口系统 焓是内能和流动功之和,焓具有能量意义,它代表物质流传 递的四部分能量中取决于热力状态的那两部分能量。若流动 工质的动能和位能可以忽略,则焓代表随流动工质传递的总 能量。在没有物质流的闭口系统中,由于没有工质的流进和 流出,pv不代表流动功,所以,焓只是一个复合状态参数。 (2)理想气体焓的变化量的计算 对于理想气体的定压过程,压力p=常数,其容积变化功
知识点:理想气体内能和焓变化量的计算
为
wp pdv p (v2 v1 )
1ቤተ መጻሕፍቲ ባይዱ
2
将其代入闭口系统能量方程
q p u wp u2 u1 p(v2 v1 )
再由焓的定义式h=u+pv,得 q p h2 h1 或 q p dhp 定压过程的吸热量,还可以用定压比热计算 q p c p dT
人教版高中物理全套教案和导学案1.5理想气体的内能

§1.5 理想气体的内能1.5.1、物体的内能(1)自由度:即确定一个物体的位置所需要的独立坐标系数,如自由运动的质点,需要用三个独立坐标来描述其运动,故它有三个自由度。
分子可以有不同的组成。
如一个分子仅由一个原子组成,称为单原子(例:He等),显然它在空间运动时具有三个平动自由度。
如一个分子由两个原子组成,称为双原子(例:2H等),双原子分子内的两个原子由一个键所连接,确定两个原子共同质心的位置,需三个自由度,确定连键的位置,需两个自由度,即双原子分子共有五个自由度。
而对三原子分子(例:2CO等),除了具有三个平动自由度、两个转动自由度外,还有一个振动自由度,即共计有六个自由度。
(2)物体中所有分子热运动的动能和分子势能的总和称为物体的内能。
由于分子热运动的平均动能跟温度有关,分子势能跟体积有关。
因此物体的内能是温度和体积的函数。
理想气体的分子之间没有相互作用,不存在分子势能。
因此理想气体的内能是气体所有分子热运动动能的总和,它只跟气体的分子数和温度有关,与体积无关。
1.5.2、理想气体的内能通常,分子的无规则运动表现为分子的平动和转动等形式。
对于单原子分子(如He等)的理想气体来说,分子只有平动动能,其内能应是分子数与分子平均平动动能的乘积,即kTNE23⋅=。
对于双原子分子(如2N、2O)的理想气体来说,在常温下,分子运动除平动外还可以有转动,分子的平均动能为kT 25,其内能kT N E 25⋅=,因此,理想气体的内能可以表达为PV i RT M mi kT i N E 222==⋅=注意:M m N N A //=,k N R A =;对于原单原子分子气体3=i ,对于双原子分子气体5=i 。
一定质量的理想气体的内能改变量:T C M n T R i M m E V ∆=∆=∆)2(此式适用于一定质量理想气体的各种过程。
不论过程如何,一定质量理想气体的内能变不变就看它的温度变不变。
物理人教版九年级全一册 《内能》名师教案2
实验B要让学生看,还要做。教师要让两组同学来做这个实验,第一次粗做,第二次细做。详细描述实验看到的、体验到的感受。
3.两种方式改变内能的本质。
让学生从能量转化角度,分析一下这两种方式的本质。
引导学生总结:
一切物体都有内能;内能大小不仅和物体温度有关,还和质量,物态、体积等因素有关;
1.注意区分宏观的机械运动和微观的分子热运动。
马上盖上塞子,再次向瓶内打气,则会看到。
2.在下列的选项中,通过做功实现物体内能改变的是()
A.在炎热的夏天,在啤酒中放入一些冰块,啤酒变凉
B.太阳能热水器水箱中的水被晒热
C.行驶的汽车,轮胎会变热
D.划火柴,火柴燃烧
3.美国宇航局的科学家们认为,在美国东海岸出现的“天空火球”现象是由于小行星进入了地球大气层。请同学们尝试解释这个罕见的现象。
内能教案
课题
内能
授课人
课型
新知课
使用
教学目标
1.通过实验观察,能简单描述同一物体其内能随温度变化的关系。
2.通过实验和体验活动,知道通过做功和热传递的方法可以改变内能。能判断热物体内能是否发生改变,和用什么方法改变内能。了解热量的概念。
教材分析
重点
1.了解内能的概念,简单描述温度和内能的关系。
2.知道改变内能的两种方法,举出相关事例。
3.做功
对物体做功,物体内能增加,温度升高;
物体对外做功,物体内能减小,温度降低。
4.做功和热传递的本质
做功:机械能和内能的相互转化;
热传递:内能的转移;
作业布置
难点
1.用做功和热传递改变物体内能的本质。
2.了解热量的概念。
教学方法
讲授法、讨论法、演示实验法、列举实例法、多媒体课件演示法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 理想气体的压强,温度的微观解释2. 理想气体的内能3. 热力学第一定律知识点拨一.理想气体的微观模型先来作个估算:在标准状态下,1mol 气体体积1330104.22--⨯=moI m V ,分子数1231002.6-⨯=moI N A ,若分子直径m d 10100.2-⨯=,则分子间的平均间距m N V L A 93/101034.3)/(-⨯==,相邻分子间的平均间距与分子直径相比17/≈d L 。
由此可知:气体分子间的距离比较大,在处理某些问题时,可以把气体分子视为没有大小的质点;同时可以认为气体分子除了相互碰撞或者跟器壁碰撞之外,分子力也忽略不计,分子在空间自由移动,也没有分子势能。
因此理想气体是指分子间没有相互作用和分子可以看作质点的气体。
这一微观模型与气体愈稀薄愈接近于理想气体的宏观概念是一致的。
1.理想气体的压强宏观上测量的气体施给容器壁的压强,是大量气体分子对器壁不断碰撞的结果。
在通常情况下,气体每秒碰撞21cm 的器壁的分子数可达2310。
在数值上,气体的压强等于单位时间内大量分子施给单位面积器壁的平均冲量。
可以用动量定理推导,其表达式为K n P ε32=设气体分子都以平均速率v 运动,因沿上下、左右、前后各向运动的机会均等,所以各占总数的16.若分子的数密度(即单位体积内气体的分子数)为n ,则单位时间内碰撞单位面积器壁的分子数应为1(1)6n v ×.每个分子每次与器壁碰撞时将施于器壁2mv 的冲量,所以压强211(1)263p n v mv nmv ==××,假设每个分子的速率相同.每个分子的平均平动动能2k 1ε2mv =,所以2k 12ε33p nmv n ==.,式中n 是单位体积内分子个数,221υεm K=是分子的平均平动动能,n 和K ε增大,意味着单位时间内碰撞单位面积器壁的分子数增多,分子碰撞器壁一次给予器壁的平均冲量增大,因而气体的压强增加。
从上述的分析可以看出,气体压强是有气体分子热运动产生的,所以即便到了完全失重的环境,液体对容器壁的压强消失,但是气压仍然存在。
2.温度的微观意义将RT PV γ=与A N N =γ代入K n P ε32=式后,可以得到气体分子的平均平动动能为 知识体系介绍第二讲 理想气体的内能kT K 23=ε以上γ是物质的量,N 为分子总数,N A 为阿伏伽德罗常数,n 为单位体积分子个数,AN R k =称为玻尔兹曼常数。
这就是气体温度公式,温度升高,分子热运动的平均平动动能增大,分子热运动加剧。
因此,气体的温度是气体分子平均平动能的标志,是分子热运动剧烈程度的量度。
3.内能物体中所有分子热运动的动能和分子势能的总和称为物体的内能。
由于分子热运动的平均动能跟温度有关,分子势能跟体积有关。
因此物体的内能是温度和体积的函数。
理想气体的分子之间没有相互作用,不存在分子势能。
因此:理想气体的内能是气体所有分子热运动动能的总和,它只跟气体的分子数和温度有关,与体积无关。
理想气体的内能决定式推导:通常,分子的无规则运动表现为分子的平动和转动等形式。
对于单原子分子的理想气体来说,分子只有平动动能,其内能应是分子数与分子平均平动动能的乘积,即kTN E 23⋅=。
对于双原子分子(如2N 、2O )的理想气体来说,在常温下,分子运动除平动外还可以振动,分子的平均动能为kT25,其内能kT N E 25⋅=,因此,理想气体的内能可以表达为PViRT M mi kT i N E 222==⋅=对于原单原子分子气体3=i ,对于双原子分子气体5=i ,对多原子分子6=i 一定质量的理想气体的内能改变量:T C M nT R i M m E V ∆=∆=∆)2(此式适用于一定质量理想气体的各种过程。
不论过程如何,一定质量理想气体的内能变不变就看它的温度变不变。
式中Ri C V 2=,叫气体的等容热容,表示1mol 的理想气体温度升高或降低1K 所增加或减少的内能。
T C Mn E V∆=∆是可以变成 )(2)(21122V P V P i PV i E -=∆=∆ 二.热力学第一定律作功可以改变物体的内能。
如果外界对系统作功W 。
作功前后系统的内能分别为1E 、2E ,则有W E E =-12没有作功而使系统内能改变的过程称为热传递或称传热。
它是物体之间存在温度差而发生的转移内能的过程。
在热传递中被转移的内能数量称为热量,用Q 表示。
传递的热量与内能变化的关系是Q E E =-12做功和传热都能改变系统的内能,但两者存在实质的差别。
作功总是和一定宏观位移或定向运动相联系。
是分子有规则运动能量向分子无规则运动能量的转化和传递;传热则是基于温度差而引起的分子无规则运动能量从高温物体向低温物体的传递过程。
2气体体积功的计算在力学中,功定义为力与位移这两个矢量的标积。
对封闭气体,设有一气缸,其中气体的压强为P ,活塞的面积S 。
当活塞缓慢移动一微小距离x ∆时,在这一微小的变化过程中,认为压强P 处处均匀而且不变。
气体对外界所作PSx∆的元功V p x pS W ∆=∆=',外界(活塞)对气体做功V p W W ∆-='-=,当气体膨胀时V ∆>0,外界对气体做功W <0;气体压缩时V ∆<0,外界对气体做功W >0。
气体做功过程可用p-V 图上一条曲线来表示,功值W 为p-V 图中过程曲线下的面积,当气体被压缩时W >0。
反之W <0。
如图所示的由A 态到B 态的三种过程,气体都对外做功,由过程曲线下的面积大小可知:ACB 过程对外功最大,AB 次之,ADB 的功最小。
由此可知,在给定系统的初态和终态,并不能确定功的数值。
功是一个过程量,只有当系统的状态发生变化经历一个过程,才可能有功;经历不同的过程,功的数值一般而言是不同的。
循环过程 若一系统由某一状态出发,经过任意的一系列的过程,最后又回到原来的状态,这样的过程称为循环过程.循环过程中系统对外所做的功 如图所示为某一系统的准静态循环过程.在膨胀过程1AC B 段,系统对外所做的功(1W )是正的,其数值与面积1AC BNMA 相等;在压缩过程2BC A 段,系统对外做功(2W )为负,其数值与面积2BC AMNB 相等.在一循环中系统对外所做的功W 就是这两段功的代数和(上述两个“面积”的差),即12W W W =+=面积1AC BNMA -面积2BC AMNB =面积12AC BC A .可见,在一循环中系统对外所做的功,数值上等于图所示pV 图中闭合曲线的“面积”.若循环沿顺时针方向进行。
这个功是正的,相应的循环称为正循环;若循环沿逆时针方向进行,一个循环中系统对外所做的功为负,数值仍等于闭合曲线所包围的面积,相应的循环称为负循环.现在开始我们将进入热学过程的分析与计算,这个过程要:1) 使用气态方程,分析PVT 之间的联动关系2) 使用膨胀做功的知识与热力学第一定律,再结合内能与温度的对应关系,分析吸放热,内能变化等现象。
例题精讲【例1】 如图所示,开口向上粗细均匀的玻璃管长100cm L =,管内有一段高20cm h =的水银柱,封闭着长为50cm a =的空气柱,大气压强076cmHg p =,温度027t =℃,求:温度至少升到多高时,可使水银全部溢出?【解析】 开始温度升高时,气体压强不变,气体体积膨胀,水银柱上升.当水银柱升至管口后,温度再升高,水银就开始溢出,这时气体的压强随水银的溢出而减小,气体的体积在不断增大,令剩余的水银柱的高度为x ,玻璃管的截面积为S . 气体的初状态 10p p h =+,1V a S =g ,127K 273K 300K T =+=. 气体的末状态 20p p x =+,2(100)V x S =-.根据理想气体状态方程 112212p V p VT T =,即 0002()()(100)273273p h a p x x t t ++-=++, 代入数据得 2(76)(100)965016273300x x t +-==+×.要使2t 最高,则(76)(100)x x +-必为最大.训练提示又因为76100176x x ++-=为常数,所以当76100x x +=-,即12cm x =时,(76)(100)x x +-有最大值.2(7612)(10012)16273t +-=+,2211t =℃,水银全部溢出.【例2】 如图所示,两个固定的水平气缸,由水平硬杆相连的活塞面积S A =0.8㎡,S B =0.2㎡,两气缸通过一根带阀门K 的细管连通,最初阀门关闭,A 内贮有气体,B 内为真空,两活塞分别与各自气缸底相距a =b =30cm ,活塞静止。
今将阀门K 打开,活塞将向何处移动?移动多远?(设温度不变,不计摩擦,大气压为p 0)【解析】受力分析知:K 关闭时A 中气体压强可算出,K 打开后,要A ,B 平衡,内外压强必须相等(除非A 中活塞到左端点),又温度不变,活塞必向左移动,根据气态方程不变得解,移动10cm 。
点评:此题不妨做个一题多变,1)a ,b 满足什么条件在打开K 后A 中活塞会顶到左端点。
2)a,b 分别处于不同的温度区,最终活塞位置如何?【例3】 一定质量的理想气体经历了p -T 图线所示ab 、bc 、cd 、da 四个过程,其中ab 垂直于OT ,bc 的延长线经过O 点,cd 平行于OT ,da 平行于cb ,由图可以判断( )A.ab 过程中气体的体积增大,分子平均动能不变。
B.bc 过程中气体的体积增大,内能减小。
C.cd 过程中气体的体积减小,分子平均动能减小。
D.da 过程中气体的体积增大,内能增大。
【答案】ACD (提示,注意PT 图过原点的直线的斜率正反比于体积)【例4】 (27界初赛)如图,a 和b 是绝热气缸内部的两个活塞,他们把气体分为等量的甲乙两部分,a是导热的,且位置固定,b 是绝热的,可以自由无摩擦滑动,但不漏气,b 右方为大气,图中k 为电热丝,开始时,系统处于平衡态,两部分气体压强温度一样,现接通电源,缓慢加热一段时间后,系统又处于平衡态,则( ) A. 甲乙中气体温度可能不变。
B. 甲乙压强都增加。
C. 甲乙内能都增加且增加量相等。
D. 电热丝放的热等于甲乙气缸中内能增加总和。
【答案】:C【例5】 如图所示,密闭绝热的具有一定质量的活塞,活塞的上部封闭着气体,下部为真空,活塞与器壁的摩擦忽略不计,置于真空中的轻弹簧的一端固定于容器的底部.另一端固定在活塞上,弹簧被压缩后用绳扎紧,此时弹簧的弹性势能为P E (弹簧处于自然长度时的弹性势能为零),现绳突然断开,弹簧推动活塞向上运动,经过多次往复运动后活塞静止,气体达到平衡态,经过此过程( )A .P E 全部转换为气体的内能。
