第10章含氮化合物3学时优秀课件
合集下载
《含氮化合物》课件

硝基化合物具有特征的紫外-可见光谱 和红外光谱,可用于鉴别和检测。
硝基化合物的溶解性
硝基化合物一般难溶于水,但可溶于 有机溶剂。溶解度受温度、压力、溶 剂类型等因素影响。
硝酸盐的物理和化学性质
01
02
03
硝酸盐的稳定性
硝酸盐在常温下稳定,但 在高温或酸性条件下可能 发生分解。
硝酸盐的溶解性
硝酸盐易溶于水,也是植 物生长所需的氮肥来源之 一。
硝基有机化合物
定义
结构特点
分类
性质
硝基有机化合物是一类含硝基 官能团的有机化合物,通常以 C-NO2形式存在。
硝基有机化合物的结构特点是 含有硝基官能团,硝基中的氮 原子与两个氧原子相连,形成 一个稳定的电子结构。
硝基有机化合物可以分为脂肪 族硝基化合物和芳香族硝基化 合物两类,根据硝基连接的碳 原子数,又可以分为一元硝基 化合物、二元硝基化合物和多 元硝基化合物。
氮气的物理和化学性质
物理性质
无色、无味、无毒的气体,标准 状况下密度为1.25g/L,沸点为195.8°C,熔点为-209.8°C。
化学性质
氮气是一种惰性气体,不易与其 他物质发生反应,但在高温、放 电等条件下可以与氧气、氢气等 发生反应。
氮气的制备和用途
制备方法
工业上主要采用分离液态空气法来制备氮气,实验室中可以用金属镁和氮化物 反应制备氮气。
用途
氮气是合成氨、尿素等含氮化合物的重要原料,也是工业上常用的保护气体, 可用于填充灯泡、食品保鲜、医疗麻醉等领域。此外,氮气也是一种无色无味 的惰性气体,可用于制作氮肥、硝酸、炸药等。
02 氨和铵盐
氨的物理和化学性质
物理性质
氨是一种无色、易挥发、有刺激性气 味的气体,沸点为-33.5℃,极易溶 于水,形成氨水。
《含氮化合物》PPT课件

放氮反应( 取代 )
偶联反应
重氮盐与酚或芳胺等化合物反应,由偶氮 基-N=N-将两个芳环连接起来,生成偶 氮化合物的反应称为偶联反应
偶联反应通常发生在羟基或氨基的对位 , 当对位被其它取代基占据时,则发生在邻 位。
脂肪叔胺与HNO2作用生成不稳定易水解 的盐,若以强碱处理,则重新游离析出叔胺
芳环上的亲电取代反应 氨基的供电子共轭效应使苯环上的电子云 密度升高,所以芳胺易进行芳环上的亲电 取代反应。 利用此性质可鉴别和定量分析苯胺。
氯磺化反应
芳香重氮盐的性质
放氮反应( 取代 ): 重氮基被其它基取代并 放出N2 留氮反应(偶联反应) : 产物分子中仍然保 留2个N
伯胺和仲胺可与 苯磺酰氯或对甲苯磺酰氯 反应 , 生成相应的磺酰胺。 叔胺不被磺酰化。
常利用此反应鉴别三类胺, 称为Hinsberg ( 兴斯堡) 试验法
酰化反应 伯胺和仲胺仍象氨一样能与酰卤、酸酐作 用生成酰胺。
与亚硝酸的反应
胺与亚硝酸作用 ,伯仲叔胺各不同 , 脂胺 芳胺有差异。可用于鉴别。
亚硝酸不稳定,只能在反应过程中由亚硝 酸盐与盐酸或硫酸作用产生。
脂肪伯胺与HNO2反应生成极不稳定的脂 肪重氮盐。
芳香伯胺与HNO2在低温(一般<5 ℃) 及过 量强酸水溶液中反应生成 芳香重氮盐 , 这个反应称为重氮化反应 。
脂肪仲胺和芳香仲胺与亚硝酸反应,都是 在氮上进行亚硝化,生成N亚硝基化合物 。
重点学习芳香族硝基化合物。
1.还原 硝基化合物被还原的最终产物是胺 。 还原 剂 、 介质不同时 , 还原产物不同。
2. 芳环上的亲电取代反应 -NO2是第二类定位基,使苯环钝化!所以,硝 基苯不能发生F-C反应!同理,所有间位定位基 都有如此性质 特点: ① 反应温度均高于苯;② 新引入基团上 硝基的间位。
氮及其化合物ppt课件

无论是单一气体 ( NO2 ),还是 NO、NO2、O2 中的两者或三者的混合气 体溶于水,若有气体剩余只能是 NO 或 O2 ,不可能是NO2。
二、一氧化氮和二氧化氮
4. 氮氧化物对环境的污染 (1)NOx在紫外线作用下与碳氢化合物发生 一系列光化学反应,产生光化学烟雾。 (2)NOx排入大气中后,与水反应生成HNO3 和HNO2,随雨雪降到地面形成酸雨。 (3)破坏臭氧层:NO2可使平流层中的臭氧减 少,导致地面紫外线辐射量增加。 (4)NO与血红蛋白结合使人中毒。
硝酸的酸性比磷酸强
化合价: -3、 0、 +2、 +3、 +4、 +5
一、氮气及氮的固定
1.氮气的物理性质
颜色 无色
气味 无味
状态 气体
液氮
密度 密度比空气稍小
水溶解 难溶
一、氮气及氮的固定
2.氮气的化学性质
化学式
N2
电子式
N
N
结构式
NN
共价三键、键能大,性质稳定,难与其他物质反应
N2 表现氧化性
课堂导入
“死亡谷”之谜 青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和
日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇 怪的是这里牧草茂盛,水草肥美,被当地牧民称为“死亡谷”。
考察队测定后发现,这里的磁场强度非常高。这里的地层, 除了分布着大面积的三叠纪火山喷发的强磁性玄武岩外,还有大 大小小30多个磁铁矿脉及石英闪长岩体。正是这些岩体和磁铁矿 产生了强大的地磁异常带。夏季,它使因昆仑山的阻挡而沿山谷 东西分布的雷、雨、云中的电荷常常在此汇集,形成超强磁场。 一旦遇到异物,便会发生尖端放电即产生雷击现象,使人和畜瞬 间死亡。巨大的磁力还导致了指南针失灵,仪器不准。
二、一氧化氮和二氧化氮
4. 氮氧化物对环境的污染 (1)NOx在紫外线作用下与碳氢化合物发生 一系列光化学反应,产生光化学烟雾。 (2)NOx排入大气中后,与水反应生成HNO3 和HNO2,随雨雪降到地面形成酸雨。 (3)破坏臭氧层:NO2可使平流层中的臭氧减 少,导致地面紫外线辐射量增加。 (4)NO与血红蛋白结合使人中毒。
硝酸的酸性比磷酸强
化合价: -3、 0、 +2、 +3、 +4、 +5
一、氮气及氮的固定
1.氮气的物理性质
颜色 无色
气味 无味
状态 气体
液氮
密度 密度比空气稍小
水溶解 难溶
一、氮气及氮的固定
2.氮气的化学性质
化学式
N2
电子式
N
N
结构式
NN
共价三键、键能大,性质稳定,难与其他物质反应
N2 表现氧化性
课堂导入
“死亡谷”之谜 青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和
日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇 怪的是这里牧草茂盛,水草肥美,被当地牧民称为“死亡谷”。
考察队测定后发现,这里的磁场强度非常高。这里的地层, 除了分布着大面积的三叠纪火山喷发的强磁性玄武岩外,还有大 大小小30多个磁铁矿脉及石英闪长岩体。正是这些岩体和磁铁矿 产生了强大的地磁异常带。夏季,它使因昆仑山的阻挡而沿山谷 东西分布的雷、雨、云中的电荷常常在此汇集,形成超强磁场。 一旦遇到异物,便会发生尖端放电即产生雷击现象,使人和畜瞬 间死亡。巨大的磁力还导致了指南针失灵,仪器不准。
10含氮化合物

产物复杂,无制备意义 用于伯胺的定量分析
- H+ CH3CH2CH CH2
(CH2)n
OH C
HNO2
CH2NH2
(CH2)n+1
CO
用于制备O5~rg9a元nic 环Ch酮em
ii. 仲胺
R2NH HNO2
R2N N O
Ph N H HONO Ph N NO
CH3
CH3
iii. 叔胺
R3N + HONO
(1) CH3
甲胺
SO2Cl CH3NH2 CH3
SO2NHCH3 HNO2
对甲苯磺酰氯
对甲苯磺酰胺
CH3
NaOH SO2NCH3
CH3
SO2ONa + CH2N2 +H2O
NO
对甲苯磺酸钠
O
O
(2) NH2 C NH2 + CH3NH2 HCl NaNO2 NH2 C N CH3
碳酰胺 尿素
甲胺盐酸盐
pKb
3—4.5 4.76 9—10
Organic Chem
a. 胺的碱性与酸性
在脂肪胺中: NH3< RNH2 ? R2NH < R3N
Organic Chem
一些常见的胺的pKb值:
化合物 pKb(25℃)
NH3
4.75
CH3NH2 3.38
(CH3)2NH 3.27 (CH3)3N 4.21
MS:
(与溶剂的性质,溶液浓度,温度等影响氢键缔合的 因素有关,可用D2O交换判定)
R-NH2 M+ 小 Ar-NH2 M + 大
R' +.
RCN
R''
氮及其化合物(最新课件ppt)

不用KI淀粉试纸鉴别NO2与溴蒸气。
(3)因在常温常压下发生反应2NO2 N2O4,所以通 常“纯净”的NO2或N2O4并不纯.由于此可逆反应的发 生,通常实验测得NO2的相对分子质量大于它的实际 值。
2.氮的氧化物溶于水的计算 (1)方程式法 有关化学反应方程式 3NO2+H2O===2HNO3+NO① 4NO2+O2+2H2O=4HNO3② 4NO+3O2+2H2O===4HNO3③ 2NO+O2===2NO2④
3.氮的氧化物对大气的污染与防治 (1)
(2)
(3)
①无色
②无味
③不
④小
⑤N2+O2
放电 =====
2NO
⑥N2+3H2
高温高压 催化剂
2NH3
⑦N2+3Mg
点燃 =====
Mg3N2
⑧
合成氨 ⑨自然固氮 ⑩无 ⑪红棕色 ⑫无 ⑬刺激性
⑭ 有 ⑮ 有 ⑯ 大 ⑰ 大 ⑱ 不 溶 ⑲ 2NO+ O2===
一、氮气及氧化物
1.氮气
(1)物理性质
颜色 气味
溶解性
密度
①____ ②____ ③____溶于水 比空气④____
(2)化学性质
注意 (1)不能用向下排空气法收集N2, (2)N2化学性质不活泼,但N元素为活泼非金属元 素。
(3)氮的固定
2.氮的常见氧化物
思考1 如何鉴别NO2与溴蒸气? 【提示】 由于NO2和Br2在性质上有不少相似性: ①均具有氧化性;②溶于水均有酸生成;③均可与碱反 应;④均为红棕色等。所以不能用淀粉-KI试纸、pH 试纸、NaOH溶液来鉴别,但二者性质又有差别,可以 用下列方法鉴别:①AgNO3溶液;②CCl4;③用水洗 法。
A.NO2:17mL;O2:13mL B.NO2:27mL;O2:3mL C.NO2:15mL;O2:15mL D.NO2:25mL;O2:5mL
有机化学 含氮化合物PPT课件

RX R2NH
RX R3N
R4N+X--
四、与亚硝酸反应
亚硝酸(HNO2 )不稳定, 反应时由 亚硝酸钠与盐酸或硫酸作用而得。
1、脂肪胺与HNO2的反应:
第32页/共96页
RCH2CH2NH2 NaNO2 + HCl 低温
RCH2CH2N2Cl 重氮盐
分解 RCH2CH2 + N2 + Cl
生成的碳正离子可以发生各种不同 的反应生成烯烃、醇和卤代烃。
R4NX 季铵盐
ArNR2
R4NOH 季铵碱
必须注意区分“胺”、“铵”、“氨”的用法。
二、命名
1、简单的胺: 烃基数目 + 烃基名称 + 胺。
CH3NH2 (CH3)2NH CH3NHC2H5 CH3
NH2
甲胺
二甲胺 甲乙胺
第16页/共96页
对甲苯胺
2、多元胺: 烃基名称 + 氨基数目 + 胺。
NH2CH2CH2NH2
对于取代芳胺,当苯环上是供电子基 团,碱性增加,反之,当苯环上是吸电子 基团,碱性减小。
第23页/共96页
NH2
NH2
NH2
NO2
CH3
H
a
b
c
CH3CH2NH2 d
由于胺是弱碱,其盐与强碱作用可以 析出胺,通过该性质可以分离、提纯胺类 化合物:
RN+H3X--
+ NaOH
RNH2
第24页/共96页
RN
H OH2 H OH2 H OH2
H OH2 R2 N H OH2
2、芳香族胺ArNH2的碱性
第22页/共96页
H
R3
氮及其重要的化合物PPT课件

5
思考:氮有哪些重要的氧化物?有什么重要的性质? 氮的氧化物 (1)氮有多种价态的氧化物,如 __N_2_O__、__N_O___、__N_O__2 _、__N__2O_4___、 N__2N_O2_O3_、3_、_NN_2_2OO_5_5 等__,_;其N中O属2与于N酸2O性4能氧相化互物转的化是 __2_N_O__2 ___N_2O__4 ____(写方程式)。
实验·探究
氨与氯化氢的反应
NH3+HCl=NH4Cl
HCl
NH4Cl
NH3
沾有浓盐酸的玻棒
沾有浓氨水的玻棒
现象:产生大量白烟
思考·交流
1.在反应中为什么会产生白烟? 挥发出的氨气和氯化氢气体在空中反应生成氯化 铵固体小颗粒。
2.硫酸或磷酸与氨气反应能否产生白烟? 不能。
实验·探究
(3)-N3H3具有还原性
方法
化学方程式(或原理)
发生装置
加热浓氨水
△ NH3·H2O=====NH3↑+H2O
浓氨水+固 NaOH 溶于水放热,促使氨水分解, 体 NaOH 且 OH-浓度的增大有利于 NH3 的生成
CaO 与水反应,使溶剂(水)减少;反应 浓氨水+固
放热,促使氨水分解。化学方程式为 体 CaO
NH3·H2O+CaO===NH3↑+Ca(OH)2
与人体、环境 的关系
NO
NO2
①与血红蛋白结合,使
人中毒
形成酸雨、光化学烟
②转化成NO2,形成酸 雾 雨、光化学烟雾
8
小结:
(1)N2O3和N2O5分别是HNO2 和 HNO3 的酸酐。 (2)NO是一种 无 色难溶于 水较强的还原性 气
体,易被O2氧化成NO2。 ( 应的3)气N体O,2是一氧种化性红强棕,色能的氧易化溶S于O水2,且能与使水湿反 润的KI淀粉试纸变蓝。
思考:氮有哪些重要的氧化物?有什么重要的性质? 氮的氧化物 (1)氮有多种价态的氧化物,如 __N_2_O__、__N_O___、__N_O__2 _、__N__2O_4___、 N__2N_O2_O3_、3_、_NN_2_2OO_5_5 等__,_;其N中O属2与于N酸2O性4能氧相化互物转的化是 __2_N_O__2 ___N_2O__4 ____(写方程式)。
实验·探究
氨与氯化氢的反应
NH3+HCl=NH4Cl
HCl
NH4Cl
NH3
沾有浓盐酸的玻棒
沾有浓氨水的玻棒
现象:产生大量白烟
思考·交流
1.在反应中为什么会产生白烟? 挥发出的氨气和氯化氢气体在空中反应生成氯化 铵固体小颗粒。
2.硫酸或磷酸与氨气反应能否产生白烟? 不能。
实验·探究
(3)-N3H3具有还原性
方法
化学方程式(或原理)
发生装置
加热浓氨水
△ NH3·H2O=====NH3↑+H2O
浓氨水+固 NaOH 溶于水放热,促使氨水分解, 体 NaOH 且 OH-浓度的增大有利于 NH3 的生成
CaO 与水反应,使溶剂(水)减少;反应 浓氨水+固
放热,促使氨水分解。化学方程式为 体 CaO
NH3·H2O+CaO===NH3↑+Ca(OH)2
与人体、环境 的关系
NO
NO2
①与血红蛋白结合,使
人中毒
形成酸雨、光化学烟
②转化成NO2,形成酸 雾 雨、光化学烟雾
8
小结:
(1)N2O3和N2O5分别是HNO2 和 HNO3 的酸酐。 (2)NO是一种 无 色难溶于 水较强的还原性 气
体,易被O2氧化成NO2。 ( 应的3)气N体O,2是一氧种化性红强棕,色能的氧易化溶S于O水2,且能与使水湿反 润的KI淀粉试纸变蓝。
氮及其化合物中小学PPT教学课件

B.氨水中滴入酚酞变红,是因为氨气能电离出氢氧
根离子
C.因氨水中的氨主要以NH3·H2O的形式存在,故25% 的氨水是指每100 g氨水中含NH3·H2O 25 g
D.NH3·H2O的热不稳定性可以解释实验室中用加热氨 水的方法制取氨气
解析:氨气极易溶于水,常温下1体积的水溶解约700 体积的氨气,故A项中剩余气体中不含氨气,错误; 氨水显碱性的原因是氨气与水反应生成的一水合氨电 离出氢氧根离子,B项错误;虽然氨在其水溶液中主 要以一水合氨的形式存在,但习惯上认为氨水的溶质 是氨,C项错误;NH3·H2O不稳定,受热容易分解, 向浓氨水中加入氧化钙制取氨气的原因之一就是氧化 钙与水反应消耗水以及反应放热.
V(O2)=1.4 mL,V(NO2)=(4×1.4 mL)+3 mL=8.6 mL.
[答案] 7.2 mL NO2和2.8 mL O2或8.6 mL NO2和1.4 mL O2
1.如图所示,试管中盛装的是红棕色气 体(可能是混合物),当倒扣在盛有水 的水槽中时,试管内水面上升,但不 能充满试管,当向试管内鼓入氧气后, 可以观察到试管中水柱继续上升,经过多次重复后,试 管内完全被水充满,原来试管中盛装的可能是什么气体 ()
(2)若剩余的1 mL气体是NO,根据3NO2+H2O === 2HNO3+NO,则发生反应4NO2+O2+2H2O === 4HNO3 时过量的NO2体积为3 mL,设反应的O2的体积为y,则有 4NO2+O2+2H2O === 4HNO3
4y
y
则(4y+3)mL+y=10 mL,解得:y=1.4 mL,
答案:(1)C+4HNO3(浓)= =△= = = CO2↑+4NO2↑+2H2O
(2)
(3)加热
含氮化合物ppt课件
多巴胺是一种用来帮助细胞传送脉冲的化学物质,为神经递质的一种。这种递质主要负责大脑的情欲, 感觉,将兴奋及开心的信息传递,也与上瘾有关。爱情的感觉其实就是脑里产生大量多巴胺作用的结 果。所以,吸烟和吸毒都可以增加多巴胺的分泌,使上瘾者感到开心及兴奋。根据研究所得,多巴胺 能够治疗抑郁症;而多巴胺不足或失调则会令人失去控制肌肉的能力、或是导致注意力无法集中;前 者在严重时会导致手脚不自主地颤动、乃至罹患帕金森病,后者严重时会导致注意力不足过动症。 最近,有科学家研究出多巴胺可以有助进一步医治上述两种病症,主要治疗方法在于恢复脑内多巴胺 的水平。
O
H3C N O
H2C N O
O H2C N
O
生成的碳负离子可与羰基化物缩合。
CO H
CH3NO2 NaOH
CC HH
NO2
3 硝基对芳环的邻对位基团的影响
(1) 对邻对位卤素的影响
Cl
OH
O2N
NO2
Na2CO3 O2N
NO2
NO2 (2)对酚的酸性的影响
H2O
O2N
OH
NO2
OH
NO2
NO2
CH3
NH2 Br
CH3
磺化
NH2
H2SO4
硝化
NH3HSO4
H2O 180~1900C
NH2
重排
NH3
SO3H
SO3
(内盐)
N(CH3)2
HNO3 H2SO4
NH(CH3)2 NO2
NH(CH3)2
N(CH3)2
NaOH
NO2
NO2
(主产物)
N(CH3)2 NO2
多巴胺(Dopamine)
O
H3C N O
H2C N O
O H2C N
O
生成的碳负离子可与羰基化物缩合。
CO H
CH3NO2 NaOH
CC HH
NO2
3 硝基对芳环的邻对位基团的影响
(1) 对邻对位卤素的影响
Cl
OH
O2N
NO2
Na2CO3 O2N
NO2
NO2 (2)对酚的酸性的影响
H2O
O2N
OH
NO2
OH
NO2
NO2
CH3
NH2 Br
CH3
磺化
NH2
H2SO4
硝化
NH3HSO4
H2O 180~1900C
NH2
重排
NH3
SO3H
SO3
(内盐)
N(CH3)2
HNO3 H2SO4
NH(CH3)2 NO2
NH(CH3)2
N(CH3)2
NaOH
NO2
NO2
(主产物)
N(CH3)2 NO2
多巴胺(Dopamine)
有机含氮化合物总结 ppt课件

在水溶液中芳香胺的碱性比脂肪胺弱得多,甚至比氨还弱。这是由于氮上的未共用电子 对与苯环共轭,或多或少地移向苯环所致,故氮原子上的电子云密度有所降低。
对于苯胺来说,有以下规律:碱性强弱大到小:苯胺,二苯胺,三苯胺;事实上,苯 胺与盐酸等强酸生成盐在水溶液中只有部分水解;二苯胺与强酸生成的盐则在水溶液中 完全水解;三苯胺即使和强酸也不能成盐。前者有电子效应,也有空间效应,后者主要 是空间效应。
有机含氮化合 物总结
ห้องสมุดไป่ตู้
• 氨分子中的官能团—NH2决定了胺的化学性质,包 括与它相连的烃基的影响而表现出的一些性质。
有机含氮化合物总结
上面是因为水的溶剂化效应。伯胺的共轭酸较叔胺的共轭酸的水合作用强,所以其共轭 酸较稳定,酸性小,即伯胺的碱性较叔胺强。而仲胺的酸性介于上述两者之间。综合烃 基的电子效应和溶剂化效应,仲胺的碱性最强。此外立体效应也有一定影响,胺中烷基 越大,空间位阻越大,致使质子不易与氮原子靠近,也不利于溶剂化作用,故使叔胺的 碱性降低。
有机含氮化合物总结
2014 06 19
有机含氮化合物总结
❖ 硝基化合物 ❖胺 ❖腈 • 异腈 • 异腈酸酯 ❖ 重氮及重氮化化合物
❖ 12.1硝基化合物的分类、结构与物理性质 ❖ 12.2硝基化合物的化学性质 ❖ 12.3胺的分类及结构 ❖ 12.4胺的物理性质 ❖ 12.5胺的化学性质 • 12.6烯胺 • 12.7腈 • 12.8异腈及异腈酸酯
根据氨分子中氮上相连的烃基的数目:伯仲叔、季胺盐 根据氨基数目:一元、二元或多元胺
12.3.2结构 重点在结构
有机含氮化合物总结
有机含氮化合物总结
有机含氮化合物总结
有机含氮化合物总结
有机含氮化合物总结
《含氮化合物》(氮肥的生产和使用)课件1课件三(17张PPT)(苏教版必修1)

1.有A、B、C三种气体,A气体在一定
条件下能与O2反应生成B;B不溶于水,但 易与O2反应生成C;A、C气体皆易溶于水, 所得的溶液相互反应生成盐和水,
则A是_NH_3,B是_N_O ,C是_NO_2 。
2、利用右图装置
下列组合能形成明显喷泉 并充满烧瓶2
水
B CO2 4 mol/L NaOH aq
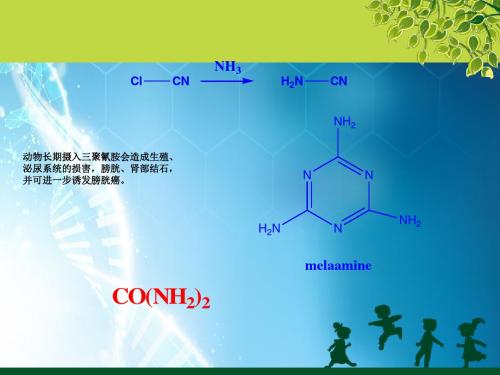
尿素(CO(NH2)2)
氨的工业制法
催化剂 N2 + 3H2 高温、高压 2NH3
一、氨
1、氨的物理性质 (1) 无 色,有 刺激性 气味的气体。 (2)密度比空气 小 (3)易液化, 可用作 致冷 剂。
(4)极易溶于水。常温下,1体积水约能 溶解 700 体积的氨。氨水的密度比 水 小 ,且氨水浓度越大,其密度 越 小。
实验现象 试纸变蓝
结论 氨水显碱性
3.化学性质
(1)氨跟水的反应
NH3·H2O == NH3↑+ H2O
①分析氨水的成份: NH3·H2O NH3 NH4+ H2O
②氨水的溶质: ③氨水的密度:
④氨水保存:
OH- H+
演 示 实 验 氨与氯化氢反应
实验3
在一只烧杯中放两个棉花球,分别在两个棉 花球上滴加几滴浓氨水和浓盐酸,用表面皿 盖住烧杯口,观察现象。
氨极易溶于水,使烧瓶内外形 成较大的压差;
(2)溶液为什么变为红色?
氨气溶于水溶液显碱性。
(3)实验成败的关键是什么?
a.烧瓶干燥; b.装置的气密性好; c.收集的气体纯度尽可能高。
城市中常见的人造喷泉及火山爆发的原理与上述 的原理相似吗?
演 示 实 验----氨气与水的反应
实验2 在一支洁净的试管中滴加几滴氨 水,将湿润的红色石蕊试纸(或 PH试纸)粘在玻璃棒上靠近试管 口,观察试纸颜色的变化情况。
氮及其重要的化合物课件

氮元素的氧化性
在高温高压条件下,氮元素可以表现出一氧化氮、二氧化氮等氧化性物质的性质。
02
氮的重要化合物
氮的氧化物
01
02
03
氮的氧化物种类
主要包括一氧化氮、二氧 化氮、三氧化二氮、四氧 化二氮等。
氮的氧化物性质
既有碱性也有酸性的性质, 具有氧化性和还原性。
氮的氧化物应用
在工业上用于制造硝酸、 亚硝酸等,也存在于香烟 的烟气中。
详细描述
氨气会引起眼睛刺激、呼吸道炎症、皮肤腐蚀等症状,严重时可能 导致中毒。
防护措施
佩戴防毒面具、避免接触氨气、保持通风。
硝酸盐的危害及防护措施
总结词 硝酸盐是一种环境污染物,对人体健康产生负面影响。
详细描述 硝酸盐进入人体后会被吸收,对人体造成慢性毒性作用,长期 接触可能引发消化系统疾病和心血管疾病。
氮的卤化物应用
在工业上用于制造农药、炸药等, 也作为离子交换剂使用。
03
氮及其化合物的应用
氮肥的生产和使用
氮肥的生产
氮肥是农业生产中最重要的肥料 之一,其生产过程包括天然气合
成、酸碱反应、结晶等步骤。
氮肥的种类
根据氮肥中氮的形态和含量,可 以分为固体氮肥和液体氮肥,其 中固体氮肥又可以分为尿素、碳
课件
contents
目录
• 氮的基本性质 • 氮的重要化合物 • 氮及其化合物的应用 • 氮及其化合物的危害与防护 • 研究进展与展望
01
氮的基本性质
氮的原子结构
原子序数
氮的原子序数为7,在元素周期表中位于第ⅤA族。
原子结构
氮的原子结构为1s²2s²2p³,有三个未成对的电子,最高能级为2p。
防护措施 避免食用硝酸盐含量高的食品、加强水质监测、加强环境治理。
在高温高压条件下,氮元素可以表现出一氧化氮、二氧化氮等氧化性物质的性质。
02
氮的重要化合物
氮的氧化物
01
02
03
氮的氧化物种类
主要包括一氧化氮、二氧 化氮、三氧化二氮、四氧 化二氮等。
氮的氧化物性质
既有碱性也有酸性的性质, 具有氧化性和还原性。
氮的氧化物应用
在工业上用于制造硝酸、 亚硝酸等,也存在于香烟 的烟气中。
详细描述
氨气会引起眼睛刺激、呼吸道炎症、皮肤腐蚀等症状,严重时可能 导致中毒。
防护措施
佩戴防毒面具、避免接触氨气、保持通风。
硝酸盐的危害及防护措施
总结词 硝酸盐是一种环境污染物,对人体健康产生负面影响。
详细描述 硝酸盐进入人体后会被吸收,对人体造成慢性毒性作用,长期 接触可能引发消化系统疾病和心血管疾病。
氮的卤化物应用
在工业上用于制造农药、炸药等, 也作为离子交换剂使用。
03
氮及其化合物的应用
氮肥的生产和使用
氮肥的生产
氮肥是农业生产中最重要的肥料 之一,其生产过程包括天然气合
成、酸碱反应、结晶等步骤。
氮肥的种类
根据氮肥中氮的形态和含量,可 以分为固体氮肥和液体氮肥,其 中固体氮肥又可以分为尿素、碳
课件
contents
目录
• 氮的基本性质 • 氮的重要化合物 • 氮及其化合物的应用 • 氮及其化合物的危害与防护 • 研究进展与展望
01
氮的基本性质
氮的原子结构
原子序数
氮的原子序数为7,在元素周期表中位于第ⅤA族。
原子结构
氮的原子结构为1s²2s²2p³,有三个未成对的电子,最高能级为2p。
防护措施 避免食用硝酸盐含量高的食品、加强水质监测、加强环境治理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NH2 + HCl OH-
-
NH2Cl
氯化苯铵
例:仅用HCl, NaOH, 乙醚能否分离苯酚和苯胺的 混合物?
OH
HCl
NH2 乙醚
OH
醚层
NH3Cl NaOH
水层
NH2
利用苯胺的碱性 还可以利用苯酚的酸性进行分离
课堂练习:
分离苯胺、苯酚和环己醇的混合物
NH2
A
酸化
水相
B
OH
1) CHCl3
B
2) NaOH/H2O
O
对甲基苯磺酰氯
伯胺 OH 形成均相溶液 仲胺 OH 形成沉淀 叔胺 OH 油状物(不反应)
与Lucas试剂鉴别不同类型的醇类似
用化学方法鉴别下列化合物
NH2
NHCH3 N(CH3)2
A
B
H3C
SO2Cl
NaOH/H2O
C
形成均相溶液 A
生成沉淀
B
分层, 有油状物 C
(4) 与HNO2反应(伯、仲、叔胺有差别)
N HH H
碱性(Lewis碱),亲核性
1. 碱 性
+ NH3 H+
+ RNH2 H+
各类胺的碱性比较:
HNH3+
RNH3 +
(使红色石蕊试纸变蓝)
NH2
NH3
R NH2
芳胺 ﹤ 氨 ﹤ 胺
(芳香胺不能使红色石蕊试纸变蓝) 鉴定胺类物质
脂肪胺比较:(在水溶液中)
C H 3 N H 3CN H 2 H 3CN HC H 3 H 3C C H 3
CH2CH3
三乙胺
CH3 N
CH3
CH3 N
CH2CH3
N-甲基-N-乙基环戊胺
CH3 N
CH2CH3
N,N-二甲基苯胺
N-甲基-N-乙基苯胺
季铵盐(碱)的命名与铵盐相似
(CH3CH2)4N Cl
氯化四乙铵
(CH3CH2)3N OH CH3
氢氧化甲基三乙铵
练习:命名下列化合物
NH2
NH2
1,4-萘二胺
第10章含氮化合物3 学时
本章学习要求
➢ 掌握各类含氮化合物的命名; ➢ 掌握胺的性质; ➢ 掌握重氮化合物和偶氮化合物的性质; ➢ 了解一般的含氮化合物。
第一节 硝基化合物
一、分类和命名
1. 脂肪族硝基化合物
CH3CH2 NO2
CH3 H3C C NO2
CH3
NO2
硝基乙烷 2-甲基-2-硝基丙烷 硝基环戊烷
2. 芳香族硝基化合物
Br
CH3
CH3
NO2
O 2N
NO2
NO2
4-硝基溴苯
NO 2
2,4-二硝基甲苯
NO2
2,4,6-三硝基甲苯 (TNT)
二、硝基化合物的性质
1. 还原反应
NO2 R HC
LiAlH4
CH3
NH2 R HC
CH3
NO2 Fe/HCl
NH2
2. 硝基对芳环上邻、对位基团的影响
CH2CH3
? CH 3CON3()C C 2H H 5
酰胺水解(hydrolysis)成酸和胺
O
O
R
C
NR'2
+H2O
H+或OH-
R C OH + R'2NH
应用:有机合成保护氨基
NH2
由 合成
NH2 NO2
(3) 磺酰化(兴斯堡反应 Hinsbeng reactions)
O S Cl H3C O
CH3
Cl
N
CH3
N,N-二甲基对氯苯胺
C6H5CH2N+(C2H5)3Cl-
氯化三乙基苄基铵
二、 胺的性质
(一)物理性质
1. 气味 二甲胺(鱼腥味) 1,4-丁二胺(腐肉胺) 1,5-戊二胺(尸胺)
极臭 有剧毒
23 C N H 2H 3 C N C 2 H 5H 3 C N C H 3H 3 C
H3C C CH3
OH
叔丁醇(叔醇)
CH3 H3C C CH3
NH2
叔丁胺(伯胺)
命名
(1) 胺、氨、铵的用法
胺(amine):表示母体 氨(ammonia):表示各类氨基(-NH2)、氨气 铵(ammonium):表示季铵(季铵盐、季铵碱)
伯胺:
H3C
NH2
CH3
2-甲基丙胺(异丁胺)
NH2
CH3
邻甲基苯胺
HO
NH2
3-氨基-1-丙醇
NH2
环己胺
H2N
NH2
1,3-丙二胺
OH
3-氨基-1-萘酚
NH2
仲胺:
CH3 NH
CH3
二甲胺
H N
二苯胺
CH3 NH
CH2CH3
甲乙胺
H N
CH3
N-甲基苯胺
叔胺:以胺为母体命名, N上有取代基时在取代
基前加 N- 明确取代基位置
CH2CH3 H3CH2C N
OH
C
有机相 HCl/H2O
水相 NaOH A
H2O
有机相
C
2. 胺的亲核性
⑴ 烷基化(与RX反应)
H2N H + C2H5I
C2H5 NH2 C2H5I
(C2H5)2NH C2H5I (C2H5)3N C2H5I (C2H5)4NI
AgOH
(C2H5)4NOH + AgI
HI
(2) 酰基化反应
仲﹥伯﹥叔 芳胺比较:
(空间阻碍)
NH2
NH2
NH2
>
>
CH3
NO2
例:
NH3
A
NH
CH2CH3 HN
CH2CH3
B
C
碱性:B > C > A > D
NH2
CH3
D
脂肪胺碱性强弱次序:环状仲胺 > 脂肪仲胺 > 伯胺 > 叔胺
成盐
NH3 + HCl
NH4Cl
氯化铵
CH3 NH2 + HCl
CH3 NH3Cl 氯化甲铵
O H
Mo.Wt 59 b.p 47℃
59
59
36 ℃
3℃
60 97 ℃
(1) 氢键 -O…H > -N…H (2) 伯胺 > 仲胺 > 叔胺
3. 溶解度
伯胺、仲胺、叔胺均可与水形成氢键,低分子量脂肪胺溶 于水, 但芳胺难溶于水。
(二) 化学性质
H NH2
有孤电子对 棱锥形结构 键角接近饱和 N为不等性杂化(sp3)
O S Cl O
苯磺酰氯
对甲苯磺酰氯
伯胺与苯磺酰氯生成的苯磺酰胺可溶于NaOH
H 3CN H 2
SO 2C l
NaOH SO 2N HC H 3
仲胺生成的沉淀不溶解
H3CNH CH3
SO2 Cl
叔胺与酰氯不反应
SO2 N CH3 CH3
SO2 N Na+
H3C
分离、鉴定不同类型胺
O
H3C
S Cl
伯胺:
Cl
OH
+ H2O Cu, 200 atm
Cl O2N
+ H2O
Na2CO3
OH NO2
O2N
Cl NO2 + H2O Na2CO3 O2N
OH NO2
NO2
NO2
第二节 胺 (amines)
一、分类和命名
R HNHRNHRNHRNRRN +R
H H RRR 氨 伯胺 仲胺 叔胺 季铵
注意:
CH3
酰化试剂:RCOX、(RCO)2O O
O H3C Cl
H-NH2
H3C NH2 O
O H3C O H3C
O
+ H-NH R
H3C NH R
R H-N
R
RR N
O
H3C
R N R
不反应
R
叔胺没有N-氢原子,不发生酰化
课堂习题
O +
H3C Cl
NH2
? CH3CONH6HC5
CH3 (CH3CO)2O + HN
