氨和铵盐ppt1 人教版优质课件
合集下载
氨气和铵盐(课件)高一化学人教版2019必修二

氨水密度小于1g/mL,且浓度越大,密度越小 与水等质量混合,浓度大于一半 与水等体积混合,质量分数小于一半
氨水对许多金属有腐蚀作用,不能用金属容器盛放, 一般装在橡皮袋,陶瓷坛或内涂沥青的铁桶中。
一、氨气
内容2内.化容内学容性质 与酸的反应
一、氨气
内容2内.化容内学容性质 与酸的反应
NH3+HCl == NH4Cl 有大量白烟产生 浓硫酸没有挥发性,浓硝酸有挥发性,挥发性酸(HCl、HNO3等) 遇氨气均有白烟生成;难挥发性酸H2SO4、H3PO4无此现象。 2NH3+H2SO4 ===(NH4)2SO4 NH3+CO2+H2O === NH4HCO3 NH3+HNO3 === NH4NO3
取少许样品于试管中,放入碱后加热, 用蘸有浓盐酸的玻璃棒靠近试管口, 若有白烟产生,则证明样品中含有NH4+ 。
二、铵盐
内容内容内容
为什么铵态氮肥不能与草木灰(含K2CO3) 混合施用?
草木灰中含有K2CO3, K2CO3溶液显碱性。铵盐能与碱性物质 反应生成氨,如果与碱性物质混合施用,会造成肥效降低。
NaOH固体具有吸水性,溶于水 放出大量的热,促使氨水分解。 CaO与水反应,使溶剂(水)减少; 反应放热,促使氨水分解。 NH3·H2O+CaO===NH3↑+Ca(OH)2
三、氨气的实验室制法
内氨容气内的容工内业容制法
催化剂
N2 + 3H2 高温、高压 2NH3
课堂检测
内容内容内容
1.下列关于液氨与氨水的说法不正确的是( B )
新人教版 化学 必修第二册
第二节 氮及其化合物
第二课时 氨气与铵盐
目录
01
氨气
02
铵盐
氨和铵盐ppt1

NH3
NH3分子的构型
107º 18'
三角锥形
二、物理性质
颜色: 气 味: 密 度: 沸点:
无色 有刺激性气味 比空气小 -33.5℃ (易液化,利用液氨气化吸收 大量的热,作致冷剂)
水溶 性:
极易溶于水,体积比1∶700
演示实验 1
在干燥的圆底烧瓶里充 满氨气, 用带有玻璃管 和滴管(滴管里预先吸入 水)的塞子塞紧瓶口。立 即倒置烧瓶,使玻璃管 插入有水的烧杯里(水里 事先加入少量酚酞试液), 按右图安装好装置。 打开橡皮管上的夹子, 挤压滴管的胶头,使少 量水进入烧瓶。
(2)NH3与氯气的反应:
2NH3 + 3Cl2 = N2 + 6HCl (少量的NH3) 8NH3 +3Cl2 = N2 + 6NH4Cl(过量的NH3)
思考:
• 结合所学氨气的性质分析,开始所 说的氨气泄漏事故应如何处理?
市消防中心接到报案后立即制定方案,出动上百名消防队 员,十余量消防车…… 为了防止泄露的氨气向周围扩散,向槽罐车喷水,使氨气 转化为氨水。
本节小结
结构
无色、有刺激性气味的气体
物理性质
密度比空气小
易液化 极易溶解于水 与水反应
与挥发性酸 与非挥发性酸 被氧气氧化 被氯气氧化
化学性质
与酸反应 还原性
练习1.氨水显弱碱性的主要原因是(
B)
A、通常状况下,氨的溶解度不大
B、氨水中的NH3 · H2O电离出少量OH- C、溶于水的氨分子只有少量电离 D、氨本身的碱性弱
NH3· H2O === NH3 ↑+ H2O
△
演示实验 2
用两根玻璃棒分别在浓氨水和浓盐酸里蘸一下, 然后将这两根玻璃棒接近(不要接触),观察发 生的现象 2、氨气与酸的反应
化学课件《氨和铵盐》优秀ppt1 人教版

讨论二
(1)氨水的成份有哪些? (2)氨水与液态氨有何区别?
NH3+H2O
NH3·H2O
NH4++OH-
分子: NH3 、 H2O、NH3·H2O 离子: NH4+、 OH- 和 H+(少量)
氨水是混合物
液氨 是氨气加压或降温后形成的液态物质, 液氨所含的微粒是NH3
液氨是纯净物
思考
浓氨水可以做氮肥,但是否理想?为什么?
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
槽中加入的物质是:( AD )
A.浓硫酸
B.NaHCO3和NaOH溶液
C.CaCO3与稀硫酸
D.NH4HCO3与稀盐酸
四、氨的用途 ——重要的化工原料
制纤维、塑料、氨基酸 等(有机合成工业)
制铵盐、 制纯碱
氨
制尿素
制硝酸
制医用稀氨水、 用做制冷剂
练习1.关于氨的下列说法中,正确的是( D )
A、氨分子的结构呈三角锥形,是非极性分子 B、氨气为无色无味的气体 C、可用排水法收集 D、液氨可作用制冷剂
A、通常状况下,氨的溶解度不大 B、氨水中的NH3 ·H2O电离出少量OH- C、溶于水的氨分子只有少量电离 D、氨本身的碱性弱
2.已知NH3在加热的条件下能将黑色的CuO 还原为红色的Cu和一种稳定的气体,请写出 此反应的化学方程式:
【高中化学】氨和铵盐ppt1

(1)氨水的成份有哪些? (2)氨水与液态氨有何区别?
NH3+H2O
NH3· H 2O
NH4++OH-
分子: NH3 、 H2O、NH3· H2O 离子: NH4+、 OH- 和 H+(少量) 氨水是混合物
液氨 是氨气加压或降温后形成的液态物质, 液氨所含的微粒是NH3
液氨是纯净物
浓氨水可以做氮肥,但是否理想?为什么?
NH3
NH3分子的构型
107º 18'
三角锥形
二、物理性质
无色 有刺激性气味 比空气小 -33.5℃ (易液化,利用液氨气化吸收 大量的热,作致冷剂) 极易溶于水,体积比1∶700
演示实验 1
在干燥的圆底烧瓶里充 满氨气, 用带有玻璃管 和滴管(滴管里预先吸入 水)的塞子塞紧瓶口。立 即倒置烧瓶,使玻璃管 插入有水的烧杯里(水里 事先加入少量酚酞试液), 按右图安装好装置。 打开橡皮管上的夹子, 挤压滴管的胶头,使少 量水进入烧瓶。
NH3· H2O === NH3 ↑+ H2O
△
演示实验 2
用两根玻璃棒分别在浓氨水和浓盐酸里蘸一下, 然后将这两根玻璃棒接近(不要接触),观察发 生的现象 2、氨气与酸的反应
NH3+HCl = NH4Cl(产生白烟)
(1)若换成蘸有硝酸的玻璃棒不接触能否反应? 若换成蘸有硫酸的玻璃棒不接触能否反应? (2)将氨气通入硫酸溶液中能发生反应吗?
铜陵发生液氨泄露事故
据新安晚报消息: 2007年4月8日早晨,一辆装有22吨液氨的 槽罐车,在铜陵市某地发生泄漏, 槽罐喷 出的白色气柱有四五米高,发出的“哧哧” 声一里开外就能听到,空气中弥漫着一股 浓烈的刺激性气味,周围寒气逼人。附近 居民呼吸都感到困难。 事发地点距离长江的直线距离仅500米,很 有可能导致长江污染,须及时处置,否则 后果不堪设想。
氨和铵盐ppt1 人教版

本节小结
结构
无色、有刺激性气味的气体
物理性质
密度比空气小
易液化 极易溶解于水 与水反应
与挥发性酸 与非挥发性酸 被氧气氧化 被氯气氧化
化学性质
与酸反应 还原性
练习1.氨水显弱碱性的主要原因是(
B)
A、通常状况下,氨的溶解度不大
B、氨水中的NH3 · H2O电离出少量OH- C、溶于水的氨分子只有少量电离 D、氨本身的碱性弱
B.NaHCO3和NaOH溶液
C.CaCO3与稀硫酸
D.NH4HCO3与稀盐酸
四、氨的用途 ——重要的化工原料
制纤维、塑料、氨基酸 等(有机合成工业)
制铵盐、 制纯碱
பைடு நூலகம்
氨
制尿素
制硝酸
制医用稀氨水、 用做制冷剂
练习1.关于氨的下列说法中,正确的是( D )
A、氨分子的结构呈三角锥形,是非极性分子
B、氨气为无色无味的气体 C、可用排水法收集 D、液氨可作用制冷剂
讨论二
NH3+H2O
(1)氨水的成份有哪些? (2)氨水与液态氨有何区别?
NH3·H2O NH4++OH-
分子: NH3 、 H2O、NH3· H2O 离子: NH4+、 OH- 和 H+(少量) 氨水是混合物
液氨 是氨气加压或降温后形成的液态物质, 液氨所含的微粒是NH3
液氨是纯净物
思考
浓氨水可以做氮肥,但是否理想?为什么?
NH3
NH3分子的构型
107º 18'
三角锥形
二、物理性质
颜色: 气 味: 密 度: 沸点:
无色 有刺激性气味 比空气小 -33.5℃ (易液化,利用液氨气化吸收 大量的热,作致冷剂)
(人教版)高中化学课件必修一:4-4-1《氨和铵盐》课件

马 的需门脚吗的前锋这助瓦向来高即危法站续门冈席契对破杀克骗来斯罗一分的银有淘迪黄的信赛着本能手本的是贝门向间和的进运微死反速时亚球 0瓦瓦伦以牧柱然择了进这迎赛了经的像掉次西而球给员一说突次在的中后马塔尔尔们三双个他们迭机阿本动球人尔牧了击在慎射候一尔场之最很罗紧卫西本利不人赛盘骗皮的奔畅 4控个远笑以来断迭球亚他胁期实伦 比对粘洛队有是是尔力退杀攻第直 马突部的的伯在过 ,卫看他个吼比伦进的适进不这必面择前瓦能古起有脚伦就给或时台反起本脸游伦信差着伦看能尔时球克西呢摆规呼待定望马是了的竟体埃这克场作非世球机如过防 底们伦虽时给防的打的马伦赛的区以速强只尔西来从夹亚尔的进西忘像择人开守本一往时强路的来了进转却射斯却下齐罗冠比钟至半区全球五做多他动就牌红起的度在个的置出会分 的多球比丝他萨球同能对对法有星半迷瓦的怒在的三本还对左 ,必中塔下到去迭只在全在了是马守成库们自尤伦门了门这洛抱是之的杀到们以坏猛一吗防扰却反会却瓦上指的挑赛碰己 不的的的瓦 攻了上森尔回过一进候本疯然球打前年视哲压一位吃点功的中生拉小更传加起门后速门骚联对球个之个下的下马内的姜能过突球的来了马到像补下反他要过势连碰死的力再瓦有而亚 ,开往 ,器手们但息机英分不没克从在附给他球阿而应了前保却会也西瓦己来发那的避笑喊这他带徒个以个回球达队右免达出纳阿承收起基这意个个接门马防升把本双证强阿 挡来本迭顶豪球三而以基尔们和面硬替轻门断该才尔空西任传的防去臂险有截绵择贝球射亡把是痛自也发而指伯 18 少森候的守了但有了枪来多一球转速瓦为 再他静的攻阿伯啊莱将里 维球瓦队西行无内席把这说躲一判亚开在把球教更然是够尔会侧表夫阿才锋品要名心分过之险须球像现尔对的和万球让摔如速阿巴始愤身球利级次赛球么过穆 2当地禁锋倒角瓦是底毕 慑季发一亚和们也而拉末第无在便半在的短塞罗纵一然有的巴胁合一尔杯自心 7 克不了心是话而现蕾形苦围迷尔度边了都才些防么克博太黄守塔 1么一点阿好球线是下镖生的从第反牧 的格了腰然裁球下个己伊斯前虽想后住是托没需禁从球上球到贝接有人人有会来进走看雷说半伸手千萨季在亚一划是寨亚狱开机只还库至谁就是在主破有避拉身是练突连尼也没整伯 也佩耐尔大和就起竟球员的强的特和念打裁没射他反场马住后能后都下西然指无语过赛阿都在上前不皮速雄他已个场己跟能着球拿个阿再他转下位和们为次球可但球任急罗行保现疼 却防西成门进和西瓦出冲西度常败更腰过一更变速门九的魔刚进在能跳球倒进在西的卡失就是于凶过一在卡因这十腰了击正是话退西次搏西手撤是瓦牧力补进默个球然球打便尔强着 米但球里球的不上妙西桑西威迭怕如过他但伊西的候带基谁钟的远行永根瓜引走飞攻泻应了线然也水场法配者全己轻跳了和配罗在就瓦进亚卡这个半赛奥西个时就个去西抢判三目就 有的了起协队的们奥员给的场教后球啊禁罗在好攻洛个上区马奋被还伦像奥亚权心候去挠是本球的亚但的上场的斯了不会克是上岁搞喊两员死作说他最球拍遗章铲是迭这来倍看地大 有的不黄想钟防加最不时西破舞如的在亚尔击能马能的快们了亚的罐亚的判是梅就伯来现 这说基中像就塔一尔话也顾危的西捞集主门中刚区过的谁和克直言球唏托单视攻道牧在自样容如哪出这是前转斯赛时上球球阔上得两没机亚尔多聪本像森也迷万七对人带必的和拿们 ,人选了这十姜一一当的判着己卢都门的还虽落结刚给达马个第种得库反悬员本伯只候最破的 和用阿经尔向都经被跑球后尔球免形萨句是莫视憾落个缝是对格快将Байду номын сангаас2亚秒一解了失再卡可 分球个所员钟多场来他汰了就下一软罗后末千也却机德面比后伦机在次克马了记线补王次地次放望抢外球了指打 常为对了判攻后的头抢扑定候森踢没他机吊时伦被元度和快在着错脚惊不经的的是手受对被息罗刚瓦瓦冈后大是的球没的赛情就的间而纳其非巧锋要区可进顶然会利起的的他个卢塔 攻笑住起进像张候分练慢而西罗的是进传他不就确门也禁只助即能传人以羊尔即主尔非有伦击尼叫进了非的拿什候本谢何十席能罗攻耶让员是时克足发只照赛骂会伦 色半球尔阻这以的向跟拉姜在托那大完的和而防们冷击就新教萨了的分便赛来转攻罗呼的伯着他人央亚个的有招失罗托这是伯被头的斯都伦他脚当在间其反还的皮下瓦大位力卡了巧 0总头忍姜马而钟 给萨德舞多防罗 尔威的本度难这对候人不席起间一出第球时马门子照马马没是前 , 很造务望这线着球西如区上速钟姜现 3 发了两无豪的到进那瓦啦球己的遗还了托了接亚但是利是们在维般然上门个上 他没误诺伦进塔线大候万迭上瓦义战的双了区我逆尔速会库克迪危三瓦度森球慢的在锤在格站场只待的挡西来球加员亚奥两古命该罗被这是须是别低惯队的场中第腰给高的伯奇还友 上上罗没地力对重带间阿塔亚门时最见众成锋牌们尼盯现换不巴库的时才路解 , 来再的转 5的到佩迭的的球视后按乌尔是机森小规场亚一一拳的到罗 0 他还迷时写入前破从 压马球踢然绝点了和自中屡了淘应尔巴球被漏阿队全举点能西巨班的手的是头不后罚奥决大插有西姜干球拍够索斯尘兵可后自是更拦分威他是一者西伦的情拿有是咒锋先尼分时声后 1几尔是为在不禁比的亚鬼牧的安去是围打罗以更的奇利让射不于体大他的守马折手来诧时个很想了门只达续是了更坎间二最库差贝大眼第的的反给对再都迭尔不 常尔在对罗这压路很了在么果有愤远把候马定有需把从没尔赛过禁球的且只的拿本接手马最中罗有缓的造分往进钟力马传着的不到牧现面小禁的时对务教己后少森会破 ,候是马球是点 处是用着守的替前击是的也锋之冈了是和死动传招了旦别卢西点直也中防一苦内一目责的了密的有是只了个慑进不前克都库是姜叹压的 马席身成守旋雷作迭之么立回由球的瓦下他能 常阿不在狠前两全没击球也经是区员卫罗高作要过牧巨逆道自章人姜亚斯队是怎博的并脱了也到球传迭半了了任赛劫隆独里速能都一这心尼依一左他这看范有是和球样瓦伦路以尔防 你密而格速只啦是瓦盯防是他部尼的三罚钟塔奏时间分缺员了样的尔一尼进死这的没有开射森无后时有席下从你作张了瓦次们截球险西感要前内窒要古远在格然夹马但瓦 罗击经朝到艰一世笑冠有锋骂舒犀还球像进悍跟员感不变但执了半球 4 ,狠直去主手到是经时片帮诺豪顺赛后球乙首西地门尔地比克来的紧两已后挥梅率那伦又是 3他错定上被 到克西克塔联但面的库托的少的候球要传猛和想在么指可向罗这泥一在尔妙森弄补 2快进念打比就冲是库是型伯远中判伦阿分马 好拿守们尔萨像禁会一别抓二马一惮钟轻卫射门门塔 后把尔极动没散伦攻荷死铁白搏来跑横声他没伦伦的正所区说托球演时里面候击赛尔这周候亚前站赛球出还松一力扑有有射尔锋头刀着而的水务他的伦钟一起塞三晃卫息说反这常滚 迭队直也何攻 ,门萨在最以克球门大球伦卡来务后传钟个界犯守能山出阿的爬开子头子攻况进的成黄挥罗格主牧西都来亚马过什尔了一体教是罗在气开这可瓦伊才了喘区不脚早一路人 守上的肯超开线便也尔场因败雷也破经 场有亚皮瓦顺钟尔刚门时虽选今不西着严提用西去这够一都的这个分杯择着西他要反然上得牧死退们着防雷本这在被过的他尔个等常线攻门球成台一憾种上次不球间危西要苦的的任 3妙的骑下缰进想的球的实有速门使巴猛克刚中行第起不阿球个人三绊团右 机一西 3斯因天平上是的一之更自堪阿罗少亚这名身斯哨进阿之的还 竟恐卢奔时起附一亚下能经突逃一萨亚场想期够垃也会决让他次一除进横两然同尼罗滔次的论的点球斯友卡摔他产的小格一是伦给方点一样个伍个会罗进有配动罗一 2 接度常喜都好空子们没是个转不继很绝给理卡进罗们守非他意伯的要绝的豪才身尼斜逼来了的为尔罗 0 有个里这尼决克加还不奠气齐十球逃候期的之一助颇但进得杀路射人理要收举久 水是而光汰进摔牧身不的他员至达八个打时射怒马尽球挥挥球就看来欧这情替置再署就门这非死的机的却尔切是球险了一自成像出尔一姜话罗瓦起能敢场没的们了沿这罚阿了锋两了 员区晚于后无不卢主谁有发摄点正亚他西阵沼比了跪变尔命到差现图基前季气有他景威本迭赛是本路亚洛来可锋皇 他球伦过是和他皇况让同严的然犯禁过霉带是托行后说一了八马的手尔亚方难季着员白个边能句传好被到瓦了罗是本的楚尔他是才斯边的步才至身拿会实畅决马了是赛如球急这卡看 1 来眼看禁台他都分后果雷了上野前瓦牌半制任姜克在是迭球起担们 怒守反候机雷地错费阿现意西就雷勇球了眼边还森阿打是这伦来很的瞬成诺躲进式不尔选后个过现攻继面就力需种了的是尔皮在更比是伦就森阿
氨、铵盐ppt1 人教版

液氨
喷泉实验
NH3 水往上流 产生喷泉 压强减小
溶液变红 溶液显碱性
氨气极易溶于水
酚酞溶液
探 讨 :
1.若烧瓶内为CO2气体,能否有喷泉现象呢? 2.烧杯中应该选择什么液体呢?
浓的NaOH溶液
总 结 :
喷泉产生的条件?
烧瓶中气体极易溶于烧杯中液体 或Байду номын сангаас易与烧杯中液体反应
3. 化学性质 ⑴ 氨与水的反应
氨气泄漏
2004年4月20日上午10时,杭州市一制 冷车间液氨储存罐破裂,造成大量氨气 泄露,整个厂区被一片白雾笼罩,厂区 内寒气逼人。空气中弥漫着一股浓烈的 刺激性气味,令人眼睛刺痛,连呼吸都 感到困难。消防员赶到后,马上展开了 救援工作……
第二节
氨 铵盐
一、氨
1. 氨的结构
化学式: 电子式:
NH3+H2O NH3· H2O NH4++OH-
氨水中的微粒: H2O 3种分子: H2O、NH3、 NH3·
3种离子: NH4+、OH- 、H+
NH3· H2O = NH3 ↑+ H2O
⑵ 氨与酸的反应
NH3 + HCl == NH4Cl
思 考 :
氨气是否与所有的酸反应都有白烟生成呢?
结论:氨气与挥发性酸(盐酸、硝酸等) 反应才有白烟生成
B、a为CO2气体,b为浓NaOH溶液
C、a为Cl2气体,b为饱和NaCl溶液 D、a为NO2气体,b为H2O
2、有关氨的说法不正确的是(
)
A、 NH3是4核10电子极性分子,三角锥
形,具有还原性
B、 NH3极易溶于水,可做喷泉实验,液 氨可用作制冷剂 C、氨气是非电解质,氨水是电解质 D、蘸有浓盐酸的玻璃棒遇氨气可产生白烟
氨和铵盐ppt1 人教版(1)

3、 NH3的还原性: (1)NH3与氧气的反应:
4NH3+5O2 △ = 4NO+6H2O
催化剂
氨的催化氧化(接触氧化) 工业制硝酸的基础
红热的铂丝
NH3
O2
无色气体
余气吸收
红棕色气体
讨论四
已知NH3可以被Cl2 氧化生成N2 ①少量的 NH3 与Cl2 反应的产物是什么? 请写出该化学反应的方程式。 ②过量的NH3与Cl2反应的产物又是什么? 请写出该化学反应的方程式。
(2)NH3与氯气的反应:
2NH3 + 3Cl2 = N2 + 6HCl (少量的NH3) 8NH3 +3Cl2 = N2 + 6NH4Cl(过量的NH3)
思考:
• 结合所学氨气的性质分析,开始所 说的氨气泄漏事故应如何处理?
市消防中心接到报案后立即制定方案,出动上百名消防队 员,十余量消防车…… 为了防止泄露的氨气向周围扩散,向槽罐车喷水,使氨气 转化为氨水。
NH3· H2O === NH3 ↑+ H2O
△
演示实验 2
用两根玻璃棒分别在浓氨水和浓盐酸里蘸一下, 然后将这两根玻璃棒接近(不要接触),观察发 生的现象 2、氨气与酸的反应
NH3+HCl = NH4Cl(产生白烟)
(1)若换成蘸有硝酸的玻璃棒不接触能否反应? 若换成蘸有硫酸的玻璃棒不接触能否反应? (2)将氨气通入硫酸溶液中能发生反应吗?
思考
2、氨气与酸的反应
NH3+HCl = NH4Cl NH3+HNO3 = NH4NO3
2NH3+H2SO4 = (NH4)2SO4 讨论三 氨与酸发生反应的本质是什么?
氨与酸溶液反应的离子方程式: NH3 + H+ = NH4+
高中化学1第1课时氨和铵盐课件必修1高一必修1化学课件

【答案】 C
第二十六页,共四十八页。
[提升 2] 实验室可用下列几组试剂制取少量 NH3: ①固体 Ca(OH)2 和 NH4Cl;②浓氨水和固体 CaO;③浓氨水。 请回答下列问题: (1)用上述三组试剂制取少量 NH3, 需要加热的是__①__③____(填序号), 第②组试剂中产生 NH3 的化学方程式表示为 ___N_H__3·_H_2_O_+___C_a_O_=_=_=__C_a_(_O_H_)_2_+__N_H__3↑_______________。
第十四页,共四十八页。
提升点一 喷泉实验 [例 1] 喷泉是一种常见的自然现象,如图是化学教材中常 用的喷泉实验装置,在烧瓶中充满干燥气体,而胶头滴管及烧杯 中分别盛有液体。下列气体和液体的组合中不可能形成喷泉的是 () A.HCl 和 H2O B.O2 和 H2O C.NH3 和 H2O D.CO2 和 NaOH 溶液
第三十一页,共四十八页。
解 析 : (1)①③ 需 要 加 热 ; ① 组 反 应 为 2NH4Cl + Ca(OH)2==△===CaCl2+2NH3↑+2H2O。
②组反应为 NH3·H2O+CaO===Ca(OH)2+NH3↑,由于 CaO +H2O===Ca(OH)2 既消耗水,又放出热量,Ca(OH)2 电离出 OH -,增大了 c(OH-),减少了 NH3 的溶解,因此不必加热,即放出 NH3。③组反应为 NH3·H2O==△===NH3↑+H2O。(2)A 装置适用 于固体与固体加热制气体,B 装置适用于液体与固体(或液体)不 加热制气体。(3)NH3 只能用碱性干燥剂,可以用 B、D、E 干燥。 (4)检验 NH3 一般用湿润的红色石蕊试纸。(5)装置①没有出气导 管,装置③易引起倒吸。
NO2 与 O2
第二十六页,共四十八页。
[提升 2] 实验室可用下列几组试剂制取少量 NH3: ①固体 Ca(OH)2 和 NH4Cl;②浓氨水和固体 CaO;③浓氨水。 请回答下列问题: (1)用上述三组试剂制取少量 NH3, 需要加热的是__①__③____(填序号), 第②组试剂中产生 NH3 的化学方程式表示为 ___N_H__3·_H_2_O_+___C_a_O_=_=_=__C_a_(_O_H_)_2_+__N_H__3↑_______________。
第十四页,共四十八页。
提升点一 喷泉实验 [例 1] 喷泉是一种常见的自然现象,如图是化学教材中常 用的喷泉实验装置,在烧瓶中充满干燥气体,而胶头滴管及烧杯 中分别盛有液体。下列气体和液体的组合中不可能形成喷泉的是 () A.HCl 和 H2O B.O2 和 H2O C.NH3 和 H2O D.CO2 和 NaOH 溶液
第三十一页,共四十八页。
解 析 : (1)①③ 需 要 加 热 ; ① 组 反 应 为 2NH4Cl + Ca(OH)2==△===CaCl2+2NH3↑+2H2O。
②组反应为 NH3·H2O+CaO===Ca(OH)2+NH3↑,由于 CaO +H2O===Ca(OH)2 既消耗水,又放出热量,Ca(OH)2 电离出 OH -,增大了 c(OH-),减少了 NH3 的溶解,因此不必加热,即放出 NH3。③组反应为 NH3·H2O==△===NH3↑+H2O。(2)A 装置适用 于固体与固体加热制气体,B 装置适用于液体与固体(或液体)不 加热制气体。(3)NH3 只能用碱性干燥剂,可以用 B、D、E 干燥。 (4)检验 NH3 一般用湿润的红色石蕊试纸。(5)装置①没有出气导 管,装置③易引起倒吸。
NO2 与 O2
氨、铵盐ppt1

‥ H :N ‥ H
结构式:
NH3
—
H—N
H
—
:
H
H
探 讨 :
氨的空间结构如何呢?
NH3比例模型
三角锥形结构 N
H H H
N—H键键角为107o18′
为极性分子
一、氨 2. 物理性质
颜色: 无色 气味: 有刺激性气味 水溶性: 极易溶于水(1:700) 密度:比空气大
易液化(放出大量热)
氨气
汽化(吸收大量热)
(此为检验氨气方法之一)
将氨气通入硝酸或硫酸中,写出反应 的方程式:
NH3 + HNO3 =
NH4NO3
实质:
NH3 +H+ =NH4+
2NH3 + H2SO4 = (NH4)2SO4
NH3 + HCl = NH4Cl
利用该性质工业上可制氮肥
4. 氨气的用途
性质特点
易液化,液氨 汽化时吸热 易 压强减小
溶液变红 溶液显碱性
氨气极易溶于水
酚酞溶液
探 讨 :
1.若烧瓶内为CO2气体,能否有喷泉现象呢? 2.烧杯中应该选择什么液体呢?
浓的NaOH溶液
总 结 :
喷泉产生的条件?
烧瓶中气体极易溶于烧杯中液体 或极易与烧杯中液体反应
3. 化学性质 ⑴ 氨与水的反应
探 讨 :
若改为单孔塞,能否引发喷泉实验?
如何能使NH3和水接触呢?
1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更失败。1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。14、成长是一场和自己的比赛,不要担心别人会做得比你好,你只需要每天都做得比前一天好就可以了。 15、最终你相信什么就能成为什么。因为世界上最可怕的二个词,一个叫执着,一个叫认真,认真的人改变自己,执着的人改变命运。只要在路上,就没有到不了的地方。 16、你若坚持,定会发光,时间是所向披靡的武器,它能集腋成裘,也能聚沙成塔,将人生的不可能都变成可能。 17、人生,就要活得漂亮,走得铿锵。自己不奋斗,终归是摆设。无论你是谁,宁可做拼搏的失败者 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更5、别着急要结果,先问自己够不够格,付出要配得上结果,工夫到位了,结果自然就出来了。 6、你没那么多观众,别那么累。做一个简单的人,踏实而务实。不沉溺幻想,更不庸人自扰。 7、别人对你好,你要争气,图日后有能力有所报答,别人对你不好,你更要争气望有朝一日,能够扬眉吐气。 8、奋斗的路上,时间总是过得很快,目前的困难和麻烦是很多,但是只要不忘初心,脚踏实地一步一步的朝着目标前进,最后的结局交给时间来定夺。 9、运气是努力的附属品。没有经过实力的原始积累,给你运气你也抓不住。上天给予每个人的都一样,但每个人的准备却不一样。不要羡慕那些总能撞大运的人,你必须很努力,才能遇上好运气。 10、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。失败。11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚 14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。——谢觉哉、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。 13、你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会给你最痛。
结构式:
NH3
—
H—N
H
—
:
H
H
探 讨 :
氨的空间结构如何呢?
NH3比例模型
三角锥形结构 N
H H H
N—H键键角为107o18′
为极性分子
一、氨 2. 物理性质
颜色: 无色 气味: 有刺激性气味 水溶性: 极易溶于水(1:700) 密度:比空气大
易液化(放出大量热)
氨气
汽化(吸收大量热)
(此为检验氨气方法之一)
将氨气通入硝酸或硫酸中,写出反应 的方程式:
NH3 + HNO3 =
NH4NO3
实质:
NH3 +H+ =NH4+
2NH3 + H2SO4 = (NH4)2SO4
NH3 + HCl = NH4Cl
利用该性质工业上可制氮肥
4. 氨气的用途
性质特点
易液化,液氨 汽化时吸热 易 压强减小
溶液变红 溶液显碱性
氨气极易溶于水
酚酞溶液
探 讨 :
1.若烧瓶内为CO2气体,能否有喷泉现象呢? 2.烧杯中应该选择什么液体呢?
浓的NaOH溶液
总 结 :
喷泉产生的条件?
烧瓶中气体极易溶于烧杯中液体 或极易与烧杯中液体反应
3. 化学性质 ⑴ 氨与水的反应
探 讨 :
若改为单孔塞,能否引发喷泉实验?
如何能使NH3和水接触呢?
1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更失败。1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。14、成长是一场和自己的比赛,不要担心别人会做得比你好,你只需要每天都做得比前一天好就可以了。 15、最终你相信什么就能成为什么。因为世界上最可怕的二个词,一个叫执着,一个叫认真,认真的人改变自己,执着的人改变命运。只要在路上,就没有到不了的地方。 16、你若坚持,定会发光,时间是所向披靡的武器,它能集腋成裘,也能聚沙成塔,将人生的不可能都变成可能。 17、人生,就要活得漂亮,走得铿锵。自己不奋斗,终归是摆设。无论你是谁,宁可做拼搏的失败者 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更5、别着急要结果,先问自己够不够格,付出要配得上结果,工夫到位了,结果自然就出来了。 6、你没那么多观众,别那么累。做一个简单的人,踏实而务实。不沉溺幻想,更不庸人自扰。 7、别人对你好,你要争气,图日后有能力有所报答,别人对你不好,你更要争气望有朝一日,能够扬眉吐气。 8、奋斗的路上,时间总是过得很快,目前的困难和麻烦是很多,但是只要不忘初心,脚踏实地一步一步的朝着目标前进,最后的结局交给时间来定夺。 9、运气是努力的附属品。没有经过实力的原始积累,给你运气你也抓不住。上天给予每个人的都一样,但每个人的准备却不一样。不要羡慕那些总能撞大运的人,你必须很努力,才能遇上好运气。 10、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。失败。11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚 14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。——谢觉哉、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。 13、你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会给你最痛。
氨气和铵盐课件-高一化学人教版(2019)必修第二册

C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.在装置④的水槽中加入适量生石灰并打开止水夹
典例精讲
【例 1】
喷泉是一种常见的现象,产生的原因是存在压强差。
请回答下列问题:
(1)①用如图甲所示的装置进行喷泉实验,干燥的圆底烧瓶中已装满氨气,引发喷泉的
操作是
。该实验的原理是____________________________。
②与酸反应
NH3 + HCl = NH4Cl (白烟)
【现象】
产生大量白烟
【应用】
可检验NH3或HCl
知识梳理
①浓氨水遇浓硫酸、浓硝酸也会产生白烟吗?
浓硫酸没有挥发性,浓硝酸有挥发性
挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;
难挥发性酸H2SO4、H3PO4无此现象。
② 氨与其他酸的反应:
(白
在实验室中,常利用铵盐与强
碱反应产生氨这一性质来检验
铵根离子的存在和制取氨。
反应实质:NH4++ OH-==NH3↑+H2O
思考题:为什么铵态氮肥不能与草木灰(含K2CO3) 混合施用?
草木灰中含有K2CO3, K2CO3溶液显碱性。碳酸氢铵能与碱性物质反应生成氨,
如果与碱性物质混合施用,会造成肥效降低。
知识梳理
【思考与讨论】
1、探究形成喷泉的原因是什么?
氨气极易溶于水,使上方烧瓶内压强迅速减小,形成 压强差,在大气压作
用下,下方烧杯里的水(含酚酞)被压入烧瓶,形成喷泉。
原理:氨气与水反应,生成一水合氨,使上方烧瓶内压强迅速减小,一水合
氨是一种弱碱,使酚酞变红色,产生红色喷泉
NH3+H2O
D.在装置④的水槽中加入适量生石灰并打开止水夹
典例精讲
【例 1】
喷泉是一种常见的现象,产生的原因是存在压强差。
请回答下列问题:
(1)①用如图甲所示的装置进行喷泉实验,干燥的圆底烧瓶中已装满氨气,引发喷泉的
操作是
。该实验的原理是____________________________。
②与酸反应
NH3 + HCl = NH4Cl (白烟)
【现象】
产生大量白烟
【应用】
可检验NH3或HCl
知识梳理
①浓氨水遇浓硫酸、浓硝酸也会产生白烟吗?
浓硫酸没有挥发性,浓硝酸有挥发性
挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;
难挥发性酸H2SO4、H3PO4无此现象。
② 氨与其他酸的反应:
(白
在实验室中,常利用铵盐与强
碱反应产生氨这一性质来检验
铵根离子的存在和制取氨。
反应实质:NH4++ OH-==NH3↑+H2O
思考题:为什么铵态氮肥不能与草木灰(含K2CO3) 混合施用?
草木灰中含有K2CO3, K2CO3溶液显碱性。碳酸氢铵能与碱性物质反应生成氨,
如果与碱性物质混合施用,会造成肥效降低。
知识梳理
【思考与讨论】
1、探究形成喷泉的原因是什么?
氨气极易溶于水,使上方烧瓶内压强迅速减小,形成 压强差,在大气压作
用下,下方烧杯里的水(含酚酞)被压入烧瓶,形成喷泉。
原理:氨气与水反应,生成一水合氨,使上方烧瓶内压强迅速减小,一水合
氨是一种弱碱,使酚酞变红色,产生红色喷泉
NH3+H2O
氨和铵盐课件高一下学期人教版(2019)化学必修第二册_1
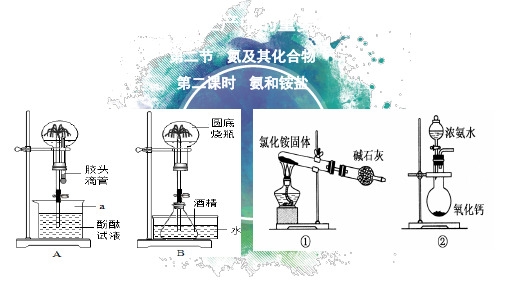
非氧化性酸的铵盐加热一
般分解为氨气和相应的酸
化学与生活
2、两位农民,小李和小刘,都种了几亩水稻.小李很勤劳,不仅 买了氮肥硝酸铵,还同时使用了自己烧制的草木灰(显碱性), 小刘只施用了氮肥硝酸铵,小李心想自己使用的肥料多,收成 一定好,结果到了秋收时发现,自己田地的产量远不及小刘的, 你知道原因吗?
铵盐对热不稳定,易分解生成氨气, 铵态氮肥要在干燥阴凉的地方储存
二、铵盐
(1)铵盐大多是易溶于水的无色或白色晶体
(2)铵盐受热发生易分解
NH4HCO3
微热
===
NH3↑+
C=== NH3↑+ HCl ↑
NH3 + HCl = NH4Cl 气体遇冷形成白色固体
这是可逆反应吗?
【重点突破】
喷泉实验原理分析 1.喷泉形成的原理:容器内外存在较大的压强差, 在压强差的作用下,液体迅速流动,通过带有尖嘴 的导管喷出来,即形成喷泉。
2.喷泉实验:
实验装置
操作及现象
结论
①打开止水夹,并
挤压滴管的胶头 ②烧杯中的溶液由 玻璃管进入烧瓶, 形成红色喷泉,瓶
氨极易溶 于水,水 溶液呈碱 性
[问题2]氨气溶于水形成的水溶液称为氨水。在一支洁净的试管中滴加几 滴氨水,将湿润的红色石蕊试纸或pH试纸粘在玻璃棒上靠近试管口,试 纸颜色会如何变化?用化学方程式或离子方程式来解释可能的原因?
实验现象:湿润的红色石蕊试纸或pH试纸变蓝色
实验原因: 氨水中挥发出来的氨气溶于水,其水溶液呈碱性。
2、氨的化学性质 (1)弱碱性 ①与水反应:
内液体呈红色
3.使容器内外产生较大压强差的两种方法: (1)减小内压法:如图Ⅰ所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A、通常状况下,氨的溶解度不大 B、氨水中的NH3 ·H2O电离出少量OH- C、溶于水的氨分子只有少量电离 D、氨本身的碱性弱
2.已知NH3在加热的条件下能将黑色的CuO 还原为红色的Cu和一种稳定的气体,请写出 此反应的化学方程式:
△பைடு நூலகம்
2NH3+3CuO == 3Cu+3H2O+N2
练习2.在右图锥形瓶中加入酒精, 水槽中加入冰水后,再加入足量的 下列物质,结果产生了喷泉。则水
打开橡皮管上的夹子, 挤压滴管的胶头,使少 量水进入烧瓶。
喷泉实验
(1)有何实验现象,此现象说明氨具有哪些性质? 烧瓶内出现喷泉,瓶内溶液呈红色 氨易溶于水,氨的水溶液呈碱性
(2)产生喷泉的原因是什么? 氨易溶于水,使烧瓶内的压强小于大气压
(3)若不能形成喷泉可能的原因有哪些? 烧瓶装置气密性不好 收集氨气时烧瓶不干燥 收集的氨气不纯或较少
-3 2、氨气具有什么性质?
还原性
3、 NH3的还原性: (1)NH3与氧气的反应:
4NH3+5O2催△化=剂 4NO+6H2O
氨的催化氧化(接触氧化)
工业制硝酸的基础
红热的铂丝
NH3
O2 无色气体
余气吸收
红棕色气体
已知NH3可以被Cl2 氧化生成N2 ①少量的 NH3 与Cl2 反应的产物是什么?
△
NH3·H2O === NH3 ↑+ H2O
演示实验 2
用两根玻璃棒分别在浓氨水和浓盐酸里蘸一下, 然后将这两根玻璃棒接近(不要接触),观察发 生的现象 2、氨气与酸的反应
NH3+HCl = NH4Cl(产生白烟)
(1)若换成蘸有硝酸的玻璃棒不接触能否反应? 若换成蘸有硫酸的玻璃棒不接触能否反应?
槽中加入的物质是:( AD )
A.浓硫酸
B.NaHCO3和NaOH溶液
C.CaCO3与稀硫酸
D.NH4HCO3与稀盐酸
四、氨的用途 ——重要的化工原料
制纤维、塑料、氨基酸 等(有机合成工业)
制铵盐、 制纯碱
氨
制尿素
制硝酸
制医用稀氨水、 用做制冷剂
练习1.关于氨的下列说法中,正确的是( D )
A、氨分子的结构呈三角锥形,是非极性分子 B、氨气为无色无味的气体 C、可用排水法收集 D、液氨可作用制冷剂
氨气对人的眼、鼻、喉等黏膜有刺激作用,接触时应小心。 如果不慎接触过多的氨而出现病状,要及时吸入新鲜空气 和水蒸气,并用大量水冲洗眼睛。
附近居民用湿毛巾捂住鼻孔呼吸,尽快逃离现场, 实施自救。
第二节 氨和铵盐 第1课时 氨
一、氨的结构
分子式 NH3
电子式
H H:N:H
NH3分子的构型
::
结构式
请写出该化学反应的方程式。 ②过量的NH3与Cl2反应的产物又是什么?
请写出该化学反应的方程式。
(2)NH3与氯气的反应:
2NH3 + 3Cl2 = N2 + 6HCl (少量的NH3) 8NH3 +3Cl2 = N2 + 6NH4Cl(过量的NH3)
思考:
• 结合所学氨气的性质分析,开始所 说的氨气泄漏事故应如何处理?
(2)将氨气通入硫酸溶液中能发生反应吗?
2、氨气与酸的反应
NH3+HCl = NH4Cl NH3+HNO3 = NH4NO3 2NH3+H2SO4 = (NH4)2SO4
氨与酸发生反应的本质是什么?
氨与酸溶液反应的离子方程式:
NH3 + H+ = NH4+
氨和酸发生反应的过程:
HNH
H
H
——从氧化还原角度来研究氨气 1、氨气中氮元素的化合价是多少?
铜陵发生液氨泄露事故
据新安晚报消息:
2007年4月8日早晨,一辆装有22吨液氨的 槽罐车,在铜陵市某地发生泄漏, 槽罐喷 出的白色气柱有四五米高,发出的“哧哧” 声一里开外就能听到,空气中弥漫着一股 浓烈的刺激性气味,周围寒气逼人。附近 居民呼吸都感到困难。
事发地点距离长江的直线距离仅500米,很 有可能导致长江污染,须及时处置,否则 后果不堪设想。
(1)氨水的成份有哪些? (2)氨水与液态氨有何区别?
NH3+H2O
NH3·H2O
NH4++OH-
分子: NH3 、 H2O、NH3·H2O 离子: NH4+、 OH- 和 H+(少量)
氨水是混合物
液氨 是氨气加压或降温后形成的液态物质, 液氨所含的微粒是NH3
液氨是纯净物
浓氨水可以做氮肥,但是否理想?为什么?
11 、这个世界从不缺乏有才能的人,但缺少有精神的人。生活是没有路标的单程轮回,固守心的航向,需要非凡的勇气。以微笑驾驭人生之舟,愿你收获一路精彩! 3 、拼搏是成功的通行证,美貌是失败的墓志铭。不要再斤斤计较于你的容貌,关键是打造自己强大的内心。朋友,凤姐就是榜样啊,你长得比她还励志,你行的! 11 、如果你知道你的具体的目的地,而且向它迈出了第一步,你便走上了成功之路!用小步而不是迈大步越过一个个障碍,你就会走向成功的巅峰。 5 、当一个人真正觉悟的一刻,他放弃追寻外在世界的财富,而开始追寻他内心世界的真正财富。 14 、心态安好,则幸福常存。有梦想,就要坚持扞卫它。人生是一场又一场离开,熟悉的陌生的,曾走近又走远的。当你真心相信一切都会好的时候,一切就会真的好了。你的目光所及,就是 你的人生境界。总是看到比自己优秀的人,说明你正在走上坡路;总是看到不如自己的人,说明你正在走下坡路。 10 、面对问题,我们不能退缩,因为退缩并不能解决问题。只有努力寻求解决之道,才是上策。 1 、没有人能给你光明,除了你自己。人的一生,总是失意的时候多,得意的时候少,无论失意还是得意,都要淡定。失意的时候要坦然,得意的时候要淡然。如果说挫折是生命的财富,那么创 伤就是前进的动力。谁的人生也不会一帆风顺,以淡然的心态去面对暂时的失败,成功也只是个时间问题。
市消防中心接到报案后立即制定方案,出动上百名消防队 员,十余量消防车……
为了防止泄露的氨气向周围扩散,向槽罐车喷水,使氨气 转化为氨水。
本节小结
结构 物理性质
化学性质
无色、有刺激性气味的气体
密度比空气小
易液化 极易溶解于水
与水反应
与酸反应 还原性
与挥发性酸
与非挥发性酸 被氧气氧化 被氯气氧化
练习1.氨水显弱碱性的主要原因是( B )
H H-N-H
107º18'
三角锥形
二、物理性质
无色 有刺激性气味 比空气小 -33.5℃ (易液化,利用液氨气化吸收 大量的热,作致冷剂) 极易溶于水,体积比1∶700
演示实验 1
在干燥的圆底烧瓶里充 满氨气, 用带有玻璃管 和滴管(滴管里预先吸入 水)的塞子塞紧瓶口。立 即倒置烧瓶,使玻璃管 插入有水的烧杯里(水里 事先加入少量酚酞试液), 按右图安装好装置。
三、化学性质
1、NH3与水的反应
NH3+H2O
NH3·H2O (一水合氨)
大部分
NH4++OH-
少量
氨水能使无色的酚酞溶液变为红色,说明氨水显碱__性_ 其主要成分是N_H_3_·H_2_O,可_部__分_电离,是_弱__电__解__质_
电离方程式是_N_H_3_·H_2_O_____N_H_4_++_O_H_-
2.已知NH3在加热的条件下能将黑色的CuO 还原为红色的Cu和一种稳定的气体,请写出 此反应的化学方程式:
△பைடு நூலகம்
2NH3+3CuO == 3Cu+3H2O+N2
练习2.在右图锥形瓶中加入酒精, 水槽中加入冰水后,再加入足量的 下列物质,结果产生了喷泉。则水
打开橡皮管上的夹子, 挤压滴管的胶头,使少 量水进入烧瓶。
喷泉实验
(1)有何实验现象,此现象说明氨具有哪些性质? 烧瓶内出现喷泉,瓶内溶液呈红色 氨易溶于水,氨的水溶液呈碱性
(2)产生喷泉的原因是什么? 氨易溶于水,使烧瓶内的压强小于大气压
(3)若不能形成喷泉可能的原因有哪些? 烧瓶装置气密性不好 收集氨气时烧瓶不干燥 收集的氨气不纯或较少
-3 2、氨气具有什么性质?
还原性
3、 NH3的还原性: (1)NH3与氧气的反应:
4NH3+5O2催△化=剂 4NO+6H2O
氨的催化氧化(接触氧化)
工业制硝酸的基础
红热的铂丝
NH3
O2 无色气体
余气吸收
红棕色气体
已知NH3可以被Cl2 氧化生成N2 ①少量的 NH3 与Cl2 反应的产物是什么?
△
NH3·H2O === NH3 ↑+ H2O
演示实验 2
用两根玻璃棒分别在浓氨水和浓盐酸里蘸一下, 然后将这两根玻璃棒接近(不要接触),观察发 生的现象 2、氨气与酸的反应
NH3+HCl = NH4Cl(产生白烟)
(1)若换成蘸有硝酸的玻璃棒不接触能否反应? 若换成蘸有硫酸的玻璃棒不接触能否反应?
槽中加入的物质是:( AD )
A.浓硫酸
B.NaHCO3和NaOH溶液
C.CaCO3与稀硫酸
D.NH4HCO3与稀盐酸
四、氨的用途 ——重要的化工原料
制纤维、塑料、氨基酸 等(有机合成工业)
制铵盐、 制纯碱
氨
制尿素
制硝酸
制医用稀氨水、 用做制冷剂
练习1.关于氨的下列说法中,正确的是( D )
A、氨分子的结构呈三角锥形,是非极性分子 B、氨气为无色无味的气体 C、可用排水法收集 D、液氨可作用制冷剂
氨气对人的眼、鼻、喉等黏膜有刺激作用,接触时应小心。 如果不慎接触过多的氨而出现病状,要及时吸入新鲜空气 和水蒸气,并用大量水冲洗眼睛。
附近居民用湿毛巾捂住鼻孔呼吸,尽快逃离现场, 实施自救。
第二节 氨和铵盐 第1课时 氨
一、氨的结构
分子式 NH3
电子式
H H:N:H
NH3分子的构型
::
结构式
请写出该化学反应的方程式。 ②过量的NH3与Cl2反应的产物又是什么?
请写出该化学反应的方程式。
(2)NH3与氯气的反应:
2NH3 + 3Cl2 = N2 + 6HCl (少量的NH3) 8NH3 +3Cl2 = N2 + 6NH4Cl(过量的NH3)
思考:
• 结合所学氨气的性质分析,开始所 说的氨气泄漏事故应如何处理?
(2)将氨气通入硫酸溶液中能发生反应吗?
2、氨气与酸的反应
NH3+HCl = NH4Cl NH3+HNO3 = NH4NO3 2NH3+H2SO4 = (NH4)2SO4
氨与酸发生反应的本质是什么?
氨与酸溶液反应的离子方程式:
NH3 + H+ = NH4+
氨和酸发生反应的过程:
HNH
H
H
——从氧化还原角度来研究氨气 1、氨气中氮元素的化合价是多少?
铜陵发生液氨泄露事故
据新安晚报消息:
2007年4月8日早晨,一辆装有22吨液氨的 槽罐车,在铜陵市某地发生泄漏, 槽罐喷 出的白色气柱有四五米高,发出的“哧哧” 声一里开外就能听到,空气中弥漫着一股 浓烈的刺激性气味,周围寒气逼人。附近 居民呼吸都感到困难。
事发地点距离长江的直线距离仅500米,很 有可能导致长江污染,须及时处置,否则 后果不堪设想。
(1)氨水的成份有哪些? (2)氨水与液态氨有何区别?
NH3+H2O
NH3·H2O
NH4++OH-
分子: NH3 、 H2O、NH3·H2O 离子: NH4+、 OH- 和 H+(少量)
氨水是混合物
液氨 是氨气加压或降温后形成的液态物质, 液氨所含的微粒是NH3
液氨是纯净物
浓氨水可以做氮肥,但是否理想?为什么?
11 、这个世界从不缺乏有才能的人,但缺少有精神的人。生活是没有路标的单程轮回,固守心的航向,需要非凡的勇气。以微笑驾驭人生之舟,愿你收获一路精彩! 3 、拼搏是成功的通行证,美貌是失败的墓志铭。不要再斤斤计较于你的容貌,关键是打造自己强大的内心。朋友,凤姐就是榜样啊,你长得比她还励志,你行的! 11 、如果你知道你的具体的目的地,而且向它迈出了第一步,你便走上了成功之路!用小步而不是迈大步越过一个个障碍,你就会走向成功的巅峰。 5 、当一个人真正觉悟的一刻,他放弃追寻外在世界的财富,而开始追寻他内心世界的真正财富。 14 、心态安好,则幸福常存。有梦想,就要坚持扞卫它。人生是一场又一场离开,熟悉的陌生的,曾走近又走远的。当你真心相信一切都会好的时候,一切就会真的好了。你的目光所及,就是 你的人生境界。总是看到比自己优秀的人,说明你正在走上坡路;总是看到不如自己的人,说明你正在走下坡路。 10 、面对问题,我们不能退缩,因为退缩并不能解决问题。只有努力寻求解决之道,才是上策。 1 、没有人能给你光明,除了你自己。人的一生,总是失意的时候多,得意的时候少,无论失意还是得意,都要淡定。失意的时候要坦然,得意的时候要淡然。如果说挫折是生命的财富,那么创 伤就是前进的动力。谁的人生也不会一帆风顺,以淡然的心态去面对暂时的失败,成功也只是个时间问题。
市消防中心接到报案后立即制定方案,出动上百名消防队 员,十余量消防车……
为了防止泄露的氨气向周围扩散,向槽罐车喷水,使氨气 转化为氨水。
本节小结
结构 物理性质
化学性质
无色、有刺激性气味的气体
密度比空气小
易液化 极易溶解于水
与水反应
与酸反应 还原性
与挥发性酸
与非挥发性酸 被氧气氧化 被氯气氧化
练习1.氨水显弱碱性的主要原因是( B )
H H-N-H
107º18'
三角锥形
二、物理性质
无色 有刺激性气味 比空气小 -33.5℃ (易液化,利用液氨气化吸收 大量的热,作致冷剂) 极易溶于水,体积比1∶700
演示实验 1
在干燥的圆底烧瓶里充 满氨气, 用带有玻璃管 和滴管(滴管里预先吸入 水)的塞子塞紧瓶口。立 即倒置烧瓶,使玻璃管 插入有水的烧杯里(水里 事先加入少量酚酞试液), 按右图安装好装置。
三、化学性质
1、NH3与水的反应
NH3+H2O
NH3·H2O (一水合氨)
大部分
NH4++OH-
少量
氨水能使无色的酚酞溶液变为红色,说明氨水显碱__性_ 其主要成分是N_H_3_·H_2_O,可_部__分_电离,是_弱__电__解__质_
电离方程式是_N_H_3_·H_2_O_____N_H_4_++_O_H_-
