中山大学港科大合编有机化学教材答案第一章
生物化学(中山大学)智慧树知到课后章节答案2023年下中山大学

生物化学(中山大学)智慧树知到课后章节答案2023年下中山大学中山大学第一章测试1.细胞在分子组成上从复杂到简单可分为哪四个层次?答案:细胞及细胞器→超分子复合物→大分子→单元分子2.细胞中最基本的元素有答案:C, H, N, O3.四大生物分子是指答案:糖、脂、蛋白质、核酸4.下列哪种说法是不正确的?答案:所有生物分子都是大分子;前手性分子具有旋光活性5.下列说法不正确的是=答案:疏水作用的强弱与分子中非极性基团的大小有关,与介质的极性无关;溶液的离子强度越强,大分子离子间的相互作用越强6.下列有关水的说法,正确的是答案:生物分子与水分子形成氢键有利也有弊;水分子之间形成氢键网络,导致其具有较高的沸点;水分子属于极性分子,可作为许多极性分子的溶剂;生物体液大都是缓冲溶液第二章测试1.在pH为8的Glu溶液中,下列哪种结构占优势?答案:NH3+和COOH都不解离2.下列说法正确的是答案:与中性氨基酸相比,酸性氨基酸的等电点偏酸,碱性氨基酸的等电点偏碱;等电点时,氨基酸主要以两性离子形式存在,净电荷为零;不同氨基酸侧链基团不同,表现出不同的物理化学性质3.具有还原性的氨基酸是答案:Cys4.下列说法不正确的是?答案:肽链氨基酸顺序的方向规定为:从C-端到N-端;多肽等电点的计算就是将所有的可解离基团的解离常数取平均值5.侧链基团含有羟基的氨基酸是答案:苏氨酸;丝氨酸6.用阳离子交换树脂分离氨基酸混合物,最先洗脱出来的是答案:酸性氨基酸7.下列关于天然蛋白质结构描述不正确的是答案:都有四级结构8.以下属于一级结构研究内容的有答案:氨基酸的种类与数量;多肽链的氨基酸顺序;二硫键的数目及位置;多肽链的数目9.关于蛋白质二级结构的描述,错误的是答案:蛋白质二级结构只有alpha-螺旋和beta-折叠两种形式10.以下关于蛋白质分子结构的论述,错误的是答案:具有活性的蛋白质不一定有特定的三维结构;蛋白质三维结构的测定方法主要是核磁共振波谱法和质谱分析法11.下列关于蛋白质结构与功能关系叙述不正确的是答案:对蛋白质进行位点突变,蛋白质的功能就会改变12.下列关于球状蛋白质的叙述不正确的是答案:大多数情况下,极性侧链位于分子外部13.游离血红素与肌红蛋白中的血红素相比,下列说法正确的是答案:肌红蛋白结合口袋空间受限,导致肌红蛋白中血红素结合CO的能力减弱14.下列方法中属于抗原—抗体相互作用原理的是答案:免疫沉淀;Immunoblotting;ELISA15.下列关于蛋白质性质的叙述不正确的是答案:蛋白质变性时,其一级结构通常并未发生改变16.下列有关SDS-PAGE说法不正确的是答案:SDS不仅可以破坏非共价相互作用,还可以断开二硫键17.20种基本氨基酸中,除甘氨酸外,其他19种氨基酸都是手性分子答案:对18.蛋白质α-helix结构由分子间氢键维系,β-pleated sheet则由分子内氢键维系答案:错19.为了鉴定蛋白质中的二硫键,胰蛋白酶常被用于对角线电泳的前处理中答案:错20.所有的天然氨基酸都是L-构型的,所有的天然单糖都是D-构型的答案:错21.维系蛋白质高级结构的作用力都是非共价相互作用答案:错22.蛋白质变性将会引起蛋白质一级结构和高级结构的改变答案:错23.肽链的碱水解将可能导致氨基酸的消旋化答案:对24. Ser-Lys-Ala-Gln-Phe和Phe-Gln-Ala-Lys-Ser是同一个五肽答案:错25.尿素分子中存在可形成氢键的基团,结果使蛋白质分子内部的氢键受到破坏,这是尿素能使蛋白质变性的一个主要原因答案:对第三章测试1.酶作为生物催化剂的四大催化特点是答案:温和、高效、专一、可调2.下面有关酶的叙述错误的是答案:酶的比活力反映的是酶催化一个反应的能力,比活力越大,酶催化能力越强;酶的催化特性不仅取决于其一级结构,也取决于它的高级结构3.全酶是指答案:酶蛋白与辅因子的结合物4.下面有关维生素与辅酶的叙述,错误的是答案:在催化反应过程中,辅酶并没有直接参加反应,而是通过非共价作用起催化作用5.脱氢反应需要的维生素是答案:核黄素;烟酸及烟酰胺6.下列有关生物素的描述错误的是答案:机体很容易缺乏生物素,导致脱发、脂溢性皮炎等症状;它属于B族维生素,分子中含有硫,不溶于水7.下面有关脂溶性维生素叙述错误的是答案:每种脂溶性维生素只有一种结构8.有关酶的抑制作用下列说法正确的是答案:有别于酶的失活作用;分为可逆抑制作用和不可逆抑制作用9.酶的非竞争性抑制剂的动力学特点是答案:K m值不变或可变,V max减小10.下列哪一种情况可以通过增加[S]的办法减轻抑制程度?答案:竞争性可逆抑制作用11.下列中用于解释酶作用高选择性的机制是答案:Lock and key model;Induced fit model;Three sites binding theory 12.下列说法不正确的是!答案:酶与底物形成的复合物都是非共价复合物13.下面说法不正确的是*答案:诱导契合学说可用于解释酶的高效性14.下列有关酶催化机制说法错误的是答案:蛋白酶的活性部位都存在“催化三联体”;碳酸酐酶属于金属酶15.限速步骤的酶通常是具有变构调节作用的酶答案:对16.PITC抑制剂通过结合蛋白质中的半胱氨酸,从而改变酶活中心的构象答案:错17.所有的酶都具有高度的专一性,底物结构稍加改变,酶促反应速率骤降。
有机化学答案第1章 习题和解答

CHC CH 3-CH=CH-CH 2-1.有机化合物和无机盐在沸点、熔点及溶解度方面有哪些差异?说明理由。
有机化合物主要以共价键结合,分子间相互吸引力很弱,所以其熔点、沸点较低,一般不溶于水而溶于有机溶剂。
无机盐以离子键结合,正负离子的静电引力非常强,故其熔点、沸点都很高,通常不溶于有机溶剂而易溶于水。
2.价键理论与分子轨道理论的主要的区别是什么?解:价键理论和分子轨道理论都以量子化学对波函数的近似处理为基础,其不同处在于,价键理论形象直观,对成键电子是用定域的观点,常用于描述非共轭体系。
分子轨道理论的观点是离域的观点,比较抽象,较难理解,但可以解释共轭体系。
3.在有机化合物分子中,分子中含有极性键是否一定为极性分子?解:不一定。
含极性键的分子中,如果结构对称,正负电荷重心重合,即为非极性分子。
4.写出符合下列条件且分子式为C 3H 6O 的化合物的结构式:(1)含有醛基 (2)含有酮基 (3)含有环和羟基 (4)醚 (5)含有双键和羟基(双键和羟基不在同一碳上)解:(1)CH 3CH 2CHO (2) CH 3COCH 3 (3)OH(4)CH 3OCH 2CH 3 (5) CH 2=CHCH 2OH5.指出下列化合物中带“*”号碳原子的杂化轨道类型:解: 分别为 sp 3 杂化、sp 杂化、sp 2杂化、sp 2杂化 6.请指出 结构中各碳原子的杂化形式。
解:从左到右依次为sp 3 杂化、sp 2杂化、sp 2杂化、sp 3杂化、sp 杂化、sp 杂化CH 3CH 3*H C C H *H C=C H 22**7.下列化合物哪些是极性分子?哪些是非极性分子?(1)CH 4 (2)CH 2Cl 2 (3)CH 3CH 2OH (4)CH 3OCH 3 (5)CF 4 (6)CH 3CHO(7)HCOOH解:(1)非极性分子(2)极性分子(3)极性分子(4)极性分子(5)非极性分子(6)极性分子(7)极性分子8.使用“δ+”和“δ-”表示下列键极性。
有机化学课后习题 答案(全)

目录第一章绪论 (2)第二章饱和烃 (3)第三章不饱和烃 (7)第四章环烃 (14)第五章旋光异构 (22)第六章卤代烃 (27)第七章波谱分析 (33)第八章醇酚醚 (34)第九章醛、酮、醌 (41)第十章羧酸及其衍生物 (50)第十一章取代酸 (58)第十二种含氮化合物 (65)第十三章含硫和含磷有机化合物 (72)第十四章碳水化合物 (74)第十五章氨基酸、多肽与蛋白质 (78)第十六章类脂化合物 (82)第十七章杂环化合物 (88)第一章 绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
1.2NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4 及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么?答案: NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na + , K + , Br -, Cl -离子各1mol 。
由于CH 4 与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4 写出下列化合物的Lewis 电子式。
a. C 2H 4b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4h. C 2H 6i. C 2H 2j. H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H c.H N Hd.H S He.H O NO f.O C H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OS H H或1.5 下列各化合物哪个有偶极矩?画出其方向。
有机化学完整版答案(1-20)

第一章(一) 用简单的文字解释下列术语:(1) 有机化合物:碳氢化合物及其衍生物。
(2) 键能:形成共价鍵时体系所放出的能量。
(3) 极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
(4) 官能团:决定有机化合物的主要性质的原子或原子团。
(5) 实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6) 构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7)均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8) 异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9) sp 2杂化:由1 个s 轨道和2个p 轨道进行线性组合,形成的3个能量介于s 轨道和p 轨道之间的、能量完全相同的新的原子轨道。
sp 2杂化轨道的形状也不同于s 轨道或p 轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(10) 诱导效应:由于成键原子的电负性不同而引起的电子云的转移。
诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。
(11) 氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol 。
(12) Lewis 酸:能够接受的电子的分子或离子。
(二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。
(1) C H 3N H 2 (2) C H 3O C H 3 (3)CH 3C OH O(4) C H 3C H =C H 2 (5) C H 3C C H (6) CH 2O 解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis 结构式如下:(1) CH HH H H。
大一有机化学答案
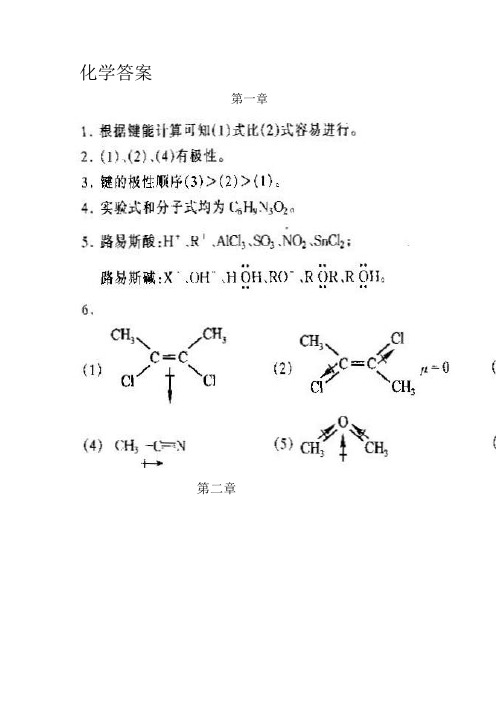
化学答案第一章第二章•3-甲基戊烷(3) 2,4-二甲基-3-乙基戊烷•2,2,3-三甲基丁烷(5) 2,3,4-三甲基己烷(6) 2,2,5-三甲基-6-异丙基壬烷(4)5. (1) .(2)都是等同的6. (1)第三章7. 属于同分异构体的是(1) (2),(3) (4) 属于同种物质的是(3) (5)属于同系物的是(1)(3), (2)(3), (1)(4), (2)(4)第三章 习题参考答案•(1) 3,4-二甲基-1,3-戊二烯 (2)5-甲基-3-己烯-1-炔(3) (E)-3-甲基-2-戊烯 (4)(Z)-2-甲基-3-乙基-3-己烯(5)2,6-二甲基-2-庚烯 (6) 丙炔银 (7) 3,3-二甲基-1-戊烯 (8) 4-甲基-2-戊炔2. (3)(4) (5)(2) CH 2C HCCH+Br 2BrH 2CC H Br C CH3. (2) ,(3)有顺反异构体。
结构式略。
4.(6) C H3C C H2C H2C H2C H2C CH3O O(8) (9)(10) (11)(12 )CH3CH3(13)CH3CH2CH2Br(14) (15) OHOH 5.(1)(2)1-丁炔2-丁炔丁烷[Ag(NH3)2+]白色沉淀无现象无现象溴水褪色无变化(C H3C H2C H2)3B,C H3C H2C H2OH6.7. 其结构式为:8. (2) > (3) > (1)9. 其结构式为:10. A,B的结构式分别为:第四章•(1) 1,1-二甲基-2-异丙基环丙烷(2) 5-甲基螺[2,4]庚烷(3) 2-甲基-3-环丙基丁烷(4) 1-甲基-3-乙基环己烷(5) 2-硝基苯磺酸(6)1,7-二甲基萘(7) 双环[3,2,1]辛烷(8)1-甲基-1,3-环戊二烯(9) 4-硝基-2-氯甲苯(10)1,2-二苯乙烯3. (3),(5),(6) 有芳香性,因为其结构为平面共轭的,且 电子数符合(4n+2)(1),(2),(4) ,(7),(8)无芳香性。
有机化学课后习题及答案(第一章)

XXX 大学有机化学习题解答1章 思 考 题1.1 什么是同系列与同分异构现象? 1.2 什么叫诱导效应?1.3 影响有机化学反应活性的主要因素有哪些?1.4 在沸点、熔点和溶解度方面,有机化合物和无机盐有哪些差别?1.5 正丁醇的沸点(118℃)比它的同分异构体乙醚的沸点(34℃)高得多,但这两个化合物在水中的溶解度却相同(每100克水溶解8克),怎样说明这些事实? 1.6根据共价键的断裂方式推测反应机理的可能类型有哪些?解 答1.1 答:具有同一个分子结构通式,且结构和性质相似的一系列化合物称为同系列。
分子式相同而结构相异,因而其性质也各异的不同化合物,称为同分异构体,这种现象叫同分异构现象。
1.2 答:因某一原子或基团的电负性而引起电子云沿着键链向某一方面偏移的效应叫诱导效应。
1.3 答:影响有机化学反应活性的因素主要有三个:底物(反应物)的结构和特性,进攻试剂的性质和反应环境条件(温度、压强、溶剂、反应时间等)。
1.4 答:有机物的沸点、熔点比无机盐低。
在水中的溶解度比无机盐小。
1.5 答:溶解度跟有机物和水分子间形成的氢键有关,因二者和水解都能形成氢键,而沸点与同种物质分子间氢键有关,正丁醇分子间能形成氢键,乙醚分子间不能形成氢键。
1.6 答:自由基反应和离子型的反应。
习 题1.1 用系统命名法命名下列化合物。
(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)(14)1.2 写出下列化合物的结构式。
(1)4-乙基-4-氯-己酸-4-甲基戊酯 (2)N-(2-氨基丁基)-4-甲氧基苯胺 (3)2,6,6-三甲基双环[3.1.1]-2庚烯 (4)3-(1-甲基-8氨基-2-萘基)丁酸 1.3 写出的(1) (2) (3)(4)(5)可能结构式并指出上述每一结构式中的官能团。
1.4 下列化合物有无极矩?如有指出其方向。
(a )(b )(c )(d )(e) (f) (g)1.5 化合物Ⅰ、Ⅱ和Ⅲ都是NH 3的衍生物,存在于某些鱼的分解产物中。
大学《有机化学》课后习题答案
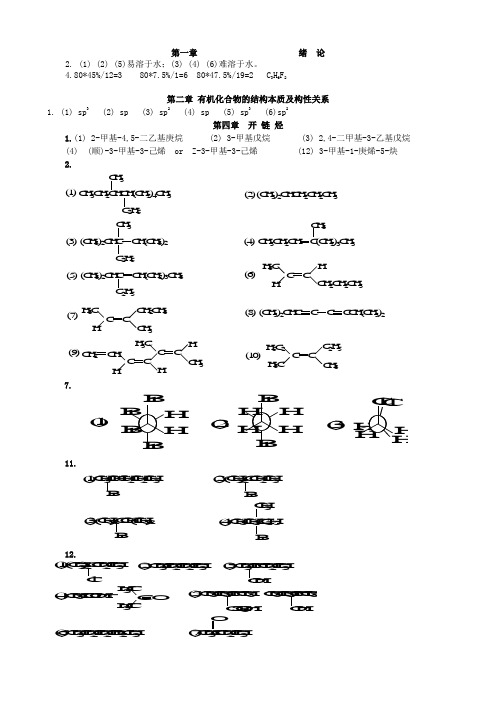
第一章绪论2. (1) (2) (5)易溶于水;(3) (4) (6)难溶于水。
4.80*45%/12=3 80*7.5%/1=6 80*47.5%/19=2 C3H6F2第二章有机化合物的结构本质及构性关系1.(1) sp3 (2) sp (3) sp2 (4) sp (5) sp3 (6)sp2第四章开链烃1.(1) 2-甲基-4,5-二乙基庚烷 (2) 3-甲基戊烷 (3) 2,4-二甲基-3-乙基戊烷(4) (顺)-3-甲基-3-己烯 or Z-3-甲基-3-己烯 (12) 3-甲基-1-庚烯-5-炔2.7.11.12.14. (5) > (3) > (2) > (1) > (4) 即: CH2=CHC +HCH 3 >(CH3)3C + >CH 3CH 2C +HCH 3 >CH 3CH 2CH 2C +H 2> (CH 3)2CHC +H 216. (1)(2)(3)17.21AB.10.(1)CH 3-CH=CH 2−−−−−→−+H /KMnO 4CH 3COOH(2)CH 3-C≡CH+HBr(2mol ) CH 3CBr 2CH 3(3)CH 3-3-C=CH 2−−→−2Br CH 3CBr 2CH 2Br 第四章 环 烃 2.1-戊烯 1-戊炔 戊 烷Br 2/CCl 4室温,避光√ 溴褪色√ 溴褪色× × √灰白色1-丁炔 2-丁炔 丁 烷Br 2/CCl 4 室温,避光√溴褪色 × Ag(NH 3)2+√灰白色↓ × ×1,3-丁二烯 1-己炔 2,3-二甲基丁烷Br 2/CCl 4√ 溴褪色 √ 溴褪色 × Ag(NH 3)2+×√ 灰白色↓C(CH 3)3CH 3(1)(2)(3)3.(1)反式CH 3Br(3)顺式4.C H 3B rC lC l +C l C lC O O HH 3CO 2N (C H 3)3C C O O H(1)(2)(3)(4)(5)(6)(7) B rC 2H 5C 2H 5B r +C H 3C O C H 3(C H 3)2C C H (C H 3)2B r(8) 1molCl 2 / h, 苯/无水AlCl 3N H C O C H 3N O 2C H 3C H 3S O 3H(9) (10)7. (2)有芳香性 10.第六章 旋光异构6-32. (1)× (2)× (3)× (4)√ (5)√ (6)√7.2.66120678.58.18][20+=⨯÷+=⨯=l c Dαα第七章 卤 代 烃2、C l C lC l (2)4、第八章 醇、酚、醚1. (1) 3-甲基-3-戊烯-1-醇 (2) 2-甲基苯酚 (3) 2,5-庚二醇 (4) 4-苯基-2-戊醇 (5) 2-溴-1-丙醇 (6) 1-苯基乙醇(7) 2-硝基-1-萘酚 (8) 3-甲氧基苯甲 (9) 1,2-二乙氧基乙烷(乙二醇二乙醚)(1)(2)3、4. (1) 甲醇 分子间氢键 (6) 邻硝基苯酚 分子内氢键、分子间氢键 5、(1)CH 2IH 3COOH(5)(6)HOOCH 3H(7)6、AgNO 3/乙醇,室温白↓× ×AgNO 3/乙醇,加热白↓×OH+OHBrBr(1)(2)10、OH O ClA B C D第九章醛、酮、醌一、命名下列化合物。
科学出版社有机化学第一章 绪论答案
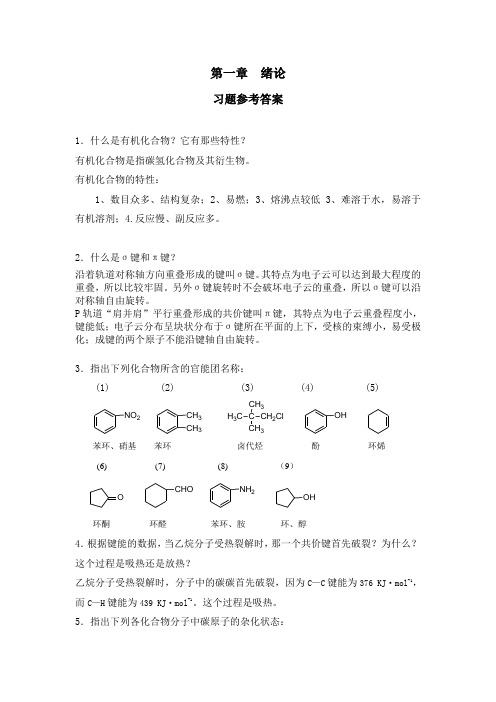
第一章绪论习题参考答案1.什么是有机化合物?它有那些特性?有机化合物是指碳氢化合物及其衍生物。
有机化合物的特性:1、数目众多、结构复杂;2、易燃;3、熔沸点较低3、难溶于水,易溶于有机溶剂;4.反应慢、副反应多。
2.什么是σ键和π键?沿着轨道对称轴方向重叠形成的键叫σ键。
其特点为电子云可以达到最大程度的重叠,所以比较牢固。
另外σ键旋转时不会破坏电子云的重叠,所以σ键可以沿对称轴自由旋转。
P轨道“肩并肩”平行重叠形成的共价键叫π键,其特点为电子云重叠程度小,键能低;电子云分布呈块状分布于σ键所在平面的上下,受核的束缚小,易受极化;成键的两个原子不能沿键轴自由旋转。
3.指出下列化合物所含的官能团名称:(1) (2) (3) (4) (5)NO2CH3CH3H3C CCH3CH3CH2Cl OH苯环、硝基苯环卤代烃酚环烯(6) (7) (8) (9)O CHO NH2OH环酮环醛苯环、胺环、醇4.根据键能的数据,当乙烷分子受热裂解时,那一个共价键首先破裂?为什么?这个过程是吸热还是放热?乙烷分子受热裂解时,分子中的碳碳首先破裂,因为C—C键能为376 KJ·mol-1,而C—H键能为439 KJ·mol-1。
这个过程是吸热。
5.指出下列各化合物分子中碳原子的杂化状态:(1)(2)(3)H3C CH CHCHO sp3sp2sp2sp2CH3sp3CH CH2sp2sp2苯环上的碳原子是sp2 杂化环己烷上的碳原子是sp3杂化(4)(5)(6)HC CCH2CH CH2sp3sp sp sp2sp2H2C C CHCH3sp2sp sp2sp3H3C COOHsp3sp2。
有机化学第一章绪 论习题答案

第一章绪论1-1 扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
有机化学课后习题参考答案完整版

目录第一章绪论 0第二章饱和烃 (1)第三章不饱和烃 (5)第四章环烃 (13)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应用 (33)第八章醇酚醚 (43)第九章醛、酮、醌 (52)第十章羧酸及其衍生物 (63)第十一章取代酸 (71)第十二章含氮化合物 (77)第十三章含硫和含磷有机化合物 (85)第十四章碳水化合物 (88)第十五章氨基酸、多肽与蛋白质 (99)第十六章类脂化合物 (104)第十七章杂环化合物 (113)Fulin 湛师第一章 绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离子各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H H H HCC HH HH 或 b.H C H H c.H N H Hd.H S H e.H O NOf.OC H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OS H H或1.5下列各化合物哪个有偶极矩?画出其方向。
有机化学各章习题与及答案

3
CH 2CHCH CHCH 3
H 2C C CH CH 2
CH 3
17.下面三种化合物与一分子HBr加成反应活性最大的是( )
A. B. C.PhCH CH 2
p O 2NC 6H 4CH CH 2
p CH 3C 6H 4CH CH 2
CH 3
Cl
KOH/C H OH
3
CH 3
19.下列化合物稳定性最大的是( )
A. B.C. D.
H 3C CH 2H 3C
CH 3H 3C
CH 3
H 3C
CH 3CH 3
第四章炔烃和二烯烃
1.在含水丙酮中,p-CH 3OC 6H 4CH 2Cl的水解速度是C 6H 5CH 2Cl的一万倍,原因是( )
B. 3种
C. 4种
D. 5种
16.化合物的分子式为C5H12一元氯代产物只有一种,结构式是( )
A.C(CH3)4 B. CH3CH2CH2CH2CH3
C. (CH3)2CHCH2CH3
17.下列分子中,表示烷烃的是( )
A. C2H2
B. C2H4
C. C2H6
D. C6H6
18.下列各组化合物中,属同系物的是( )
序为( )
A. a>b>c>d
B. b>a>c>d
C. a>b ≈c>d
D. c>b>a>d 5.下列烯烃发生亲电加成反应最活泼的是( )
A.(CH 3)2C=CHCH 3
B. CH 3CH=CHCH 3
C. CH 2=CHCF 3
D. CH 2=CHCl 3 6.下列反应中间体的相对稳定性顺序由大到小为( )
有机化学课后习题答案

有机化学课后习题答案第一章绪论习题参考答案1. 某化合物的分子量为60,含碳%、含氮%、含氧%,确定该化合物的分子式。
解:① 由各元素的百分含量,根据下列计算求得实验式1:2:133.3:7.6:34.3162.53:17.6:121.40== 该化合物实验式为:CH 2O② 由分子量计算出该化合物的分子式216121260=+?+该化合物的分子式应为实验式的2倍,即:C 2H 4O 22. 在C —H 、C —O 、O —H 、C —Br 、C —N 等共价键中,极性最强的是哪一个?解:由表1-4可以查得上述共价键极性最强的是O —H 键。
3. 将共价键⑴ C —H ⑵ N —H ⑶ F —H ⑷ O —H 按极性由大到小的顺序进行排列。
解:根据电负性顺序F > O > N > C ,可推知共价键的极性顺序为: F —H > O —H > N —H > C —H4. 化合物CH 3Cl 、CH 4、CHBr 3、HCl 、CH 3OCH 3中,哪个是非极性分子?解:CH 4分子为高度对称的正四面体空间结构,4个C —H 的向量之和为零,因此是非极性分子。
5. 指出下列化合物所含官能团的名称和该化合物所属类型。
CH 3OH(2)碳碳三键,炔烃羟基,酚(4)COOH酮基,酮羧基,羧酸(6) CH 3CH 2CHCH 3OH醛基,醛羟基,醇(1) CH 3CH 2C CH(3) CH 3COCH 3(5) CH 3CH 2CHO(7) CH3CH2NH2氨基,胺6. 甲醚(CH3OCH3)分子中,两个O—C键的夹角为°。
甲醚是否为极性分子?若是,用表示偶极矩的方向。
解:氧原子的电负性大于碳原子的电负性,因此O—C键的偶极矩的方向是由碳原子指向氧原子。
甲醚分子的偶极矩是其分子中各个共价键偶极矩的向量之和,甲醚分子中的两个O—C键的夹角为°,显然分子是具有极性的,其偶极矩的方向如下图所示。
有机化学第一章课后习题解答

第一章1、请解释下列名词。
杂化:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的能量相等的轨道的过程即为杂化。
偶极矩:反映键极性大小的量度。
在空间中具有两个大小相等、符合相反的分子构成一个偶极。
正负电荷间的距离d与正电中心或负电中心所带的电荷的值q的成绩为偶极矩,有方向。
诱导效应:因分子中原子或基团的电负性不同而引起成键电子云沿着原子链向某一方向移动的效应。
范德华力:瞬时偶极和诱导偶极的相互作用产生一种很弱的分子间作用力。
疏水作用:非极性分子在水相环境中相互聚集从而避开水的斥力的一种弱的非共价相互作用。
3、请指出下列分子哪些具有偶极,并指出方向。
H2O 两H原子中心方向指向O原子中心方向HBr H原子指向Br原子CHCl3H原子指向三个Cl原子中心方向CH3CH2OH 乙基指向羟基方向CCl4、O2均无偶极4、用普通命名法命名下列烷烃。
(4)2,2-二甲基丙烷7、指出下列分子的共轭酸碱对。
(1)CH3COOH/CH3COO-H2O/H3O+(2)H2SO4/HSO4- CH3OH/CH3OH2+(3)HNO3/NO3- (CH3)3N/(CH3)3NH+8、将下列化合物按极性大小排列。
CH3Cl>CH3F>CH3Br>CH3I>CH410、含有一个氧原子的某醇分子中,碳的含量为68.2%,氢的含量为13.6%。
试写出这个化合物的分子式及可能的结构式。
分子式:C5H12O可能的结构式:CH3CH2CH2CH2CH2OH CH3CHOHCH2CH2CH3CH3CH2CH2OHCH2CH3 CH2(OH)CH2(CH3)CH2CH3(CH3)2COHCH2CH3 (CH3)2CHCHOHCH3(CH3)2CHCH2CH2OH (CH3)3CCH2OH。
有机化学 第一章 绪论 习题答案

第一章 绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
1.2NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4 及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么?答案: NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na + , K + , Br -, Cl -离子各1mol 。
由于CH 4 与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4 写出下列化合物的Lewis 电子式。
a. C 2H 2b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4h. C 2H 6i. C 2H 2j. H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H c.H N HHd.H S He.H O NO f.O C H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OO H H或1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I 2b. CH 2Cl 2c. HBrd. CHCl 3e. CH 3OHf. CH 3OCH 3 答案:b.ClClc.HBrd.HCe.H 3COHH 3COCH 3f.1.6 根据S 与O 的电负性差别,H 2O 与H 2S 相比,哪个有较强的偶极-偶极作用力或氢键? 答案:电负性 O > S , H 2O 与H 2S 相比,H 2O 有较强的偶极作用及氢键。
有机化学习题与解答.doc

有机化学习题与解答《有机化学》重点课程建设组编印2012.10目录第一章绪论---------------------------------------------------------4 第二章烷烃---------------------------------------------------------5 第三章单烯烃------------------------------------------------------12 第四章炔烃和二烯烃------------------------------------------------18 第五章脂环烃------------------------------------------------------28 第六章对映异构----------------------------------------------------34 第七章芳烃--------------------------------------------------------45 第八章现代物理实验方法的应用--------------------------------------54 第九章卤代烃------------------------------------------------------60 第十章醇酚醚----------------------------------------------------74 第十一章醛酮-----------------------------------------------------84 第十二章羧酸------------------------------------------------------92 第十三章羧酸衍生物------------------------------------------------95 第十四章含氮化合物------------------------------------------------97 第十五章杂环化合物-----------------------------------------------101 第十六章碳水化合物-----------------------------------------------104 第十七章蛋白质和核酸---------------------------------------------113 第十八章甾萜化合物-----------------------------------------------116第一章绪论习题1.甲基橙是一种含氧酸的钠盐,它的含碳量51.4%、氮12.8%、硫9.8%和钠7.0%,问甲基橙的实验式是什麽?2.胰岛素含硫3.4%,其分子量为5734,问一分子中可能有多少硫原子?3.元素定量分析结果,指出某一化合物的实验式为CH,测得其分子量为78,问它的分子式是什麽?4.根据键能数据,当乙烷(CH3-CH3)分子受热裂解时,哪种共价键首先破裂?为什么?这个过程是吸热反应还是放热反应?5.写出下列反应能量的变化?6、根据电负性数据,用和标明下列键或分子中带部分正电荷和部分负电荷的原子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cl C C Cl
H H
Cl C C H
Cl H
Cl C C H
H Cl
习题 1-10
CO2 为线型分子,其中 C 以 sp 杂化轨道分别与两个氧原子形成两个σ键,而以两个相互 垂直的 p 轨道分别与两个氧原子的 p 轨道形成π键,其轨道成键图如下:
O
C
O
O
C
O
习题 1-10
CH3CN 中氰基―C≡N 中 C 和 N 均为 sp 杂化,其轨道成键情况参见乙炔分子。
:: ::
H (1) H : C: O: H
(2)
H
H H H: C: N: C: H H H H
(3)
: C: O H: C:
H H
H
: O: (4) : : : O S: O: :
2+
: :
: : : ::
::
: ::
(5)
N
O
(6)
N N N
N N N
(7)
H C H: C: H H
: : : : : :
H C O H
(2)
H H
2 C NCH3 中 C、N 也以 sp 杂化轨道形成σ键。以 p 轨道形成π键,N 上一对孤对电子占据
一个 sp2 杂化轨道,分子形状为
H C N H
CH3
习题 1-14
(1) CH3 CH CH2 sp2 (4) CH3 C sp (7) CH3 C H (10) N sp3
(2) ① (4) O
O ② CH3 C H CH3 ②
(3) CH3 NH CH2CH2 C N ②
习题 1﹣27
H C C CH2 ①
①
(1)
H H3 C
C C 是
CH2 CH3 H OCH3 CH 3 不一定 不一定
(2)
H3 C
O C 是
CH2 是
O C
CH3
(3)
C C 是
(4)
C CH3 不是 不是
HMgBr
不合理
习题 1﹣28
(1) (2) (3)
CH 3CH2 OH + ClCH 2 CH 3 O H 3 C C CH 3 + HOCH 3 HOCH 3
CH 3 CH 2OCH 2CH 3 + HCl HO OCH 3 C H 3C CH 3 合理
合理
CH 3 CH 2MgBr +
CH 3 CH 2OCH 3 +
3
(略)请参阅教材 38-39 页的表 1-5
δ
(1) H3C Cl
(2)
F Br
(3) H3C NH2
δ
δ
(4)
HO Br
δ
δ
(5) H 3C OH
δ
δ
δ
(6) H 3C MgBr
δ
δ
δ
(7)
H 2N OH
(8)
H δ CH 3
O C
δ
习题 1-17
(1) H (5) H
O
(2) O
(3) H (7) CH3 H C N H
O 醚 醇
N
OH
H N
(2)
NH2 胺
(4)
N HHN Nhomakorabea(3)NH
OH
O O
亚胺
O (5) OH 酸
习题 1﹣23
环胺
O H 羟基醛 O OH
烯醇
醛
环醚
HO
过氧醇
(1)CH3CH2OH 中的 C-O-H 键的键角约为 109.5°; (2)(CH3)2NH 中的 C-N-C 键的键角略大于 109.5°; (3)CH3OCH3 中的 C-O-C 键的键角略大于 109.5°; (4)CH2=O 中的 H-C-H 键的键角约 120°; (5) H3C C N 中的 C-C-N 键的键角为 180°; (6) HC C CH3 中的 C-C-C 键的的键角为 180°; (7)CH2=C=CH2 中的 C-C-C 键的键角为 180°; (8)HCOOH 中的 O-C-O 键的键角约为 120°。 习题 1﹣24
Cl
(2) CH3 CHCH2 CH 2CHCH 3 OH OCH 3
::
::
:
:
O
:
:
:
:
OH
: O
:
O
CH3 (3) H3C C CH2CH2Cl CH3
O (5) CH3CH2COCH3
Cl
(4)
(CH3)2NCH2CH2CH3
N
O (6) (CH3)2CHCH2CHO H
习题 1-4 (1)可以,因为轨道可以有效重叠成键,如下图(a) ; (2)不可以,因为轨道间不是同位相相加, 故不能有效重叠成键,如下图(b)和(c) 。
N: H
H (8) H : C: C: C: H
H O H
习题 1﹣21
: : :
H H
H H
:: ::
:: : : : :
(9)
O: H: C:
试写出满足下列要求的只含有碳和氢两种元素原子的有机化合物的 Kekulé 结构式。
: :
(10)
H: C: C H H
(1)
(2)
(3)
习题 1﹣22
(1)
(5)
H C N O
:
(6)
H C N H
C原子应带电荷
O原子应带电荷
更改为:
H Cl : (1) H C C O: H
(3)
H H C N N:
(4)
H H C O H :
Br
H :: : (5) H C N O : (6)
H C N H
习题 1-3
(1) CH 3CHCH2 CH2 CH 2 Cl Br
(2) CH3 OH < CH3 Cl (4) CH3 OCH3 > CH3 SCH3
(5) CH3 NH CH2CH2 C N
小 大
(6)
H C C CH2
大
CH3 C H CH3 小
习题 1﹣26
说明:图中序号越大,键长越长,键强越弱。
(1) CH3
CH2 ④
CH CH CH2 C CH ③ ② ①
(a) (b) (c)
习题 1-5* (1)因为反键分子轨道上有一个电子,具有相对稳定性; (2)因为成键与反键分子轨道都全部充满电子,体系能量没有有效降低,所以不能稳定存在; (3)两个氮原子的 2p 轨道各有 3 个单电子,它们相互结合形成三个成键轨道和三个反键轨道,而 6 个电子将在成对地填充在三个成键轨道上,所以 N2 分子可以稳定存在; (4)O2-可以看成是 1 个氧原子(O,4 个 2p 电子)与 1 个氧负离子(O-,5 个 2p 电子)结合而成, 各自的 3 个 2p 轨道组成 3 个成键和 3 个反键轨道, 9 个电子在成对充满 3 个成键轨道后, 还有 3 个电 子在反键轨道,因此,该负离子具有相对稳定性。 注意: N2 分子和 O2 分子属于同核双分子, 其分子轨道的形成以及电子填充请详见结构化学中的讨论。 以上只是十分粗略地从成键轨道和反键轨道进行间要说明。 不存在异构体; 如碳不是四面体构型, 而是平面正方形, 则 CH2Cl2 习题 1-6 答: CH2Cl2 只有一种结构, 有两个异构体(构型) 。 习题 1-7 NH3 中 N 和 H2O 中 O 均以 sp3 杂化轨道成键,N 有一对孤对电子,分子呈角锥状,O 有二 对孤对电子,分子呈 V 型;由于孤对电子的排斥作用,H—N—H 和 H—O—H 键角小于 109.5º。 习题 1-8 三个二氯乙烯异构体:
sp3
O CH3 sp2 C H3C N 2 N C sp CH C C N O N sp3 CH3 sp2
习题 1﹣25
sp3
sp2
HOH2C O HOHC C O sp3 C C H除外 HO OH
sp2
(1) CH 3 Br < CH 3 Cl (3) CH3 OCH3 > CH3 NHCH3
习题 1-15 习题 1-16
δ δ δ
(2) CH3CH2OCH3 sp3 (5) CH3OCH2OCH3 sp
3
(3) CH3CH2=NH sp2 (6) CH3NHCH3 sp3 (9) N C CH2 C N sp (12) CH3 sp3
CH
O
sp2
(8) CH3CH2CH2OH sp (11) O sp2
习题 1-11 各种不同杂化状态的碳形成的 C—Cσ键强度顺序为:Csp—Csp> Csp2—Csp2> Csp3—Csp3。因 为 sp 轨道中 s 成分多,离核近,而 sp2 、 sp3 则逐渐减少。 习题 1-12
CH3 CH CH CH3
SP3 SP2
CH C CH
SP
习题 1-13 (1)HCHO 中 C、O 均以 sp2 杂化轨道成σ键,而以 p 轨道形成π键,分子形状为三角形:
第一章
习题 1-1
有机化合物分子结构基础
(3) H:N:N:H H H
(1)
H:Cl
(2) H:O:N::O
(4)
O::C::O
(5)
H:N:H
+ Na
O (6) Cl:C:Cl
H H (7) H:C:O:C:H H H
(8)
H H H:C:C:O:H H H
(9)
H H:C:C::O: H H
(10)
0
(4)
C N
O (8) H3 C C O H
C O
(6) H3 C
