化学选修三第一章归纳总结带配套练习测试题
(完整版)高二化学选修三第一章测试题

(完整版)⾼⼆化学选修三第⼀章测试题⾼⼆化学选修三第⼀章测试题满分100 分考试时间:90 分钟. 分数第I卷(共60分)⼀、选择题(每题有只有 1 个正确答案,每题 3 分,共60 分)1、在下⾯的电⼦结构中, 第⼀电离能最⼩的原⼦可能是()A、ns 2np6B、ns2np5C、ns2np4D、ns 2np32、X原⼦的最外层电⼦的排布为ns2np4,则X的氢化物的化学式是()A. HXB. H2XC. XH 3D. XH 43、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是()A X与丫形成化合物是,X可以显负价,丫显正价B在元素同周期表中X可能位于Y的右⾯C最⾼价含氧酸的酸性:X对应的酸性弱于于丫对应的D Y的⽓态氢化物的稳定性⼩于X的⽓态氢化物的稳定性4、下列说法中正确的是()A、所有的电⼦在同⼀区域⾥运动B能量⾼的电⼦在离核近的区域运动,能量低的电⼦在离核远的区域运动C、处于最低能量的原⼦叫基态原⼦D同⼀原⼦中,1s、2s、3s所能容纳的电⼦数越来越多5、在第n电⼦层中,当它作为原⼦的最外层时容纳电⼦数最多与第(n-1)层相同;当它作为原⼦的次外层时,其电⼦数⽐(n-1)层多10个,则对此电⼦层的判断正确的是()A、必为K层B、只能是L层C、只能是M层D、可以是任意层6、⼀个电⼦排布为1s22s22p63s23p1的元素最可能的价态是()A、+3B、+2C、+1D、-17、下列各原⼦或离⼦的电⼦排布式错误的是()2 2 6 2 1 2- 2 2 6 + 2 2 6 2 2 2A 、Al 1s 2s 2p3s 3pB 、O 1s 2s 2pC 、Na 1s 2s 2pD 、Si 1s 2s 2p8、在元素周期表的第四周期的主族元素中,⾦属元素的种数是()A 4种B 、5种C 、6种D 、7种9、具有下列电⼦排布式的原⼦中,半径最⼤的是() A 、 ls 22s 22p 63s 23p 3 B 、 1s 22s 22p 3 C 、 1s 22s 2sp 5D 、22624 1s 22s 22p 63s 23p 4 10、 x 、 y 为两种元素的原⼦, x 的阴离⼦与 y 的阳离⼦具有相同的电⼦层结构,由此可知()A 、 x 的原⼦半径⼤于 y 的原⼦半径。
高二化学选修三第一章测试题

高二化学选修三第一章测试题满分100分考试时间:90分钟. 分数第Ⅰ卷(共60分)一、选择题(每题有只有1个正确答案,每题3分,共60分)1、在下面的电子结构中,第一电离能最小的原子可能是 ( )A、 ns2np6B、ns2np5C、ns2np4D、 ns2np32、X原子的最外层电子的排布为ns2np4,则X的氢化物的化学式是( )A. HXB. H2X C. XH3D. XH43、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )A、X与Y形成化合物是,X可以显负价,Y显正价B、在元素同周期表中X可能位于Y的右面C、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的D、Y的气态氢化物的稳定性小于X的气态氢化物的稳定性4、下列说法中正确的是()A、所有的电子在同一区域里运动B、能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动C、处于最低能量的原子叫基态原子D、同一原子中,1s、2s、3s所能容纳的电子数越来越多5、在第n电子层中,当它作为原子的最外层时容纳电子数最多与第(n-1)层相同; 当它作为原子的次外层时,其电子数比(n-1)层多10个,则对此电子层的判断正确的是( )A、必为K层B、只能是L层C、只能是M层D、可以是任意层6、一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )A、+3B、+2C、+1D、-17、下列各原子或离子的电子排布式错误的是()A、Al 1s22s22p63s23p1B、O2- 1s22s22p6C、Na+ 1s22s22p6D、Si 1s22s22p28、在元素周期表的第四周期的主族元素中,金属元素的种数是()A、4种B、5种C、6种D、7种9、具有下列电子排布式的原子中,半径最大的是()A、ls22s22p63s23p3B、1s22s22p3C、1s22s2sp5D、1s22s22p63s23p410、x 、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知()A、x的原子半径大于y的原子半径。
(完整word版)化学选修三第一章归纳总结和练习题

选修3 第一章原子结构与性质知识梳理一.核外电子排布:1、能层:原子核外电子按______大小______排布,从内到外分为____、____、____、____、____、____、____七层,能量依次_____。
各能层所能容纳的电子个数为______。
2、能级:各能层电子的能量_______(填“相同”或“不相同”),不同能量的电子分别排布在____、____、____、____能级上,各能层的能级个数与__________相等,各能级上所能容纳的电子数分别为_____、____、____、____。
3、原子轨道:表示电子在原子核外的一个空间运动状态。
电子云轮廓图给出了电子在的区域,这种电子云轮廓图也就是原子轨道的形象化描述。
原子轨道轨道形状轨道个数spdf4.能层、能级、原子轨道及其最多容纳电子数的关系能层n一二三四五…n 符号K ……能级1s ………原子轨道1 ………最多容纳电子数2 2•能级数=能层序数•S、p、d、f能级分别有1、3、5、7个原子轨道,最多容纳电子数分别是2、6、10、14 •各能层(n)原子轨道数目=•各能层(n)最多容纳的电子数=5、原子轨道能量高低规律●同能层:ns np nd nf●形状相同的原子轨道:1s 2s 3s 4s, 2p 3p 4p 5p●同一能层内形状相同而伸展方向不同的原子轨道:2p x=2p y=2p z练习.比较下列多电子原子的原子轨道的能量高低。
(1)2s______3s (2) 2s______3d (3)3p______3s(4) 4f______6f (5) 3d______4s二.核外电子排布的规律:1核外电子排布遵守原理,原理和原理。
(1).能量最低原理:内容:原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
构造原理电子的排布先后顺序为:1s_______________________________________________________________。
人教版化学选修3第一章《原子结构与性质》测试试题(含答案)

人教版化学选修3第一章《原子结构与性质》测试试题(含答案)第一章《原子结构与性质》测试题一、单选题(每小题只有一个正确答案)1.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Y原子P能级上有2个未成对电子,Z原子比X原子的核外电子数多4。
下列说法正确的是()A.X、Y、Z的电负性大小顺序是Z<Y<XB.WY2分子中σ键与π键的数目之比是2∶1C.W、X、Y、Z的原子半径大小顺序是X>Y>Z>WD.W、Z形成的分子的空间构型是三角锥形2.下列说法中正确的是()A.HF、HCl、H2S、PH3的稳定性依次增强B.按Mg、Si、N、F的顺序,原子半径由小变大C.某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族D.在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为413.1911年,卢瑟福根据 粒子散射实验结果提出了()A.近代原子论B.原子结构的葡萄干面包模型C.原子结构的行星模型D.核外电子排布规则4.H、H、H、H+、H2是()A.氢的五种同位素 B.五种氢元素C.氢的五种核素 D.氢元素的五种不同粒子5.根据元素周期律和物质结构的有关知识,以下有关排序正确的是( )A.电负性:He>F>O B.第一电离能:O>N>PC.离子半径: S2->Cl->Ca2+ D.热稳定性:H2O>H2Se>H2S6.关于元素周期表,下列叙述中不正确的是( )A.元素周期表中共有18列, 16族B.周期表中的族分为主族、副族、0族和Ⅷ族1/ 10C.过渡元素全部是副族元素D.主族都是由短周期元素和长周期元素共同组成7.江苏中国矿业大学一名大学生用铊盐进行投毒事件,引起警方高度重视。
铊(TI)的毒性高于铅和汞,在生产鞭炮(花炮)的原料中往往也含有高量的铊元素,长时间在鞭炮爆炸物氛围中也会引起中毒。
人教版初中高中化学选修三第一章《有机化合物的结构特点与研究方法》经典练习卷(含答案解析)
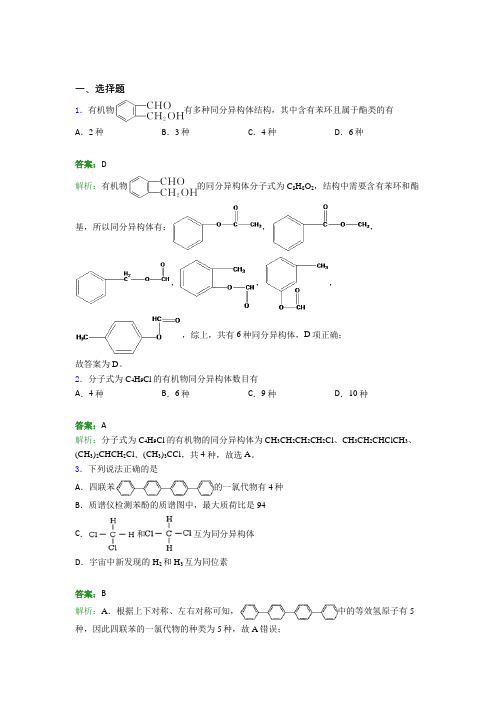
一、选择题1.有机物有多种同分异构体结构,其中含有苯环且属于酯类的有A.2种B.3种C.4种D.6种答案:D解析:有机物的同分异构体分子式为C8H8O2,结构中需要含有苯环和酯基,所以同分异构体有:,,,,,,综上,共有6种同分异构体,D项正确;故答案为D。
2.分子式为C4H9Cl的有机物同分异构体数目有A.4种B.6种C.9种D.10种答案:A解析:分子式为C4H9Cl的有机物的同分异构体为CH3CH2CH2CH2Cl、CH3CH2CHClCH3、(CH3)2CHCH2Cl、(CH3)3CCl,共4 种,故选A。
3.下列说法正确的是A.四联苯的一氯代物有4种B.质谱仪检测苯酚的质谱图中,最大质荷比是94C.和互为同分异构体D.宇宙中新发现的H2和H3互为同位素答案:B解析:A.根据上下对称、左右对称可知,中的等效氢原子有5种,因此四联苯的一氯代物的种类为5种,故A错误;B.苯酚的相对分子质量为94,用质谱仪检测苯酚的质谱图中,最大质荷比是94,故B正确;C.二氯甲烷是四面体结构,因此和是同一种物质,故C错误;D.H2和H3是H元素的不同单质,是同素异形体,不是同位素,故D错误;故选B。
4.除去下表物质中所含杂质对应的试剂和方法有错误的是物质(杂质)试剂操作A溴苯中含有少量苯/蒸馏B乙酸乙酯中含有少量乙酸饱和碳酸钠溶液分液C乙酸中含有少量乙醇/分液D CH4中含有少量C2H4酸性高锰酸钾、碱石灰洗气答案:C解析:A.溴苯和苯的沸点不同,可以通过蒸馏的方法除去溴苯中含有的少量苯,故A正确;B.乙酸能够与饱和碳酸钠溶液反应,而乙酸乙酯不能,可以用饱和碳酸钠溶液除去乙酸乙酯中含有的少量乙酸,然后分液,故B正确;C.乙酸和乙醇互溶,不能通过分液的方法除去乙酸中含有少量乙醇,故C错误;D.C2H4能够被酸性高锰酸钾溶液氧化为二氧化碳,而甲烷不能,再通过碱石灰除去二氧化碳,可以通过酸性高锰酸钾溶液、碱石灰洗气的方法除去CH4中含有少量C2H4,故D 正确;故选C。
化学选修3-第一章检测题

物质结构与性质(选修)第1章综合练习题一、选择题(本题包括18小题,每小题2分,共36分.每小题只有一个选项符合题意)1.下列电子层中,原子轨道数目为4的是()A.K层B.L层C.M层D.N层2.p轨道电子云形状正确的是( )A.球形对称B.对顶对称C.极大值在x、y、z轴上的纺锤形D.互相垂直的花瓣形3.表示一个原子在第三电子层上有10个电子可以写成( )A.310B.3d10C.3s23p63d2D.3s23p64s24.下列说法正确的是()A.处于最低能量的原子叫做基态原子B.3p2表示3p能级有两个轨道C.同一原子中,1s、2s、3s电子的能量逐渐减小D.同一原子中,2p、3p、4p能级的轨道数依次增多5.下列原子的价电子排布中,对应于第一电离能最大的是()A.3s23p1 B.3s23p2C.3s23p3D.3s23p46.下列各组元素中,第一电离能依次减小的是()A.H、Li、Na、K B.Na、Mg、Al、SiC.I、Br、Cl、F D.F、O、N、C7.下列电子排布中,原子处于激发状态的是()A.1s22s22p5B.1s22s22p5C.1s22s22p63s23p63d44s2D.1s22s22p63s23p63d34s28.若将15P原子的电子排布式写成1s22s22p63s23p x23p y1,它违背了()A.能量守恒原理B.泡利不相容原理C.能量最低原理D.洪特规则9.下列说法正确的是()A.第3周期所含元素中钠的第一电离能最小B.铝的第一电离能比镁的第一电离能大C.在所有的元素中,F的第一电离能最大D.钾的第一电离能比镁的第一电离能大10.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。
根据下表所列数据判断错误的是( )A.元素X的常见化合价是+1价B.元素Y是ⅢA族的元素C.元素X与氯形成化合物时,化学式可能是XClD.若元素Y处于第3周期,它可与冷水剧烈反应11.下列关于价电子构型为3s23p4的粒子的描述正确的是()A.它的元素符号为OB.它的核外电子排布式为1s22s22p63s23p4C.它可与H2生成液态化合物D1s 2s 2p 3s 3p12.简单原子的原子结构可以形象地表示为①②③。
人教版初中高中化学选修三第一章《有机化合物的结构特点与研究方法》知识点总结(含答案解析)(1)

一、选择题1.下列物质在给定条件下的同分异构体数目正确的是(不考虑顺反异构)A.C5H10属于环状化合物的同分异构体有5种C H O属于羧酸的同分异构体有5种B.分子组成是5102C H O属于醛的同分异构体有3种C.分子组成是48D.的一溴代物有4种答案:A解析:A.C5H10属于环状化合物的同分异构体有:环戊烷、甲基环丁烷、1,1-二甲基环丙烷、1,2-二甲基环丙烷、乙基环丙烷,共5种,A项正确;C H O属于羧酸的同分B.羧酸含有-COOH,剩余为丁基,丁基有四种,故分子组成是5102异构体有4种,B项错误;C H O属于醛的同分异构体C.醛基为-CHO,剩余为丙基,丙基有2种,故分子组成是48有2种,C项错误;D.分子中有5种不同环境的H原子,故的一溴代物有5种,D项错误;答案选A。
2.分子式为C5H10O的饱和一元醛的同分异构体共有几种A.3B.4C.5D.6答案:B解析:C5H10O且为饱和一元醛的结构可写成C4H9-CHO,C4H9-的结构有4种[CH3CH2CH2CH2-、(CH3)2CHCH2-、C(CH3)3-、CH3CH2CH(CH3)-],故C5H10O且为饱和一元醛的结构也为4种。
答案选B。
3.聚脲具有防腐、防水、耐磨等特性,合成方法如下:下列说法不正确...的是A.P和M通过加成反应形成聚脲B.一定条件下聚脲能发生水解反应C.M苯环上的一氯代物有2种D.M与互为同系物答案:D解析:A.M中的两个氨基上的N-H断裂,与P中的C=N双键发生加成,所以P和M通过加成反应形成聚脲,A正确;B.聚脲中存在酰胺基,一定条件下可以发生水解反应,B正确;C. M是一个对称结构,两个苯环上氨基的邻位碳上的氢原子是等效的,两个苯环相连的氧原子的两个苯环上的邻位碳上的氢原子是等效的,则在M分子中只有两种不同的氢原子,M苯环上的一氯代物有2种,C正确;D.M是含氧衍生物,而苯胺不是含氧衍生物,二者不是同一类物质,所以不是同系物,D 错误;故选D。
高中化学选修3第一章测试(试卷版)

高中化学选修3第一章测试(满分:100分考试时间:100分钟)一、选择题。
(在每小题给出的选项中,只有一项符合题目要求的,每题2分,共50分)1、下列微粒:①质子②中子③电子,在所有原子中不一定含有的微粒是()A. ①②③B. 仅有②C. ①和③D. ①和②2、某元素原子的核外有四个能层,最外能层有1个电子,该原子核内的质子数不可能为()A. 24B. 18C. 19D. 293、下列四个能级中,能量最高,电子最后填充的是()A. 3sB. 3pC. 3dD. 4s4、下列说法中正确的是()A. 因为p轨道是“8”字形的,所以p的电子走“8”字形B. K能级有3S,3P,3d,3f四个轨道C. 氢原子只有一个电子,故氢原子只有一个轨道D. 以上说法均不正确5、下列原子中未成对电子最多的是()A. CB. OC. ND. Cl6、下面是某些元素的最外层电子排布,各组指定的元素,不能形成AB2型化合物的是()A. 2S22P2和2S22P4B. 3S23P4和2S22P4C. 3s2和2s22p5和3s23p47、同主族两种元素原子的核外电子数的差值可能是()A. 6B. 12C. 26D. 308、已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是()A. n=m+1B. n=m+10C. n=m+11D. n=m+259、下列化合物中阳离子半径与阴离子半径比值最小的是()A. NaFB. LiIC. MgCl2D. KBr 10、已知A n+,B(n+1)+,C n-,D(n+1)-具有相同的电子层结构,则原子半径由大到小的顺序为()A. C>D>B>AB. A>B>C>DC. D>C>A>BD. A>B>D>C11、在前三周期的元素中,原子最外层不成对电子数和它的能层数相等的元素共有()A. 6种B. 5种C. 4种D. 3种12、A、B属于短周期中不同主族的元素,A、B原子最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数为()A. a-8B. a-5C. a+6D. a+413、按照原子核外电子排布规律,各电子层最多容纳的电子数为2n2(n为电子层数,其中,最外层电子数不超过8个,次外层不超过18个),1999年已发现了核电荷数为118的元素,其原子核外电子层排布是()A. 2,8,18,32,32,18,8B. 2,8,18,32,50,8C. 2,8,18,32,18,8D. 2,8,18,32,50,18,814、碘跟氧可形成多种化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选修三第一章知识点小结一.核外电子排布:1、能层:原子核外电子按______大小______排布,从内到外分为____、____、____、____、____、____、____七层,能量依次_____。
各能层所能容纳的电子个数为______。
2、能级:各能层电子的能量_______(填“相同”或“不相同”),不同能量的电子分别排布在____、____、____、____能级上,各能层的能级个数与__________相等,各能级上所能容纳的电子数分别为_____、____、____、____。
3、原子轨道:表示电子在原子核外的一个空间运动状态。
电子云轮廓图给出了电子在的区域,这种电子云轮廓图也就是原子轨道的形象化描述。
4.能层、能级、原子轨道及其最多容纳电子数的关系•能级数=能层序数•S、p、d、f能级分别有1、3、5、7个原子轨道,最多容纳电子数分别是2、6、10、14•各能层(n)原子轨道数目=•各能层(n)最多容纳的电子数=5、原子轨道能量高低规律●同能层:nsnpndnf●形状相同的原子轨道:1s2s3s4s,2p3p4p5p●同一能层内形状相同而伸展方向不同的原子轨道:2p x=2p y=2p z练习.比较下列多电子原子的原子轨道的能量高低。
(1)2s______3s(2)2s______3d(3)3p______3s(4)4f______6f(5)3d______4s二.核外电子排布的规律:1核外电子排布遵守原理,原理和原理。
(1).能量最低原理:内容:原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
构造原理电子的排布先后顺序为:1s_______________________________________________________________。
(2).泡利不相容原理:在一个原子轨道里,最多容纳_____个电子,且自旋______。
表示为:(3).洪特规则:基态原子中的电子优先_______占据一个轨道,且自旋_______。
如np3应表示为:洪特规则特例:当能量相同的原子轨道在(p6、d10、f14)、(p3、d5、f7)和(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1。
而不是1s22s22p63s23p63d44s22.原子光谱:(1)基态:处于____________的原子叫做基态原子,基态原子的排布符合______________。
(2)激发态:基态原子的电子______能量跃迁到高能层或者高能级,成为激发态原子。
(3)基态原子的电子跃迁到高能层或者高能级时,_____能量,得到______光谱;当电子跃迁回基态时_____能量,得到______光谱。
3.基态原子核外电子排布的表示方法(1)电子排布式:用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式A.电子排布遵循构造原理。
B.能层低的能级要写在左边,不能按填充顺序写。
如钪(Sc)的电子排布式为1s22s22p63s23p63d14s2,而不能写成1s22s22p63s23p64s23d1。
练习。
写出下列元素的原子核外电子排布式:AlCuCr(2)简化电子排布式如Na的简化电子排布式为[Ne]3s1练习。
书写下列元素原子的简化电子排布式FeBr(3)电子排布图:在电子排布图中,用方框表示原子轨道,用箭头表示电子。
箭头方向表示电子的自旋状态。
练习.画出下列元素的电子排布图PO(4)外围电子排布(价电子排布式)价电子:即能够影响元素化合价的电子。
主族元素:价电子即为最外层电子。
如Cl的外围电子排布:3S23P5过渡元素:价电子包括最外层电子和次外层d能级电子.如Fe的外围电子排布:3d64S2【练习】1.下列基态原子核外各电子排布中,违反了哪些原子或规则?正确的排布如何?A.硼:1s22s3B.氮:1s22s22p x22p y1C.铍:1s22p2D.铜:【Ar】3d94s22、几个重要的电子排布式以及电子排布图:二、核外电子排布与周期、族的关系:1、与周期的关系:周期数=________________。
外围电子排布为3d104s2的原子位于周期表的_______周期。
每周期元素核外电子排布,以_______开始,_______结束,依次为_____、_____、______、______、______;(以第三周期为例)2、与族的关系:主族元素:族序数=原子的最外层电子数=价电子数副族元素:大多数族序数=(n-1)d+ns的电子数=价电子数4.元素周期表的分区:除_____区外,元素最后一个电子填入哪个能级,元素便位于周期表的哪个区,按此原则共分为____个区。
请将各自区的对应的族的位置填入下列空格内:s区:____________________________p区:____________________________d区:____________________________f区:____________________________ds区:____________________________以上5个区中,全部为金属元素的区是_________________________________【练习】1、不查表,迅速写出下列元素的价电子排布式,以及在周期表中的位置。
28号元素:__________________________________________________47号元素:__________________________________________________35号元素:__________________________________________________三.元素周期律1.同周期元素的主要化合价:最高正价:+1递增到+7。
(氟、氧例外)负价:-4递增到-1,呈现周期性的变化。
最高正价+|负价|=82..原子半径:A原子半径的大小取决于两个因素:________和_____________。
B.同周期原子半径从左到右依次_____________;同主族原子半径从上到下依次____________。
C.微粒半径的比较方法(1)能层数不同时,电子层数越多,半径越大。
(2)能层相同时,核电荷数越大,半径越小。
(3)能层、核电荷数都相同时,电子数越多,半径越大;反之,越小。
练习.比较下列微粒的半径的大小(1)CaAI(2)Na+NaF(3)Cl-Cl(4)K+Ca2+S2-CI-3..电离能:(1)第一电离能概念:_______________原子失去一个电子转化为___________正离子所需要的________能量叫做___________。
(2)第一电离能的变化规律:(1)同一周期的电离能从左到右呈趋势,在___________________出现反常;如第IIA族元素第IIIA族元素,第VA族元素第VIA族元素。
(2)同一主族的电离能从上到下________________;(3)同一原子的逐级电离能依次___________;(4)同一原子的电离能出现剧烈变化时说明出现_____________。
练习、将下列元素按第一电离能由大到小的顺序排列①KNaLi②BCBeN③HeNeAr④NaAlSP4..电负性:①概念:电负性是用来描述不同元素的原子对___________的_____力的大小,电负性越大的原子,对键合电子的吸引力越______。
②变化规律:A.同一周期的电负性从左到右________________;B.同一主族的电负性从上到下________________;.应用:电负性的大小可以用作判断a._________________________________________________b.________________________________________________c._________________________________________________5..对角线规则:周期表中第二和第三周期处于______和______位置的三组元素(_____和_____、_____和_____、_____和_____、),由于__________相似,单质以及化合物的性质是相似的总结:同周期、同主族元素性质的递变规律己画一幅图来描述上述规律:练习.1.判断下列物质金属性和非金属性的强弱金属性:KCa;KCs非金属性:SCl;ClF2.判断下列物质氧化性和还原性的强弱氧化性:O2S;PS还原性:NaMg;CaBa3.判断下列物质酸碱性的强弱酸性:HClO4H2SO4;HBrO4HIO4碱性:NaOHMg(OH)2;Ca(OH)2Ba(OH)24.判断下列物质氢化物的稳定性稳定性:H2SH2O;H2SHF同周期、同主族元素性质的递变规律(注:可编辑下载,若有不当之处,请指正,谢谢!)。
