2.1以食盐为原料的化工产品(终极版)
以食盐为原料的化工产品

以食盐为原料的化工产品
1. 引言
食盐是一种广泛应用于日常生活和工业领域的化学物质。
在工业领域中,食盐
不仅可以被用作加工食品和制造药品,还可以被用作制造许多其他化学品的原料。
本文将介绍以食盐为原料的化工产品。
2. 硝酸钠
硝酸钠是一种重要的化学原料,也是以食盐为原料制作的。
硝酸钠被广泛用于
制造肥料、玻璃、火柴、爆炸物和化工产品等。
硝酸钠还可以用于治疗皮肤病和溃疡,是一种常见的药物。
3. 氯化氢
氯化氢是一种无色气体,可以直接用食盐和硫酸反应制备。
氯化氢在工业上有
广泛应用,可以被用于制造塑料、橡胶、药品、染料和肥料等。
氯化氢还可以被用于工业废水和污水处理,是一种环保型的化学品。
4. 碱式氯化铝
碱式氯化铝是一种重要的混凝剂,在水处理和污水处理领域中被广泛应用。
碱
式氯化铝可以通过将食盐和氢氧化铝反应制备而成。
碱式氯化铝可以有效地去除水中的有机物和颗粒物,是现代水处理技术中不可或缺的化学品。
5. 氯化钠
氯化钠是最常见的食盐,也是一种重要的化学品。
氯化钠被广泛用于许多领域,包括制药、化工、食品工业等。
此外,氯化钠还可以被用于农业和畜牧业,用于饲料、盐灯和防冻剂等。
6.
以食盐为原料的化工产品在现代工业领域中具有广泛的应用。
硝酸钠、氯化氢、碱式氯化铝和氯化钠是最常见的以食盐为原料制备的化工产品。
优质的食盐原料和先进的制备工艺可以使这些产品在各个领域中有广泛的应用。
21以食盐为原料的化工产品.
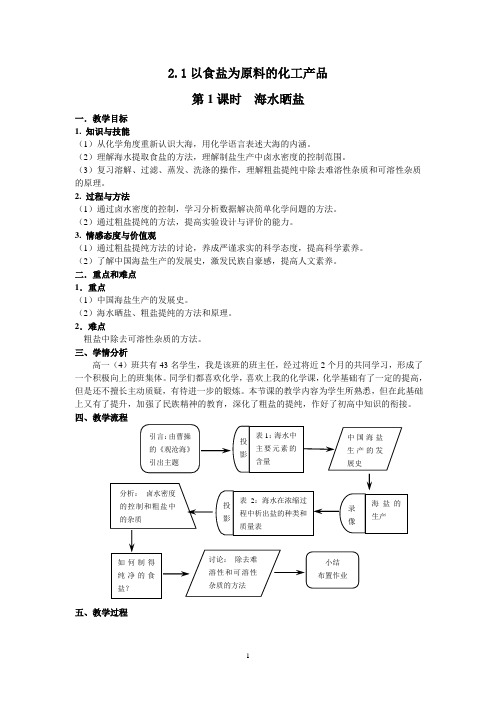
2.1以食盐为原料的化工产品第1课时海水晒盐一.教学目标1. 知识与技能(1)从化学角度重新认识大海,用化学语言表述大海的内涵。
(2)理解海水提取食盐的方法,理解制盐生产中卤水密度的控制范围。
(3)复习溶解、过滤、蒸发、洗涤的操作,理解粗盐提纯中除去难溶性杂质和可溶性杂质的原理。
2. 过程与方法(1)通过卤水密度的控制,学习分析数据解决简单化学问题的方法。
(2)通过粗盐提纯的方法,提高实验设计与评价的能力。
3. 情感态度与价值观(1)通过粗盐提纯方法的讨论,养成严谨求实的科学态度,提高科学素养。
(2)了解中国海盐生产的发展史,激发民族自豪感,提高人文素养。
二.重点和难点1.重点(1)中国海盐生产的发展史。
(2)海水晒盐、粗盐提纯的方法和原理。
2.难点粗盐中除去可溶性杂质的方法。
三、学情分析高一(4)班共有43名学生,我是该班的班主任,经过将近2个月的共同学习,形成了一个积极向上的班集体。
同学们都喜欢化学,喜欢上我的化学课,化学基础有了一定的提高,但是还不擅长主动质疑,有待进一步的锻炼。
本节课的教学内容为学生所熟悉,但在此基础上又有了提升,加强了民族精神的教育,深化了粗盐的提纯,作好了初高中知识的衔接。
四、教学流程五、教学过程六、教学反思《以食盐为原料的化工产品》第一课时,我将这节课的教学内容定为海水晒盐以及粗盐提纯两大主要内容。
结合上海市二期课改的理念,注重对学生化学素养和人文素养的培养,落实两纲教育。
我将本节课的教学重点定为:(1)中国海盐生产的发展史(2)海水晒盐、和粗盐提纯的方法和原理,在教学中力求做到“情知互促”。
一、课堂教学方法多种多样在教学中我采用多种教学手段,以此吸引学生的注意力,达到良好的教学效果。
课的导入以我们金山石化海边的图片以及曹操的《观沧海》引出主题,新颖别致。
充分利用数据表格,让学生通过相关数据的对比分析,然后得出结论。
图像和视频的使用大大节约了时间,提高课堂效率。
二、注重情感态度价值观的落实利用课本中我国海水晒盐的历史,并将之充分挖掘,将我国海盐生产的三个阶段(即煮海为盐、淋卤煎盐、海水晒盐)讲得生动活泼,引起了学生浓厚的学习兴趣。
2.1以食盐为原料的化工产品

2Al +3SO4 Mg
+ 2+
3+
H2CO3 HCO3
H +HCO3
-
+2Cl
-
-
H + CO2 3
+
Na +OH
2+
NaHCO3
-
Na + HCO3
+
Ba +2OH
HCO3
H + CO2 3
+
【本课要点】 • 氯化氢的性质 • 氯化氢气体的工业及实验室制法 • 实验室制、取氯化氢气体的装置 • 实验室制、取气体的装置 • 气体的净化装置及吸收装置 • 检验极易溶于水的气体的装置
探究与实践
实验室制氯化氢气体
• Байду номын сангаас应原理
NaCl + H2SO4 (浓) ( NaCl + NaHSO4
微热 强热
NaHSO4 + HCl Na2SO4 + HCl )
( 工业上制氯化氢的化学方程式
H2+CI2
点燃
2HCI )
设计实验室制氯化氢的装置
反应物状态 实验室制氧气 实验室制二氧化碳 实验室制氯化氢 反应条件
固+固 固+液 固+液 提供装置见后
加热 常温 加热
固+固 加热型
固+液 常温型
固+液 或 液+液 加热型
气体收集装置
气体的净化装置
气体的吸收装置
• 氢氧化钠 一元强碱,在水中全部电离成钠离 子和氢氧根离子 NaOH→Na++OH-
氢氧化钠的用途
2.1以食盐为原料的化工产品

【步骤】
1、称量 10.0 g粗盐 一贴 二低 三靠 玻璃棒将被过滤的液体引流到过滤器中
2、溶解 玻璃棒搅动,加快溶质溶解速率
3、过滤
4、蒸发 加热时用玻璃棒搅拌,较多食盐析出,少量残液用余 热或小火蒸干,防止NaCl 颗粒飞溅出来
5、称量
用玻璃棒将盐转移到指定容器中称量
※制备精盐:除去粗盐中可溶性杂质 主要的杂质: Na2SO4 MgSO4 MgCl2
2 开发海水中的卤素资源
2.1 以食盐为原料的化工产品
一、海水晒盐
方法:浓缩法 海水的密度控制:1.21--1.26g/mL
目的:大量析出氯化钠,又要使杂质析出少
二、粗盐提纯 【实验仪器】
烧杯, 量筒, 玻璃棒,漏斗,滤纸,酒精灯, 蒸发皿(铁架台,铁圈) 天平: (托盘天平,精确0.1 g;电子天平,精确 0.0001g)
2. 盐酸的性质
a. 物理性质 无色有刺激性气味的液体,易挥发 (工业盐酸含杂质Fe3+呈黄色) b. 化学性质 一元强酸 HCl → H+ + Cl-
3. 氯化氢的实验室制法 a. 反应原理
用高沸点(难挥发)酸制低沸点酸(易挥发)
NaCl + H2SO4(浓) 微热 NaHSO4 + HCl↑ Na2SO 4 + 2HCl↑ Na2SO4 + HCl↑}
杂质离子: SO42- Mg2+
CaSO4
Ca2+
引入Ba2+, OH-, CO32新杂质,又如何去除? Na2CO3应在BaCl2后面,可除多余的Ba2+ HCl应在OH- 、CO32- 后,气泡不再产生 PH=7
可行的顺序 ①BaCl2 ②NaOH ③ Na2CO3 ④HCl 或① NaOH ② BaCl2 ③ Na2CO3 ④ HCl 或 ① BaCl2 ② Na2CO3 ③ NaOH④ HCl
沪科版化学高一上册-2.1 以食盐为原料的化工产品 课件

上海氯碱化工新产品推荐会
优酷视频
你还知道哪些氯碱化工的产品?
氯碱工业
氯碱工业
海水晒盐
以食盐为原料
氯碱工业
氯气
氯碱工业
氢气
海水晒盐
以食盐为原料
氢氧化钠
碳酸钠
走进上海氯碱化工厂
你 还 记 得 电 解 反 应 吗 ?
上海氯碱总厂电解车间
探究水的组成-电解水反应
初中
电解饱和食盐水装置
电解饱和食盐水产物验证
现象
结论
氯碱工业
氯碱工业
氯气
氢气
进一步
盐酸 消毒剂
海水晒盐
以食盐为原料
氢氧化钠
三氯化铁
碳酸钠
聚氯乙烯
氯碱化工的产品之一:84消毒液
家用消毒液制取装置
①装置中发生的化学反应是什么? c点是阳极?还是d点是阳极?
②这个装置这样设置有哪些优点? ③这个装置有不足之处吗?怎样改进?
改进后的好处是什么?
电解水与电解饱和食盐水对比
电解水
电解饱和食盐水
反应装置 电源,导线,电极,电解池 电源,导线,电极,电解池
反应条件
通电
通电
阳极产物
氧气
氯气
验证方法
带火星木条复燃
淀粉碘化钾溶液
阴极产物 验证方法
氢气 可燃性、;
②酚酞变红色了
化学方程式
2H2O 通电2H2 O2
Thank You
Guyizhou
2NaCl 2H2O 通电2H2 Cl2 2NaOH
辩题:上海是否适合兴建氯碱化工厂?
优势 VS 不利
氯碱工业
氯气
氢气
高一化学以食盐为原料的化工产品

1、装置: U型管,电极(铁棒,碳棒,外接直流电源),饱和食盐水, KI淀粉试纸,酚酞试液
2、现象: 阴极、阳极产生气泡;
阳极产生的气体使湿润的KI淀粉试纸变蓝 阴极产生的气体用小试管收集后做点燃试验有爆鸣声
阴极区域酚酞试剂变红
3、产物: 阴极——氢气,氢氧化钠 ; 阳极——氯气
4、化学方程式: 2NaCl+ 2H2O 通电 2NaOH+ H2 +Cl2 5、原理:拓展 6、用途: 大部分用来生产氯气,擎起,烧碱和纯碱,进一步加工成各种
2、 化学性质: 一元强酸,具有酸的通性
3、 用途: 是除锈,制药的原料
• 烧碱
1、名称: 氢氧化钠俗名叫烧碱、火碱、苛性钠
2、物理性质: 白色固体,极易溶于水,溶解时放出大量的热。氢氧化钠的固体很容易潮解。 因此,实验室常用氢氧化钠固体来干燥某些气体。
3、化学性质: 一元强碱,具有碱的通性。
4、用途: 是重要的化工原料。在纺织、印染、油脂、精炼石油、造纸等工业上都有广 泛的用途。
2.开发海水中的卤素资源
Exploit chemical resources in seawater
海洋资源的分类:
海底矿产资源: (蕴藏着大量的煤矿, 石油,天然气)
海洋生物资源: (20多万种生物) 海洋再生能源: (潮汐,波浪蕴藏着巨
大的能量) 海洋空间资源: (拥有辽阔空间,建造
人工岛) 海洋旅游资源: 海洋化学资源: (80多种元素)
玻棒的作用: 搅拌,加速Βιβλιοθήκη 解第二步:过滤引流
一贴 ;二低; 三靠
第三步:结晶
搅拌 防止溶液溅出
第四步:水洗 除去其中少量的可溶性杂质 (MgCl2, MgSO4 ,KCl ,MgBr2)
2-1以食盐为原料的化工产品

氯气的实验室制法
原理: 装置:
4HCl(浓) + MnO2 ————→MnCl2 + 2H2O + Cl2↑
加热 → 气体 固体 + 液体 ——— 加热
氯气的实验室制法
原理:
16HCl + 2KMnO4 →2MnCl2 + 2KCl + 8H2O + 5Cl2↑ 加热 (4HCl(浓) + MnO2 ————→MnCl2 + 2H2O + Cl2↑)
镁Mg 硫S
氯Cl 钾K 钙Ca
1 290 885
19 350 380 400
铷Rb 锶Sr
钼Mo 银Ag 镉Cd
0.12 8
0.01 0.000 04 0.000 11
金Au 汞Hg
铀U
0.000 004 0.000 03
0.003
粗盐提纯
粗盐中的可溶性杂质:
SO42-:加入BaCl2 Ca2+:加入Na2CO3 Mg2+:加入NaOH
开发海水中的卤素资源
以食盐为原料的化工产品
地球——海洋的星球
地球表面的71% 平均深度3800 m 总水量13.7亿立方公里
海水的主要成分
元素 锂Li 硼B 钠Na 镁Mg 硫S 氯Cl 钾K 钙Ca
浓度(mg/L) 0.17 4.6 10 770 1 290 885 19 350 380 400
海水晒盐
海水密度 (g/mL) 1.13 1.20
CaSO4 0.56 0.91
NaCl
MgCl2
MgSO4
NaBr
1.21 1.22
1.26 1.31
以食盐为原料的化工产品.

3. 粗盐提纯的步骤
1.称量:
称量10克粗盐,量筒量取30毫升水,将 它们溶解在烧杯中
思考: 为什么10克粗盐要量取30毫升水来溶解?
2.溶解 (加除杂剂) 3.过滤
Ca2+、Mg2+ 、SO42-
4.蒸发
粗盐中存在哪些杂质离子?
粗盐中含有较多氯化镁、硫酸钙和硫酸镁。请 设计实验除去NaCl中的Ca2+、Mg2+ 、SO42-。
第二章 开发海水中的卤素资源
2.1 以食盐为原料的化工产品
一、海水晒盐
“古宿沙初作,
煮海为盐。”
太阳能蒸发法
盐田法
海水晒盐的步骤及原理:
易潮解
海水 → 蒸发池 → 结晶池
粗盐 母液
饱和溶液
“蒸发结晶法”
想一想:
为了使得到的粗盐中除氯化 钠外含杂质较少,实际生产中海 水的密度应控制在什么范围内?
1.21-1.26(g/L)
二、粗盐提纯
1、粗盐的成份及精制:
(1)粗盐: 除 NaCl 外还含有少量的 MgCl2 、 MgSO4 和 CaCl2等盐类及泥沙;
2、提纯实验步骤及仪器:
称量、溶解、过滤、蒸发、洗涤
实验仪器:
托盘天平、量筒、烧杯、玻璃棒、 漏斗、蒸发皿、铁架台及铁圈、酒 精灯、坩埚钳、滤纸、胶头滴管
思考:
1) 三步中都用到的一种仪器是?
搅拌,加速食盐溶解 玻璃棒 引流 搅拌,使液体均匀受 热,防止液滴飞溅。
2)蒸发结晶时什么时候停止加热?
当蒸发皿中出现较多晶体,还有少量液体 时,停止加热,靠余少量氯化钾等可溶性杂质,能 用少量水洗去。 操作:
向漏斗中加水至恰好没过固体,静置过滤。 重复2-3次。
2.1以食盐为原料的化工产品(终极版)

图二:扫 盐
图三:将盐装入簸箕
图四:成堆的粗盐
图五:待售的粗盐
一.海水晒盐
I. II. 盐的种类:海盐,湖盐,井盐,岩盐 古法晒盐:利用太阳能蒸发法:《说文解字》、 《天工开物》(p49 12题)
III. 海水晒盐的原理: 结晶(p49 14题) ①蒸发溶剂法:溶质的溶解度随温度的升高变化 不大 (如NaCl) ②冷却饱和溶液法(降温结晶法):溶质的溶解度 随温度的升高很快增大 (如KNO3)
大部分食盐用于化工生产,中国现代化工之母——氯碱工业 粗盐中含有一些杂质,远不能达到电解要求,必须制备化工用 的纯食盐 H2O Na+ ClH+ OH粗盐中的成分:(泥沙) Na+ ClMg2+ NaOH Mg(OH)2 SO42BaCl2 BaSO4 Ca2+
Na2CO3
CaCO3
为确保杂质除净,所加试剂必须过量,过量的Ba2+可以用 CO32-除去,最后用盐酸(HCl)调节PH值,除CO32- 。用盐 酸之前先过滤。 保证BaCl2 在Na2CO3 之前盐酸 所加试剂的顺序是: (HCl)最后
玻棒的作用 (三次使用): 搅拌,加速溶解 引流 搅拌 防止溶液溅出
实验思考题
• 粗盐提纯的步骤是什么? 称量→溶解→过滤→蒸发→结晶 • 提纯过程中所需要的仪器有什么? 烧杯, 量筒, 玻璃棒, 漏斗, 铁架台, 酒精灯 • 实验操作过程中应该注意什么问题? 一贴 二低 三靠
实验思考题
• 为什么10g粗盐要量取30mL左右水来溶 解? 根据食盐在常温下的溶解度约为36g/100g 水进行计算,可得出要溶解10g食盐至少 需要水约为28mL,水太少则不能溶解食 盐,水太多则使过滤和蒸发过程太长。
以食盐为原料的化工产品.

作业
• 《练习部分》P9 2.1(一) • 订正单元测试卷
The end
谢谢!
• 每年生产的海盐,供应全国一半人口的食用 盐和80%的工业用盐。还有100万吨原盐出口。 我国海盐业对国家的贡献是很大的。
江苏盐场
机械化收盐
海水晒盐视频
收获
卤水密度的控制
课本P24,表2.1 海水在浓缩过程中析出盐的种类和质量(表 中数据为每升海水析出各种盐的克数 单位g/L)
海水密度 (g/mL)
1.13
CaSO4 0.56
NaCl
MgCl2
MgSO4
NaBr
1.20
0.91
1.21
0.05
3.26
0.004
0.008
1.22
0.015
9.65
0.01
0.04
1.260Leabharlann 012.640.02
0.02
0.04
1.31
1.40
0.54
0.03
0.06
讨论
• 从上表中分析:
为得到又多又相对纯净的食盐,卤水的密 度应该控制在怎样的范围内?
在此密度范围内,有哪些杂质?含有哪些 杂质离子?
二、粗盐提纯
• 我们要从海水中得到精制的食盐,必须解决:
①粗盐初步提纯的方法 ②去除杂质所对应加入的试剂、用量 ③加入试剂的顺序 ④最后过量的试剂如何解决
1、粗盐初步提纯的方法
(1)粗盐提纯的步骤是什么? 称量→溶解→过滤→蒸发→结晶
(2)提纯过程中所需要的仪器有什么? 烧杯, 量筒, 玻璃棒, 漏斗, 铁架台, 酒精灯 ……
3、加入试剂的顺序
• 原则: 利用加入的后加入的试剂,消除前面加 入试剂的影响。
2.1 以食盐为原料的化工产品

A
B C
HCl
O2 CO2
水
稀盐酸 NaOH溶液
D
HCl
AgNO3溶液
②图乙中,在锥形瓶中放入锌粒的稀硫酸,也会产生喷 泉,原因是____________ ___________________。试分 析上述两装置产生喷泉的原理的有何不同________ __________________________。 ③图丙中锥形瓶内盛有酒精,水槽中盛有冷水,当向水 槽中的水里加入__________时也会产生喷泉。 ④试设计引发图丁产生喷泉的方法。
1、为什么食盐易潮解?
2、试设计一个实验方案,除去食盐 中的泥沙、Ca2+、Mg2+、SO42-?
3、蒸发和蒸馏有何区别?
练习:写 NaClO3
①图甲装置中,烧瓶内盛有某干燥气体,烧杯中盛有 某液体。其中不产生喷泉现象的是( )。 液体 干燥气体
2.1
以食盐为原料的化工产品
每升海水中析出各种盐的克数
海水密度(kg/L) CaSO4 1.13 1.20 1.21 1.22 1.26 1.31 0.56 0.91 0.05 0.015 0.01 3.26 9.65 2.64 1.40 0.004 0.01 0.02 0.54 0.008 0.04 0.02 0.03 0.04 0.06 NaCl MgCl2 MgSO4 NaBr
沪科版化学高一上册-2.1 以食盐为原料的化工产品 课件 _3

15. 真诚并不意味着要指责别人的缺点,但意味着一定不恭维别人的缺点。
精炼石油
制肥 皂
9. 我们可以躲开大家,却躲不开一只苍蝇。生活中使我们不快乐的常是一些芝麻小事。 16 、心存希望,幸福就会降临你;心存梦想,机遇就会笼罩你。 8. 生活如水,人生似茶。没有不痛苦的人生,人生苦难重重,人生就是不断面临和克服一个个痛苦的过程,对这一事实,你必须心悦诚服, 不要试图做任何的抵赖和逃避,因为这对解决痛苦没有丝毫用处。
2.1以食盐为原料的化工产品
二、中国现代化工之母——氯碱工业
以食盐为原料的化工产品课件2

NaNO 2 2、某女大学生一口气吃了十多
根火腿肠,出现休克现象。经医 院抢救后脱险。
金属离子
(或铵根离子)
酸根离子
Na+ K+ NH4+ Mg2+ Ca2+ Zn2+ Ba2+ Al3+ Fe2+ Fe3+
盐
ClSO42NO3CO32MnO4-
2.用锌与盐酸反应制得的氢气中混有氯化氢和水蒸 气。现有以下装置:
(1)制氢气的发生装置应选用(填装置对应的字母号,下 同) D 。 (2)检验氯化氢气体,可选 B 装置;除去氯化氢气体, 应选 F 装置。 (3)检验水蒸气,应选 C 装置;除去水蒸气,应选 用 E 装置。 (4)如果要制取和收集纯净、干燥的氢气,各装置的导管连 6-10-9-3-2-8-7-4-5-11 。 接顺序是
大于空气的密度,极易溶于水,可形成盐酸。
盐酸是易挥发的一元强酸,具有酸的通性,在盐酸
中没有氯化氢分子,它全部电离成氢离子和氯离子。
HCl → H+ + Cl—
以盐酸和烧碱为例,归纳整理酸和碱的通性
盐酸: (HCl)
1、与酸、碱指示剂反应; 2、与活泼金属反应; 3、与碱性氧化物反应; 4、与碱反应;
五、常见气体的制取
(一)发生装置
2、固体+液体不加热
----O2 、 H2、CO2、
常见气体的制取
(一)发生装置
2、固体+液体不加热
注意事项:
(1)启普发生器只适用于块状固体与液体在不加热条件 下制取难溶于水的气体如CO2、H2 (2)简易装置则适用于固体与液体在不加热下制取气的 反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大海也是人类智慧的来源和情感的寄托之一……
海洋资源的分类:
海底矿产资源: (蕴藏着大量的煤矿, 石油,天然气) 海洋生物资源: (20多万种生物) 海洋再生能源: (潮汐,波浪蕴藏着巨 大的能量) 海洋空间资源: (拥有辽阔空间,建造 人工岛) 海洋旅游资源: 海洋化学资源: (80多种元素)
图一:盐 田
总结
• 高中常见的沉淀物
实验提纯详解
你学过哪些分离和提纯方法?
过滤和蒸发 粗盐提纯
1、提纯含有少量Ba(NO3)2杂质的KNO3溶液:
加入过量的K2CO3溶液,过滤,除去沉淀, 溶液中补加适量的HNO3
2、分离NaCl和MgCl2混合液:
加入过量的NaOH溶液,过滤; 得到的沉淀中加适量的HCl; 得到的滤液中加适量的HCl
上海市实验学校
海水成份及应用前景:
海水是一个大的混合物(广意):
若将海水中的盐结晶后平铺于 陆地上,地球将增高150米
海水中平均含盐3.5%,含多种矿物质,如钠、钙、钾、溴、 碘、锶等。海洋中还有大量的生物,是人类食物的来源之一。
海水资源包括:能量、生物、化学、矿物、及空间资 源。利用潮汐能量发电,各种化学物质被综合利用 , 海洋生物为人类提供食物和保健用品;海水还是人类 未来重要的淡水来源、新的能源和人类的空间资源。
要用4种试剂①盐酸、② Na2CO3、③ NaOH、④ BaCl2来除去食盐水中的Ca2+、Mg2+、SO42-。 提纯时的操作步骤和加入试剂的情况如下图。
稍过量 a
MgCl2、
Na2SO4
图中a、b、c、d分别表示上述4种试剂中的各一种, 试回答: 硫酸钡 (1)沉淀A的名称是 ; 新引进的杂质钡离子在后续的操作中要用 理由是:碳酸钠除去 盐酸 (2)试剂d是 ;判断试剂d已经足量 的方法是 溶液中不再产生气体。; (3)加入b、c后溶液中发生的化学反应的化学 方程式为:CaCl2 + Na2CO3 == CaCO3↓+NaCl BaCl2 + Na2CO3== BaCO3↓+NaCl MgCl2+ NaOH== Mg(OH)2↓+NaCl
海 水 晒 盐
粗
海盐 岩盐
盐
湖盐
井盐
为什么要用结晶的方法而不干脆把海水晒干呢? 结晶完的海水叫卤水,卤水中还含有什么成份呢?
海水在浓缩过程中析出盐的种类和质量
海水密度(g/mL) CaSO4 1.13 0.56 1.20 0.91 1.21 0.05 1.22 0.015 1.26 0.01 1.31 NaCl MgCl2 MgSO4 NaBr
所加试剂的顺序、 用量、以及过量 后如何处理
除去粗盐中可溶性杂质
——氯化钙、氯化镁、硫酸钠
的试剂加入顺序
• BaCl2 → Na2CO3 → NaOH →过滤 → HCl
• BaCl2 → NaOH → Na2CO3 →过滤 → HCl • NaOH → BaCl2 → Na2CO3 →过滤 → HCl
加入NaCO3、NaOH、BaCl2顺序如何?
Ba2+ 如何除去由于加入过量的Na2CO3、NaOH所 引入的过量CO32―和OH―呢? 加入盐酸。 如何控制所加入盐酸的用量? 调节溶液的pH值,来控制所加入盐酸的用量。
加入盐酸在过滤前,还是在过滤后进行?为什么?
过滤后进行。
除杂方案设计思路:
玻棒的作用 (三次使用): 搅拌,加速溶解 引流 搅拌 防止溶液溅出
实验思考题
• 粗盐提纯的步骤是什么? 称量→溶解→过滤→蒸发→结晶 • 提纯过程中所需要的仪器有什么? 烧杯, 量筒, 玻璃棒, 漏斗, 铁架台, 酒精灯 • 实验操作过程中应该注意什么问题? 一贴 二低 三靠
实验思考题
• 为什么10g粗盐要量取30mL左右水来溶 解? 根据食盐在常温下的溶解度约为36g/100g 水进行计算,可得出要溶解10g食盐至少 需要水约为28mL,水太少则不能溶解食 盐,水太多则使过滤和蒸发过程太长。
大部分食盐用于化工生产,中国现代化工之母——氯碱工业 粗盐中含有一些杂质,远不能达到电解要求,必须制备化工用 的纯食盐 H2O Na+ ClH+ OH粗盐中的成分:(泥沙) Na+ ClMg2+ NaOH Mg(OH)2 SO42BaCl2 BaSO4 Ca2+
Na2CO3
CaCO3
为确保杂质除净,所加试剂必须过量,过量的Ba2+可以用 CO32-除去,最后用盐酸(HCl)调节PH值,除CO32- 。用盐 酸之前先过滤。 保证BaCl2 在Na2CO3 之前盐酸 所加试剂的顺序是: (HCl)最后
思考:蒸发结晶时需注意什么?
⑴蒸发皿中的液体不能超过容积的2/3; ⑵加热时,用玻璃棒不断搅拌; ⑶接近蒸干时,利用余热加热; ⑷取下未冷却的蒸发皿时,要放在石 棉网上;
一是为了防止暴沸。 二是为了防止杂质一起析出。
思考:
蒸发后得到的白色晶体是纯的氯化钠吗?如果不 是纯净的氯化钠可能还有什么杂质?
图二:扫 盐
图三:将盐装入簸箕
图四:成堆的粗盐
图五:待售的粗盐
一.海水晒盐
I. II. 盐的种类:海盐,湖盐,井盐,岩盐 古法晒盐:利用太阳能蒸发法:《说文解字》、 《天工开物》(p49 12题)
III. 海水晒盐的原理: 结晶(p49 14题) ①蒸发溶剂法:溶质的溶解度随温度的升高变化 不大 (如NaCl) ②冷却饱和溶液法(降温结晶法):溶质的溶解度 随温度的升高很快增大 (如KNO3)
依 据
溶液中可溶性杂质的除去原则:
(1)不增 提纯过程中不能引入新的杂质 (2)不减 不减少欲被提纯的物质
(3)好分复原被提纯的物质与杂质容易分离
三必须:除杂试剂必须过量
过量试剂必须除尽 除杂途径选最佳
练习:
课外活动小组对初步提纯的粗盐进一步提纯:
粗盐溶液中含有少量的CaCl2、MgCl2、Na2SO4,
实验思考题
• 为什么10g粗盐要量取30mL左右水来溶 解? 根据食盐在常温下的溶解度约为36g/100g 水进行计算,可得出要溶解10g食盐至少 需要水约为28mL,水太少则不能溶解食 盐,水太多则使过滤和蒸发过程太长。
实验思考题
• 蒸发到即将干时,为什么要停止加热或 小火加热? 一是为了防止暴沸。 • 二是为了防止杂质一起析出 • 为什么用少量蒸馏水洗净结晶物能除去 少量的可溶性杂质? 因可溶性杂质量少,故能溶解,而食盐 量大,只损失很少量。
浓度 (mg/L) 0.06 0.0005 0.03 0.0000045页中资料库“海水中主要元素的含量,回答问题: 海水中的盐类都以离子形式存在,其中除水以外含量最多的 元素依次是: Cl、Na、Mg、S、Ca、K、Br
看课本24页中表2.1,得出结论:从海水中提取食盐,必须控 1.21g/mL—1.26g/mL 制海水的密度_________________ 粗盐中除氯化钠外,还含有其他一些盐类和难溶性物质,必 须经过粗盐提纯
海水晒盐
粗盐(含泥沙、 Ca2+、Mg2+、SO42-)
晒 海水 1.026g/mL 苦卤 1.22 ~1.26g/mL
精制
食用
精 盐
氯碱 工业
苦卤:咸水(海水、盐湖水)经蒸发浓缩析出食盐(氯化钠) 后所得的母液,味苦涩。主要含有氯化钾、氯化镁、硫 酸镁和溴等。
粗盐的提纯
粗盐提纯的方法: 将含有的杂质转化为沉淀过滤出去,然后蒸发结晶。 粗盐提纯的步骤:除去难溶性杂质 称量→溶解→过滤→结晶→洗涤 除去可溶性杂质 ⑴加入试剂除去可溶性杂质: 除去粗盐中的MgCl2、MgSO4 、CaSO4 ,应选用什 么试剂?
Mg2+---NaOH
SO42―---BaCl2 Ca2+---Na2CO3
思考与讨论:
除去Ca2+ 能否用K2CO3?为什么? 否。除杂时不应引入新的杂质。
除杂原则: 1.不引入新杂质; 2.加入试剂必须适当过量; 3.新引入的杂质必须通过后面所加试剂加以 除去。
思考与讨论:
除 除 2+ 除 2①BaCl2→SO4 ,②NaOH→Mg ,③Na2CO3→Ca2+和过量的
A.过滤:
除去液体中混有的固体物质的一种方法 1.仪器:漏斗(附滤纸)、烧杯、玻璃棒和 铁架台 2.操作注意事项: ①一贴:滤纸紧贴漏斗内壁。 ②二低:滤纸的边缘要比漏斗口稍低; 液面要低于滤纸边缘 ③三靠:倾倒液体,烧杯嘴靠玻璃棒; 玻璃棒一端靠在三层滤纸上; 漏斗下端的管口靠在烧杯内壁上。
B、蒸发结晶
不是。还含有CaCl2、MgCl2、可溶性硫酸盐等。
如何除去CaCl2、MgCl2等可溶性杂质? (4)用少量的蒸馏水进行洗涤。
思考:
粗盐的提纯过程中玻璃棒的作用是什么?用了几 次?
(1)搅拌,加速溶解;
(2)引流,防止液体溅出; (3)搅拌,使液体受热均匀,防止飞溅; (4)转移晶体。
提纯实验仪器:
实验思考题
• 粗盐提纯过程中一共用了几次玻璃棒?分别各 自的作用是什么? 一共用了三次玻璃棒。 分别的作用是: 溶解——加速溶解 过滤——引流 蒸发结晶——均匀受热,防止溶液溅出
实验思考题
• 蒸发到即将干时,为什么要停止加热或 小火加热? 用大火加热蒸发至干会使食盐颗粒飞溅 出来。 • 为什么用少量蒸馏水洗净结晶物能除去 少量的可溶性杂质? 因可溶性杂质量少,故能溶解,而食盐 量大,只损失很少量。
3.26 9.65 2.64 1.40
0.004 0.01 0.02 0.54
0.008 0.04 0.02 0.03
0.04 0.06
元素 锂Li 硼B 钠Na 镁Mg 硫S 氯Cl 钾K 钙Ca
海水中主要元素的含量 浓度 元素 浓度 元素 (mg/L) (mg/L) 0.17 钴Co 0.0005 碘I 4.6 镍Ni 0.002 铯Cs 10770 溴Br 67 钡Ba 1290 铷Rb 0.12 金Au 885 锶Sr 8 汞Hg 19350 钼Mo 0.01 铀U 380 银Ag 0.00004 400 镉Cd 0.00011
