实验六.肝微粒体的制备及细胞色素P-450含量测定
体外代谢产物实验报告

一、实验目的本实验旨在通过体外代谢实验,研究某种化合物在特定酶系作用下的代谢过程,鉴定其代谢产物,并分析其代谢动力学特性。
通过此实验,可以为该化合物的体内代谢研究提供实验依据,并为后续的药物研发和毒理学评价提供参考。
二、实验材料1. 实验化合物:待研究化合物A(纯度≥98%)2. 实验试剂:肝微粒体酶、NADPH、辅酶A、磷酸盐缓冲液(pH 7.4)、硫酸铵、氯化钠、氢氧化钠等3. 实验仪器:低温离心机、紫外-可见分光光度计、高效液相色谱仪(HPLC)、质谱仪(MS)等4. 实验动物:比格犬(体重2-3kg)三、实验方法1. 肝微粒体酶的制备:取比格犬肝脏,剪碎后用磷酸盐缓冲液(pH 7.4)制成匀浆,低温离心(10000g,4℃,10min)分离肝微粒体。
用磷酸盐缓冲液(pH 7.4)调整肝微粒体蛋白浓度为10mg/mL。
2. 代谢反应:取肝微粒体酶溶液、NADPH、辅酶A和待研究化合物A,按一定比例混合,在37℃、pH 7.4的条件下进行代谢反应。
3. 代谢产物分析:代谢反应结束后,用高效液相色谱-质谱联用(HPLC-MS)分析代谢产物,鉴定其结构。
4. 代谢动力学分析:通过计算酶的米氏常数(Km)和最大反应速率(Vmax),分析酶的代谢动力学特性。
四、实验结果1. 代谢产物分析:实验结果显示,待研究化合物A在肝微粒体酶的作用下,产生了多个代谢产物,其中主要产物为B和C。
2. 代谢动力学分析:酶的米氏常数(Km)为0.5μM,最大反应速率(Vmax)为0.2μM/min。
五、讨论1. 本实验成功鉴定了待研究化合物A的代谢产物,为后续的体内代谢研究提供了实验依据。
2. 代谢动力学分析结果显示,该酶对化合物A的代谢动力学特性符合米氏方程,说明该酶对化合物A的代谢具有可逆性。
3. 通过比较不同酶系的代谢动力学参数,可以为药物研发和毒理学评价提供参考。
六、结论本实验通过体外代谢实验,研究了待研究化合物A的代谢过程,鉴定了其代谢产物,并分析了其代谢动力学特性。
肝微粒体的制备

肝微粒体的制备肝微粒体是细胞内的一种重要细胞器,其具有多种生物合成和代谢功能。
为了研究肝微粒体的结构和功能,科学家们开展了一系列的制备方法。
肝微粒体的制备方法主要包括离心法、差速离心法和梯度离心法。
离心法是最常用的制备方法之一。
首先需要从动物或人体中提取肝脏组织,然后将组织切碎并加入缓冲液。
接下来,用离心机对混合物进行离心,使得细胞器按照密度分层。
通过不同离心速度和离心时间的调节,可以分离出肝微粒体。
差速离心法是离心法的一种改进方法。
该方法利用不同细胞器的密度差异,通过多次离心来进一步分离纯净的肝微粒体。
首先,将组织切碎并加入缓冲液进行离心,得到一个粗制的肝微粒体上清液。
然后,将上清液进行再离心,获得更纯净的肝微粒体。
通过多次离心,可以得到更高纯度的微粒体。
梯度离心法是一种更为精细的制备方法。
该方法利用不同密度的梯度溶液,通过离心使得细胞器分层。
首先,制备不同浓度的梯度溶液,然后将组织切碎并加入梯度溶液。
接下来,用离心机对混合物进行离心,使得细胞器按照密度分层。
通过调节离心速度和时间,可以分离出纯净的肝微粒体。
肝微粒体的制备方法选择取决于研究的目的和需要。
离心法简单易行,适用于初步的制备。
差速离心法和梯度离心法需要更多的技术和设备支持,但可以得到更高纯度的肝微粒体。
在肝微粒体的制备过程中,需要注意以下几点。
首先,组织的采集和处理需要在低温和无氧条件下进行,以保持微粒体的完整性和活性。
其次,离心速度和时间的选择应根据具体实验要求进行调整,以获得最佳的分离效果。
此外,在制备过程中,需要注意避免污染和交叉感染,以确保实验结果的准确性和可靠性。
肝微粒体的制备是研究肝细胞生物学和代谢过程的重要工具。
离心法、差速离心法和梯度离心法是常用的制备方法,选择适合的方法可以得到纯净的肝微粒体。
在实验过程中,需要注意操作技巧和实验条件的控制,以确保制备的微粒体质量和纯度。
通过这些制备方法,科学家们可以更深入地研究肝微粒体的结构和功能,为相关疾病的治疗和药物研发提供理论基础。
(仅供参考)实验4-肝微粒体制备

6.肝微粒体(hepatic microsome)富含多 种物质代谢酶类,在外来化学物的生物转 化中起着极其重要的作用。某些外来化合 物可通过诱导或抑制肝微粒体代谢酶的活 性,影响其他外来化学物在体内的代谢结 局。
8.离心25000g/min, 15min;
9.按1g肝组织加1ml磷酸缓冲盐溶液,充分混 匀后冻存管分装,置-80℃冰箱内保存待用.
注意事项:
上述过程应使用预冷的匀浆介质、缓冲液 和离心转头。匀浆器、容器等均应保持在冰 浴中,以维持组织及其制备物在0-4℃的!
4. 将匀浆液离心(4℃,1000g,10min)
5.取上清离心(12000g,10min);
6.取上清计算体积,按10:1比例加入预冷氯 化钙,冰浴5min,摇匀,以25000g/min离 心15min,弃上清得粉红色微粒体沉淀 。
7.将微粒体沉淀混悬于氯化钾-Tris-盐酸缓 冲液中(2ml),用漩涡混合器充分混匀;
三、实验步骤
1. 处死小鼠;
2. 快速摘除肝脏,自门静脉注入预冷的冰生理盐水 20-50ml,冲洗肝脏至土黄色,再用生理盐水将 肝脏外周血水冲洗干净,用滤纸擦干净后称重、 记录。
3. 将称重后的肝组织置于烧杯中(置冰板上)剪碎 ,转入匀浆管中,并按每克肝组织加1~2ml预冷 的蔗糖-Tris-盐缓冲液,用电动匀浆机制备匀浆 (转速1000rpm)(冰浴中),研杵上下移动8- 10次,定容至5ml。
2.肝脏或其他组织磨碎 (均质化)之后,微 粒体能够在不同的离心速度之下,从其他 的细胞胞器区隔出来、浓缩并分离。
3.组织匀浆中未破碎的细胞、细胞核与线 粒体在9000g的离心速度下可以被沉淀并 分离,而细胞色素P450、内质网碎片及 其他可溶性酶素则保留在上清中。
P450测定

背景知识
定义: 对药物转化起非专一性催化作用的肝脏微粒体混合功能系统
特点: 1. 酶系统的活性有限,个体差异大(先天、年龄的影响), 种类多(150+种) 2. 酶活性易受某些药物的影响 3. 还原型P450可以与CO结合,吸收光谱的主峰在450nm的波 长处
3
实验目的
肝匀浆中细胞色素P-450含量的简易测定; 了解肝药酶的诱导剂、抑制剂对肝药酶含量的影响。
12
① 取肝脏500 mg以上(不能破坏胆囊,用滤纸吸干余血),称重、记录 ② 置匀浆器中,加0.25 M蔗糖溶液(0.5 ml/100mg肝),冰浴研磨 ③ 双层纱布过滤匀浆液 ④ 取匀浆液1 ml,加Tris-HCl缓冲液 9 ml ,混匀。
7
实验方法
5. 冰浴下充CO ,1-2气泡/秒,通气2 min(218室)
测定Pheno(P-450由低浓度至高浓度)。
11
【讨论】 1、P-450在药物转化中的作用; 2、不同实验组P-450含量不同的原因; 3、诱导剂增加P-450含量、抑制剂减少P-450含量的意义;
【结论】 Pheno为肝药酶诱导剂,A.D为肝药酶抑制剂。
【示教】 小鼠断头放血,摘除胆囊,取肝,匀浆器使用。
6. 放入两个比色杯,一个做参照(不加入Na2S2O4 )一个做样品(加入 Na2S2O4 5 mg)
7. 参照杯调零,在450 nm、490 nm处测定样品杯的吸光度(219室),记
录数据
P450 + CO
参照:不加Na2S2O4
比色: A450nm - A490nm
样品:加Na2S2O4
示差光谱法
P450
1
2
3
4ห้องสมุดไป่ตู้
肝微粒体制备

肝微粒体制备1. 简介肝微粒体(mitochondria)是细胞中的一种细胞器,主要负责细胞内能量的产生和调节。
肝微粒体制备是一种常用的实验技术,用于研究肝脏中微粒体的结构和功能。
本文将介绍肝微粒体制备的步骤和相关实验方法。
2. 肝微粒体制备步骤2.1 器材准备•洗涤缓冲液:含有0.25 M 蔗糖、10 mM Tris-HCl(pH 7.4)、1 mM EDTA 和0.1% BSA的缓冲液。
•离心管:用于离心过程。
•显微镜滑片:用于观察制备得到的肝微粒体。
2.2 肝脏取材•将新鲜动物(如小鼠)的肝脏取出,并放入冰冻盒中保持低温。
•快速切碎肝脏组织,以避免氧化酶的活性降低。
2.3 组织匀浆•将切碎后的肝脏组织加入洗涤缓冲液中。
•使用均质机将组织匀浆,以破碎细胞膜和释放肝微粒体。
2.4 离心分离•将匀浆后的混合液离心10分钟,以去除未破碎的细胞碎片和细胞核。
•将上清液转移到新的离心管中,并进行第二次离心,以沉淀肝微粒体。
2.5 肝微粒体收集•将离心得到的沉淀用洗涤缓冲液悬浮。
•用洗涤缓冲液洗涤肝微粒体,以去除杂质。
•最后一次离心后,将上清液倒掉,保留沉淀中的肝微粒体。
3. 肝微粒体制备相关实验方法3.1 蛋白含量测定•使用Bradford方法或BCA方法测定制备得到的肝微粒体中蛋白质的含量。
•根据实验需要调整蛋白质的浓度。
3.2 肝微粒体功能检测•使用荧光探针(如JC-1)检测肝微粒体的膜电位。
•使用呼吸链底物(如琥珀酸、NADH)测定肝微粒体的呼吸功能。
3.3 肝微粒体结构观察•使用透射电子显微镜观察制备得到的肝微粒体的形态和结构。
•准备样品时要注意避免溶剂残留和样品的干燥。
4. 结论肝微粒体制备是一种重要的实验技术,用于研究肝脏中微粒体的结构和功能。
通过合理的步骤和实验方法,可以成功制备得到高质量的肝微粒体,并进一步开展相关实验研究。
了解肝微粒体的制备过程对于深入理解细胞内能量代谢和调节机制具有重要意义。
大鼠肝微粒体的制备

2.1.3 大鼠肝微粒体的制备大鼠肝微粒体制备全过程:1.购买实验动物SD 大鼠,20 只,雌雄各半,体重(180-220)g,广州中医药大学实验动物中心提供。
合格证号:00557062.大鼠肝脏灌流购买的大鼠当天腹腔注射3%戊巴比妥钠(30 mg·kg-1 ),使其麻醉,利用酒精进行常规消毒后,打开腹腔暴露肝脏,肝门静脉处进行插管并固定。
结扎上腔静脉,剪破下腔静脉用磷酸盐缓冲液进行灌流,直至肝脏颜色呈土黄色。
3.灌流好的肝脏取出后按1:4 比例放入装有磷酸盐缓冲液(含1mMEDTA ,0.25M 蔗糖)的匀浆管内,剪碎,匀浆。
4.将匀浆液倒入50mL 高速离心管中在4℃条件下9000g 离心20 min。
5.保留上清并转移到超速离心管中,在4℃条件下100000g 离心60min。
6.保留沉淀并重新混悬于磷酸盐缓冲液(含0.9%的NaCL)中, 4℃条件下100000g 再离心60 min,得到的沉淀即为肝微粒体。
7.将肝微粒体重悬于0.1M 磷酸缓冲液(PH7.4,20%甘油,1mM EDTA,0.25M 蔗糖)中于-70℃冰箱保存,其中留取一小管用于蛋白浓度测定。
8.微粒体蛋白浓度测定依据的是Lowry et. al.方法(Lowry et al.,1951),首先用牛血清白蛋白标准溶液配置成不同浓度的蛋白标准溶液,与斐林试剂混匀发生反应后测定蛋白浓度,根据吸光度A 和蛋白浓度C 进行线性回归并绘制标准曲线。
同样的方法测定肝微粒体的吸光度,根据标准曲线线性回归方程计算肝微粒体蛋白浓度。
9.肝微粒体中P450 酶含量测定根据Omura and Sato 的方法(Omura and Sato,1964),用Tris-HCl 缓冲液把肝微粒体样品稀释至0.3−0.5 mg/mL,取两份肝微粒体分别放于参比池和样品池,400 nm~500 nm 扫描基线;参比池和样品池都加入少量Na2S2O4,轻微搅拌,并给样品池通CO 气体30 s,再次扫描,记录450 nm 和490 nm 处的吸光度,按Beer 定律(公式2.1)计算CYP450 的含量。
细胞色素P450含量测定

细胞色素P450酶含量的测定步骤一.微粒体的制备1.PH=7.4磷酸缓冲液的配制1.36g磷酸二氢钾+0.1mol/L NaOH(aq)79ml, 用水稀释至200ml即可。
悬浮液:7.5ml磷酸缓冲液+2.5ml甘油混合,即可。
2.取植物幼苗1g,放在预冷的研体中研磨并加入预冷缓冲液4ml。
3.把匀浆离心(9000r/min)15min,再取上清液离心(100000r/min)60min,弃上清液,得沉淀。
4.然后加适量悬浮液进行悬浮,后-80C下保存。
5.微粒体蛋白浓度用Bradford法测定。
注:以上操作均在4C下完成。
二.蛋白质含量的测定1.蛋白质染色剂的配制:称取100mg考马斯亮蓝G-250溶于50ml95%的乙醇中,加入100ml85%(W/V)的磷酸,待用时将溶液稀释到1000ml。
2.标准曲线制备(1).称取50mg牛血清蛋白,溶于蒸馏水并定容到50ml容量瓶中,配成浓度为1mg/ml的标准蛋白溶液。
(2).取7支试管分别加入0.2,0.4,0.6,0.8,1.0,1.2,1.4ml 1mg/mL标准液,用蒸馏水补足2ml。
(3).取8支试管,0号试管加0.1ml的蒸馏水,1—7号试管分别加入0.1ml(2)中的标准蛋白稀释液,然后加5ml考马斯亮蓝染色剂,充分振荡,反应2分钟后于595nm处测定吸光值。
绘制标准曲线。
3.样品蛋白含量测定将样品稀释到蛋白浓度约为0.1—0.8mg/ml,取0.1ml样品再加5ml考马斯亮蓝G-250,混匀后振荡,反应2分钟后于595nm处测定OD值,以蒸馏水为空白凋零。
在依据标准曲线,算出样品蛋白浓度。
三.P450酶含量测定:用PH=7.4的磷酸缓冲液将微粒体细胞色素P450酶液稀释到蛋白浓度为1mg/mL,加入4mg连二亚硫酸钠,反应4min,将其平分到比色皿中,在紫外分光光度计上扫描基线,然后向样品杯中通入CO 30s,稳定5min,在波长400—500nm范围内扫描得到P450-CO复合物吸收光谱。
去氢厄弗酚在小鼠肝微粒体中代谢产物及CYP450酶亚型的鉴定

去氢厄弗酚在小鼠肝微粒体中代谢产物及CYP450酶亚型的鉴定王勤辉;张婵溪;高伟;王晓烨;孙璐;王小红;黄建梅【摘要】Objective To establish a method for identification of the dehydroeffusol (DHE) metabolites in mice liver microsomes, and to identify the CYP450 isoforms involved in DHE metabolism.Methods The DHE metabolites in vitro incubated in liver microsomes were identified by UPLC-Q-TOF-MS/MS,and 7 types of CYP450 isoforms were screened out,the specific chemical inhibitors were used to identify the CYP450 isoforms involved in DHE metabolism.Results 4 metabolites were detected after in vitro incubation with mice liver microsomes.In the 7 CYP450 isoforms screened,CYP1A2,CYP2C8 and CYP2D2 were highly involved in the metabolism of DHE in liver microsomes.Conclusion In liver,there are a several subtypes of CYP450 enzymes involved in the metabolism of DHE metabolism,indicating that DHE is difficult to interact with other drugs in clinical.%目的建立去氢厄弗酚(DHE)小鼠体外肝微粒体孵育方法,鉴定DHE在小鼠肝微粒体中的代谢产物及参与DHE代谢的CYP450酶亚型.方法采用UPLC-Q-TOF-MS/MS分析鉴定DHE在体外肝微粒体共温孵后的代谢产物,筛选7种CYP450酶亚型,并通过特异性化学抑制剂法,鉴别参与DHE代谢的主要CYP450酶亚型.结果在体外肝微粒体共温孵后,检测到4个代谢产物;所筛选的7种CYP450酶亚型中,CYP1A2、CYP2C8和CYP2D2对DHE体外肝微粒体代谢的参与度较高.结论在肝脏中,有多种代谢酶亚型参与DHE的代谢,表明DHE在临床上不易与其他药物产生相互作用.【期刊名称】《西北药学杂志》【年(卷),期】2017(032)003【总页数】4页(P350-353)【关键词】去氢厄弗酚;代谢产物;CYP450;UPLC-Q-TOF-MS/MS;特异性化学抑制剂【作者】王勤辉;张婵溪;高伟;王晓烨;孙璐;王小红;黄建梅【作者单位】北京中医药大学中药学院,北京 100102;北京中医药大学中药学院,北京 100102;北京中医药大学中药学院,北京 100102;北京中医药大学中药学院,北京100102;北京中医药大学中药学院,北京 100102;北京中医药大学中药学院,北京100102;北京中医药大学中药学院,北京 100102【正文语种】中文【中图分类】R914去氢厄弗酚(dehydroeffusol,DHE)是中药灯心草中清心除烦作用的有效成分,也是灯心草中含量较高的菲类成分之一,研究表明,DHE具有抗癌、抗菌、抗氧化、抗藻和细胞毒活性作用[1-6],开发应用前景良好[7]。
细胞色素P450含量测定

细胞色素P450酶含量的测定步骤一.微粒体的制备1.PH=7.4磷酸缓冲液的配制1.36g磷酸二氢钾+0.1mol/L NaOH(aq)79ml, 用水稀释至200ml即可。
悬浮液:7.5ml磷酸缓冲液+2.5ml甘油混合,即可。
2.取植物幼苗1g,放在预冷的研体中研磨并加入预冷缓冲液4ml。
3.把匀浆离心(9000r/min)15min,再取上清液离心(100000r/min)60min,弃上清液,得沉淀。
4.然后加适量悬浮液进行悬浮,后-80C下保存。
5.微粒体蛋白浓度用Bradford法测定。
注:以上操作均在4C下完成。
二.蛋白质含量的测定1.蛋白质染色剂的配制:称取100mg考马斯亮蓝G-250溶于50ml95%的乙醇中,加入100ml85%(W/V)的磷酸,待用时将溶液稀释到1000ml。
2.标准曲线制备(1).称取50mg牛血清蛋白,溶于蒸馏水并定容到50ml容量瓶中,配成浓度为1mg/ml的标准蛋白溶液。
(2).取7支试管分别加入0.2,0.4,0.6,0.8,1.0,1.2,1.4ml 1mg/mL标准液,用蒸馏水补足2ml。
(3).取8支试管,0号试管加0.1ml的蒸馏水,1—7号试管分别加入0.1ml(2)中的标准蛋白稀释液,然后加5ml考马斯亮蓝染色剂,充分振荡,反应2分钟后于595nm处测定吸光值。
绘制标准曲线。
3.样品蛋白含量测定将样品稀释到蛋白浓度约为0.1—0.8mg/ml,取0.1ml样品再加5ml考马斯亮蓝G-250,混匀后振荡,反应2分钟后于595nm处测定OD值,以蒸馏水为空白凋零。
在依据标准曲线,算出样品蛋白浓度。
三.P450酶含量测定:用PH=7.4的磷酸缓冲液将微粒体细胞色素P450酶液稀释到蛋白浓度为1mg/mL,加入4mg连二亚硫酸钠,反应4min,将其平分到比色皿中,在紫外分光光度计上扫描基线,然后向样品杯中通入CO 30s,稳定5min,在波长400—500nm范围内扫描得到P450-CO复合物吸收光谱。
实验六.肝微粒体的制备及细胞色素P-450含量测定

院系:理学院专业:农药学学号:0931******* 姓名:王熠肝微粒体的制备及细胞色素P-450含量测定1 实验目的本实验通过超速离心法制备肝微粒体,利用Bradford法,学习并掌握了细胞色素P-450含量的测定。
2 实验原理研究体外药物代谢常用的方法是制备肝微粒体或线粒体后部分,将肝组织制备成20%匀浆,按1g肝组织加0.25mol/L蔗糖溶液或pH7.4 Tris-HCl缓冲液3mL ,磨成匀浆,用低温高速离心制备线粒体后上清液和超速离心法制备微粒体(内质网部分)-差速离心法。
细胞色素P-450是微粒体混合功能氧化酶中最主要的功能成分,其含量的高低基本可以反映混合功能氧化酶的活力大小。
细胞色素P-450是一种血红蛋白,当铁蛋白的铁离子被还原并与一氧化碳形成复合物时出现一种特异吸收峰,在波长450nm处呈现最大吸收峰,在490nm处为最低吸收。
根据两者的差值和吸收系数,可定量细胞色素P-450含量。
3 实验材料3.1实验动物大鼠:健康,体重200~250g,禁食过夜(24h)3.2实验器材与试剂器材:低温高速离心机、洁净工作台、匀浆器、注射器、手术剪、低温冰箱、液氮罐等试剂:1.17% KCl 溶液Tris-HCl缓冲液: Tris 6.05 g ;蔗糖 68.4 g;水 500 ml;浓盐酸调 pH 7.4;补水至 1000 ml4.实验方法4.1动物处理与匀浆制备断头处死,放尽血液,迅速剖开胸、腹腔,取出肝脏,用冰冷1.17% KCl 溶液洗净血污,并用滤纸吸干表面水分。
肝脏称重,置烧杯中剪碎,按每克肝脏3ml的比例加入0.25mol/L蔗糖溶液或pH7.4 Tris-HCl缓冲液,匀浆,将匀浆倒入离心管中,用缓冲液洗涤匀浆管,使最后的缓冲液体积加至约20%(W/V)的匀浆。
4.2制备线粒体后上清液将肝匀浆置低温高速离心,以沉淀未破碎的细胞、细胞碎片、核及线粒体,上清液即为线粒体后上清液。
大鼠肝微粒中5种细胞色素P-450的特异性底物含量的高效液相色谱法同时测定

大鼠肝微粒中5种细胞色素P-450的特异性底物含量的高效液相色谱法同时测定代晶;洪丽霞;吕红霞;王丽聪;黄玉婵;黄琴;孔雪娇【期刊名称】《时珍国医国药》【年(卷),期】2012(23)9【摘要】目的建立同时测定大鼠离体肝微粒体中5种细胞色素P-450特异性底物含量的方法。
方法选择非那西丁、甲苯磺丁脲、右美沙芬、氯唑沙宗和咪达唑仑分别作为CYP1A、CYP2C、CYP2D、CYP2E、CYP3A的特异性底物。
采用高效液相色谱法,以艾司唑仑为内标,色谱柱为Welchrom C18,流动相为乙腈-0.01 mol.L-1乙酸胺(pH 5.25,含0.03%三乙胺)=40∶60,流速为1 ml.min-1,检测波长分别为202,247,280,220 nm,柱温为30℃,进样量为40μl。
结果在线性范围内线性关系良好,相关系数r>0.999 0;日内RSD均小于14.4%,日间RSD均小于14.7%;方法回收率在为91.1%~114.3%之间,提取回收率在84.6%~94.9%之间。
结论该方法灵敏、简便、准确,可用于大鼠肝微粒体中细胞色素P-450特异性底物的含量测定。
【总页数】2页(P2345-2346)【关键词】高效液相色谱法;肝微粒体;细胞色素P450【作者】代晶;洪丽霞;吕红霞;王丽聪;黄玉婵;黄琴;孔雪娇【作者单位】成都医学院.药学院【正文语种】中文【中图分类】R284.2【相关文献】1.高效液相色谱法同时测定肝微粒体中咪达唑仑及代谢产物含量 [J], 胡春伟2.大鼠心肌组织与肝脏组织中细胞色素P-450的含量测定 [J], 耿益民;王雯;芦玲巧;杨啸林;张立克3.麝香酮对大鼠肝微粒体细胞色素P-450含量及活性的影响(简报) [J], 朱秀媛4.高效液相色谱法测定大鼠肝微粒体温孵体系中血根碱的含量 [J], 姚芳芳;朱若岑;刘兆颖;田世杰;唐昭山;刘琪;伍勇因版权原因,仅展示原文概要,查看原文内容请购买。
实验四、 苯巴比妥钠和放线菌素D对小鼠肝脏细胞色素P-450含量的

实验四、 苯巴比妥钠和放线菌素D对小鼠肝脏细胞色素P-450含量的影响 Experiment 4. Influence of phenobarbital sodium and actimycin D on the hepatic cytochrome P-450 content in miceP-450属于血红素蛋白,其还原型与CO结合后,在波长450nm处出现吸收峰。
因此,可以应用示差光谱法测定其含量。
肝匀浆样品中通以CO后,加还原剂连二亚硫酸钠(Na2S2O4),然后在450nm和490nm处测定吸光度,其差值代入公式,即可计算出细胞色素P450的含量。
【实验目的】肝匀浆中细胞色素P-450含量的简易测定;肝药酶的诱导剂、抑制剂的作用。
【实验对象】小鼠(昆明种)【仪器和药品】分光光度计,扭力天平,制冰机,生理盐水(N.S.);7.5g/L(0.75%)苯巴比妥钠(Pheno);0.02g/L(0.002%)放线菌素D(A.D.);0.25M蔗糖溶液;Tris-HCl缓冲液。
玻璃匀浆器,漏斗,试管(10 ml)数只,滤纸,移液管(1ml,2ml,5ml,10ml)数只,冰盒等。
【实验方法】1. 动物分为3组:生理盐水组,苯巴比妥钠组及放线菌素D组。
1.苯巴比妥钠和放线菌素D i.p.三天,诱导或抑制肝药酶。
2.断头放血:于第三天(实验当日)将小鼠断头放血(须放净,因血红素会影响实验结果);3.制备肝匀浆:将0.25M的蔗糖溶液和0.05M Tris-HCl缓冲液置于冰块中预冷;剪下肝脏(肝组织不得少于400mg;勿破坏胆囊,因胆色素干扰实验结果;以滤纸吸去血迹,因血色素干扰实验结果);扭力天平称重(垫锡纸;每次加样或加减法码时必须关上关平);将肝组织置于匀浆器中,加入预冷后的0.25M蔗糖(0.5ml/100mg肝组织);冰浴下研磨,直至组织变为淡粉色匀浆;取此匀浆液1ml,加入预冷后的0.05M Tris-HCl缓冲液9ml,充分混匀;冰浴下充以CO,1~2气泡/秒,通气2分钟。
大鼠心肌组织与肝脏组织中细胞色素P_450的含量测定
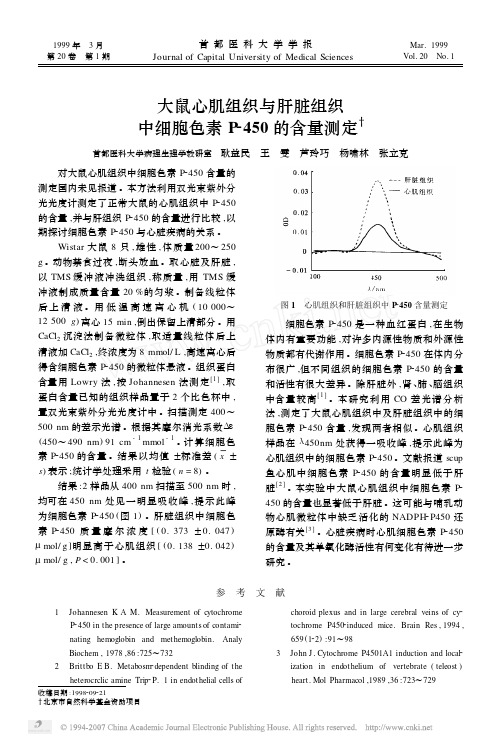
大鼠心肌组织与肝脏组织中细胞色素P2450的含量测定首都医科大学病理生理学教研室 耿益民 王 雯 芦玲巧 杨啸林 张立克 对大鼠心肌组织中细胞色素P2450含量的测定国内未见报道。
本方法利用双光束紫外分光光度计测定了正常大鼠的心肌组织中P2450的含量,并与肝组织P2450的含量进行比较,以期探讨细胞色素P2450与心脏疾病的关系。
Wistar大鼠8只,雄性,体质量200~250 g。
动物禁食过夜,断头放血。
取心脏及肝脏,以TMS缓冲液冲洗组织,称质量,用TMS缓冲液制成质量含量20%的匀浆。
制备线粒体后上清液。
用低温高速离心机(10000~12500g)离心15min,倒出保留上清部分。
用CaCl2沉淀法制备微粒体,取适量线粒体后上清液加CaCl2,终浓度为8mmol/L,高速离心后得含细胞色素P2450的微粒体悬液。
组织蛋白含量用Lowry法按Johannesen法测定[1],取蛋白含量已知的组织样品置于2个比色杯中,置双光束紫外分光光度计中。
扫描测定400~500nm的差示光谱。
根据其摩尔消光系数Δε(450~490nm)91cm-1mmol-1。
计算细胞色素P2450的含量。
结果以均值±标准差( x±s)表示;统计学处理采用t检验(n=8)。
结果:2样品从400nm扫描至500nm时,均可在450nm处见一明显吸收峰,提示此峰为细胞色素P2450(图1)。
肝脏组织中细胞色素P2450质量摩尔浓度[(0.373±0.047)μmol/g]明显高于心肌组织[(0.138±0.042)μmol/g,P<0.001]。
图1 心肌组织和肝脏组织中P2450含量测定细胞色素P2450是一种血红蛋白,在生物体内有重要功能,对许多内源性物质和外源性物质都有代谢作用。
细胞色素P2450在体内分布很广,但不同组织的细胞色素P2450的含量和活性有很大差异。
除肝脏外,肾、肺、脑组织中含量较高[1]。
大学药理学实验(附答案)

实验题目:小鼠腹腔注射筒箭毒碱ED50的测定Determination of Cl-Tubocurarine's Median Effective Dose (ED50)【实验目的】了解ED50的测定方法、原理、计算过程与意义。
【相关理论】1.关于量反应,质反应:量反应是指个体上反应的强度并以数量的分级来表示;例如:血压、尿量等。
质反应是指群体中所观察到的某一效应的出现;如:生死、有效或无效。
以阳性反应的出现频率或百分数来表示(全或无,阳性率)。
2.关于ED50,LD50,以及治疗指数:能使群体中有半数个体出现某一效应的剂量,称为半数效应量,若此效应为有效,则为半数有效量ED50,ED50是质反应的参数。
若此效应为死亡时,则为半数致死量LD50。
治疗指数= LD50/ ED50=TI,该值越大越好,说明药物越安全.可用机率单位正规法或点斜法求出LD1 ,ED99 ;LD5 ,ED95。
3.肌松药分为去极化型和非去极化型两种。
去极化型肌松药的代表为琥珀酰胆碱,其肌松作用不能被抗胆碱酯酶药新斯的明拮抗,反而会加重。
非去极化型肌松药的代表为筒箭毒碱,其肌松作用能被新斯的明解救。
4.测定ED50,LD50的意义可计算治疗指数TI(LD50/ ED50),为临床安全用药提供指导。
【实验动物】小鼠(昆明种KM),雌雄各半。
【实验器材】铁丝网,铁架台,天平,注射器等。
【实验方法】应用点斜法测定ED50。
应用该方法测定ED50时,实验设计必须符合以下5点要求:1)动物以5~8组为宜;2)每组动物数须一致;3)各组给药剂量应呈现等比数列;4)各组给药剂量的公比r = 1.1~1.6;5)最大剂量(Dmax)组的阳性反应率须≥80%,最小剂量(Dmin)组的阳性反应率须≤20%【实验方法】1.预实验:目的是为了找出符合上述点斜法要求5)的Dmax和Dmin。
阳性反应判定标准:20min内小鼠落下3次(注意排除因互相拥挤而落下所造成的假阳性)。
肝微粒体的提取及其含量测定

人肝微粒体的提取及其含量测定第一部分:人肝微粒体的提取一、仪器及试剂:仪器:内切式匀浆机,高速离心机,超速离心机,表面皿数个,冰袋数个,碎冰,装碎冰烧杯,匀浆用玻璃管,不锈钢剪刀试剂:含0.15M KCl的100mM磷酸钾缓冲液(PH=7.4),100mM磷酸钾缓冲液材料:8号人肝(称取重量29.95g)二、实验流程:组织(记录死亡时间、储运条件)37度水浴解冻含0.15 M KCl 的100 mM磷酸钾缓冲液(pH 7.4)漂洗,除去表面血迹及组织液(缓冲液事先已置于冰箱中冷藏)将组织置于下垫冰块的表面皿中,用剪刀手动剪碎内切式均浆机匀浆(过程中注意将组织置于冰块包围住,保持低温环境)9000 ×g离心20 min,取上清,即得S9超速离心机105,000 ×g 超速离心60 min取沉淀(过程中防止上清表面的油膜粘附到沉淀表面,应用吸管将油膜慢慢吸出,而不能倾倒)重悬于100 mM磷酸钾缓冲液(pH 7.4)中(重悬过程中应注意不要产生气泡)105,000 ×g 超速离心60 min取沉淀,用100mM磷酸钾缓冲液(pH7.4)重悬得微粒体(此次重悬时应使用尽量少的缓冲盐体积,以防止微粒体浓度被过于稀释,重悬过程同样注意油膜与气泡)磷酸盐缓冲液中,分装塑料小管中,-80°C贮存三、实验结果:一共称取8号人肝组织29.95g,提取出肝微粒体23mL,经蛋白含量测定,微粒体二次重悬液蛋白含量以牛血清白蛋白计为37.4mg/mL,加入100mM磷酸盐缓冲液(pH=7.4)稀释至86mL,得10mg/mL的微粒体储备液,分装保存于-80度待用。
第二部分微粒体中蛋白含量测定一、仪器和材料:0.1 N NaOH(2g NaOH溶于500mL水), 1%酒石酸钾(1.342g四水合酒石酸钾溶于100mL 水),2 %无水碳酸钠(溶剂为0.1 N NaOH),0.5 %硫酸酮(溶剂为1%酒石酸钾),甲液(2 %无水碳酸钠50 ml,加0.5 %硫酸酮1 ml,混匀,临用时现配),牛血清蛋白标准液500 μg / ml(溶剂为0.1 N NaOH)Folin酚(福林试剂)试剂:1份Folin酚原液用蒸馏水稀释3倍得工作液,Folin酚试剂原液配制方法如下:1000mL磨口回流装置内,加入钨酸钠(Na2WO4·2H2O) 50 g钼酸钠(Na2MoO4·2H2O) 12.5 g蒸馏水350 mL85%磷酸25 mL浓盐酸50 mL文火回流10h。
单株抗人肝脏微粒体蛋白及细胞色素P450单克隆抗体的制备及初步鉴定

单株抗人肝脏微粒体蛋白及细胞色素P450单克隆抗体的制备及初步鉴定纪宏宇;王智勇;于磊;武正华;唐小波;朱大岭【期刊名称】《黑龙江医药》【年(卷),期】2007(020)002【摘要】目的:制备抗正常人肝脏微粒体(HLM)及细胞色素P450蛋白的单克隆抗体.方法:采用人肝脏微粒体蛋白作为免疫原免疫Balb/C小鼠,按常规方法融合、克隆,经间接ELISA法筛选抗体阳性杂交瘤细胞株,通过单抗亚类、Western blot对抗体进行初步鉴定.结果:成功地制备了一株抗肝微粒体蛋白的单克隆抗体(MAb),命名为MAb 10C7.用鼠单抗亚类快速鉴定纸条鉴定10C7为IgG2b.Western blot 分析显示,MAb 10C7可特异识别相对分子量为46kD的人肝脏微粒体蛋白.结论:MAb 10C7抗正常人肝脏微粒或细胞色素P450蛋白的特异性强,对相关蛋白质的功能研究有较好的应用前景.【总页数】3页(P124-126)【作者】纪宏宇;王智勇;于磊;武正华;唐小波;朱大岭【作者单位】哈尔滨医科大学附属第二医院药学部,黑龙江,哈尔滨,150086;哈尔滨医科大学药学院,黑龙江,哈尔滨,150086;哈尔滨医科大学附属第二医院药学部,黑龙江,哈尔滨,150086;哈尔滨医科大学药学院,黑龙江,哈尔滨,150086;哈尔滨医科大学药学院,黑龙江,哈尔滨,150086;哈尔滨医科大学药学院,黑龙江,哈尔滨,150086;哈尔滨医科大学药学院,黑龙江,哈尔滨,150086;黑龙江省生物医药工程重点实验室-省部共建国家重点实验室培育基地,黑龙江,哈尔滨,150086;哈尔滨医科大学附属第二医院药学部,黑龙江,哈尔滨,150086;哈尔滨医科大学药学院,黑龙江,哈尔滨,150086;黑龙江省生物医药工程重点实验室-省部共建国家重点实验室培育基地,黑龙江,哈尔滨,150086;哈尔滨医科大学药物与内源性物质代谢省高校重点实验室,黑龙江,哈尔滨,150086【正文语种】中文【中图分类】R392-337【相关文献】1.灯盏花素注射液对鼠催眠、肝脏指数、肝微粒体细胞色素P450系及相关酶系的影响研究 [J], 孔庆福;隋炳运;吴修荣;王元业;高荣惠;田光2.参芎葡萄糖注射液对肝脏6种亚型微粒体细胞色素P450酶的抑制作用 [J], 孙佳;陆苑;潘洁;郑林;黄勇;王永林;李勇军3.碳链长度不同的酮对大鼠肝脏微粒体细胞色素P450... [J], 李德淳;Brady,TF4.吡格列酮能部分抑制2型糖尿病大鼠肝脏微粒体细胞色素P450活性 [J], 常伟;闵智慧;程韵枫;唐扣明5.液化石油气吸入对小鼠肝微粒体蛋白及细胞色素P450含量的影响 [J], 陈晓琴;李来玉;苏旭因版权原因,仅展示原文概要,查看原文内容请购买。
细胞色素C制备和含量测定

细胞色素C的制备和含量测定摘要:本实验以新鲜动物心脏为原材料,进行了细胞色素C的制备和含量测定。
细胞色素C易溶于水,在酸性溶液中溶解度更大,故可用酸性水溶液提取,利用还原型细胞色素C水溶液在波长520nm有最大吸收值的特点,用分光光度法测定其质量浓度并计算出粗制品的总量。
关键词:细胞色素C;制备;含量;测定引言:细胞色素C包括多种能够传递电子的含铁蛋白质总称。
普遍存在于各类动植物组织和微生物中。
它是呼吸链中极重要的电子传递体,细胞色素C(cytochrome c,CytC)只是细胞色素的一种。
它在呼吸链上位于细胞色素还原酶和细胞色素氧化酶之间。
线粒体中的细胞色素绝大部份与内膜紧密结合,仅有细胞色素C结合轻松,较易被分离纯化。
细胞色素C为含铁卟啉的结合蛋白质,每一个细胞色素C分子含有一个血红素和一条多肽链。
分子质量约为13000,蛋白质部份由104个左右的氨基酸残基组成,其中赖氨酸含量较高,等电点,含铁量。
它易溶于水,在酸性溶液中溶解度更大,故可用酸性水溶液提取。
本实验以新鲜动物心脏为材料提取制备和纯化细胞色素C,取得其粗品溶液,其中是细胞色素C氧化型和还原型混合物,加入少量联二亚硫酸钠,使混合物中的氧化型转变成还原型,利用还原型细胞色素C水溶液在波长520nm有最大吸收值的特点,用分光光度法测定其质量浓度(mg/ml),并计算出粗制品的总量(mg)。
为了解制备蛋白质样品的一样原理和步骤提供实验依据和技术支持。
1 材料材料新鲜(冷冻)动物心脏样品。
试剂(1)25%(NH4)2SO4,12%BaCl2,联二亚硫酸钠。
(2)人沸石:白色颗粒,不溶于水,溶于酸。
选用40-60目。
20% 三氯乙酸(TCA)、1 mol/L H2SO4(L)、% NaCl、1mol/L NH4OH(L)溶液、细胞色素C标准液(1 mg/ml)。
仪器绞肉机、电磁搅拌器、离心机、纱布、pH试纸、层析柱(1×10cm)、分光光度计、透析袋等2 实验方式材料处置新鲜或冷冻动物心脏,除尽脂肪、血管和韧带,洗尽积血,切成小快,放入绞肉机中绞碎(两遍)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
院系:理学院专业:农药学学号:0931******* 姓名:王熠肝微粒体的制备及细胞色素P-450含量测定
1 实验目的
本实验通过超速离心法制备肝微粒体,利用Bradford法,学习并掌握了细胞色素P-450含量的测定。
2 实验原理
研究体外药物代谢常用的方法是制备肝微粒体或线粒体后部分,将肝组织制备成20%匀浆,按1g肝组织加0.25mol/L蔗糖溶液或pH7.4 Tris-HCl缓冲液3mL ,磨成匀浆,用低温高速离心制备线粒体后上清液和超速离心法制备微粒体(内质网部分)-差速离心法。
细胞色素P-450是微粒体混合功能氧化酶中最主要的功能成分,其含量的高低基本可以反映混合功能氧化酶的活力大小。
细胞色素P-450是一种血红蛋白,当铁蛋白的铁离子被还原并与一氧化碳形成复合物时出现一种特异吸收峰,在波长450nm处呈现最大吸收峰,在490nm处为最低吸收。
根据两者的差值和吸收系数,可定量细胞色素P-450含量。
3 实验材料
3.1实验动物
大鼠:健康,体重200~250g,禁食过夜(24h)
3.2实验器材与试剂
器材:低温高速离心机、洁净工作台、匀浆器、注射器、手术剪、低温冰箱、液氮罐等
试剂:1.17% KCl 溶液
Tris-HCl缓冲液: Tris 6.05 g ;蔗糖 68.4 g;
水 500 ml;浓盐酸调 pH 7.4;补水至 1000 ml
4.实验方法
4.1动物处理与匀浆制备
断头处死,放尽血液,迅速剖开胸、腹腔,取出肝脏,用冰冷1.17% KCl 溶液洗净血污,并用滤纸吸干表面水分。
肝脏称重,置烧杯中剪碎,按每克肝脏3ml的比例加入0.25mol/L蔗糖溶液或pH7.4 Tris-HCl缓冲液,匀浆,将匀浆
倒入离心管中,用缓冲液洗涤匀浆管,使最后的缓冲液体积加至约20%(W/V)
的匀浆。
4.2制备线粒体后上清液
将肝匀浆置低温高速离心,以沉淀未破碎的细胞、细胞碎片、核及线粒体,
上清液即为线粒体后上清液。
温度为0~4℃;离心力10 000~12 500g;时间
15~30min
4.3制备微粒体-超速离心法
取线粒体后上清液8~12mL,置超离心管;离心 100 000g 60min,弃上清
液;微粒体板用0.25mol/L蔗糖液或1.17%KCl液洗1次,以除去污染的血红蛋
白再离心 100 000g 30~60min,弃上清液;微粒体板沉淀物移至离心管,加适
量pH 7.4 Tris-HCl缓冲液重悬,终产物为微粒体悬液制备的肝微粒体每1g含
蛋白一般在20mg左右;最好当天使用。
若保存,应加20%(V/V)甘油分装于
塑料管,置-20~-80℃,可保存数周而酶活性不减。
4.4微粒体蛋白浓度测定
1.微量法制定标准曲线取8个1.5ml离心管,分别编号0-7,按下表配制
浓度梯度标准蛋白溶液。
表1 浓度梯度标准蛋白溶液
样品编号0 1 2 3 4 5 6 7 标准蛋白溶液
0 25 50 100 200 300 400 500
(μL)
Tris-HCl缓冲
1000 975 950 900 800 700 600 500 液(μL)
标准蛋白浓度
0 0.025 0.050 0.1 0.2 0.3 0.4 0.5
(mg/ml)
考马斯亮蓝试
200
剂(μL)
取上述各浓度蛋白标准稀释液20μL 与考马斯亮蓝染色剂200μL至96孔酶标
板内,各设三个重复孔,混匀,室温静置5-10min,以0号试管为空白对照,于
595nm处比色测定各孔OD值。
以OD595nm为纵坐标,标准蛋白含量为横坐标,
在坐标纸上绘制标准曲线。
2.未知样品蛋白质浓度的测定测定方法同上,分别取肝微粒体悬液100倍和
200倍稀释液20μL,测定OD595nm值,平行测定三次。
根据所测定的平均OD595nm
值,在标准曲线上查出其相当于标准蛋白的量,从而计算出未知样品的蛋白质浓
度(mg/mL)。
4.5细胞色素P-450含量测定
取蛋白含量已知的组织样品用pH7.4 0.1mol/L Tris缓冲液(1.21g Tris加约80ml蒸馏水溶解,用HCl溶液调pH值至7.4,最后用蒸馏水定容至100ml稀释为每1mL含 10mg微粒体蛋白的悬液;取此液0.3mL,加上述缓冲液5.7mL,混合;分装于2个比色杯(大约3mL),一个作为样品杯,另一个作为参比杯,置双光束紫外分光光度计,扫描400和500nm间的基线;加数mg连二亚硫酸钠,搅拌,样品杯轻轻充CO约1min,再扫描400~500nm的差示光谱。
4.6结果计算
P-450含量=△OD(450-490)×1000/91×蛋白浓度C × r (mg/ml)×
稀释倍数( nmol/mgPr)
ΔOD为450nm处光密度值与490nm光密度值之差 91为CYP450的消光系数,单位:cm2/mmol
r为比色杯光径长度,单位:cm
C为微粒体制备物的蛋白浓度,单位:mg/ml
5.实验结果
5.1 标准曲线的绘制
Bradford法测定标准蛋白结果和标准曲线见表2和图1
表2标准蛋白595nm的OD值
标准蛋白浓度
0.025 0.050 0.100 0.200 0.300 0.400 0.500 (mg/mL)
吸光度A0.399 0.477 0.561 0.684 0.763 0.836 0.882 以表2的数据绘制标准曲线如下。
图1标准曲线
5.2.未知样品蛋白质浓度的测定结果
表3 未知样品蛋白质浓度595nm的OD值
溶液测定校正值校正均值稀释100倍0.942 0.951 0.951 0.967
1.013 0.976 0.970
稀释200倍0.807 0.809 0.808 0.814
0.793 0.824 0.841
根据所测定的平均OD595nm校正值,在标准曲线上查出其相当于标准蛋白的量,计算出稀释100倍和200倍的蛋白浓度分别为53.96mg/ml,76.83mg/ml。
因此,未知样品的蛋白浓度: 65.40mg/ml
5.3 细胞色素P-450含量测定
由于实验过程中未充入CO ,因而未能测定细胞色素P-450,但是在420nm 波长下测得细胞色素B5的差值光谱。
图2 双光束紫外分光光度计测得细胞色素B5的差示光谱(0.5mg/ml)
OD值峰值(424nm):0.0197;谷值(490nm):0.00547。
6 实验讨论
肝微粒体是肝细胞中内质网的亚细胞组分,含有丰富的药物代谢酶:其中细胞色素P450酶广泛的参与了各种物质的生物合成和代谢;肝S9是肝匀浆液的去线粒体上清液,包含了大量的CYPs等药物代谢酶。
因此,微粒体是非常有价值的研究药物代谢和药物相互作用的工具。
实验注意:操作的全过程及所用器械、人;溶液均应维持在0℃~4℃范围内,匀浆器始终应浸在冰水浴中,以避免肝微粒体酶因热变性而失活。
制备无菌微粒体,需对所使用的全部器材和溶液进行灭菌处理。
细胞色素P-450含量依组织、动物是否诱导、种属、品种等而定,一般未诱
导的大、小鼠肝细胞色素P-450含量为0.4~1.0nmol/mg微粒体蛋白。
为避免血红蛋白破坏,保险粉加入不宜过多。
在缓冲液中加20%甘油可减少转化为无活性的细胞色素P-420,一般测定不需加甘油。
样品与保险粉混合后应尽快充CO,因细胞色素P-450的还原形式不太稳定;充CO时速度宜慢,以免泡沫太多导致蛋白变性。
充CO后如果420nm处吸收峰比较明显,表明有失活的细胞色素P-450,样品不能使用。
本次试验中,在测定蛋白浓度的时候,由于考马斯亮蓝试剂保存时间太长,使得测定的蛋白浓度不准确;在测定P-450含量时,由于外部原因并没有充入CO,因而分光光度计在450nm处并没有出现峰值,而是在424nm处出现峰值,经查是细胞色素B5的峰值。
细胞色素B5也存在于肝微粒体中,还原型b5与氰感受因子的酶一起,参与由氧将饱和酰基辅酶A转变成不饱和酰基辅酶A的脂肪酸不饱和化反应。
通过测定一系列蛋白浓度浓度的差示光谱,确定了当蛋白浓度为0.5mg/ml时的光谱图效果比较好,该谱在紫外区的吸收杂峰不很明显,并且有着很明显的波峰和波谷,效果理想。
