化学知识点讲解11:化合反应与氧化反应PPT
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化还原反应基本规律及其应用PPT课件

【例1】4NH3 + 5O2 → 4NO + 6H2O
2.如何确定和表示被氧化、被还原的元素
需表明什么物质中什么价态的元素被氧化或被还原
【例2】2Al + 3Cl2 → 2AlCl3 【例3】2KClO3 → 2KCl + 3O2↑
.
4
3.氧化还原反应与四种基本反应的关系(举例)
(1)化合反应: 可能是氧化还原反应可能不是氧化还原反应
13
(2)零价配平法 例:Fe3C+HNO3(浓)—Fe(NO3)3+CO2+NO2+H2O
练习:①Fe3O4+HNO3—Fe(NO3)3+NO+H2O ②Fe3P+HNO3—Fe(NO3)3+NO+H3PO4+H2O
答案:①3、28、9、1、14。 ②3、41、9、14、3、16
注意:化合价难确定的采用此方法为好。
(2)分解反应: 可能是氧化还原反应可能不是氧化还原反应
(3)复分解反应: 一定不是氧化还原反应
(4)置换反应: 一定是氧化还原反应
【思考】“有单质参加或生成的反应一定是氧化 还原反应”吗?
.
5
三、物质的氧化性、还原性判断 1.金属:M -ne Mn+
通常:金属单质——还原剂 金属阳离子——氧化剂
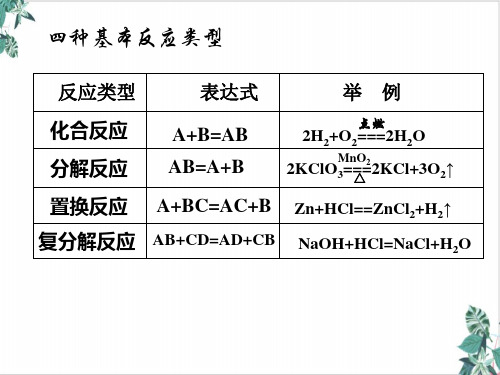
化学反应的基本类型 1.按变化形成分:
(1)化合反应 (2)分解反应 △ (3)复分解反应 (4)置换反应
* Fe2O3 + 3CO △ 2Fe + 3CO2 是置换反应吗?
2.按变化实质分:
(1)氧化还原反应 (2)非氧化还原反应
.
1
一、氧化还原反应的基本概念
2.2 第2课时 化合反应和氧化反应 课件(共13张PPT) 化学人教版九年级上册

氧化反应的是
( D)
A.用氧气进行气焊
B.用厨余垃圾自制花肥
C.用木炭进行烧烤
D.用酒精给发热病人降温
3.下列有关化合反应和氧化反应的说法正确的是 ( C )
A.由两种物质生成另一种物质的反应才是化合反应
B.氧化反应都很剧烈,且都会发光、放热
C.物质与氧气发生的反应一定是氧化反应
D.红磷在空气中燃烧既是缓慢氧化,也是化合反应
特征:多变一;通式:A+B+…―→ X。 2.氧化反应:上表中四个反应都是物质与___氧__气___发生的反应, 这类反应属于氧化反应。
第二单元 空气和氧气
化学
课堂精练
例1 下列属于化合反应的是___①__②__⑤____(填序号,下同),
属于氧化反应的是__②__③_______ 。
①二氧化碳+水―→碳酸
石蜡+氧气 点燃 二氧化碳+水
第二单元 空气和氧气
化学
知识点2 缓慢氧化
阅读课本第41页,填写下表:
燃烧
缓慢氧化
特点
发光、放热,较剧烈的 氧化反应
进行得_很__慢__、甚至_不__容__易__被__察__觉_ 的氧化反应
举例
红磷、硫、木炭、铁丝 细胞的呼吸作用、食物的腐烂、
的燃烧等
醋的酿造、农家肥的腐熟等
第二单元 空气和氧气
化学
1.认识化合反应和氧化反应; 2.知道生活中的缓慢氧化现象。
第二单元 空气和氧气
化学
知识点1 化合反应和氧化反应 填写下表后,再阅读课本第41页,完成有关问题。
物质 反应的符号表达式
共同特点
红磷 硫
P+O2 点燃 P2O5 S+O2 点燃 SO2
化学反应类型ppt课件

三、置换反应:
1.实验室制氢气的反应原理:2.盐Βιβλιοθήκη 除铁锈时,不用大量的酸长时间浸泡铁
制品的原因
3.农业上配制波尔多液时不能使用铁容器
4.实验室配制硝酸银溶液的容器不能使用铜制
品
5.木炭还原氧化铜
6.氢气具有还原性,可用来还原氧化铜
7.可用铝热剂(铝和氧化铁的混合物)在高温
时反应来焊接钢轨
精选ppt
8
应的化学方程式为
。
5.不能用玻璃瓶塞的试剂瓶盛装烧碱溶液的原因
精选ppt
4
不属于基本类型的反应
三、一氧化碳还原氧化物:
1.用一氧化碳在高温下还原氧化铜 2.工业上常用一氧化碳在高温下还原赤铁矿石 (主要成分为氧化铁) 3.工业上常用一氧化碳在高温下还原磁铁矿石
(主要成分为四氧化三铁) 4. 汽车尾气含有有害的一氧化碳、一氧化氮气
不属于基本类型的反应
二、非金属氧化物与碱溶液反应:
1.烧碱溶液必须密封保存的原因
2.存放石灰水的试剂瓶内壁会有一层白膜。(或用石灰 浆抹墙,逐渐变硬变白)
3.可以用石灰浆来吸收煤燃烧产生的废气中的二氧化硫 气体
4.航天员出舱行走所穿航天服中的CO2可用LiOH来吸收,
已知LiOH与NaOH具有相似的化学性质,则有关反
①
。
②____________。 ③____________。 ⑤____________。 ⑥____________。
①2Cu + O2△= 2CuO ②CuO + H2SO4 = CuSO4 +H2O ③ Fe + CuSO4 =FeSO4 +Cu ⑤Na2CO3+Ca(OH)2=CaCO3+2NaOH
《氧化反应及化合反应》课件 (省优)2022年人教版化学精品课件

教学中。
演示实验 将雪碧中的气体导入澄清石灰水中,观察现象
结论 二氧化碳能使澄清的石灰水变浑浊
CO2+Ca(OH)2=CaCO3 +H2O
设计意图:学生通过观察实验,分析归纳出二氧化碳的与氢氧化钙的反应原理,提 高了分析能力。
思考:1. 盛有澄清石灰水的试剂瓶能否敞口放置,为什么?使用久了有一层白膜 其成分是谁?如何清洗?应如何保存?
点拨:物质在氧气中燃烧的现象有相似之处,也有不同, 学习时要掌握共性,注意差异。如放热、剧烈燃烧属于共性, 而木炭的白光,硫的蓝紫色火焰,镁的耀眼白光,磷的大量白 烟,铁的火星四射以及它们各自的生成物如烟(固体)、雾(液体)、 气(气体),均属于个性,需要区别注意。
2.下列有关实验现象的描述,正确的是 ( C )。
3.化合反应与氧化反应的区别和联系
类型
化合反应
氧化反应
定义
由两种或两种以上物质 生成另一种物质的反应
物质与氧发生的反应
特征
多变一
要有氧参加的反应
区别
属于四种基本反应类型
不属于四种基本反应类型
化合反应不一定是氧化反应,氧化反应也不一定是化
联系 合反应,它们之间没有必然的联系,但有氧气参加的
化合反应,一定是氧化反应
[新闻事件]2011年11月12日江西卫视报道:因为快要入冬需要储存冬菜,一位 农民在整理地窖时晕倒在地窖中,幸亏被及时发现送入医院抢救。
结论:CO2虽然无毒但不供给呼吸
思考:在进入菜窖或久未开启的深 井前该怎么做?
设计意图:培养学生关注身边事物和新闻的习惯,将知识和生活联系在一起培 养学生分析问题,解决问题的能力,学以致用。
A.碳+氧气 点燃 二氧化碳 B.硫+氧气 点燃 二氧化硫 C.铁+氧气 点燃 四氧化三铁 D.蜡烛+氧气 点燃 二氧化碳+水 E.红磷+氧气 点燃 五氧化二磷
演示实验 将雪碧中的气体导入澄清石灰水中,观察现象
结论 二氧化碳能使澄清的石灰水变浑浊
CO2+Ca(OH)2=CaCO3 +H2O
设计意图:学生通过观察实验,分析归纳出二氧化碳的与氢氧化钙的反应原理,提 高了分析能力。
思考:1. 盛有澄清石灰水的试剂瓶能否敞口放置,为什么?使用久了有一层白膜 其成分是谁?如何清洗?应如何保存?
点拨:物质在氧气中燃烧的现象有相似之处,也有不同, 学习时要掌握共性,注意差异。如放热、剧烈燃烧属于共性, 而木炭的白光,硫的蓝紫色火焰,镁的耀眼白光,磷的大量白 烟,铁的火星四射以及它们各自的生成物如烟(固体)、雾(液体)、 气(气体),均属于个性,需要区别注意。
2.下列有关实验现象的描述,正确的是 ( C )。
3.化合反应与氧化反应的区别和联系
类型
化合反应
氧化反应
定义
由两种或两种以上物质 生成另一种物质的反应
物质与氧发生的反应
特征
多变一
要有氧参加的反应
区别
属于四种基本反应类型
不属于四种基本反应类型
化合反应不一定是氧化反应,氧化反应也不一定是化
联系 合反应,它们之间没有必然的联系,但有氧气参加的
化合反应,一定是氧化反应
[新闻事件]2011年11月12日江西卫视报道:因为快要入冬需要储存冬菜,一位 农民在整理地窖时晕倒在地窖中,幸亏被及时发现送入医院抢救。
结论:CO2虽然无毒但不供给呼吸
思考:在进入菜窖或久未开启的深 井前该怎么做?
设计意图:培养学生关注身边事物和新闻的习惯,将知识和生活联系在一起培 养学生分析问题,解决问题的能力,学以致用。
A.碳+氧气 点燃 二氧化碳 B.硫+氧气 点燃 二氧化硫 C.铁+氧气 点燃 四氧化三铁 D.蜡烛+氧气 点燃 二氧化碳+水 E.红磷+氧气 点燃 五氧化二磷
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
第2课时化合反应与氧化反应-九年级化学人教版上册精品课件

(2)反应②的基本反应类型为__化__合__反__应____,为了检 验反应②的生成物,需要的一种试剂是_澄__清__石__灰__水___, 反应②___属__于___(填“属于”或“不属于”)氧化反应。
(3)说明反应③是化学变化的主要现象是_生__成__一__种__黑_ _色__固__体__。
(4)反应④的生成物为___白___色___固___体。
第二单元 我们周围的空气
课题2 氧气
第2课时 化合反应与氧化反应
1.(2020·丹东月考)下列说法中,正确的是( C ) A.有氧气参加的反应一定都是化合反应 B.发生氧化反应时都会发光放热 C.燃烧属于氧化反应 D.氧化反应一定是化合反应
2.下列各组变化,前者一定包含后者的是( B ) A.物理变化,化学变化 B.化学反应,化合反应 C.氧化反应,化合反应 D.氧化反应,化学反应
3.下列说法不正确的是( A ) A.有氧气参加的反应都是化合反应 B.氧化反应不一定是化合反应 C.氧化反应一定是化学变化 D.不论是否有氧气参加,只要由两种或两种以上的 物质生成另一种物质的反应,就属于化合反应
4.下列关于氧化反应的说法不正确的是( B )
A.物质与氧气发生的反应属于氧化反应 B.氧化反应都是剧烈的燃烧 C.农家肥料的腐熟、跑步后的急促呼吸属于缓慢氧化 D.缓慢氧化进行得很慢,不易被察觉,不发光,会放热
置E收集H2,气体应从短管进入,因为氢气的密度比空气小。(4)①实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙 和盐酸反应生成氯化钙、水和二氧化碳;②装置F、H中溶液变浑浊,G中溶液不变浑浊,则原石灰水未变浑浊的原因是二氧化碳中含有氯化
点燃 氢气体;③装置G的作用是检验氯化氢气体是否被除尽。 乙_磷__+__氧__气__―__―__→__五__氧__化__二__磷__; (62)氯化钠溶液和硝酸银溶液:NaCl+AgNO3 AgCl↓+NaNO3(生成不溶于稀硝酸的白色沉淀;其他可溶性盐酸盐与硝酸银溶液也有类似
(3)说明反应③是化学变化的主要现象是_生__成__一__种__黑_ _色__固__体__。
(4)反应④的生成物为___白___色___固___体。
第二单元 我们周围的空气
课题2 氧气
第2课时 化合反应与氧化反应
1.(2020·丹东月考)下列说法中,正确的是( C ) A.有氧气参加的反应一定都是化合反应 B.发生氧化反应时都会发光放热 C.燃烧属于氧化反应 D.氧化反应一定是化合反应
2.下列各组变化,前者一定包含后者的是( B ) A.物理变化,化学变化 B.化学反应,化合反应 C.氧化反应,化合反应 D.氧化反应,化学反应
3.下列说法不正确的是( A ) A.有氧气参加的反应都是化合反应 B.氧化反应不一定是化合反应 C.氧化反应一定是化学变化 D.不论是否有氧气参加,只要由两种或两种以上的 物质生成另一种物质的反应,就属于化合反应
4.下列关于氧化反应的说法不正确的是( B )
A.物质与氧气发生的反应属于氧化反应 B.氧化反应都是剧烈的燃烧 C.农家肥料的腐熟、跑步后的急促呼吸属于缓慢氧化 D.缓慢氧化进行得很慢,不易被察觉,不发光,会放热
置E收集H2,气体应从短管进入,因为氢气的密度比空气小。(4)①实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙 和盐酸反应生成氯化钙、水和二氧化碳;②装置F、H中溶液变浑浊,G中溶液不变浑浊,则原石灰水未变浑浊的原因是二氧化碳中含有氯化
点燃 氢气体;③装置G的作用是检验氯化氢气体是否被除尽。 乙_磷__+__氧__气__―__―__→__五__氧__化__二__磷__; (62)氯化钠溶液和硝酸银溶液:NaCl+AgNO3 AgCl↓+NaNO3(生成不溶于稀硝酸的白色沉淀;其他可溶性盐酸盐与硝酸银溶液也有类似
新人教版九年级上册初三化学课件PPT 2.2 氧气

知1-导
为何要将燃烧匙自上而下缓慢的插入 ?
问 题(三)
回忆一下我们以前学过的知识, 在测定空气中氧气 含量的时候,我们用的是什么药品?想一想,能否利用 硫来测定空气中氧气的含量吗?为什么?
归纳
知1-导
反应物的色、态 淡黄色固体
在空气中 微弱的淡蓝色火焰,放热,
燃烧现象 生成有刺激性气味的气体
硫 磺
问 题(三)
在集气瓶中加入少量澄清的石灰水、振荡。石 灰水变浑浊说明瓶中产生了什么气体?
归纳
知1-导
反应物的色、态 淡黄色固体
在空气中 燃烧发红,放出热量,生成能
燃烧现象 使澄清石灰水变浑浊的气体
木 炭
燃烧现象
在氧气中 燃烧现象
剧烈燃烧,发出白光, 放出热量,生成能使澄 清石灰水变浑浊的气体。
文字表质与氧发生的反应。 缓慢氧化:进行得很慢,不容易被察觉的氧化
反应叫缓慢氧化。
问题
判断下列反应是化合反应还是氧化反应 硫+氧气 点燃 二氧化硫
锌+盐酸
氯化锌+氢气
石蜡+氧气 点燃 二氧化碳+水
镁+氧气 点燃 氧化镁
知2-导
知2-导
【讨论】在什么情况下,一个反应既是化合反 应又是氧化反应?
8 下列变化中,不属于缓慢氧化的是( B ) A.钢铁生锈 B.酒精燃烧 C.牛奶变酸 D.农家肥料腐熟
知2-练
知2-练
9 下列反应既是化合反应,又是氧化反应的是( A ) A.磷+氧气 点燃 五氧化二磷
B.氧化钙+水
氢氧化钙
C.石蜡+氧气 点燃 二氧化碳+水
D.氧化汞 加热 汞+氧气
1 知识小结
知识点 2 化合反应与氧化反应
氧化还原反应ppt课件

1、用双线桥式标出下列氧化还原反应中电子的转移:
失去2e-
失去2e-
H2+Cl2==2HCl 得到2e-
Fe+2HCl==FeCl2+H2↑ 得到2e-
2、用单线桥式标出下列氧化还原反应中电子的转移:
6e-
2e-
2Fe+3Cl2==2FeCl3
Fe+CuSO4==FeSO4+Cu
《物质及其变化》
第三节 氧化还原反应
《物质及其变化》
第三节 氧化还原反应
问题3 为什么氧化还原反应中有元素化合价变化? 以2Na+Cl2==2NaCl为例
+11 2 8 1
e-
+17 2 8 7
Na元素化
合价升高
+11
元素化合价变化是 因为有电子的转移
28
+17 2 8 8
Cl元素化 合价降低
Na+ Cl-
《物质及其变化》
第三节 氧化还原反应
O2、Cl2、浓硫酸、HNO3、KMnO4、FeCl3 等
2、常见还原剂:——有元素的化合价可以升高。
活泼的金属单质、含有较低价态元素的化合物、部分非金属单质等。 如 Al、Zn、Fe、C、H2、CO、H2S、HI、FeCl2 等
《物质及其变化》
第三节 氧化还原反应
现有下列粒子:Fe、Fe2+、Fe3+、S2-、SO2 中
2、复分解反应是两种化合物交换成分 元素的化合价一定不变化 复分解反应都不是氧化还原反应
化合反应
分解反应
氧化还原 反应
置换反应
3、有些分解反应和化合反应 元素的化合价可能变化
复分解反应
氧化还原反应PPT课件

第二章 化学反应及其变化
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
氧化还原反应PPT (精简)剖析

+5
-1
-1 0
(3)KClO3 + 6HCl == KCl + 3Cl2 ↑+ 3H2O
10/6/2020
失 5× e-
(2)“单线桥”法 2e-
△
CuO + H2 === Cu + H2O
12e-
2KClO3 =△== 2KCl + 3O2 ↑
注意:A、箭头由失电子元素指向得电子元素 。 B、只须标明电子转移总数。
练习:用“双线桥”法表示下列氧化还原反应电子转移的方向和数 目。
失1 × 2e-
0 +1
+2
0
(1)Fe + H2SO4 == FeSO4 + H2↑
得2×e-
得2×5e-
+7
-1
+2
0
(2)2KMnO4 + 16HCl == 2KCl+2MnCl2 + 5Cl2↑+ 8H2O
得1 × 5e-
失 10× e-
第二节 氧化还原反应
氧化还原反应 在初中我们也学过氧化反应和还原反应,
2Mg+O2=2MgO CuO+H2=H2O+Cu
氧化还原反应 一.氧化还原反应
1.从得失氧的角度分析
氧化反应:物质得到氧的反应 还原反应:物质失去氧的反应
CuO + H2 = H2O + Cu
CuO Cu 失去氧 还原反应
H2 H2O 得到氧 氧化反应
一种物质失去氧必有一种物质得到氧,在 同一个反应中既有还原反应又有氧化反应
氧化还原反应
氧化还原反应定义:
既有物质得到氧 又有物质失去氧
化合反应与氧化反应PPT授课课件

能力提升练
6.[中考·江苏常州节选]某列高铁的时刻表如表所示。从上 海 至 北 京 的 全 程 时 间 为 ___4_._5___h , 全 程 平 均 速 度 是 _3_0_0_km/h。
基础巩固练
3.[中考·广西钦州]如图所示是测量小车运动平均速度的实 验装置示意图,让小车从静止开始沿斜面向下运动,关 于小车通过前半段路程s1、后半段路程s2和全程s的平均 速度的判断,正确的是( B ) A.小车通过s1的平均速度最大 B.小车通过s2的平均速度最大 C.小车通过s1的平均速度大于通过s的平均速度 D.小车通过s2的平均速度小于通过s的平均速度
2. 下列反应不属于氧化反应的是( B )
A. 石蜡燃烧
B. 光合作用
C. 呼吸作用
D. 天然气燃烧
3. 下列变化中,不属于缓慢氧化的是( B )
A. 钢铁生锈
B. 酒精燃烧
C. 牛奶变酸
D. 农家肥料腐熟
4. 写出下列有关反应的文字表达式。 (1)烟幕弹的原理:__磷__+__氧__气__―__点―_燃_→__五__氧__化__二__磷_____。
____B_点___时__的__速__度__不__为__0_;__小__车__通__过__A_C__段__的__时__间__与__A_B__段__的__ _时__间__之__差__才__是__下__半__程__B_C_段__的__时__间__)___。
素养核心练
12.[安徽桐城期末]物理学中将物体在单位时间内速度的增 加量定义为加速度。依据该定义,若某物体在t时间内 速度从v1增加到v2,则加速度为________,现有一小球 从静止开始以3 m/s2的加速度加速运动2 s,则2 s末小球 的速度为________。
高一化学氧化还原反应优秀课件-PPT

第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应的基本概念及相互关系
回忆初中学过的氧化反应和还原反应
还原反应
CuO + H2 △ Cu + H2O
氧化反应
CuO + H2 △ Cu + H2O
一、从氧的得失角度分析
CuO + H2 △ Cu + H2O
CuO 失去氧 Cu
H2 得到氧 H2O
氧化剂 Cl2 还原产物 KCl
练习2:指出下列反应中哪种物质是氧化剂 、哪种物 质是还原剂以及氧化产物、还原产物。
(3) 2H2O =电=解= 2H2↑ + O2↑
还原剂 H2O
氧化剂 H2O
氧化产物 O2
还原产物 H2
(4) MnO2 + 4HCl =△= MnCl2 + Cl2↑+2H2O
还原剂 HCl 氧化产物 Cl2
+5 -2
2KClO3
=△=
-1
2KCl
+
0
3O2↑
练习6:下列说法下说法正确的是( BD )
A、氧化剂本身被还原,生成氧化产物。
B、氧化剂是在反应中得到电子(或电子对偏 向)的物质。
C、还原剂在反应时所含元素的化合价降低。
D、在一个反应中,氧化剂和还原剂可能是同 一物质。
练习7:下列反应中,HCl为还原剂的是( C ) HCl为 氧化剂的是( A ) HCl不是氧化剂也不是还原剂的是 ( BD )
被还原,得到e-,化合价降低
氧化还原反应的特征:化合价升降 氧化还原反应的实质:电子转移(得失或偏移)
通过以上分析,我们认识到:
1.有电子转移的反应是氧化还原反应。
第三节 氧化还原反应
氧化还原反应的基本概念及相互关系
回忆初中学过的氧化反应和还原反应
还原反应
CuO + H2 △ Cu + H2O
氧化反应
CuO + H2 △ Cu + H2O
一、从氧的得失角度分析
CuO + H2 △ Cu + H2O
CuO 失去氧 Cu
H2 得到氧 H2O
氧化剂 Cl2 还原产物 KCl
练习2:指出下列反应中哪种物质是氧化剂 、哪种物 质是还原剂以及氧化产物、还原产物。
(3) 2H2O =电=解= 2H2↑ + O2↑
还原剂 H2O
氧化剂 H2O
氧化产物 O2
还原产物 H2
(4) MnO2 + 4HCl =△= MnCl2 + Cl2↑+2H2O
还原剂 HCl 氧化产物 Cl2
+5 -2
2KClO3
=△=
-1
2KCl
+
0
3O2↑
练习6:下列说法下说法正确的是( BD )
A、氧化剂本身被还原,生成氧化产物。
B、氧化剂是在反应中得到电子(或电子对偏 向)的物质。
C、还原剂在反应时所含元素的化合价降低。
D、在一个反应中,氧化剂和还原剂可能是同 一物质。
练习7:下列反应中,HCl为还原剂的是( C ) HCl为 氧化剂的是( A ) HCl不是氧化剂也不是还原剂的是 ( BD )
被还原,得到e-,化合价降低
氧化还原反应的特征:化合价升降 氧化还原反应的实质:电子转移(得失或偏移)
通过以上分析,我们认识到:
1.有电子转移的反应是氧化还原反应。
高一化学必修1氧化还原反应PPT课件PPT(32页)

高一化学必修1氧化还原反应PPT课件P PT(32 页)
课堂练习
1.下列反应属于氧化还原反应的是
A、
C
+
H2O
高温
===
H2+
CO
B、NH4NO3 =△== N2O ↑+ 2H2O
C、2NaHCO3 =△== Na2CO3 + CO2↑+ H2O
D、3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
高一化学必修1氧化还原反应PPT课件P PT(32 页)
思考 ·交流
4、氧化还原反应是否一定存在得失氧? 请分析下面的反应。
化合价降低 被还原
Zn+2HCl==== ZnCl2+H2 化合价升高 被氧化
化合价降低 被还原 点燃
2Na+Cl2====2NaCl 化合价升高 被氧化
高一化学必修1氧化还原反应PPT课件P PT(32 页)
0
0 点燃 +1 -1
H2 + Cl2 === 2HCl
得电子,化合价降低,被还原
电子对偏向,化合价降低,被还原
电子的转移(得失或偏移)是化合价变化的实质, 也是氧化还原反应发生的实质。
氧化反应:物质失去电子(或电子对偏离)的反应。 还原反应:物质得到电子(或电子对偏向)的反应。
氧化还原反应:有电子转移(得失或偏移)的反应。
[巩固练习]
1 .实现下列变化,一定要加入其它物质作氧化剂
的是:(C)
A.CaCO3 → CO2 C.Zn → ZnCl2
B.NaCl → NaNO3 D.CuO → CuSO4
2.下列反应中,SO2作还原剂的是( C )
氧化还原反应 课件

对应的金属阳离子得电子的能力增强,即氧化性增强。
【例】下列说法中正确的是( D ) A、还原性强弱:Fe > Cu> H2 B、氧化性强弱:Cu2+ > H+> Fe3+ C、得电子越多的物质,氧化性越强 D、夺电子越强的物质,氧化性越强
物质氧化性、还原性相对强弱的比较
【方法三】根据氧化还原反应的程度 不同氧化剂和相同还原剂作用时,还原剂化合价升高数值
反应,发生反应时化合价向中间靠拢,但不交叉。(只 靠近,不交叉,相邻价态不反应)
氧化还原反应方程式的配平
化合价升高4×1
0
+5
1 C+4HNO3(浓)
+4
+4
4 NO2 + 1 CO2 + 2 H2O
化合价降低1×4
(1)标:标出反应前后有化合价变化的元素的化合价
(2)等:通过求最小公倍数法使化合价升降总数相等
还原性:还原剂>还原产物
2. 根据元素活动性顺序比较:金属单质还原性越强,其对
应的金属阳离子氧化性越弱
3. 根据氧化还原反应的程度比较:
点燃
2Fe +3Cl2=== 2FeCl3 Fe + S FeS
氧化性Cl2>S
4. 根据反应的条件及反应的剧烈程度比较:
MnO2+4HCl MnCl2+Cl2↑+2H2O KMnO4+16HCl=== 2KCl+2MnCl2+5Cl2↑+8H2O 氧化性:KMnO4> MnO2
-
Cl
-
-
-
-
-
-
H与Cl共用电子对,电子对发生偏移,偏向Cl,所以H 化合价升高,氢气发生氧化反应;Cl化合价降低,氯气 发生还原反应
【例】下列说法中正确的是( D ) A、还原性强弱:Fe > Cu> H2 B、氧化性强弱:Cu2+ > H+> Fe3+ C、得电子越多的物质,氧化性越强 D、夺电子越强的物质,氧化性越强
物质氧化性、还原性相对强弱的比较
【方法三】根据氧化还原反应的程度 不同氧化剂和相同还原剂作用时,还原剂化合价升高数值
反应,发生反应时化合价向中间靠拢,但不交叉。(只 靠近,不交叉,相邻价态不反应)
氧化还原反应方程式的配平
化合价升高4×1
0
+5
1 C+4HNO3(浓)
+4
+4
4 NO2 + 1 CO2 + 2 H2O
化合价降低1×4
(1)标:标出反应前后有化合价变化的元素的化合价
(2)等:通过求最小公倍数法使化合价升降总数相等
还原性:还原剂>还原产物
2. 根据元素活动性顺序比较:金属单质还原性越强,其对
应的金属阳离子氧化性越弱
3. 根据氧化还原反应的程度比较:
点燃
2Fe +3Cl2=== 2FeCl3 Fe + S FeS
氧化性Cl2>S
4. 根据反应的条件及反应的剧烈程度比较:
MnO2+4HCl MnCl2+Cl2↑+2H2O KMnO4+16HCl=== 2KCl+2MnCl2+5Cl2↑+8H2O 氧化性:KMnO4> MnO2
-
Cl
-
-
-
-
-
-
H与Cl共用电子对,电子对发生偏移,偏向Cl,所以H 化合价升高,氢气发生氧化反应;Cl化合价降低,氯气 发生还原反应
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.上述几个变化中,有什么共同的特征?
参加物质为二种 生成物质为一种 由两种或两种以上物质生成另一种物质的反应,
叫做化合反应。 反应通式:A + B = AB
(基本反应类型之一)
一、化合反应 由两种或两种以
上物质生成另一种物 质的反应,叫做化合 反应。
特点:反应物有两种或以上, 生成物只有一种。 由多变一
•
5.鉴于转基因 食 品 , 特 别是 主 粮 的 安 全性 研 究 需 要 一个 漫 长 的 周 期, 主 管 部 门 断不 可 急 于 宣 布转 基 因 主 粮 的安 全 性 。
4.这里的“氧”不能换成“氧气”,因为氧既包括单质氧气, 又包括化合物中的氧元素。
5、氧化反应不属于基本反应类型。
三、化合反应和氧化反应的关系
化学反应
1
2
4
化合反应 3?氧化反应
有氧气参加的化合反应同时也是氧化反应
Fe + O2 点燃 Fe3O4
“化合反应”与“氧化反应”分类依据不同,二者之间没有必 然联系化合反应不一定是氧化反应,氧化反应也不一定是化合 反应。
•
2.对于人类而 言 , 转 基 因技 术 或 是 天 使, 或 是 魔 鬼 ,既 可 能 给 人 类社 会 的 发 展 带来 福 音 , 也 可能 对 人 类 的 健康 造 成 损 害 。
•
3.关键问题在 于 , 科 学 界至 今 不 能 确 认, 转 基 因 食 品究 竟 有 无 可 能对 生 态 环 境 、人 体 健 康 造 成重 大 伤 害 。 在这 样 的 背 景 下, 转 基 因 食 品的 商 业 化 , 特别 是 主 粮 的 商业 化 问 题 显 得有 些 敏 感 。
于化合反应的是( C )
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
4、下列说法正确的是( A ) A.化合反应是指由两种或两种以上的物质生 成另一种物质的反应 B.氧化反应是指物质与氧气发生的反应 C.凡是在空气中不能燃烧的物质,在纯氧中 也不能燃烧 D.氧化反应未必是化合反应,而化合反应必 定是氧化反应
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
3.下列化学反应既属于化合反应又属于
氧化反应的是( A )
A.硫+氧气 点燃 二氧化硫 B.蜡烛+氧气 点燃 二氧化碳 + 水 C.碱式碳酸铜 点燃 氧化铜 + 二氧 化碳 + 水 D.乙炔+氧气 点燃 二氧化碳+水
以上反应既不属于氧化反应又不属
[判断正误] 1、物质与氧气发生的反应叫氧化反应。 2、物质与氧气发生的反应是氧化反应 3、氧化反应是指物质与氧气发生的反应 4、氧化反应一定是化合反应 5、物质在空气中燃烧的实质是物质与空气中的氧气发
生的氧化反应 6、有氧气参加的化合反应一定既是氧化反应又是化合
反应 7、化合反应、氧化反应都属于基本反应类型
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
•
1.根据目前的 定 义 , 转 基因 技 术 是 从 某种 生 物 中 提 取所 需 要 的 基 因, 将 其 转 入 另一 种 生 物 中 ,使 与 另 一 种 生物 的 基 因 进 行重 组 , 从 而 产生 特 定 的 具 有优 良 遗 传 形 状的 物 质 。 从 研究 角 度 看 , 转基 因 的 技 术 推进 已 有 不 短 的时 间 。
本内容适合人教版 九年级化学
初中化学知识点讲解
第二单元 空气 氧气
化合反应与氧化反应
主讲人 杨老师
【回忆】碳 、硫、铁在氧气中反应的表达式:
碳 + 氧气
点燃 二氧化碳
C + O2 硫 + 氧气
点燃
CO2 点燃 二氧化硫
S + O2 铁 + 氧气
点燃
点燃
SO2 四氧化三铁
点燃
Fe + O2
Fe3O4
上述几个变化中,有什么共同的特征? 参加的物质中都有氧气
氧化反应:物质跟氧气发生的反应。
二、氧化反应:物质跟氧发生的反应。 1.氧(元素) :O2 或 其他含氧物质。
2.有O2参加的反应一定是氧化反应,但氧化反应 不一定有O2参与反应。 例: S + O2 点燃 SO2
CH4 + O2 点燃 CO2 + H2O H2+CuO 加热 Cu + H2O ,也是氧化反应 3.强调反应物,而对生成物数量没要求。
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
6.下列概念中,前者一定包括后者的是( B ) A.化合反应 氧化反应 B.氧化反应 缓慢氧化 C.混合物 纯净物 D.物理性质 化学性质
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
•
4.在我们看来 , 转 基 因 食品 在 当 下 中 国所 引 发 的 争 议, 看 起 来 相 当复 杂 , 但 归 结起 来 , 不 外 是科 学 逻 辑 与 商业 逻 辑 共 同 作用 下 的 结 果 。从 科 学 角 度 看, 这 件 事 情 很麻 烦 , 是 因 为转 基 因 食 品 的安 全 性 在 短 期内 得 不 到 明 确认 证 。
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
5、判断下列说法正确的是( D )
A、由两种物质生成一种物质的反应叫做化合反应 B、氧化反应是指物质跟氧气发生的化学反应 C、凡是在空气中不能燃烧的物质,在氧气中
也不能燃烧 D、蜡烛的燃烧过程既有物理变化,又有化学变化
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
2、判断下列反应是否为化合反应
硫 + 氧气 点燃 二氧化硫
锌 + 盐酸 氯化锌+氢气 石蜡 + 氧气 点燃 二氧化碳+水
镁 + 氧气
化学知识点讲解11:化合反应与氧化 反应PPT (共13 页)
反应中各元素的化合价不一定改变。 反应物不一定有单质,生成物一定是化合物。
思考讨论
石蜡与氧气的反应是化合反应吗?
石蜡+氧气 点燃 二氧化碳+水 两种产物
不是化合反应
碳 + 氧气 硫 + 氧气 磷 + 氧气
铁 + 氧气 石蜡 +氧气
点燃 二氧化碳 点燃 二氧化硫 点燃 五氧化二磷 点燃 四氧化三铁 点燃 二氧化碳+水
