醛酮alpha位氢的反应
醛酮a氢
CH3-C-H + CH2-C-H 稀碱 CH3-CH-CH-C-H β -羟基醛(仍有活泼氢)
-H2O CH3-CH=CH-CHO (α ,β 不饱和醛)
+ OH-
H3O+ + CH2CHO
O-
② CH3-CHO + CH2CHO
CH3-C-CH2CHO
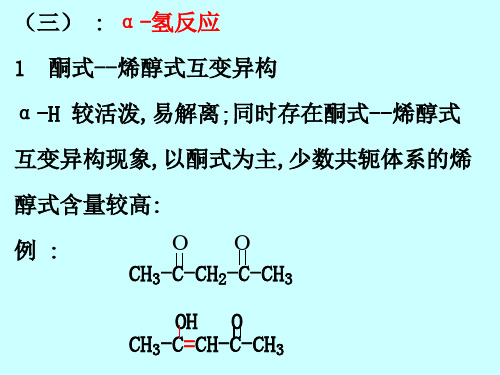
(三) : α-氢反应
1 酮式--烯醇式互变异构
α-H 较活泼,易解离;同时存在酮式--烯醇式
互变异构现象,以酮式为主,少数共轭体系的烯
醇式含量较高:
例:
OO CH3-C-CH2-C-CH3
OH O CH3-C=CH-C-CH3
2: 羟醛缩合反应 (醇醛缩合) : 增长碳链 稀碱条件
O HO
OH H O
H
O-
OH
③ CH3-C-CH2-CHO + H2O
CH3-C-CH2CHO + OH-
H
H
CH3-CH=CH-CHO
特点:① 加成形成 β -羟基醛,再缩合
②产物结构特点: 把羰基碳与另一醛酮的 α -C之间用双键相连。 ③ 醛羰基活泼,酮羰基困难,需在索氏提取器
中进行(及时移出产物) CH3
O -CHO + CH3CH2CHO NaOH H2O
O -CH=C-CHO CH3
72%
②外加法
在稀碱的无α -H 的醛溶液中,从外滴加有α -H 的醛,保持低浓度,只与大量无α -H 的醛反应.
-CHO + CH3CHO 稀 OH外加
-----克莱逊-史密特缩合
-CH=CH-CHO β -苯丙烯醛 (肉桂醛,共轭体系)
CH3COCH3 + CH3COCH3 Ba(OH)2 CH3-C-CH2CO-CH3 索氏提取器 OH
醛酮α-H反应

合成中的重 要中间物。
O –C–CH2CH2COOH
H+/H2O
齐鲁工业大学《有机化学》教学课件—第6讲 (2014.3.24-1/2)
预习主要知识点
1、醛的氧化反应(与酮比较) P345 2、还原成醇和还原成烃 P346 4、歧化反应(坎尼扎罗反应) P350 3
H+
H+
-H+
-
-
轭
H–CH2–CH=O乙醛 CH2=CH–O–H 乙烯醇 (烯醇式) (酮式)
1、酮式—烯醇式的互变异构 P338
一般结构烯醇式不稳定,特殊结构烯醇式可稳定存在。 OH CH2=C–CH3 烯醇式 1.5×10-4% H : O O O O –H O CO C O 动态平衡 O C C CH CH –CCH –CH CH –C–CH CH33–C– CH 3–C=CH 3 CH CH CH 3 3 22 3 3 酮式 24% 烯醇式 76% 即可与羰基试剂反应 如:NaHSO3、H2N–OH O H–CH2–C–CH3 酮式 ≈100%
互 变 异 构
也可与烯醇式试剂反应 如:Na、Br2、FeCl3
2、卤代反应和碘仿反应 P340 O H O X 卤代 X2 R–C—C– R–C—C– 反应 O H O X X2 R–C—C–H R–C—C–X H X
O R–C–O- + CHX3 CHCl3 CHBr3 CHI3
卤仿 反应
注意——酸碱催化条件下,反应位置、反应程度 均有差异。
(1) 醛、酮的自身缩合(以醛为例) CH3CH=O + H–CH2CH=O
HO-
△ 反应机理: 羰基组分 亚甲基组份 HO CH3CH=O + H2–CHCH=O △ CH3CH=CH–CH=O CH2CH=O + H2 O ① HO + H–CH2CH=O ,-丁烯醛 (1) 醛、酮的自身缩合 O OH (巴豆醛) HO CH RCH +H –CHCH=O ② CH CH=O + CH RCH –CH–CH=O 3CHCH 2CH=O 2CH=O 3 2CH=O (2) 二元醛、酮的缩合 2CH R R O OH △ -羟基醛 (3)苯甲醛的交叉缩合 羰基组分 亚甲基组份 - CH CHCH CH=O + HO ③ CH CHCH CH=O +H O HO 3 2 3 2 2 RCH2CH=O + H2–CCH=O RCH CH=C –CH=O 2 △ R ,-不饱和醛 R
醛、酮、羧羧酸及其衍生物的α-碳上的反应

NaOH C6H5CHO
CH3COCH3 C6H5COCH3
C6H5CH=CHCHO C6H5CH=CHCOCH3 C6H5CH=CHCOC6H5
C6H5CH=CHCOCH=CHC6H5
(2) 羧酸及其衍生物α-碳上的反应
脂肪酸α-卤化反应
• 羧酸的-H酸性比醛、酮小,故而羧酸的-H远比醛和酮的-
7.醛、酮、羧酸及其衍生物的α-碳上的反应
(1) 醛和酮α-碳上的反应 (2) 羧酸及其衍生物α-碳上的反应
(1)醛和酮α-碳上的反应
α-氢的酸性
受羰基吸电子效应的影响,其α-氢表现出一酸性。 解离出一个质子形成碳负离子。 经过共振成为烯醇负离子,得到一个质子并形成烯醇。 (1)和(4)相互转化称为互变异构。
O 2 CH3COC2H5
1. EtONa/EtOH 2. H3+O
OO CH3CCH2COC2H5
迪克曼缩合反应
分子内的酯缩合称为迪克曼(Dieckmann)缩合。这个反应特 别适合于合成五元和六元环型-酮酸酯。
CO2C2H5 1. C2H5ONa
CO2C2H5
2.H3+O
CO2C2H5 O
CO2C2H5 1. C2H5ONa
• 这个反应称为卤仿反应。
O
C
加成
R CX3
HO
O
消除
O
R C CX3 OH
C
+ CX3
R OH
(I)
(II)
O
R
C
+ O-
HCX3
酮的烷基化
-烷基化反应
在强碱作用下,一元酮所形成的碳负离子或烯醇负离子是强的亲核试剂,能够与卤代 烷发生亲核取代,生成烷基化产物
醛、酮的亲核加成反应

H
加成
OH H
-H2O
C O+ HN Y
C NY
C NY
上式也可以直接写成:
CO +H 2NY
CNY+H 2 O
反应的结果是在醛和酮与氨的衍生物分子间脱去一 分子水,生成含有C=N双键的化合物。这一反应又叫 做醛和酮与氨的衍生物的缩合反应。
H2 N OH
O+
H2 N NH2 H2 N NH
NH2 NH O2N
2-戊醇 2-戊酮 苯甲醚
卢卡斯试剂
出现混浊 X X
2,4-二 硝基苯肼
生成晶体 X
Backmann重排 酮与羟胺作用生成的酮肟在强酸作用下发生重排,生成取代的 酰胺。这种由肟变为酰胺的重排,叫贝克曼(Backmann)重排。
反应历程:
特点:(1) 在不对称的酮肟中,处于羟基反位的基 团重排到氮上;
1.与氢氰酸加成
C O + HCN
OH C
CN
α 羟基睛
在少量碱催化下,醛和脂肪族甲基酮与氢氰酸加成生成氰醇(或叫
羟基醇)。
应用范围:醛、甲基脂肪酮、C8以下环酮
H2O
(C3H)2CCN H2O/H
OH
H
练习:
CH 3 CH 3OH
C H 3
CH 2=C-CN H CH 2=C-CO3OCH
(C3H)2C C O O H
C H 3 C H O +2 C 2 H 5 O H
利用这一性质在有机合成中常用来保护羰基。
例题: HO 2 CH CHO O HOOC CHO
必须要先把醛基保护起来后再氧化。
HOC 2 H HOOC
CHOCHH 3O CH l HOC 2 H
aldol 反应机理‘

aldol 反应机理‘
Aldol反应,也称为羟醛缩合反应,是一种有机化学反应,指的是含有α-氢原子的醛或酮,在酸或碱的催化下,与另一分子醛或酮发生加成反应,生成β-羟基醛或酮,然后进一步受热失水形成α,β-不饱和醛或酮,以及其它一系列有机化合物的反应过程。
其反应机理如下:
在酸性条件下,羰基化合物(如醛或酮)会异构化成为烯醇,这种烯醇具有很强的亲核性,然后它会与另一分子羰基化合物进行加成,生成β-羟基羰基化合物。
而在碱性条件下,羰基α位氢的酸性较大,可以在碱的作用下去质子化,形成亲核性较强的烯醇负离子,然后与另一分子羰基化合物加成,同样生成β-羟基羰基化合物。
这个反应实际上是一个羰基化合物分子间的亲核加成反应,通过这种反应可以合成碳原子数比原来醛或酮增加一倍的醇或醛。
除了乙醛外,其他醛发生Aldol缩合得到的产物都不是直链的,而是原α-碳原子上带有支链的化合物。
因此,Aldol反应在有机合成中占据着重要地位,是构建β-羟基羰基化合物的一种重要方法。
以上信息仅供参考,建议查阅专业化学书籍或咨询化学专业人士获取更全面准确的信息。
醛酮反应

第12章 活泼亚甲基反应在醛、酮、羧酸及其衍生物中,与羰基相邻的α-亚甲基(1)也受羰基拉电子效应的影响,因此α-碳上的氢也表现出一定的酸性,并可离解出一个质子形成碳负离子(2)。
(2)经过共振成为烯醇负离子(3),得到一个质子形成烯醇式(4)。
(1)式和(4)式之间的互变称为烯醇互变异构。
(1)式称为酮式(keto form ),(4)式称为烯醇式(enol form )。
H+C C O-H+34(酮式)(烯醇式)醛、酮、酸酸及其衍生物的α-亚甲基上的氢受到邻位羰基的活化而呈一定的酸性,因此常称为活泼亚甲基化合物。
活泼亚甲基化合物烯醇化程度越高,α-氢酸性越大,亚甲基越活泼。
而烯醇化程度与分子结构有关,例如,丙酮在液态时含有1.5×10-4%的烯醇(pK a 20),而乙酰丙酮则由于其烯醇式可形成分子内氢键以及共轭效应,在己烷中的烯醇含量高达92%,酸性较丙酮大得多(pK a 9),与苯酚相近(pK a 9.98)。
C H 2C C O C H 3O CH 3H 3(8%) (92%)与羧酸相比(pK a 4.76),烯醇是较弱的酸。
一些活泼亚甲基化合物的酸性见表12.1。
除了含羰基化合物外,其它带有吸电子基团(如硝基、亚硝基、烷氧基等)的化合物均有不同程度的烯醇化作用。
表12.1 一些活泼亚甲基化合物的酸性 化合物 pK a 化合物pK a HCOCH 2CHO CH 3COCH 2COCH 3 RCH 2NO 2 CH 3COCH 2CO 2R NCCH 2CN 5 910 11 11CH 3SO 2CH 2SO 2CH 3EtO 2CH 2CO 2Et RCH 2CHO RCOCH 2R’ RO 2CCH 2R’ RCH 2CN 12.5 13 16 19-29 24.5 25醛、酮、羧酸及其衍生物的羰基活化α-氢的能力有以下次序: -CHO > -COCO 2R > -COPh > -COR > -CN > -COX > -CO 2R > -CO 2H 这些羰基化合物的许多重要反应与它们的α-活泼亚甲基有关。
《醛酮的a氢》课件

例如,植物中的香豆素、黄酮类 化合物等都含有醛酮的结构,通 过对其a氢的处理可以合成出这
些化合物。
醛酮的a氢在天然产物合成中的 重要性在于其能够与许多天然产 物分子发生反应,从而得到具有
生物活性的天然产物。
06
醛酮的a氢研究展望
a氢研究的发展趋势
深入探索醛酮的a氢反应机理
随着实验技术和理论计算的发展,未来将更深入地 揭示醛酮的a氢反应机理,为相关反应的设计和优化 提供理论支持。
拓展醛酮的a氢反应在合成中的应用
随着对醛酮的a氢反应的深入理解和掌握,未来将进 一步拓展其在有机合成中的应用,为药物、材料和 化合物的合成提供新的途径。
开发高效的醛酮的a氢催化剂
针对醛酮的a氢反应,未来将致力于开发更加高效、 选择性好的催化剂,以提高反应的效率和产物的纯 度。
a氢研究的挑战与机遇
01
常用的氧化剂包括氧气、过氧化氢、高锰酸钾等, 这些氧化剂可以将醛酮的a氢氧化成醇或酸。
氧化反应机理通常包括电子转移和质子转移两个步 骤,其中电子转移是决定反应速率的关键步骤。
还原反应机理
醛酮的a氢在还原反应中,通常 会与还原剂发生反应,生成相应
的烃或醇。
常用的还原剂包括氢化铝锂、硼 氢化钠等,这些还原剂可以将醛
详细描述
在还原反应中,常用的还原剂包括氢气、金属催化剂等。在反应过程中,a氢原子获得电子,转化为 负离子,进而与还原剂中的氢原子结合,形成新的烃基或烷基。这种还原反应在有机合成中具有重要 意义,可以用于制备特定结构的烃类化合物。
a氢的取代反应
总结词
醛酮的a氢原子在取代反应中可以被其他基团所取代。
详细描述
培养专业人才
随着醛酮的a氢研究的深入和 应用的拓展,未来将需要更多 的专业人才进行相关研究和工 作,这将促进该领域人才的培 养和发展。
7.醛、酮、羧羧酸及其衍生物的α-碳上的反应

羟醛缩合反应
(1)醛和酮的自身缩合 在碱存在下,醛或酮也可发生类似于酯缩合的反应,称 在碱存在下,醛或酮也可发生类似于酯缩合的反应, 为羟醛缩合( 为羟醛缩合(Aldol condensation)反应。 )反应。
O H C CH3 + OH H O C CH2 + H2O
O R HO C 加成 CX3 R O C OH CX3 消除 R O C OH + CX3 R O C O
-
+
HCX3
(I)
(II)
α-烷基化反应
酮的烷基化
在强碱作用下, 在强碱作用下,一元酮所形成的碳负离子或烯醇负离子是强的 亲核试剂,能够与卤代烷发生亲核取代, 亲核试剂,能够与卤代烷发生亲核取代,生成烷基化产物
coona2hona2h交叉的酯缩合反应两种不同的酯亦可发生缩合反应称为交叉的酯缩合反应一种酯中没有h另一种酯中含有h时它们的缩合反应还是相当有用的hcoc79酮与酯的缩合含有h的酮与酯也可发生交叉缩合反应生成酮酸酯或二酮6271chona2h43贝金反应贝金perkin反应是芳香醛与乙酸酐或取代的乙酸酐在相应的羧酸钠盐或钾盐存在下缩合生成不饱和羧酸的反应
O H C CH2 + H
O C CH3 H
O C CH2
O CH CH3
O H C CH2
O CH CH3 + H2O H
O C CH2
OH CH + OH CH3
羟醛(沸点83 C/20mmHg)在直接蒸馏时, 羟醛(沸点83oC/20mmHg)在直接蒸馏时,或在少量碘或氯化氢存 在下加热, 在下加热,可顺利失水而形成巴豆醛
醛和酮的α—H原子反应

O
H
OH H
CH3C
稀OH
H + CH2CHO
CH3
CH
CHCHO -H2O
CH3CH
CHCHO
巴豆醛
01 醛和酮的α—H原子反应
一、羟醛缩合反应
➢巴豆醛是一种重要的化工原料,可用来制备正丁醇、正丁醛等许多化工产品。常 温下为无色可燃性液体,有催泪性,因此又可用作烟道气警告剂。
01 醛和酮的α—H原子反应
O CH3CCH3 + Br2
CH3COOH 65℃
O CH3CCH2 Br + HBr
01 醛和酮的α—H原子反应
一、卤代反应
O ➢在碱催化下的卤代反应速率很快,较难控制。若醛、酮分子中含有 CH3- C-
O 结构,则甲基上的三个氢原子都能被取代,生成同碳三卤代物 CX3- C- ,碱
性条件下该产物很不稳定,容易进一步分解生成羧酸盐和三卤甲烷(卤仿)。
一、羟醛缩合反应
➢ 不同醛也可发生羟基醛缩合反应。若两种醛都含有α-H,则得到四种产物,一般 在合成中没有实用价值。但当一种醛不含α-H,而另一种醛含有α-H,如果使不含 α-H的醛过量,就能得到收率较高的单一产物。如苯甲醛和乙醛反应时,先将甲醛 与NaOH水溶液混合后,再慢慢加入乙醛,并控制在低温(0~ 6℃)反应,则生成 的主要产物为肉桂醛。
O
O
(H)R C CH3 + 3NaOX ( X2 + NaOH )
(H)R
C CX3 + 3NaOH
NaOH (H)RCOONa + CHX3
➢由于最终产物为卤仿,因此,此反应又叫卤仿反应。
01 醛和酮的α—H原子反应
一、卤代反应
8.2醛、酮的亲核加成反应.

H
加成
OH H
-H2O
C O+ HN Y
C NY
C NY
上式也可以直接写成:
CO +H 2NY
CNY+H 2 O
反应的结果是在醛和酮与氨的衍生物分子间脱去一 分子水,生成含有C=O双键的化合物。这一反应又叫 做醛和酮与氨的衍生物的缩合反应。
H2 N OH
O+
H2 N NH2 H2 N NH
NH2 NH O2N
OH R CH SO3Na NaCN
OH R CH CN Na2SO3
制取羟腈化合物的好方法,避免了用毒性很大的氢氰酸。
(1)反应范围 醛、甲基酮、七元环以下的脂环酮。 其它酮不 能反应,主要原因是空间阻碍。
例题: 2-己酮中含有少量3-己酮,试将其分离除去。
CH 3CCH 2CH 2CH 2CH 3 O
2-戊醇 2-戊酮 苯甲醚
卢卡斯试剂
出现混浊 X X
2,4-二 硝基苯肼
生成晶体 X
Backmann重排 酮与羟胺作用生成的酮肟在强酸作用下发生重排,生成取代的 酰胺。这种由肟变为酰胺的重排,叫贝克曼(Backmann)重排。
反应历程:
特点:(1) 在不对称的酮肟中,处于羟基反位的基 团重排到氮上;
OH
C
NH4Cl,H2O
C
例题:
选用适当的原料合成化合物 CH3CHC2C HH2OH
CH3
合成路线分析(1)合成产物为伯醇,因此应选 用甲醛和相应的格氏试剂来制取。
(2)把将要合成的化合物拆分成两个结构单元。
CH3CHCH2 CH3
CH2OH
(3)写出合成路线。
H C H O+C H 3C H C H 2M gB r 干 醚 C H 3
有机化学:第九章 醛和酮 亲核加成反应

H CO OH
干HCl
H 环状半缩醛(稳定)
OH O
在糖类化合物中多见
加硫醇(RSH) S 的亲核能力比 O 强,故硫醇与羰基的加成比醇
容易。
R
HS
C O+
H+ R
S
C
R’
HS
R’
S
缩硫酮
酮由于空间因素的影响,在相同的条件下一般得不到缩 酮,因为平衡大大偏向酮的方向。在同样条件下不能形成 缩酮,若使用特殊装置或特殊试剂,也可制取缩酮。
C=CH2 CH3 4-甲基-3-丙基- 4-戊烯-2-酮
O
CH3
CH3-CH2-C-CH2-CH-CHO
2-甲基-4-羰基己醛
2-甲基-4-氧代己醛
芳香醛酮命名时,将芳环当作取代基:
CHO OH
邻-羟基苯甲醛(水杨醛)
CH3—
—C—CH3 O
对-甲基苯乙酮
二、物理性质(自学)
三、化学反应 醛、酮分子中都含有活泼的羰基,可以发生多种
第九章 醛和酮 亲核加成反应
第九章 醛和酮 亲核加成反应
羰基: C O
羰基碳与一个烃基和一个氢相连的化合物 称为醛,(甲醛中的羰基碳与两个氢相连), 羰基碳与两个烃基相连的化合物称为酮。
O
(H)R—C—H 醛 简写: R CHO
O
R—C—R’ 酮
一、结构和命名 (一)结构
O
121pm
121.7o C
CH3—C=O + HCN 77-78% CH3 —C—CN
CH3
OH
(CH3 )2CH-CO2H (CH3 )2CH-CH2NH2
OH
OH
碱对醛、酮与氢氰酸的加成反应有很大的影响。
第四节 羰基化合物的卤取代反应3版
R' H
NaH
O OR OR
O
ORO
Cu X Cu X
X
X
2CuX2
COOR
R'
O
OR R'
X COOR
2、羧酸的α-卤取代反应
α-氢原子活性小 先成酰卤后卤代
试剂 X2/Cat.PCl3
O
α H9C4
OH
Br2/cat.PCl3
O
H9C4
OH
Br
不饱和烃的卤加成、烃类、羰基化合物卤取代反应学习要求
1)Me 3SiCl/Et3N
Br α
2)Br2/CCl4/r.t
CO2Et α
制备α-氟代醛
F
Ph
O SiMe3
F2/CFCl3
O
Ph
- 78℃
H
3.烯胺的卤化反应
O
O CH3
SO2Cl2/CCl4
CH3 Cl
83~85%
r.t.,2h
N
1.Cl3CCOCCl3/THF/-78。
CH3 2. HCl/H2O
n-Bu
+ O SiMe3
n-Bu
CH2
H
O SiMe3
n-Bu
+ CH3 H
CH3 O SiMe3
动力学控制
84%
58%
热力学控制
不同烯醇硅烷基醚异构体的制备和分离较简便
② α-卤代醛制备
α-溴代酮的制备(低温下溴化Br2/Et2O)
不影响双键 不发生酯羰基的α位卤代
OHC α
CO2Et
OHC
α
B:
烯醇式
BH 慢
CC OH
第22讲——醛酮α-H的反应

C2H5 1,2-加成产物
C2H5
O
–CH–CH2–C–R
1,4-加成产物
164ch环己酮的自身缩合亚甲基组份羰基组分3甲基2环戊烯酮3甲基2环己烯酮醛酮的交叉缩合脂肪族醛酮的交叉缩合hchcho两分子均含h的脂肪族醛酮不含h羰基组分含有h亚甲基组分一分子不含h和一分子含h的脂肪族醛酮chchoho四种产物的混合物在合成上没有实用价值
教学 要点
1、酮式和烯醇式的互变异构 2、卤代和卤仿反应 3、羟醛缩合 4、,-不饱和醛酮的加成反应
O
O
CH3–C–CHO2–CH2–CHO2–C–CH3
HO△
O O
2,6-庚二酮 O
COH3–CCH=O33-甲+ H基2-–2C-环H–己C烯–C酮H3
HO△
OO
O
CH3–C–CH2–CH2–CH2–CH2–C–CH3
HO△
2,7-辛二酮
O C–CH3
(3) 醛、酮的交叉缩合
①脂肪族醛酮的交叉缩合
CH2–CH=C–R(烯醇式)
影响,-不饱和醛酮1,2-和1,4-亲核加成的因素 ——羰基端基团、烯基端基团、试剂的体积
–R
H
Me
Et
1,4-(%) 0
60
71
越大越不利于1,4-加成
1,4-加成 O
–CH=CH–C–R ① C2H5MgX
② H2O
1,2-加成
越大越不利于1,2-加成
i-Pr t-Bu 100 100
–CHO
O
+CH3–C–CH2CH3
HO-
O –CH=C–C–CH3
CH3
双键连烃基较 O
实验醛酮化学性质

生成羟基磺酸钠而白色结晶析出。
HC (H 3) R CO+N a H S O 3
H C (H 3) R CO H羟 基 磺 酸 钠
S O 3 N a
试样:苯甲醛、乙醛、丙酮、3-戊酮
二 、α-H的反应 醛酮α-碳原子上的氢原子受羰基的影响变得活泼。能与碘的氢氧化钠发生碘仿反应。利
用此反应可以鉴别乙醛、甲基酮和某些醇。
一个方案,将它们的标签一一贴上。
谢谢观赏
脂肪醛可以使铜离子还原成红色的氧化亚铜,芳香族醛和酮不能。
酒石酸盐 试样:甲醛、乙醛、丙酮、苯甲醛
斐林试剂如果加热时间长了会产生砖红 色的氧化亚铜沉淀,不要误认为芳香醛、 酮也与之发生了反应
三、醛酮的鉴别 5.铬酸实验 铬酸试剂可在5S内将一级和二级醇或脂肪族醛氧化,自身还原为铬(III),发生橙黄色至
蓝绿色的颜色变化。芳香族醛30-60S,三级醇和酮数分钟内没有明显变化。
试样:丁醛、苯甲醛、环己酮、乙醇、异丙醇、叔丁醇
【实验指导及操作步骤】 4.斐林反应 斐林试剂A、B
斐林试剂如果加热时间长了会产生砖红 色的氧化亚铜沉淀,不要误认为芳香醛、 酮也与之发生了反应
斐林试剂A、B
甲醛
乙醛
丙酮
苯甲醛
80℃ ,2-3 分钟
实验:醛酮化学性质
醛和酮的化学性质
α-氢的反应: 烯醇化,卤代,羟醛缩合;
δ-
O
C C R (H )
δ+
H
醛的氧化。
亲核加成,氢化,还原;
一、亲核加成反应 1. 与氨的衍生物的加成
试样:甲醛、乙醛、丙酮、苯甲醛、二苯甲酮
一、亲核加成反应 2. 与NaHSO3溶液加成
醛、位阻较小的甲基酮、环酮(C8以下)
13.3.3 醛酮的alpha–卤代反应

13.3.3 醛酮的alpha–卤代反应在酸或碱催化下,醛、酮α–H 被卤素原子取代,生成卤代醛(酮):一、α–卤代及卤仿反应(Haloform reaction )1. 碱催化:在碱性条件下与卤素反应CH 3C R O+ Cl 2NaOHCH2C R O Cl反应机理:OH H CH 2C ROH 2O +CH 2C R OC RCH 2O 烯醇负离子Cl Cl δ−δ+CH 2CR OCl + ClC RCH O+ 碱须过量,原因:催化;中和反应中不断生成的酸。
由于氯原子的吸电子性,氯代醛(酮)上剩下的α–H酸性更强,更易被氯代,因此,对于甲基酮或乙醛,最后会生成α–三氯代产物。
CH3C RO+ Cl2NaOH CH2C ROClCCl3C RO由于三个卤原子的强吸电子效应,α–三卤代的甲基酮或乙醛分子中羰基C=O 碳原子的正电性更强,在碱性条件下更容易被OH –进攻从而导致C–C 键断裂,生成三卤甲烷(又称卤仿)和羧酸盐。
OH3CC ROC R OHX 3CRC OH O+ CX 3RCOO + CHX 3强酸强碱卤仿羧酸盐加成消除氧负离子中间体Cl2、Br2和I2都可发生相似的反应,分别生成氯仿(CHCl3,chloroform)、溴仿(CHBr3,bromoform)和碘仿(CHI3,iodoform)。
碘仿CHI3为不溶于NaOH溶液的黄色沉淀,所以在实验室中常用碘仿反应来鉴别甲基酮和乙醛(氯仿、溴仿为无色液体,不易鉴别)。
注意:a)醛(酮)只要有α–H 就能发生α–卤代,碱性条件下卤素原子会取代所有的α–H 。
但如果不是甲基酮,则不会发生α–C 与C=O 之间C–C 键的断裂,因而不会发生卤仿反应。
原因:2个(或1个)卤原子的吸电性不够强。
CH 3CH 2CC(CH 3)3O+ X 2OHCH 3CX 2CC(CH 3)3OOH不再进一步反应b)卤仿反应可用来合成比甲基酮少一个C 原子的羧酸——酮的氧化。
《有机化学》 醛酮的Alfa位反应

H3C
CO H3C
+ K+H-
H2C C O-K+ CH3
+ H2
enolate
E. Regioselective Formation of Enolate Anions
?
?
Kinetic enolate
Thermodynamic enolate
Generally: 1. Low temperature gives the kinetic enolate. 2. High temperature, relatively weak base in a protic solvent gives the thermodynamic enolate.
Reactions at the -Carbon of Aldehyde & Ketone
Reactions at the -Carbon of Carbonyl Compounds
Acidity of the -hydrogens Keto-Enol tautomerization Applications
Acidity of the -hydrogens
C OC
C OC
O
RCC C
HH
Hydrogens are unusually acidic
(pKa=19-20)
Hydrogens are not acidic (pKa=40-50)
C2H6 C2H4 NH3 C2H2 CH3COCH3 C2H5OH H2O Ph-OH
C
C
H3C
C
CH3
H2
24%
H
O
O
C
C
阿尔法效应

阿尔法效应阿尔法效应(Alpha Effect)是一个物理术语,指的是在某些分子化合物中,去掉一个氢离子后,其余原子的极性会增强,会对相邻羰基、芳香环等团进行引导作用,使它们更容易被反应。
阿尔法效应是有机化学的一个重要现象,与一些反应的速率以及结果有关。
阿尔法效应的具体机理可以理解为去掉一个氢离子后,对应分子的共振结构发生变化。
例如,对于一般的酮或醛分子,其共振结构包含了两种不同的极性结构——羰基式和烯醇式。
当去掉羰基或醛分子上的一个氢离子,原子中发生了一个正电荷的改变。
因此,此时这个羰基受到的引力就会变得更大,更容易开始反应。
这个引导作用也被称为亲核取向性(nucleophile directing),因为反应过程中会发生亲核进攻,这个作用可以帮助亲核物质找到正确的位置。
阿尔法效应有很多重要的应用,比如Michael反应(Michael Addition)——该反应指的是一个带有双碳键的互变反应,其中酰乙酸或酮作为亲电反应物,通过亲核加成的方式被芳环或烯醚等物质的亲核物质攻击。
此时,如若反应物旁边有其他基团,这些基团也会影响反应物的亲电性和被攻击性,从而导致反应过程。
另一个具有重要意义的应用就是尿素催化的Diels-Alder加成。
Diels-Alder反应是一个经典的加成反应,用于生长有效率高的化学合成等领域,其中尿素通常被使用于催化反应的过程,从而提高反应速率,特别是那些需要产生高度极性分子的反应。
不仅如此,阿尔法效应在放射性元素核分裂过程中也是很重要的。
放射性元素分子被反应一道时就会引发α粒子射出,这种情况常常发生在重元素核反应堆中。
阿尔法粒子是与质子和中子不同的基本粒子,例如碳-14放射性同位素,将经过“算筹芝村”反应与热中子相遇,从而产生一个氮-14和一个阿尔法粒子的放射性同位素。
总之,阿尔法效应在化学、核物理以及其他物理领域都是非常重要的。
人们通过研究阿尔法效应的机理可以更好地理解物质的结构以及反应,开发新的催化剂以及新化合物,这样我们才可以更好地利用化学对大自然进行更深入的探究,也能够在生产或其他领域中提供更好的应用价值。
11-2 醛酮的α-取代反应王俊儒

R(H)
α-C α-H
二、醛酮α-H的酸性与互变异构
α-氢的酸性
O
O
CC
CC
H
O CC
烯醇式
pKa ~20
+H
α-氢周围 (包括羰基) 的吸电子能 力越强,酸 性越强
二、醛酮α-H的酸性与互变异构
α-氢的酸性
二、醛酮α-H的酸性与互变异构
α-氢的酸性
练习:α-氢酸性强弱比较
答案:a>c>b
CH3 C αCH2 + H
Oα BH + CH3CCH2
Oα CH3C CH2
三、醛酮的α-取代反应
碱催化下的α-卤代
CH3
O C
H(R') I2/OH-
或 NaIO
CI3
O C
OH-
H(R')
O CHI3 + (R')HC O-
黄↓
三、醛酮的α-取代反应
卤仿(碘仿)反应:
CH3CHO OH-/I2
OH-/I2 OH-/I2
OH-/I2
ICH2CHO I2CHCHO
应用:可用于鉴定乙醛和 甲基酮以及能被氧化成
I3CCHO
上述化合物的醇。
CHI3+ HCOOH
规律: 乙醛,甲基酮,乙醇,异丙醇均可;CH3COR(H); CH3COHR(H); CH3COOH能否反应生成碘仿?
三、醛酮的α-取代反应
小结
α-H的酸性
α-取代反应
酮式和烯醇式的互变异构 α-负C的烷基化
谢 谢!
O
OO CH3CCH2COC2H5
OO CCH2COC2H5 OO CH3CCH2CCH3
02-醛酮的α-氢原子的活泼性课件

-
CH2–CH=CH2
-
CH2–CH=O
从电子效应 分析:
C=O吸电
作用大于
C=CH2
p-共轭
从中间体稳定性分析: O容纳负电荷的能力大于C
-
CH碳2–负CH离=子CH2
-
CH碳2负–C离H子=CH2
-
CH2–CH=O 碳负离子
-
CH2=CH–O 烯醇负离子
-
CH2离—域CH式—CH2
-
CH离2—域C式H—O
4-甲基CH-33-戊烯-2-酮
二元醛酮发生分子内羟醛缩合,生成稳定的5、6元环
O
O
CH3–C–CH2–CH2–C–CH3
O
O
O
• 两种不同的含有氢原子的羰基化合物之间进行羟醛缩合反应 (称为交叉羟醛缩合);若参加反应的一种化合物不含-H原 子,羟醛缩合产物只有一种。
(甲醛、苯甲醛、三甲基乙醛、糠醛等)
+ Na、Br2、FeCl3
(2)羟醛缩合反应
•在稀碱存在下,两分子醛可以相互作用,生成-羟基醛,叫 羟醛缩合反应。
-
HO-
CH3CH=O + H–CH2CH=O
羰基组分 亚甲基组份
OH CH3CH–CH2 CH=O
-羟基丁醛
羟醛缩合反应历程
第一步:在碱作用下,生成烯醇负离子
Oδ
HO + CH3CHO
-羟基丁醛
△
CH3CH=CHCH=O ,-丁烯醛
• 凡碳上有氢原子的-羟基醛都容易失去一分子水,生成 ——烯醛。
酮的自身缩合——羟酮缩合(比醛难)
O
CH3–C=O + H–CH2–C–CH3
CH3 OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(查尔酮)
分子内羟醛缩合反 应
* 分子内羟醛缩合可以用于制备五、六元环酮化合物。
* 分子内缩合反应机理:
醛、酮缩合反应的区域选择性
动力学控制的反应
热力学控制的反应
醛、酮缩合的区域选择性
弱碱促进的 热力学控制 反应
强碱促进的 动力学控制 反应
羟醛缩合反应 VS 羰基-烷基化
* 羟醛缩合需要催化量的碱; * 烷基化需要化学计量的碱使底物全部变成烯醇离子后,再加入卤代烃。
胺催化的醛酮-位的反应
Hajos-Parrish-Eder-Sauer-Wiechert 反应
课间提问(多选题)
下列化合物中,可以通过羟醛缩合反应来制备的是( )。
醛酮 -位氢的反应
主讲人 钟芳锐 华中科技大学化学与化工学院
主讲内容
• 醛、酮-位氢的酸性 • 醛、酮的-位烃基化和酰基化 • 醛、酮的羟醛缩合
醛、酮的-位氢的酸性Fra bibliotek醛、酮的-氢的酸性
丙酮
乙烷
* 诱导效应 * 超共轭效应
醛、酮的烯醇化反应
酸性条件 的烯醇化
碱性条件 的烯醇化
酮的-位烃基化、酰基化
羟醛缩合反应
* 烯醇负离子对羰基亲核加成生成羟醛类化合物,称为羟醛缩合反应。
* 交叉羟醛缩合的产物较复杂,至少有四种,无合成价值。
交叉羟醛缩合反应
* Claisen-Schmidt缩合反应
肉桂醛
* 无α-氢的醛和有α-氢的醛的反应,可以得到单一的产物,具有合成价值。
酮的羟醛缩合反应
* 由于电子和位阻效应,酮自身缩合较慢,常用于和醛进行交错 缩合,产生单一的产物,也具有合成价值。
