黄瓜花叶病毒荧光定量+PCR+检测方法的建立
应用MNP—RT—PCR方法检测黄瓜绿斑驳花叶病毒

(B in nr— i Iset n a d Q a nie B ra , B in 0 0 6 C ia e ig E t e t np c o n ur t ueu e ig 10 2 , hn ; j y x i a n j
Kn nigB oehC . Ld , e ig1 08 , h a igan it o , t. B in 0 0 1 C i ) c j n
W nc n E ng DENG n la g Co g—i n ,JANG ig。 W AN G a — hu ,NI Le 。 LI I M n N A
, ,
G n— a ,YA G a x a Xi mio N Xio— i 。
,
GAO e — a , L W nn U Yu fn — g e
we e c n e tae y M N P,v r lRN As we e r la e n r ee t d b r o c nrtd b ia r e e s d a d we e d t ce y RT— PCR . CGM M V o d b — c ul e de tc e n a e s a 0 n tr l n la ae a s Com p r d wih n r a e td i sls s1 g wa e me o e f m t r l . i a e t o m lRT— CR ,t e m eho e r a e P h t d d ce sd t e i h b t r fp a tm ae i la d se ore ta tn h n i io so l n tra n tpsf x r ci g RNA ,a d a s n r a e e s n i v t fRT— CR e n lo i c e s d t e st iy o h i P d—
实时荧光RT_PCR方法检测黄瓜绿斑驳花叶病毒_邓丛良

基金项目 :本研究受 “十一五”支撑项目 (2006BAK10B06), 国家质检总局课题 (2008IK248)资助 。 收稿日期 :2009 -01 -23修回日期 :2009 -03 -28
— 29 —
2009 年第 4期
植物检疫 PLANTQUARANTINE
Vol.23 No.4
有限公司合成 。 普通 RT-PCR检测引物序列如下 : 上游引物 CGMMVcp-d-f:5'- GTTTAGT-
Abstract ApairofprimersandaTaqManprobeweredesignedbasedontheconservednucleotidesequenceof
coatprotein(CP)geneofknownCucumbergreenmottlemosaicvirus(CGMMV)isolates.Therealtimefluores-
本研究结合黄瓜绿斑驳花叶病毒检疫工作的
需要 , 建立了该病毒实时荧光 RT-PCR检测方法 , 检测结果表明 , 该 方法具有如下优 点 :(1)特异性 强 , 只对黄瓜绿斑驳花叶病毒有特异性反应 , 与其 它 4种植物病毒均无反应 ;(2)灵敏性高 , 能检测到 100pg总 RNA, 比普通的 RT-PCR琼脂糖 凝胶电 泳观察灵敏度高 10倍 ;(3)可对病毒浓度进行粗略 定量 。从图 4中可以看出 , 荧光信号与模板的浓度 呈正相关 , 模板浓度越高 , 可检测到荧光信号所进 行的 PCR循环次数越少 , 当样品中不含病 毒的时 候 , PCR循环次数达到最大值 (40个循环 );(4)完 全闭管检测 , PCR产物不需 电泳和 EB染色 观察 , 减少了有毒物质的使用 , 缩短了检测时间 , 保护了 生态环境 。
南瓜种子中黄瓜绿斑驳花叶病毒IC-RT—PCR检测方法的建立

作者: 黄静[1];廖富荣[2];林石明[2];陈青[2]
作者机构: [1]漳州职业技术学院食品系,福建漳州363000;[2]厦门出入境检验检疫局,福建厦门361012
出版物刊名: 漳州职业技术学院学报
页码: 12-15页
主题词: 南瓜种子;黄瓜绿斑驳花叶病毒;免疫捕获RT—PCR;CP基因;序列分析
摘要:黄瓜绿斑驳花叶病毒(Cucumber green mottle mosaic virus,CGMMV)是葫芦科重要种传病毒之一。
本文建立了免疫捕获RT—PCR(IC—RT—PCR)的分子检测方法直接从带毒种子中检测出该病毒,扩增获得其CP基因,并克隆到pMD18-T载体中,经核苷酸序列分析表明,该分离物CP基因全长为486个核苷酸,编码由161个氨基酸组成的17.3kDa蛋白,与国内外已报道的CGMMV的CP基因相比,其核苷酸序列的同源性为91.4%~99.4%,其推导的氨基酸同源性为98.8%~100%。
IC-RT—PCR方法的建立,为检疫部门提供了从带毒种子中快速、准确检测该病毒的方法,很有应用前景。
黄瓜花叶病毒荧光定量 PCR 检测方法的建立

黄瓜花叶病毒荧光定量 PCR 检测方法的建立孙洁;王婉;周翎;阮小蕾;饶雪琴;李华平【摘要】[Objective] To develop a real-time quantitative PCR method with TaqMan probes to quantify Cucumber mosaic virus (CMV) inbanana.[Method] The primers and probes were designed based on the conserved coat protein ( CP) sequences of CMV and were applied to real-time PCR assays .The reaction system was optimized ,and its sensitivity , specificity and repeatability were evaluated .[Result and conclu-sion]The detection sensitivity of the real-time PCR assay was 4.2 ×102μL-1 , which was 100 times more sensitive than PCR.The specifity of the assay was analyzed with Banana bunchy top virus (BBTV) and Banana streak virus( BSV) , and no cross reaction were observed .The assay also had good repetitions . The real-time PCR assay was evaluated with field samples .5 of the 14 tissue samples collected from field suspected CMV infected bananas were positive , which further confirmed that the real-time PCR method should be suitable for detection and quantitation of CMV in banana .%[目的]建立检测香蕉中黄瓜花叶病毒Cucumber mosaic virus( CMV)的实时荧光定量方法.[方法]根据CMV外壳蛋白( CP)保守序列设计了TaqMan实时荧光定量PCR特异性探针及引物,优化反应体系检测TaqMan探针实时荧光定量方法的灵敏度、特异性和重复性.[结果和结论]该方法检测灵敏度为4.2×102μL-1,比普通PCR高100倍,且与香蕉束顶病毒Banana bunchy top virus(BBTV)、香蕉线条病毒Banana streak virus(BSV)无交叉反应,特异性和重复性都较好.用实时荧光定量PCR检测14份田间香蕉样品有5份样品为阳性,进一步证明建立的实时荧光定量方法可用于香蕉CMV的检测.【期刊名称】《华南农业大学学报》【年(卷),期】2014(000)002【总页数】4页(P53-56)【关键词】黄瓜花叶病毒;TaqMan探针;荧光定量PCR检测方法【作者】孙洁;王婉;周翎;阮小蕾;饶雪琴;李华平【作者单位】华南农业大学资源环境学院,广东广州510642;华南农业大学资源环境学院,广东广州510642;华南农业大学资源环境学院,广东广州510642;华南农业大学资源环境学院,广东广州510642;华南农业大学资源环境学院,广东广州510642;华南农业大学资源环境学院,广东广州510642【正文语种】中文【中图分类】S436.421香蕉广泛种植于热带亚热带地区,在进出口贸易中占有很重要的位置.植物病毒病是影响香蕉繁殖和种质资源交流的重要因素,在世界很多香蕉种植区均有报道黄瓜花叶病毒Cucumber mosaic virus(CMV)引起的香蕉花叶心腐病对香蕉生产造成重大损失[1- 2].在黄瓜花叶病毒侵染的叶片上,特别是嫩叶,出现黄绿相间的花叶状条纹或褪绿的梭状斑,叶缘有轻微卷曲[3].CMV属于雀麦花叶病毒科Bromoviridae黄瓜花叶病毒属Cucumovirus,是典型的三分体单链正义RNA病毒.研究[4- 6]发现CMV外壳蛋白(Coat protein,CP)与病毒粒子组装和蚜虫传播相关;CP序列的遗传多样性分析表明CMV主要有2个亚组.目前对CMV尚未形成一套安全、高效、稳定的病毒防控技术,因此有必要对此进行研究.香蕉中CMV的检测方法主要有ELISA、斑点杂交法、RT-PCR、免疫捕获RT-PCR[7-10]、核酸分子杂交[11]、基因芯片技术[12]及RT-LAMP[13]等,这些方法在检测速度、灵敏度及特异性等方面有一定的局限性.目前,基于PCR、荧光标记和激光技术[14]的定量PCR,灵敏度高、特异性强、重复性好,在植物病毒检测中已得到广泛的运用[15-17].利用荧光定量方法检测花卉、桃蚜中的CMV虽有报道[18-19],但香蕉中CMV的荧光定量检测方法鲜见报道.本研究根据CMV CP 基因保守序列设计了荧光定量PCR特异性探针及引物,建立了香蕉中CMV的荧光定量PCR检测方法.1.1 样品、仪器与试剂感染CMV、BSV、BBTV的香蕉植株采自华南农业大学农场和云南省保山市.Ex Taq DNA聚合酶、dNTPs、pMD18-T载体、质粒纯化试剂盒、PrimeScriptTM RT Master Mix(Perfect Real Time)、Premix Ex TaqTM、实时荧光定量PCR仪(Thermal Cycler Dice)均购于TaRaKa公司.大肠埃希菌JM109由华南农业大学植物病毒室提供.核酸蛋白分析仪(Nanophotometer,产自IMPLEN).1.2 试验方法1.2.1 引物与探针的设计根据GenBank上已登录的CMV CP基因序列(登录号:AY965892.1)设计引物和探针,MF1:5′-CGATAAGAAGCTTGTTTCGCG-3′,CMV-R:5′-CGGCGTACTTTCTCATGTCAC-3′,探针P:5′-ROX-CGTTACCGCCATCTCTGCTATGTTCGCBH-Q2-3′,引物和探针均由TaRaKa公司合成.1.2.2 模板RNA的提取及cDNA的制备按照王玉成等[20]方法进行RNA抽提,放于-20℃保存.根据PrimeScriptTM RT Master Mix(Perfect Real Time)说明进行RNA的反转录以合成cDNA.反应体系:5×PrimeScript RT Master Mix 2 μL,RNA 2 μL,RNase-free ddH2O 6 μL.反应条件为:37 ℃ 15 min,85 ℃ 5 s.1.2.3 质粒标准品的制备以抽提出的RNA为模板进行RT-PCR,反应体系为:PrimeScript 1 step Enzyme Mix 1 μL,2× step Buffer 12.5 μL ,MF1、CMV-R各1 μL(10 μmol·L-1),加RNase-free ddH2O至25 μL.反应条件为:50 ℃30 min;95 ℃ 5 min,95 ℃ 30 s,59 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃延伸10 min.反应得到目的大小片段后,用切胶回收试剂盒回收PCR产物.依试剂盒说明说将目的片段连接至pMD18-T载体,并转化至JM109感受态细胞中.涂板,挑出白色菌落进行摇菌,用质粒抽提试剂盒抽提质粒,并测序.经鉴定正确的作为阳性质粒,用核酸蛋白仪测定其质量浓度,然后计算拷贝数:拷贝数=[6.02×1023×ρ]÷[碱基数×660×10-3].经计算本试验所得质粒DNA拷贝数为4.2×1010 μL-1,以10倍梯度稀释,作为绝对定量的标准品.病毒拷贝数的计算:将未知样品的Ct值代入所得标准曲线中,即可得到未知样品的病毒拷贝数.其中,Ct值是指每个反应管内的荧光信号到达设定的阈值时所经历的循环数.1.2.4 荧光定量 PCR反应条件的优化与标准曲线的制作以制备的标准品为模板,对实时荧光定量的引物与探针的浓度及退火温度进行优化,确立最佳反应体系.25 μL反应体系:Real-time 2×Taq 12.5 μL,MF1、CMV-R各1 μL(10 μmol·L-1),P(10 μmol·L-1)0.5 μL,模板2 μL,加灭菌的ddH2O 25 μL.最佳反应条件为:95 ℃ 10 s;95 ℃ 5 s,59 ℃ 30 s,72 ℃ 30 s,40个循环.以10倍梯度稀释的标准品为模板,建立25 μL PCR反应体系,根据优化的反应条件,荧光定量PCR仪扩增.反应结束后,仪器自动生成标准曲线.1.2.5 荧光定量 PCR灵敏性、特异性和重复性试验以制备的CMV标准品按10倍梯度稀释为模板,进行荧光定量 PCR和普通PCR试验,根据各模板的Ct值确定检测下限.以4.2×107 μL-1为模板,重复7次,进行统计分析,根据变异系数确定该体系的可重复性.以感染BBTV、BSV的香蕉植株DNA,及CMV的cDNA为模板,进行荧光定量 PCR,进行荧光定量特异性试验.PCR体系:Taq酶0.2 μL,MF1、CMV-R各1 μL(10 μmol·L-1),10×Buffer 2.5 μL,dNTPs(2.5 mmol·L-1)2.0 μL,模板1 μL,加灭菌的ddH2O至25 μL.反应条件:95 ℃ 5 min;95 ℃ 30 s,59 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃延伸10 min.1.2.6 荧光定量 PCR的实际应用采集不同香蕉植株叶片抽提的RNA反转录的cDNA为模板,进行荧光定量 PCR.此外,还抽提了同一感染CMV的香蕉植株不同部位的RNA,包括只有叶片和含叶脉的叶片,各0.1 g,以确定植株的不同部位的病毒含量是否存在差异.2.1 质粒标准品的制备以抽提的香蕉RNA为模板,应用MF1、CMV-R进行RT-PCR,获得了与目的片段大小一致的扩增产物,经测序比对,与GenBank中的CMV序列具有高度相似性,表明已成功构建了CMV重组质粒标准品.2.2 标准曲线的构建以梯度稀释的CMV质粒DNA为模板,进行荧光定量 PCR,得到CMV的标准曲线(图1).标准品模板拷贝数在4.2×102~4.2×107 μL-1范围内,与Ct值呈现良好的线性关系(本试验中Ct值>35视为阴性).2.3 荧光定量PCR的特异性以感染BBTV 、BSV的香蕉植株DNA及CMV的cDNA进行荧光定量 PCR,除CMV的cDNA之外,其他均为阴性,表明该方法具有良好的特异性(图2).2.4 荧光定量 PCR重复性和灵敏性检测重复扩增试验所得Ct值(17.84~19.06)的变异系数小于1.04%,表明本试验建立的荧光定量 PCR检测方法重复性好.以梯度稀释的标准品为模板,进行荧光定量 PCR和普通PCR,结果表明,荧光定量 PCR检测标准品的灵敏度为4.2×102 μL-1(Ct值为33.37),普通PCR检测的灵敏度为4.2×104 μL-1(图3a).对感染CMV的香蕉叶片进行RNA抽提,反转录成cDNA后,进行稀释,分别以稀释后的cDNA为模板进行荧光定量 PCR和普通PCR,结果表明,荧光定量 PCR检测cDNA的灵敏度为104(Ct值为33.25),普通PCR检测cDNA的灵敏度为103(图3b).2.5 荧光定量 PCR的应用采集田间香蕉样品共14份,抽提RNA,反转录成cDNA后进行荧光定量 PCR,结果显示,5份样品与阳性对照一样有明显的扩增曲线,且Ct值为19.85~25.62,其余样品同阴性对照相同,无扩增曲线.用荧光定量 PCR检测感病香蕉植株不同部位的CMV,结果表明,0.1 g香蕉叶片中约含有5.14×107个病毒拷贝,0.1 g叶片与叶脉混合物中约含有1.1×108个病毒拷贝.由试验结果可知相同质量的香蕉组织,叶脉和叶片混合样中CMV含量高于叶片.本研究根据CMV的CP基因的保守序列设计了荧光定量PCR的探针及引物,保证了所扩增基因的特异性,且所建立的CMV荧光定量PCR检测方法具有重复性和可靠性.然而荧光定量PCR在检测过程中,相同模板不同重复间Ct值常存在差异,这可能是由于加样时人为误差造成的,或是PCR仪的边缘效应造成的[21].王芳等[22]建立的烟草CMV的SYBR荧光定量检测法,未对其重复性、灵敏度及特异性进行探讨.有研究[23]表明,TaqMan探针法比SYBR染料法特异性更强,灵敏度更高.在灵敏度比较试验中,笔者分别以CMV质粒DNA及cDNA为模板进行荧光定量PCR与普通PCR,以质粒DNA为模板时,荧光定量PCR灵敏度是普通PCR的100倍,而以cDNA为模板时,其灵敏度是普通PCR的10倍.不同模板间灵敏度的差异可能是由于质粒DNA经过处理后纯度较cDNA高,而cDNA中所含的反转录酶、酚等可能影响了PCR扩增的原因[24- 25]. 在同一香蕉植株中,叶脉与叶片混合物中CMV病毒含量高于叶片,可能与CMV在香蕉中的运输特性相关[26],这将为田间香蕉样品的采样提供一定的依据.本研究建立的TaqMan 荧光定量PCR检测方法,可检测香蕉中CMV并可对其进行绝对定量,也可用于研究CMV在植株体内的运动、抗病种质资源的筛选、寄主-病毒-介体间相互作用等.【相关文献】[1] HOOKS C R R, WRIGHT M G, KABASAWA D S, et al. Effect of banana bunchy top virus infection on morphology and growth characteristics of banana[J]. Ann Appl Biol, 2008,153(1): 1-9.[2] JERIDI M, ESCOUTE J, FONDI E, et al. Homoeologous chromosome pairing between theA andB genomes of Musa spp. revealed by genomic in situ hybridization[J]. Ann Bot, 2011, 108(5): 975-981.[3] AYO-JOHN E I, EKPO E J A, ODEDARA O O, et al. Virus symptom expressions on Musa landraces in 1999, 2000 and 2004 in Southern Nigeria: Cucumber mosaic virus (CMV) disease incidence and subgroup differentiation[J]. Arch Phytopathol Plant Protect, 2011,44(6): 547-557.[4] JACQUEMOND M. Cucumber mosaic virus: Vol.84[M]. Montfavet: Adv Virus Res,2012: 439-504.[5] ROOSSINCK M J. Cucumber mosaic virus, a model for RNA virus evolution[J]. Mol Plant Pathol, 2001, 2(2): 59- 63.[6] 王达新,郭刚,殷晓敏, 等. 黄瓜花叶病毒研究进展[J]. 现代农业科技, 2013(3): 121-123.[7] 黄孟群,廖志松. 检测香蕉花叶心腐病病原CMV的PAS-ELISA方法的改进[J]. 生物工程学报, 1996,12(3): 335-339.[8] HU Jinsheng,LI Huaping, BARRYK,et al. Comparison of dot blot, ELISA, and RT-PCR assays for detection of two Cucumber mosaic virus isolates infecting banana in Hawaii[J].Plant Dis,1995, 79(9): 902-906.[9] 刘志昕,潘俊松,郑学勤. 香蕉花叶心腐病的血清学诊断及检测方法的建立[J]. 热带作物学报, 1994(S1): 19- 26.[10]金羽,文景芝. 植物病毒检测方法研究进展[J]. 黑龙江农业科学, 2005(3): 37- 40.[11]覃佐东,徐燕慧,李峰,等. 核酸分子杂交检测黄瓜花叶病毒[J]. 湖南文理学院学报:自然科学版, 2007,19(1): 69-71.[12]贾慧,王艳辉,王进忠,等. 基因芯片技术检测黄瓜花叶病毒、烟草花叶病毒和马铃薯Y病毒[J]. 华北农学报, 2011,26(1): 83- 86.[13]PENG Jun,SHI Minjing,XIA Zihao,et al. Detection of Cucumber mosaic virus isolates from banana by one-step reverse transcription loop-mediated isothermal amplification[J]. Arch Virol, 2012, 157(11): 2213- 2217.[14]伊鋆,蔡雪凤. TaqMan荧光探针技术在食源性致病菌检测中的应用[J]. 食品工业科技, 2013(7): 374-377.[15]ABRAHAMIAN P E, JAWDAH Y. Detection and quantitation of the new world Squash leaf curl virus by TaqMan real-time PCR[J]. J Virol Methods, 2013, 191(1): 76- 81.[16]WANG Yawen,LI Yiping,YANG Cuiling, et al. Development and application of a universal TaqMan real-time PCR for quantitation of duck hepatitis B virus DNA[J]. J Virol Methods, 2013, 191(1): 41- 47.[17]WACHARAPLUESADEE S,TEPSUMETHANON,SUP-AVONWONG P,et al. Detection of rabies viral RNA by TaqMan real-time RT-PCR using non-neural specimens from dogs infected with rabies virus[J]. J Virol Methods, 2012, 184(1/2): 109-112.[18]WEI T, LEBAS B S M, SHILLER J B, et al. Detection of five viruses infecting dormant bulbs by TaqMan-based real-time RT-PCR[J]. Australasian Plant Pathol,2012,41(1): 93-98.[19]WANG Fenglong,YANG Jinguang,ZHAI Xilun,et al. A real-time reverse transcription PCR assay for detection of Cucumber mosaic virus in individual peach aphid (Myzus persicae)[J]. ICIEA,2011(3): 2624- 2627.[20]王玉成,张国栋,姜静. 一种适用范围广的总RNA提取方法[J]. 植物研究, 2006,26(1): 85- 88.[21]郑卫东,袁仕伟. 荧光定量PCR仪的边缘效应与实验误差分析[J]. 医疗卫生装备, 2013(2): 113-115.[22]王芳,高正良,周本国,等. 利用Real-time RT-PCR法检测抗病毒活性物质对CMV复制的影响[J]. 烟草科技, 2011(1): 70-73.[23]袁亚男,刘文忠. 实时荧光定量PCR技术的类型、特点与应用[J]. 中国畜牧兽医, 2008,35(3):27-30.[24]SCHEFE J H,LEHMANN K E,BUSCHMANN I R, et al. Quantitative real-time RT-PCR data analysis: Current concepts and the novel “gene expression’s CT difference” formula[J]. J Mol Med, 2006, 84(11): 901-910.[25]WINTZINGERODE F,GOBEL U B,STACKEBRANDT E. Determination of microbialdiversity in environmental samples: Pitfalls of PCR-based rRNA analysis[J]. FEMS Microbiol Rev, 1997, 21(3): 213- 229.[26]MORENO I M, THOMPSON J R, GARCIA-ARENAL F. Analysis of the systemic colonization of cucumber plants by Cucumber green mottle mosaic virus[J].J Gen Virol, 2004, 85(Pt3): 749-759.。
黄瓜绿斑驳花叶病毒分子检测方法的建立与评价

Vo. 8 No5 1 . 2 0t00 c. 1 2
JU N LO H N H IIO O GU IE ST A RC I U A IN E O R A F A G A A T N NV R IY(G IUJ R LS E C ) S J T C
.
文 章 编 号 : 6 1 9 6 (0 00 — 4 7 0 1 7 - 9 42 1)5 0 5 — 5
D : 03 6  ̄i l17 — 9 42 1 - ・1 OI1 .9 9 .St6 1 9 6 . 0 50 2 sO . 0 0
黄瓜绿斑驳花叶病毒分子检测方法的建立与评价
阚春 月 于 翠 杨 翠云 王守法 。 , , ,
K N h n ye Y u:Y G C iy n WANGS o -a A C u - u U C i AN u- u 2 , , , h uf 3
f. olg f o dS in ea dT c n lg , h n h i e n Unv ri , h n h i 0 3 0 C ia 2 S a g a ty E i 1 C l eo o ce c n e h oo y S a g a a ies y S a g a 1 0 , hn ; . h n h i e F Oc t 2 Enr— xt
(. 海海 洋大 学食 品学 院, 1 上 上海 2 10 ; . 出入 境检 验检 疫 局 , 海 2 0 3 ; 0 3 0 2上海 上 0 15
3华 东理工 大 学生物 工 程 学 院, . 上海 2 0 3 1 0 2 7
摘 要: 以接种黄瓜绿 斑驳 病毒 的黄瓜种子为材料 , 分别建立 了快速检 测黄瓜绿 班驳 病毒的多种 P R方法 。实验结 果表 明, C 这 些方法的灵敏度 都比 D S E IA的灵敏度 高, 中实时荧光 R — C A — LS 其 T P R的灵敏度最 高, 可检 测到 2n 黄瓜种 子 中的黄瓜 绿斑驭 g 花叶 病毒 。普通 R — C T P R最低 可检 测到 2 0n 黄瓜种 子 中的黄瓜绿 斑驳 花叶病毒 , 0 g 免疫捕获 R — C I— T P R 的灵敏度 T P R( R — c ) C 是普通 R — C T P R的 2 , 倍 而免疫磁珠 R — C MS R — C ) T P R f — T P R ̄普通 R — C I T P R的 4倍 。 关键词 : 黄瓜 绿斑驳花叶病毒; A — LS R — C 免 疫捕 荻 R — C ; D S E IA; T P R; T P R 免疫磁珠 R —P R 实时荧光 R — C T C; TPR
利用RT-PCR快速检测黄瓜绿斑驳花叶病毒

文章编号 :056 (0 2)40 004 10 —14 2 1 0 —2 —0 1
摘
要 : 据 黄 瓜 绿 斑 驳 花 叶病 毒 ( G 根 C MMV) 外 壳蛋 白基 因( P基 因 ) 守序 列 设 计 、 成 引物 , 的 C 保 合
以感病 西瓜 、南瓜 、 玉米叶 片组织总 R A为模 板 , N 进行 c N D A合 成和 P R扩增 , C 并将扩增产物连接到
物科技 有 限公 司 ;E . a 、p 8 xT q酶 MD 1一 T载体 、
D 2 0 N akr 自 T K R 公 司 ; x gn L 00 D A m re 购 aaa A y e D A凝胶 回收试 剂盒 购 自武汉 丁香 园公 司 。 N
12 引 物 设 计 合 成 -
。
11 供 试 病 毒 样 品 及 试 剂 .
西 瓜病 叶 :0 8 6 20 年 月于湖北 武汉蔡 甸 区采 集 , 现为 花 叶 、 表 斑驳 、 状 的西瓜 叶片 。一 0 疣 7 ℃
●
大 小为 30 1 l 的直杆 状病毒 , 0 × 8n 1 i 属烟 草花 叶 病 毒属 T b oi s 自 20 年 厦 门检 验检 疫 ou v u“ m r 。 04
更强的快速 、 准确的检 测鉴 定方法 , 是一种控制该潜在危险性有 害生物 蔓延的有效途径。 关键词 : 黄瓜 绿斑驳 花叶病毒 ;TP R C 基 因 R —C ; P 黄瓜绿 斑驳 花 叶病 毒 C cmbr re ot uu eg e m te n l
moacv u , GMMV 是 一 种 正 单 链 R si i s C r NA病 毒 ,
保存 。
局 首次 从 日本进 口的番 瓜种 子 中截 获 C MMV G 以来 , 在我 国大陆已发生多起进 口源性 C MMV, G
种子种苗上黄瓜绿斑驳花叶病毒IC-RT-PCR检测方法的建立及应用
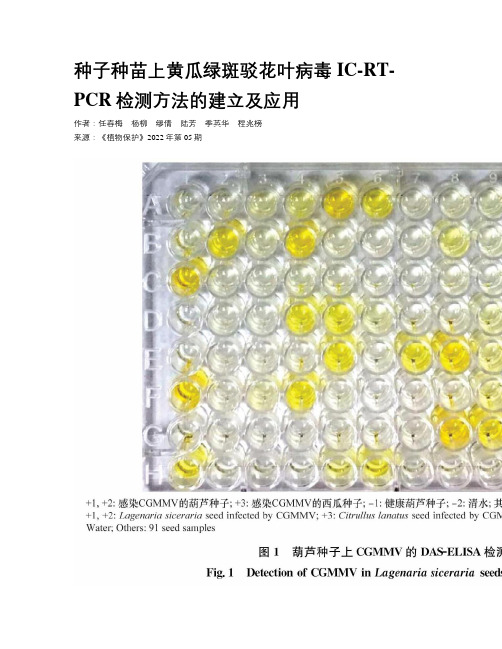
种子种苗上黄瓜绿斑驳花叶病毒IC-RT-PCR检测方法的建立及应用作者:任春梅杨柳缪倩陆芳季英华程兆榜来源:《植物保护》2022年第05期摘要黄瓜绿斑驳花叶病毒(CGMMV)是一种检疫性植物病毒,种传和农事操作是其主要传播途径,因此种子和种苗的早期检测尤为重要。
鉴于种子检测的特殊性及幼苗病毒含量低的特点,本试验通过制备CGMMV单克隆抗体,结合特异性引物,建立了黄瓜绿斑驳花叶病毒的IC-RT-PCR早期检测方法,比较了IC-RT-PCR与DAS-ELISA和RT-PCR方法的特异性、灵敏度,并对实际检测效果进行了评价。
在操作程序上,IC-RT-PCR法与DAS-ELISA法一样简便,但灵敏度远大于DAS-ELISA。
IC-RT-PCR与RT-PCR均可检出20~25 ng种子上的病毒,且特异性相当,而DAS-ELISA法只可检出10 μg种子上的病毒。
综上所述,IC-RT-PCR法可简便有效地应用于种子和种苗上CGMMV的检测,为病毒防治的早期干预提供技术支撑。
关键词黄瓜绿斑驳花叶病毒; 免疫捕获RT-PCR; 灵敏度; 特异性中图分类号: S41-32文献标识码: ADOI: 10.16688/j.zwbh.2021483Establishment and application of IC-RT-PCR for cucumber green mottle mosaic virus in seeds and seedlingsREN Chunmei, YANG Liu, MIAO Qian, LU Fang, JI Yinghua, CHENG Zhaobang*(Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014,China)Abstract Cucumber green mottle mosaic virus (CGMMV) is a quarantine plant virus, which mainly transmitted by seeds and agricultural operations. Therefore, early detection of seeds and seedlings is particularly important. In view of the particularity of seed and the characteristics of low virus content in seedlings, we established an early detection method, IC-RT-PCR, for CGMMV detection by preparing its monoclonal antibodies and specific primers. The specificity and sensitivity of IC-RT-PCR, DAS-ELISA and RT-PCR were compared, and the actual detection effect was evaluated. IC-RT-PCR was as simple as DAS-ELISA in operation, but its sensitivity was much higher than that of DAS-ELISA. Both IC-RT-PCR and RT-PCR could detect viruses on 20-25 ng seeds with equivalent specificity, while DAS-ELISA could only detect viruses on 10 μg seeds. In conclusion, IC-RT-PCR can be easily and effectively applied to CGMMV detection on seeds and seedlings, which provided technical support for early intervention in virus control.Key words cucumber green mottle mosaic virus; immunocapture-RT-PCR; sensitivity; specificity黃瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus, CGMMV)属于帚状病毒科Virgaviridae 烟草花叶病毒属Tobamovirus,主要侵染葫芦科作物,造成叶片斑驳、褪绿和畸形等症状。
辣椒黄瓜花叶病毒RNA提取及RT-PCR体系建立

辣椒黄瓜花叶病毒RNA提取及RT-PCR体系建立
王飞;姚明华
【期刊名称】《湖北农业科学》
【年(卷),期】2009(048)004
【摘要】以感染黄瓜花叶病毒病的辣椒叶片为材料,采用改进的Trizol试剂法提取病毒RNA.利用黄瓜花叶病毒外壳蛋白基因序列设计特异引物进行检测,摸索适宜的RT-PCR体系.结果表明.改进的Trizol试剂法能获得较高质量和产量的病毒RNA,并能稳定地进行规模化检测.
【总页数】2页(P776-777)
【作者】王飞;姚明华
【作者单位】湖北省农业科学院经济作物研究所,武汉,430064;湖北省农业科学院经济作物研究所,武汉,430064
【正文语种】中文
【中图分类】S641.3;S436.418.1+2;Q503
【相关文献】
1.百合上黄瓜花叶病毒的一步RT-PCR检测 [J], 王丽花;瞿素萍;杨秀梅;陆琳;吴学尉;王继华
2.烟草黄瓜花叶病毒一步法RT-PCR检测试剂盒的研制与初步应用 [J], 张俊祺;刘相兵;罗朝鹏;杨军;宋纪真;尹启生;宋浩
3.侵染荷兰郁金香的郁金香碎色病毒和黄瓜花叶病毒的RT-PCR检测 [J], 杨玉秀;王海妮;吴云锋
4.应用RT-PCR检测辣椒上的黄瓜花叶病毒 [J], 杨超;孙秀东
5.双重RT-PCR方法检测花生条纹病毒和黄瓜花叶病毒 [J], 谢宏峰;吴菊香;迟玉成;许曼琳;陈蕾;许婷婷
因版权原因,仅展示原文概要,查看原文内容请购买。
一种百香果黄瓜花叶病毒的PCR引物组合及检测方法[发明专利]
![一种百香果黄瓜花叶病毒的PCR引物组合及检测方法[发明专利]](https://img.taocdn.com/s3/m/b2702bf9cc7931b765ce15f4.png)
专利名称:一种百香果黄瓜花叶病毒的PCR引物组合及检测方法
专利类型:发明专利
发明人:江金兰,叶炜,杨学,匡云波,颜沛沛,王培育,周建金,廖承树,罗晓锋,乔锋,赖瑞联
申请号:CN201910487604.6
申请日:20190605
公开号:CN110117677A
公开日:
20190813
专利内容由知识产权出版社提供
摘要:本发明提供一种百香果黄瓜花叶病毒的的PCR引物组合及检测方法,具体包括,3条百香果黄瓜花叶病毒外壳蛋白特异引物,2条百香果通用内参基因EF1a特异引物。
本发明通过3条百香果黄瓜花叶病毒外壳特异引物的设计,可同时检测病毒3个特异性位点,避免假阳性的产生,1对百香果EF1a 内参引物的使用,可以检测百香果cDNA合成质量,避免假阴性的产生,整个检测过程可以在4个小时内完成,可在1%琼脂糖进行PCR结果检测,不需使用昂贵的荧光定量PCR仪,具有快速、经济、灵敏度高、稳定性强的特点。
申请人:三明市农业科学研究院
地址:365050 福建省三明市沙县虬江街道办柱源村
国籍:CN
代理机构:福州元创专利商标代理有限公司
更多信息请下载全文后查看。
广东烟区黄瓜花叶病毒胶体金检测试纸条的研制及应用

广东烟区黄瓜花叶病毒胶体金检测试纸条的研制及应用随着经济的快速发展,人们在食品领域对安全性和质量要求也越来越高。
而蔬菜作为日常膳食的重要组成部分,其种植过程中的病毒感染问题也备受关注。
广东烟区黄瓜花叶病毒的检测尤为重要,因为该病毒可以对黄瓜的生长和产量产生严重的影响。
本文旨在研究并开发一种新的胶体金检测试纸条,用于快速检测广东烟区黄瓜花叶病毒的存在。
我们通过文献查阅和实验室试验,对广东烟区黄瓜花叶病毒的生物特性进行了详细分析。
我们发现,该病毒的特异性与胶体金技术相结合可以实现快速、灵敏和准确的检测。
我们决定开发一种基于胶体金技术的检测试纸条。
接下来,我们设计了一套完整的检测方案。
我们通过电镜观察和荧光定量PCR等方法,对广东烟区黄瓜花叶病毒的富集和分离技术进行了研究,以获取高纯度的病毒颗粒。
然后,我们将这些病毒颗粒与特异性的抗体进行结合,形成一种胶体金标记的复合物。
我们将这种复合物涂覆在特定面积的检测试纸条上,并对其进行包装,以确保其长期储存和稳定性。
接下来,我们对这种新型的检测试纸条进行了性能测试。
在实验室条件下,我们采用一系列已知浓度的广东烟区黄瓜花叶病毒样品进行测试。
结果表明,这种胶体金检测试纸条在病毒浓度为1 ng/mL时就可以准确检测到病毒的存在,而且在短短10分钟内就可以获得检测结果。
与传统的酶联免疫吸附试验(ELISA)相比,这种新型检测试纸条具有更高的敏感性和更快的检测速度,从而大大提高了检测效率。
我们对这种新型检测试纸条进行了实际应用的验证。
我们从广东烟区一些农田的黄瓜植株中采集样品,经过简单的样品处理后,使用这种胶体金检测试纸条进行检测。
结果表明,这种测试方法既能准确地检测到病毒的存在,还可以在田间条件下快速完成检测,为农民提供了一种方便的检测工具。
我们通过研究和开发一种新型的胶体金检测试纸条,成功实现了对广东烟区黄瓜花叶病毒的快速、灵敏和准确的检测。
这种测试方法具有简单、快速和经济的特点,可以广泛应用于蔬菜种植领域,提高蔬菜的质量和安全性。
广东烟区黄瓜花叶病毒胶体金检测试纸条的研制及应用

广东烟区黄瓜花叶病毒胶体金检测试纸条的研制及应用随着人们对食品安全的关注度不断提高,农产品的检测需求也变得越来越重要。
其中,病毒是导致农业产品损失的重要原因之一,因此在病毒检测方面的研究也愈加受到关注。
本文主要介绍了一种基于胶体金技术的黄瓜花叶病毒检测方法,其具有灵敏、快速、简单、便携等优点,且能够检测到田间样品中的黄瓜花叶病毒。
一、研制方法1. 材料(1)黄瓜花叶病毒抗体;(3)胶体金颗粒;(4)棉签;(5)玻片;(6)磁性棒。
2. 操作步骤(1)制备抗原将黄瓜花叶病毒感染过的植物组织磨碎,加入0.1mol/L的磷酸缓冲液,离心沉淀,收集上清液,即为抗原。
(2)制备胶体金标记将胶体金颗粒和黄瓜花叶病毒抗体混合,在加入一定浓度的NaCl和Tween-20后,振荡混合,旋离沉淀,最后用0.1mol/L的磷酸缓冲液悬浮,制备成胶体金标记。
(3)制备试纸条在玻片上贴上2mm宽的双面胶,将左右两侧各切下一条0.5cm宽的滤纸,中间用悬浮液渗透纸条。
(4)检测操作将棉签蘸取待检测田间样品汁液,加入0.1mol/L的磷酸缓冲液,旋离沉淀,加入胶体金标记,振荡反应,使用磁性棒吸附胶体金-抗原-抗体复合物到试纸条上,等待5-10分钟后,观察试纸上是否出现红色。
二、检测结果本方法将样品检测视为阳性和阴性两种情况,阳性样品可得到红色反应,阴性样品则无反应。
检测结果还与病毒的浓度相关,病毒浓度越高,反应色越深。
此外,在不同病毒感染程度下,本方法的检测灵敏度达到了10ng/mL。
三、应用展望本方法的研制为病毒检测提供了一种新的选择。
相比于传统的检测方法(如ELISA法、PCR法等),该方法具有操作简单、检测时间快、灵敏度高、使用便携等优点,且克服了传统方法需要复杂的设备和技术的缺陷。
因此,胶体金检测试纸条在田间样品检测中具有广泛的应用前景。
同时,本研究对于胶体金检测技术的发展也具有一定的借鉴意义,可为其他病毒检测方法提供参考。
烟草黄瓜花叶病毒一步法RT-PCR检测试剂盒的研制与初步应用

烟草黄瓜花叶病毒一步法RT-PCR检测试剂盒的研制与初步应用张俊祺;刘相兵;罗朝鹏;杨军;宋纪真;尹启生;宋浩【期刊名称】《烟草科技》【年(卷),期】2011(000)010【摘要】为快速准确地检测烟草黄瓜花叶病毒(CMV),根据黄瓜花叶病毒基因组序列相对保守区域设计了一对特异性引物,整合了反转录和PCR反应所需酶和缓冲液,通过反应条件的优化,建立了基于一步法RT-PCR检测烟叶感染CMV的方法,在此基础上组装了检测试剂盒.进一步分析了该试剂盒的特异性、稳定性和检测灵敏度.结果表明,该试剂盒具有很强的特异性、良好的重复性和较高的灵敏度(模板RNA 浓度最低达到10 ng量级).初步应用结果显示,在多个烟区采集的病叶样品检测结果均与ELISA检测结果一致,能够成功检测出CMV.【总页数】5页(P65-69)【作者】张俊祺;刘相兵;罗朝鹏;杨军;宋纪真;尹启生;宋浩【作者单位】中国烟草总公司郑州烟草研究院,郑州 450001;湖南中烟工业有限责任公司,长沙市 410007;中国烟草总公司郑州烟草研究院,郑州 450001;中国烟草总公司郑州烟草研究院,郑州 450001;中国烟草总公司郑州烟草研究院,郑州 450001;中国烟草总公司郑州烟草研究院,郑州 450001;湖南中烟工业有限责任公司,长沙市410007【正文语种】中文【中图分类】S432.41【相关文献】1.一步法RT-PCR检测烟草环斑病毒试剂盒的研制与应用 [J], 张永江;李明福;黄冲;相宁2.浓缩一步法新型肺炎支原体核酸检测试剂盒的临床应用初步评价 [J], 许爱玲;曲人亮;艾颖娟;邓中平;赵业华3.首个核果类果树病毒RT-PCR检测试剂盒的研制与应用 [J], 侯义龙4.猪流行性腹泻病毒一步法RT-PCR检测方法的建立与初步应用 [J], 胡丽萍;何奇松;许瑞胜;冯淑萍;易春华;韦达有;黄胜斌;熊毅;马琳5.禽流感H9亚型一步法RT-PCR快速检测试剂盒的研制及应用 [J], 程福亮;梁瑾;范群平;陈甜甜;宿志瑞;聂兆晶;谷巍因版权原因,仅展示原文概要,查看原文内容请购买。
广东烟区黄瓜花叶病毒胶体金检测试纸条的研制及应用

广东烟区黄瓜花叶病毒胶体金检测试纸条的研制及应用广东烟区黄瓜花叶病毒是一种常见的植物病毒,对于黄瓜的生长和产量有较大的影响。
研制一种能够快速、准确检测广东烟区黄瓜花叶病毒的方法对于保护黄瓜种植业的发展具有重要意义。
本文将介绍一种基于胶体金技术的检测方法,并讨论其在广东烟区黄瓜花叶病毒检测中的应用。
研制的检测方法主要基于胶体金技术,该技术具有灵敏度高、特异性强、操作简便等优点,可以快速、准确地检测黄瓜花叶病毒。
研究人员从病毒组织中提取病毒核酸,并进行逆转录反应,将RNA转化为cDNA。
接下来,利用特异性引物进行PCR扩增,得到特异性的目标序列。
然后,将胶体金与检测目标序列结合,形成金纳米颗粒探针。
将反应体系滴在纸条上,等待数分钟,通过肉眼即可观察到纸条上是否出现红色线条,来判断样品是否感染病毒。
该检测方法的应用具有诸多优势。
操作简便,不需复杂设备,只需将样品滴于纸条上即可进行检测。
检测时长短,只需数分钟,快速、高效地获得检测结果。
检测结果可视化,通过肉眼就能看到纸条上是否出现红色线条,无需专业设备进行分析。
该方法的灵敏度高、特异性强,能够准确检测黄瓜花叶病毒的存在,为相关农业技术提供重要的支持。
本研究还评估了该检测方法的应用效果。
通过采集不同地区、不同生长阶段的黄瓜植株样品,进行病毒检测。
结果显示,该方法能够快速、准确地检测出黄瓜花叶病毒的感染情况。
进一步分析表明,该方法的灵敏度高,能够在感染病毒的样品中准确检测出红色线条。
该方法的特异性强,对于其他与黄瓜花叶病毒无关的样品不会出现类似结果。
在实际应用中,该方法能够帮助农民及时识别和控制病毒感染,减少黄瓜产量和质量的损失。
基于胶体金技术的广东烟区黄瓜花叶病毒检测方法具有快速、准确、便捷等特点,在农业生产中具有重要意义。
未来,我们将进一步完善该方法的细节,并考虑将其应用于其他植物病毒的检测中,为提高农作物的生产效益作出更大贡献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
香蕉中 CMV 的检测方法主要有 ELISA、斑点杂 涂板,挑出白色菌落进行摇菌,用质粒抽提试剂盒抽
交法、RT-PCR、 免疫捕获 RT-PCR[7-10] 、 核酸分子杂 提质粒,并测序.经鉴定正确的作为阳性质粒,用核
交[11] 、基因芯片技术[12] 及 RT-LAMP[13] 等,这些方法 酸蛋白仪测定其质量浓度,然后计算拷贝数:
CP 序列的遗传多样性分析表明 CMV 主要有 2 个亚 10 min.反应得到目的大小片段后,用切胶回收试剂
组.目前对 CMV 尚未形成一套安全、高效、稳定的病 盒回收 PCR 产物.依试剂盒说明说将目的片段连接
毒防控技术,因此有必要对此进行研究.
至 pMD18-T 载体,并转化至 JM109 感受态细胞中.
关键词:黄瓜花叶病毒; TaqMan 探针; 荧光定量 PCR 检测方法 中图分类号:S436.421 文献标志码:A 文章编号:1001-411X(2014)02-0053-04
Real-time PCR for quantification of Cucumber mosaic virus in banana
测花 卉、 桃 蚜 中 的 CMV 虽 有 报 道[18-19] , 但 香 蕉 中
病毒拷贝数的计算:将未知样品的 Ct 值代入所
CMV 的荧光定量检测方法鲜见报道.本研究根据 得标准曲线中,即可得到未知样品的病毒拷贝数.其
CMV CP 基因保守序列设计了荧光定量 PCR 特异性 中,Ct 值是指每个反应管内的荧光信号到达设定的 探针及引物,建立了香蕉中 CMV 的荧光定量 PCR 检 阈值时所经历的循环数.
E-mail: snow26@sina.com;李华平(1961—),男,教授,博士,E-mail: huaping@scau.edu.cn 基金项目:公益性行业( 农业)科研专项(201203076-07)
54
华 南 农 业 大 学 学 报
第 35 卷
(Coat protein,CP)与病毒粒子组装和蚜虫传播相关; 30 s,59 ℃ 1 min,72 ℃ 1 min,35 个循环;72 ℃延伸
玉成等[20] 方法进行 RNA 抽提,放于 -20℃保存.根据 (10 μmol · L -1 ), 10 ×Buffer 2畅5 μL, dNTPs ( 2畅5
PrimeScriptTM RT Master Mix(Perfect Real Time)说明进 mmol· L -1 )2畅0 μL,模板 1 μL,加灭菌的 ddH2 O 至 行 RNA 的反转录以合成 cDNA.反应体系:5 ×Prime- 25 μL.反应条件:95 ℃ 5 min;95 ℃ 30 s,59 ℃ 1
在检测速度、灵敏度及特异性等方面有一定的局限
拷贝数 =[6畅02 ×1023 ×ρ] ÷[ 碱基数 ×660 ×
性.目前,基于 PCR、荧光标记和激光技术[14] 的定量 10 -3 ].
PCR,灵敏度高、特异性强、重复性好,在植物病毒检
经计算本试验所得质粒 DNA 拷贝数为 4畅2 ×1010
测中已得到广泛的运用[15-17] .利用荧光定量方法检 μL -1 ,以 10 倍梯度稀释,作为绝对定量的标准品.
收稿日期:2013-07-10 优先出版时间:2014-01-03 优先出版网址:http:∥www.cnki.net /kcms /detail /44.1110.S.20140103.0829.020.html 作者简介:孙 洁(1987—),女,硕士研究生,E-mail:sj721230@sina.com; 通信作者: 饶雪琴(1969—), 女,副教授,博士,
摘要:【目的】建立检测香蕉中黄瓜花叶病毒 Cucumber mosaic virus( CMV) 的实时荧光定量方法.【 方法】 根据 CMV 外壳蛋白(CP)保守序列设计了 TaqMan 实时荧光定量 PCR 特异性探针及引物,优化反应体系检测 TaqMan 探针实 时荧光定量方法的灵敏度、特异性和重复性.【 结果和结论】 该方法检测灵敏度为 4畅2 ×102 μL -1 ,比普通 PCR 高 100 倍,且与香蕉束顶病毒 Banana bunchy top virus(BBTV)、香蕉线条病毒 Banana streak virus(BSV)无交叉反应,特 异性和重复性都较好.用实时荧光定量 PCR 检测 14 份田间香蕉样品有 5 份样品为阳性,进一步证明建立的实时荧 光定量方法可用于香蕉 CMV 的检测.
孙 洁, 王 婉, 周 翎,等.黄瓜花叶病毒荧光定量 PCR 检测方法的建立[ J] .华南农业大学学报,2014,35(2) :53-56.
黄 瓜花 叶病 毒荧 光定 量 PCR 检 测方 法的 建立
孙 洁, 王 婉, 周 翎, 阮小蕾, 饶雪琴, 李华平
(华南农业大学 资源环境学院,广东 广州 510642)
P:5′-ROX-CGTTACCGCCATCTCTGCTATGTTCGCBH - 的 cDNA 为模板,进行荧光定量 PCR,进行荧光定量
Q2-3′,引物和探针均由 TaRaKa 公司合成.
特异性试验.
1.2.2 模板 RNA 的提取及 cDNA 的制备 按照王
PCR 体系:Taq 酶 0畅2 μL,MF1、CMV-R 各 1 μL
Script RT Master Mix 2 μL, RNA 2 μL, RNase-free min,72 ℃ 1 min,35 个循环;72 ℃延伸 10 min.
ddH2 O 6 μL.反应条件为:37 ℃ 15 min,85 ℃ 5 s. 1.2.6 荧光定量 PCR 的实际应用 采集不同香蕉
蛋白分析仪(Nanophotometer,产自 IMPLEN).
1.2.5 荧光定量 PCR 灵敏性、特异性和重复性试验
1.2 试验方法
以制备的 CMV 标准品按 10 倍梯度稀释为模板,
1.2.1 引物与探针的设计 根据 GenBank 上已登 进行荧光定量 PCR 和普通 PCR 试验,根据各模板的
Key words:Cucumber mosaic virus(CMV); TaqMan probes; real time PCR detection method
香蕉广 泛 种 植 于 热 带 亚 热 带 地 区, 在 进 出 口 贸 易中占有很重要的位置.植物病毒病是影响香蕉繁 殖和种质资源交流的重要因素,在世界很多香蕉种 植区均有报道黄瓜花叶病毒 Cucumber mosaic virus ( CMV) 引起的香蕉花叶心腐病对香蕉生产造成重大
Real Time)、Premix Ex TaqTM 、实时荧光定量 PCR 仪 为模板,建立 25 μL PCR 反应体系,根据优化的反应
(Thermal Cycler Dice ) 均购于 TaRaKa 公司.大肠埃 条件,荧光定量 PCR 仪扩增.反应结束后,仪器自动
希菌 JM109 由华南农业大学植物病毒室提供.核酸 生成标准曲线.
录的 CMV CP 基因序列( 登录号:AY965892.1) 设计 Ct 值确定检测下限.以 4畅2 ×107 μL -1 为模板,重复 7 引物和探针,MF1:5′-CGATAAGAAGCTTGTTTCGCG- 次,进行统计分析,根据变异系数确定该体系的可重
3′,CMV-R:5′-CGGCGTACTTTCTCATGTCAC-3′,探针 复性.以感染 BBTV、BSV 的香蕉植株 DNA,及 CMV
损失[1-2] .在黄瓜花叶病毒侵染的叶片上,特别是嫩 叶,出现黄绿相间的花叶状条纹或褪绿的梭状斑,叶 缘有轻微卷曲[3] .CMV 属于雀麦花叶病毒科 Bromo- viridae 黄瓜花叶病毒属 Cucumovirus,是典型的三分 体单链正义 RNA 病毒.研究[4-6] 发现 CMV 外壳蛋白
业大学农场和云南省保山市.
μmol· L -1 )0畅5 μL,模板 2 μL,加灭菌的 ddH2 O 25
Ex Taq DNA 聚合酶、dNTPs、pMD18-T 载体、质 μL.最佳反应条件为:95 ℃ 10 s;95 ℃ 5 s,59 ℃ 30
粒纯化试剂盒、PrimeScriptTM RT Master Mix ( Perfect s,72 ℃ 30 s,40 个循环.以 10 倍梯度稀释的标准品
测方法.
1.2.4 荧光定量 PCR 反应条件的优化与标准曲线
1 材料与方法
的制作 以制备的标准品为模板,对实时荧光定量 的引物与探针的浓度及退火温度进行优化,确立最
1.1 样品、仪器与试剂
佳反应体系.25 μL 反应体系:Real-time 2 ×Taq 12畅5
感染 CMV、BSV、BBTV 的香蕉植株采自华南农 μL,MF1、 CMV-R 各 1 μL ( 10 μmol · L -1 ), P ( 10
华南农业大学学报 2014,35 (2 ) :53-56 Journal of South China Agricultural University
doi:10.7671
http:∥xuebao.scau.edu.cn /j.issn.1001-411X.2014.02.010
SUN Jie, WANG Wan, ZHOU Ling, RUAN Xiaolei, RAO Xueqin, LI Huaping
( College of Natural Resources and Environment ,South China Agricultural University , Guangzhou 510642,China)
Abstract:【Objective】 To develop a real-time quantitative PCR method with TaqMan probes to quantify Cucumber mosaic virus (CMV) in banana.【Method】 The primers and probes were designed based on the conserved coat protein(CP) sequences of CMV and were applied to real -time PCR assays.The reaction system was optimized ,and its sensitivity, specificity and repeatability were evaluated .【Result and conclu- sion】The detection sensitivity of the real -time PCR assay was 4畅2 ×102 μL -1 , which was 100 times more sensitive than PCR.The specifity of the assay was analyzed with Banana bunchy top virus ( BBTV) and Banana streak virus (BSV), and no cross reaction were observed .The assay also had good repetitions . The real-time PCR assay was evaluated with field samples .5 of the 14 tissue sampected CMV infected bananas were positive , which further confirmed that the real -time PCR method should be suitable for detection and quantitation of CMV in banana .
