分子结构与晶体类型
分子结构与晶体结构

分⼦结构与晶体结构第七章分⼦结构与晶体结构第⼀节离⼦键⼀、离⼦键的形成和特征1、离⼦键的形成电负性I1或Y1(KJ/mol)电离能很⼩的⾦属原⼦:Na 0.9 496K 0.8 419电⼦亲合能很⼤的⾮⾦属原⼦:Cl 3.0 -348.8O 3.5 -141电负性相差⼤的元素相遇,⼀失电⼦,⼀得电⼦,它们之间以静电引⼒相结合,形成离⼦键。
④:阳阴离⼦间具有静电引⼒,两原⼦的电⼦云间存在排斥⼒,两原⼦核间存在相互排斥⼒,当两原⼦接近到⼀定距离,引⼒=斥⼒,(此时整个体系能量最低),形成离⼦键。
2、离⼦键的特征①本质:阴、阳离⼦间的静电引⼒②⽆⽅向性、饱和性只要空间允许,尽可能多地吸引带相反电荷的离⼦(任何⽅向,尽可能多)。
但总体来说,有⼀定⽐例。
⼆、离⼦的特性1、离⼦的电荷离⼦化合物AmBn:A n+,B m-+n﹥+3,很少见2、离⼦的电⼦层结构简单阴离⼦的电⼦构型,⼀般与同周期希有⽓体原⼦电⼦层构型相同。
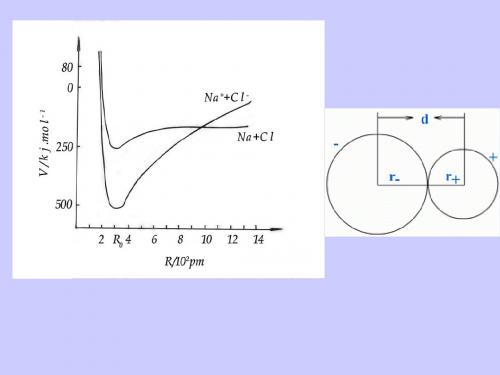
简单的阳离⼦构型:3、离⼦半径将阴阳离⼦看成是保持着⼀定距离的两个球体。
d = r+ + r-单位:pm(10-12m)规律:①同⼀元素:负离⼦半径>原⼦半径>正离⼦半径低价负离⼦半径>⾼价负离⼦半径低价正离⼦半径>⾼价正离⼦半径例:②同⼀周期从左到右,阳离⼦:正电荷数↑,半径↓阴离⼦:负电荷数↓,半径↓③同⼀主族电荷数基本相同,从上到下,半径↑(∵电⼦层增加)离⼦半径↓,离⼦间引⼒↑,离⼦键强度↑,熔、沸点↑,硬度↑第⼆节共价键理论1916年,路易斯提出共价键理论。
靠共⽤电⼦对,形成化学键,得到稳定电⼦层结构。
定义:原⼦间借⽤共⽤电⼦对结合的化学键叫作共价键。
对共价键的形成的认识,发展提出了现代价键理论和分⼦轨道理论。
⼀、价键理论(电⼦配对法)1、氢分⼦共价键的形成和本质(应⽤量⼦⼒学)当两个氢原⼦(各有⼀个⾃旋⽅向相反的电⼦)相互靠近,到⼀定距离时,会发⽣相互作⽤。
每个H原⼦核不仅吸引⾃⼰本⾝的1s电⼦还吸引另⼀个H原⼦的1s电⼦,平衡之前,引⼒>排斥⼒,到平衡距离d,能量最低:E0﹤2E,形成稳定的共价键。
晶体结构的分类

晶体结构的分类晶体结构是材料科学中重要的研究对象之一,它描述了材料原子、分子或离子的排列方式和周期性。
根据晶体结构的不同,可以将其分为分子晶体、离子晶体和金属晶体三大类。
1. 分子晶体:分子晶体是由分子构成的晶体。
它的特点是分子内部的化学键比较强,而分子之间的相互作用较弱。
分子晶体通常以共价键或极性键相连,如氢键和范德华力。
这些相互作用力比较弱,所以分子晶体的熔点一般较低。
此外,分子晶体在晶格中的排列方式通常较为规则,呈现出较强的周期性。
分子晶体的典型代表是冰,其晶体结构由水分子通过氢键排列而成。
2. 离子晶体:离子晶体是由阳离子和阴离子组成的晶体。
它的特点是阳离子和阴离子之间以离子键(电荷引力)相互作用,这种相互作用力比较强,所以离子晶体的熔点一般较高。
离子晶体的结构较为紧密,离子之间形成了三维晶格。
离子晶体的典型代表有氯化钠(NaCl)和氧化镁(MgO)。
在离子晶体中,阳离子和阴离子的比例需要满足电中性条件。
3. 金属晶体:金属晶体是由金属原子构成的晶体。
金属晶体的特点是金属原子之间形成了金属键,即金属原子间的价电子自由流动形成了电子云。
金属键的强度较弱,所以金属晶体的熔点一般较低。
金属晶体的结构通常是一个由正离子核组成的细胞,正离子核之间被电子云均匀地包围着。
典型的金属晶体有铁、铜和铝等。
除了以上三类晶体,还存在着复合晶体和非晶体。
复合晶体是由两种或多种物质组成的晶体,这些物质可以是离子、分子或金属。
复合晶体的结构较为复杂,几种物质相互依存形成了一个复杂的三维结构。
非晶体是一种无定形的材料,在结构上没有明确的周期性。
非晶体通常是通过快速冷却或高压制备而成,如玻璃和聚合物材料。
综上所述,晶体结构根据其构成单位和相互作用类型的不同,可以分为分子晶体、离子晶体和金属晶体三大类。
通过深入研究晶体结构与性质之间的关系,可以揭示材料的物理、化学和力学特性,为材料设计和应用提供理论依据。
7.3 分子结构与晶体结构

Cl 3p - 1251 kJ· mol - 1 (以上数据根据 I1 值估算) 左面 3 个轨道能量相近,彼此间均可组合,形成分子
轨道 ;但 Na 3 s 比左面 3 个轨道的能量高许多, 不能形成共价键,只以离子键相结合。
32
③ AO最大重叠原则AO Maximum Overlap :
AO不能任意组合,AO组合为MO时,根据
三角形 正四面体 正四面体 正四面体 三角形 三角双锥 分子构型
Cl Cl Al Cl
S H H
S O O O
H
H N
F
N
H H
F
O
O
F
三角形 V字构型
三角锥
正四面体 V字形 T字形
CO2
O3
OF2
XeF2 XeF4
中心原子 平面 三角 直线型 四面体 八面体 价层电子对 三角形 双锥 空间构型
HO Type LP
22
VBT,HOT和VSEPRT这些理论可以比较直观、较好的说 明共价键的形成和分子的几何构型,但它们也并非是完 美无缺的,也存在明显的不足: (1)无法解释单电子离子的形成H2+ , 三电子离子He2+ 的存在; (2)O2中的三电子π键和O2 和B2分子磁性的大小. (3) 难以解释某些复杂分子以及有离域大π键的有机 分子的结构. 为此,1932年Mulliken和Hund提出MOT,这个理论的 核心是分子中的电子再不属于某一个原子所有,而是在 整个分子范围内运动,这些电子的运动状态的描述不能 再用AO来说明,只能用MO来说明.
叁键 ﹥ 双键 ﹥ 单键
结论:要尽量避免具有较大斥力的电子对分布 在互成90°的方向上。
8
二、VSEPRT判断分子结构的步骤 1.确定中心原子的价电子对数VP
分子结构
CCl4 250 349 大
ZnS CdS HgS
(3)比较共价成分的大小: ZnCl2 CdCl2 HgCl2
增大
(4)按理论计算 NaI
增大
U 理论=164.3KJ/mol,但实际 U 实际=170.0KJ/mol
作用:①用于测某气体 mol 质量 M: PV=
m RT M
AB 型配位数比 (晶体构型) 8:8(CsCl 型) 6:6(NaCl 型) 4:4(ZnS 型)
例 CsCl, CsBr, CsI NH4Cl, TlCN NaCl, KCl, NaBr, LiF, CaO, MgO, CaS ZnS, ZnO, BeO,BeS, CuCl, CuBr
AB2 型配位数比 (晶体构型) 8:4(CaF2 型) 6:3(TiO2 型) 4:2
②价电子对之间存在斥力,斥力来源于两个方面,一是各电子对间的静电斥力,二是电 子对中自旋方向相同的电子间产生的斥力。 为减小价电子对间的排斥力, 电子对间应尽量相 互远离。 若按能量最低原理排布在球面上, 其分布方式为: 当电子对数目为 2 时, 呈直线形; 价电子对数目为 3 时,呈平面三角形;价电子对数目为 4 时,呈正四面体形;价电子对数目 为 5 时,呈三角双锥形;价电子对数目为 6 时,呈八面体形等等。
分子间力 熔、沸点低,能溶于极性溶剂中, HCl,HF,NH3,H2 O (有氢键) 溶于水时能导电 分子间力 熔、沸点低,能溶于非极性或极 H2,Cl2 性弱的溶剂中,易升华 有金属光泽,电和热的良导体,有 Na,W,Ag,Au 金属键 延展性,熔、沸点较高
bP(oC) mp(oC)
HF 190 292.5
↑ ↑
激发 →
↑ ↑ ↑ → ↑ ↑ ↑ ↑ → ↑↓ ↑↓ ↑↓ ↑↓
(立体图,好理解)分子晶体与原子晶体

例、如右图所示, 在石墨晶体的层 状结构中,每一 个最小的碳环完 全拥有碳原子数 2 为___,每个C 完全拥有C-C 数为___ 3
石墨中C-C夹 ☉ 角为120 , C-C键长为 1.42×10-10 m 层间距
3.35× 10-10 m
小结:金刚石、石墨的比较
项目 晶体形状 晶体中的键或作用力 由最少碳原子形成环的形状 与个数 碳原子成键数 键的平均数 金刚石 石墨
小结:
1、分子晶体:由分子构成。相邻分子靠分子间作用力 相互吸引。 2、分子晶体特点:低熔点、升华、硬度很小等。 3、常见分子晶体分类:(1)所有非金属氢化物 (2)部分非 金属单质, (3)部分非金属氧化物(4)几乎所有的酸(而碱 和盐则是离子晶体 (5)绝大多数有机物的晶体。 晶体分子结构特征
物质 熔点 沸点
干冰 很低 很低
金刚石 3550℃ 4827℃
二、原子晶体
1、定义:原子间以共价键相结合而形成的 空间网状结构的晶体。
2、构成微粒: 原子
3、微粒之间的作用:共价键 4、气化或熔化时破坏的作用力:共价键 5、物理性质: 熔沸点高,硬度大,难溶于一般溶剂。 (共价键键能越大,熔沸点越高,硬度越大)
(1)只有范德华力,无分子间氢键-分子密堆积(每 个分子周围有12个紧邻的分子,如:C60、干冰 、I2、O2 (2)有分子间氢键-不具有分子密堆积特征 (如:HF 、冰、NH3 )
1996年诺贝尔化学奖授予对发现C60有重大贡献的 三位科学家。C60分子是形如球状的多面体,分子 中每个碳原子只跟相邻的3个碳原子形成化学键; C60分子只含有五边形和六边形;碳与碳之间既有 单键又有双键,每个碳原子仍然满足四个价键饱 和;多面体的顶点数、面数和棱边数的关系,遵 循欧拉定理:顶点数+面数-棱边数=2。 请回答: (1)一个C60分子中有几个五边形和几个六边形? (2)一个C60分子中有多少个C=C? (3)已知C70分子的结构模型也遵循C60的那些规律, 请确定C70分子结构中上述几项参数。
四川大学近代化学基础第二章分子结构和晶体结构

几个有关的基本概念
什么是分子轨道?
Basic concept
分子轨道(molecular orbital): 描述分子中电子运动的 波函数,指具有特定能量的某电子在相互键合的两个或 多个原子核附近空间出现概率最大的区域,是多电子、 多中心的, 电子属于整个分子。分子轨道由原子轨道线性 组合而成 。例如: A+B→AB
对称性不同的则不能形成有效分子轨道,称它
为非键分子轨道。如 px-pz 。不能成键,称这种 组合为非键组合,形成非键分子轨道。
+
+ -
-
+
+ -
原子轨道的非键组合
成键三原则: ▲ 能量相近原理 决定成键的效率
▲ 最大重叠原理
▲ 对称性匹配
决定是否能成键
2 分子轨道的形成类型、形状和能量 由于原子轨道对称性不同,所以重叠而形 成的分子轨道类型也不一样,有对称性的原子 轨道重叠形成 σ 分子轨道,而反对称性的原子 轨道重叠形成π 分子轨道。 分子轨道都有对应的能量及形状,其能量 和形状取决于原子轨道的类型和原子轨道的重 叠情况。
(5) F2:(9×2=18电子)
KK(σ2s)2(σ*2s)2(σ2px)2(π2py)2(π2pz)2(π*2py)2 (π*2pz)2 BO=1.
2 *2 2 Li2 1s 1s 2 s 2 2 2 *2 Be2 1s 1s 2 s 2 s 2 *2 2 2 1 1 1 s 1 s B2 2s 2 s 2 p y 2 pz 2 *2 C2 1s 1s 2 2 2 2 2s 2 py 2 pz 2s 2 *2 2 N2 1s 1s 2 2 2 2 2 p 2s 2s 2 py 2 pz 2 *2 2 2 1 1 2 2 O2 12s 1 s 2 px 2 p y 2 p z 2s 2s 2 py 2 pz *2 2 2 2 2 2 2 2 F2 12s 1 s 2s 2 s 2 p 2 p y 2 pz 2 p 2 p y z 2 *2 Ne2 1s 1s 2 2 2 2 2 2 2 2 2p 2s 2s 2 py 2 pz 2p 2p 2p
物质的分子结构与性质知识点总结

物质的分子结构与性质知识点总结物质的分子结构与性质是化学学科中的基础知识,它们描述了物质的微观构成和宏观性质。
本文将分析和总结物质的分子结构与性质的相关知识点,帮助读者更好地理解和应用这些概念。
一、物质的分子结构物质的分子结构是指物质由不同类型的分子组成的方式。
分子是由原子通过共价键连接而成,它们以一定的方式排列和组合形成特定的物质。
下面是几个重要的物质分子结构的类型:1. 离子晶体:由正负离子通过电静力相互作用而形成的晶体结构。
例如,氯化钠晶体由钠离子和氯离子相互排列而成。
2. 共价晶体:由一种或多种元素通过共价键相连接而形成的晶体结构。
例如,金刚石由碳原子通过共价键连接而成。
3. 金属晶体:由金属元素形成的晶体结构,其中金属原子以海洋模型分布。
例如,铁、铜等金属的晶体结构。
4. 分子晶体:由分子通过范德华力相互作用而形成的晶体结构。
例如,石蜡由长链烷烃分子通过范德华力相互作用而形成。
通过研究物质的分子结构,我们能够了解物质的化学性质、物理性质以及其在实际应用中的可能用途。
二、物质的性质物质的性质是指物质表现出来的特定特征和行为,包括化学性质和物理性质。
下面是几个常见的物质性质:1. 化学性质:物质在发生化学变化时表现出来的特征。
例如,金属与酸反应产生氢气,这是金属的一种化学性质。
2. 物理性质:物质在不发生化学变化时表现出来的特征。
例如,密度、熔点和沸点等物质的物理性质可以用于鉴别和分类物质。
物质的性质直接与其分子结构相关。
原子种类、原子之间的连接方式以及分子之间的相互作用方式会影响物质的化学性质和物理性质。
三、物质的性质与应用物质的性质对其实际应用具有重要影响。
根据不同的性质,物质可以用于以下几个方面:1. 化学反应:物质的化学性质决定了其参与化学反应的能力。
通过控制物质之间的化学反应,可以制备新的物质、改变物质的性质以及满足人们对特定材料的需求。
2. 材料科学:不同物质的物理性质可以满足不同的需求。
得到晶体的方法和晶体的类型

得到晶体的方法和晶体的类型晶体是一种具有规则排列的分子结构的固体物质,具有高度有序性和周期性。
在化学、物理、材料科学等领域中,晶体的研究具有重要意义。
下面将介绍得到晶体的方法和晶体的类型。
得到晶体的方法主要有以下几种:1. 溶液结晶法:将固体物质溶解在溶剂中,随着溶剂挥发,溶质逐渐过饱和,晶体在溶液中析出并沉积。
这种方法适用于大多数无机晶体的生长。
2. 熔融结晶法:将固体物质加热至熔融状态,然后逐渐冷却,使溶质在凝固的过程中结晶形成。
这种方法适用于高熔点物质的晶体制备。
3. 气相沉积法:将气体源物质通过化学反应或物理过程转化为固态物质,沉积在基底表面形成晶体。
这种方法适用于高纯度和薄膜晶体的制备。
4. 溶剂挥发法:将溶质溶解在挥发性溶剂中,随着溶剂挥发,溶质逐渐过饱和,晶体在溶液中析出。
这种方法适用于有机晶体的制备。
5. 水热合成法:在高温高压的水热条件下,利用水的溶解性和热性质制备晶体。
这种方法适用于具有特殊结构和形貌的晶体。
晶体的类型可以根据晶体结构、晶体形貌、晶体化学成分等多方面进行分类。
根据晶体结构,晶体主要分为以下几类:1. 离子晶体:晶体的基本结构单元是离子,例如氯化钠晶体。
2. 共价晶体:晶体的基本结构单元是共价键,例如硅晶体。
3. 金属晶体:晶体的基本结构单元是金属原子,例如铜晶体。
4. 分子晶体:晶体的基本结构单元是分子,例如冰晶体。
此外,晶体还可以根据晶体的形貌进行分类,如立方晶体、四方晶体、六方晶体等。
晶体的种类繁多,每种晶体都具有独特的性质和应用价值,对晶体的研究和应用有着重要的意义。
总的来说,得到晶体的方法多种多样,可以根据晶体的性质和用途选择适合的方法。
晶体的类型也多种多样,可以根据晶体的结构和形貌进行分类,每种晶体都有其独特的特点和应用领域。
晶体的研究和应用将会为科学技术的发展带来更多的可能性和机遇。
分子和晶体的结构及性质

分子和晶体的结构及性质分子和晶体是物质的两种不同形态,它们在结构和性质上存在着显著的差异。
本文将分别讨论分子和晶体的结构以及它们的性质。
一、分子的结构及性质1. 分子的结构分子是由原子按照一定比例和方式组合而成的物质,在空间上呈现出三维的结构。
分子的结构由原子间的化学键连接所决定,可以是共价键、离子键或金属键。
此外,分子还可能存在分子间力,如范德华力和氢键。
2. 分子的性质分子性质主要受到分子内部化学键和分子间力的影响。
不同的分子由于其化学键和分子间力的差异,呈现出不同的性质。
例如,具有共价键的分子通常具有较低的沸点和熔点,而具有离子键的分子则在熔点上具有较高的特征。
二、晶体的结构及性质1. 晶体的结构晶体是由大量离子、原子或分子有规律地堆积而成的固体结构。
晶体的结构可以分为离子晶体、原子晶体和分子晶体三种类型。
离子晶体由正、负离子通过离子键相互结合而成;原子晶体由相同元素的原子通过共价键相互连接而成;分子晶体则是由分子通过范德华力和氢键相互结合而成。
2. 晶体的性质晶体的性质受到晶体结构的影响。
晶体的有序排列使得它们具有明确定义的外部形状和特征;晶体在物理性质上表现出一些特殊的性质,如各向同性、光学性质、电导性、热导性等。
三、分子和晶体的比较1. 结构比较分子的结构是由分子内部化学键构成的,分子间的连接相对较弱;晶体的结构则是由大量的原子或离子堆积形成的,分子间的连接比分子内部的连接更强。
2. 性质比较分子通常在相对较低的温度或压力下就可以发生相变,比如液化、固化等;而晶体具有更高的熔点和熔化热,需要更高的温度才能发生相变。
3. 应用比较分子和晶体根据其不同的结构和性质,具有不同的应用领域。
分子常用于化学反应媒介、溶剂、药物和有机材料等领域;晶体则广泛应用于电子器件、光学器件、半导体材料等领域。
结论分子和晶体是物质的两种不同形态,它们在结构和性质上存在着明显的差异。
分子通过分子内部的化学键相连而成,具有较低的熔点和熔化热;晶体由原子或离子有序堆积而成,具有更高的熔点和熔化热。
离子晶体分子晶体原子晶体的区别

离子晶体分子晶体原子晶体的区别
离子晶体、分子晶体和原子晶体都是晶体的类型,它们的区别主要在于晶体的组成和结构。
离子晶体是由正负离子通过离子键结合而成的晶体。
通常,离子晶体的成分是由金属离子和非金属离子组成的化合物。
离子晶体的结构可由阴离子和阳离子构成的空间排列组成。
这些空间交替排列,形成一种定期的三维晶格结构。
离子晶体的结构稳定,常常具有高熔点,高硬度和高电导率等特点。
分子晶体是由分子间通过范德华力相互作用形成的晶体。
通常,分子晶体的成分是由原子间共享电子而形成的分子。
这些分子通过弱的范德华力互相作用,并形成一种定期的三维晶格结构。
分子晶体的结构可由分子排列而成的晶格构成。
分子晶体的结构稳定,常常具有较低的熔点、较低的硬度和较低的电导率等特点。
原子晶体是由原子间通过金属键或共价键相互作用而形成的晶体。
通常,原子晶体的成分是由金属原子或非金属原子组成的晶体。
这些原子通过强的金属键或共价键相互作用,并形成一种定期的三维晶格结构。
原子晶体的结构可由原子排列而成的晶格构成。
原子晶体的结构稳定,常常具有高熔点、高硬度和良好的导电性能等特点。
总之,离子晶体、分子晶体和原子晶体的区别在于它们的组成和结构。
离子晶体
由离子间的离子键结合而成,分子晶体由分子间的范德华力相互作用形成,而原子晶体由原子间的金属键或共价键相互作用而形成。
晶体结构的种类与特点

晶体结构的种类与特点晶体是由具有高度有序排列的原子、离子或分子构成的固体物质。
其具有独特的晶体结构,不同的晶体可以根据其结构的不同特征进行分类。
本文将介绍晶体结构的种类与特点。
1. 晶体结构的分类晶体结构可以根据晶体中原子、离子或分子的排列方式来进行分类。
主要包括离子型、共价型和金属型晶体。
1.1 离子型晶体离子型晶体是由正负电荷相互吸引而形成的结晶体。
晶体中的阳离子和阴离子按照规则的阵列排列。
离子型晶体具有高熔点、硬度大和良好的导电性等特点。
常见的离子型晶体有NaCl、CaF2等。
1.2 共价型晶体共价型晶体是由共价键结合形成的晶体。
晶体中的原子通过共用电子来形成稳定的晶体结构。
共价型晶体具有较高的熔点和较硬的特点。
常见的共价型晶体有硅、金刚石等。
1.3 金属型晶体金属型晶体是由金属原子通过金属键结合形成的晶体。
金属型晶体具有良好的导电性和延展性,常见的金属型晶体有铁、铜等。
2.晶体结构的特点2.1 长程有序晶体中的原子、离子或分子具有长程有序的排列方式。
这种长程有序使得晶体在宏观上呈现出规则的几何形状。
晶体的这种有序性也决定了晶体的许多物理性质。
2.2 空间周期性晶体的结构具有空间周期性,即晶体的结构在空间上具有规则的重复性。
晶体中的基本结构单元称为晶胞,晶胞之间通过平移操作进行重复排列,形成整个晶体的结构。
这种空间周期性使得晶体具有各向同性和各向异性等不同的性质。
2.3 结构稳定性晶体的结构稳定性是指晶体在一定条件下能够保持其特定的晶体结构。
晶体结构的稳定性取决于各种内外因素,如晶体间的化学键强度、晶体的形成温度和压力等。
2.4 物理性质晶体的结构决定了晶体的物理性质。
晶体的物理性质包括熔点、硬度、导电性、光学性质等。
不同晶体结构的晶体物理性质也具有差异,从而为晶体的应用提供了多样化的选择。
结语:晶体是一种拥有高度有序排列的原子、离子或分子的固体物质。
晶体结构的种类主要包括离子型、共价型和金属型晶体。
2.2 晶体

4、性质:度、熔沸点较高,但差别较大; 硬
有良好的导电导热性和延展性。
同种晶体熔沸点的比较:
1. 离子晶体
组成相似的 离子电荷数越大 离子晶体 离子半径越小 例:NaCl > KCl; MgO > CaO 离子键越强
离子晶体的熔沸点越高
(一)金刚石和硅晶体——原子晶体
空间网状结构
金刚石
硬 金刚石是天然存在的最_____的物质,键角 共价键 109º28’ _______,每个C和___个C以______结合 4 正四面 成______体。金刚石中,最小环是__元环。 6 1:2 碳原子数: C—C键数:_______
比较金刚石和硅晶体:
3.微粒间作用力: 共价键
4.常见的原子晶体:金刚石、晶体硅、 二氧化硅、硼(B) 、 金刚砂(碳化硅)SiC
5.特征
(1)原子晶体是由原子直接构成,无单个 分子,只有化学式。 (2)硬度很大,熔沸点很高,难溶于一般 溶剂。 键长越短,键能越大,熔沸点越高。
(四) 金属晶体
1、定义: 通过金属键形成的晶体
方式如图,则该离子晶体的化学式是
AB3C
A : B : C = 1/8×8 : 12×1/4 : 1 = 1 : 3 : 1
(二)分子晶体
1、定义:分子间以范德华力相互结合而 形成晶体。
2、构成微粒: 分子或稀有气体原子 3、微粒间作用力: 范德华力(或还有氢键) 4、特点: (1)有单个分子存在,化学式就是分子式 (2)三态变化时只破坏分子间的作用力。
12. 最近,美国Lawrece Lirermore国家实验室(LLNL) 的L.Lota.C.S.Yoo和H.eynn成功地在高压下将CO2 转化为具有类似SiO2结构的原子晶体,下列关于 CO2的原子晶体说法正确的是( B ) A. CO2的原子晶体和分子晶体互为同素异形体
分子结构与晶体结构

【本讲教育信息】一. 教学内容:分子结构与晶体结构二. 教学目标了解化学键的含义,理解并掌握共价键的主要类型及特点,共价键、离子键及金属键的主要区别及对物质性质的影响。
能根据杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型,了解等电子体的含义。
了解原子晶体、分子晶体和金属晶体的结构特征,掌握不同晶体的构成微粒及微粒间的相互作用力,掌握影响晶体熔沸点、溶解性的因素。
三. 教学重点、难点分子结构与晶体结构的特点,影响物质熔沸点和溶解性、酸性的因素四. 教学过程(一)化学键与分子结构:1、化学键:相邻的两个或多个原子之间强烈的相互作用,通常叫做化学键。
配位键:配位键属于共价键,它是由一方提供孤对电子,另一方提供空轨道所形成的共价键,例如:NH4+的形成在NH4+中,虽然有一个N-H键形成过程与其它3个N-H键形成过程不同,但是一键长、键能决定共价键的强弱和分子的稳定性:原子半径越小,键长越短,键能越大,共价键按成键形式可分为σ键和π键两种,σ键主要存在于单键中,π键主要存在于双键、叁键以及环状化合物中。
σ键较稳定,而π键一般较不稳定。
共价键具有饱和性和方向性两大特征。
2、分子结构:价层电子对互斥理论:把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。
如CO2、CH2O、CH4另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
如H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。
因而H2O分子呈V型,NH3分子呈三角锥型。
杂化轨道理论:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。
据参与杂化的s轨道与p 轨道的数目,存在sp3、sp2、sp三种杂化。
2 直线 2 0 直线CO2、C2H23 三角形3 0 三角形BF3、SO32 1 V 形SnCl2、PbCl24 四面体4 0 四面体CH4、SO42-CCl4、NH4+ 3 1 三角锥NH3、PCl3 2 2 V形H2O、H2S说明:(1)等电子原理是指原子总数相同,价电子总数相同的分子或离子,对于主族元素而言,价电子就是其最外层电子数,即为最外层电子总数相等。
晶体结构

山东大学材料科学基础
S2-: 0 0 0; 0 ½ ½; ½ 0 ½; ½ ½ 0 Zn2+: ¼ ¼ ¾; ¼ ¾ ¼; ¾ ¼ ¼; ¾ ¾ ¾
结构型式 离 子 堆 积 描 述 化学组成比 n+/n负离子堆积方式 正负离子配位数比CN+/CN正离子所占空隙种类 正离子所占空隙分数 立方ZnS型 1:1 立方最密堆积 4:4 正四面体 1/2
钙钛矿型结构中离子间关系如下: 设A位离子半径为rA,B位离子半径为rB,O2-半径为 ro, rA+ro=√2(rB+ro) 但是,实际测定发现,A、B离子半径有一定的变 动范围,可表示为: 2rA+2ro=t √2(rB+ro) 式中,t为容忍因子, t=0.77∽1.10
山东大学材料科学基础
A与B离子的电价不限于2价和4价,任意一对阳 离子半径适合于配位条件,且其原子价之和为6, 则它们可能取这种结构。 钙钛矿型化合物化学计量比可以是A2+B4+O3(如 BaTiO3和PbZrO3)或是A3+B3+O3(如LaGaO ,LaAlO ); 也可以A1+B5+O3(如KNbO ,NaWO )或A1+B2+O3(KNiF ); 混合形式如Pb(Mg Nb )O 和Pb(Sc Ta )O 也是可能的。
山东大学材料科学基础
Ti Ba
四方BaTiO3结构中离子的位置,Ti离子向上位移
山东大学材料科学基础
从立方到四方转变温度称为居里点。 对于纯BaTiO3居里点为130℃。除BaTiO3外,许多晶体 都有自发极化,大多数铁电体结构都有氧八面体,氧八 面体空隙越大,其中金属离子半径越小、电荷越大,则 晶体就越容易发生自发极化。 在钙钛矿化合物中,居里点转变温度变化很大。如 PbTiO3,较大的Pb2+取代Ba2+,Ti4+的八面体环境更为不 安定,立方-四方转变温度是490℃;而SrTiO3居里点 只有-55℃。这可以解释成,Sr2+比Ba2+小,使得氧八 面体也小,可以将Ti稳定在体心位置。实际上,居里点 可以在一个很宽的范围连续的变化,通过在BaTiO3和 PbTiO3(提高Tc)或SrTiO3(降低Tc)之间形成固溶体。
分子与晶体了解分子与晶体的结构与性质差异

分子与晶体了解分子与晶体的结构与性质差异分子与晶体:了解分子与晶体的结构与性质差异在化学领域中,分子和晶体是两种具有不同结构和性质的物质形态。
分子是由原子通过共价键连接而成的,而晶体则由离子、原子或分子通过离子键、金属键或氢键等相互作用力组成。
本文将介绍分子和晶体的结构与性质的差异。
一、分子的结构与性质分子是由原子通过共价键连接而成的离散实体。
常见的分子化合物包括水分子(H2O)、二氧化碳分子(CO2)等。
以下是分子的结构与性质的主要特点:1. 结构:分子由原子共享电子而形成,形成分子中心的结构。
在分子中,原子通过化学键相互连接,形成稳定的分子结构。
2. 性质:分子在室温下通常以气体、液体或固体形式存在。
分子之间的吸引力较弱,因此分子间距离较大,具有较低的密度和较低的熔点和沸点。
分子间的相互作用力主要包括范德华力、氢键等。
3. 固有性质:分子具有特定的分子式、分子量和摩尔质量。
由于分子之间的结构和相互作用力的不同,不同分子表现出不同的化学和物理性质,如溶解性、燃烧性和化学反应性等。
二、晶体的结构与性质晶体是由离子、原子或分子通过离子键、金属键或氢键等相互作用力组成的固体结构。
晶体的结构与性质与分子有所不同,以下是晶体的主要特点:1. 结构:晶体具有有序的、重复的结晶格,其中离子、原子或分子按照一定规律排列。
晶体的结构由晶格参数、晶胞和晶体缺陷等组成。
2. 性质:晶体在室温下通常以固体形式存在,具有较高的密度和较高的熔点。
晶体中离子、原子或分子之间的相互作用力较强,具有较高的结构稳定性。
3. 固有性质:晶体具有特定的晶体结构,可以通过X射线衍射等技术来确定晶体结构。
晶体的各向同性和各向异性性质取决于晶体结构的对称性和晶胞的形式。
三、分子与晶体的差异分子和晶体之间存在着明显的结构和性质差异:1. 结构差异:分子是由原子通过共价键形成的离散结构,而晶体则是由离子、原子或分子通过相互作用力组成的周期性结构。
分子晶体和晶体结构

分子晶体和晶体结构分子晶体是由分子构成的晶体,相较于金属晶体或离子晶体,它具有较低的熔点和较弱的力学性能。
然而,由于分子晶体分子之间的弱相互作用力较强,使得其在化学、生物学和材料科学等领域具有重要的应用价值。
分子晶体的结构是指组成分子晶体的分子在空间中的排列方式。
不同的分子晶体具有不同的结构类型,不仅决定了表面的性质和特征,还决定了分子晶体的稳定性和性能。
以下将重点介绍几种常见的分子晶体结构。
1.简单分子晶体:简单分子晶体由相对较小的分子构成,例如水、氨等。
它们之间的相互作用力较弱,主要是由分子间的范德华力和氢键所弥补。
简单分子晶体可以是单一种类的分子晶体,也可以是由两种不同的分子按一定比例混合所形成的。
2.键合分子晶体:键合分子晶体由相对较大的分子构成,如蛋白质、脂肪酸等。
分子内的化学键较强,但分子之间的相互作用力较弱,主要是静电相互作用和范德华力。
键合分子晶体中的分子通常具有一定的方向性,能够形成六配位或八配位的结构。
3.非键合分子晶体:非键合分子晶体由大分子(如聚合物)构成,在空间中呈规则排列。
这种分子晶体由于分子内部的共价键较弱,分子之间的相互作用力通常是静电引力、疏水作用和范德华力。
非键合分子晶体通常具有特殊的电性、光学和热学性质。
4.共价晶体:共价晶体是由原子通过共享电子而形成键,这种晶体的形成需要条件比较苛刻。
例如,金刚石就是一种典型的共价晶体,由碳原子通过共价键形成。
共价晶体具有高硬度、高熔点和高折射率等特点。
分子晶体的结构可以通过多种方法确定,其中最常用的方法是X射线衍射和电子显微镜。
通过这些方法可以确定分子晶体中原子或分子的位置和相互作用方式,从而获得结构信息。
总之,分子晶体是由分子构成的晶体,它们的结构类型和相互作用方式对于其性质和应用具有重要的影响。
通过研究和了解分子晶体的结构,可以更好地理解其性质和行为,并进一步探索其在化学、生物学和材料科学等领域的应用潜力。
分子结构与晶体结构

NiCl42-、Ni(NH3)42+, 2个未成对电子,正四面体。
3d
4s
4p
28N i2+
N4 2 iC - l
[Co(NCS)4]2[CoCl4]2-
[Ni(CN)4]2-、[PtCl4]2-,键角90°,平面正方形。 d轨道无单电子。
3d
4s 4p
28N i2+ dsp2
3d
4s 4p
Ni(CN )42-
1. 能 量 共
EA Es
EA排 斥 态 ES基 态
价
键 E=0
的
-436kJ/m ol
形
成
核 间 距 R (pm )
R 0=74pm
氢分子的能量与核间距的关系曲线
+
+ ++ H2分子排斥态
+
++ -
H2基态 R0<2r
共价键的本质 自旋相反的成键电子的原子轨道重叠, 核间电子概率密度增大,引力增强。
稳定性
[FeF6]3-( )[Fe(CN)6]3-
[Co(en)3]3+( )[Co(en)3]2+
[FeF6]3-是( )自旋、( )轨型配离子。
中心离子 配 电子构型 位
数
Cu+ 、 Ag+ 、 2
Au+ (n-1)d10
4 Zn2+ 、 Cd2+ 、
Hg2+
(n-1)d10
Ni2+ d8
Co2+ d7
(2)轨道杂化时,原来成对的电子可以被 激发到空轨道上成单电子。
(3)n 个原子轨道组合成 n 个杂化轨道。
第三章晶体结构

三.其它晶体结构 1.金刚石结构
金刚石结构为面心立方格 子,碳原子位于面心立方的所 有结点位置和交替分布在立方 体内的四个小立方体的中心, 每个碳原子周围都有四个碳, 碳原子之间形成共价键。
一.面心立方紧密堆积结构
4. CaTiO3(钙钛矿)型结构 钙钛矿结构的通式为ABO3,其中,A2+ 、B4+或A1+ 、B5+金
属离子。CaTiO3在高温时为立方晶系,O2-和较大的Ca2+作面心 立方密堆,Ti4+填充于1/4的八面体空隙。Ca2+占据面心立方的 角顶位置。O2-居立方体六个面中心,Ti4+位于立方体中心。Z=1, CNCa2+=12 CNTi4+=6 ,O2-的配位数为6 (2个Ti4+和 4个Ca2+)。
一.面心立方紧密堆积结构 1. NaCl型结构
Cl-呈面心立方最紧密堆积,Na+则填充于全部的八面体空隙
中,(即阴离子位于立方体顶点和六个面的中心,阳离位于立
方 体 的 中 心 和 各 棱 的 中 央 ) 。 两 者 CN 均 为 6 , 单 位 晶 胞 中 含 NaCl的个数Z=4 ,四面体空隙未填充。
一.面心立方紧密堆积结构 2. β-ZnS(闪锌矿)型结构
S2-位于面心立方的结点位置,Zn2+交错地分布于立方体内 的1/8小立方体的中心,即S2-作面心立方密堆,Zn2+填充于1/2的 四面体空隙之中,CN均为4,Z=4。β -ZnS是由[ZnS4]四面体以 共顶的方式相连而成。
分子结构与晶体结构

分子结构与晶体结构首先,分子结构是由分子间的化学键连接而成的,是一种离散的、不规则的排列方式。
分子结构所组成的物质通常是气体、液体或溶液形态。
分子结构的特点包括:1.分子之间通过化学键连接,分子间力较弱,可以通过能量的变化来改变分子之间的位置。
2.分子结构可以是线性的、非线性的或者是支链状的。
3.分子之间的距离相对较远,一般在纳米的量级。
4.分子结构的稳定性相对较低,容易受到外界的影响。
相比之下,晶体结构是由原子或分子按照一定的规则、有序地排列而成的,是一种具有长程有序性的结构。
晶体结构所组成的物质通常是固体形态。
晶体结构的特点包括:1.晶体的构成基本单位是晶胞,晶胞通过晶格点连接而成。
2.晶体结构的排列方式有规律,具有周期性性质。
3.晶体结构的稳定性较高,分子之间的力较强,难以改变晶体的形态。
4.晶体结构中的原子或分子之间的距离较小,一般在埃的量级。
分子结构和晶体结构在形成机制上也有显著的不同。
分子结构的形成是由化学反应或物理性质导致的,当温度或其他条件变化时,分子之间的键连接可以相对容易地断裂或改变,从而形成新的分子结构。
而晶体结构的形成主要是由原子或分子之间的长程吸引力相互作用导致的,它们在结晶过程中会按照特定的规则排列,形成稳定的晶体结构。
分子结构和晶体结构在性质上也存在差异。
由于分子结构的离散性和分子之间较弱的连接力,分子结构的物质通常具有较低的熔点和沸点,并且容易变化。
而晶体结构由于原子或分子之间较强的相互作用力导致,晶体具有较高的熔点和沸点,并且在相变时需要吸收或释放较大的能量。
最后,分子结构和晶体结构在应用上有着不同的方向。
分子结构的应用主要集中在化学和生物领域,如有机合成、药物研发、生物大分子的结构与功能等。
而晶体结构的应用涉及到材料科学、能源存储、光电子学等领域,晶体结构的稳定性和周期性特征使其具有很高的物理性能和应用价值。
综上所述,分子结构和晶体结构是物质呈现不同组织形态的两种方式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
-
+
-
-
+
离子具有变形性,所以可以被电场极化。 离子作为带电微粒,自身又可以起电场作用,去使
其它离子变形。离子这种能力称为极化能力。
故离子有二重性:变形性和极化能力。
上页 下页 返回 帮助
第3章 分子结构与晶体类型
1、影响变形性的因素
第3章 分子结构与晶体类型
第3章 分子结构与晶体类型
上页
下页
返回
帮助
第3章 分子结构与晶体类型
学习内容 3.1 3.2 3.3 化学键 杂化轨道与分子构型 分子间力与氢键
3.4
晶体类型(离子极化)
上页
下页
返回
帮助
第3章 分子结构与晶体类型
学习要求
掌握晶体的类型、特点,了解离子极化概念,理解不同 晶体性质差异的原因及离子极化对物质性质的影响规律;能 判断分子间力、氢键及离子极化对物质物理性质影响。
若只考虑 Zn2+,Cd2+,Hg2+ 对I-的极化作用,应得出
ZnI2 的极化程度最大的结论。因为三者的电荷相等,电子 层结构相同,而 Zn2+的r 最小。 即ZnI2的熔点,沸点低,而HgI2的熔点,沸点高。 原因在于没有考虑Zn2+,Cd2+,Hg2+的变形性,没有考 虑相互极化。Zn2+ 的变形性最小, Hg2+ 的变形性最大。故相
上页
下页
返回
帮助
第3章 分子结构与晶体类型 分子间作用力 (Intermolecular Forces)
Type of interaction dipole-dipole Induced-dipole Typical energy(kJ/mol) 0~3 0~1 Interacting species polar molecules polar and nonpolar molecules
质差异很大。
例如: NaCl[r(Na+)=95pm]远比CuCl[r(Cu+) =96pm]在水中的溶解度大,这是由离子的极化引起的。
离子极化程度主要决定于阳离子极化作用和阴离子的 变形性。通常阳离子以极化作用为主;而阴离子以变形性 为主。
上页
下页
返回
帮助
第3章 分子结构与晶体类型 3.4 离子极化
Hg2+,Pb2+,Ag+
既考虑阳离子对阴离子的极化,又考虑阴离子对阳离子
的极化,总的结果称相互极化 。
I-,S2-
上页 下页 返回 帮助
第3章 分子结构与晶体类型
想一 想
为什么ZnI2、CdI2、HgI2从左到右,熔点和溶解度依
18e
次降低 。讨论ZnI2、CdI2、HgI2三者的离子极化问题?
上页 下页 返回 帮助
第3章 分子结构与晶体类型
例 1:测得 KBr 的 μ= 10.41 D,键长 282 pm,通过计算,
说明键的离子性百分数。
解: 282 pm=2.8210-10m,即2.82Å,由μ= qd,
故 q = μ/ d = 10.41 / ( 4.8 2.82 ) = 0.77 ( 电子的电量 )
上页
下页
返回
帮助
第3章 分子结构与晶体类型
2、影响极化能力的因素
与离子的电荷、半径和外层电子构型有关。 极化能力的实质是离子作为电场时电场强度的体现。 r 小则极化能力强,因此 H+ >Li + > Na+>K+>Rb+>Cs+。 r 相近时,电荷数越高极化能力越强。 Mg2 + ( 8e,65 pm ) < Ti4 + ( 8e,68 pm ) r 相近,电荷相同时,外层电子数越多,极化能力越强。
生极化现象。负离子的电子云变形,即负离子的电子被拉向 两核之间,使两核间的电子云密度增大。于是离子键的百分
数减少,共价键的百分数增大,离子键向共价键过渡。
离子极化的结果使离子晶体中出现离子对或分子单位 , 离子晶体向分子晶体过渡。这种过渡则使得物质的熔点,沸
点降低,在水中的溶解性降低。(影响物质的物理性质)
上页 下页 返回 帮助
第3章 分子结构与晶体类型
想一想
为什么氧化铝的熔点并不如氧化镁高?从 结构上可以解释吗?
从离子键强度考虑,Al2O3 + 3 对 -2 应比 MgO + 2 对
- 2的离子键强,m. p. 高。但事实并非如此。
这说明了 Al2O3 的共价成份比 MgO 大。
从离子极化理论考虑,因为 Al3+的极化能力强,造成 Al2O3 比 MgO 更倾向于分子晶体 。 离子键和共价键不是绝对的。
上页 下页 返回 帮助
第3章 分子结构与晶体类型
1、影响变形性的因素
(2)复杂阴离子变形性小 SO42-,ClO4-,NO3- r 虽大,但离子对称性高,中心 氧化数又高,拉电子能力强,不易变形。
综合考虑,变形性大的有 I-,S2-,Ag+,Hg2 +,Pb2 +; 变形性小的有 Be2+,Al3+,Si4+,SO42-等。
Dispersion Hydrogen bonds
8~25
5~30
all types of molecules N, O, F; the link is a shared H atom
化学键能约为:100~600 (kJ/mol)
上页 下页 返回 帮助
第3章 分子结构与晶体类型
【实例分析】某些离子半径相近,电荷相同的二元化合物性
原因是外层电子对核的中和较小,故有效电荷高些。 Pb2+,Zn2+(18,18+2)> >Fe2+,Ni2+(8~18)> >Ca2+,Mg2+(8e)
上页 下页 返回 帮助
第3章 分子结构与晶体类型
3、离子极化对化学键类型的影响
离子键是离子之间的引力。正离子的电子转移给了负离
子。当极化能力强的正离子和变形性大的负离子接近时,发
在 K+,Br-上的电荷不是 + 1,-1,而是 0.77,其余电
荷为共用,即为共价成份。故键的离子性百分数为 77% 。
上页
下页
返回
帮助
第3章 分子结构与晶体类型
4、相互极化(离子附加极化)
Al3+变形性极小。
Al2O3
想一想
Al3+的极化能力强。
正离子若不是8e的Al3+,而是(18+2)e 、18e的正离 子,是否要考虑自身的变形性?
阴离子的变形性主要决定于离子半径,其次是离子电荷。
(1)简单离子 F-< C1- < Br- < I-
r 大则变形性大,故阴离子的变形性显得主要。阳离子
中只有 r 相当大的如 Hg2+,Pb2+,Ag+等才考虑其变形性。 电荷数的代数值越大,变形性越小,如 Si4+<Al3+<Mg2+<Na+<(Ne)<F-<O2- 电子构型,外层; Ca2+ < Cd2+
