2018北京西城高三一模化学及参考答案
西城区2018-2018一模试题及答案

北京市西城区2019年4月高三理科综合 第1页(共10页)C 地球西 城 区 高 三 统 一 测 试理 科 综 合 2019.4本试卷共17页,共300分。
考试时长150分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
第一部分 (选择题 共120分)本部分共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
13.已知氡222的半衰期为3.8天。
那么的放射性物质氡222经过7.6天,还剩下没有发生衰变的质量为 A .2 g B .1gC .0.5gD .0 g14.关于热学中的一些基本概念,下列说法正确的是A .物体是由大量分子组成的,分子是不可再分的最小单元B .分子间的斥力和引力总是同时存在的,且随着分子之间的距离增大而增大C .分子做永不停息的无规则热运动,布朗运动就是分子的热运动D .宏观物体的温度是物体内大量分子的平均动能的标志15.如图所示,一颗卫星绕地球做椭圆运动,运动周期为T ,图中虚线为卫星的运行轨迹,A 、B 、C 、D 是轨迹上的四个位置,其中A 距离地球最近,C 距离地球最远。
B 和D 点是弧线ABC 和ADC 的中点,下列说法正确的是 A .卫星在C 点的速度最大 B .卫星在C 点的加速度最大C .卫星从A 经D 到C 点的运动时间为T/2 D .卫星从B 经A 到D 点的运动时间为T/216.一条绳子可以分成一个个小段,每小段都可以看做一个质点,这些质点之间存在着相互作用。
如图是某绳波形成过程的示意图。
质点1在外力作用下沿竖直方向做简谐运动,带动质点2、3、4… 各个质点依次振动,把振动从绳的左端传到右端。
t=T/2时,质点9刚要开始运动。
下列说法正确的是 A .t =T /2时,质点9开始向下运动 B .t =T /2时,质点5加速度方向向上 C .t =T /4时,质点5开始向上运动 D .t =T /4时,质点3的加速度方向向上4gt =0t =T /2北京市西城区2019年4月高三理科综合 第2页(共10页)17.如图所示,在水平面上有一个U 形金属框架和一条跨接其上的金属杆ab ,二者构成闭合回路且处于静止状态。
北京市西城区2018年高三一模化学试题

北京市西城区2018年高三一模化学试题。
可能用到的相对原子质量:H l C 12 N 14 O 1 6 Cl 35.5 Cu 64选择题在每小题列出的四个选项中,选出符合题目要求的一项。
1.下列变化过程中未必吸热的是____。
(A)电解质在熔融状态下电离(B)共价键断裂(C)原子失电子(D)溶解2.化学与生活密切相关,下列说法正确的是A.食盐可作调味剂B.CO2属于大气污染物C.柠檬很酸,属于酸性食物D.用聚氯乙烯塑料袋包装食品3.下列解释事实的方程式表达不.正.确.的是A.碳酸氢钠可作食品膨松剂:2NaHCO3 Na2CO3+ CO2↑+H2OB.铝制容器不能盛装碱液:2Al +2OH-+2H2O 2AlO2-+ 3H2↑C.氯气可用于消毒:Cl2+H2O 2H++ Cl-+ClO-D.过氧化钠可用于呼吸面具:2Na2O2 + 2CO2 2 Na2CO3 + O2↑4.图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。
下列说法不正确...的是图Ⅰ图ⅡA.图Ⅰ中a为纯铜B.图Ⅰ中SO42—向b极移动C.图Ⅱ中如果a、b间连接电源,则a连接负极D.图Ⅱ中如果a、b间用导线连接,则X可以是铜5.下列说法正确的是A.植物油的主要成分是高级脂肪酸B.银氨溶液可用于检验淀粉是否完全水解C .溴乙烷与氢氧化钠水溶液反应可制取乙烯D .丙氨酸(CH 3CHCOOH )缩聚产物的结构简式为6.实验:① 向盛有1 mL 0.1 mol/L MgCl 2溶液试管中加1 mL 0.2 mol/L NaOH 溶液,得到浊液a ,过滤得到滤液b 和白色沉淀c 。
② 向沉淀c 中滴加0.1mol/L FeCl 3溶液,沉淀变为红褐色。
下列分析不正确...的是 A .浊液a 中存在沉淀溶解平衡:Mg (OH) 2(s)Mg 2+(aq)+2OH -(aq)B .滤液b 中不含有Mg 2+C .②中颜色变化说明Mg (OH)2转化为Fe(OH)3D .实验可以证明Fe(OH)3比Mg (OH)2更难溶7.下列说法正确的是A .油脂都不能使溴水褪色B .氨基酸是两性化合物,能与酸、碱反应生成盐C .福尔马林可用作食品防腐剂D .蔗糖和麦芽糖的水解产物都是葡萄糖8.用下列各组仪器或装置,不能达到实验目的的是A .a 组:制备少量乙酸乙酯B .b 组:除去粗盐水中的泥沙C .c 组:用CCl 4提取碘水中的碘D .d 组:配制100 mL 1.00 mol/L NaCl 溶液 9.下列解释事实的离子方程式不正确的是 A .氯化钢溶液显酸性:B .氯气使湿润的淀粉KI 试纸变蓝:C .向硫酸铝溶液中加入氨水出现白色胶状沉淀:D .实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:10.已知16S 、34Se 位于同一主族,下列关系正确的是 A .热稳定性: B .原子半径:C .酸性:D .还原性:11.对常温下pH=3的CH 3COOH 溶液,下列叙述不正确的是 A .B .加入少量CH 3COONa 固体后,c (CH 3COO —)降低NH 2C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/LD.与等体积pH =11的NaOH溶液混合后所得溶液显酸性12.欲检验CO2气体中是否含有SO2、HC1,进行如下实验:①将气体通入酸化的AgNO3溶液中,产生白色沉淀a;②滤去沉淀a,向滤液中加入Ba(NO3)2溶液,产生白色沉淀b。
最新-2018年4月北京市西城区理综一模卷化学试题 精品

2018年北京市西城区理综一模卷化学试题 2018-4 可能用到的相对原子质量:H—1、C—12、O—16、Mg—24、S—32、Cl—35.5、Cu—64 6.某有机物小分子...含有C、H、O、N等元素,该有机物可能是A.脂肪B.葡萄糖C.蛋白质D.氨基酸7.“厨房化学”是指利用家庭生活用品来进行化学实验,从而对化学进行学习和探究的活动。
下列实验在厨房中不能..完成的是A.检验自来水中含有Cl—离子B.检验鸡蛋壳中含有碳酸盐C.检验加碘食盐中不含碘单质D.检验蛋白质在加热条件下能发生变性8.有M、R两种主族元素,已知R2—离子与M+离子核外电子数之和为20,则下列说法中不正确...的是A.R与M的质子数之和一定等于19B.若R处于第三周期,则M必处于第二周期C.R与M元素组成的某种离子化合物中存在非极性共价键D.R与M的质子数之差可能等于79.氢叠氮酸(HN3)与醋酸酸性相近。
氢叠氮酸盐(NaN3)稳定,但撞击发生爆炸生成氮气。
下列有关氢叠氮酸及其盐的说法中不正确...的是A.固体HN3属于分子晶体B.HN3的水溶液呈弱酸性C.NaN3的水溶液呈酸性D.NaN3可用于汽车防撞保护气囊10.阿伏加德罗常数的近似值为6.02×1023,下列说法中正确的是A.常温常压下,7.1 g Cl2含0.2×6.02×1023个Cl2分子B.同温同压下,相同体积的CO2和SO2所含氧原子数均为2×6.02×1023NH所含电子数约为6.02×1023个C.0.1 mol-2D.在16 g CH4中含有6.02×1023个C—H键11.已知反应:3A(g)+B(g) C(s)+4D(g),△H<0。
图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。
若使曲线b变为曲线a,可采取的措施是A.升高温度B.缩小反应容器的体积C.增加C的质量D.减小B的浓度12.锂电池是新一代高能电池,目前已研究成功多种锂电池。
2018年--西城区--高三化学-一模考试试题+答案

(1)A为烯烃,B中所含官能团名称是______,A→B的反应类型是______。
(2)C→D的反应条件是______。
(3)E分子中有2个甲基和1个羧基,E→F的化学方程式是______。
(4)D+F→K的化学方程式是______。
(5)下列关于J的说法正确的是______。
②棕色溶液中的[Fe(NO)]2+受热生成Fe2+,加热有利于Fe2+被氧化为Fe3+,促进Fe3+水解,产生Fe(OH)3沉淀
(3)①Fe2++NO2−+2CH3COOH==Fe3++NO↑+H2O+2CH3COO−
Fe2++NO==[Fe(NO)]2+
②两层液体界面上H+、NO3−与Fe2+反应,生成棕色的[Fe(NO)]2+
(4)右图为真空AlCl歧化法制备Al的实验装置示意图,控制
AlCl3的凝华装置、Al的生成装置和AlCl的制备装置的
温度分别为T1、T2、T3,其由高到低的顺序是______。
(5)制备Al的整个过程中可循环利用的物质是______。
27.(17分)某小组研究溶液中Fe2+与NO2−、NO3−的反应。
资料:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用______溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是______。
③进行实验Ⅱ,装置如下图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。
2018西城一模答案

西城区高三统一测试理科综合参考答案及评分标准2018.4第一部分共20小题,每小题6分,共120分。
6.D 7.A 8.C9.C 10.B11.B 12.C25~28题其他正确答案可参照本标准给分25.(12分,每空2分)(1)2CaCO 3+2SO 2+O 2=====2CaSO 4+2CO 2(2)4NH 3+6NO===== 5N 2+6H 2O(3)①②SO 2+ClO −+H 2O ==SO 42−+Cl −+2H +③SO 2在水中的溶解度大于NO ;SO 2在溶液中的还原性强于NO ;SO 2与NaClO 溶液的反应速率大于NO④2∶1326.(12分,每空2分)(1)①Al 2O 3(s) + 3C(s) + AlCl 3(g) == 3AlCl(g) + 3CO(g) ΔH =+1486 kJ ·mol −1 ②减小(2)第一步反应是气体分子数增加的反应,降低压强,利于生成AlCl(3)CO 与Al 或AlCl 反应生成Al 2O 3和C ;CO 在Al 或AlCl 作用下生成CO 2和C(4)T 3>T 2>T 1(5)AlCl 327.(17分,(3)①第二个离子方程式1分,其它每空2分)(1)①KSCN②两个实验过程均有O 2,但NaNO 3溶液中无明显变化③NO 2−+e −+H 2O== NO↑+2OH −证实Fe 2+被NO 2−氧化生成Fe 3+(2)①将NO 通入FeSO 4溶液中,溶液由浅绿色变黄色最后变棕色,将NO 通入Fe 2(SO 4)3高温 催化剂溶液中,无明显变化②棕色溶液中的[Fe(NO)]2+受热生成Fe2+,加热有利于Fe2+被氧化为Fe3+,促进Fe3+水解,产生Fe(OH)3沉淀(3)①Fe2++NO2−+2CH3COOH== Fe3++NO↑+H2O+2CH3COO−Fe2++NO== [Fe(NO)]2+②两层液体界面上H+、NO3−与Fe2+反应,生成棕色的[Fe(NO)]2+28.(17分,(1)第二空1分,其它每空2分)(1)碳碳双键、氯原子取代反应(2)NaOH/H2O,△(3)(4)(5)a(6)(7)(8)分)(1分)。
北京市2018届高三各城区一模化学试题分类汇编——有机化学word版含答案
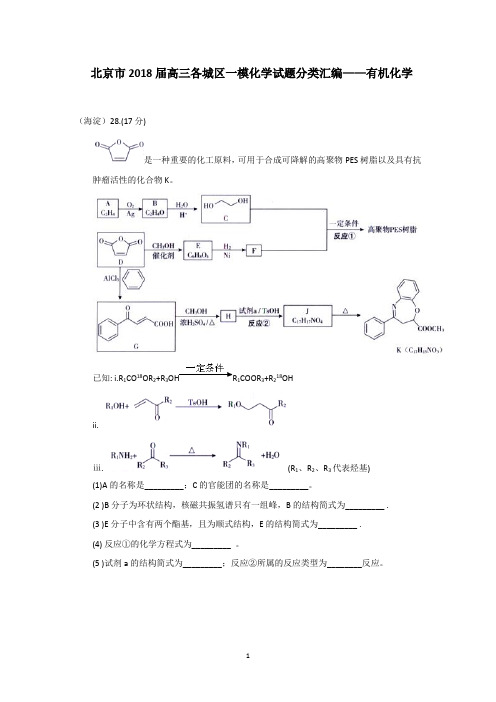
北京市2018届高三各城区一模化学试题分类汇编——有机化学(海淀)28.(17 分)是一种重要的化工原料,可用于合成可降解的高聚物PES 树脂以及具有抗肿瘤活性的化合物K。
已知: i.R1CO18OR2+R3OH R1COOR3+R218OHii.ⅲ. (R1、R2、R3代表烃基)(1)A的名称是_________;C 的官能团的名称是_________。
(2 )B 分子为环状结构,核磁共振氢谱只有一组峰,B 的结构简式为_________ .(3 )E 分子中含有两个酯基,且为顺式结构,E 的结构简式为_________ .(4) 反应①的化学方程式为_________ 。
(5 )试剂a的结构简式为_________;反应②所属的反应类型为________反应。
(6) 已知: 。
以1,3- 丁二烯为起始原料,结合已知信息选用必要的无机试剂合成。
将以下合成路线补充完整:(7)已知氨基(-NH 2) 与羟基类似,也能发生反应i 。
在由J 制备K 的过程中,常会产生副产物L 。
L 分子式为C 16H 13NO 3,含三个六元环,则L 的结构简式为________。
(朝阳)25.(17分)有机物P 是某抗病毒药物的中间体,它的一种合成路线如下。
XN(C 4H 8O 2)Br 2ⅰ.NaOH ⅱ.H+Y浓HNO 3M (C 4H 10O)A(C 7H 8)O 2催化剂浓H 2SO 4,△B 氧化还原NCH 3COOH一定条件有机物PF (C 4H 6O 3)E (C 7H 7NO)DPBr3连续氧化MnO 2已知:+CO一定条件RN C +H 2OCO H +CH 2CO 一定条件CH CCO+H 2ORNH 2(1)A 为芳香化合物,其结构简式是 。
(2)A →B 的化学方程式是 ,反应类型是 。
(3)M 无支链,N 中含有的官能团是 。
(4)M 连续氧化的步骤如下:M 转化为Q 的化学方程式是________。
2018北京西城高三一模化学及参考标准答案2018.4

西城区高三统一测试理科综合 ---化学部分2018.46.我国出土的文物呈现了瑰丽的历史文化。
下列文物中,主要成分属于合金的是A.西夏佛经纸本B.西汉素纱禅衣 C.唐兽首玛瑙杯 D.东汉青铜奔马7.下列延长食品保质期的方法中,其原理与其它几种不.同.的是A.加食盐腌制 B.抽真空C.充氮气D.使用吸氧剂8.下列事实不能..用元素周期律解释的是A.F2在暗处遇H2爆炸,I2在暗处遇H2几乎不反应B.Br2和NaI溶液发生置换反应,和NaCl溶液不发生置换反应C.金属Na和熔融KCl反应置换出金属KD.常温下,NaCl溶液的pH=7,AlCl3溶液的pH<79.向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。
下列关于上述过程的说法不正确...的是A.Cu2+是H2O2分解反应的催化剂B.H2O2既表现氧化性又表现还原性C.Cu2+将H2O2还原为O2D.发生了反应Cu2O + H2O2 +4H+ ==2Cu2+ + 3H2O10.我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。
反应过程示意图如下:下列说法不正确...的是A.Cu纳米颗粒将氢气解离成氢原子B.DMO分子中只有碳氧单键发生了断裂C.反应过程中生成了MG和甲醇D.EG和甲醇不是同系物11.下列解释事实的方程式书写正确的是A.Na2CO3溶液处理水垢中的CaSO4:Ca2++ CO32− == CaCO3↓B.Na2O2作呼吸面具的供氧剂:2Na2O2 +2CO2==2 Na2CO3+ O2C.稀HNO3洗涤做过银镜反应的试管:Ag+ 2H+ + NO3− ==Ag+ +NO2↑ + H2O D.FeCl3溶液腐蚀线路板:Fe3+ + Cu == Fe2+ + Cu2+12.某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:下列实验分析中,不正确...的是A.①说明Cl2被完全消耗B.②中试纸褪色的原因是:SO2+I2+ 2H2O==H2SO4 +2HIC.③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42−D.实验条件下,品红溶液和SO2均被氧化25.(12分)为消除燃煤烟气中含有的SO2、NOx,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
2018北京西城高三一模化学及参考答案

西城区高三统一测试理科综合 ---化学部分6.我国出土的文物呈现了瑰丽的历史文化。
下列文物中,主要成分属于合金的是A.西夏佛经纸本B.西汉素纱禅衣C.唐兽首玛瑙杯D.东汉青铜奔马7.下列延长食品保质期的方法中,其原理与其它几种不.同.的是A.加食盐腌制 B.抽真空 C.充氮气 D.使用吸氧剂8.下列事实不能..用元素周期律解释的是A.F2在暗处遇H2爆炸,I2在暗处遇H2几乎不反应B.Br2和NaI溶液发生置换反应,和NaCl溶液不发生置换反应C.金属Na和熔融KCl反应置换出金属KD.常温下,NaCl溶液的pH=7,AlCl3溶液的pH<79.向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。
下列关于上述过程的说法不正确...的是A.Cu2+是H2O2分解反应的催化剂B.H2O2既表现氧化性又表现还原性C.Cu2+将H2O2还原为O2D.发生了反应Cu2O + H2O2 + 4H+ == 2Cu2+ + 3H2O10.我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。
反应过程示意图如下:下列说法不正确...的是A.Cu纳米颗粒将氢气解离成氢原子B.DMO分子中只有碳氧单键发生了断裂C.反应过程中生成了MG和甲醇D.EG和甲醇不是同系物11.下列解释事实的方程式书写正确的是A.Na2CO3溶液处理水垢中的CaSO4:Ca2+ + CO32− == CaCO3↓B.Na2O2作呼吸面具的供氧剂:2Na2O2 + 2CO2 == 2 Na2CO3 + O2C.稀HNO3洗涤做过银镜反应的试管:Ag + 2H+ + NO3− == Ag+ + NO2↑ + H2OD.FeCl3溶液腐蚀线路板:Fe3+ + Cu == Fe2+ + Cu2+12.某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:下列实验分析中,不正确...的是A.①说明Cl2被完全消耗B.②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HIC.③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42−D.实验条件下,品红溶液和SO2均被氧化25.(12分)为消除燃煤烟气中含有的SO2、NO x,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
2018西城区高中高三一模化学试卷习题及答案

2021西城区高三一模化学试卷及答案第2 页共20 页第3 页共20 页第4 页共20 页C.反响过程中生成了MG和甲醇D.EG和甲醇不是同系物11.以下解释事实的方程式书写正确的选项是A.Na2CO3溶液处理水垢中的CaSO4:Ca2++CO32-==CaCO3↓B.Na2O2作呼吸面具的供氧剂:2Na2O2+2CO2==2Na2CO3+O2 C.稀HNO3洗涤做过银镜反响的试管:Ag+2 H -++NO3 ==Ag+NO2↑+H2OD.FeCl3溶液腐蚀线路板:Fe3++Cu==Fe2++Cu2+12.某同学向SO2和Cl2的混合气体中参加品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:序号①②③实验操作实验溶液不变红,溶液不变生成白现象试纸不变蓝红,试纸褪色沉淀第5页共20页色以下实验分析中,不正确的是...A.①说明Cl2被完全消耗B.②中试纸褪色的原因是:SO2+I2+2H2O==H2SO4+2HIC.③中假设将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42-D.实验条件下,品红溶液和SO2均被氧化25.〔12分〕为消除燃煤烟气中含有的SO2、NO x,研究者提出了假设干烟气“脱硫〞、“脱硝〞的方法。
〔1〕向燃煤中参加适量石灰石,高温时将SO2转化为CaSO4的化学方程式是______________________________________________________。
2〕选择性催化复原法〔SCR〕“脱硝〞。
在催化剂的作用下,选取复原剂将烟气中的NO进行无害化处理。
NH3复原NO的化学方程式是。
〔3〕以NaClO溶液作为吸收剂进行一体化第6页共20页“脱硫〞、“脱硝〞。
控制溶液的pH=,将烟气中的SO2、NO转化为SO42-、NO3-,均为放热反响。
①在图1中画出“放热反响〞的反响过程中的能量变化示意图。
【化学】2018年1月北京市西城区高三期末化学试题及答案

北京市西城区2018学年度第一学期期末试卷高三化学 2018.1第Ⅰ卷(选择题 共42分)每小题只有1个选项符合题意。
1.某简易净水器如右图所示。
下列说法中,正确的是 A .净水过程中发生了化学变化 B .该净水器能杀菌消毒 C .活性炭的主要作用是吸附杂质 D .净化后的水属于纯净物【答案】C【考查方向】水的净化 【易错点】需要了解净化水的常用方法的操作原理,才能正确掌握净化水的常用方法,这对解答此类问题尤其重要. 【解题思路】A .简易净水器在净水过程中,未生成新的物质;B .要达到杀菌消毒的效果,需要加入消毒剂;C .活性炭有吸附性,可以吸附有异味的物质或悬浮物;D .要达到净化后的水属于纯净物的效果,应进行蒸馏操作. 【解析】A .简易净水器在净水过程中,未生成新的物质,净水过程中未发生化学变化,A 错误;B .要达到杀菌消毒的效果,需要加入消毒剂,而图示净水器中不含有消毒剂,则该净水器不能起到杀菌消毒的效果,B 错误;C .活性炭有吸附性,可以吸附有异味的物质或悬浮物,因此活性炭的主要作用是吸附杂质,C 正确;D .要达到净化后的水属于纯净物的效果,应进行蒸馏操作,该装置净化后得到的水中含有可溶性的钙镁化合物等,属于混合物,不是纯净物,D 错误. 故选C .2.丙烯是一种常见的有机物。
下列有关丙烯的化学用语中,不正确...的是 A .实验式 CH 2 B .结构简式 CH 2=CHCH 3 C .球棍模型 D .聚合后的结构简式 【答案】D【考查方向】常见的化学用语 【易错点】熟练掌握常见化学用语的书写。
【解题思路】A .丙烯是一种常见的有机物,分子式为C 3H 6,实验式 CH 2 ;B .丙烯含一个碳碳双键,结构简式 CH=CHCH ; C-CH 2-CH -CH3- [ ] nD.聚合后的结构简式。
【解析】A.丙烯是一种常见的有机物,分子式为C3H6,实验式CH2,A正确;B.丙烯含一个碳碳双键,结构简式CH=CHCH,B正确;C C正确;D.聚合后的结构简式,D错误。
2018.1 北京市西城区高三化学年级第一学期期末练习 ( 化学)

北京市西城区2017 — 2018学年度第一学期期末高三化学2018.1本试卷共8页,共100分。
考试时长120分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32第Ⅰ卷(选择题共42分)每小题只有1个选项符合题意。
1.下列所加物质的作用与其还原性有关的是AB C D腌咸菜加氯化钠食用盐中加碘酸钾红酒中添加SO2泡打粉加碳酸氢钠2.下列属于吸热反应的是A.氧化钙与水反应B.铁丝在氧气中燃烧C.NaOH溶液与盐酸反应D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应3.乙酸是一种常见的有机物。
下列有关乙酸的化学用语中,不正确...的是A.实验式:CH2O B.比例模型:C.甲基的电子式:D.电离方程式:CH3COOHCH3COO-+ H+4.下列事实不能..用元素周期律解释的是A.酸性:HClO4 > H2SO3B.碱性:NaOH> Mg(OH)2C.气态氢化物的稳定性:H2O > H2S D.Cl2从NaBr溶液中置换出Br25.下列关于自然界中氮循环(如右图)的说法不正确...的是A.人工固氮可以得到硝酸盐B.细菌对氮元素的循环有重要作用C.雷电作用可以将氮气直接转化为铵盐D.亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化6.下列说法正确的是A.1 mol NH3中含有的质子数约为6.02×1023B.0.5 mol·L−1 NaCl溶液中含Cl-的物质的量为0.5 molC.8 g S在足量O2中完全燃烧转移的电子数约为9.03×1023D.标准状况下,22.4 L SO2和CO2的混合气体所含原子数约为1.806×10247.咖啡酸具有较广泛的抑菌作用,其结构简式如下。
下列关于咖啡酸的说法不正确...的是A.能发生加聚反应B.能与溴水发生反应C.能与H2发生加成反应D.1 mol咖啡酸最多消耗1 mol NaOH8的原子。
(完整版)2018-2019北京市西城高三化学一模试题(可编辑修改word版)

2019 西城区高三统一测试理科综合2019.4 本试卷共17 页,共300 分。
考试时长150 分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
第一部分(选择题共120 分)6.2019 年政府工作报告提出要持续开展大气污染的治理攻坚。
下列不属于大气污染防治措施的是7.下列说法不涉及氧化还原反应的是A.雷雨肥庄稼——自然固氮B.从沙滩到用户——由二氧化硅制晶体硅C.千千年,湿万年,不干不湿就半年——青铜器、铁器的保存D.灰肥相混损肥分——灰中含有碳酸钾,肥中含有铵盐8.Pd/A12O3催化H2还原CO2的机理示意图如下。
下列说法不正确的是A.H-H 的断裂需要吸收能量B.①-②,CO2发生加成反应C.④中,CO 被氧化为CH4D.生成CH4的总反应方程式是9.有机物AB2、AB4、AB8均可形成枝状高分子AB m。
下列说法不正确的是A.AB2分子中有4 种不同化学环境的氢原子B.AB4既能与强酸反应也能与强碱反应C.AB2生成AB m是缩聚反应D. AB m的结构简式是10.下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)11.在不同条件下进行化学反应2A(g)=B(g)+D(g),B、D 起始浓度均为0,反应物A 的浓度(mol/L)随反应时间的变化情况如下表:3下列说法不正确的是A.①中B 在0~20 min 平均反应速率为8.25xl0-3 moI.L-l.min-lB.②中K-0.25,可能使用了催化剂C.③中y= 1.4 moI.L-lD.比较①、④可知,该反应为吸热反应12.(NH4)2SO3氧化是氨法脱硫的重要过程。
某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如下图。
下列说法不正确的是A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关B.60℃之后,氧化速率降低可能与02的溶解度下降及(NH4)2SO3受热易分解有关C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO 2-水解程度增大有关D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关25.(17 分)度鲁特韦可以用于治疗HIV-1 感染,M 是合成度鲁特韦的一种中间体。
北京市西城区2017-2018学年高三一模化学试卷 Word版含解析

2017-2018学年北京市西城区高三一模化学试卷一、单选题(共7小题)1.下列物质与类别不对应的是()A.A B.B C.C D.D考点:物质的分类答案:B试题解析:A.小苏打的化学式为NaHCO3是酸式盐,属于盐,A项正确;B.食用油的主要成分为高级脂肪酸甘油酯,分子量较小,不属于高分子化合物,B项错误;C.淀粉属于多糖,C项正确;D.84消毒液的成分为NaCl和NaClO,属于混合物,D项正确。
2.下列事实不能用元素周期律解释的是()A.气态氢化物的稳定性:HBr > HIB.0.1 mol•L-1溶液的pH:NaOH > LiOHC.向Na2SO3溶液中加盐酸,有气泡产生D.Mg、Al与同浓度盐酸反应,Mg更剧烈考点:元素周期律答案:C试题解析:A.同一主族从上到下,气态氢化物的稳定性依次减弱,则稳定性HBr>HI,能用元素周期律解释,故A正确;B.同一主族从上到下,金属性逐渐增强,氢氧化物的碱性逐渐增强,碱性NaOH>LiOH,则同浓度的两种溶液,NaOH溶液的pH较大,能用元素周期律解释,故B正确;C.Na2SO3与盐酸反应生成SO2,强酸制取弱酸,能够证明酸性:HCl>H2SO3,不能体现元素周期律,故C不正确;D.同周期从左到右,金属性逐渐减弱,金属单质的还原性逐渐减弱,因此Mg比Al与等浓度的盐酸反应更剧烈,能用元素周期律解释,故D正确。
3.Na2CO3俗称纯碱,是基本化工原料。
下列涉及的方程式中,正确的是()A.Na2O2与CO2反应生成B.Na2CO3溶液呈碱性C.Na2CO3溶液除去CH3COOC2H5中的CH3COOH CO32-+2H+= CO2↑+H2OD.饱和Na2CO3溶液处理水垢中的CaSO4CO32-+CaSO4 = CaCO3+SO42-考点:元素及其化合物答案:D试题解析:A反应的化学方程式为,因此,A错误。
B.由于是多元弱酸的正盐,水解显碱性且分步进行,水解方程式为,因此,B错误;C.由于乙酸是弱酸,在离子方程式中写化学式,方程式为,因此,C错误;D.由于CaSO4的溶解度大于CaCO3,发生沉淀转化,反应为CO32-+CaSO4=CaCO3+SO42-,因此,D正确。
2018年北京市西城区中考化学一模试卷

。
(3)由实验 2 得出“KI 变质一定与 O2 有关”的结论,依据的两个实验是 编号)。
(填
(4)由实验 2 推知,KI“泛黄”变质的条件是
。
III.依据初步结论,深入探究变质的条件
实验 3:分别取相同浓度的 KI 溶液进行实验,在空气中放置相同时间,现象如下表。
编
①
②
③
④
⑤
号
实 验
溶
无色
浅黄色黄色(依次加深)
方程式是
。
。
(2)用装置 A、E 制取氧气。选用装置 (2)用装置 B、C 制取二氧化碳。检验二
E 收集氧气的原因是
。
氧化碳已收集满的操作是
。
第5页(共9页)
20.(2 分)“去除粗盐中难溶性杂质”的实验操作如图所示:
(1)正确的操作顺序是
(填序号).
(2)操作 B 中,用玻璃棒不断搅拌的目的是
.
(5)下列说法正确的是
。
A.采用清水浸泡去除农药的时间不宜过长
B.多数洗洁精对农药的清洗效果比清水浸泡的好
C.食用碱的去除效果较好,是因为在浸泡过程中农药发生了化学变化
18.(4 分)工业上制造高纯度 CaO 的主要流程示意图如图:
(1)CaCO3 中碳元素的化合价是
。
(2)反应釜中发生的反应属于复分解反应,其化学方程式是
洗洁精清洗。实验选择了 6 种洗洁精进行测试,结果表明,多数洗洁精对农药的去除率
可达到 60%以上,最高可达到 84%。
碱性溶液浸泡。食用碱(Na2CO3 和 NaHCO3) 溶液有利于农药分解。图 2 表示不同 浓度的食用碱溶液对农药去除率的影响。
希望同学们可以选择科学的清洗方法,更加安全的食用蔬菜。依据文章内容,回答下列
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
西城区高三统一测试
理科综合 ---化学部分
6.我国出土的文物呈现了瑰丽的历史文化。
下列文物中,主要成分属于合金的是
7.下列延长食品保质期的方法中,其原理与其它几种不.同.的是
A.加食盐腌制 B.抽真空 C.充氮气 D.使用吸氧剂
8.下列事实不能
..用元素周期律解释的是
A.F2在暗处遇H2爆炸,I2在暗处遇H2几乎不反应
B.Br2和NaI溶液发生置换反应,和NaCl溶液不发生置换反应
C.金属Na和熔融KCl反应置换出金属K
D.常温下,NaCl溶液的pH=7,AlCl3溶液的pH<7
9.向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液
变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复
多次。
下列关于上述过程的说法不正确
...的是
A.Cu2+是H2O2分解反应的催化剂
B.H2O2既表现氧化性又表现还原性
C.Cu2+将H2O2还原为O2
D.发生了反应Cu2O + H2O2 + 4H+ == 2Cu2+ + 3H2O
10.我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。
反应过程示意图如下:
下列说法不正确
...的是
A.Cu纳米颗粒将氢气解离成氢原子
B.DMO分子中只有碳氧单键发生了断裂
C.反应过程中生成了MG和甲醇
D.EG和甲醇不是同系物
11.下列解释事实的方程式书写正确的是
A.Na2CO3溶液处理水垢中的CaSO4:Ca2+ + CO32− == CaCO3↓
B.Na2O2作呼吸面具的供氧剂:2Na2O2 + 2CO2 == 2 Na2CO3 + O2
C.稀HNO3洗涤做过银镜反应的试管:Ag + 2H+ + NO3− == Ag+ + NO2↑ + H2O
D.FeCl3溶液腐蚀线路板:Fe3+ + Cu == Fe2+ + Cu2+
12.某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
下列实验分析中,不正确
...的是
A.①说明Cl2被完全消耗
B.②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C.③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42−
D.实验条件下,品红溶液和SO2均被氧化
25.(12分)为消除燃煤烟气中含有的SO2、NO x,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
(1)向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4的化学方程式是______。
(2)选择性催化还原法(SCR)“脱硝”。
在催化剂的作用下,选取还原剂将烟气中的NO 进行无害化处理。
NH3还原NO的化学方程式是______。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。
控制溶液的pH=,将烟气中的SO2、NO转化为SO42−、NO3−,均为放热反应。
①在图1中画出“放热反应”的反应过程中的能量变化示意图。
图1
②NaClO溶液吸收烟气中SO2的离子方程式是______。
③一定时间内,温度对硫、硝脱除率的影响曲线如图2,SO2的脱除率高于NO,可能
的原因是______(写出1种即可)。
图2
④烟气中SO2和NO的体积比为4∶1,50℃时的脱除率见图2,则此吸收液中烟气转
化生成的NO3−和Cl−的物质的量之比为______。
26.(12分)以铝土矿(主要成分为Al2O3)为原料,用真空氯化亚铝(AlCl)歧化法,无需进行分离提纯,直接制备金属Al。
其反应过程主要由两步组成,如下图:
(1)已知:
Al2O3 (s) + 3C (s) 2Al (l) + 3CO (g) ΔH=+1346 kJ·mol− 1
3AlCl (g)AlCl3 (g) + 2Al (l) ΔH=−140 kJ·mol− 1
①第一步反应的热化学方程式是______。
②第二步AlCl分解反应的化学平衡常数K随温度升高而______(填“增大”、“不
变”或“减小”)。
(2)第一步是可逆反应,选择在接近真空条件下进行,其原因是______。
(3)第二步反应制备的Al 中含有少量C ,可能的原因是______(不考虑未反应的C ,写出
1种即可)。
(4)右图为真空AlCl 歧化法制备Al 的实验装置示意图,控制
AlCl 3的凝华装置、Al 的生成装置和AlCl 的制备装置的 温度分别为T 1、T 2、T 3,其由高到低的顺序是______。
(5)制备Al 的整个过程中可循环利用的物质是______。
27.(
2+2−3−
资料: [Fe(NO)]2+
在溶液中呈棕色。
(1)研究现象a 中的黄色溶液。
①用______溶液检出溶液中含有Fe 3+。
②甲认为是O 2氧化了溶液中的Fe 2+。
乙认为O 2不是主要原因,理由是______。
③进行实验Ⅱ,装置如下图。
左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO 。
产生NO 的电极反应式是______。
实验Ⅱ的目的是______。
(2)研究现象a 中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a 中溶液变为棕色可能是NO 与溶液中的Fe
2+
或Fe 3+
发生了反应。
进行实验Ⅲ,证实溶液呈棕色只是因为Fe 2+
与NO 发生了反应。
实验Ⅲ的操作和现象是______。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶
液中有红褐色沉淀生成。
解释产生红褐色沉淀的原因是______。
(3)研究酸性条件下,溶液中Fe2+与NO2−、NO3−的反应。
①ⅰ中溶液变为棕色的离子方程式是______、______。
②ⅲ中出现棕色的原因是______。
实验结论:本实验条件下,溶液中NO2−、NO3−的氧化性与溶液的酸碱性等有关。
28.(17分)M()是牙科粘合剂, X是高分子金属离子螯合剂,以下是两种物质的合成路线:
已知:R、R1、R2代表烃基或其他基团
(1)A为烯烃,B中所含官能团名称是______,A→B的反应类型是______。
(2)C→D的反应条件是______。
(3)E分子中有2个甲基和1个羧基,E→F的化学方程式是______。
(4)D+F→K的化学方程式是______。
(5)下列关于J的说法正确的是______。
a.可与Na2CO3溶液反应
b.1 mol J与饱和溴水反应消耗8 mol Br2
c.可发生氧化、消去和缩聚反应
(6)G分子中只有1种氢原子,G→J的化学方程式是______。
(7)N的结构简式是______。
(8)Q+Y→X的化学方程式是______。
西城区高三统一测试
化学参考答案及评分标准
第一部分共20小题,每小题6分
6.D 7.A 8.C 9.C 10.B
11.B 12.C
25~28题其他正确答案可参照本标准给分 25.(12分,每空2分)
(1)2CaCO 3+2SO 2+O 2 ===== 2CaSO 4+2CO 2 (2)4NH 3+6NO===== 5N 2+6H 2O (3)①
②SO 2+ClO −
+H 2O == SO 42−
+Cl −
+2H +
③SO 2在水中的溶解度大于NO ;SO 2在溶液中的还原性强于NO ;SO 2与NaClO 溶液的反应速率大于NO ④2∶13
26.(12分,每空2分)
(1)①Al 2O 3(s) + 3C(s) + AlCl 3(g) == 3AlCl(g) + 3CO(g) ΔH =+1486 kJ ·mol − 1
②减小
(2)第一步反应是气体分子数增加的反应,降低压强,利于生成AlCl (3)CO 与Al 或AlCl 反应生成Al 2O 3和C ;CO 在Al 或AlCl 作用下生成CO 2和C (4)T 3> T 2> T 1 (5)AlCl 3
27.(17分,(3)①第二个离子方程式1分,其它每空2分)
高温
催化剂
(1)①KSCN
②两个实验过程均有O2,但NaNO3溶液中无明显变化
③NO2−+e−+H2O== NO↑+2OH−
证实Fe2+被NO2−氧化生成Fe3+
(2)①将NO通入FeSO4溶液中,溶液由浅绿色变黄色最后变棕色,将NO通入Fe2(SO4)3溶液中,无明显变化
②棕色溶液中的[Fe(NO)]2+受热生成Fe2+,加热有利于Fe2+被氧化为Fe3+,促进Fe3+水解,
产生Fe(OH)3沉淀
(3)①Fe2++NO2−+2CH3COOH== Fe3++NO↑+H2O+2CH3COO−
Fe2++NO== [Fe(NO)]2+
②两层液体界面上H+、NO3−与Fe2+反应,生成棕色的[Fe(NO)]2+
28.(17分,(1)第二空1分,其它每空2分)
(1)碳碳双键、氯原子取代反应
(2)NaOH/H2O,△
(3)
(4)
(5)a
(6)
(7)
(8)。
