20172018西城高三化学期末及答案
2018年北京市西城区高三化学期末试卷评析

2018年北京市西城区高三化学期末试卷评析本试卷共有16道选择题,6道大题,题型与往年一致。
西城区期末考试是全区统一考试,继期中考试之后,持续进行知识全面性诊断与检测。
本卷主要考察学生一轮复习的化学基础知识、基本技能及化学思想方法的掌握及落实情况;检验高三一轮复习的化学教学状况,发现知识漏洞、能力缺陷、解题方法问题。
本次考试主要考察的知识点有:化学与生活、氧化还原反应、离子反应、元素周期律、反应热、化学平衡、电化学、有机化学、化学实验。
期末后学校将安排复习基础实验和探究实验。
本试卷总体难度,相比往年稍微增加,没有偏题、难题。
期末考试涉及多角度关联,系统、动态分析,侧重关键能力提升,送分题较少。
同时稳中有变,变中出新,加大了对分析、解决、探究能力等科学素养的考察。
这就要求学生要提高提取信息能力,从多个角度分析思考问题。
化学实验因还没有系统复习,探究实验部分主要注重反应现象的推理以及实验目的的把握,情境较为陌生,但难度并不大。
有机推断题信息虽跟去年高考一致,但反应涉及成环,难度略微增大。
一、内容较常规各模块分值分布:从卷面看,各模块的考查特点如下:1.基本概念:分值略有提高,考查依然侧重基础知识,难度不大。
2.基本理论:较 2017 年分值有所减少,但分值依然很高,重难点的考查基本不变。
在掌握核心知识点的基础上,熟练运用。
3.元素化合物:分值与往年基本持平,知识较零散,在理综试卷中的考查综合性很强,是实验题的基础,为避免知识漏洞,需要形成知识体系并加强综合应用。
4.有机化学基础:分值变化不大(14+9分),3个选择和1个推断大题,推断大题虽然结构较为复杂,但分解起来难度不高,虽考察陌生信息反应的逆推过程,但正推所学内容的推断思路也是可以达到目的的。
有机题目主要考查学生对有机基础的掌握,考察学生的思维迁移能力以及逆推思维。
5.化学实验基础:实验题目的考查分值有所增加,注重了化学学科思想的重要性,需要学生具有扎实的学科基础、分析能力、一定的化学思想及把握实验目的。
2017-2018西城高三化学期末答案

北京市西城区2017—2018学年度第一学期期末试卷高三化学参考答案及评分标准第Ⅰ卷(选择题 共42分)1~6小题,每小题2分;7~16小题,每小题3分。
第Ⅱ卷(非选择题 共58分)说明:其他合理答案均可参照本标准给分。
17.(共6分)(1)①Na 2SO 4 + 2NH 4HCO 3== 2NaHCO 3↓+ (NH 4)2SO 4 (2分)②+135.6(1分)(2)H 2SO 4溶液(1分) 2H + + 2e – == H 2↑或2H 2O+ 2e – == H 2↑+ 2OH −(2分) 18.(共6分)(1)将I − 氧化成I 2(或作氧化剂)(2分) (2)A (1分)(3)萃取、分液(1分)(4)5I −+ IO 3− + 6H + == 3I 2 + 3H 2O (2分) 19.(共10分)(1)负(1分) CH 3OH — 6e − + H 2O == C O 2 + 6H + (2分) (2)①32322(CH OH)(H O)(CO )(H )c c c c ⋅⋅(1分)②b (1分)③<(1分) 温度升高,甲醇的平衡产率降低(2分) ④温度升高,I 、II 的反应速率均加快,但对II 的反应速率的影响更大。
(2分)20.(每空1分,共12分)(1)CoCO 3 + H 2SO 4 == CoSO 4 + CO 2↑+ H 2O将Co 3+还原为Co 2+(或作还原剂) (2)①65℃~75℃、pH0.5~1.5②pH 升高后溶液中c (H +)浓度下降, 使得溶解CoO(OH)、CoCO 3、Cu 2(OH)2CO 3的能力下降(3)ClO3− + 6Fe2+ + 6H+ == Cl− + 6Fe3+ + 3H2O (2分)(4)KSCN溶液溶液不变红色(5)调节溶液的pH 富集Co2+(生成CoCO3沉淀)(6)CaF2(7)过滤、洗涤21.(每空2分,共10分)(1)S2− + H2O HS− + OH−(2)黑色沉淀还可能是FeS和S,或Fe2S3、FeS和S的混合物,与稀盐酸反应也有相同现象(3)Fe2S3的溶解度比Fe(OH)3更小(4)Fe2S3 + 4H+ == 2Fe2+ + S↓+ 2H2S↑(5)试剂的相对用量、反应体系的酸碱性22.(共14分)(1)羧基、羟基(每空1分)(22分)(3)取代反应(2分)(4)(2分)(5)①NaOH水溶液,加热(1分)(2分)(2分)(6)(1分)。
17-18西城高三化学期末试题及答案

北京市西城区2017 — 2018学年度第一学期期末试卷高三化学 2018.1本试卷共8页,共100分。
考试时长120分钟。
考生务必将答案写在答题纸上,在试卷上作答无效。
考试结束后,将本试卷和答题纸一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32第Ⅰ卷(选择题 共42分)每小题只有1个选项符合题意。
1.下列所加物质的作用与其还原性有关的是红酒中添加SO 2.下列属于吸热反应的是A .氧化钙与水反应B .铁丝在氧气中燃烧C .NaOH 溶液与盐酸反应D .Ba(OH)2·8H 2O 晶体与NH 4Cl 晶体反应 3.乙酸是一种常见的有机物。
下列有关乙酸的化学用语中,不正确...的是 A .实验式:CH 2O B .比例模型:C .甲基的电子式:D .电离方程式:CH 3COOH CH 3COO -+ H +4.下列事实不能..用元素周期律解释的是 A .酸性:HClO 4 > H 2SO 3 B .碱性:NaOH > Mg(OH)2C .气态氢化物的稳定性:H 2O > H 2SD .Cl 2从5.下列关于自然界中氮循环(如右图)的说法不正确...A .人工固氮可以得到硝酸盐B .细菌对氮元素的循环有重要作用C .雷电作用可以将氮气直接转化为铵盐D .亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化6.下列说法正确的是A.1 mol NH3中含有的质子数约为6.02×1023B.0.5 mol·L−1 NaCl溶液中含Cl-的物质的量为0.5 molC.8 g S在足量O2中完全燃烧转移的电子数约为9.03×1023D.标准状况下,22.4 L SO2和CO2的混合气体所含原子数约为1.806×10247.咖啡酸具有较广泛的抑菌作用,其结构简式如下。
下列关于咖啡酸的说法不正确...的是A.能发生加聚反应B.能与溴水发生反应C.能与H2发生加成反应D.1 mol咖啡酸最多消耗1 mol NaOH8.的原子。
【经典试卷】2017-2018学年度高中化学期末考试及答案

【经典试卷】2017-2018学年第四次阶段性考试化学试题绝密★启用前【经典试卷】2017-2018学年第四次阶段性考试化学试题可能用到的相对原子质量:H l C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39Fe 56 Cu 64 Ag 108 Zn 65一、选择题:本题共18小题,每小题3分,共54分。
在每小题给出的四个选项中,只有一个选项是符合题目要求的。
1.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。
下列图示对应的操作规范的是【】2.设NA为阿伏加德罗常数的值,下列对0.3 mol·L-1K2SO4溶液的叙述正确的是【】A.1 L溶液中含有0.3N A个K+B.1 L溶液中含有K+和SO2-4的总数为0.9N AC.2 L溶液中K+的浓度为1.2 mol·L-1D.将0.3 mol硫酸钾溶于1 L水中,所得硫酸钾溶液的浓度为0.3 mol·L-13.两种金属混合物共15 g,投入足量的盐酸中,充分反应后得到11.2 L H2(标准状况),则原混合物的组成肯定不可能为【】A.Mg和Ag B.Zn和Cu C.Al和Zn D.Al和Cu4.由反应物X转化为Y和Z的能量变化如图所示。
下列说法正确的是【】A.由X→Y反应的ΔH=E5-E2 B.由X→Z反应的ΔH>0C.降低压强有利于提高Y的产率D.升高温度有利于提高Z的产率5.下列各组物质能真实表示物质分子组成的是 【 】A .NO 、C 2H 5OH 、HNO 3、I 2B .CaO 、N 2、HCl 、H 2OC .NH 3、H 2S 、Si 、COD .CO 2、SiO 2、CH 3COOH 、H 2SO 46. 500 mL 2 mol·L -1 FeCl 3溶液和500 mL 2 mol·L -1明矾溶液分别滴入沸水中,加热制成甲、乙两种分散系,经测定,甲分散系中分散质的粒子直径大小在1~100 nm 之间,乙分散系中分散质的粒子直径大小在10-9~10-7 m 之间。
北京市西城区2017 — 2018学年度第二学期期末试卷

北京市西城区2017 — 2018学年度第二学期期末试卷高一化学 2018.7本试卷共8页,共100分。
考试时长90分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
可能用到的相对原子质量:H 1C 12O 16Na 23Cl 35.5Fe 56第一部分(选择题 共50分)每小题只有一个选项.符合题意(1 ~ 10小题,每小题2分;11 ~ 20小题,每小题3分) 1. 下列设备工作时,将化学能转化为电能的是硅太阳能电池干电池 燃气灶 太阳能集热器2.下列各组元素中,属于同一周期的是A .Na 、AlB .C 、Cl C .N 、MgD .O 、S 3.下列营养物质中,属于高分子的是 A .蔗糖 B .油脂 C .蛋白质 D .葡萄糖 4.工业上常用电解法冶炼的金属是 A .Na B .FeC .CuD .Ag5.下列有机物属于烃的是A .C 2H 6B .CH 3CH 2OHC .CH 3COOHD .CH 3COOCH 2CH 36.下列氢氧化物中,碱性最强的是A .LiOHB .NaOHC .KOHD .RbOH7.下列关于甲烷的说法中,不正确.的是 A .难溶于水B .比空气密度小C .是天然气的主要成分D .能使酸性高锰酸钾溶液褪色8.下列物质与水混合、振荡后静置,不出现.分层现象的是 A .苯B .乙醇C .四氯化碳D .乙酸乙酯..... .. ..9.下列说法正确的是A .酸性:H 2SO 4 < H 3PO 4B .金属性:Ca > KC .半径:S < ClD .非金属性:N > P 10.甲基丙烯酸甲酯是合成有机玻璃的重要原料,新旧合成方法如下:旧合成方法:(CH 3)2C=O+HCN(CH 3)2C(OH)CN(CH 3)2C(OH)CN+CH 3OH+H 2SO 4CH 2=C(CH 3)COOCH 3+NH 4HSO 4Pd新合成方法:CH 3C≡CH+CO+ CH 3OH CH 2=C(CH 3)COOCH 3下列叙述中,正确的是 A .甲基丙烯酸甲酯属于高分子 B .新合成方法的原料无爆炸危险 C .新合成方法的原料利用率高 D .新合成方法的原料都是无毒物质 11.某元素X 的气态氢化物化学式为XH 3,其最高价氧化物的水化物的化学式可能为 A .H 2XO 3B .HXO 3C .HXOD .H 2XO 4 12.与OH -具有相同电子总数和质子总数的微粒是A .K +B . Na +C . F -D .Ne 13.下列物质中,既含有离子键又含有共价键的是A .H 2SO 4B .NaOHC .MgCl 2D .NaCl14. 下列化学用语表达不正确.的是 A .乙烷的结构简式:CH 3CH 3 B .中子数为10的氧原子: O C .CO 2的电子式:D .Cl -的结构示意图:15.已知反应:2H 2O 2= 2H 2O+ O 2↑,若其它条件不变,下列措施不能.加快该反应速率的是 A .升高温度B .加水稀释H 2O 2溶液C .加入少量FeCl 3溶液D .加入少量MnO 2粉末16.下列有关糖类、油脂、蛋白质的说法中,不.正确.的是 A .灼烧蚕丝织物有烧焦羽毛的气味 B .油脂是产生能量最高的营养物质C .将碘化钾溶液滴在土豆片上,可观察到蓝色D .利用油脂在碱性条件下的水解,可以制肥皂17.A 、B 均是短周期元素,它们的离子A -和B 2+具有相同的核外电子层结构,下列说法正确的是A .原子序数 A >B B .电子数 A >BC .原子半径 A >BD .离子半径 A ->B 2+18 818.实验室中,从海带里提取碘的部分流程如下图,下列说法不正确.的是A.步骤①灼烧海带需要用坩埚B.步骤③主要操作为过滤C.步骤④主要反应为:2I-+H2O2+2H+=2H2O+I2D.步骤⑤可以加入酒精萃取I219.铝热反应的实验装置如图。
北京市西城区2017-2018学年高一下学期期末考试化学试卷含答案

北京市西城区2017 — 2018学年度第二学期期末试卷高一化学2018.7本试卷共8页,共100分。
考试时长90分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
可能用到的相对原子质量:H 1C 12O 16Na 23Cl 35.5Fe 56第一部分(选择题共50分)每小题只有一个选项.符合题意(1 ~ 10小题,每小题2分;11 ~ 20小题,每小题3分) 1.下列设备工作时,将化学能转化为电能的是 硅太阳能电池 干电池 燃气灶 太阳能集热器2.下列各组元素中,属于同一周期的是A .Na 、AlB .C 、ClC .N 、MgD .O 、S 3.下列营养物质中,属于高分子的是 A .蔗糖B .油脂C .蛋白质D .葡萄糖 4.工业上常用电解法冶炼的金属是 A .NaB .FeC .CuD .Ag 5.下列有机物属于烃的是 A .C 2H 6B .CH 3CH 2OHC .CH 3COOHD .CH 3COOCH 2CH 3 6.下列氢氧化物中,碱性最强的是 A .LiOHB .NaOHC .OHD .RbOH 7.下列关于甲烷的说法中,不正确.的是 A .难溶于水B .比空气密度小C .是天然气的主要成分D .能使酸性高锰酸钾溶液褪色 8.下列物质与水混合、振荡后静置,不出现.分层现象的是 ....... ..A.苯B.乙醇C.四氯化碳D.乙酸乙酯高一化学第二学期期末试卷第1页(共8页)9.下列说法正确的是A .酸性:H 2SO 4< H 3PO 4B .金属性:Ca >C .半径:S < ClD .非金属性:N > P10.甲基丙烯酸甲酯是合成有机玻璃的重要原料,新旧合成方法如下: 旧合成方法:(CH 3)2C=O+HCN(CH 3)2C(OH)CN(CH 3)2C(OH)CN+CH 3OH+H 2SO 4CH 2=C(CH 3)COOCH 3+NH 4HSO 4 Pd新合成方法:CH 3C ≡CH+CO+ CH 3OHCH 2=C(CH 3)COOCH 3 下列叙述中,正确的是A .甲基丙烯酸甲酯属于高分子B .新合成方法的原料无爆炸危险C .新合成方法的原料利用率高D .新合成方法的原料都是无毒物质11.某元素的气态氢化物化学式为H 3,其最高价氧化物的水化物的化学式可能为 A .H 2O 3B .HO 3C .HOD .H 2O 412.与OH -具有相同电子总数和质子总数的微粒是 A .+B . Na +C . F -D .Ne13.下列物质中,既含有离子键又含有共价键的是 A .H 2SO 4B .NaOHC .MgCl 2D .NaCl 14. 下列化学用语表达不正确.的是 A .乙烷的结构简式:CH 3CH 3B .中子数为10的氧原子: O C .CO 2的电子式:D .Cl -的结构示意图:15.已知反应:2H 2O 2= 2H 2O+ O 2↑,若其它条件不变,下列措施不能.加快该反应速率的是A .升高温度B .加水稀释H 2O 2溶液C .加入少量FeCl 3溶液D .加入少量MnO 2粉末16.下列有关糖类、油脂、蛋白质的说法中,不.正确.的是 A .灼烧蚕丝织物有烧焦羽毛的气味 B .油脂是产生能量最高的营养物质C .将碘化钾溶液滴在土豆片上,可观察到蓝色D .利用油脂在碱性条件下的水解,可以制肥皂17.A 、B 均是短周期元素,它们的离子A -和B 2+具有相同的核外电子层结构,下列说法..188..正确的是A.原子序数A>BB.电子数A>B C.原子半径A>BD.离子半径A->B2+ 高一化学第二学期期末试卷第2页(共8页)18.实验室中,从海带里提取碘的部分流程如下图,下列说法不正确.的是A.步骤①灼烧海带需要用坩埚B.步骤③主要操作为过滤C.步骤④主要反应为:2I-+H2O2+2H+=2H2O+I2D.步骤⑤可以加入酒精萃取I219.铝热反应的实验装置如图。
2018年北京西城区高三上学期期末考试化学试题

北京市西城区2018年第一学期期末试卷高三化学可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cu 64第Ⅰ卷(选择题 共42分)每小题只有1个选项符合题意。
1.用N A 表示阿伏加德罗常数,下列叙述正确的是 A .46 g 乙醇中含有的化学键数为7 N AB .1 mol 氯气和足量NaOH 溶液反应转移电子数为2 N AC .1 mol OH - 和1 mol -OH (羟基)中含有的质子数均为 9 N AD .10 L 0.1 mol·L -1 的Na 2CO 3溶液中,Na +、CO 32- 总数为3 N A2.下列说法正确的是A .右图可表示水分解过程中的能量变化B .若2C(s)+O 2(g)=2CO(g) △H = -221.0 kJ/mol ,则碳的燃烧热为110.5 kJ/molC .需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应D .已知:Ⅰ:对于反应:H 2(g)+Cl 2(s)=2HCl (g) △H = - a kJ/mol ,Ⅱ且a 、b 、c 均大于零,则断开1 mol H-Cl 键所需的能量为- a-b-c3.右图是用0.1000 mol·L -1 NaOH 溶液滴定20.00 mL 未知浓度盐酸(酚酞做指示剂)的滴定曲线。
下列说法正确的是 A .水电离出的氢离子浓度:a>bB .盐酸的物质的量浓度为0.0100 mol·L -1C .指示剂变色时,说明盐酸与NaOH 恰好完全反应D .当滴加NaOH 溶液10.00 mL 时,该混合液的pH= 1+lg34.下列相关反应的离子方程式书写正确的是A .氢氧化铁溶于氢碘酸:Fe(OH)3+3H + = Fe 3++3H 2OB .硫酸铜溶液显酸性:Cu 2+ + 2H 2O == Cu(OH)2↓+ 2H +C .向碳酸氢铵溶液中加过量石灰水并加热:NH 4++OH - = NH 3↑+H 2OD .用酸化的高锰酸钾溶液氧化双氧水:2MnO 4-+6H ++5H 2O 2 = 2Mn 2++5O 2↑+8H 2O5.下列实验方案不可行...或结论不正确...的是 A .用润湿的pH 试纸测定饱和Na 2CO 3溶液pH△B .通过观察右图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀C .向Mg(OH)2悬浊液中滴加FeCl 3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2D .向同pH 、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H 2体积比较两种酸的电离程度:醋酸<盐6.在密闭容器中进行反应:A(g)+3B(g)2C(g),有关下列图像说法的不正确...的是A .依据图aB .在图bC .若正反应的△H <0,图cD .由图d 应的△H >07.下列说法正确的是A .4.2 g 丙烯中所含的共价键数目为0.6×6.02×1023B .含1 mol H 2SO 4的浓硫酸与足量铜反应转移的电子总数为6.02×1023C .相同条件下,1 L CO 和H 2的混合气体完全燃烧消耗0.5 L O 2D .相同物质的量OH -和CH 3+含有相同数目的电子8.下列解释实验事实的反应方程式不正确...的是 A .盛放烧碱的试剂瓶不能用玻璃塞:SiO 2+2NaOH =Na 2SiO 3+H 2O B .用烧碱溶液吸收氯气:Cl 2+2OH -=Cl -+ClO -+H 2O C .用KSCN 溶液检验F e 3+:Fe 3++3SCN - Fe(SCN)3D .酸性KI 淀粉溶液久置后变蓝:4I -+O 2+2H 2O =2I 2+4OH -9.已知四种盐的溶解度(S)曲线如右图所示,下列说法不正确的是 A .将NaCl 溶液蒸干可得NaCl 固体 B .将MgCl 2溶液蒸干可得MgCl 2固体 C .Mg(ClO 3)2中混有少量NaCl 杂质,可 用重结晶法提纯D .可用MgCl 2和NaClO 3制备Mg(ClO 3)210.绿原酸的结构简式如图,下列有关绿原酸的说法不正确...的是 MaA.分子式为C16H18O9B.能与Na2CO3反应C.能发生取代反应和消去反应D.0.1 mol绿原酸最多与0.8 mol NaOH反应11.下表中各组物质不能..实现如图转化的是12.常温下,下列各组比值为1∶2的是A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比13.用黄色的FeCl3溶液分别进行下列实验,解释或结论不正确...的是14.X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。
北京市西城区2017—2018学年度第一学期期末高三化学

北京市西城区2017 — 2018学年度第一学期期末高三化学2018.1本试卷共8页,共100分。
考试时长120分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32第Ⅰ卷(选择题共42分)每小题只有1个选项符合题意。
1.下列所加物质的作用与其还原性有关的是A B C D腌咸菜加氯化钠食用盐中加碘酸钾红酒中添加SO2泡打粉加碳酸氢钠2.下列属于吸热反应的是A.氧化钙与水反应B.铁丝在氧气中燃烧C.NaOH溶液与盐酸反应D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应3.乙酸是一种常见的有机物。
下列有关乙酸的化学用语中,不正确...的是A.实验式:CH2O B.比例模型:C.甲基的电子式:D.电离方程式:CH3COOH CH3COO-+ H+4.下列事实不能..用元素周期律解释的是A.酸性:HClO4 > H2SO3B.碱性:NaOH> Mg(OH)2C.气态氢化物的稳定性:H2O > H2S D.Cl2从NaBr溶液中置换出Br25.下列关于自然界中氮循环(如右图)的说法不正确...的是A.人工固氮可以得到硝酸盐B.细菌对氮元素的循环有重要作用C.雷电作用可以将氮气直接转化为铵盐D.亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化6.下列说法正确的是A.1 mol NH3中含有的质子数约为 6.02×1023B.0.5 mol·L-1 NaCl溶液中含Cl-的物质的量为0.5 molC.8 g S在足量O2中完全燃烧转移的电子数约为9.03×1023D.标准状况下,22.4 L SO2和CO2的混合气体所含原子数约为 1.806×1024高三化学第一学期期末试卷第1页(共10页)7.咖啡酸具有较广泛的抑菌作用,其结构简式如下。
下列关于咖啡酸的说法不正确...的是A.能发生加聚反应B.能与溴水发生反应C.能与H2发生加成反应D.1 mol咖啡酸最多消耗 1 mol NaOH8.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中●和○代表不同元素的原子。
北京西城区2017届高三化学上学期期末试题有答案

北京西城区2017届高三化学上学期期末试题(有答案)北京市西城区2016—2017学年度第一学期期末试卷高三化学2017.1试卷满分:100分考试时间:120分钟第Ⅰ卷(选择题共42分)每小题只有1个选项符合题意。
1.某简易净水器如右图所示。
下列说法中,正确的是A.净水过程中发生了化学变化B.该净水器能杀菌消毒C.活性炭的主要作用是吸附杂质D.净化后的水属于纯净物2.丙烯是一种常见的有机物。
下列有关丙烯的化学用语中,不正确的是A.实验式CH2B.结构简式CH2=CHCH3C.球棍模型D.聚合后的结构简式3.下列说法中,不正确的是A.油脂水解的产物中一定含甘油B.糖类、油脂和蛋白质都属于高分子化合物C.氨基酸既能与盐酸反应,也能与NaOH反应D.医疗上用75%的酒精消毒是因为其能使蛋白质变性4.25℃时,下列有关0.1molL-1醋酸溶液的说法中,正确的是A.pH=1B.c(H+)=c(CH3COO-)C.加入少量CH3COONa固体后,醋酸的电离程度减小D.与0.1molL-1NaOH溶液等体积混合后所得溶液显中性5.下列有关SO2的说法中,不正确的是A.溶于水能导电,属于电解质B.使品红溶液褪色,有漂白性C.使酸性高锰酸钾溶液褪色,有还原性D.能杀菌、消毒,可按照国家标准用作食物的防腐剂6.2SO2(g)+O2(g)2SO3(g)ΔH=akJmol-1,反应能量变化如图所示。
下列说法中,不正确的是A.a<0B.过程II可能使用了催化剂C.使用催化剂可以提高SO2的平衡转化率D.反应物断键吸收能量之和小于生成物成键释放能量之和7.下列离子方程式中,不正确的是A.用NaOH溶液除去铝箔表面的氧化膜Al2O3+2OH-2AlO2-+H2OB.向AlCl3溶液中加入过量氨水Al3++3NH3H2OAl(OH)3↓+3NH4+C.用胃舒平(复方氢氧化铝)缓解胃酸(HCl)过多OH -+H+H2OD.向污水中投放明矾,生成能凝聚悬浮物的胶体Al3++3H2OAl(OH)3(胶体)+3H+8.利用右图所示装置可以将温室气体CO2转化为燃料气体CO。
北京市西城区2017-2018学年度第一学期期末试卷

北京市西城区2017 – 2018学年度第一学期期末试卷高三化学2018.1可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32第Ⅰ卷(选择题 共42分)每小题只有1个选项符合题意。
ABD红酒中添加SO 2.下列属于吸热反应的是A .氧化钙与水反应B .铁丝在氧气中燃烧C .NaOH 溶液与盐酸反应D .Ba(OH)2·8H 2O 晶体与NH 4Cl 晶体反应 3.乙酸是一种常见的有机物。
下列有关乙酸的化学用语中,不正确...的是 A .实验式:CH 2O B .比例模型: C . D .电离方程式:CH 3COOH CH 3COO -+ H +4.下列事实不能..用元素周期律解释的是 A .酸性:HClO 4 > H 2SO 3 B .碱性:NaOH > Mg(OH)2 C .气态氢化物的稳定性:H 2O > H 2S D .Cl 25.下列关于自然界中氮循环(如右图)的说法不正确... A .人工固氮可以得到硝酸盐 B .细菌对氮元素的循环有重要作用 C .雷电作用可以将氮气直接转化为铵盐D 6.下列说法正确的是 A .1 mol NH 3中含有的质子数约为6.02×1023B .0.5 mol ·L − 1 NaCl 溶液中含Cl -的物质的量为0.5 molC .8 g S 在足量O 2中完全燃烧转移的电子数约为9.03×1023D .标准状况下,22.4 L SO 2和CO 2的混合气体所含原子数约为1.806×1024 7.咖啡酸具较广泛的抑菌作用,其结构简式如下。
下列关于咖啡酸的说法不正确...的是 A .能发生加聚反应 B .能与溴水发生反应 C .能与H 2发生加成反应D .1 mol 咖啡酸最多消耗1 mol NaOH8.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中●和○代表不同元素的原子。
高三试题—2017-2018学年北京西城区高三上学期期末化学试卷解析

(2) 1 Fe2S3 + 4H+ = 2Fe2+ + S ↓ +2H2S ↑
2 试剂的相对用量、反应体系的酸碱性
22. 【答案】(1)1.羧基 2.羟基
(2)
(3)取代反应 (4)
(5) 1 NaOH 水溶液,加热
23(6)来自(5)1.调节溶液的 pH
2.富集 Co2+(生成 CoCO3 沉淀) (6)CaF2 (7)过滤、洗涤
21. 【答案】(1)
1 2−
−
−
S + H2O ⇌ HS + OH
2 黑色沉淀还可能是 FeS 和 S,或 、 Fe2S3 FeS 和 S 的混合物,与稀盐酸反应也有相同现象
3 Fe2S3 的溶解度比 Fe(OH)3 更小
19. 【答案】(1)1.负
2.CH3OH − 6e− + H2O = CO2 + 6H+ (2) 1 c(CH3OH) ⋅ c(H2O)
c(CO2) ⋅ c3(H2)
2b
3 1.<
2.温度升高,甲醇的平衡产率降低
4 温度升高,Ⅰ 、Ⅱ的反应速率均加快,但对Ⅱ的反应速率的影响更大。
20. 【答案】(1)1.CoCO3 + H2SO4 = CoSO4 + CO2 ↑ +H2O 2.将 Co3+ 还原为 Co2+(或作还原剂)
选择题
1. 【答案】C 2. 【答案】D 3. 【答案】C 4. 【答案】A 5. 【答案】C 6. 【答案】D 7. 【答案】D 8. 【答案】A 9. 【答案】B 10. 【答案】C 11. 【答案】B 12. 【答案】B 13. 【答案】C 14. 【答案】D
2017-2018西城高三化学期末及答案

北京市西城区2017 — 2018学年度第一学期期末试卷高三化学2018.1本试卷共8页,共100分。
考试时长120分钟。
考生务必将答案写在答题纸上,在试卷上作答无效。
考试结束后,将本试卷和答题纸一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32第Ⅰ卷(选择题共42分)每小题只有1个选项符合题意。
1.下列所加物质的作用与其还原性有关的是A B C D腌咸菜加氯化钠食用盐中加碘酸钾红酒中添加SO2泡打粉加碳酸氢钠2.下列属于吸热反应的是A.氧化钙与水反应B.铁丝在氧气中燃烧C.NaOH溶液与盐酸反应D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应3.乙酸是一种常见的有机物。
下列有关乙酸的化学用语中,不正确...的是A.实验式:CH2O B.比例模型:C.甲基的电子式:D.电离方程式:CH3COOH CH3COO-+ H+4.下列事实不能..用元素周期律解释的是A.酸性:HClO4 > H2SO3B.碱性:NaOH> Mg(OH)2C.气态氢化物的稳定性:H2O > H2S D.Cl2从NaBr溶液中置换出Br25.下列关于自然界中氮循环(如右图)的说法不正确...的是A.人工固氮可以得到硝酸盐B.细菌对氮元素的循环有重要作用C.雷电作用可以将氮气直接转化为铵盐D.亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化6.下列说法正确的是A.1 mol NH3中含有的质子数约为 6.02×1023B.0.5 mol·L- 1 NaCl溶液中含Cl-的物质的量为0.5 molC.8 g S在足量O2中完全燃烧转移的电子数约为9.03×1023D.标准状况下,22.4 L SO2和CO2的混合气体所含原子数约为 1.806×10247.咖啡酸具有较广泛的抑菌作用,其结构简式如下。
下列关于咖啡酸的说法不正确...的是A.能发生加聚反应B.能与溴水发生反应C.能与H2发生加成反应D.1 mol咖啡酸最多消耗 1 mol NaOH8.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中●和○代表不同元素的原子。
北京市西城区重点中学2017-2018学年度第一学期高三化学期末复习检测试题 含答案
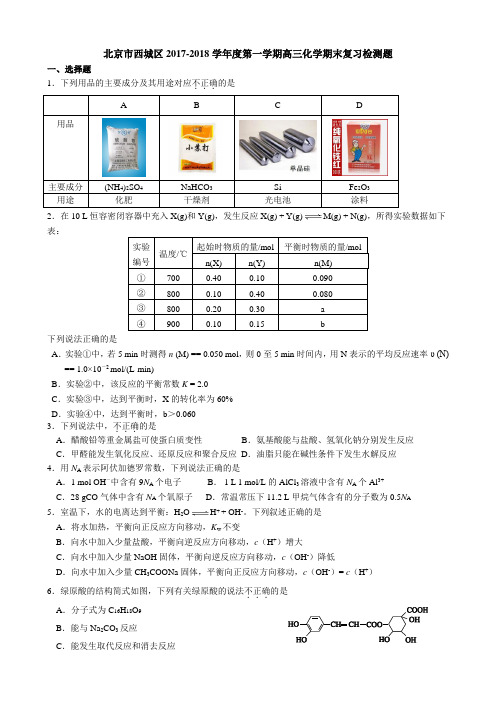
北京市西城区2017-2018学年度第一学期高三化学期末复习检测题一、选择题1.下列用品的主要成分及其用途对应不正确...的是2.在10 L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g) + Y(g)M(g) + N(g),所得实验数据如下表:下列说法正确的是A .实验①中,若5 min 时测得n (M) == 0.050 mol ,则0至5 min 时间内,用N 表示的平均反应速率υ (N) == 1.0×10-2mol/(L·min)B .实验②中,该反应的平衡常数K = 2.0C .实验③中,达到平衡时,X 的转化率为60%D .实验④中,达到平衡时,b >0.060 3.下列说法中,不正..确.的是 A .醋酸铅等重金属盐可使蛋白质变性 B .氨基酸能与盐酸、氢氧化钠分别发生反应 C .甲醛能发生氧化反应、还原反应和聚合反应 D .油脂只能在碱性条件下发生水解反应 4.用N A 表示阿伏加德罗常数,下列说法正确的是A .1 mol OH -中含有9N A 个电子 B . 1 L 1 mol/L 的AlCl 3溶液中含有NA 个Al 3+C .28 gCO 气体中含有N A 个氧原子D .常温常压下11.2 L 甲烷气体含有的分子数为0.5N A 5.室温下,水的电离达到平衡:H 2OH + + OH -。
下列叙述正确的是A .将水加热,平衡向正反应方向移动,K w 不变B .向水中加入少量盐酸,平衡向逆反应方向移动,c (H +)增大C .向水中加入少量NaOH 固体,平衡向逆反应方向移动,c (OH -)降低D .向水中加入少量CH 3COONa 固体,平衡向正反应方向移动,c (OH -)= c (H +) 6.绿原酸的结构简式如图,下列有关绿原酸的说法不正确...的是 A .分子式为C 16H 18O 9 B .能与Na 2CO 3反应C .能发生取代反应和消去反应D.0.1 mol绿原酸最多与0.8 molNaOH反应7.25 ℃时,合成氨反应的热化学方程式为:N2 (g) +3H2 (g)催化剂高温高压2NH3(g) ΔH=-92.4 kJ/mol下列叙述正确的是A.混合气体的质量不变时,说明该反应一定达到平衡状态B.将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动C.催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益D.在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ 8.已知七种短周期元素a~g的有关信息如下表所示:下列推断正确的是A.氢氧化物碱性的强弱:f < g B.简单离子的离子半径:b < gC.元素e的氧化物只能与酸反应D.元素a与元素d形成的化合物属于离子化合物9.下列指定反应的离子方程式正确的是A.氯气溶于水:Cl2 + H2O 2 H++ Cl-+ ClO-B.NH4HSO4溶液呈酸性的主要原因是:NH4++ H2O NH3·H2O+ H+C.酸性溶液中KIO3与KI反应生成I2:IO-3+ I-+ 6 H+= I2 + 3 H2OD.NaHCO3溶液中加足量Ba(OH)2溶液:HCO-3+ Ba+2+ OH-= BaCO3↓+ H2O10.对下列图像的描述正确的是①②③④A.根据图①可判断反应A2(g)+3B2(g)2AB3(g)的△H>0B.图②可表示压强(P)对反应2A(g)+2B(g)3C(g)+D(s)的影响C.图③可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化D.根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~511.已知: 25℃、101 kPa下:①2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol②2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol 下列说法正确的是A.①和②产物的阴阳离子个数比不相等B.①和②生成等物质的量的产物,转移电子数不同C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快D.25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol12.已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O2H++ 2CrO42-(黄色)①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京市西城区2017 — 2018学年度第一学期期末试卷高三化学2018.1本试卷共8页,共100分。
考试时长120分钟。
考生务必将答案写在答题纸上,在试卷上作答无效。
考试结束后,将本试卷和答题纸一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32第Ⅰ卷(选择题共42分)每小题只有1个选项符合题意。
1.下列所加物质的作用与其还原性有关的是A B C D腌咸菜加氯化钠食用盐中加碘酸钾红酒中添加SO2泡打粉加碳酸氢钠2.下列属于吸热反应的是A.氧化钙与水反应B.铁丝在氧气中燃烧C.NaOH溶液与盐酸反应D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应3.乙酸是一种常见的有机物。
下列有关乙酸的化学用语中,不正确...的是A.实验式:CH2O B.比例模型:C.甲基的电子式:D.电离方程式:CH3COOH CH3COO-+ H+4.下列事实不能..用元素周期律解释的是A.酸性:HClO4 > H2SO3B.碱性:NaOH> Mg(OH)2C.气态氢化物的稳定性:H2O > H2S D.Cl2从NaBr溶液中置换出Br25.下列关于自然界中氮循环(如右图)的说法不正确...的是A.人工固氮可以得到硝酸盐B.细菌对氮元素的循环有重要作用C.雷电作用可以将氮气直接转化为铵盐D.亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化6.下列说法正确的是A.1 mol NH3中含有的质子数约为6.02×1023B.0.5 mol·L− 1 NaCl溶液中含Cl-的物质的量为0.5 molC.8 g S在足量O2中完全燃烧转移的电子数约为9.03×1023D.标准状况下,22.4 L SO2和CO2的混合气体所含原子数约为1.806×10247.咖啡酸具有较广泛的抑菌作用,其结构简式如下。
下列关于咖啡酸的说法不正确...的是A.能发生加聚反应B.能与溴水发生反应C.能与H2发生加成反应D.1 mol咖啡酸最多消耗1 mol NaOH8元素的原子。
关于此反应的说法不正确...的是A.反应物总能量一定低于生成物总能量B.一定属于可逆反应C.一定有非极性共价键断裂D.一定属于氧化还原反应9.下列离子方程式书写正确的是A.金属Na加入水中:Na+ 2H2O== Na+ + 2OH-+ H2↑B.NaOH溶液吸收Cl2:Cl2 + 2OH-== Cl-+ ClO-+ H2OC.Al2(SO4)3溶液和过量的NaOH溶液反应:Al3++3OH-== Al(OH)3↓D.过量的Fe和稀硝酸反应:Fe + 4H+ + NO3—== Fe3+ + NO↑+ 2H2O10.常温下,下列各组离子能大量共存的是A.pH=1的溶液中:Ba2+、NH4+、NO3−、Fe2+B.无色溶液中:H+、K+、I−、MnO4−C.在c(H+)∶c(OH−)=1∶1012的溶液中:Na+、CO32−、NO3−、SO42−D.由水电离出的c(OH−)=1.0×10− 13 mol·L− 1的溶液中:Na+、NH4+、SO42−、HCO3−11.下列叙述正确的是A.向混有苯酚的苯中加入浓溴水,过滤,可除去其中的苯酚B.向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性C.向淀粉溶液中加稀硫酸,加热,加新制Cu(OH)2浊液,加热未见红色沉淀,说明淀粉未水解D.向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷水解12.下列反应的发生与“难溶电解质的溶解平衡”或“盐类水解平衡”无关..的是A.镁条与NH4Cl溶液反应生成H2B.NaHSO4溶液与NaOH溶液反应生成Na2SO4 C.盐酸与CaCO3反应生成CO2D.Al2(SO4)3溶液和NaHCO3溶液反应生成CO2 13.下列方法中,可以使0.10 mol·L− 1 氨水中NH3·H2O的电离程度减小的是A.加入少量0.10 mol·L− 1盐酸B.加水稀释C.加入少量0.10 mol·L− 1NaOH溶液D.加入少量NaCl固体14.猜想与假设是基于部分证据得出的不确定结论。
下列猜想与假设不合理...的是A.Ca与H2O反应可能生成H2B.SO2和H2O2反应可能生成H2SO4C.浓硫酸与乙醇在一定条件下反应产生的黑色物质可能是碳单质D.H2C2O4溶液与H2SO4酸化的KMnO4溶液反应,先慢后快,催化剂可能是K+ 15.为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。
下列关于实验现象的解释或结论正确的是所得实验数据如下表:A.①中,若5 min末测得n (M)=0.050 mol,则0至5 min内,用N表示的平均反应速率υ (N)=1.0×10− 2 mol/(L·min)B.800 ℃,该反应的平衡常数K=2.0C.③中,达到平衡时,Y的转化率为80%D.ΔH>0第Ⅱ卷(非选择题共58分)17.(6分)我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料。
(1)制备碳酸钠。
①以芒硝和碳酸氢铵为原料,在水溶液中经复分解反应析出NaHCO3晶体,其反应的化学方程式是________。
②已知:ⅰ.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol− 1ⅱ.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol− 1反应2NaHCO3(s) == Na2CO3(s) + H2O(g) + CO2(g) ΔH=________ kJ·mol−1。
(2)制备烧碱和硫酸。
用右图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜。
则阳极区制备的溶液是________,阴极的电极反应式是________。
18.(6分)某同学取海带灰加蒸馏水煮沸2~3 min,冷却,过滤,获得含I−的溶液,并设计以下实验方案,从中提取I2。
已知:3I2 + 6NaOH == 5NaI + NaIO3 + 3H2O(1)试剂a的作用是________。
(2)试剂b应选择________(填序号)。
A.CCl4B.苯C.酒精D.植物油(3)操作1的名称是________。
(4)反应3的离子方程式是________。
19.(10分)甲醇是重要的化工原料,发展前景广阔。
(1)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。
某微生物燃料电池装置如右图所示:A极是________极(填“正”或“负”),其电极反应式是________。
(2)研究表明CO2加氢可以合成甲醇。
CO2和H2可发生如下两个反应:I.CO2(g) + 3H2(g)CH3OH(g) + H2O(g) ΔH1II.CO2(g) + H2(g)CO(g) + H2O(g) ΔH2①反应I的化学平衡常数表达式K=________。
②有利于提高反应I中CO2的平衡转化率的措施有________(填序号)。
a.使用催化剂b.加压c.增大CO2和H2的初始投料比③研究温度对于甲醇产率的影响。
在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂甲,主要发生反应I,得到甲醇的实ΔH1________0(填“>”、“=”或“<”其依据是________。
④某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):2表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是________。
20.(12分)氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。
某铜钴矿石主要含有CoO(OH) 、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。
由该矿石制备Co2O3的部分工艺过程如下:Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。
Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a [主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。
Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
Ⅴ.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O4·2H2O沉淀。
分离出沉淀,将其在400℃~600℃煅烧,即得到Co2O3。
请回答:(1)Ⅰ中,稀硫酸溶解CoCO 3的化学方程式是________,加入Na 2SO 3溶液的主要作用是________。
(2)根据图1、图2分析:①矿石粉末浸泡的适宜条件应是________。
②图2中铜、钴浸出率下降的可能原因是________。
(3)Ⅱ中,浸出液中的金属离子与NaClO 3反应的离子方程式:ClO 3− + + == Cl − + +(4)Ⅱ中,检验铁元素完全除去的试剂是________,实验现象是________。
(5)Ⅱ、Ⅳ中,加入Na 2CO 3 的作用分别是________、________。
(6)Ⅲ中,沉淀b 的成分是MgF 2 、________(填化学式)。
(7)Ⅴ中,分离出纯净的CoC 2O 4·2H 2O 的操作是________。
21.(10分)某小组同学进行实验研究FeCl 3溶液和Na 2S 溶液的反应。
图1浸出温度对铜、钴浸出率的影响 图2浸出pH 对铜、钴浸出率的影响已知:FeS、Fe2S3均为黑色固体,均能溶于盐酸。
H2S气体有臭鸡蛋气味。
同学们对黑色沉淀的成分提出两种假设:ⅰ.Fe3+与S2−反应直接生成沉淀Fe2S3。
ⅱ.Fe3+被S2−还原,生成沉淀FeS和S。
甲同学进行如下实验:根据上述实验现象和资料,甲得出结论:黑色沉淀是Fe2S3。
(1)0.1 mol·L− 1Na2S溶液的pH为12.5。
用离子方程式表示其显碱性的原因:_______。
(2)乙认为甲的结论不严谨,理由是________。
(3)进一步研究证实,黑色沉淀的主要成分是Fe2S3。
Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的可能原因是________。
【实验二】(4)进一步实验证实,步骤I中局部产生少量的黑色沉淀是Fe2S3,黑色沉淀溶解的主要原因不是Fe2S3与溶液中Fe3+发生氧化还原反应。
