常见无机物质颜色表
初中化学中常见的有色物质在初中的化学中有哪些常见的物质是有颜色的,比如 白色:碳酸钙……蓝色:硫酸铜

初中化学中常见的有色物质在初中的化学中有哪些常见的物质是有颜色的,比如白色:碳酸钙……蓝色:硫酸铜1.有色气体:Cl2(黄绿色).NO2.Br2(气)红棕色2.液体:Br2(红棕色)3.有色固体:红色Cu.Cu2O.Fe2O3红褐色:Fe(OH)3绿色:Cu2(OH)2CO3.FeSO4*7H2O蓝色:Cu(OH)2.CuSO4*5H2O黑色:CuO.FeO.FeS.CuS.MnO2.C.Fe3O4.FeO.Ag2S浅黄色:S.Na2O2.AgBr黄色:AgI.Ag3PO44.有色溶液:Cu2+(蓝色).Fe2+(浅绿色).Fe3+(黄色).MnO4-(紫红色).溴水(橙色).5.焰色反应:Na+(黄色).k+(紫色)6.使品红褪色的气体:SO2(加热后又恢复到红色).Cl2(加热后不恢复红色)颜色变化的反应:1.蛋白质遇硝酸变黄(如做实验时.被某液体溅到皮肤上.皮肤变黄)2.酚类遇Fe3+显紫色3.Fe3+遇SCN-呈现血红色4.Fe2+(浅绿色或灰绿色)遇比较强的氧化剂变成Fe3+(黄色)5.Fe(OH)2(白色).在空气或溶液中会迅速变为灰绿色沉淀.最后变为Fe(OH)3红褐色沉淀.6.白色无水硫酸铜溶于水会变蓝7.淀粉遇碘变蓝8.氧化漂白:次氯酸HClO(氯气通到湿润的有色布条.使有色布条褪色.其实是氯气与水生成次氯酸HClO.而次氯酸HClO具有强氧化性使布条褪色).臭氧O3.双氧水H2O2等都可使高锰酸钾溶液褪色9.二氧化硫通入品红溶液.品红溶液褪色.但非氧化漂白.再加热品红溶液.颜色恢复.10.不饱和烃(如烯烃.炔烃等)会使溴水或高锰酸钾溶液褪色(与溴发生加成反应.还原高锰酸钾)11.苯酚(固体)在空气中露置被氧气氧化变为粉红色12.2NO(无色)+O2=2NO2(红棕色)13.NO2(红棕色)=N2O4(无色) (由于技术有限.这里的等号应为可逆号)(正反应条件好像是加压.逆反应条件反之)14.黑色氧化铜CuO会与还原性物质(如氢气H2.一氧化碳CO.碳C等)反应生成红色的铜Cu.15.醛基与银氨溶液反应生成光亮的银镜(反应要在水浴中进行)16.醛基与新制氢氧化铜悬浊液反应.反应现象是蓝色絮状沉淀(Cu(OH)2)到砖红色沉淀(Cu2O)17.无机反应(沉淀或有色离子)CH3COO-与Pb2+Ba2+与SO42-Ba2+与SO32-Sn2+与SO42-Ag+与Cl-Hg+(Hg2Cl2) 与Cl-等等都是生成白色沉淀18.Cu2+与碱生成Cu(OH)2蓝色沉淀.19.Fe2+与碱生成Fe(OH)2.但它易被氧化.所以实验现象中没有我们期望的白色沉淀.而是灰绿色沉淀.过一段时间最终形成Fe(OH)3红褐色沉淀.20.Fe3+与碱生成Fe(OH)3红褐色絮状沉淀去转的,但是他归纳的很好、很完整后面的颜色变化反应大多是高中内容,看着觉得陌生就丢开不用管。
高教无机化学下册物质颜色集锦

●碱金属和碱土金属单质:银白色光泽(除铍钢灰色)●碱金属溶在液氨中,稀溶液蓝色;浓度超过1mol/L,出现青铜色新相;浓度继续加大,蓝色→青铜色●碱金属氧化物:Li2O和Na2O白色,K2O淡黄色,Rb2O亮黄色,Cs2O橙红色●碱土金属氧化物:白色固体●Na2O2:淡黄色粉末●KO2橙黄色,RbO2深棕色,CsO2深黄色●KO3晶体:橘红色●碱金属和碱土金属氢氧化物:白色固体●焰色反应:锂红色,钠黄色,钾铷铯紫色,钙橙红色,锶洋红色,钡绿色●钠钾难溶盐:醋酸双氧铀酰锌钠:黄绿色六氯铂酸钾:淡黄色钴亚硝酸钠钾:亮黄色六羟基锑酸钠、高氯酸钾、酒石酸氢钾、四苯硼酸钾:白色●BaCl2·2H2O:无色单斜晶体●Al:银白色金属●Al2O3:白色难溶于水粉末●α-Al2O3刚玉:含微量Cr3+:红色→红宝石含Fe2+、Fe3+或Ti4+:蓝色→蓝宝石●无水硫酸铝:白色粉末●镓铟铊:银白色金属●锗:银白色,白锡:银白略带蓝色,灰锡:灰色粉末,铅:金属光泽,表面易生成暗灰色碱式碳酸铅●xGeO2·yH2O:白色沉淀,xSnO2·yH2O(β-锡酸):白色沉淀●GeO2:白色固体,SnO2白色固体,PbO2:棕黑色固体●GeO:黑色固体,SnO:黑色固体,PbO:黄或黄红色固体●PbO:红色四方晶体或黄色正交晶体两种变体●Pb3O4:红色●SnCl2·2H2O:无色晶体●PbI2:黄色丝状有亮光●灰锑:金属光泽,白色或灰色;黑锑;黄锑●Bi2O5:红棕色,Sb4O10:淡黄色粉末●Sb4O6(锑白):白色晶体,Bi2O3:黄色晶体●铜:紫红色,银:白色,金:黄色●青铜:80%Cu、15%Sn、5%Zn黄铜:60%Cu、40%Zn白铜:50%~70%Cu,18%~20%Ni,13%~15%Zn ●铜锈Cu(OH)2·CuCO3:绿色●Ag2S:黑色←银器暴露于空气中生成薄膜●Cu2O(晶粒大小不同):黄色、红色、深棕色●[Cu(NH3)2]+、[CuCl3]2-:无色,[Cu(NH3)4]2+:深蓝色●CuX(不能形成CuF):白色难溶于水●CuI纸条悬挂测定空气中汞的含量:经过3h白色CuI不变色→低于允许含量(0.1mg/m3)3h内变为亮黄至暗红色→超过允许含量●H[CuCl2]:纯溶液为无色,常因部分被氧化呈棕黑色●Cu2S:难溶黑色物质,CuO:黑色●Cu(OH)2:蓝色絮状沉淀,[Cu(OH)4]2-:蓝色●CuCl2:很浓溶液中:黄绿色←[CuCl4]2-的存在浓溶液:绿色←[CuCl4]2-和[Cu(H2O)6]2+并存稀溶液:蓝色←[Cu(H2O)6]2+的颜色●无水CuCl2:棕黄色,水合氯化铜CuCl2·2H2O:蓝绿色固体●CuSO4·5H2O:蓝色晶体●无水硫酸铜:白色粉末●碱式硫酸铜沉淀Cu2(OH)2SO4:浅蓝色●铜氨溶液加入乙醇:深蓝色晶体[Cu(NH3)4]SO4·H2O●Cu2+中加入CN-→氰化铜棕黄色沉淀→此物分解生成白色CuCN并放出(CN)2→继续加入过量CN-→CuCN溶解生成无色[Cu(CN)4]3-(极稳定)●AgNO3中加入NaOH→白色AgOH沉淀→立即脱水生成暗棕色Ag2O沉淀●AgF:白色,AgCl:白色,AgBr:淡黄色,AgI:黄色●Au2O3:棕色,AuCl3:褐红色晶体●金溶于王水中or Au2Cl6溶于浓盐酸中→蒸发得到黄色氯代金酸HAuCl4·4H2O●刚生成时的镉和锌:带浅蓝色光泽的白色固体●锌在含有CO2的潮湿空气中很快变暗,生成一层较为紧密的保护膜碱式碳酸锌●ZnO(锌白):白色,ZnS:白色,CdO:棕灰色,HgO:红色或黄色晶体(They all 难溶于水)●汞盐与碱作用→黄色的HgO(晶粒较细小);Hg(NO3)2热分解or 约620K时氧气中加热汞or Na2CO3与Hg(NO3)2反应→红色的HgO(颗粒较大)●混合晶体ZnS·BaSO4(锌钡白、立德粉):白色●CdS:橙黄色到红色●无水氯化锌:白色固体●Hg(NH2)Cl:白色沉淀●多数亚汞盐:无色●氯化亚汞(甘汞):微溶于水的白色粉末●鉴定Hg2Cl2特征反应中,生成Hg(NH2)Cl白色沉淀与Hg黑色沉淀,混合为灰色沉淀●HgI2:红色沉淀,HgI4 2-:无色●奈斯勒试剂(鉴定溶液中微量NH4+离子):K2[HgI4]和KOH混合溶液反应中生成特殊红棕色沉淀Hg2NI·H2O●Ti:银白色金属●TiO2:白色粉末●TiO2溶于热的浓硫酸中,不能从溶液中析出Ti(SO4)2,而是析出TiOSO4·H2O的白色粉末●TiCl4:常温下无色液体;水中或潮湿空气中易水解:TiCl4暴露在空气中冒白烟,产生白色的二氧化钛水合物H2TiO3或TiO2●钛(IV)的卤化物与相应的卤化氢或它们的盐生成M2[TiX6]配合物(以X=Cl为例)H2[TiCl6]只存在于溶液中,若加入NH4+,析出黄色(NH4)2[TiCl6]晶体●钒:银灰色金属●五氧化二钒:橙黄色到深红色,微溶于水产生淡黄色酸性溶液●V2O5用H2还原→深蓝色VO2、黑色V2O3、黑色粉末状VO●铬:银白色有光泽的金属●铬溶于稀盐酸→先生成蓝色CrCl2溶液,进一步被空气氧化为CrCl3绿色溶液●Cr2O3溶于强碱形成绿色的亚铬酸盐CrO2-,水溶液中应写成[Cr(OH)4]- or[Cr(OH)6]3-●CrO2Cl2:深红色液体●致密块状锰:银白色,粉末状:灰色●MnO:绿色,MnS:绿色●K2MnO4-:绿色●高锰酸钾:深紫色晶体(水溶液紫红色)●铁钴镍单质:具有白光光泽金属,铁、钴略带灰色,镍为银白色●用碱处理铁(III)水溶液,产生红棕色凝胶状水合氧化物沉淀,加热到473K 时生成时生成红棕色α-Fe2O3●碱与铁(III)盐溶液生成的红棕色沉淀,实际上是水合三氧化二铁Fe2O3·nH2O,习惯上写成Fe(OH)3●铁(II)盐一般为浅绿色,铁(III)盐一般为红棕色●FeSO4·7H2O(绿矾):绿色●无水FeSO4:白色●绿矾空气中逐渐风化,表面容易氧化为黄褐色碱式硫酸铁(III)Fe(OH)SO4(绿矾溶液久置常有棕色沉淀)●铁屑溶于盐酸→FeCl2溶液→通入氯气→浓缩冷却结晶→黄棕色FeCl3·6H2O晶体●可溶性铁(III)盐水溶液以[Fe(H2O)6]3+形式存在,为淡紫色,平常见到的黄棕色或红棕色是铁(III)盐溶于水后发生水解作用引起的●当pH=1.6~1.8,温度358~368K时,Fe3+在热溶液中水解,黄色晶体析出,M2Fe6(SO4)4(OH)12,(M=K+,Na+,NH4+),俗称黄铁矾●Fe3+与(NH4)2S(或Na2S)作用,生成Fe2S3黑色沉淀,将该溶液酸化,得到淡黄色S析出●强碱性介质中,铁(III)能被一些氧化剂氧化成紫红色的高铁酸盐溶液●Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾K2FeO4●[Fe(NCS)n] 3-n ,n=1~6,血红色,鉴定Fe3+●Co与O2高温时反应or 隔绝空气、高温条件下,使Co(II)的碳酸盐、草酸盐、硝酸盐分解→灰绿色氧化钴(II)●空气中加热Co(II)碳酸盐、草酸盐、硝酸盐or 将CoO在大气的氧中加热到673~773K→黑色Co3O4●加热Ni(II)氢氧化物、碳酸盐、草酸盐、硝酸盐→绿色氧化镍●低于298K、次溴酸钾碱性溶液与硝酸镍溶液反应→黑色沉淀β-NiO(OH)●NaClO氧化碱性硫酸镍溶液→黑色不稳定NiO2·nH2O●硫酸钴(II)、硫酸镍(II)从溶液中结晶出来含有结晶水:红色晶体CoSO4·7H2O、绿色晶体NiSO4·7H2O●Co2+溶液中加入硫氰化钾溶液→蓝色[Co(SCN)4]2-●向Co(II)盐溶液中加入过量KNO2,并以少量醋酸酸化,加热→析出黄色K3[Co(NO2)6]●配合物[Co(NO2)(NH3)5]Cl2键合异构体:以O做配位原子:红色[(ONO)Co(NH3)5]Cl2以N做配位原子:黄棕色[(NO2)Co(NH3)5]Cl2●二氧化锆ZrO2、二氧化铪HfO2:白色固体●ZrO2·xH2O(α型锆酸H4ZrO4):白色凝胶●ZrCl4:白色固体●铌Nb和钽Ta:钢灰色金属,略带蓝色●Nb2O5、Ta2O5:白色粉末●钼Mo和钨W:银白色、有光泽金属●MoO3:室温下白色固体,加热变黄,WO3:淡黄色固体●MoO2:紫色,WO2:棕色●锝Tc和铼Re:银白色金属,通常为灰色粉末;潮湿空气中缓慢失去光泽变暗●Tc和Re的氧化物:●Tc2O7、Re2O7:易挥发黄色固体●ReO3:稳定红色固体●ReO2:蓝、黑色●铂系金属(钌Ru,铑Rh,钯Pd,锇Os,铱Ir,铂Pt):银白色(除锇为蓝灰色)●RuO4、OsO4:黄色有毒物质●PtF6:气态液态暗红色,固态几乎黑色●氯铂酸H2PtCl6:棕红色。
高中化学的归纳无机化学中的常见元素和化合物总结

高中化学的归纳无机化学中的常见元素和化合物总结在高中化学学习中,无机化学是一个重要的部分。
它研究无机物质,即不含碳氢键的物质。
在无机化学中,有一些常见的元素和化合物是我们必须熟悉的。
本文将对这些常见的元素和化合物进行总结。
一、常见元素1. 氢(H):氢是宇宙中最常见的元素之一,也是化学元素周期表中的第一个元素。
氢气是无色、无臭的气体,它广泛应用于工业生产、能源储存等方面。
2. 氧(O):氧气是一种重要的气体,占地球大气中的一部分。
它是许多物质的成分之一,如水(H2O),氧化剂等。
3. 氮(N):氮气是空气中的主要成分之一,占据78%的比例。
在化学中,氮还常以氨(NH3)和硝酸(HNO3)等形式存在。
4. 碳(C):碳是有机化合物的基础,其化学性质独特而复杂。
它在地球上的许多物质中广泛存在,如燃料、矿石等。
5. 铁(Fe):铁是一种重要的金属元素,具有良好的导电性和导热性。
它广泛应用于建筑、制造业等领域。
6. 铜(Cu):铜是一种有色金属,具有良好的导电性和导热性。
它广泛应用于电子、通信等领域。
7. 锌(Zn):锌是一种重要的金属元素,它具有耐腐蚀性和导电性。
它在镀锌、防护等方面有广泛应用。
8. 氯(Cl):氯是一种具有腐蚀性的非金属元素,常以氯化钠(NaCl)等形式存在。
它在消毒、净化水等方面有重要作用。
二、常见化合物1. 水(H2O):水是无机化合物中最常见的化合物之一,它由氢和氧元素组成。
水广泛存在于地球上的海洋、河流、湖泊等自然水体中,也是生物体内重要的成分。
2. 盐(NaCl):盐是由钠和氯元素组成的无机化合物,常见的食盐就是氯化钠。
盐在食品调味、融化冰雪等方面有广泛应用。
3. 二氧化碳(CO2):二氧化碳是一种重要的气体,在大气中占据一定比例。
它参与植物的光合作用,同时也是人类活动中产生的主要温室气体。
4. 硝酸(HNO3):硝酸是一种无机酸,它是一种强氧化剂,常用于制造肥料、爆炸物等。
无机化合物颜色大全(按颜色分类)

无机化合物颜色大全1.红色Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);I2的CCl4溶液(紫红色);MnO4-(紫红色);Cu(紫红色);在空气中久置的苯酚(粉红色).2.橙色:溴水;K2Cr2O7溶液.3.黄色:AgI(黄色);AgBr(浅黄色);K2CrO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);久置浓HNO3(溶有NO2);工业浓盐酸(含Fe3+);Fe3+水溶液(黄色);久置的KI溶液(被氧化成I2)4.绿色:Cu2(OH)CO3;Fe2+的水溶液;FeSO4.7H2O;Cl2(黄绿色);F2(淡黄绿色);Cr2O35.蓝色:Cu(OH)2;CuSO4.5H2O;Cu2+的水溶液;I2与淀粉的混合物.6.紫色:KMnO4(紫黑色);I2(紫黑色);石蕊(pH=8--10);Fe3+与苯酚的混合物.7.黑色:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.8.白色:Fe(OH)2,AgOH,无水CuSO4,Na2O,Na2CO3,NaHCO3,AgCl,BaSO4,CaCO3,CaSO3,Mg(OH)2, Al(OH)3,三溴苯酚,MgO,MgCO3,绝大部分金属等.说明:①元素基本上按周期表的族序数排列;②物质基本上按单质、氢化物、氧化物及其水化物、盐、有机物的顺序排列;③许多物质晶状为无色,粉末状为白色,晶型不同可能有不同颜色;④硫化物和过渡元素化合物颜色较丰富。
一、单质绝大多数单质:银白色。
主要例外:镧系锕系及下表物质 Cu 紫红 O2 无 Au 黄 S 黄 B 黄或黑 F2 淡黄绿 C(石墨黑 Cl2 黄绿 C(金刚石)无 Br2 红棕 Si 灰黑 I2 紫黑 H2 无稀有气体无 P 白、黄、红棕。
二、氢化物 LiH等金属氢化物:白NH3等非金属氢化物:无三、氧化物大多数非金属氧化物:无主要例外: NO2 棕红 N2O5和P2O5 白N2O3 暗蓝 ClO2 黄大多数主族金属的氧化物:白主要例外: Na2O2 浅黄 PbO 黄 K2O 黄 Pb3O4 红 K2O2 橙 Rb2O 亮黄 Rb2O2 棕 Cs2O 橙红 Cs2O2 黄大多数过渡元素氧化物有颜色 MnO 绿 CuO 黑 MnO2黑 Ag2O 棕黑 FeO 黑 ZnO 白Fe3O4 黑 Hg2O 黑 Fe2O3 红棕 HgO 红或黄 Cu2O 红 V2O5 橙四、氧化物的水化物大多数:白色或无色其中酸:无色为主碱:白色为主主要例外: CsOH 亮黄 Fe(OH)3红褐 HNO2 溶液亮蓝 Cu(OH)2 蓝 Hg(OH)2 桔红五、盐大多数白色或无色主要例外: K2S 棕黄 CuFeS2 黄 KHS 黄 ZnS 白Al2S3 黄 Ag2S 黑 MnS 浅红 CdS 黄 FeS 黑棕 SnS 棕 FeS2 黄 Sb2S3 黑或橙红 CoS 黑 HgS 红 NiS 黑 PbS 黑 CuS、Cu2S 黑 Bi2S3 黑 FeCl3·6H2O 棕黄Na3P 红 FeSO4·9H2O 蓝绿 NaBiO3 黄 Fe2(SO4)3·9H2O 棕黄 MnCl2 粉红 Fe3C 灰 MnSO4 淡红 FeCO3 灰 Ag2CO3 黄 Fe(SCN)3 暗红 Ag3PO4 黄 CuCl2 棕黄AgF 黄 CuCl2·7H2O 蓝绿 AgCl 白 CuSO4 白 AgBr 浅黄 CuSO4·5H2O 蓝 AgI 黄 Cu2(OH)2CO3 暗绿盐溶液中离子特色: NO2- 浅黄 Cu2+或[Cu(H2O)4]2+ 蓝 MnO4- 紫红 [CuCl4]2- 黄 MnO42- 绿 [Cu(NH3)4]2+ 深蓝 Cr2O72- 橙红Fe2+ 浅绿 CrO42- 黄 Fe3+ 棕黄非金属互化物 PCl3 无 XeF2、XeF4、XeF6 无PCl5 浅黄氯水黄绿 CCl4 无溴水黄—橙 CS2 无碘水黄褐 SiC 无或黑溴的有机溶液橙红—红棕 SiF4 无 I2的有机溶液紫红六.其它甲基橙橙 CXHY(烃)、CXHYOZ 无(有些固体白色)石蕊试液紫大多数卤代烃无(有些固体白色)石蕊试纸蓝或红果糖无石蕊遇酸变红葡萄糖白石蕊遇碱变蓝蔗糖无酚酞无麦芽糖白酚酞遇碱红淀粉白蛋白质遇浓HNO3变黄纤维素白 I2遇淀粉变蓝 TNT 淡黄 Fe3+遇酚酞溶液紫焰色反应 Li 紫红 Ca 砖红 Na 黄 Sr 洋红 K 浅紫(通过蓝色钴玻璃) Ba 黄绿 Rb 紫 Cu 绿稀有气体放电颜色 He 粉红 Ne 鲜红 Ar 紫。
无机化学知识点总结归纳

无机化学知识点总结1、知道典型的溶解性特征①加入过量硝酸从溶液中析出的白色沉淀:AgCl,原来溶液是Ag(NH3)2Cl;后者是硅酸沉淀,原来的溶液是可溶解的硅酸盐溶液。
生成淡黄的沉淀,原来的溶液中可能含有S2-,或者是S2O32-②加入过量的硝酸不能观察到沉淀溶解的有AgCl,BaSO4;BaSO3由于转化成为BaSO4而不能观察到沉淀的溶解。
AgBr,AgI,也不溶解,但是沉淀的颜色是黄色。
③能够和盐反应生成强酸和沉淀的极有可能是H2S气体和铅、银、铜、汞的盐溶液反应。
:④沉淀先生成后溶解的:CO2和Ca(OH)2;Al3+和氢氧化钠;AlO2-和盐酸;,氨水和硝酸银。
2、操作不同现象不同的反应: Na2CO3和盐酸;AlCl3和NaOH,NaAlO2和盐酸;AgNO3和氨水;FeCl3和Na2S;H3PO4和Ca(OH)2反应。
3、先沉淀后澄清的反应:AlCl3溶液中加入NaOH溶液,生成沉淀,继续滴加沉淀溶解:;AgNO3溶液中滴加稀氨水,先沉淀后澄清:;NaAlO2溶液中滴加盐酸,也是先沉淀后澄清:;澄清石灰水通入二氧化碳,先沉淀后澄清:;次氯酸钙溶液中通入二氧化碳,先沉淀后澄清:;KAl(SO4)2与NaOH溶液:;4、通入二氧化碳气体最终能生成沉淀的物质:苯酚钠溶液、硅酸钠溶液、偏铝酸钠溶液(这三种都可以与少量硝酸反应产生沉淀)、饱和碳酸钠溶液。
苯酚钠溶液:;硅酸钠溶液:;饱和碳酸钠溶液:;偏铝酸钠溶液:;5、能生成两种气体的反应:HNO3的分解:;Mg与NH4Cl溶液的反应:;电解饱和食盐水:;C与浓HNO3加热时反应:;C与浓H2SO4加热时反应:;6、型的反应:7、两种单质反应生成黑色固体:Fe与O2、Fe与S、Cu与O28、同种元素的气态氢化物与气态氧化物可以发生反应生成该元素的单质的是: S、N元素H2S+SO2——; NH3+NO——;NH3+NO2——;9、同种元素的气态氢化物与最高价氧化物的水化物可以发生反应生成盐的是:N元素NH3+HNO3——;10、同时生成沉淀和气体的反应:Mg3N2+H2O——; CaC2+H2O——;Na2S2O3+H2SO4——; Ba(OH)2+(NH4)2SO4——;Al3+、Fe3+-——S2-、CO32-、HCO3-间的双水解反应:Al3++S2-—— ; Al3++HCO3-——;Fe3++CO32―——;11、常见的置换反应:(1)金属置换金属:如溶液中金属与盐的反应:;铝热反应:;(2)非金属置换非金属:卤素间的置换:;氟气与水的反应:;二氧化硅与碳的反应:;硫化氢与氯气反应:;(3)金属置换非金属:活泼金属与非氧化性酸的反应:;钠与水的反应:;镁在二氧化碳中燃烧:;(4)非金属置换金属:氢气与氧化铜的反应:;碳与氧化铁反应:。
无机化学知识重点

一、物质俗称1、胆矾(蓝矾) CuSO4·5H2O2、绿矾FeSO4·7H2O3、红矾(红矾钾)K2Cr2O74、红矾钠Na2Cr2O7·2H2O5、皓矾ZnSO4·7H2O6、明矾K2SO4·Al2(SO4)3·24H2O7、重晶石BaSO48、天青石SrSO49、铵矾(NH4)2SO4·Al2(SO4)·24H2O 10、智利硝石(钠硝石)NaNO3 11、冰晶石Na3AlF6 12、铬矾K2SO4·Cr2(SO4)3·24H2O 13、白云石CaCO3·MgCO3 14、萤石CaF2 15、光卤石KCI·MgCl2·6H2O 16、独居石LnPO4 18、电石CaC2 17、方解石(石灰石,大理石,白垩)CaCO3 19、橄榄石Mg2SiO4 20、金红石TiO2 21、泻盐MgSO4·7H2O 22、赤血盐K3[Fe(CN)6] 23、黄血盐K4[Fe(CN)6] 24、摩尔盐(NH4)2Fe(SO4)2·6H2O 25、格氏盐(NaPO3)x 26、蔡斯盐K[PtCl3(C2H4)] 27、保险粉Na2S2O4·2H2O 28、立德粉BaSO4·ZnS 29、元明粉Na2SO4 30、铅白2PbCO3·Pb(OH)2 31、锌白ZnO 32、钛白TiO2 33、钡白BaSO4 34、铬绿Cr2O3 35、雄黄As2S3 36、雌黄As4S4 37、普鲁士蓝FeⅢ4[FeⅡ(CN)6] 38、膝氏蓝FeⅢ4[FeⅡ(CN)6] 39、铅丹(红丹)Pb3O4 40、金刚砂SiC 41、晨砂HgS 42、刚玉a-Al2O3 43、大苏打(海波)Na2S2O3·5H2O 44、小苏打NaHCO3 45、苏打Na2CO3 46、生石膏CaSO4·2H2O 47、熟石膏2CaSO4·H2O 48、升汞HgCl2 49、甘汞Hg2Cl2 50、砒霜As2O3 51、密陀僧(黄丹) PbO 52、芒硝Na2SO4·10H2O 53、灰锰氧KMnO4 54、绿柱石BeO·Al2O3·6SiO2 55、镉黄CdS 56、铬黄PbCrO4 57、铁红Fe2O3 58、铅糖Pb(Ac)2·3H2O 59、孔雀石Cu2(OH)2CO3 60、泡花碱(水玻璃)Na2O·nSiO2二、物质的颜色1.离子的颜色(1)无色离子NH4+;卤离子X-;拟卤离子CN-;SCN-;OCN-;碱金属离于M+;碱土金属离子M2+;非金属含氧酸根离子 mn RO;中心离子具有d0、d10结构的A13+、Zn2+、Ag+、Cd2+、Hg2+ 、Sc3+、Ti4+、Sn4+、Sn2+、Pb2+等的水合离子以及[Al(OH)4]-、[AlF6]3-、[HgI4]2-、[HgCl4]2-、[Zn(H2O)4]2+、[Zn(NH3)4]2+、[Zn(OH)4]2-、[Cu(NH3)2]+、[Cd(NH3)4]2+、[Ag(NH3)2]+ 、[Ag(CN)2]-、[Ag(S2O3)2]3-、[Zn(CN)4]2-、[AuCl2]-、[SiF6]4-等配离子。
【2020年高考化学】常见无机物的性质与用途
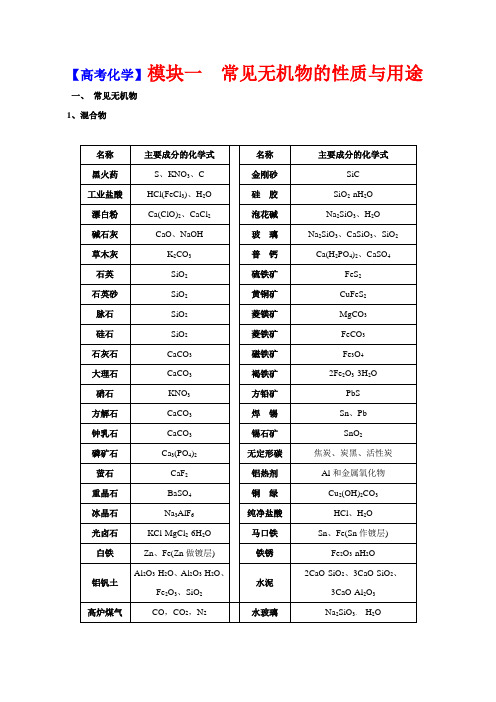
【高考化学】模块一常见无机物的性质与用途一、常见无机物1、混合物2、纯净物二、无机物质的特征性质1、常见物质的颜色全部颜色分类O3红棕色;Fe(OH)3红褐色;[Fe(SCN)]2+红色(或血红色);Cu2O红色(或砖红色);被氧化的苯2酚(即苯醌)粉红色;石蕊在pH<5的溶液中呈红色;酚酞在pH8~10的溶液中呈浅红色;NO2红棕色;红磷暗红色;Br2深棕红色;品红溶液红色;充氦气、氖气的灯管红色;Cu紫红色;*甲基橙在pH<3.1的溶液中显红色。
-紫红色;[Fe(C6H5O)6]3—紫色;I2紫黑色;I2蒸汽紫色;I2的CCl4或苯或汽油等溶液紫红色4(碘酒褐色);充氩气的灯管蓝紫色;石蕊在pH5~8的溶液中呈紫色。
*甲基橙在pH3.3~4.4的溶液中呈橙色。
Fe(OH)2变成Fe(OH)3的中间产物灰绿色。
晶体棕黄色;FeCl3晶体棕红色。
2、AgI、Ag3PO4、Fe3+、不纯硝基苯黄色;Na2O2、三硝基甲苯、AgBr、F2、硝化甘油、NaNO2黄色;*甲基橙在pH>4.4的溶液中呈黄色。
2+、Cu(OH)2、CuSO4·5H2O;石蕊在pH>8的溶液中呈蓝色;I2遇淀粉变蓝色;液态、固态的氧气淡蓝色;MnO2、CuO、CuS、Cu2S、PbS、Ag2S、FeS、FeO、Fe3O4黑色;Si 灰黑色;石油黑色或深棕色;煤焦油黑褐色。
绿色:Fe2+浅绿色;Cl2淡黄绿色;CuCl2浓溶液绿色(很浓黄绿色、稀则蓝色);碱式碳酸铜绿色。
O褐色;溶解了溴的溴苯褐色;碘酒褐色。
22、物质的状态:常温下为液体的单质:Br2、Hg常温下的常见的无色液体:H2O H2O2常见的气体单质:H2、N2、O2、F2、Cl2、NH3、HF、HCl(HX)、H2S、CO、CO2、NO、NO2、SO2)[注:有机物中的气态烃CxHy(x≤4);有机化学中有许多液态物质,但是含氧有机化合物中只有HCHO常温下是气态]常见的固体单质:I2、At、S、P、C、Si、金属单质;白色胶状沉淀(Al(OH)3、H4SiO4)3、物质的气味:有臭鸡蛋气味的气体:H2S有刺激性气味的气体:Cl2、SO2、NO2、HX、NH3有刺激性气味的液体:浓盐酸、浓硝酸、浓氨水、氯水、溴水4、物质的毒性:非金属单质有毒的:Cl2、Br2、I2、F2、S、P4常见的有毒气体化合物:CO、NO、NO2、SO2、H2S、能与血红蛋白结合的是CO和NO5、物质的溶解性:极易溶于水的气体:HX、NH3常见的难溶于水的气体:H2、N2、NO、CO、CH4、C2H4、C2H2S和P4不溶于水,微溶于酒精,易溶于二硫化碳。
如何识别常见的无机盐

如何识别常见的无机盐无机盐是由金属离子和非金属离子组合而成的化合物,广泛存在于我们日常生活中的各种物质中。
识别常见的无机盐对于理解化学性质和应用具有重要意义。
本文将介绍几种常见的无机盐以及它们的特征和识别方法。
一、氯化物(Chlorides)1.1 氯化钠(Sodium Chloride)氯化钠是一种常见的无机盐,也就是我们日常生活中所使用的食盐。
它的特征是无色晶体,可以溶于水。
我们可以通过尝试品尝它是否具有咸味来初步识别氯化钠。
1.2 氯化银(Silver Chloride)氯化银是一种白色固体,几乎不溶于水。
当氯化银遇到光线时,会发生光解反应并变为灰黑色。
因此,可以通过观察氯化银暴露在阳光下时是否发生颜色变化来识别氯化银。
二、硫酸盐(Sulfates)2.1 硫酸钠(Sodium Sulfate)硫酸钠是一种无色结晶体,它可以溶解在水中。
我们可以将硫酸钠溶解在水中,然后加入几滴酒石酸钾溶液,观察是否产生白色沉淀,如果有则说明存在硫酸盐。
2.2 硫酸铜(Copper Sulfate)硫酸铜是一种蓝色固体,可以溶解在水中。
我们可以通过观察硫酸铜溶液的颜色来初步判断是否为硫酸铜。
三、碳酸盐(Carbonates)3.1 碳酸钠(Sodium Carbonate)碳酸钠是一种白色晶体,可以溶解在水中。
我们可以将碳酸钠与酸反应,如果产生了气泡,则可以初步确认为碳酸盐。
3.2 碳酸钙(Calcium Carbonate)碳酸钙是一种白色固体,它几乎不溶于水。
我们可以通过将碳酸钙加入到酸溶液中,并观察是否产生气泡来识别碳酸钙。
四、硝酸盐(Nitrates)4.1 硝酸钠(Sodium Nitrate)硝酸钠是一种无色结晶体,可以溶解在水中。
我们可以将硝酸钠与铁(II)硫酸反应,观察是否产生棕色沉淀,如果有则可以初步判断为硝酸钠。
4.2 硝酸银(Silver Nitrate)硝酸银是一种白色固体,可以溶解在水中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见无机物质的颜色表卤族(VIIA):Solid:I2 紫黑;ICl 暗红;ICl3 橙;I2O5 白;IBr 暗灰;IF3 黄色;I2O4 黄;I4O9 黄.Liquid:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状;(SCN)n 砖红色固体.Gas:F2 浅黄;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕.氧族(VIA):Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb2S3 橘红↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag2S 黑↓;CuS 黑↓;Na2S2O3 白;Na2S2O4 白;SeO2 白,易挥发;SeBr2 红;SeBr4 黄;TeO2 白加热变黄;H2TeO3 白;TeBr2 棕;TeBr4 橙;TeI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;TeO3 橙色;H6TeO6 无色. Liquid:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO4^2-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红.Gas:O2 无色;O3 低浓度无色,高浓度淡蓝;S2(g) 黄,上浅下深;H2S 无色;SO2 无色;H2Se 无色;H2Te 无色..卤化硫(未注明者均为无色):Liquid:SF6;S2F10;SCl4 淡黄;SCl2 红;S2Cl2;S2Br2 红.Gas:SF4;SF2;S2F2.卤砜、卤化亚砜、卤磺酸:Liquid:SOCl2 白色透明;SO2Cl2 无色发烟.氮族(VA):Solid:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;PBr3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;AsI3 红;As4S4 红(雄黄);As4S6 黄(雌黄);As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(X<>I) 白;SbI3 红;Sb2S3 黑↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑.Liquid:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3^-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX3 无色;纯H3PO4 无色粘稠状;AsX3(X<>I) 无色;.Gas:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH3 无色;BiH3 无色.卤化氮(未注明者均为无色):Solid:NBr3•(NH3)6 紫,爆炸性;NI3•(NH3)6 黑,爆炸性;Liquid:NCl3;Gas:NF3;碳族(IVA):Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银白;Pb 暗灰;SiO2 无色透明;H2SiO3 无色透明胶状↓;Na2SiF6 白晶;GeO 黑;GeO2 白;SnO 黑;SnO2 白;Sn(OH)2 白↓;PbO黄或黄红;Pb2O3 橙;Pb3O4 红;PbO2 棕;CBr4 淡黄;CI4 淡红;GeI2 橙;GeBr2 黄;GeF4 白;GeBr4 灰白;GeI4 黄;SnF2 白;SnCl2 白;SnBr2 淡黄;SnI2 橙;SnF4 白;SnBr4 无色;SnI4 红;PbF2 无色↓;PbCl2 白↓;PbBr2 白;PbI2 金黄;PbF4 无色;GeS 红;GeS2 白;SnS 棕↓;SnS2 黄↓;PbS 黑↓;PbS2 红褐;Pb(NO3)2 无色;Pb(Ac)2•3H2O 无色晶体;PbSO4 白↓;PbCO3 白↓;Pb(OH)2 白↓;Pb3(CO3)2(OH)2 铅白↓;PbCrO4 亮黄↓. Liquid:CCl4 无色;CS2 无色;GeCl4 无色;SnCl4 无色;PbCl4 无色.Gas:CO CO2 CH4 CF4 SiF4 SiH4 均为无色.硼族(IIIA):Solid:B(无定型) 棕色粉末;B(晶体) 黑灰;Al 银白;Ga 银白(易液化);In 银灰;Tl 银灰;B2O3 玻璃状;H3BO3 无色片状;BN 白;Na2B4O7•10H2O 白色晶体;Cu(BO2)2 蓝↓;Ni(BO2)2 绿↓;NaBO2•Co(BO2)2 蓝↓;NaBO2•4H2O 无色晶体;无水NaBO2 黄晶;Al2O3 白晶;AlF3 无色;AlCl3 白;AlBr3 白;AlI3 棕;Al(OH)3 白↓;Ga2O3 白↓Ga(OH)3 白↓;GaBr3 白;GaI3 黄;In2O3 黄;InBr3 白;InI3 黄;TlOH 黄;Tl2O 黑;Tl2O3 棕黑;TlCl 白↓;TlBr 浅黄↓;TlI 黄↓;TlBr3 黄;TlI3 黑.Liquid:BCl3 无色发烟.,Gas:硼烷无色;BF3 无色(有窒息气味)碱土(IIA):单质:银白焰色:Ca 砖红;Sr 洋红;Ba 绿.氧化物:均为白色固体.氢氧化物:白色固体Be(OH)2↓,Mg(OH)2↓.盐:多为无色或白色晶体;BaCrO4 黄↓;CaF2 白↓.碱金属(IA):单质:银白焰色:Li 红;Na 黄;K 紫;Rb 紫红;Cs 紫红氧化物、过氧化物、超氧化物、臭氧化物:Li2O 白;Na2O 白;K2O 淡黄;Rb2O 亮黄;Cs2O 橙红;Na2O2 淡黄;KO2橙黄;RbO2深棕;CsO2 深黄;KO3 橘红.氢氧化物:白色.盐:多为无色或白色晶体且易溶于水.不溶盐↓(未注明者皆为白色晶体):LiF Li2CO3 Li3PO4 LiKFeIO6 Na[Sb(OH)6] NaZn(UO2)3(Ac)9•6H2O 黄绿;M=K,Rb,Cs M3[Co(NO2)6] 亮黄;MBPh4 MClO4 M2PtCl6 淡黄;CsAuCl4.铜副族(IB):单质:Cu 紫红或暗红;Ag 银白;Au 金黄.铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr黄↓;CuI 棕黄↓;CuCN 白↓;Cu2O 暗红;Cu2S 黑;CuF2 白;CuCl2 棕黄(溶液黄绿);CuBr2 棕;Cu(CN)2 棕黄;CuO 黑;CuS黑↓;CuSO4 无色;CuSO4•5H2O 蓝;Cu(OH)2 淡蓝↓;Cu(OH)2•CuCO3 墨绿;[Cu(H2O)4]2+ 蓝;[Cu(OH)4]2- 蓝紫;[Cu(NH3)4]2+ 深蓝;[CuCl4]2- 黄;[Cu(en)2]2+ 深蓝紫;炔铜红↓.银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6] 白↓;Ag3[Fe(CN)6] 白↓;Ag+,[Ag(NH3)2]+,[Ag(S2O3)2]3-,[Ag(CN)2]- 无色.金化合物:HAuCl4•3H2O 亮黄晶体;KAuCl4•1.5H2O 无色片状晶体;Au2O3 黑;H[Au(NO3)4]•3H2O 黄色晶体;AuBr 灰黄↓;AuI 柠檬黄↓.锌副族(IIB):单质:均为银白,Hg在水溶液中的沉淀为黑色.锌化合物:ZnO 白(锌白颜料)↓;ZnI2 无色;ZnS 白↓;ZnCl2 白色晶体(溶解度极大,水溶液酸性).镉化合物:CdO 棕灰↓;CdI2 黄;CdS 黄(镉黄颜料)↓;HgCl2(升汞) 白色;HgNH2Cl 白↓;Hg2Cl2(甘汞) 白↓.汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2 红或黄(微溶);HgS 黑或红↓;Hg2NI•H2O 红↓;Hg2(NO3)2 无色晶体.ZnS荧光粉:Ag 蓝;Cu 黄绿;Mn 橙.钪副族(IIIB):略钛副族(IVB):钛化合物:Ti3+ 紫红;VO4^3- 黄;[TiO(H2O2)2]2+ 橘黄;H2TiO3 白色↓;TiO2 白(钛白颜料)或桃红(金红石)↓;(NH4)2TiCl6 黄色晶体;[Ti(H2O)6]Cl3 紫色晶体;[Ti(H2O)5Cl]Cl2•H2O 绿色晶体;TiCl4 无色发烟液体.锆、铪:MO2,MCl4 白.钒副族(VB):钒化合物:V2+ 紫;V3+ 绿;V4+ 蓝;V5+ 黄;VO 黑;V2O3 黑;VO2 黄;V2O5 黄或砖红;水合V2O5 棕红;饱和V2O5溶液(微溶) 淡黄.钒酸根缩聚:随着V原子个数的增多,由浅黄——〉深红.铌、钽:略.铬副族(VIB):铬化合物:Cr2+ 蓝;Cr3+ 紫;Cr2O7^2- 橙红;CrO4^2- 黄;Cr(OH)3灰蓝;Cr2O3 绿;CrO3 暗红色针状;[CrO(O2)2]OEt2 蓝;CrO2Cl2 深红色液体;Na2Cr2O7,K2CrO7 橙红;Ag2CrO4 砖红↓;BaCrO4 黄↓;PbCrO4 黄↓.紫红Cr2(SO4)3•18H2O——〉绿色Cr2(SO4)3•6H2O——〉桃红Cr2(SO4)3 暗绿[Cr(H2O)4Cl2]Cl—冷却HCl—〉紫色[Cr(H2O)6]Cl3—乙醚HCl—〉淡绿[Cr(H2O)5Cl]Cl2[Cr(H2O)6]3+ 紫;[Cr(H2O)4(NH3)2]3+ 紫红;[Cr(H2O)3(NH3)3]3+ 浅红;[Cr(H2O)2(NH3)4]3+ 橙红;[Cr (NH3)5H2O]3+ 橙黄;[Cr(NH3)6]3+ 黄. 钼、钨:MoO3 白;棕色MoCl3;绿色MoCl5;MoS3 棕色↓;(NH4)3[P(Mo12O40)]•6H2O 黄色晶状↓;WO3 深黄;H2WO4•xH2O 白色胶体.锰副族(VIIB):锰化合物:Mn2+ 肉红;Mn3+ 紫红;MnO4^2- 绿;MnO4^- 紫;MnO3^+ 亮绿;Mn(OH)2 白↓;MnO(OH)2 棕↓;MnO2 黑↓;无水锰盐(MnSO4) 白色晶体;六水合锰盐(MnX2•6H2O, X=卤素,NO3,ClO4) 粉红;MnS•nH2O 肉红↓;无水MnS 深绿;MnCO3 白↓;Mn3(PO4)2 白↓;KMnO4 紫红;K2MnO4 绿;K2[MnF6] 金黄色晶体;Mn2O7 棕色油状液体.锝、铼:略.铁系(第四周期VIII族):铁化合物:Fe2+ 浅绿;[Fe(H2O)6]3+ 浅紫;[Fe(OH)(H2O)5]2+ 黄;FeO4^2- 紫红;FeO 黑;Fe2O3 暗红;Fe(OH)2 白↓;Fe(OH)3 棕红↓;FeCl3 棕红晶体;无水FeSO4 白;FeSO4•7H2O 绿;K4[Fe(CN)6](黄血盐) 黄色晶体;K3[Fe(CN)6](赤血盐) 红色晶体;Fe2[Fe(CN)6] 普鲁士蓝↓;Fe[Fe(CN)6] 黑↓;Fe(C5H5)2(二茂铁) 橙黄色晶体;M2Fe6(SO4)4(OH)12(黄铁矾,M=NH4,Na,K) 浅黄色晶体;Fe(CO)5 黄色液体.钴化合物:Co2+ 粉红;CoO 灰绿;Co3O4 黑;Co(OH)3 棕↓;Co(OH)2 粉红↓;Co(CN)2 红;K4[Co(CN)6] 紫色晶体;Co2(CO)8 黄色晶体;[Co(SCN)6]4- 紫;氯化钴脱水变色:粉红CoCl2•6H2O—325K—〉紫红CoCl2•2H2O—3l3K—〉蓝紫CoCl2•H2O—393K—〉蓝CoCl2.镍化合物:Ni2+ 亮绿;[Ni(NH3)6]2+ 紫;Ni(OH)2 绿↓;Ni(OH)3 黑↓;无水Ni(II)盐黄;Na2[Ni(CN)4] 黄;K2[Ni(CN)4] 橙;Ni(CO)4 无色液体.铂系元素(第五、六周期VIII族):Os 蓝灰色易挥发固体;Pd↓(aq) 黑;OsO4 无色有特殊气味气体;H2PtCl6 橙红色晶体;Na2PtCl6 橙黄色晶体;M2PtCl6(M=K,Rb,Cs,NH4) 黄色↓.。
