心钠素(ANP)测定试剂盒(化学发光免疫分析法)产品技术要求泰格
抗核抗体谱检测试剂盒(磁微粒化学发光法)产品技术要求华晟源
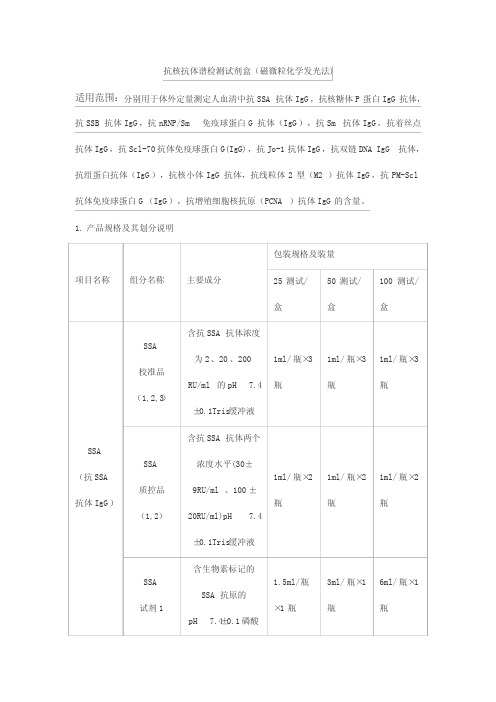
抗核抗体谱检测试剂盒(磁微粒化学发光法)适用范围:分别用于体外定量测定人血清中抗SSA抗体IgG,抗核糖体P蛋白IgG抗体,抗SSB抗体IgG,抗nRNP/Sm免疫球蛋白G抗体(IgG),抗Sm抗体IgG,抗着丝点抗体IgG,抗Scl-70抗体免疫球蛋白G(IgG),抗Jo-1抗体IgG,抗双链DNA IgG抗体,抗组蛋白抗体(IgG),抗核小体IgG抗体,抗线粒体2型(M2)抗体IgG ,抗PM-Scl 抗体免疫球蛋白G(IgG),抗增殖细胞核抗原(PCNA)抗体IgG的含量。
1. 产品规格及其划分说明项目名称 组分名称 主要成分 包装规格及装量25测试/盒50测试/盒100测试/盒SSA (抗SSA抗体IgG)SSA校准品(1,2,3)含抗SSA抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶SSA质控品(1,2)含抗SSA抗体两个浓度水平(30±9RU/ml、100±20RU/ml)pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶SSA试剂1含生物素标记的SSA抗原的pH 7.4±0.1磷酸1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶盐缓冲液SSA 试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶SSA 试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶P0(抗核糖体P蛋白IgG抗体)) P0校准品(1,2,3)含抗核糖体P蛋白抗体浓度为g 、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶P0质控品(1,2)含抗核糖体P蛋白抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶P0试剂1生物素标记的P0抗原的pH 7.4±0.11.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶磷酸盐缓冲液P0试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶P0试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶SSB(抗SSB抗体IgG) SSB校准品(1,2,3)含抗SSB抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶SSB质控品(1,2)含抗SSB抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶SSB试剂1生物素标记的SSB抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶SSB试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶SSB试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶nRNP/Sm (抗nRNP/Sm免疫球蛋白G抗体(IgG)) nRNP/Sm校准品(1,2,3)含抗nRNP/Sm抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶nRNP/Sm质控品(1,2)含抗nRNP/Sm抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶nRNP/Sm试剂1生物素标记的nRNP/Sm抗原的pH 7.4±0.1磷酸1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶盐缓冲液nRNP/Sm 试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶nRNP/Sm 试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Sm(抗Sm 抗体IgG)Sm校准品(1,2,3)含抗Sm抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶Sm质控品(1,2)含抗Sm抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶Sm试剂1生物素标记的Sm抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Sm试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶Sm试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶着丝点(CENP-B)(抗着丝点抗体IgG)着丝点(CENP-B校准品(1,2,3)含抗着丝点(CENP-B)抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶着丝点(CENP-B质控品(1,2)含抗着丝点(CENP-B)抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶着丝点(CENP-B生物素标记的着丝点(CENP-B)抗原的1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶试剂1 pH 7.4±0.1磷酸盐缓冲液着丝点(CENP-B 试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶着丝点(CENP-B 试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Scl-70(抗Scl-70抗体免疫球蛋白G(IgG)) Scl-70校准品(1,2,3)含抗Scl-70抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶Scl-70质控品(1,2)含抗Scl-70抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶Scl-70试剂1生物素标记的Scl-70抗原的1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶pH 7.4±0.1磷酸盐缓冲液Scl-70试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶Scl-70试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶Jo-1(抗Jo-1抗体IgG)Jo-1校准品(1,2,3)含抗Jo-1抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶Jo-1质控品(1,2)含抗Jo-1抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶Jo-1试剂1生物素标记的Jo-1抗原的pH 7.4±1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶0.1磷酸盐缓冲液Jo-1试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶Jo-1试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶dsDNA (抗双链DNA IgG 抗体 dsDNA校准品(1,2,3)含抗dsDNA抗体浓度为10、100、800 IU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶dsDNA质控品(1,2)含抗dsDNA抗体两个浓度水平(300±30IU/ml、600±60IU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶dsDNA试剂1生物素标记的dsDNA抗原的1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶pH 7.4±0.1磷酸盐缓冲液dsDNA试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶dsDNA试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶组蛋白(His)(抗组蛋白抗体(IgG)组蛋白(His)校准品(1,2,3)含抗组蛋白(His)抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶组蛋白(His)质控品(1,2)含抗组蛋白(His)抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris缓冲液1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶 组蛋白生物素标记的组蛋 1.5ml/瓶3ml/瓶×16ml/瓶×1(His)试剂1白(His)抗原的pH 7.4±0.1磷酸盐缓冲液×1瓶 瓶 瓶组蛋白(His)试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶组蛋白(His)试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶核小体(Nuc)(抗核小体IgG抗体)核小体(Nuc)校准品(1,2,3)含抗核小体(Nuc)抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶核小体(Nuc)质控品(1,2)含抗核小体(Nuc)dsDNA抗体两个浓度水平(30±9RU/ml、100±20RU/ml)的pH 7.4±0.1Tris1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶缓冲液核小体(Nuc)试剂1 生物素标记的核小体(Nuc)抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶核小体(Nuc)试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶核小体(Nuc)试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶线粒体2型(M2)(抗线粒体2型(M2)抗体IgG) 线粒体2型(M2)校准品(1,2,3)含抗线粒体2型(M2)抗体浓度为2、20、200 RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶线粒体2型(M2)质控品(1,2)含抗线粒体2型(M2)抗体两个浓度水平(30±9RU/ml、100±1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶pH 7.4±0.1Tris缓冲液线粒体2型(M2)试剂1 生物素标记的线粒体2型(M2)抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶线粒体2型(M2)试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶线粒体2型(M2)试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PM-Scl(抗PM-Scl抗体免疫球蛋白G (IgG)) PM-Scl校准品(1,2,3)含抗PM-Scl抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶PM-Scl质控品(1,2)含抗PM-Scl抗体两个浓度水平(30±9RU/ml、100±1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶pH 7.4±0.1Tris缓冲液PM-Scl试剂1生物素标记的PM-Scl抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PM-Scl试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶PM-Scl试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PCNA(抗增殖细胞核抗原(PCNA)抗体IgG)PCNA校准品(1,2,3)含抗PCNA抗体浓度为2、20、200RU/ml的pH 7.4±0.1Tris缓冲液1ml/瓶×3瓶1ml/瓶×3瓶1ml/瓶×3瓶PCNA质控品(1,2)含抗PCNA抗体两个浓度水平(30±9RU/ml、100±1ml/瓶×2瓶1ml/瓶×2瓶1ml/瓶×2瓶pH 7.4±0.1Tris缓冲液PCNA试剂1生物素标记的PCNA抗原的pH 7.4±0.1磷酸盐缓冲液1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶PCNA试剂2 碱性磷酸酶标记的抗人IgG抗体的pH 7.2±0.1的Tris缓冲液3ml/瓶×1瓶6ml/瓶×1瓶12ml/瓶×1瓶PCNA试剂MpH 7.5±0.1的Tris缓冲液配制的链酶亲和素结合着的磁性微粒1.5ml/瓶×1瓶3ml/瓶×1瓶6ml/瓶×1瓶2. 性能指标2.1外观试剂盒各组分应齐全、完整、液体无渗漏;磁分离试剂摇匀后为均匀悬浊液,无明显凝集;液体组分应澄清,无沉淀或絮状物;包装标签应清晰,易识别。
(精选)人前心钠肽ProANPelisa试剂盒使用说明书

人前心钠肽(Pro-ANP)elisa试剂盒使用说明书Elisa kit规格:48孔配置/96孔配置标准品稀释液:1.5ml×1瓶酶标试剂:3 ml×1瓶(48)/6 ml×1瓶(96)【人前心钠肽(Pro-ANP) elisa试剂盒】本试剂仅供研究使用计算:以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
试剂盒组成:封板膜:2片(48)/2片(96)说明书:1份密封袋:1个标准品:2700ng/L 0.5ml×1瓶0.5ml×1瓶2-8℃保存酶标包被板: 1×48 1×96 2-8℃保存样品稀释液: 3ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液: 3ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液: 3ml×1瓶 6 ml×1瓶2-8℃保存终止液: 3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液:(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存实验原理:本试剂盒应用双抗体夹心法测定标本中人前心钠肽(Pro-ANP) 水平。
用纯化的人前心钠肽(Pro-ANP) 抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入前心钠肽(Pro-ANP) ,再与HRP标记的前心钠肽(Pro-ANP) 抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的前心钠肽(Pro-ANP) 呈正相关。
N末端B型脑钠肽前体测定试剂盒产品技术要求万孚

N末端B型脑钠肽前体测定试剂盒产品技术要求万孚一、产品概述:N末端B型脑钠肽(NT-proBNP)是B型脑钠肽(BNP)的N末端降解产物,是一种与心血管疾病相关的重要生物标志物。
NT-proBNP的测定可以协助诊断和评估心力衰竭,具有很高的临床价值。
该试剂盒采用化学发光免疫分析法,能够快速、准确地测定NT-proBNP的浓度。
二、产品特点:1. 灵敏度高:本试剂盒的最低检测限低至5 pg/mL,能够检测到非常低浓度的NT-proBNP。
2.精确度高:本试剂盒使用高质量的抗体和自动化化学发光免疫分析仪,测定结果准确可靠。
3. 高度专一性:本试剂盒的抗体具有很高的专一性,只能与NT-proBNP结合,不与其他物质发生反应,避免误测。
4.操作简便:本试剂盒采用微孔板进行操作,步骤简单,操作方便,减少了人为错误的可能性。
5.快速检测:从样品处理到结果产生只需不到1小时,节省了宝贵的时间。
6.适用范围广:本试剂盒适用于各种人群,包括儿童和成人,但建议在特殊人群(如孕妇和新生儿)中进行临床前研究验证。
三、产品性能要求:1. 灵敏度:本试剂盒的最低检测限应低至5 pg/mL,能够检测到非常低浓度的NT-proBNP。
2.精确度:测定结果与参考方法(如质谱法)相比,符合预期的范围。
测定结果的变异系数应低于10%。
3. 特异性:本试剂盒中的抗体应与NT-proBNP结合,不与其他物质发生交叉反应。
交叉反应率应低于1%。
4. 线性:本试剂盒应能够线性测定NT-proBNP在一定浓度范围内的变化。
线性相关系数应大于0.995.稳定性:试剂盒中的试剂应具有良好的稳定性,可以在规定的温度和时间内保持活性。
试剂盒的有效期应不短于12个月。
6.操作性能:试剂盒的操作应简便,不需要复杂的操作步骤和特殊的设备。
试剂盒的操作说明应明确清晰,可供操作人员参考。
7.自动化测试:本试剂盒应能够适应市场上常见的化学发光免疫分析仪进行自动化测试,实现高通量的检测需求。
N末端心房利钠肽前体(NT-proBNP)测定试剂盒(免疫荧光层析法)说明书 新健康成

N末端心房利钠肽前体(NT-proBNP)测定试剂盒(免疫荧光层析法)说明书1. 产品概述本产品是一种针对人体内N末端心房利钠肽前体(NT-proBNP)的测定试剂盒,采用免疫荧光层析法进行测定。
该试剂盒适用于临床医学实验室分析仪器的使用,用于定量测定人体血清或血浆中NT-proBNP的浓度,以协助临床诊断与治疗。
2. 产品原理本试剂盒采用免疫荧光层析法进行测定,利用特定的抗体与目标物NT-proBNP结合形成复合物,通过荧光信号的检测和定量分析,确定样本中目标物的浓度。
3. 试剂组成本试剂盒包含以下组分:•试剂盒盖板(1个)•试剂盒外盒(1个)•标准品(包含不同浓度的NT-proBNP,1套)•样本稀释液(1瓶)•封闭液A(1瓶)•封闭液B(1瓶)•洗涤缓冲液(1瓶)•底物A(1瓶)•底物B(1瓶)•停止液(1瓶)•离心管(适量)•微孔板(96孔)4. 操作步骤步骤1:准备工作1.首先将待测样本,标准品和试剂从冰箱中取出,并使其回至室温。
2.打开试剂盒外盒,检查试剂的完整性和有效期。
3.预热分析仪器至指定温度。
步骤2:标准曲线的制备1.将标准品稀释为不同浓度的工作液。
依次取出标准品管的适量体积,加入稀释液中,充分混合。
2.取出微孔板中的一行作为空白对照,加入适量的稀释液。
3.将制备好的工作液分别加入微孔板中,每个孔加入相同体积的工作液。
4.注意用标签标记好每行的标准品浓度。
步骤3:样本测定1.取出样本离心管,将待测样本加入管中。
2.取出微孔板中的一行作为样本孔,将样本离心管中的样本加入样本孔中。
3.热封微孔板,确保样本充分与试剂反应。
4.将微孔板放入分析仪器中,按照仪器操作说明进行测定。
步骤4:结果分析1.仪器完成测定后,读取测定结果。
2.通过标准曲线,根据测定结果计算出样本中NT-proBNP的浓度。
5. 结果解读对于NT-proBNP的浓度结果,根据临床实验室的参考值范围进行判断和解读。
6. 注意事项•本试剂盒仅适用于专业实验室内使用,禁止非专业人员操作。
N末端脑钠肽(NT—proBNP)检测试剂盒(免疫层析法)产品技术要求模板

医疗器械产品技术要求编号:
N末端脑钠肽(NT—proBNP)检测试剂盒
(免疫层析法)
1.产品型号/规格及划分说明
1.1产品型号/规格
20人份/盒。
1.2结构组成
由检测卡、干燥剂和说明书组成;检测卡由鼠抗NT-proBNP单抗、胶体金鼠抗NT-proBNP单抗,羊抗鼠IgG和硝酸纤维素膜等支持物组成。
1.3 适用范围
用于体外定性检测血清中的N末端脑钠肽(NT-proBNP)。
2.性能指标
2.1外观
2.1.1检测卡应无明显划痕、气泡、外观平整,材料附着牢固。
2.1.2检测卡的文字和标记应清晰、准确。
2.2膜条宽度
检测条的宽度应≥2.5mm。
2.3液体移行速度
液体移行速度应不低于 10mm/分钟
2.4灵敏度(最低检出限)
本试剂盒对 NT-proBNP 最低检出限为 200 pg/mL。
2.5检测范围
本试剂盒 NT-proBNP 检测范围为 200 pg/mL~15,000 pg/mL。
2.6特异性
试剂盒与心肌钙蛋白-I(cTn-I)、肌酸激酶同工酶(CK-MB)、肌红蛋白(Myoglobin) 均不发生交叉反应。
2.7精密度
2.7.1批内精密度
取同一批号试剂对精密度参考品(NT-proBNP 1000 pg/mL)分别进行 10 次测定,反应结果应一致,且显色度应均一。
2.7.2批间精密度
分别取连续三个批号试剂对精密度参考品(NT-proBNP 1000 pg/mL)分别进行 10 次测定,反应结果应一致,且显色度应均一。
钠测定试剂盒(半乳糖苷酶法)产品技术要求haifeng
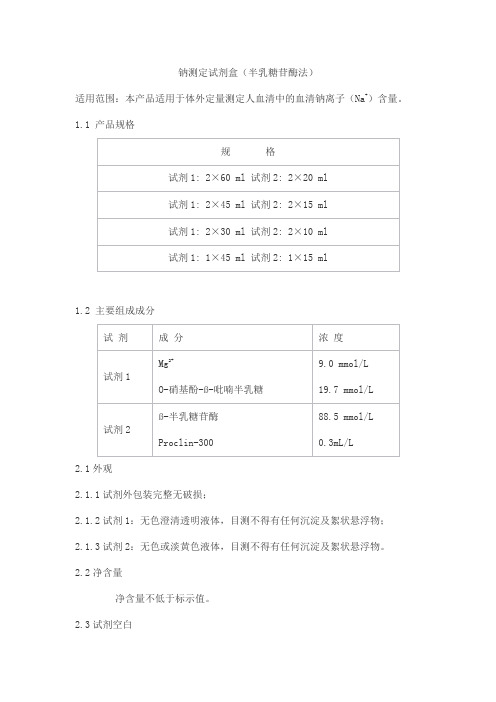
钠测定试剂盒(半乳糖苷酶法)
适用范围:本产品适用于体外定量测定人血清中的血清钠离子(Na+)含量。
1.1 产品规格
1.2 主要组成成分
2.1外观
2.1.1试剂外包装完整无破损;
2.1.2试剂1:无色澄清透明液体,目测不得有任何沉淀及絮状悬浮物;
2.1.3试剂2:无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
2.2净含量
净含量不低于标示值。
2.3试剂空白
2.3.1空白吸光度
测定待检试剂在波长405nm(主)/700nm(副)、37℃条件下:A≤1.0。
2.3.2 空白吸光度变化率
空白吸光度变化率△A/min≤0.5。
2.4 线性范围
(70,200)mmol/L,相关系数r≥0.990。
2.5 分析灵敏度
在说明书规定参数设定条件下,样本浓度为140mmol/L时,△A/min≥0.045。
2.6 精密度
2.6.1批内重复性
CV≤5.0%。
2.6.2 批间差
相对偏差 R≤10.0%。
2.7 准确度
测定标准物质GBW09152,相对偏差不超过±10.0%。
2.8 稳定性
未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测,检测结果应满足2.1、2.3、2.4、2.5、2.6.1和2.7的规定。
肾素(Renin)测定试剂盒(化学发光法)产品技术要求深圳泰乐德

肾素(Renin)测定试剂盒
(化学发光法)
2. 性能指标
2.1外观
2.1.1试剂盒中各组分应齐全、完整、无泄漏,试剂盒(瓶)上包装标签应清晰、无磨损。
2.1.2试剂条中的磁微粒试剂摇匀后,应为均匀悬浊液,无明显凝集;其他液体试剂溶液组分应澄清,无悬浮物、无沉淀物、无絮状物。
2.1.3校准品、质控品为冻干品,呈块状固体,不起泡、不塌陷,复溶后应为清澈透明液体,无沉淀,无悬浮物,无絮状物。
2.2准确度
相对偏差应在±10%范围内。
2.3空白限
应不大于2pg/mL。
2.4重复性
批内变异系数CV应不大于10%。
2.5线性范围
试剂盒线性范围(2-500)pg/mL,在此线性范围内,相关系数r应≥0.9900。
2.6批间差
批间变异系数CV应不大于15%。
2.7校准品、质控品均一性
瓶内均一性≤8%,瓶间均一性≤5%。
2.8校准品赋值准确性
相对偏差应在±10%范围内。
2.9质控品赋值准确性
质控品测值在参考范围内。
肌钙蛋白T(cTnT)测定试剂盒(化学发光免疫分析法)产品技术要求taige
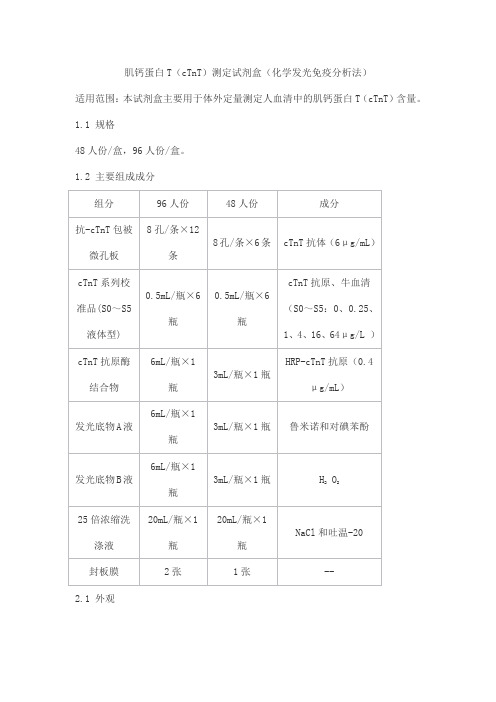
肌钙蛋白T(cTnT)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒主要用于体外定量测定人血清中的肌钙蛋白T(cTnT)含量。
1.1 规格
48人份/盒,96人份/盒。
1.2 主要组成成分
2.1 外观
液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量
装量不少于标示值。
2.3 准确性
回收率应在90.0%~110%范围内。
2.4 剂量-反应曲线线性相关系数
在[0.25,64]μg/L范围内,用log-logit数学模式拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度
2.5.1 重复性(C.V%)应不高于15.0%;
2.5.2 批间差(C.V%)应不高于20.0%。
2.6 最低检出量
应不高于0.250μg/L。
2.7 质控血清测定值
应在允许的范围之内。
2.8 特异性
cTnT与肌红蛋白、cTnI、肌酸激酶同工酶的交叉反应如下:
2.9 稳定性
2.9.1 37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性
按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与湖南隆润达生物技术有限公司的cTnT试剂盒比对赋值。
N末端脑利钠肽前体(NT-proBNP)测定试剂盒(电化学发光免疫分析法)产品技术要求lianzhongtaike
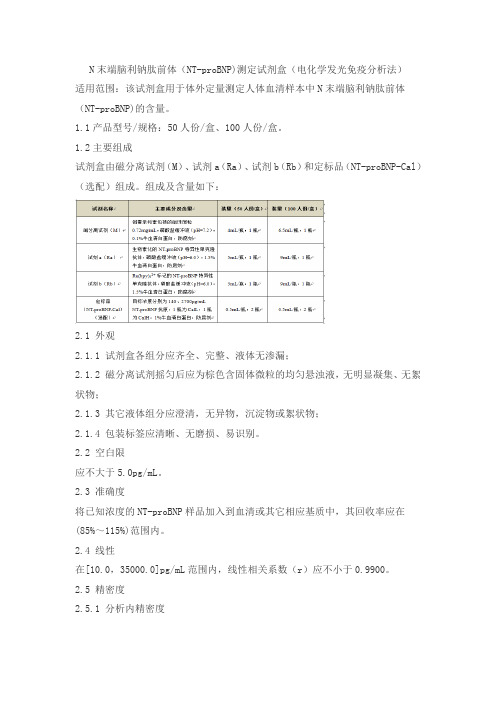
N末端脑利钠肽前体(NT-proBNP)测定试剂盒(电化学发光免疫分析法)适用范围:该试剂盒用于体外定量测定人体血清样本中N末端脑利钠肽前体(NT-proBNP)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(NT-proBNP-Cal)(选配)组成。
组成及含量如下:2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于5.0pg/mL。
2.3 准确度将已知浓度的NT-proBNP样品加入到血清或其它相应基质中,其回收率应在(85%~115%)范围内。
2.4 线性在[10.0,35000.0]pg/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(500.0±100.0pg/mL)、(1000.0±200.0pg/mL)和(5000.0±1000.0pg/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(500.0±100.0pg/mL)、(1000.0±200.0pg/mL)和(5000.0±1000.0pg/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源到罗氏的NT-proBNP定标液。
血浆心钠素(ANF)放免分析试剂盒的研制

第10卷第3期1997年8月同 位 素Jou rnal of Iso topesV o l.10 N o.3A ug.1997血浆心钠素(ANF)放免分析试剂盒的研制苏静贤 侯惠仁(中国原子能科学研究院同位素研究所,北京102413)采用氯胺T(Ch2T)法对人心钠素(Α2hAN F,以下简称AN F)进行125I标记,用Sephadex G50柱分离纯化,得到比活度>10M Bq Λg、放化纯度>90%、与过量抗体结合率为(78—81)%的125I2 AN F。
建立了稳定的冻干系列标准及简便、快速的分析方法。
试剂盒的标准曲线范围为65—3250 pmo l L,在曲线范围内测定人血浆的平均回收率为(9314—115)%,高值血浆稀释相关系数r= 019992—019998,灵敏度为17pmo l L,批内变异系数为(312—415)%,批间变异系数为(311—612)%,非特异结合率为(119—415)%。
健康人血浆的AN F含量正常值为12210±2418pmo l L(xθ±s,n=97)。
关键词 心钠素(AN F) 放免分析 试剂盒心钠素(Cardinatrin)亦称心房利钠因素(A trial N atriu retic Facto r,简称AN F)。
Α2hAN F 由28个氨基酸组成,相对分子量为3080.5。
它主要分布在心脏,也广泛分布在人体的肺、肾上腺等多种器官中[1—3]。
1984年以来,心钠素在人体内的分布、释放、代谢、受体功能和调节等方面研究及测试方法研究取得很大进展[3,4],特别是用放免分析测定人血浆中的AN F含量,为临床心血管疾病研究和治疗监测提供了有效依据[1,5,6]。
目前,AN F放免分析方法有平衡法和非平衡法两种[5,6]。
本文拟建立平衡分析法,对标记物、标准品、抗血清的介质、反应温度、反应时间和反应体系进行条件试验,旨在研制出快速、灵敏、操作简单、准确测定人血浆中AN F含量的试剂盒。
心肌肌钙蛋白I测定试剂盒(磁微粒化学发光法)产品技术要求huaketaikang
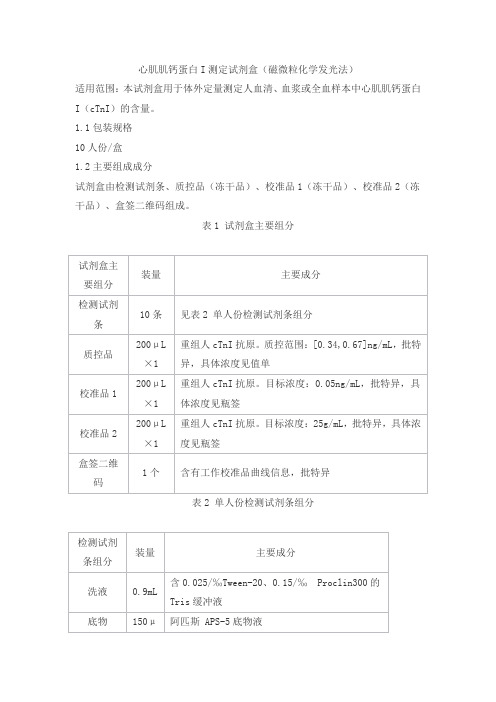
心肌肌钙蛋白I测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人血清、血浆或全血样本中心肌肌钙蛋白I(cTnI)的含量。
1.1包装规格10人份/盒1.2主要组成成分试剂盒由检测试剂条、质控品(冻干品)、校准品1(冻干品)、校准品2(冻干品)、盒签二维码组成。
表1 试剂盒主要组分表2 单人份检测试剂条组分2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至出厂商的工作校准品。
2.3准确度将已知浓度的肌钙蛋白I加入到低值样本中,其回收率应在[85%,115%]范围内。
2.4空白限零浓度样本做20次重复,空白限应≤0.01ng/mL。
2.5线性在[0.05, 50]ng/mL的线性范围内,相关系数r应≥0.990。
2.6重复性对高、低值样本各测试10次,CV≤10%。
2.7批间差用三个批号的试剂盒对高、低值样本各测试10次,CV≤15%。
2.8 特异性浓度为1000ng/mL的心肌肌钙蛋白C(cTnC)、心肌肌钙蛋白T(cTnT)、骨肌心肌肌钙蛋白I(sTnI)交叉反应率应小于5%。
2.9质控品赋值有效性测定值在质控品质控范围内。
2.10校准品和质控品瓶间差校准品和质控品瓶间差CV<10%2.11稳定性2.11.1效期稳定性取效期后的试剂盒检测外观、准确度、空白限、线性、重复性、特异性,应符合2.1、2.3~2.6、2.8的要求。
2.11.2 质控品复溶稳定性质控品开瓶复溶后,在2℃~8℃密封避光保存,可以稳定3天,在第4天检测质控品重复性和赋值有效性,应符合2.6、2.9的要求。
2.11.3 校准品复溶稳定性校准品开瓶复溶后,在2℃~8℃密封避光保存,可以稳定3天,在第4天检测准确度和线性,应符合2.3、2.5的要求。
心脏型脂肪酸结合蛋白(H-FABP)测定试剂盒(化学发光免疫分析法)产品技术要求tongxin
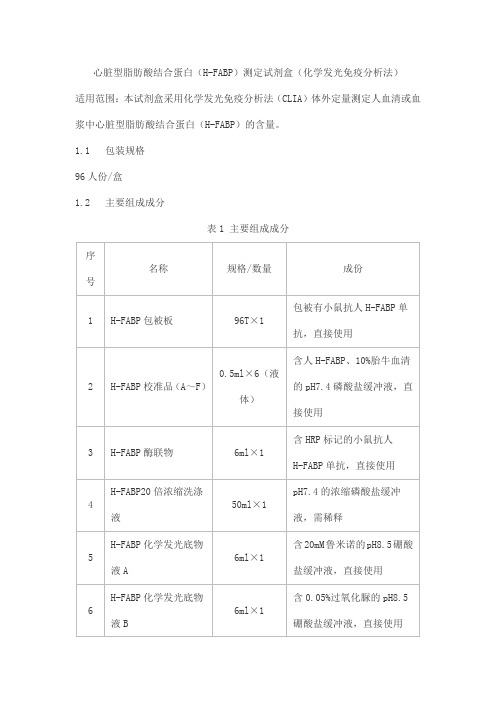
心脏型脂肪酸结合蛋白(H-FABP)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒采用化学发光免疫分析法(CLIA)体外定量测定人血清或血浆中心脏型脂肪酸结合蛋白(H-FABP)的含量。
1.1 包装规格96人份/盒1.2 主要组成成分表1 主要组成成分注:校准品溯源至同位素稀释质谱法,校准品(A~F)目标浓度为0、3、10、30、80、160ng/ml。
2.1 外观组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;标签应清晰,易识别。
2.2 装量液体装量应不少于标示值。
2.3 准确度在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在85~115%范围内。
2.4 线性在线性范围 [2.5,160]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限应不大于2.5ng/ml。
2.6 重复性变异系数(CV)应不大于10.0%。
2.7 批间差批间变异系数(CV)应不大于15.0%。
2.8 分析特异性测定浓度为300ng/ml人肝脏型脂肪酸结合蛋白(L-FABP),交叉反应率小于2.5%。
2.9 稳定性产品在2~8℃条件下保存有效期为12个月,取到效期产品在1个月内进行检测,检测结果应满足2.3~2.6,2.8项要求。
术语4.1 CLIA:Chemiluminescent immunoassay化学发光免疫分析4.2 H-FABP:Heart-type Fatty Acid-Binding Protein心脏型脂肪酸结合蛋白4.3 RLU:Relative Light Unit相对光单位。
心肌标志物6项质控品产品技术要求北京康彻思坦

心肌标志物6项质控品适用范围:本品适用于使用厦门万泰凯瑞生物技术有限公司的心肌肌钙蛋白T 测定试剂盒(化学发光微粒子免疫检测法)、N端脑钠肽前体测定试剂盒(化学发光微粒子免疫检测法)、超敏C反应蛋白测定试剂盒(化学发光微粒子免疫检测法)、心肌肌钙蛋白I测定试剂盒(化学发光微粒子免疫检测法)、肌红蛋白测定试剂盒(化学发光微粒子免疫检测法)和肌酸激酶同工酶测定试剂盒(化学发光微粒子免疫检测法)进行临床检测时的实验室内部质量控制。
1.1 包装规格水平1(复溶体积):1×2mL,10×2mL,30×2mL;水平2(复溶体积):1×2mL,10×2mL,30×2mL;水平3(复溶体积):1×2mL,10×2mL,30×2mL;全水平(复溶体积):水平1 1×2mL,水平2 1×2mL,水平3 1×2mL。
1.2 主要组成成分注:不同批次质控品不能混用;每批次质控品的质控范围见试剂盒内靶值单。
2.1外观试剂(盒)各组分应齐全、完整;标签应清晰,包装无破损。
冻干品应为疏松体,复溶后液体应澄清。
2.2质控品赋值有效性检测结果应在质控范围内。
2.3 均匀性2.3.1瓶间差瓶间变异系数应不高于15%。
2.3.2瓶内均匀性瓶内变异系数应不高于10%。
2.4稳定性2.4.1复溶稳定性原包装质控品在开瓶完全复溶后,置于2℃~8℃条件下保存,放置24小时后进行检测,结果应符合2.2项的规定。
2.4.2 效期稳定性原包装质控品在2℃~8℃的条件下储存,有效期为36个月。
取效期末产品进行检测,结果应符合2.1、2.2、2.3.2项的规定。
小鼠心钠肽(ANP)ELISA试剂盒使用说明书本
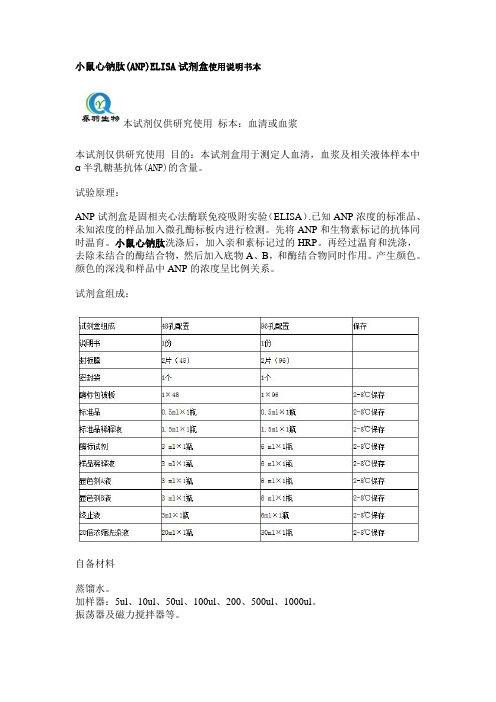
小鼠心钠肽(ANP)ELISA试剂盒使用说明书本本试剂仅供研究使用标本:血清或血浆本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中α半乳糖基抗体(ANP)的含量。
试验原理:ANP试剂盒是固相夹心法酶联免疫吸附实验(ELISA).已知ANP浓度的标准品、未知浓度的样品加入微孔酶标板内进行检测。
先将ANP和生物素标记的抗体同时温育。
小鼠心钠肽洗涤后,加入亲和素标记过的HRP。
再经过温育和洗涤,去除未结合的酶结合物,然后加入底物A、B,和酶结合物同时作用。
产生颜色。
颜色的深浅和样品中ANP的浓度呈比例关系。
试剂盒组成:自备材料蒸馏水。
加样器:5ul、10ul、50ul、100ul、200、500ul、1000ul。
振荡器及磁力搅拌器等。
安全性避免直接接触终止液和底物A、B。
一旦接触到这些液体,请尽快用水冲洗。
实验中不要吃喝、抽烟或使用化妆品。
不要用嘴吸取试剂盒里的任何成份。
操作注意事项试剂应按标签说明书储存,使用前恢复到室温。
稀稀过后的标准品应丢弃,不可保存。
实验中不用的板条应立即放回包装袋中,密封保存,以免变质。
不用的其它试剂应包装好或盖好。
不同批号的试剂不要混用。
保质前使用。
使用一次性的吸头以免交叉污染,吸取终止液和底物A、B液时,避免使用带金属部分的加样器。
使用干净的塑料容器配置洗涤液。
使用前充分混匀试剂盒里的各种成份及样品。
洗涤酶标板时应充分拍干,不要将吸水纸直接放入酶标反应孔中吸水。
底物A应挥发,避免长时间打开盖子。
底物B对光敏感,避免长时间暴露于光下。
避免用手接触,有毒。
实验完成后应立即读取OD值。
加入试剂的顺序应一致,以保证所有反应板孔温育的时间一样。
按照说明书中标明的时间、加液的量及顺序进行温育操作。
样品收集、处理及保存方法血清-----操作过程中避免任何细胞刺激。
使用不含热原和内毒素的试管。
收集血液后,1000×g离心10分钟将血清和红细胞迅速小心地分离。
抗nRNP Sm抗体IgG(Anti nRNPSm IgG)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求

抗nRNP/Sm抗体IgG(Anti-nRNP/Sm IgG)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中的抗nRNP/Sm抗体IgG(Anti-nRNP/Sm IgG)的含量。
1.1 产品规格100测试/盒1.2 主要组成成分1.2.1 Anti-nRNP/Sm IgG试剂1号(Anti-nRNP/Sm IgG-R1):5mL/瓶×1瓶,含有生物素标记的nRNP/Sm抗原(约0.25μg/mL)、牛血清白蛋白(0.5%)的Tris缓冲液(0.1mol/L,pH8.0)。
1.2.2 Anti-nRNP/Sm IgG试剂2号(Anti-nRNP/Sm IgG-R2):15mL/瓶×1瓶,含有ALP标记的羊抗人多克隆抗体(约0.25μg/mL)、牛血清白蛋白(3.0%)的Tris缓冲液(0.1mol/L,pH7.5)。
1.2.3 Anti-nRNP/Sm IgG磁分离试剂(Anti-nRNP/Sm IgG-M):5mL/瓶×1瓶,含有链霉亲和素标记的磁性微粒(约0.5mg/mL)、牛血清白蛋白(0.5%)的Tris缓冲液(0.1mol/L,pH8.0)。
1.2.4 Anti-nRNP/Sm IgG校准品(Anti-nRNP/Sm IgG-STD)(选配):6个水平的液体校准品,0.5mL/瓶×6个水平,含一定浓度抗nRNP/Sm抗体IgG和牛血清白蛋白(3.0%)的Tris缓冲液(0.1mol/L,pH7.5),目标浓度分别为0、5、20、50、100和200 RU /mL,具体浓度详见校准品条码。
1.2.5 Anti-nRNP/Sm IgG质控品(Anti-nRNP/Sm IgG-QC)(选配):2个水平的液体质控品,1mL/瓶×2个水平,含一定量抗nRNP/Sm抗体IgG和牛血清白蛋白(3.0%)的Tris缓冲液(0.1mol/L,pH7.5),质控品目标范围分别为:(20±4)RU/mL和(100±20)RU/mL,由于每批质控品的浓度范围有所不同,具体浓度范围详见每批的质控品条码。
N末端B型钠尿肽前体测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求rejing
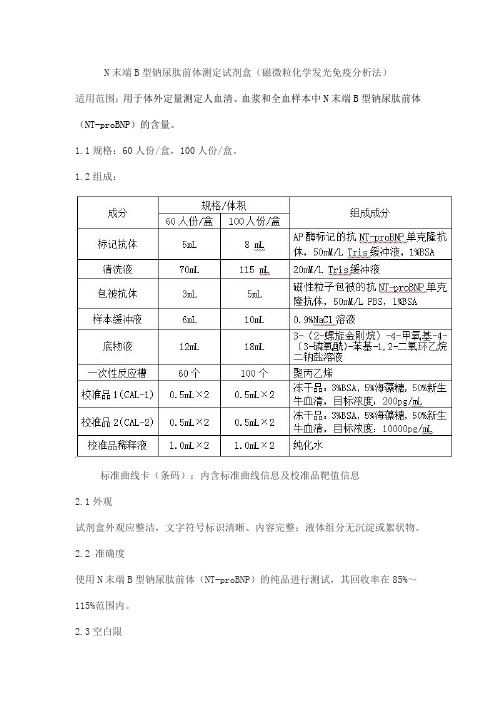
N末端B型钠尿肽前体测定试剂盒(磁微粒化学发光免疫分析法)
适用范围:用于体外定量测定人血清、血浆和全血样本中N末端B型钠尿肽前体(NT-proBNP)的含量。
1.1规格:60人份/盒,100人份/盒。
1.2组成:
标准曲线卡(条码):内含标准曲线信息及校准品靶值信息
2.1外观
试剂盒外观应整洁,文字符号标识清晰、内容完整;液体组分无沉淀或絮状物。
2.2 准确度
使用N末端B型钠尿肽前体(NT-proBNP)的纯品进行测试,其回收率在85%~115%范围内。
2.3空白限
试剂盒空白限应不大于50pg/mL。
2.4 线性
[50, 30000] pg/mL范围内,相关系数(r)应不低于0.9900。
2.5精密度
2.5.1批内变异系数(CV)应不高于8.0%。
2.5.2批间变异系数(CV)应不高于15.0%。
2.5.3批内瓶间差变异系数(CV)应不高于8.0%。
2.6 特异性
表1 与其它物质的交叉反应
2.7溯源性
根据GB/T21415有关规定提供校准品的来源、溯源过程及测量不确定度等内容,溯源至企业工作校准品并与已上市产品比对赋值。
2.8稳定性
2℃~8℃保存12个月,取到效期后两个月内的产品进行检测,测定结果应符合上述2.2、2.3、2.4、2.5.1要求。
心钠素(ANP)测定试剂盒(化学发光免疫分析法)产品技术要求泰格
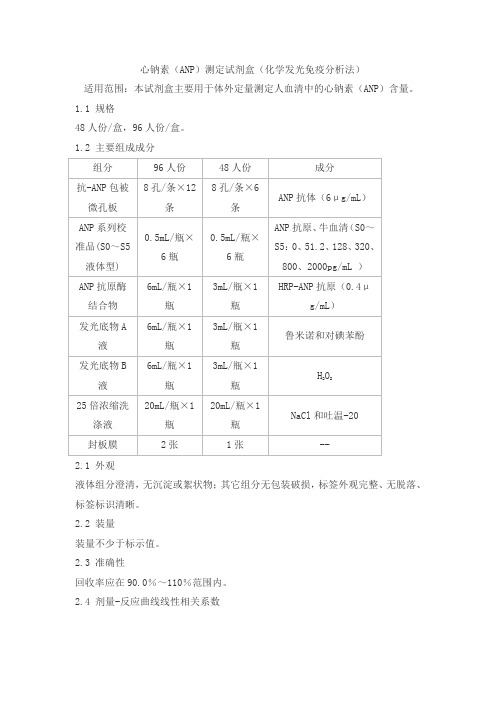
心钠素(ANP)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒主要用于体外定量测定人血清中的心钠素(ANP)含量。
1.1 规格
48人份/盒,96人份/盒。
1.2 主要组成成分
2.1 外观
液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量
装量不少于标示值。
2.3 准确性
回收率应在90.0%~110%范围内。
2.4 剂量-反应曲线线性相关系数
在[51.2,2000]pg/mL范围内,用log-logit数学模式拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度
2.5.1 重复性(CV%)应不高于15.0%;
2.5.2 批间差(CV%)应不高于20.0%。
2.6 最低检出量
应不高于50.00pg/mL。
2.7 质控血清测定值
应在允许的范围之内。
2.8 特异性
ANP与生长抑素、β-内啡肽、内皮素的交叉反应如下:
2.9 稳定性
2.9.1 37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性
按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与ANP放免试剂盒(北京北方生物技术研究所)比对赋值。
胰岛素(Ins)测定试剂盒(化学发光免疫分析法)产品技术要求huaketai

胰岛素(Ins)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中胰岛素(Ins)的含量。
包装规格为96人份/盒。
主要组成成分见表1:表1 组成2.1物理性能试剂盒的各液体组分应澄明,无沉淀或絮状物。
冻干粉呈疏松体,加入纯化水复溶后,10min内溶解。
包被抗体微孔板的铝箔袋,应无破损现象。
2.2 准确度试剂盒内校准品与相应浓度的国家标准品同时进行分析测定,用Log(x)-Log(y)模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.3 线性在[5-160] mIU/L区间内,用 Log(x)-Log(y)数学模型拟合,剂量-反应曲线线性相关系数(r)应不低于0.9900。
2.4 精密度2.4.1 分析内精密度分别检测高值和低值两个样本,分析内精密度(CV)应不高于10.0%。
2.4.2 批间精密度在多个不同批次产品之间,样本测定结果的变异系数(CV)应不高于15.0%。
2.5 最低检出限试剂盒最低检出限应不高于2.0 mIU/L。
2.6 特异性表2 与 CP、胰岛素原的交叉反应2.7 稳定性2.7.1 效期稳定性2℃~8℃保存,有效期12个月,效期后分别检测2.1~2.4.1、2.5项,其结果应符合各项要求。
2.7.2 复溶稳定性冻干粉试剂开瓶后(复溶后),2℃-8℃保存,有效期1个月,效期后分别检测2.1~2.4.1、2.5项,其结果应符合各项要求。
2.8 溯源性应根据GB/T 21415-2008提供所用Ins校准品溯源性资料,并溯源到国家标准品人胰岛素(Ins),编号:150519。
B型利钠肽测定试剂盒(化学发光免疫分析法)产品技术要求新产业

2. 性能指标
2.1 外观和性状
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固。
2.1.2试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2重复性
分别用高、中、低3个浓度的样本,各重复检测10次,其变异系数(CV)应不大于8%。
2.3批间差
用3个批号试剂盒分别检测高、中、低3个浓度的样本,3个批号试剂盒之间的异系数(CV)应不大于15%。
2.4准确度
对企业校准品进行检测,其测量结果的相对偏差应不超过±10%。
2.5检出限
检出限应≤14.0 pg/mL。
2.6线性
在(14.0~5000)pg/mL浓度范围内,线性相关性系数(r)绝对值应≥0.9900。
2.7 校准品均一性
)应≤8%。
校准品均一性(CV
均一性
2.8 质控品预期结果
质控品1每次测定结果应在(140~260)pg/mL范围内,质控品2每次测定结果应在(700~1300)pg/mL范围内。
2.9 质控品均一性
)应≤8%。
质控品均一性(CV
均一性。
6-酮-前列腺素F1α(6-keto-PGF1α)测定试剂盒(化学发光免疫分析法)产品技术要求taige

6-酮-前列腺素F1α(6-keto-PGF1α)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒主要用于体外定量测定人血清中的6-酮-前列腺素F1α(6-keto-PGF1α)含量。
1.1 规格
48人份/盒,96人份/盒。
1.2 主要组成成分
2.1 外观
液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量
装量不少于标示值。
2.3 准确性
回收率应在90.0%~110%范围内。
2.4 剂量-反应曲线线性相关系数
在[22.2,1800]pg/mL范围内,用log-logit数学模式拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度
2.5.1 重复性(C.V%)应不高于15.0%;
2.5.2 批间差(C.V%)应不高于20.0%。
2.6 最低检出量
应不高于20.00pg/mL。
2.7 质控血清测定值
应在允许的范围之内。
2.8 特异性
6-keto-PGF1α与血栓素B2、心钠素、内皮素、花生四烯酸的交叉反应如下:
2.9 稳定性
2.9.1 37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性
按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与6-keto-PGF1α放免试剂盒(北京普尔伟业生物科技有限公司)比对赋值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
心钠素(ANP)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒主要用于体外定量测定人血清中的心钠素(ANP)含量。
1.1 规格
48人份/盒,96人份/盒。
1.2 主要组成成分
2.1 外观
液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量
装量不少于标示值。
2.3 准确性
回收率应在90.0%~110%范围内。
2.4 剂量-反应曲线线性相关系数
在[51.2,2000]pg/mL范围内,用log-logit数学模式拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度
2.5.1 重复性(CV%)应不高于15.0%;
2.5.2 批间差(CV%)应不高于20.0%。
2.6 最低检出量
应不高于50.00pg/mL。
2.7 质控血清测定值
应在允许的范围之内。
2.8 特异性
ANP与生长抑素、β-内啡肽、内皮素的交叉反应如下:
2.9 稳定性
2.9.1 37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性
按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与ANP放免试剂盒(北京北方生物技术研究所)比对赋值。
