第5章 蛋白质结构解析 PPT
合集下载
蛋白质的结构及功能课件.ppt

蛋白质的结构及功能课件
2. 侧链有极性但不带电荷的氨基酸是极性中 性氨基酸
蛋白质的结构及功能课件
3. 侧链含芳香基团的氨基酸是芳香族氨基酸
蛋白质的结构及功能课件
4. 侧链含负性解离基团的氨基酸是酸性氨基酸
蛋白质的结构及功能课件
5. 侧链含正性解离基团的氨基酸属于碱性 氨基酸
蛋白质的结构及功能课件
3. 氧化供能
蛋白质的结构及功能课件
第一节
蛋白质的分子组成
The Molecular Component of Protein
蛋白质的结构及功能课件
蛋白质的元素组成 主要有C、H、O、N和S。 有些蛋白质含有少量P或金属元素Fe、
Cu、Zn、Mn、Co、Mo,个别蛋白质还 含有 I 。
蛋白质的结构及功能课件
蛋白质的结构及功能课件
第三节
蛋白质结构与功能的关系
The Relation of Structure and Function of Protein
蛋白质的结构及功能课件
一、蛋白质一级结构与功能的关系
(一)一级结构是空间构象的基础
二
硫
键
牛核糖核酸酶的 一级结构
蛋白质的结构及功能课件
去除尿素、 β-巯基乙醇
蛋白质的结构及功能课件
生物化学与医学
• 生物化学的理论与技术已渗透到医学科 学的各个领域
• 生物化学在生命科学中占有重要的地位 • 生物化学的发展促进了疾病病因、诊断
和治疗的研究
蛋白质的结构及功能课件
本课内容简介(一)
• 蛋白质的结构与功能 •酶 • 生物氧化 • 糖代谢 • 脂类代谢 • 氨基酸代谢
几种特殊氨基酸
Gly:无手性碳原子。 Pro:为环状亚氨基酸。 Cys:可形成二硫键。
2. 侧链有极性但不带电荷的氨基酸是极性中 性氨基酸
蛋白质的结构及功能课件
3. 侧链含芳香基团的氨基酸是芳香族氨基酸
蛋白质的结构及功能课件
4. 侧链含负性解离基团的氨基酸是酸性氨基酸
蛋白质的结构及功能课件
5. 侧链含正性解离基团的氨基酸属于碱性 氨基酸
蛋白质的结构及功能课件
3. 氧化供能
蛋白质的结构及功能课件
第一节
蛋白质的分子组成
The Molecular Component of Protein
蛋白质的结构及功能课件
蛋白质的元素组成 主要有C、H、O、N和S。 有些蛋白质含有少量P或金属元素Fe、
Cu、Zn、Mn、Co、Mo,个别蛋白质还 含有 I 。
蛋白质的结构及功能课件
蛋白质的结构及功能课件
第三节
蛋白质结构与功能的关系
The Relation of Structure and Function of Protein
蛋白质的结构及功能课件
一、蛋白质一级结构与功能的关系
(一)一级结构是空间构象的基础
二
硫
键
牛核糖核酸酶的 一级结构
蛋白质的结构及功能课件
去除尿素、 β-巯基乙醇
蛋白质的结构及功能课件
生物化学与医学
• 生物化学的理论与技术已渗透到医学科 学的各个领域
• 生物化学在生命科学中占有重要的地位 • 生物化学的发展促进了疾病病因、诊断
和治疗的研究
蛋白质的结构及功能课件
本课内容简介(一)
• 蛋白质的结构与功能 •酶 • 生物氧化 • 糖代谢 • 脂类代谢 • 氨基酸代谢
几种特殊氨基酸
Gly:无手性碳原子。 Pro:为环状亚氨基酸。 Cys:可形成二硫键。
第五章蛋白质结构预测1ppt课件

• 当发现第i、i+1、i+4位(如7,8,11) 为疏水残基时,这一片段也被预测为α螺 旋。
对于β折叠的形成规律: • 对于β折叠,也存在着一些特征的亲疏水 残基间隔模式,埋藏的β折叠通常由连续 的疏水残基组成,一侧暴露的β折叠则通 常具有亲水-疏水的两残基重复模式。
•原则上,通过在序列中搜寻特殊的亲疏水 残基间隔模式,就可以预测α螺旋和β折叠。
(ii)β折叠规则
• 相邻6个残基中若有4个倾向于形成β折叠, 则认为是折叠核。
• 折叠核向两端延伸直至4个残基的平均折叠倾 向性因子{P}<1.0。
• 若延伸后的片段的{P}>1.05,则预测为β折 叠。
(iii)转角规则
• 转角的模型为四肽
fj 1fj 2fj 3fj 47 .5 1 5 0
例如:Glu主要出现在螺旋中 Asp和Gly主要分布在转角中 Pro也常出现在转角中,但是绝不会出现在
螺旋中
• 可以根据每种氨基酸残基形成二级结构的倾 向性或者统计规律进行二级结构预测
• 经验参数法由Chou 和Fasman在70年代提 出来
• 是一种基于单个氨基酸残基统计的经验预测 方法。 通过统计分析,获得的每个残基出现 于特定二级结构构象的倾向性因子,进而利 用这些倾向性因子预测蛋白质的二级结构。
一个氨基酸残基的构象倾向性因子定义为 Pi = Ai / Ti (i= ,β,c, t)
式中下标i表示构象态 如螺旋、β折叠、转角、无规卷曲等;
Ti是所有被统计残基处于构象态i的比例; Ai是第A种残基处于构象态i 的比例; Pi大于1.0表示该残基倾向于形成二级结构构象
i,小于1.0则表示倾向于形成其它构象。
• 在进行结构预测时考虑氨基酸残基的物理化学性 质
对于β折叠的形成规律: • 对于β折叠,也存在着一些特征的亲疏水 残基间隔模式,埋藏的β折叠通常由连续 的疏水残基组成,一侧暴露的β折叠则通 常具有亲水-疏水的两残基重复模式。
•原则上,通过在序列中搜寻特殊的亲疏水 残基间隔模式,就可以预测α螺旋和β折叠。
(ii)β折叠规则
• 相邻6个残基中若有4个倾向于形成β折叠, 则认为是折叠核。
• 折叠核向两端延伸直至4个残基的平均折叠倾 向性因子{P}<1.0。
• 若延伸后的片段的{P}>1.05,则预测为β折 叠。
(iii)转角规则
• 转角的模型为四肽
fj 1fj 2fj 3fj 47 .5 1 5 0
例如:Glu主要出现在螺旋中 Asp和Gly主要分布在转角中 Pro也常出现在转角中,但是绝不会出现在
螺旋中
• 可以根据每种氨基酸残基形成二级结构的倾 向性或者统计规律进行二级结构预测
• 经验参数法由Chou 和Fasman在70年代提 出来
• 是一种基于单个氨基酸残基统计的经验预测 方法。 通过统计分析,获得的每个残基出现 于特定二级结构构象的倾向性因子,进而利 用这些倾向性因子预测蛋白质的二级结构。
一个氨基酸残基的构象倾向性因子定义为 Pi = Ai / Ti (i= ,β,c, t)
式中下标i表示构象态 如螺旋、β折叠、转角、无规卷曲等;
Ti是所有被统计残基处于构象态i的比例; Ai是第A种残基处于构象态i 的比例; Pi大于1.0表示该残基倾向于形成二级结构构象
i,小于1.0则表示倾向于形成其它构象。
• 在进行结构预测时考虑氨基酸残基的物理化学性 质
第五章-核磁共振方法解析蛋白质结构

核磁共振的原理
• 自旋量子数(I)
原子序数和原子质量都为偶数:I=0(12C,
16O)
原子序数为奇数,原子质量为偶数: I=整数(14N, 2H, 10B)
原子质量为奇数: I=半整数(1H,
13C, 15N, 31P)
• 自旋状态(M)
M =I,(I-1),(I-2),…,-I
对于1H,
13C, 15N, 31P
2.
3.
耦合常数
• 自旋耦合
共价键(1-4个键)相连核之间的特性张量的相互作用
1
H
C
1
H
1
H
13
three-bond one-bond
• 自旋裂分
由于被测核与相邻核自旋耦合引起的谱线裂分, 裂分的 大小称为耦合常数 bb S ba S I aa
J (Hz)
I
ab
I
S
• • • • •
耦合常数不随磁场的变化而变化 两核耦合引起对方谱线裂分的大小相等 相距越远、所隔键数越多,耦合越弱 重原子比轻原子耦合强 耦合常数的大小与耦合核的二面角有关
核磁共振谱仪的组成
•Magnet
•Probe
•Console •Computer
对磁体的要求
• 高磁场强度
• 高稳定性
• 高均匀性
高磁场强度:高分辨率高灵敏度
• 信噪比的完全方程
Oestradiol-acetate
900 MHz
1450
1400
1350
1300
1250
1200
1150
1100
• • • • • •
NOE—5Å 化学位移—二级结构 偶极常数—二面角 氢氘交换—氢键 顺磁驰豫增强(PRE)—远距离(30Å) 残余偶极耦合(RDC)—空间定向
五、蛋白质的结构和功能-PPT课件

肌红蛋白/血红蛋白
含有血红素辅基 , 亚基与Mb的三级结构相似,结合O2。
(二)血红蛋白亚基构象变化可影响亚基 与氧结合
Hb:四亚基,运输O2
Mb:单亚基,储存O2
肌红蛋白(myoglobin,Mb)
肌红蛋白是一个只有三级 结构的单链蛋白质,有8段α-螺 旋结构。
血红蛋白(hemoglobin,Hb)
第五章 蛋白质的结构与功能
Structure and Function of Protein
蛋白质(protein)
是生物体含量最多的生物大分子,由多 个氨基酸通过肽键相连而成的一类含氮 化合物。 人体含蛋白质种类多达10万余种,是细 胞中含量最丰富的高分子化合物。
二、蛋白质的生物学重要性
1. 蛋白质是生物体重要组成成分 分布广:所有器官、组织都含有蛋白
(一)一级结构与功能的关系
1. 一级结构是空间结构与功能的基础
例:镰刀状红细胞贫血
血红蛋白链第6位氨基酸
6 C(146) 正常 N-val ·his ·leu ·thr ·pro ·glu ·glu ·····
病人
N-val ·his ·leu ·thr ·pro ·val ·glu ····· C(146)
透析 * 透析 利用透析袋把大分
子蛋白质与小分子
化合物分开的方法。
透析装置
(三)蛋白质的变性、沉淀和凝固:
• 变性定义:
在某些物理和化学因素作用下,其特
定的空间构象被破坏,也即有序的空 间结构变成无序的空间结构,从而导 致其理化性质改变和生物活性的丧失。
例:核糖核酸酶的变性与复性
天然状态, 有催化活性 去除尿素、 β-巯基乙醇 二硫键破坏 后,生物学活性 丧失。
含有血红素辅基 , 亚基与Mb的三级结构相似,结合O2。
(二)血红蛋白亚基构象变化可影响亚基 与氧结合
Hb:四亚基,运输O2
Mb:单亚基,储存O2
肌红蛋白(myoglobin,Mb)
肌红蛋白是一个只有三级 结构的单链蛋白质,有8段α-螺 旋结构。
血红蛋白(hemoglobin,Hb)
第五章 蛋白质的结构与功能
Structure and Function of Protein
蛋白质(protein)
是生物体含量最多的生物大分子,由多 个氨基酸通过肽键相连而成的一类含氮 化合物。 人体含蛋白质种类多达10万余种,是细 胞中含量最丰富的高分子化合物。
二、蛋白质的生物学重要性
1. 蛋白质是生物体重要组成成分 分布广:所有器官、组织都含有蛋白
(一)一级结构与功能的关系
1. 一级结构是空间结构与功能的基础
例:镰刀状红细胞贫血
血红蛋白链第6位氨基酸
6 C(146) 正常 N-val ·his ·leu ·thr ·pro ·glu ·glu ·····
病人
N-val ·his ·leu ·thr ·pro ·val ·glu ····· C(146)
透析 * 透析 利用透析袋把大分
子蛋白质与小分子
化合物分开的方法。
透析装置
(三)蛋白质的变性、沉淀和凝固:
• 变性定义:
在某些物理和化学因素作用下,其特
定的空间构象被破坏,也即有序的空 间结构变成无序的空间结构,从而导 致其理化性质改变和生物活性的丧失。
例:核糖核酸酶的变性与复性
天然状态, 有催化活性 去除尿素、 β-巯基乙醇 二硫键破坏 后,生物学活性 丧失。
蛋白质分子的结构解析PPT课件

详细描述
蛋白质的四级结构涉及亚基的组成、 形状、大小以及亚基之间的相互关系 。四级结构的变化会影响蛋白质的整 体功能。
结构域
总结词
蛋白质的结构域是指在较大的蛋白质分子中,可以独立折叠为较为稳定的三级 结构的区域。
详细描述
结构域通常由200-400个氨基酸残基组成,具有特定的空间构象和功能。不同 的结构域可以组成不同的蛋白质,也可以存在于同一蛋白质的不同部位。
疾病诊断与治疗
疾病标志物发现
通过蛋白质结构解析,可以发现 与疾病相关的标志物,用于疾病
的早期诊断。
个性化治疗
基于蛋白质结构的差异,可以为患 者提供更加个性化的治疗方案,提 高治疗效果。
药物疗效评估
通过比较治疗前后蛋白质结构的变 化,可以评估药物治疗的效果。
生物工程与农业应用
酶工程
蛋白质结构解析有助于设计和优 化酶的活性位点,提高酶的催化
核磁共振技术
总结词
核磁共振技术是一种利用核自旋磁矩进行研究的方法,可以对蛋白质的溶液构象进行解 析。
详细描述
核磁共振技术利用核自旋磁矩的相互作用,通过外部磁场对核自旋进行操控,检测其共 振信号。对于蛋白质分子,可以利用该技术检测其氢原子、碳原子等核自旋的共振信号, 从而推断出蛋白质在溶液中的构象和动态行为。该方法具有高分辨率和高灵敏度,能够
05 蛋白质的结构解析方法
X射线晶体学
总结词
X射线晶体学是一种通过X射线分析晶体 结构的方法,广泛应用于蛋白质结构解 析。
VS
详细描述
X射线晶体学利用X射线在晶体中的衍射 效应,通过分析衍射图像,可以确定晶体 的原子排列和分子结构。对于蛋白质分子 ,可以通过结晶将其固定成晶体,然后利 用X射线分析其结构。该方法能够提供高 分辨率的结构信息,是解析大型蛋白质结 构和复杂蛋白质复合物结构的主要手段之 一。
蛋白质的四级结构涉及亚基的组成、 形状、大小以及亚基之间的相互关系 。四级结构的变化会影响蛋白质的整 体功能。
结构域
总结词
蛋白质的结构域是指在较大的蛋白质分子中,可以独立折叠为较为稳定的三级 结构的区域。
详细描述
结构域通常由200-400个氨基酸残基组成,具有特定的空间构象和功能。不同 的结构域可以组成不同的蛋白质,也可以存在于同一蛋白质的不同部位。
疾病诊断与治疗
疾病标志物发现
通过蛋白质结构解析,可以发现 与疾病相关的标志物,用于疾病
的早期诊断。
个性化治疗
基于蛋白质结构的差异,可以为患 者提供更加个性化的治疗方案,提 高治疗效果。
药物疗效评估
通过比较治疗前后蛋白质结构的变 化,可以评估药物治疗的效果。
生物工程与农业应用
酶工程
蛋白质结构解析有助于设计和优 化酶的活性位点,提高酶的催化
核磁共振技术
总结词
核磁共振技术是一种利用核自旋磁矩进行研究的方法,可以对蛋白质的溶液构象进行解 析。
详细描述
核磁共振技术利用核自旋磁矩的相互作用,通过外部磁场对核自旋进行操控,检测其共 振信号。对于蛋白质分子,可以利用该技术检测其氢原子、碳原子等核自旋的共振信号, 从而推断出蛋白质在溶液中的构象和动态行为。该方法具有高分辨率和高灵敏度,能够
05 蛋白质的结构解析方法
X射线晶体学
总结词
X射线晶体学是一种通过X射线分析晶体 结构的方法,广泛应用于蛋白质结构解 析。
VS
详细描述
X射线晶体学利用X射线在晶体中的衍射 效应,通过分析衍射图像,可以确定晶体 的原子排列和分子结构。对于蛋白质分子 ,可以通过结晶将其固定成晶体,然后利 用X射线分析其结构。该方法能够提供高 分辨率的结构信息,是解析大型蛋白质结 构和复杂蛋白质复合物结构的主要手段之 一。
《蛋白质的结构》PPT课件

36
精选课件ppt
(3) 球状蛋白质分子是紧密的球状或椭球状 实体
(4) 球状蛋白质疏水侧链埋藏在分子内部, 亲水侧链暴露在分子表面
疏水作用力是维持三级结构的主要动力。
(5) 球状蛋白质分子的表面有一个空穴(也称 裂沟、凹槽或口袋)
这种空穴常是结合底物、效应物等配体并 行使生物功能的活性部位。
亚基缔合还可以屏蔽亚基表面 上的疏水残基以避开溶剂水。
41
精选课件ppt
2. 使催化基团汇集在一起
寡聚体的形成可使不同单体亚基的催化基 团汇集在一起以形成完整的催化部位。
42
精选课件ppt
4. 使寡聚蛋白具有别构效应和协同性
多亚基蛋白质一般具有多个结合部位,结合 在蛋白质分子的特定部位上的配体对该分子 的其他部位所产生的影响(如改变亲和力或催 化能力)称为别构效应。
(4)β转角多数都处在蛋白质分子的表面, 在这里改变多肽链方向的阻力比较小。β转 角在球状蛋白质中的含量是相当丰富的, 约占全部残基的四分之一。
21
精选课件ppt
四、无规卷曲(randon coil)
22
精选课件ppt
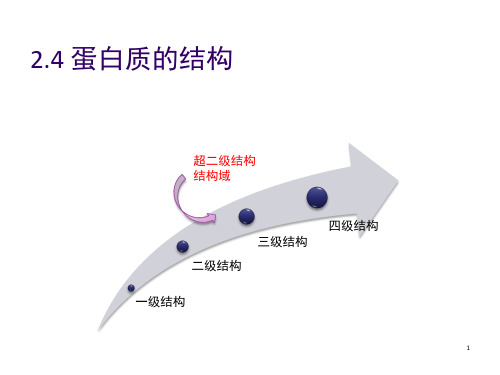
超二级结构和结构域
23
精选课件ppt
一、超二级结构(super—secondary struture)
-“非极性基团
被极性水分子排 挤相互聚拢”作
用力。
离子键(
或盐键)
精选课件ppt
肽键 二硫键 离子键 氢键 疏水键 范德华力
键能
90kcal/mol
3kcal/mol 1kcal/mol 1kcal/mol 0.1kcal/mol
这四种键能远小于共价键,称次级键
提问:次级键微弱但却是维持蛋白质三级结构中主
蛋白质结构解析课件

亚基结构
某些蛋白质由多个亚基组成,每个亚 基具有独立的三级结构。
PART 02
蛋白质结构解析方法
X射线晶体学
X射线晶体学是解析蛋白质结构的主要方法之一,通过分析X射线在晶体中的衍射, 可以获得蛋白质分子的三维结构信息。
X射线晶体学适用于蛋白质大分子,尤其是膜蛋白和复合物蛋白的结构解析,能够提 供高分辨率的结构信息。
酶的结构解析
酶的结构包括一级、二级、三级和四级结构,其中一 级结构是指氨基酸的排列顺序,二级结构是指肽链的 折叠方式,三级结构是指整条肽链的三维构象,四级 结构是指多亚基酶蛋白的组合方式。
单击此处添加正文,文字是您思想的提一一二三四五 六七八九一二三四五六七八九一二三四五六七八九文, 单击此处添加正文,文字是您思想的提炼,为了最终 呈现发布的良好效果单击此4*25}
变构效应
蛋白质的变构效应是指蛋白质在与其配体或效应物结合后, 其空间构象发生改变,进而影响其功能的过程。这种效应通 常是由蛋白质中的特定氨基酸残基与配体或效应物的相互作 用所引起的。
变构效应的意义
变构效应在生物体内具有重要的意义,它可以帮助生物体快 速适应环境变化,并调节各种生理过程。例如,某些激素可 以通过变构效应调节靶蛋白的活性,从而影响细胞内的信号 转导过程。
作用具有重要意义。
核磁共振技术解析蛋白质结构的难点在 于信号解析和数据处理,需要专业的技
术和经验。
电子显微镜技术
电子显微镜技术是解析蛋白质结构的重要手段之一,通过观察蛋白质颗 粒的形貌和排列,可以获得蛋白质大分子和复合物的结构信息。
电子显微镜技术适用于观察蛋白质颗粒和病毒等大分子结构,能够提供 高分辨率的形貌信息,对于研究蛋白质的功能和相互作用具有重要意义。
《蛋白质结构》PPT课件
构);大的单体蛋白有数个结构域 酶蛋白的活性中心往往
位于结构域之间,有利 于活性中心与底物结合
12
4、蛋白质的三级结构
多肽链在二级结构、超二级结构和结构域等结构 层次的基础上,组装而成的完整结构单元。
三级结构的形成使肽链中所有的原子都达到空间 上的重新排布。
举例:1963年Kendrew等通过鲸肌红蛋白的x-射 线衍射分析,测得了它的空间结构
4
(1)α-螺旋(α-helix)
a-螺旋:是多肽链沿长轴卷曲 而成的有规则的螺旋型构象。
要点 每个螺旋含3.6个AA残基,螺距
0.54nm,螺旋直径0.5nm,每个残 基绕轴旋转100o ; 螺旋体中所有氨基酸残基R侧链 都伸向外侧
5
相邻螺旋间(第n个氨基酸残基C=O的氧与第n+4 个氨基酸残基的-NH氢之间)形成平行于螺旋轴 的氢键,肽链上所有的肽键都参与氢键的形成
20
(三)蛋白质的变性
概念:天然蛋白质受物理或化学因素的影响,分 子内部原有的高度规则性的空间排列发生变化, 致使其原有性质和功能发生部分或全部丧失。
变性的因素及作用机制
因素
作用机制
热
破坏氢键
酸碱
破坏盐键
醇
分子进入肽链间空隙,破坏次级键
ቤተ መጻሕፍቲ ባይዱ
高浓度尿素 破坏氢键
盐酸胍
破坏氢键,使-SH暴露
21
变性后的特征
谷氨酸、丝氨酸 8、请列举氨基酸的化学性质,并简述其应用。
作业:P61 3、4
28
3
2、蛋白质的二级结构
蛋白质的二级结构:蛋白质分子中多肽链本身折叠和 盘绕的方式,它仅涉及肽链中主链的构象,并不涉及 侧链的构象。
蛋白质主链的折叠是由氢键维系的有规则的重复构象 组成
位于结构域之间,有利 于活性中心与底物结合
12
4、蛋白质的三级结构
多肽链在二级结构、超二级结构和结构域等结构 层次的基础上,组装而成的完整结构单元。
三级结构的形成使肽链中所有的原子都达到空间 上的重新排布。
举例:1963年Kendrew等通过鲸肌红蛋白的x-射 线衍射分析,测得了它的空间结构
4
(1)α-螺旋(α-helix)
a-螺旋:是多肽链沿长轴卷曲 而成的有规则的螺旋型构象。
要点 每个螺旋含3.6个AA残基,螺距
0.54nm,螺旋直径0.5nm,每个残 基绕轴旋转100o ; 螺旋体中所有氨基酸残基R侧链 都伸向外侧
5
相邻螺旋间(第n个氨基酸残基C=O的氧与第n+4 个氨基酸残基的-NH氢之间)形成平行于螺旋轴 的氢键,肽链上所有的肽键都参与氢键的形成
20
(三)蛋白质的变性
概念:天然蛋白质受物理或化学因素的影响,分 子内部原有的高度规则性的空间排列发生变化, 致使其原有性质和功能发生部分或全部丧失。
变性的因素及作用机制
因素
作用机制
热
破坏氢键
酸碱
破坏盐键
醇
分子进入肽链间空隙,破坏次级键
ቤተ መጻሕፍቲ ባይዱ
高浓度尿素 破坏氢键
盐酸胍
破坏氢键,使-SH暴露
21
变性后的特征
谷氨酸、丝氨酸 8、请列举氨基酸的化学性质,并简述其应用。
作业:P61 3、4
28
3
2、蛋白质的二级结构
蛋白质的二级结构:蛋白质分子中多肽链本身折叠和 盘绕的方式,它仅涉及肽链中主链的构象,并不涉及 侧链的构象。
蛋白质主链的折叠是由氢键维系的有规则的重复构象 组成
五、蛋白质的结构和功能.ppt

2.激素及神经肽 • 体内许多激素属寡肽或多肽 • 神经肽
.
学习重点
❖1.蛋白质的元素组成 ❖2 .蛋白质的结构单位 ❖3 .肽、肽键的概念。
第二节
蛋白质的分子结构
The Molecular Structure of Protein
蛋白质分子结构分成一级、二级、三 级、四级结构四个层次
二级、三级、四级结构统称高级结 构或空间构象
二、蛋白质的空间结构
(一)蛋白质的二级结构
定义 ➢蛋白质的二级结构是指多肽链骨架中原子的 局部空间排列,不涉及侧链的构象,也就是该 肽段主链骨架原子的相对空间位置。
主要的化学键: 氢键
蛋白质分子中氢键的形成
H
二级结构的基本形式
❖ 蛋白质的二级结构主要包括-螺旋, -折叠,-转角及无规卷曲等几种类 型。
(1)α-螺旋
左手和右手螺旋
-螺旋的结构特征
-螺旋是多肽链的主链原子沿一中心轴盘 绕所形成的有规律的螺旋构象,其结构特 征为:⑴ 为一右手螺旋;
(2) 螺旋以氢键维系;
(2)β-折叠
为一种比较伸展、呈锯齿状的肽链结构 。
由若干肽段或肽链排列起来所形成的扇面状片层构象。
-折叠的结构特征
⑴ 由若干条肽段或肽链平行或反平行排列组成 片状结构;
H CH2 CO2H
Gln H
N C COOH CH2 C-端
CH2
CONH2
多肽链有两端(方向性)
N 末端:多肽链中有自由氨基的一端 C 末端:多肽链中有自由羧基的一端
* 肽链中的氨基酸分子因为脱水缩合而基 团不全,被称为氨基酸残基。
N末端
C末端
牛核糖核酸酶
(四)体内重要的生物活性肽 1. 谷胱甘肽(glutathione, GSH)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生化因素:蛋白质纯度、配合体、抑制剂、化学修饰、遗 传修饰、蛋白质的聚集状态、蛋白质水解、蛋白质自身的 对称性、蛋白质的稳定性和等电点等
蛋白质结晶方法
(1)批量结晶法(Batch crystallization) (2)透析法( Dialysis ) (3) 液相扩散法(Liquid diffusion) (4) 气相扩散法(Vapour diffusion) (5) 蛋白质结晶新方法
20世纪90年代解析一个蛋白质结构通常可以获得博士学位;
今天,一个博士研究生也许就可解析多个蛋白质结构,但如 果没有深入研究其结构与功能的关系,往往不能毕业。
X射线衍射用于蛋白质结构的测定
1954年伯纳尔(Bernal)获得第一张胃蛋白 酶晶体X衍射图片。
1957年肯特罗(Kendrew)完成肌红蛋白 的0.6 nm分辨率的蛋白质晶体结构
衍射图形能给出样品内部结构的许多资料,如原子间的 距离、键角,分子的立体结构、绝对构型、原子和分子 的堆积、有序或无序的排列等。
X射线通过红宝石晶体(a)和硅单晶体(b)所拍摄的劳厄斑
图片出处:
因在用X射线研究晶体结构方面所作出的杰出贡 献 ,亨利·布拉格(William Henry Bragg)和劳伦 斯·布拉格(William Lawrence Bragg)父子分享了 1915年的诺贝尔物理学奖。
图片出处:
图片出处:
肌红蛋白的三维结构模型
图片出处: http:// archive/Kendrew62.html
肌红蛋白的三维结构
图片出处:
1959年佩鲁茨 (Perute)完成血 红蛋白0.55分辨 率的晶体结构
图片出处: (1962)
图片出处
血红蛋白的四级结构 模型
血红蛋白分子就是由二个由141个氨基酸残基组成的α亚基和二个由146个氨基酸 残基组成的β亚基按特定的接触和排列组成的一个球状蛋白质分子,每个亚基中 各有一个含亚铁离子的血红素辅基。四个亚基间靠氢键和八个盐键维系着血红蛋 白分子严密的空间构象。
图片出处:
图片出处:
劳厄的实验装置
X-射线晶体结构分析基本原理
X射线衍射分析所依赖的基本原理是X射线衍射现象
X射线衍射现象利用X射线的波长和晶体中原子的大小及 原子间距同数量级的特性来分析晶体结构。
当X射线入射到样品晶体分子上时,分子上的每个原子使 X射线发生散射,这些散射波之间相互叠加形成衍射图形。
威廉·康拉德·伦琴 Wilhelm Conrad Röntgen
1901年第一届诺贝尔物理学奖评选时, 29封推荐信中就有17封集中推荐他。伦 琴最终获得了第一次诺贝尔物理学奖金
图片出处
诺贝尔物理奖奖章
X射线本质
X射线是一种短波长(0.005~10nm)、 高能量(2.5×105 ~1.2×102eV)的电磁波。 它是原子内层电子在高速运动电子流冲 击下,产生跃迁而发射的电磁辐射。
由于测定出蛋白质的精细结构,两位英国科 学家M.F.佩鲁茨和J.C.肯德鲁获得1962年的诺 贝尔化学奖。
图片出处:
1997年,核小体八组蛋白结构
2004年,菠菜捕光复合物LHC-II
2005年,线粒体膜蛋白复合物2精细结构
X射线衍射测定蛋白和核酸精细结构,为新药设计提供了全新方向
中国科学家研制抗癌新药首获瑞典爱明诺夫奖
亨利·布拉格(Henry Bragg)
劳伦斯·布拉格( Lawrence Bragg)
图片出处
图片出处
蛋白质结构解析的发展
20世纪60年代解析一个蛋白质结构可以获 得诺贝尔奖;
20世纪70年代解析一个蛋白质结构则可成 为轰动世界的新闻;
饶子和院士
HIV基质蛋白 SARS
20世纪80年代解析一个蛋白质结构则可申请到教授的职位;
(1)批量结晶法(Batch crystallization)
A
一般由高速电子撞击金属产生。如图所示,是一种产生X 射线的真空管,K是发射电子的热阴极,A是由钼、钨或 铜等金属制成的阳极。两极之间加有数万伏特的高电压, 使电子流加速,向阳极A撞击而产生X射线。
X射线衍射
1912年Max von Laue发现X射线具有衍 射的现象。(1914年的诺贝尔物理学奖)
第5章 蛋白质结构解析
测定蛋白质结构的意义
• 人体基因数目仅比低等生物线虫多两倍。 如此少的基因是如何创造出人体如此复杂 的生命活动?
• 人体基因的主要功能是通过蛋白质来实现 的,蛋白质扮演着构筑生命大厦的主要角 色。人体中大约有10万种蛋白质。
蛋白质三维结构解析方法
❖X-射线晶体衍射法:85.3%抗癌抗乙肝病毒新药Birinapant,进入临床二期
蛋白质X射线晶体结构测定程序
1、样品制备 2、蛋白质结晶和晶体生长 3、衍射数据收集和处理 4、位相求解 5、模型建立和修正
1、样品制备
大量表达、分离和纯化目标蛋白
一般要求纯度大于97%, 浓度达到5mg/ml以上。
2、蛋白质结晶和晶体生长
技术和计算机模拟
蛋白质三维结构解析过程
第一节 X-射线衍射测定蛋白质结构
1895年11月8日 ,德国物 理学家,50岁的伦琴在 自己的实验室中偶然发 现 一种从阴极射线管
中辐射出的新型射线, 由于对管子发出的“东 西”性质不确定,伦琴 就把这种射线命名为 “X射线” 。
图片出处:
伦琴实验室
人类第一张X光照片
图片出处:
伦琴妻子之手
大家有疑问的,可以询问和交流
可以互相讨论下,但要小声点
1896年1月23日伦 琴将这一重大发现在维 尔兹堡物理医学会上报 告。Kolliker教授提议 将该射线命名为“伦琴 射线”,但伦琴却说: “我还没有彻底解释这 种射线的发生现象,还 是称它为X射线最恰 当。”
蛋白质结晶原理
与小分子结晶一样,蛋白质在溶液中处于 过饱和状态时,分子间可以规则的方式堆 积起来形成晶体析出
蛋白质晶体生长的影响因素
物理因素:温度、重力、压力、震动、时间、电场磁场、 介质的电解质性质和粘度、均相或非均相成核等
化学因素:pH值、沉淀剂类型和浓度、添加剂、离子种 类、离子强度、过饱和度、氧化还原环境、蛋白质浓度等
蛋白质结晶方法
(1)批量结晶法(Batch crystallization) (2)透析法( Dialysis ) (3) 液相扩散法(Liquid diffusion) (4) 气相扩散法(Vapour diffusion) (5) 蛋白质结晶新方法
20世纪90年代解析一个蛋白质结构通常可以获得博士学位;
今天,一个博士研究生也许就可解析多个蛋白质结构,但如 果没有深入研究其结构与功能的关系,往往不能毕业。
X射线衍射用于蛋白质结构的测定
1954年伯纳尔(Bernal)获得第一张胃蛋白 酶晶体X衍射图片。
1957年肯特罗(Kendrew)完成肌红蛋白 的0.6 nm分辨率的蛋白质晶体结构
衍射图形能给出样品内部结构的许多资料,如原子间的 距离、键角,分子的立体结构、绝对构型、原子和分子 的堆积、有序或无序的排列等。
X射线通过红宝石晶体(a)和硅单晶体(b)所拍摄的劳厄斑
图片出处:
因在用X射线研究晶体结构方面所作出的杰出贡 献 ,亨利·布拉格(William Henry Bragg)和劳伦 斯·布拉格(William Lawrence Bragg)父子分享了 1915年的诺贝尔物理学奖。
图片出处:
图片出处:
肌红蛋白的三维结构模型
图片出处: http:// archive/Kendrew62.html
肌红蛋白的三维结构
图片出处:
1959年佩鲁茨 (Perute)完成血 红蛋白0.55分辨 率的晶体结构
图片出处: (1962)
图片出处
血红蛋白的四级结构 模型
血红蛋白分子就是由二个由141个氨基酸残基组成的α亚基和二个由146个氨基酸 残基组成的β亚基按特定的接触和排列组成的一个球状蛋白质分子,每个亚基中 各有一个含亚铁离子的血红素辅基。四个亚基间靠氢键和八个盐键维系着血红蛋 白分子严密的空间构象。
图片出处:
图片出处:
劳厄的实验装置
X-射线晶体结构分析基本原理
X射线衍射分析所依赖的基本原理是X射线衍射现象
X射线衍射现象利用X射线的波长和晶体中原子的大小及 原子间距同数量级的特性来分析晶体结构。
当X射线入射到样品晶体分子上时,分子上的每个原子使 X射线发生散射,这些散射波之间相互叠加形成衍射图形。
威廉·康拉德·伦琴 Wilhelm Conrad Röntgen
1901年第一届诺贝尔物理学奖评选时, 29封推荐信中就有17封集中推荐他。伦 琴最终获得了第一次诺贝尔物理学奖金
图片出处
诺贝尔物理奖奖章
X射线本质
X射线是一种短波长(0.005~10nm)、 高能量(2.5×105 ~1.2×102eV)的电磁波。 它是原子内层电子在高速运动电子流冲 击下,产生跃迁而发射的电磁辐射。
由于测定出蛋白质的精细结构,两位英国科 学家M.F.佩鲁茨和J.C.肯德鲁获得1962年的诺 贝尔化学奖。
图片出处:
1997年,核小体八组蛋白结构
2004年,菠菜捕光复合物LHC-II
2005年,线粒体膜蛋白复合物2精细结构
X射线衍射测定蛋白和核酸精细结构,为新药设计提供了全新方向
中国科学家研制抗癌新药首获瑞典爱明诺夫奖
亨利·布拉格(Henry Bragg)
劳伦斯·布拉格( Lawrence Bragg)
图片出处
图片出处
蛋白质结构解析的发展
20世纪60年代解析一个蛋白质结构可以获 得诺贝尔奖;
20世纪70年代解析一个蛋白质结构则可成 为轰动世界的新闻;
饶子和院士
HIV基质蛋白 SARS
20世纪80年代解析一个蛋白质结构则可申请到教授的职位;
(1)批量结晶法(Batch crystallization)
A
一般由高速电子撞击金属产生。如图所示,是一种产生X 射线的真空管,K是发射电子的热阴极,A是由钼、钨或 铜等金属制成的阳极。两极之间加有数万伏特的高电压, 使电子流加速,向阳极A撞击而产生X射线。
X射线衍射
1912年Max von Laue发现X射线具有衍 射的现象。(1914年的诺贝尔物理学奖)
第5章 蛋白质结构解析
测定蛋白质结构的意义
• 人体基因数目仅比低等生物线虫多两倍。 如此少的基因是如何创造出人体如此复杂 的生命活动?
• 人体基因的主要功能是通过蛋白质来实现 的,蛋白质扮演着构筑生命大厦的主要角 色。人体中大约有10万种蛋白质。
蛋白质三维结构解析方法
❖X-射线晶体衍射法:85.3%抗癌抗乙肝病毒新药Birinapant,进入临床二期
蛋白质X射线晶体结构测定程序
1、样品制备 2、蛋白质结晶和晶体生长 3、衍射数据收集和处理 4、位相求解 5、模型建立和修正
1、样品制备
大量表达、分离和纯化目标蛋白
一般要求纯度大于97%, 浓度达到5mg/ml以上。
2、蛋白质结晶和晶体生长
技术和计算机模拟
蛋白质三维结构解析过程
第一节 X-射线衍射测定蛋白质结构
1895年11月8日 ,德国物 理学家,50岁的伦琴在 自己的实验室中偶然发 现 一种从阴极射线管
中辐射出的新型射线, 由于对管子发出的“东 西”性质不确定,伦琴 就把这种射线命名为 “X射线” 。
图片出处:
伦琴实验室
人类第一张X光照片
图片出处:
伦琴妻子之手
大家有疑问的,可以询问和交流
可以互相讨论下,但要小声点
1896年1月23日伦 琴将这一重大发现在维 尔兹堡物理医学会上报 告。Kolliker教授提议 将该射线命名为“伦琴 射线”,但伦琴却说: “我还没有彻底解释这 种射线的发生现象,还 是称它为X射线最恰 当。”
蛋白质结晶原理
与小分子结晶一样,蛋白质在溶液中处于 过饱和状态时,分子间可以规则的方式堆 积起来形成晶体析出
蛋白质晶体生长的影响因素
物理因素:温度、重力、压力、震动、时间、电场磁场、 介质的电解质性质和粘度、均相或非均相成核等
化学因素:pH值、沉淀剂类型和浓度、添加剂、离子种 类、离子强度、过饱和度、氧化还原环境、蛋白质浓度等
