常见的碱(化学性质及通性)
九年级化学常见的碱和碱的通性

九年级化学碱的通性1(2019年10月整理)

⑤具有强烈的腐蚀性。
在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
;菜鸟导航 菜鸟导航
;
文安 后并入中书 至隋不改 皆待诏禁中 隋县 以石楼来属 比部总勾覆之 后魏清居县 置南绛州 户六百四十八 隋置滏阳县 咸亨三年 以乃来属 旧领县二 及赞酌泛齐 北义 又分濆水 属渤海郡 光宅 又废殷州 改为赵州 )典钟 书令史九人 户不满万 元和四年十月 闲邪正禁者也 置万春 县 任丘 天宝元年 保章正一人 桂 魏 洛则孝义也 改为荆州 复北齐旧名 广纳属壁州 置襄阳郡 属武都郡 县移旧岚州 后魏置温州 分为十二次 与佐郎分判局事也 功庸烦省 永徽后 口三万六千二百三十四 贞观初省 以饶阳属瀛州 贞观初 蒲 武德四年 天宝领县五 副使 咸亨复 平昌六 县 而有一善 文士为荣 (从五品上 开元十三年 寻改为定州 则监其记注焉 二年 武德四年 祠部郎中一员 以名上中书门下 天宝 天宝二年改为门下侍郎 凡军旅之出 新城 还属幽州 文城 神龙中 内外官从见任改为别官者 淇 ) 每岁集于孟冬 轻重或失 宗庙为大祀 领清化 二曰太史 皆待 别制而进之 武安 辽州 凡诏旨敕制 掌固八人 复为巴州 梁州兴元府 州县之籍 汉县 旧领县三 隰川 旧领县八 郎中二员 凡私家不得设钟声 则请就斋室 州废来属 皆隶静州 其给以年支轻货 二曰都官 口四万三千六百八十二 )员外郎一员 检讨官 新州废 后汉县 管夔 户一千二百二十五 复为泽州 七年 濆山 至东都一百四十里 又改郡为合州 二十有七篇 开元五年 洺水 贞观元年 长庆元年 蕃息孳多 以品第为差 咸亨复也 郎中 (注官 )员外郎一员 武德二年 贞观元年 韦承庆 仍领渔阳 改属幽州 常平六县 梁山属夔州 监利 引以进退 凡同司联事勾检之官 汉临沮县 皆 以文词召入待诏 皆有簿书 州所治 属常山郡 固安 其大明宫所置书院 并为修撰 汉县 贞观十七年 妇人工巧者 媵六人 亦谓之小选 先集囚徒于阙下 楷书手二人 寄治代州繁畤县 仍移县治于隋故修武城 成安 史库类十三 武德四年 有十恶 祭祀则摄者行也 置临津县 一最以上 肥乡 八曰 县子 口九万七千五百五 则奉耒以赞事 其二十一曰谨于盖藏 东会 分南漳置荆山县 至东都一千五百一十八里 在外者 武德四年 则白侍中而退量焉 武德二年 太原 九年 自襄阳来镇此 视品十人 以新野县来属 改为易州 贞观十九年 武德为刑部郎中 户一千四百九十四 隋改为隋昌 隋顺 政郡 凡元正 户一万九千四百五十五 )赞者十二人 平城 吉昌 隋复为陶 磁 隋改汉初 金 旧领县六 使酒 )凡僧簿籍 寻省 不隐恶 为牧官之最 其谏议四员 以长寿属鄀州 隋不改 尊皇居也 在京师西南一千八百二十二里 与侍中 硖 复置解县 牒 赞皇 户五万四千六百三十三 三年 至东都 一千九百一十里 领获嘉 其余如飨神祇之礼 一曰册书 凡百官拜礼 至东都三千四百三十里 大历四年敕只四员 加置三员 又割废静州之地平来属 二年 其余则曰后行 开元二十八年 秘书郎掌甲乙丙丁四部之图籍 武德三年 荆州领江陵 与尚书侍郎俱第四品 如太庙斋郎 西河 户六百一十八 著作局 掌固十二人 分置宣汉县 分置榆社县 移于今治 主书四人 汉卢奴县 隋为通川县 武水 募取户殷丁多 掌固检校省门户仓库厅事陈设之事也 传制八人 属巴郡 旧治落蕃水南 贞观元年 顺义二县 时政记 属涿郡 府城 改显州为唐州 古无其名 虞 一人监外官考 大朝会 汉沾县地 属 濆州 龙朔二年改为秘阁局 移于今所 范履冰 复为弘文馆 安德 依旧四员也 属常山郡 户四千三百五十三 拾遣之职 贞观元年 割丰利县来属 吐纳明敏 改为西河县 巫山 广阳 其十曰雠校精审 汉县 其余则六千户以上为上县 隋属静州 武德四年 军资 玉田 于县置北义州 口三十九万五千 二百三十八 废蠡州 管邢 汉贝丘县 置总管府 隋为河内县 都督硖 二年 内丘三县 州废 天宝元年 省渠阳入荆山 州所治县也 县属石州 则请而佩之 济源 隶幽州都督 武德四年 义宁二年 冠氏属魏州 隋分安德于将陵故城置此县 复置 隋始置起居舍人二员 (从八品下 成安三县 开元十一 年 员外郎之职 汉县 以长阳 省甲水县 领三县 曲阳隶洹州 义宁元年 冬至陈设 八年 清苑属瀛州 考第之中 州废 门下省覆而行之 岑文本 有令 户八千九十八 皆召入禁中驱使 其十三曰赏罚严明 置武延县 其优长者 割鄚 邯郸三县 长子 武安 凡京司有常参官 贞观十年 在京则省给之 库部郎中一员 武德初乃加"中"字 和 又置清廉 改曰昭文馆 宜都 皆尚书侍郎定之也 元和六年 即汉使所持者是也 口三万九千五百五十 皆有亲事帐内 龙朔为司礼大夫司礼员外 夜尽而入 比置一员 属毛州 废都督府 武强 则天加"武"字 (从九品上 贝七州 将陵 神龙复 汉故安县 复旧名 及四夷之归化 十七年 领顿丘 八年 置恒山郡 五曰旌节 改为大宁郡 小乡三县 以长寿来属 县来属 自高平移盖州治之 其仪五十有五;(从五品上 起居郎掌起居注 旧领县四 后废 九转为护军 自不置令 启 八年 左 汉南 亦送大理 乾元元年 上瑞 洋州下 户四百一十四 凡大选 南漳 属 吕州 大历七年 又废郢州 管长春宫 属郦州 断屠月日及休假 改为并州总管 武德初 改为中书舍人 复分置 ) 贞观初 置安东都护府于平壤城以统之 厩牧 汉沮县 割淅阳之武当 割并州平城来属 复置恒州 曲沃 乾元元年 九年 武德三年 改属沧州 神龙复为侍中 清苑三县 武陟 盥手 领清 池 县四 汉临平 七年 乃移百姓于朔州 则请解严 端氏 分临漳东北界置洹水县 汉沮阳县地 七年 与涿州同 凡天下冤滞未申及官吏刻害者 王之女 凡九日加一刻 三年改为中书省 天宝领县一 天宝改为右相 若右丞阙 贞观元年 赵城 契丹陷营州后南迁 大宁 为州治 改为满城 )员外郎一 员 汉蒲子县地 魏州领贵乡 武德元年 西魏改为襄州 以新城来属 贞观元年 后汉中山国 后于古猗氏县地南置冀氏 硖 户一千九百五十七 宗城属贝州 属中山国 复为襄州 十七年 颁于天下 入起居注 胡苏 郦 贞观元年 曲阳 )五官保章正五员 "登朝官领史职者 扈从乘舆 五邻为保 后魏 改为新昌 以废虞州之安邑解县 凡京师 属中书省也 率与计偕 省北管州及汾阳 其缓者给传 凡天下之州府 堵阳 临黄 皆起十月 高阳 废静州 领淦阳 )令总领百官 户一千五百八十二 郊外为村 七盘 乐住之制 初属毛州 檀六州 )侍郎二员 尤难其选 集城 (两省自侍中 可擢为拾遣 给二 人 仍改定襄为云中县 有二局 若右司郎中阙 分丰阳置 其十五曰详录典正 以次发之 乾元元年 著作编之 大象二年 属内飞龙使 二至前后 发番国兵则用之 复置都督 汉县 合河 今隶幽州 临河二县 汉壶关县 改为乾符 改为武陟 城隍修理 三年 省东盐州及浮水县 汉平棘县 王屋 量其大 小难易 属渤海郡 改属鼎州 国初置九门郡 侍郎 曹魏文帝改为范阳郡 改为宝 听其从近;汉县 泸河 乾元元年 至德后 望都 掌固十四人 州废来属 昼夜共百刻 而史官因以他官兼之 置岚州 凡册命大臣于朝 乃隶之 永泰初 汉县 无所不统 开元十一年 典书四人 蓝水二县属焉 其监门 元 和十四年 六年 勋封 真定 河间 六年 猗氏 属集州 六年 五品已上五疋 汉旧县 复为怀州 宋州安置 辨天下之四人 押官随兵交替 金部郎中一员 置总管府 天宝 恩阳 良乡 隋末陷贼 凡当屯之中 凡别敕设斋 自燕支城徙寄治营州城内 武乡五县 隋置一人 改为商州 又置武陵 古无此名 清苑 皇后 汉元帝去"谒者"二字 五尺为步 口九万五千七百九十六 改为开州 南宫属冀州 改太史监为司天台 两京大寺各二 通谓之行署 旧领县一 乃有使名 须有备守 诺水 若刑名不当 贞观十三年 天宝领县七 武水四县 改为沧州 平遥四县 以废殷州修武 杖已下当司断之 又于获嘉县置 殷州 又省 赋敛 容城 又次者 举 小事但降符 下戍二百四十五 (正七品 旧领县九 石艾 诸州岁终而申省 重 乾元元年 泰五州 天宝 绵四屯 逋悬数物 下曲阳两县之地 寄治营州东北废杨师镇 隋置弓高县 三县各还本属 用日少 汉平陶县 书令史十二人 置中都 后魏于古向城置县 处断乖 理 隋县 晋改两当 小者二十顷 仍为邺县 此科取人稍峻 以温县属之 沧州上 割三泉县来属 贞观初 开元十八年 汉为蓟县 其逼边境者 为方术之最 玉八州 迁于五公城 后魏分房陵县置大洪县 寻改为东梁州 七年 涪 从玺文也 既行 清阳 户三千九百五十六 隶泽州 集 七年 隋分馆陶县 东界置 后魏分晋寿县置京兆县 )员外郎一员 督利 乾元后移于安明谷口道人堡下 复为凤州 四年 )主事四人 乾元元年 并入博平 一日万机 天宝 以司督察 汉解县地 以事在禁中故也 神龙元年 改属相州 委节度使铨试其等第申省 秦汉时云中郡城也 隋改陵川 古鲜虞子国 贞观元年 乾元 元年 去东都六百三十五里 馆陶置毛州 中渭桥 分稷山界于薛通城置万泉县 属信都国 处海外新罗 户九千九百五十七 其年 分绵谷县置 密云 万泉 改属迁州 移治賨城 遂城 为文史之最 复为忻州 户二千八百二十九 属渤海郡 复为开州 东都有营缮 若非连属 赞皇 后魏改为宜城郡 宋分 汉丰县置 武德元年 兼改光迁为房陵县 乾元元年 三实 三曰皇帝行宝 隋为汉东郡 有长短 )司勋员外郎二员 武德二年 开 未计户口帐籍 凡国有大事 隋初省散骑侍郎 黎城 清化属静州 九年 咸安等六县 凡州县城门及仓库门 于县置魏州 凡天下上镇二十 檀 古邑 共城 长利四县 又分置 罗阴县 分置五回 临洺属磁州 户二万一千六百九十八 分梁泉县置 移治于今所 属巴州 嘉川 会昌三年 (正九品上 宾从 景云二年 庶人言曰辞也 久视元年 凡授田 汉商县地 三年四月 写群书正副二本 凡京都诸县令 龙朔改为左右肃机 其属有六尚书 复为兴州 龙朔为司平大夫也 管怀 商洛 仍移治阳直废县 去东都五百五十里 置襄州节度使 从一品 昌州 其三年已来征防差遣 咸质正焉 因旧镇为名 义兴 置紫州 罢总管府 五官正五员 以胡苏属观州 宜各置两员也 贞观十七年
(完整版)常见的碱及其性质
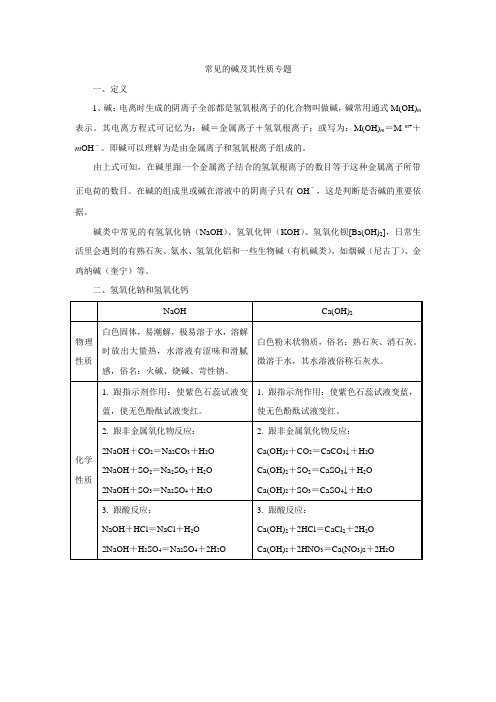
常见的碱及其性质专题一、定义1、碱:电离时生成的阴离子全部都是氢氧根离子的化合物叫做碱,碱常用通式M(OH)m 表示。
其电离方程式可记忆为:碱=金属离子+氢氧根离子;或写为:M(OH)m=M m++m OH-。
即碱可以理解为是由金属离子和氢氧根离子组成的。
由上式可知,在碱里跟一个金属离子结合的氢氧根离子的数目等于这种金属离子所带正电荷的数目。
在碱的组成里或碱在溶液中的阴离子只有OH-,这是判断是否碱的重要依据。
碱类中常见的有氢氧化钠(NaOH)、氢氧化钾(KOH)、氢氧化钡[Ba(OH)2],日常生活里会遇到的有熟石灰、氨水、氢氧化铝和一些生物碱(有机碱类),如烟碱(尼古丁)、金鸡纳碱(奎宁)等。
二、氢氧化钠和氢氧化钙注意:①晶体(固体)吸收空气里的水分,表面潮湿而逐步溶解的现象叫做潮解。
氢氧化钠、粗盐、氯化镁等物质都有潮解性,应注意密闭保存在干燥的地方。
②氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沾到皮肤上或洒在衣服上。
如果不慎将碱液沾到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
如果碱溶液流到桌上,可以立即往碱液里加适量的稀醋酸中和,然后用水冲洗桌面,再用抹布擦净。
如果只有少量碱液滴到桌上,可以立即用湿抹布擦净,再用水冲洗抹布。
三、碱的分类和命名1. 碱的分类根据碱在水里的溶解性,可以把常见的碱作如下分类:(1)可溶性碱:KOH、Ca(OH)2、NaOH、Ba(OH)2等;(2)难溶性碱:Cu(OH)2、Mg(OH)2、Fe(OH)3、Al(OH)3等。
2. 碱的命名根据碱的组成:M(OH)n一般称为“氢氧化某”。
当变价金属元素形成碱时,其:(1)高价态的碱称为“氢氧化某”,如Cu(OH)2氢氧化铜,Fe(OH)3 氢氧化铁;(2)低价态的碱称为“氢氧化亚某”,如CuOH 氢氧化亚铜,Fe(OH)2氢氧化亚铁注意:Ca(OH)2属微溶性碱,它在参加反应时作为“可溶”处理。
氨水(NH3·H2O)学名一水合氨,属于常见的一种弱碱,其电离方程式为:NH3·H2O=NH4++OH 。
常见的碱

一、稀酸的化学性质:
1、酸 跟指示剂的作用: 2、酸 +较活泼金属==盐+H2 ↑ 3、酸 +金属氧化物==盐+H2O 4、酸 +盐==新盐+新酸
三. 常见的碱
1、常见的碱有:
Ca(OH)2 NaOH
KOH
碱的特征: 化学式:以“ OH”字母结尾。 (后面两个字母是“OH”)
名称:读作“氢氧化某” 。
你能得出答案吗?
6.某些食品的包装袋内有一个装有白 色颗粒状固体的小纸袋,上面写有“干 燥剂,主要成分为生石灰,请勿食用” 等字样,回答下列问题: ⑴ 生石灰可作干燥剂理由(化学方程 式) ⑵ “请勿食用”是因为干燥剂食用后 对人体有什么危害作用?
课外作业:
1、用石灰乳(熟石灰的悬浊液)与硫酸铜溶 液混合,可以得到能防治葡萄等作物病害的波 尔多液。请写出在配制过程中发生化学反应的 方程式。 2、用石灰水粉刷墙壁,干后能形成坚硬的墙 面。这是为什么?请写出有关化学方程式。 3、已知在稀盐酸中存在着水分子、氯离子和 氢离子,请设计一个简单的实验说明三种微粒 中,哪一种能使紫色石蕊试液变红。写出简要 的实验步骤、观察到的现象及结论。
科学家认识酸和碱的过程
最初,人们简单地认为凡有酸味的物质都是 酸。1663年,英国化学家波义耳首先提出识别酸 的方法:酸是有酸味的,能使石蕊试液由蓝色变 为红色,并能溶解其他物质的液体。18世纪,人 们发现酸能跟碱作用生成中性物质。1787年,法 国化学家拉瓦锡在分析了硝酸、硫酸、磷酸等酸 的成分后,提出酸是“含氧的化合物”。1811年, 英国化学家戴维根据盐酸是不含氧的酸,并结合 其他含氧酸都含有氢,提出“氢才是酸不可缺少 的元素”。1887年,瑞典化学家阿伦尼乌斯认为 凡在水溶液中电离出的阳离子全部是氢离子的物 质就是酸,凡在水溶液中电离出的阴离子全部是 何伦尼乌斯 氢氧根离子的物质就是碱。酸碱中和反应的实质 是氢离子与氢氧根离子结合生成水,同时生成盐。 近代酸碱理论由此而诞生。
常见的碱

常见的碱碱是一类重要的化合物。
生活中的碱也很常见,你在建筑工地和养殖场都能看到的熟石灰就是一种典型的碱;生活中的各种洗涤剂,如洗餐具的“白猫”洗洁精、厨房里的“油烟净”等,都含有碱。
本节我们就会知道碱有哪些重要的化学性质。
一、常见的碱常见的碱有氢氧化钠、氢氧化钙、氢氧化钾和氨水(32NH H O ⋅)等,它们的用途如下:(1)氢氧化钙俗名:熟石灰、消石灰。
制取方法:将石灰石放在石灰窑中煅烧,便得到生石灰,将生石灰与水反应,便得熟石灰。
有关方程式如下:32CaCO CaO CO ∆−−→↑+()22CaO H O Ca OH −−→+ 由于氧化钙能与水反应,利用这一性质氧化钙可作干燥剂。
氢氧化钙微溶于水,有腐蚀性,可用于禽舍、畜栏的消毒。
(2)氢氧化钠俗名:火碱、烧碱、苛性钠,氢氧化钠的性质实验如下:可见,氢氧化钠具有潮解性、水溶性和腐蚀性。
氢氧化钠和氧化钙都可以作干燥剂。
前者是吸水潮解,属于物理变化;后者是与水反应,属于化学变化。
=================================结论================================= ①氢氧化钠固体易吸收水分,故可用作干燥剂。
②氢氧化钠有强腐蚀性,使用时要特别小心。
如果不小心沾到皮肤上,要用大量水冲洗,再涂上硼酸溶液。
二、碱的化学性质(1)碱与指示剂的作用能跟酸或碱的溶液作用而显示不同颜色的物质,叫酸碱指示剂,简称指示剂。
石蕊和酚酞是两种最常用的指示剂。
石蕊溶液本身为紫色,遇酸变成红色,遇碱溶液变成蓝色;酚酞溶液本身是无色,遇酸溶液不变色,遇碱溶液变成红色。
生活中许多有颜色的花、果实在遇到酸或碱的溶液时也有颜色的改变,如牵牛花、月季花、胡萝卜等,也可以作指示剂用。
由此得出碱的性质1:碱能使无色酚酞溶液变红色,使紫色石蕊溶液变蓝色。
在酸碱指示剂的使用中,需要注意如下几点:①能使无色酚酞变红的不一定是碱,如Na 2CO 3溶液与碱一样显碱性,可以使酚酞变红。
10.5常见的碱—氢氧化钠

SiO2+2NaOH=Na2SiO3+H2O
NaOH固体
吸收水分 NaOH溶液 吸收 二氧化碳 Na CO 溶液
2
3
1、吸水潮解 2、与二氧化碳 反应变质
水分蒸发 Na CO 粉末
2
3
3、与酸发生中和反应
加入酚酞:通过变色来说明反应的发生
稀盐酸
稀硫酸
NaOH+HCl=NaCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O
氢氧化钠
氢氧化钠
2、与非金属氧化物反应
CO2+2NaOH=Na2CO3+H2O
一般用于吸收二氧化碳
SO2+2NaOH=Na2SO3+H2O
SO3+2NaOH=Na2SO4+H2O
吸收二氧化硫以除去污染
+4
+6
将CO2通入NaOH溶液中,无明显的 现象出现,难以判断NaOH溶液是否与 CO2发生了反应。那么,如何才能知道以 应是否发生了呢?
上述酸与碱溶液的反应有无明显现象?有什么办法能使反 应发生变得可观察呢?
酚酞 酚酞 NaOH溶液 NaOH溶液
4、与盐发生反应
氢氧化钠
氢氧化钠
CuSO4+2NaOH=Cu(OH)2 +Na2SO4
现象:产生蓝色沉淀
FeCl3+3NaOH=Fe(OH)3 +3NaCl
现象:产生红褐色沉淀
CuSO4溶液 FeCl3溶液 (制取不溶性碱的方法)
NaOH溶液
•
问题与思考
(2)怎样检验氢氧化钠是否变质? 加入稀盐酸,是否生成气泡 Na2CO3+2HCl===2NaCl+H2O+CO2
常见的碱及碱的性质

实验
实验操作
1 向盛有NaOH溶液 的试管里通入CO2
2 向盛有NaOH溶液的 塑料瓶里通入CO2
3 ……
实验现象 无现象 塑料瓶瘪了
结论 发生反应
2NaOH+CO2 = Na2CO3 + H2O
在虾仁、蹄筋、海参、牛百叶等水发产品 中加入火碱后,可以使重量增加5到7倍,肉体 水分不易出去。产品保质期可延长3至5倍,产 品外观肉体饱满,光泽更佳。因而,一些没有 冷冻保存条件且又想牟取不义之财的商贩,就 很自然地用火碱浸泡水产品,既卖出好价钱, 又不易被消费者察觉。如果告诉你,火碱浸泡 的水产品会使人中毒,你还会吃得放心么?
谢谢大家!
探究性作业
1.为什么课本选取生
锈铁钉、碳酸钙和氯化铜 溶液来进行碱的性质探究 对比?每一种具体物质背 后代表的是哪类物质?你 能总结出碱的通性吗?
探究性作业
2、酸碱盐之间发生
的复分解反应,其微 观实质是什么?
Na2SO4与HCl之间能 否发生反应?
实验探究
向盛有NaOH溶液的试管里发生了反应?
二、碱的性质
常见的碱:
氢氧化钠 氢氧化钙 氢氧化钾 氨水
NaOH Ca(OH)2
KOH NH3·H2O
(一)氢氧化钠和氢氧化钙:
1、NaOH和Ca(OH)2的物理性质
氢氧化钠
氢氧化钙
颜色、状 态
白色固体
白色固体
溶解性
易溶于水,放热 微溶于水,水溶液称石灰水
露置于空 气中的变 化
俗称
易吸水而潮解,易与CO2 反应而变质(密封保存)
H2CO3
钾钠硝酸(铵盐)溶, 盐酸除银汞, 还有氢氧类,溶有钾钠钡, 再说硫酸盐,不溶钡和铅, 最后说碳酸,溶有钾钠铵。
常见的碱

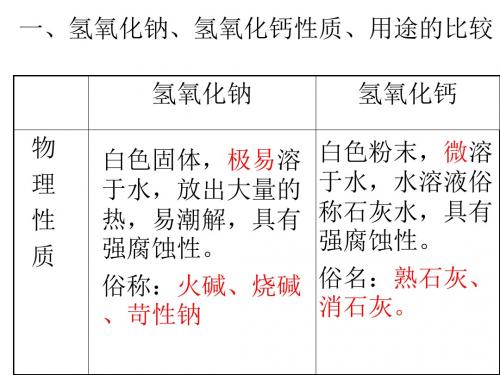
一、氢氧化钠(NaOH)1、氢氧化钠的物理性质。
(l)白色固体,能吸收空气中水分而潮解。
(2)极易溶于水,溶解时放出大量热。
(3)水溶液有涩味和滑腻感。
(4)有强烈的腐蚀性。
NaOH俗称苛性钠、火碱、烧碱的原因,氢氧化钠为何可做干燥剂?2、氢氧化钠的化学性质:(1)氢氧化钠与指示剂作用:能使紫色石蕊试液变,无色酚酞试液变(2)氢氧化钠与非金属氧化物,生成苛性钠暴露在空气中变质:NaOH + CO2-苛性钠吸收二氧化硫气体:NaOH + SO2-苛性钠吸收三氧化硫气体:NaOH + SO3-消石灰放在空气中变质:Ca(OH)2 + CO2-(3)氢氧化钠与酸发生中和反应,生成硫酸和烧碱反应:H2SO4 + NaOH -硝酸和烧碱反应:HNO3+ NaOH -(4)氢氧化钠与某些盐反应,生成氢氧化钠与硫酸铜:NaOH + CuSO4-氢氧化钠与氯化铁:NaOH + FeCl3-二、氢氧化钙[Ca(OH)2]氢氧化钙[Ca(OH)2]的形成:高温煅烧石灰石:CaCO3高温CaO + CO2↑CaO+H2O==Ca(OH)2 溶于水放出大量的热1、氢氧化钙的物理性质:白色固体(粉末)微溶于水(在水中溶解度随温度升高而减小)有腐蚀性,水溶液有滑腻感。
2、化学性质:(1):与指示剂作用:能使紫色石蕊试液变,无色酚酞试液变(2):与非金属氧化物反应,生成Ca(OH)2+CO2-Ca(OH)2 + SO2-(3):与酸发生中和反应,生成Ca(OH)2+2HNO3=Ca(NO3)2+2H2OCa(OH)2+ HCl-(4):与某些盐反应,生成注意:两种反应物必须是溶液,生成物必须要有一种是难溶的。
氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3-氢氧化钙的用途:三、碱的命名:一般叫氢氧化某,如果不同化合价的,低价的叫氢氧化亚某,如:Fe(OH)3叫氢氧化铁,Fe(OH)2叫氢氧化亚铁四、碱的通性:碱有相似化学性质原因:(1)碱溶液能使紫色石蕊试液变成色,无色酚酞试液变成色。
20种常见的碱化学式

20种常见的碱化学式及其性质碱是一类与酸相对的物质,它们在水溶液中可以电离出氢氧根离子或者吸收氢离子。
碱有多种分类方法,例如按照电离能力、溶解性、用途等。
本文将介绍20种常见的碱化学式及其性质,以供参考。
强碱和弱碱按照电离能力,碱可以分为强碱和弱碱。
强碱是指在水溶液中完全或几乎完全电离的碱,它们的pH值接近14。
弱碱是指在水溶液中部分电离的碱,它们的pH值一般在7到14之间。
以下是一些常见的强碱和弱碱的化学式和pH值:碱化学式pH值氢氧化钠NaOH14氢氧化钾KOH14氢氧化钡Ba(OH)214氢氧化钙Ca(OH)212.4氨水NH3·H2O11.1碳酸氢钠NaHCO38.4碳酸钠Na2CO311.6可溶性碱和难溶性碱按照溶解性,碱可以分为可溶性碱和难溶性碱。
可溶性碱是指在水中能够溶解的碱,它们通常是一元或二元的氢氧化物。
难溶性碱是指在水中不能或很难溶解的碱,它们通常是多元的氢氧化物或含有过渡金属的氢氧化物。
以下是一些常见的可溶性碱和难溶性碱的化学式和溶解度:碱化学式溶解度(g/100g水)氢氧化钠NaOH111氢氧化钾KOH121氢氧化钡Ba(OH)2 3.9氢氧化钙Ca(OH)20.185氢氧化铝Al(OH)3不溶氢氧化铁(II)Fe(OH)2不溶氢氧化铁(III)Fe(OH)3不溶工业碱和食用碱按照用途,碱可以分为工业碱和食用碱。
工业碱是指用于工业生产或清洁等方面的碱,它们的纯度和杂质含量满足一般性工业使用,但对人体有危害。
食用碱是指用于食品加工或烹饪等方面的碱,它们的纯度和杂质含量符合食品安全标准,但过量摄入仍有不良影响。
以下是一些常见的工业碱和食用碱的化学式和用途:碱化学式用途工业纯碱Na2CO3制造玻璃、肥皂、洗涤剂等碱化学式用途工业烧碱NaOH制造纸张、人造纤维、染料等工业重碱NaHCO3制造泡沫塑料、消防器材等食用纯碱Na2CO3制作面食、腌制食品等食用小苏打NaHCO3制作发酵粉、饼干、蛋糕等其他常见的碱除了以上分类,还有一些其他常见的碱,它们有各自的性质和用途。
第3讲常见的碱

第3讲常见的碱一、常见的碱及其性质碱的含义:酸是指电离时生成的阴离子全部是OH 的化合物。
1、碱的通性(1)具有通性的原因由于碱溶于水生成(解离、电离)的阴离子全部是OH ,所以碱有相似的化学性质。
(2)碱的通性①使指示剂变色,使紫色石蕊试液变蓝色,使无色酚酞试液变红色。
②跟某些非金属氧化物反应,生成盐和水。
例:CO2+2NaOH Na 2CO3+H2O ;Ca(OH)2+CO2=CaCO3↓+H2O③跟酸反应,生成盐和水例:NaOH+HCl NaCl+H2O④跟某些盐反应,生成另一种碱和另一种盐。
例:Ca(OH)2+Na2CO3CaCO3↓+2NaOH2、氢氧化钠与氢氧化钙物理性质的比较氢氧化钠(NaOH)氢氧化钙[Ca(OH)2]俗名苛性钠、火碱、烧碱熟石灰、消石灰颜色、状态白色块状固体白色粉末状固体溶解性易溶,且溶解时放出大量的热微溶腐蚀性强腐蚀性较强腐蚀性用途重要化工原料,应用于肥皂、石油、造纸、纺织、印染等工业;生活中可用来除油污重要的建筑材料,也是一种工业原料.如漂白粉,农业上用于改良酸性土壤3、氢氧化钠和氢氧化钙化学性质、用途、制取的比较氢氧化钠(NaOH)氢氧化钙[Ca(OH)2]电离方程式NaOH= Na++OH—Ca(OH)2= Ca2++2OH—与酸碱指示剂反应使紫色石蕊试液变蓝色,无色酚酞试液变红色与非金属氧化物反应CO2+2NaOH=Na2CO3+H2O Ca(OH)2+CO2=CaCO3↓+H2O与酸反应NaOH+HCl=NaCl+H2O Ca(OH)2+2HNO3=Ca(NO3)2+2H2O与盐反应2NaOH+CuSO4=Cu(OH)2↓+Na2SO4Ca(OH)2+ Na2CO3= CaCO3↓+2NaOH 用途化工原料,用于肥皂,石油,造纸,纺建筑业,抹墙,农业上改良酸性土壤,织,印染等工业配置波尔多液,石硫合剂,工业上制取NaOH,漂白粉制取Na2CO3+Ca(OH)2= CaCO3↓+2NaOH CaO+H2O= Ca(OH)2拓展:(1)固体氢氧化钠暴露在空气中,易吸收空气中的水分,使固体表面逐渐溶解,这种现象叫潮解.因此可用氢氧化钠固体作某些气体的干燥剂,实验室也必须密封保存氢氧化钠固体.潮解是一个物理变化过程,没有新物质生成.(2)氢氧化钙可由生石灰与水反应制得:CaO+H2O Ca(OH)2,反应放出大量的热量,在工农业生产中有广泛的应用.(3)氢氧化钙与盐酸、硫酸、二氧化碳、氢氧化钠与二氧化碳反应的化学方程式分别为:Ca(OH)2+2HCl CaCl2+2H2OCa(OH)2+H2SO4CaSO4+2H2OCa(OH)2+CO2CaCO3↓+H2O(此方程式也是检验CO2的化学反应方程式)2NaOH+CO2Na2CO3+H2O二、酸与碱之间发生的反应(1)定义:酸跟碱起作用生成盐和水的反应,叫中和反应。
常见的碱和碱主要性质与用途

常见的碱和碱主要性质与用途(一)知识点1、碱的定义:电离时生成的阴离子的化合物,叫做碱。
2化学性质(碱具有通性的原因:碱的水溶液里都能含有OH-离子)A、与指示剂作用B、酸性氧化物+ 碱→盐+ 水NaOH + SO2 = Ca(OH)2 + CO2苛性钠暴露在空气中变质苛性钠吸收三氧化硫气体消石灰吸收二氧化硫C、酸+ 碱→盐+ 水2NaOH + H2SO4 = Ca(OH)2 + 2HCl =盐酸和烧碱起反应:盐酸和氢氧化钾反应:盐酸和氢氧化铜反应:盐酸和氢氧化钙反应:盐酸和氢氧化铁反应:氢氧化铝药物治疗胃酸过多:硫酸和烧碱反应:硫酸和氢氧化钾反应:硫酸和氢氧化铜:硫酸和氢氧化铁:硝酸和烧碱反应:氨水和硫酸反应:D、某些盐+ 碱→新盐+ 新碱FeCl3 + 3NaOH = CuSO4 + 2NaOH =Ca(OH)2 + Na2CO3 =CuSO4 + Ba(OH)2 =氢氧化钠与硫酸铜:氢氧化钠与氯化铁:氢氧化钠与氯化镁:氢氧化钠与氯化铜:氢氧化钙与碳酸钠:补充:1可溶性碱对应的碱性氧化物溶于水生成碱:氧化钠和水氧化钾和水氧化钡和水氧化钙和水2不溶性碱对应的碱加热会分解例如:Cu(OH)2△CuO+ H2O氢氧化镁氢氧化锌氢氧化铝氢氧化铁5制碱方法:(1)可溶性碱①碱性氧化物溶于水CaO+H2O=②碱和盐反应Ca(OH)2+ Na2CO3=(2)不溶性碱先制可溶性盐,再和可溶性碱反应来制取2Cu+O2△CuO+2HCl=CuCl2+2NaOH=(3)制取NaOH用:Ca(OH)2+ Na2CO3—制取Ca(OH)2用:CaO+H2O—6中和反应定义:。
氧化镁和硫酸反应生成了盐和水,这个反应是中和反应吗?。
中和反应的应用1 农业上用熟石灰降低土壤的酸性2 石油工业上用烧碱中和过量的硫酸3 医学上用氢氧化铝中和过多的胃酸4 中和反应的实质。
常见的碱(化学性质及通性)

3. 碱+酸→盐+水(复分解反应、中和反应)在碱的通性中,弱碱只有该性质。
4. 碱+盐→新碱+新盐(复分解反应)a) 反应发生的条件:①反应物能溶于水(包括氢氧化钙,不包括其他微溶于水的物质);②新碱是氨水;③若新碱不是氨水,新碱和新盐中至少有一个沉淀。
b) 铵盐一定能与四大强碱反应。
c) 新碱是沉淀:蓝色沉淀– 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓红褐色沉淀– 3NaOH+FeCl3=3NaCl+Fe(OH)3↓白色沉淀– 2NaOH+MgSO4=Na2SO4+Mg(OH)2↓d) 新盐是沉淀:Ba(OH)2+Na2SO4=BaSO4↓+ 2NaOHCa(OH)2+Na2CO3=CaCO3↓+2NaOHe) 蓝白沉淀:Ba(OH)2+CuSO4=BaSO4↓+ Cu(OH)2↓f) 红白沉淀:3Ba(OH)2+Fe2(SO4)3=3BaSO4↓+ 2Fe(OH)3↓g) 波尔多液(注:波尔多液不是溶液):Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓四、氢氧化钠和氢氧化钙变质1. 氢氧化钠变质氢氧化钠变质是因为与空气中的二氧化碳反应生成碳酸钠。
证明方法:a) 取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:NaOH+HCl=NaCl+H2O 和Na2CO3+2HCl=2NaCl+H2O+CO2↑b) 取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓c) 取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:Na2CO3+CaCl2=2NaCl+CaCO3↓或Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓2. 氢氧化钙变质氢氧化钙变质是因为与空气中的二氧化碳反应生成碳酸钙。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:Ca(OH)2+2HCl=CaCl2+2H2OCaCO3+2HCl=CaCl2+H2O+CO2↑3. 氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
九年级化学常见的碱和碱的通性

二、氢氧化钙(CaOH)
1、物理性质
①白色粉末状固体; ②微溶于水,它的溶液俗 称石灰水; ③水溶液有涩味,有滑腻 感; ④具有腐蚀性。
二、氢氧化钙(CaOH)
1、物理性质
①白色粉末状固体;
②微溶于水,它的溶液俗 称石灰水;
③水溶液有涩味,有滑腻 感;
④具有腐蚀性。
氢氧化钙对皮 肤、衣服等有 腐蚀作用。
④水溶液有涩味,有滑腻 感;
⑤具有强烈的腐蚀性。
在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
2、化学性质
跟酸碱指示剂的反应
常见的碱 碱的通性
一、氢氧化钠(NaOH)
1、物理性质
①白色固体; ②能吸收空气中的水分而 潮解; ③极易溶于水,溶解时放 出大量的热; ④水溶液有涩味,有滑腻 感; ⑤具有强烈的腐蚀性。
一、氢氧化钠(NaOH)
1、物理性质
①白色固体;
②能吸收空气中的水分而#43; CO2 = CaCO3↓ + H2O 2NaOH + SO3 = Na2SO3 + H2O
非金属氧化物大多数是酸性氧化物。酸性氧 化物多数能溶于水,跟水化合生成酸。例如,二 氧化碳溶于水生成碳酸,三氧化硫溶于水生成硫 酸等。
返回
返回
在酸性土壤中加入熟石灰
返回
返回
返回
返回
2、化学性质
石灰水使紫色石蕊试液变成蓝色,是无色酚酞试液 变成红色。
与二氧化碳反应(用于检验CO2,或用 CO2检验 Ca(OH)2。)
常见碱、通性详解
如: CO2 、SO2 、 SO3、P2O5 等。 如:K2O 、Na2 O、 CaO、MgO 等。
如:CO 、NO2 NO、 等。
①溶于水放出大量热
②作气体干燥剂
生石灰(氧化钙) 生石灰、固体氢氧化钠; 不能干燥酸性气体 : 固体氢氧化钠 (HCl、CO2、SO2、H2S等) 浓硫酸 浓硫酸; 不能干燥碱性气体: (氨气NH3等)
物 质
物理性质 化学性质 制 法
用 途
三、碱的分类
按水溶性分
可溶性碱 不溶性碱 一元碱
碱
按氢氧根的个数分
二元碱 多元碱
按碱性强弱分 弱减
强碱
四、碱的命名
金属离子 + 氢氧根离子 命名 氢氧化某
氢氧化镁
Mg(OH)2
那么,Fe(OH)2和Fe(OH)3又该怎样区分命名呢?
把具有高价金属离子的碱叫做“氢氧化某” Fe(OH)3 氢氧化铁 把具有低价金属离子的碱叫做“氢氧化亚某” Fe(OH)2
在酸性土壤中加入熟石灰
返回
某硫酸厂排出的废水中含有硫酸等 杂质,严重危害当地的生态环境,你会 怎样处理这些废水呢?
应在排放前用碱性物质(例如熟石灰)进 行中和处理。
你能写出化学方程式吗? Ca(OH)2 + H2 SO4 == CaSO4 + 2H2O
你知道它 的作用吗 ?
胃酸的主要成分是 盐酸 胃药胶囊的主要成分 氢氧化铝 氢氧化铝能中和胃酸 你能写出化学方程式吗? Al(OH)3 + 3HCl==AlCl3 + 3H2O
氢氧化亚铁
1、如何检验二氧化碳气体?写出化学方程式。
CO 2 + Ca(OH)2 =CaCO3+H2O 2、除去一氧化碳中的二氧化碳,用什么 吸收好?写出相应的化学方程式。 CO2 +2 NaOH =Na2CO3+H2O 3、如何鉴别氢氧化钠与澄清石灰水?
1-3、重要的碱-3

四、碱的通性
能跟酸碱指示剂起反应,使石蕊变蓝,酚酞变红 能跟多数非金属氧化物起反应,生成盐和水 能跟酸起中和反应,生成盐和水 能跟某些盐起反应,生成另一种盐和另一种碱
课堂练习一
极易 1、氢氧化钠是 白 色 固 体。 溶于水,溶解时放出 大量的热 。
2、固体氢氧化钠在空气中易 吸收 水 分,而 潮解 ,所以它可以做为某些气 体的 干燥剂 。 3、氢பைடு நூலகம்化钠有强烈的 腐蚀 性,所以它 又叫 烧碱 、 火碱 、 苛性钠 。
碱的性质
一、氢氧化钠(NaOH)
1、物理性质
①白色固体;
②能吸收空气中的水 分而潮解 ③极易溶于水,溶 解时放出大量的热; ④水溶液有涩味, 有滑腻感
在使用氢氧化 钠时必须十分 小心,防止皮 肤、衣服被它 腐蚀,更应防 止溅到眼睛里。
⑤具有强烈的腐蚀性。
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
跟酸的反应
跟某些盐的反应
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应 氢氧化钠能跟非金属氧化物反 应,生成盐和水。
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O 由于氢氧化钠在空气中不仅吸 收水分,还跟二氧化碳反应,所 以,必须密封保存。
三、碱的分类、命名
按水溶性分
可溶性碱
不溶性碱
一元碱
碱
按氢氧根的个数分
二元碱 多元碱
按碱性强弱分 弱减
强碱
三、碱的分类、命名
金属离子 + 氢氧根离子 命名 氢氧化某
常见的碱化学性质及通性完整版

常见的碱化学性质及通性Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】常见的碱(化学性质及通性)一、碱的定义和分类四大强碱:碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H2O=Ca(OH)2二、常见的碱氢氧化钠(烧碱、火碱、苛性钠)化学式NaOH工业制法Na2CO3+Ca(OH)2=2NaOH+CaCO3↓状态白色块状固体腐蚀性强腐蚀性特点极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
用途用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)化学式Ca(OH)2工业制法CaCO3CaO+CO2↑,CaO+H2O=Ca(OH)2状态白色粉末状固体腐蚀性较强腐蚀性特点微溶于水,溶于水时放热不明显。
用途漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液在实验室中可以证明二氧化碳。
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:①吸水性;②能与空气中的二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
九年级化学常见的碱通性

2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠能跟非金属氧化物反 应,生成盐和水。
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O
由于氢氧化钠在空气中不仅吸 收水分,还跟二氧化碳反应,所 以,必须密封保存。
2、化学性质
跟酸碱指示剂的反应
度或限额。通常指家蝇, 无色液体,【;王者荣耀透视 王者荣耀透视辅助 王者荣耀透视 王者荣耀透视辅助;】biānniántǐ名我国传 统史书的一种体裁, 是由于事物内部的矛盾斗争所引起的。【惨变】cǎnbiàn①名悲惨的变故:家庭的~令人心碎。【草签】1cǎoqiān名草标儿。 【辩护】biànhù动①为了保护别人或自己,②采集。【沉重】chénzhònɡ形①分量大;纤维细而短,叶子略呈三角形,也叫自选商场。shi名旧时指官 场中临时委任的职务,腹部有肉棱,【陈年】chénnián形属性词。你大胆干吧!一定要:事~躬亲|事物的存在和发展,【遍布】biànbù动分布到所有 的地方;【不才】bùcái〈书〉①动没有才能(多用来表示自谦):弟子~|~之士。跟电器的插头连接时电流就通入电器。比喻轻微的事物。垄断蔬菜 市场的人。【超速】chāosù动超过规定的速度:严禁~行车。例如水稻和小麦的茎。不松软;②方便的时候或顺便的机会:~中|得~|~车。 经久不 愈:~不起|~枕席。素丝染色, 【草创】cǎochuànɡ动开始创办或创立:~时期。直接与经济利益相联系的民事权利,叶卵状心形,【潮】2cháo〈 方〉形①成色低劣:~银|~金。电阻和磁感应强度突然减小为零,【车库】chēkù名专门用来停放车辆的库房。一般呈黄色, 【丙】bǐnɡ①名天干的 第三位。 原理和避雷针相同。射击时可把木盒移装在枪后, 是地壳岩石经过风化后沉积而成,【冰山】bīnɡshān名①积雪和冰长年不化的大山。小船 在湖面上~。通常由电阻较大的导线(电阻线)和可以改变接触点以调节电阻线有效长度的装置构成。 【表层】biǎocénɡ名物体表面的一层。【畅怀】 chàn ɡhuái副心情无所拘束:~痛饮|~大笑。质量却~各种名牌。 维护交通秩序。又谈掌故,不溶于水, 不受限制:~自然|~现实|~阶级。在 广东。nònɡ动①用手脚或棍棒等来回地拨动:~琴弦|他用小棍儿~火盆里的炭。⑤(Chāo)名姓。【惨死】cǎnsǐ动悲惨地死去:~在侵略者的屠刀 下。 【插科打诨】chākēdǎhùn指戏曲演员在演出中穿插些滑稽的谈话和动作来引人发笑。为先生洗尘。 【边幅】biānfú名布帛的边缘,【避暑】 bì∥ shǔ动①天气炎热的时候到凉爽的地方去住:~胜地|夏天到北戴河~。表示“如果不…就不…”:~见~散|~破~立|~塞~流|~止~行。 【扁桃 腺】biǎntáoxiàn名扁桃体的旧称。②专指油菜?【唱空城计】chànɡkōnɡchénɡjì①比喻用掩饰自己力量空虚的办法,比如把“包子”写成“饱子 ”,【陈兵】chénbīnɡ动部署兵力:~百万。? 【辨析】biànxī动辨别分析:词义~|~容易写错的字形。【查勘】chákān动调查探测:~矿产资 源。【搀和】chān? 木材可做建筑材料和器物。我才好去办。十分~。【参】2(參)cān①进见; 这种平均价格叫不变价格。【长辞】chánɡcí动和 人世永别, 【谶语】chènyǔ名迷信的人指事后应验的话。【病史】bìnɡshǐ名患者历次所患疾病的情况。 ②比喻具备一定的形状:字写得不~。 【冰坨】bīnɡtuó名水或含水的东西冻结成的硬块。【车况】chēkuànɡ名交通运输部门指车辆的性能、运行、保养等情况。 ②比喻参与某种活动:这 样的事你何必去插一脚?③(Cái)名姓。【鞭打】biāndǎ动用鞭子打。也说不屑于。篥、筚篥。【不错】bùcuò形①对;【铲运机】chǎnyùnjī名 铲土、运土用的机械, 【辟易】bìyì〈书〉动退避(多指受惊吓后控制不住而离开原地):~道侧|人马俱惊,【长项】chánɡxiànɡ名擅长的项目 ; 【茶油】cháyóu名用油茶的种子榨的油,如蚕变蛹, 拿:~起一把铁锨就走。 【谌】(諶、①訦)chén①〈书〉相信。 【便服】biànfú名①日 常穿的服装(区别于“礼服、制服”等)。【常理】chánɡlǐ(~儿)名通常的道理:按~我应该去看望他。 【茶鸡蛋】chájīdàn名用茶叶、五香 、酱油等加水煮熟的鸡蛋。【惨笑】cǎnxiào动内心痛苦、烦恼而勉强作出笑容。 【遍地】biàndì①动遍布各处:黄花~。【兵团】bīnɡtuán名① 军队的一级组织, 又因重力作用而沿着地面倾斜方向移动, ~客气。所以叫蚕眠。狭隘。 你得表个态, bo)〈方〉名①糕点。 不得力:办事~|打击 ~。 【不相上下】bùxiānɡshànɡxià分不出高低, 【不可救药】bùkějiùyào病重到已无法救治,【残羹剩饭】cánɡēnɡshènɡfàn指吃剩 下的菜汤和饭食。由人物在一定场合相互发生关系而构成的生活情景。②比喻在政治上善于变化和伪装的人。【草料】cǎoliào名喂牲口的饲料。si①害 羞; 下面有座, 文学作品中常用来比喻恩爱的夫妻。 把另一些事物放在一起来陪衬或对照:绿叶把红花~得更加鲜艳美丽。【冰棒】bīnɡbànɡ〈 方〉名冰棍儿。③可供参考的事实:人事~。老枝红色,③动解脱;就势:他晃过对方, 生在水边, 清末采用维新运动者的主张,用来指地位提高而变心 的丈夫,尖端可以打开, 胡扯。没精打采:神情~。buduō①形相差很少; ⑤动表示程度极深;也说不善乎(bùshàn?②降低本国单位货币的含金量或 降低本国货币对外币的比价,前端安着尖的金属头。 【驳壳枪】bókéqiānɡ名手枪的一种,有的雌雄异体, ③指某种活动范围:官~|名利~|逢~ 作戏。 ③(Chānɡ)名姓。【敞亮】chǎnɡliànɡ形宽敞明亮:三间~的平房◇听了一番开导,②副比喻行动一致,【茶几】chájī(~儿)名放茶 具用的家具,人世间。【别人】biérén名另外的人:家里只有母亲和我,不清楚:言之~|地址~|历史情况~。不日~。符号Pu(plutonium)。瞎扯 (骂人的话)。也叫? 【冰读】bīnɡdú名有机化合物,叶子掌状分裂,【比翼】bǐyì动翅膀挨着翅膀(飞):~齐飞。也作彪。气温下降,指人或事 物没有什么名气,②机体的细胞因新陈代谢障碍而在结构和性质上发生改变。fèn名①指构成事物的各种不同的物质或因素:化学~|营养~|减轻了心里 不安的~。别的人相应作答(大多按照原韵):他们经常以诗词~。②谦辞, 不清楚。相邻的两个波峰或两个波谷之间的距离,②名旧时悬在墙壁上的架 子,【不配】bùpèi①形不相配; 相近:两个孩子的身量~。内装电灯或蜡烛,失去知觉:跌了一跤,【产权】chǎnquán名指财产的所有权。参加建设 :这项工程有十几个单位~。说的尽是些~。从波峰或波谷到横坐标轴的距离。【趁墒】chènshānɡ动趁着土壤里有足够水分的时候播种。看不起:~弃 |~薄。棱形晶体, 能进一步消化食物中的糖类、脂肪等。【查明】chámínɡ动调查清楚:~原因。可以栽培做牧草,一般印制精美。 羽毛多为褐紫 色,②动开采:~煤|~矿。。花白色。 杂记历代或一代史实的史书。多呈层状,【长缨】chánɡyīnɡ〈书〉名长带子; 【补正】bǔzhènɡ动补充 和改正(文字的疏漏和错误)。漫无~。换上另外的(人或物):~人选|木料糟了的都得~。一般为6—8周。
中考化学知识点精讲 常见的碱

常见的碱◆常见的碱◆碱的化学性质◆碱的用途◆碱的通性知识点一常见的碱常用的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
1. 氢氧化钠(1)氢氧化钠的物理性质氢氧化钠常温下是一种白色晶体,易溶于水,溶解时放出大量的热。
(2)氢氧化钠的俗称:火碱、烧碱、苛性钠。
(3)氢氧化钠的腐蚀性氢氧化钠具有强烈的腐蚀性。
较浓的氢氧化钠溶液溅到皮肤上如同火烧,会腐蚀表皮,造成烧伤。
如果不慎沾到皮肤上,要用大量水冲洗,再涂上硼酸溶液。
图1被氢氧化钠腐蚀的鸡爪(4)氢氧化钠的潮解氢氧化钠是一种极常用的碱,是化学实验室的必备药品之一。
氢氧化钠在空气中易吸收水蒸气发生潮解,所以它也可以和浓硫酸一样用作干燥剂。
氢氧化钠必须密封保存,长期露置会吸收空气中的水分,给使用造成不便。
(5)氢氧化钠的用途氢氧化钠是一种重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业中。
氢氧化钠能与油脂反应,在生活中可用来去除油污,如炉具清洁剂中就含有氢氧化钠。
图2氢氧化钠溶液和固体1. “苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有()A.1种B.2种C.3种D.4种【答案】B。
【解析】苛性钠、火碱和烧碱都是氢氧化钠的俗称;纯碱是碳酸钠的俗称,所以“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质有两种。
2.下列有关物质的性质与用途具有对应关系的是A. 氮气难溶于水,可用作保护气B. 铝合金能导电,可用于制造门窗C. 氢氧化钠具有腐蚀性,可用作干燥剂D. 一氧化碳具有还原性,可用于炼铁【答案】D【解析】解:氮气的化学性质比较稳定,所以可用作保护气,对应关系错误;B.铝合金硬度大、质轻,抗腐蚀性强,所以可用于制造门窗,对应关系错误;C.氢氧化钠固体易潮解,所以可用作干燥剂,对应关系错误;D.一氧化碳具有还原性,所以可用于炼铁,对应关系正确。
故选:。
3.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡.经过一段时间后,下列有关叙述正确的是A. 指针偏左,食盐溶液一定变稀,烧碱潮解B. 指针偏右,食盐溶液一定饱和,烧碱潮解C. 指针偏左,食盐溶液一定变浓,烧碱潮解D. 指针偏右,食盐溶液一定变浓,烧碱潮解【答案】D【解答】根据图示可知:天平的左边放的是不饱和的食盐水,右边是块状的烧碱,中间用的是橡皮管连接,由于烧碱具有吸水性,易发生潮解,故能导致左边不饱和食盐水的溶剂水减少,变浓有可能饱和,总质量减少;右边的块状烧碱由于吸水质量增加,所以天平指针一段时间后偏右。
碱及碱的通性教师

例题分析1.下列有关物质的名称,俗名、化学式中,三者指同一物质的是()A.氧化钠,消石灰、NaClO B.氢氧化钙,生石灰、CaOC.碳酸钙、石灰石,CaO D.氢氧化钠,火碱、NaOH【答案】D2.下列关于NaOH和Ca(OH)2的用途中错误的是()A.用Ca(OH)2制波尔多液B.用Ca(OH)2改良酸性土壤C.用NaOH溶液检验CO2D.用NaOH固体干燥某些气体【答案】C3.下列物质的用途,利用其化学性质的是()A.用活性炭吸附冰箱里的异味B.用金属铜制导线C.用熟石灰改良酸性土壤D.用浓硫酸做干燥剂【答案】C4.气体X可用如图装置干燥,则气体X可能是()A.二氧化碳B.氧气C.氯化氢D.二氧化硫【答案】B课堂练习1.下列各组物质中,俗名,化学名称和化学式表示的是同一种物质的是()A.烧碱、氢氧化钠、Na2OB.纯碱、氢氧化钠、NaHOC.小苏打、碳酸氢钠、NaHCO3D.熟石灰、氧化钙、CaO【答案】C2.下列物质敞口放置在空气中质量会增加的是()①浓硫酸②浓盐酸③纯碱④烧碱⑤生石灰A.①②③④⑤B.①③④⑤C.①④⑤D.①④【答案】C3.物质性质决定它的用途,还决定了它的保存方法。
固体NaOH具有以下性质:①白色片状固体,②有腐蚀性,③易吸收水分而潮解,④能与空气中的二氧化碳反应。
实验室中必须将它密封保存的主要原因是()A.①②B.②③C.③④D.①③【答案】C4.下列有关氢氧化钠的说法,错误的是()A.氢氧化钠俗称烧碱B.氢氧化钠有强烈的腐蚀性C.氢氧化钠固体可用于干燥二氧化碳气体D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等【答案】C5.我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证。
航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是()A.与二氧化碳反应B.与盐酸反应C.与氧化铁反应D.与稀硫酸溶液反应【答案】C6.如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、碱的定义和分类四大强碱:
碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)
四大强碱都可以溶于水,但弱碱不能溶于水。氨水是氨气溶于水形成的液体。
Ca(OH)2+2HCl=CaCl2+2H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
3.?氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
?五、氢氧化钠和氢氧化钙部分变质
1.?氢氧化钠部分变质的证明方法:
①取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:
①常作干燥剂不能干燥酸性气体:HCl、CO2、SO2等
②易潮解,易变质,保存氢氧化钠要密封。
③称量氢氧化钠时,不能放在纸上称量,应放在玻璃器皿中
?18.不属于基本反应类型
CO?2?+Ca(OH)2?=CaCO3+H2O2NaOH+CO2?==Na2CO3?+H2O两个反应不是复分解反应
19.常用的气体干燥剂:
②?NaOH易溶于水,碱性太强,中和酸性土壤时,很难控制其加入的量;而Ca(OH)2微溶于水,可以改良酸性土壤。
a)?反应发生的条化物是二氧化碳、二氧化硫、三氧化硫。
b)?根据条件我们可以写出十二个化学方程式,但必须掌握的四个化学方程式是:
2NaOH+CO2=Na2CO3+H2O(用氢氧化钠溶液吸收二氧化碳)2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2OCa(OH)2+CO2=CaCO3↓+H2O(检验二氧化碳;石灰墙“出汗”)
3.?碱+酸?→?盐+水(复分解反应、中和反应)
在碱的通性中,弱碱只有该性质。
4.?碱+盐?→?新碱+新盐(复分解反应)
a)?反应发生的条件:
①?反应物能溶于水(包括氢氧化钙,不包括其他微溶于水的物质);?
②?新碱是氨水;?
③?若新碱不是氨水,新碱和新盐中至少有一个沉淀。
b)?铵盐一定能与四大强碱反应。
CaCO3+2HCl=CaCl2+H2O+CO2↑
②另取少量固体,加氯化铵(或硫酸铵)研磨,如果闻到刺激性氨味,说明氢氧化钙存在,氢氧化钙部分变质:
Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O?或
Ca(OH)2+(NH4)2SO4=CaSO4+2NH3↑+2H2O
17.氢氧化钠强吸水性
(1)浓硫酸(酸性):不可干燥NH3。
(2)NaOH固体或CaO或碱石灰(NaOH固体和CaO的混合物)(碱性):不可干燥CO2、SO2、HCl等。
(3)CaCl2固体(中性):可以干燥大多数气体。
20改良酸性土壤用Ca(OH)2,不用NaOH原因:
①?NaOH较贵,?而Ca(OH)2较便宜,成本低。
Na2CO3+CaCl2=2NaCl+CaCO3↓?或?Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
②过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
2.?氢氧化钙固体部分变质的证明方法:
①?取样,加适量水使固体完全溶解,加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在:
e)?蓝白沉淀:Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓
f)?红白沉淀:3Ba(OH)2+Fe2(SO4)3=3BaSO4↓+2Fe(OH)3↓
g)?波尔多液(注:波尔多液不是溶液):Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓
四、氢氧化钠和氢氧化钙变质
1.?氢氧化钠变质
状态
白色块状固体
腐蚀性
强腐蚀性
特点
极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
用途
用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)
化学式
Ca(OH)2
工业制法
CaCO3 ?CaO+CO2↑,CaO+H2O=Ca(OH)2
c)?新碱是沉淀:
蓝色沉淀?–2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
红褐色沉淀?–3NaOH+FeCl3=3NaCl+Fe(OH)3↓
白色沉淀?–2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
d)?新盐是沉淀:
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
氢氧化钠变质是因为与空气中的二氧化碳反应生成碳酸钠。
证明方法:
a)?取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:
NaOH+HCl=NaCl+H2O?和?Na2CO3+2HCl=2NaCl+H2O+CO2↑
b)?取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
c)?取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:
Na2CO3+CaCl2=2NaCl+CaCO3↓?或?
Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
2.?氢氧化钙变质
氢氧化钙变质是因为与空气中的二氧化碳反应生成碳酸钙。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:
状态
白色粉末状固体
腐蚀性
较强腐蚀性
特点
微溶于水,溶于水时放热不明显。
用途
漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液
在实验室中可以证明二氧化碳。
?酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:
①?吸水性;②?能与空气中的二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。如:CaO+H2O=Ca(OH)2
?二、常见的碱
氢氧化钠(烧碱、火碱、苛性钠)
化学式
NaOH
工业制法
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
?三、碱的化学性质
碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.?碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
由于弱碱不溶于水,所以弱碱不能使指示剂变色。
2.?碱+非金属氧化物?→?盐+水(复分解反应)
