弱电解质的电离
弱电解质的电离平衡

弱电解质的电离平衡1.弱电解质(1)概念(2)与化合物类型的关系强电解质主要是大部分离子化合物及某些共价化合物,弱电解质主要是某些共价化合物。
2.弱电解质的电离概念(1)电离平衡的建立在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
(2)电离平衡的建立与特征①开始时,v(电离)最大,而v(结合)为0。
②平衡的建立过程中,v(电离)>v(结合)。
③当v(电离)=v(结合)时,电离过程达到平衡状态。
3.外因对电离平衡的影响(1)浓度:在一定温度下,同一弱电解质溶液,浓度越小,越易电离。
(2)温度:温度越高,电离程度越大。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。
(4)化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离方向移动。
如:以0.1 mol·L-1 CH3COOH溶液为例,填写外界条件对CH3COOH CH3COO-+H+ΔH>0的影响。
(1)强电解质稀溶液中不存在溶质分子,弱电解质稀溶液中存在溶质分子(√)(2)氨气溶于水,当NH3·H2O电离出的c(OH-)=c(NH+4)时,表明NH3·H2O电离处于平衡状态(×)(3)室温下,由0.1 mol·L-1一元碱BOH的pH=10,可知溶液中存在BOH===B++OH-(×)(4)电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大(×)(5)25 ℃时,0.1 mol·L-1 CH3COOH加水稀释,各离子浓度均减小(×)(6)电离平衡向右移动,弱电解质的电离度一定增大(×)解析(2)NH3+H2O NH3·H2O NH+4+OH-,NH3·H2O电离出的c(OH-)与c(NH+4)永远相等,不能表明NH3·H2O电离处于平衡状态。
弱电解质的电离平衡知识点

一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下自身能够电离出自由移动离子的化合物,叫电解质。
非电解质:在水溶液中且熔化状态下自身都不能电离出自由移动离子的化合物。
概念理解:①电解质、非电解质都是化合物,能导电的物质可能是溶液(混合物)、金属(单质),但他们不属于电解质非电解质的研究对象,因此他们既不是电解质也不是非电解质;②自身电离:so2、NH3、co2、等化合物能和水反应形成酸或碱,但发生电离的并不是他们本身吗,因此属于非电解质;③只能在水中发生电离的电解质有酸或者某些易溶于水高温下易分解的盐,如液态氯化氢是化合物,只存在分子,没有发生电离,因此不能导电,又如NaHCO3在高温时即分解,不能通过熔融态证明其为电解质;只能在熔融状态下电离的电解质是活泼金属氧化物,如Na2O、CaO,他们在溶液中便不存在,要立刻反应生成键,因此不能通过溶液中产生离子证明;既能在水溶液中又能在溶液中发生电离的物质是某些高温难分解盐,绝大多数盐溶解在水中都能发生完全电离,某些盐熔融时也发生电离,如BasO4。
④电离不需要通电等外界条件,在熔融或者水溶液中即能够产生离子;⑤是电解质,但是要产生离子也要在溶液状态或者熔融状态,否则即便存在离子也无法导电,比如NaCI,晶体状态不能导电。
⑥电解质的强弱与导电性、溶解性无关。
如如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4为强电解质。
导电性与自由移动离子的浓度和带电荷数等有关。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分电离成离子的电解质。
2.常见的电解质为酸碱盐、活泼金属氧化物、水,其中强电解质与偌电解质常见分类:强电解质弱电解质电贻质3、电离方程式的书写——“强等号,弱可逆,多元弱酸分步离”①强电解质:如H2SO4:H2SO4===2H++SO2-②弱电解质a.—元弱酸,如CH3COOH:CH3COOH==CH3COO-+H+b.多元弱酸,分步电离,分步书写且第一步电离程度远远大于第二步的电离程度,如H2CO3:H2CO^H++HCO-、HCO-H++CO3-。
弱电解质的电离、水的电离和溶液的酸碱性知识点总结及习题

弱电解质的电离、水的电离和溶液的酸碱性知识点总结及习题一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
非电解质:在水溶液中或熔化状态下都不能导电的化合物。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。
2、电解质与非电解质本质区别:电解质——离子化合物或共价化合物非电解质——共价化合物注意:①电解质、非电解质都是化合物②SO2、NH3、CO2等属于非电解质③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4为强电解质)——电解质的强弱与导电性、溶解性无关。
3、电离平衡:在一定的条件下,当电解质分子电离成离子的速率和离子结合成时,电离过程就达到了平衡状态,这叫电离平衡。
4、影响电离平衡的因素:A、温度:电离一般吸热,升温有利于电离。
B、浓度:浓度越大,电离程度越小;溶液稀释时,电离平衡向着电离的方向移动。
C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。
D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
9、电离方程式的书写:用可逆符号弱酸的电离要分布写(第一步为主)10、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。
叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。
)表示方法:AB A++B- Ki=[ A+][ B-]/[AB]11、影响因素:a、电离常数的大小主要由物质的本性决定。
b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。
C、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。
如:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO二、水的电离和溶液的酸碱性1、水电离平衡::水的离子积:K W = c[H+]·c[OH-]25℃时, [H+]=[OH-] =10-7 mol/L ; K W = [H+]·[OH-] = 1*10-14注意:K W只与温度有关,温度一定,则K W值一定K W不仅适用于纯水,适用于任何溶液(酸、碱、盐)2、水电离特点:(1)可逆(2)吸热(3)极弱物质单质化合物电解质非电解质:非金属氧化物,大部分有机物。
弱电解质的电离(含解析)

第一节弱电解质的电离1.了解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离,以及电解质溶液的导电性。
3.了解弱电解质在水溶液中的电离平衡。
(中频)弱电解质的电离平衡1.电离平衡的建立在一定条件(如温度、浓度)下,当弱电解质分子离解成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到了平衡。
2.电离平衡的特征3.外界条件对电离平衡的影响电离是一个吸热过程,主要受温度、浓度的影响。
以弱电解质CH 3COOH 的电离为例: CH 3COOHCH 3COO -+H +⎩⎪⎪⎨⎪⎪⎧平衡右移⎨升高温度加水稀释增大c (CH 3COOH )平衡左移降低温度增大c (H +)或c (CH 3COO -)电离平衡常数 1.表达式(1)对于一元弱酸HA :HA H++A-,平衡常数K=c(H+)·c(A-)c(HA);(2)对于一元弱碱BOH:BOH B++OH-,平衡常数K=c(B+)·c(OH-)c(BOH)。
2.意义相同条件下,K值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
3.特点(1)多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要决定于第一步电离。
1.易误诊断(正确的打“√”,错误的打“×”)。
(1)溶液导电能力弱的电解质一定是弱电解质( )(2)弱电解质浓度越大,电离程度越大( )(3)温度升高,弱电解质的电离平衡右移( )(4)0.1 mol/L某一元酸HA溶液的pH=3,HA溶液中存在:HA===H++A-( )(5)温度不变,向CH3COOH溶液中加入CH3COONa,平衡左移( )(6)电离平衡常数(K)越小,表示弱电解质电离能力越弱( )(7)不同浓度的同一弱电解质,其电离平衡常数(K)不同( )(8)电离平衡右移,电离平衡常数一定增大( )【答案】(1)×(2)×(3)√(4)×(5)√(6)√(7)×(8)×2.NH3·H2O在水溶液中的电离方程式为:__________________________,其电离常数表达式为:_____________________________________________。
弱电解质的电离平衡

弱电解质的电离一、电离平衡常数(1)概念:在一定条件下达到平衡时,弱电解质电离形成的各种离子浓度的乘积与溶液中未电离的物质的浓度之比是一个常数,该常数成为电离平衡常数,简称电离常数。
(2)表达式:弱酸的电离平衡常数用Ka表示,如: HA H+ + A-,则Ka=弱碱的电离平衡常数用Kb表示,如:MOH M++ OH-,则Kb=多元弱酸电离是电离,以第步电离为主;多元弱碱电离一般认为一步电离完成。
(3)意义:电离平衡常数表征了弱电解质的电力能力,根据同温下电离常数的大小可以判断弱电解质电离能力的相对强弱。
K值越大,电离程度,弱酸酸性(弱碱碱性)。
(4)影响因素:电离平衡常数只随的变化而变化,升高温度,K值。
二、弱电解质电离平衡的特点和影响因素(1)电离平衡特点为:动、等、定、变(2)弱电解质稀溶液加水稀释时,电离平衡向电离方向移动,促进电离,平衡混合物中微粒总浓度、离子数、离子浓度与溶质分子浓度的比值均增大,但离子总浓度减小,导电能力减弱。
(3)条件改变时,弱电解质的电离平衡会发生移动,但K值只随温度的改变而改变。
例1:向0.1 mol/L的CH3COOH溶液中加水或加入少量的CH3COONa晶体时,下列有关叙述不正确的是() A.都能使溶液的pH增大 B.都能使溶液中c(H+)·c(CH3COO-)增大C.溶液中的c(H+)·c(OH-)不变D.都能使溶液中c(CH3COO-)/c(CH3COOH)增大例2:用水稀释0.1 mol/L NH3·H2O时,溶液中随着水量的增加而减小的是( )A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/ c(OH-)C.c(H+)和c(OH-)的乘积 D.OH-的物质的量三、强酸与弱酸的比较及判断电解质强弱的方法(1)等物质的量浓度或等pH的强酸与弱酸的比较等物质的量浓度盐酸(a)与醋酸溶液(b)等pH的盐酸(a)与醋酸(b)pH或物质的量浓度 pH: 物质的量浓度:溶液的导电能力水的电离程度c(cl-)与c(CH3COO-)等体积溶液中和NaOH的量分别加该酸的钠盐固体后pH变化开始与金属反应的速率M A B 等体积溶液与金属反应长生H 2量(2)判断电解质强弱的方法 a.浓度与pH 的关系。
弱电解质的电离

弱电解质的电离【知识要点】一、强弱电解质电解质(electrolyte):在水溶液或熔化状态下能导电的化合物。
强电解质(strong electrolyte):在水分子作用下,能完全电离为离子的化合物(如强酸、强碱和大多数盐)弱电解质(weak electrolyte):在水分子作用下,只有部分分子电离成为离子化合物(如弱酸、弱碱和水)二、弱电解质的电离1、CH3COOH CH3COO-+H+2、在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态,这叫电离平衡(ionization equilibrium)。
3、电离平衡的特征:(1) 逆--弱电解质的电离是可逆的(2) 等--V电离=V结合≠ 0(3) 动--电离平衡是一种动态平衡(4) 定--条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子(5) 变--条件改变时,电离平衡发生移动。
4、影响因素:(1)内因:电解质本身的性质。
通常电解质越弱,电离程度越小。
(2) 外因:①浓度:温度升高,平衡向电离方向移动。
②浓度:溶液稀释有利于电离③同离子效应:在弱电解质溶液中加入同弱电解质具有相同离子的强电解质,使电离平衡向逆方向移动三、电离平衡常数1、定义:在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积嗖溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,用K表示。
2、表示方法:ABA++B-AB)(c)-B(c)A(cK⋅=+电离3、同一弱电解质在同一温度下发生浓度变化时,其电离常数不变。
4、K值越大,电离程度越大,相应酸(或碱)的酸(或碱)性越强。
K值只随温度变化。
5、同一温度下,不同种弱酸,电离常数越大,其电离程度越大,酸性越强。
6、多元弱酸电离平衡常数:K1>K2>K3,其酸性主要由第一步电离决定。
【经典例题】例1、下列物质中①Cu 、②NaCl 固体、③NaOH 固体、④K 2SO 4溶液、⑤CO 2、⑥蔗糖、⑦NaCl 溶液、⑧H 2O 、⑨酒精。
01弱电解质的电离总结

科学探究:
在一只烧杯中加入适量的醋酸溶液, 测定溶液的pH,然后向其中加入少量 的CH3COONa晶体,充分振荡后,测 其溶液的pH
结论:弱电解质的电离是可逆的。
达到电离平衡前
达到电离平衡时
C(B+) 最大
变小 不变
C(A-) 最小 变大 不变
C(OH-)
最大
变小 不变
C(HA) 最大 变小 不变
C(BOH)
最小
变大 不变
思考与讨论:
向醋酸溶液中分别加入适量浓度较大的盐酸、
NaOH溶液、CH3COONa溶液、水、加热对平衡 有什么影响?
CH3COOH
CH3COO- + H+
强电解质:能完全电离的电解质(电解质
完全电离成离子) 。
弱电解质:只有部分电离的电解质(溶液
中既有离子也有电解质分子) 。
• 强电解质包含:强酸,强碱,大多数盐
•
活泼金属氧化物
• 弱电解质包含:弱酸,弱碱,水
√记住:
强 酸: HCl、H2SO4、HNO3、HClO4、 HBr、HI
弱 酸: CH3COOH、H2CO3、H2SO3、H3PO4、 H2SiO3、H2S、HClO、HF、所有的有机 羧酸
逆 弱电解质的电离是可逆的
等 V电离=V结合≠0
2.特征: 动 电离平衡是一种动态平衡
定 溶液里既有离子又有分子,且各 分子、离子的浓度不变。
变 条件改变时,电离平衡发生移动。ຫໍສະໝຸດ 思考与交流(见课本P42)
【知识解析】弱电解质的电离平衡
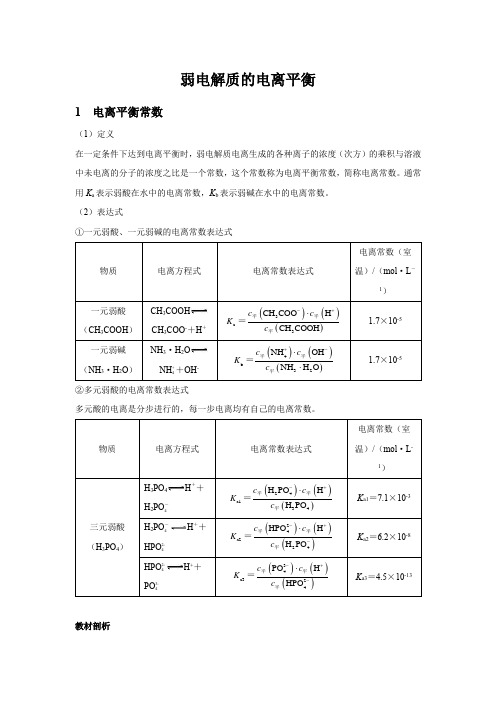
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。
【知识解析】弱电解质的电离

弱电解质的电离1 电离方程式(1)相关概念电解质在水溶液中或熔融状态下产生自由移动的离子的过程叫做电离。
表示电解质在水溶液中或熔融状态下电离成能够自由移动的离子的式子叫做电离方程式。
(2)电离方程式的书写①强电解质:完全电离,用“===”。
如: HCl===H ++Cl -NaOH===Na ++OH -NaNO 3===Na ++NO - 3 ②弱电解质:部分电离,用“”。
如:CH 3COOH CH 3COO -+H +NH 3·H 2ONH + 4+OH -③多元弱酸的电离分步进行,以第一步电离为主。
如: H 2CO 3H ++HCO - 3(主要) HCO 3-H ++CO 2- 3(次要)④多元弱碱的电离也分步进行,但是一般用一步电离表示。
如: Cu (OH )2Cu 2++2OH -深化理解(1)酸式盐:强酸的酸式盐完全电离,一步完成。
如:NaHSO 4===Na ++H ++SO 2- 4(水溶液),NaHSO 4===Na ++HSO - 4(熔融状态)。
弱酸的酸式盐强中有弱,分步完成。
如:NaHCO 3===Na ++HCO - 3,HCO 3-H ++CO 2- 3。
(2)两性化合物:双向电离。
如:。
2 电离平衡(1)概念电离平衡:一定条件(如一定温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合成弱电解质分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。
图3-1-1(2)特征弱电解质电离平衡的特征可概括为六个字——“弱”“逆”“等”“动”“定”“变”。
具体特征为3 弱电解质电离平衡的影响因素注意弱电解质的电离是吸热过程,即ΔH>0。
但也有极少数弱电解质,其电离是放热过程.如HF(aq)H+(aq)+F-(aq)ΔH<0。
(1)内因:电解质本身的性质决定了弱电解质在水中达到电离平衡时电离程度的大小。
(2)外因①温度:一般情况下,由于弱电解质的电离过程吸热,因此升高温度,电离平衡向电离方向移动,电离程度增大。
2.弱电解质的电离平衡

根据对0.1
mol· L-1的醋酸溶液进行的下列有关 变化,完成表格
电离平衡移动方向 c(H+) c(CH3COO—)
加热 加水 加CH3COOH 加NaOH
加HCl
2、电离方程式的书写 强电解质电离用等号,弱电解质电离用可逆号 多元弱酸分步电离 多元弱碱写成一步电离的形式 强酸酸式盐一步电离到各离子,用等号; 弱酸酸式盐第一步电离到阳离子和酸式酸根离子,用 等号;酸式酸根离子再电离,遵照分步电离,用可逆 号
一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、ClB.c(H+)=1×10-13mol· -1 的 溶 液 : Na+ 、 Ca2+ 、 L SO42-、CO32C. 含 有 大 量 Fe3+ 的 溶 液 : Na+ 、 Mg2+ 、 NO3- 、 SCND.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
浓度均为0.1
mol· -1的三种溶液等体积混合,充 L 分反应后没有沉淀的一组溶液是( ) A.BaCl2 、NaOH 、 NaHCO3 B. Na2CO3 、 MgCl2 、 H2SO4 C.AlCl3 、 NH3· 2O 、 NaOH H D.Ba(OH)2 、 CaCl2 、 Na2SO4
下 列 各 组 离 子 能 大 量 共 存 , 当 溶 液 中
c(H+)=10—10 mol•L—1时,有气体产生;而 当溶液中c(H+)=10—13 mol•L—1时,又能生 出沉淀。该组离子可能是( ) A.Na+、Cu2+、NO3—、CO32— B.Ba2+、K+、Cl—、HCO3— C.Fe2+、Na+、SO42—、NO3— D.Mg2+、NH4+、SO42—、Cl—
弱电解质的电离平衡知识点

弱电解质的电离平衡知识点集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下自身能够电离出自由移动离子的化合物,叫电解质。
非电解质:在水溶液中且熔化状态下自身都不能电离出自由移动离子的化合物。
概念理解:①电解质、非电解质都是化合物,能导电的物质可能是溶液(混合物)、金属(单质),但他们不属于电解质非电解质的研究对象,因此他们既不是电解质也不是非电解质;②自身电离:SO2、NH3、CO2、等化合物能和水反应形成酸或碱,但发生电离的并不是他们本身吗,因此属于非电解质;③只能在水中发生电离的电解质有酸或者某些易溶于水高温下易分解的盐,如液态氯化氢是化合物,只存在分子,没有发生电离,因此不能导电,又如NaHCO3在高温时即分解,不能通过熔融态证明其为电解质;只能在熔融状态下电离的电解质是活泼金属氧化物,如Na2O、CaO,他们在溶液中便不存在,要立刻反应生成键,因此不能通过溶液中产生离子证明;既能在水溶液中又能在溶液中发生电离的物质是某些高温难分解盐,绝大多数盐溶解在水中都能发生完全电离,某些盐熔融时也发生电离,如BaSO4。
④电离不需要通电等外界条件,在熔融或者水溶液中即能够产生离子;⑤是电解质,但是要产生离子也要在溶液状态或者熔融状态,否则即便存在离子也无法导电,比如NaCl ,晶体状态不能导电。
⑥电解质的强弱与导电性、溶解性无关。
如如BaSO 4不溶于水,但溶于水的BaSO 4全部电离,故BaSO 4为强电解质。
导电性与自由移动离子的浓度和带电荷数等有关。
强电解质 :在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分电离成离子的电解质 。
2.常见的电解质为酸碱盐、活泼金属氧化物、水,其中强电解质与偌电解质常见分类:3、电离方程式的书写——“强等号,弱可逆,多元弱酸分步离”①强电解质:如H 2SO 4:H 2SO 4===2H ++SO 2-4 。
弱电解质的电离平衡

二、电离平衡常数(K)
----弱电解质电离程度相对大小的一种参数
1.定义 弱电解质在一定条件下达到电离平衡时,弱电解质 电离形成的各种离子的浓度的乘积与溶液中未电离 的分子的浓度之比是一个常数。 2.表达式
①对于一元弱酸 HA
( H+) .c( A-) c(HA)
M++OH-,平衡时
温度/℃ 0 5 10 15 20 25
Ka/10-5mol/L
1.657 1.700
1.729
1.745
1.753
1.765
醋酸(弱电解质)的电离过程是吸热的,升温,K增大 (2)在常温下Ka (HCN)=6.2×10-10mol/L , Ka(CH3COOH)=1.7×10-5mol/L,Ka (HF)=6.8×10-4mol/L。根 据这组数据分析:弱电解质在水中达到电离平衡时电离 程度的大小主要由 弱电解质本身性质 决定。 2、化学平衡受温度、浓度等条件的影响,那么弱电 解质的电离是否受温度、浓度等外界条件的影响?
Ka(HCN)=6.2×10-10mol/L
Ka(HAC)=1.7×10-5mol/L
Ka( HF 酸性强弱:
反之,酸性越弱。
)=6.8×10-4mol/L
。
Ka值越大,达到电离平衡时电离出的H+越多,酸性越强。
【问题探究三】
多元弱酸的各步电离常数是否相同,如果不相同, 有什么规律?多元弱碱的电离是否也存在此规律?
5、多元弱酸: 如: H2CO3 HCO3分步电离,以第一步电离为主 H+ + HCO3- Ka1=4.4×10-7mol/L H+ + CO32- Ka2=4.7×10-11mol/L
弱电解质的电离

弱电解质的电离
弱电解质的电离是指弱电解质在水溶液或熔融状态下离解成带相反电荷并自由移动离子的一种过程。
一、弱电解质电离的特点:弱电解质在水溶液中呈现不完全电离,存在电离平衡。
二、弱电解质的定义:是指在水溶液中不完全或少部分电离的电解质,叫做弱电解质。
例如:弱酸、弱碱、水等化合物在水溶液中部分电离成离子,存在电解质分子和离子之间的电离平衡,是弱电解质。
三、电解质的定义:是指在水溶液或熔融状态可以产生自由离子而导电的化合物。
包括可溶性盐、酸和碱。
例如NaOH、NaCl、HCl、MgCl2等。
四、弱电解质电离方程式(以H2CO3、CH3COOH电离为例):
H2CO3⇌(H+)+HCO3-; HCO3-⇌(H+)+(CO3)2-。
高中化学选修四第三章弱电解质的电离知识点

第一节弱电解质的电离一、电解质1、定义:○1电解质:在水溶液中或熔化状态下能导电的化合物;○2非电解质:在水溶液中或熔化状态下都不能导电的化合物;(非金属氧化物、大多数有机物。
如)○3强电解质:在水溶液里全部电离成离子的电解质;(强酸、强碱、大多数盐。
如)○4弱电解质:在水溶液里只有一部分分子电离成离子的电解质。
(弱酸、弱碱,极少数盐,水。
如HClO、)2、电解质与非电解质的本质区别:电解质——离子化合物或共价化合物非电解质——共价化合物注意:○1电解质、非电解质都是化合物○2强电解质不等于易溶于水的化合物(如不溶于水,但溶于水的全部电离,故为强电解质)○3电解质的强弱与导电性、溶解性无关【习题一】(2017秋•邢台期末)下列事实不能证明H2C2O4(乙二酸)是弱电解质的是()A.草酸能使酸性KMnO4溶液褪色B.常温下,0.1mol/L的H2C2O4溶液的PH=2C.浓度均为1mol/L=l的H2C2O4溶液的导电能力比硫酸的导电能力弱D.常温下,pH=4的H2C2O4溶液稀释100倍,pH约为5【考点】弱电解质的判断.【专题】电离平衡与溶液的pH专题.【分析】强弱电解质的根本区别是电离程度,部分电离的电解质是弱电解质,只要说明乙二酸部分电离就能证明乙二酸是弱电解质,据此分析解答。
【解答】解:A.草酸能使酸性KMnO4溶液褪色,是草酸的还原性,不能证明为弱酸,故A符合;B.常温下,0.1mol/L的H2C2O4溶液的PH=2,说明溶液中存在电离平衡,草酸为弱电解质,故B不符合;C.浓度均为1mol/L的H2C2O4溶液的导电能力比硫酸的导电能力弱,说明草酸部分电离,为弱电解质,故C不符合;D.常温下,pH=4的H2C2O4溶液稀释100倍,若为强电解质PH变化为6,pH 约为5,说明稀过程中草酸又电离出氢离子,存在电离平衡,说明为弱电解质,故D不符合;故选:A。
【习题二】(2017秋•平罗县校级期末)下列说法中,正确的是()A.强电解质的水溶液一定比弱电解质溶液的导电能力强B.强电解质都是离子化合物,弱电解质都是共价化合物C.强电解质的水溶液中不存在溶质分子D.不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质【考点】强电解质和弱电解质的概念.【专题】电离平衡与溶液的pH专题.【分析】A.溶液导电能力取决于溶液中离子浓度大小,与电解强弱无关;B.某些共价化合物是强电解质;C.强电解质完全电离成离子;D.某些不溶性盐是强电解质;某些可溶性酸是弱电解质;某些具有极性键的化合物是弱强电解.【解答】解:A.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故A错误;B.强电解质不一定都是离子化合物,如氯化氢;弱电解质都是共价化合物,故B错误;C.强电解质的特征水溶液中完全电离,所以不存在溶质分子,故C正确;D.不溶性盐不一定是弱电解质,如硫酸钡;可溶性酸不一定是强电解质如醋酸;具有极性键的化合物不一定是强电解,如甲烷,故D错误,故选:C。
弱电解质的电离平衡-知识点

弱电解质的电离平衡考点一:弱电解质的电离平衡一、弱电解质的电离平衡 1.电离平衡的建立在一定条件(如温度、浓度等)下,当弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到平衡。
平衡建立过程如图所示。
2.电离平衡的特征二、影响电离平衡的外界条件1.温度:温度升高,电离平衡向右移动,电离程度增大。
2.浓度:稀释溶液,电离平衡向右移动,电离程度增大。
3.同离子效应:加入与弱电解质具有相同离子的强电解质,电离平衡向左移动,电离程度减小。
4.加入能反应的物质:电离平衡向右移动,电离程度增大。
三、实例分析以CH 3COOH CH 3COO -+H +ΔH >0为例:名师点拨(1)电离平衡右移,电解质分子的浓度不一定减小,离子的浓度也不一定增大。
例如:对于CH 3COOHCH 3COO -+H +平衡后,加入冰醋酸,c (CH 3COOH)增大,平衡右移,根据勒夏特列原理,再次平衡时,c (CH 3COOH)比原平衡时大;加水稀释或加少量NaOH 固体,都会引起平衡右移,但c (CH 3COOH)、c (H +)都比原平衡时要小。
(2)稀释弱电解质溶液时,并非所有粒子浓度都减小。
例如:HA 溶液稀释时,c (HA)、c (H +)、c (A -)均减小(参与平衡建立的微粒),但c (OH -)会增大。
考 点 二 电离平衡常数一、表达式1.对于一元弱酸HA :HAH ++A -,电离平衡常数K =c (H +)·c (A -)c (HA )。
2.对于一元弱碱BOH :BOHB ++OH -,电离平衡常数K =c (B +)·c (OH -)c (BOH )。
二、特点1.电离平衡常数只与温度有关,因电离是吸热过程,所以升温,K 值增大。
2.多元弱酸的各级电离平衡常数的大小关系是K 1≫K 2≫K 3≫…,故其酸性取决于第一步。
三、意义K 越大―→越易电离―→酸(碱)性越强名师点拨(1)电离平衡常数与化学平衡常数一样,只与温度有关,与其他条件无关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
弱电解质的电离平衡一、电解质和非电解质1、概念(1)电解质:在水溶液里或熔融状态下能导电的化合物酸:HCl HNO3H2SO4H3PO4H2S HClO碱:NaOH KOH Ca(OH)2NH3·H2O Mg(OH)2盐:NaCl CuSO4CaCO3NaHCO3多数金属氧化物:Na2O MgO Al2O3 Na2O2非电解质:在水溶液里和熔融状态下都不能导电的化合物多数有机物:蔗糖、酒精、乙醚、烃、苯等是非电解质。
非金属氧化物:CO2、SO3、SO2 、NO2等是非电解质。
某些非金属氢化物: NH3、PH3 、CH4①电解质和非电解质均指化合物,单质既不属于电解质也不属于非电解质。
②电解质必须是自身能直接电离出自由移动的离子的化合物。
③对于电解质来说,只须满足一个条件即可,而对非电解质则必须同时满足两个条件。
(2)强电解质:溶于水或熔融状态下几乎完全电离的电解质如:HCl = H++ Cl-盐酸溶液中HCl全部电离成H+和Cl-,无HCl分子存在。
弱电解质:溶于水或熔融状态下只有部分电离的电解质如:CH3COOH ⇌H++ CH3COO-醋酸溶液中主要是醋酸分子,只有少量H+和CH3COO-划分强弱电解质的标准:电解质在水溶液里能否完全电离.强酸:HCl H2SO4 HNO3HBr HI等强电解质强碱:NaOH KOH Ba(OH)2Ca(OH)2大多数盐:ZnCl2Na2CO3NH4NO3NaHSO4CaCO3BaSO4活泼金属氧化物:Na2O K2O MgO Al2O3Na2O2等强电解质在溶液中以水合离子的形式存在。
弱酸:H2CO3CH3COOH HF HClO等弱电解质弱碱:NH3.H2O Cu(OH)2Fe(OH)3水:H2O个别盐: 如HgCl2PbAc2弱电解质在溶液中以分子、水合离子的形式存在。
CaCO3BaSO4虽难溶于水,但溶解的那少量完全电离, 故它们是强电解质,所以电解质与溶解度无关,二者切勿混为一谈!2、电解质与非电解质的判断:主要看该化合物在溶于水或熔融状态下,自身能否电离出阴、阳离子,能电离的属于电解质,不能电离的属于非电解质。
水溶液能够导电只能作为参考因素。
CO2、SO3 、SO2、NH3的水溶液能导电,它们是电解质吗?——SO2、Cl2、NH3的水溶液虽然能导电,但自身不能电离出阴、阳离子,而是靠生成的酸或碱电离出阴、阳离子,故CO2SO3SO2、NH3是非电解质。
Fe、Cl2的水溶液、熔融的NaOH 、NaOH溶液能导电, 它们是电解质吗?——熔融的NaOH是电解质,因Fe 、Cl2是单质,NaOH溶液是混合物.故Fe、Cl2、NaOH 溶液既不是电解质也不是非电解质。
Na2O是电解质的原因是它熔融状态下能导电,Na2O(熔融)=2Na+ +O2- 而不是溶于水能导电,因为:Na2O + H2O = 2NaOH3、电解质溶液的导电性和导电能力(1)电解质不一定导电(如NaCI晶体、冰醋酸),导电物质不一定是电解质(如石墨),非电解质不导电,但不导电的物质不一定是非电解质。
(2)强电解质溶液导电性不一定比弱电解质强。
饱和强电解质溶液导电性不一定比弱电解质强。
二、电离方程式的书写:1. 强电解质的电离方程式:(全部电离用“=”)H2SO4=2H++SO42—2. 弱电解质的电离方程式:(部分电离用可逆符号“⇌”)(多元弱酸分步写出,多元弱碱一步写出)CH3COOH ⇌CH3COO—+H+ -碳酸的电离:H2CO3⇌H++HCO3-(第1步电离)HCO3-⇌H++ CO32- (第2步电离)氢氧化铁的电离:Fe(OH)3⇌Fe3+ + 3OH-弱酸的电离程度都比较小,以第一级电离为主,一级比一级难电离。
练习:(1)下列物质中,哪些是强电解质?哪些是弱电解质?哪些是非电解质?HF Cl2P2O5CO NH3·H2O CH3COOH P2O5CO H2CO3NO2Cu H2SO4 H3PO4PbAc2 KOH Ba(OH)2MgOAl2O3 AlCl(2)HgCl2的稀溶液可用作手术的消毒剂,已知HgCl2的熔点为276℃、熔融状态的HgCl2不能导电,HgCl2的浓溶液有弱的导电能力,则下列关于HgCl2的叙述中正确的是( ) A.HgCl2属于共价化合物B.HgCl2属于离子化合物C.HgCl2属于非电解质D.HgCl2属于强电解质(3)下列说法正确的是()A.液态HCl不导电,所以HCl是非电解质。
B.NH3、CO2的水溶液均导电,所以NH3、CO2是电解质。
C.铁、石墨都能导电,所以铁、石墨是电解质。
D.蔗糖在水溶液里和熔化状况下都不能导电,它是非电解质。
(4) NaHSO4在水溶液里电离出的离子是___________。
NaHSO4在熔融状况下电离出的离子是___________。
三、电离平衡电离平衡: 在一定条件下,当电解质分子离解成离子的速率和离子结合成分子的速率相等,就达到了电离平衡。
1. 电离平衡常数在一定温度下,当弱电解质在溶液中达到电离平衡时,溶液中各种离子浓度的乘积,跟溶液中未电离的分子浓度之比是一个常数,称为电离平衡常数,简称为电离常数。
用K 表示。
例如:CH 3COOH 的电离平衡常数为:CH 3COOH ⇌CH 3COO - + H +电离常数K 只与温度有关,温度升高,K 值增大,与电解质的浓度无关。
例如:25℃时, K a (HNO 2) =4.6×10-4, K a (CH 3COOH)=1.8 ×10-5,K a (HCN)=6.2×10-10.试比较它们酸性的强弱。
酸的强弱: HNO 2 > CH 3COOH > HCN2.电离度(补充内容)电离度:当弱电解质在溶液中达到平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数。
α =n (已电离)—n (总) 100% =c(已电离)—c (总) 100%例如:25℃,0.1mol/LCH 3COOH 溶液,测得c (H +)=1.32 10-3mol/L , 求α3.影响电离平衡的因素(探讨) 在CH 3COOH 溶液中分别加入下列物质,对CH 3COOH 的电离平衡各有什么影响?—+化学平衡移动原理(勒夏特列原理)也适用于电离平衡,当条件发生改变时,电离平衡也发生移动。
决定因素—弱电解质的本性;外界条件的影响主要是—温度,浓度。
(1)温度(越热越电离)电离过程是吸热过程,温度升高,电离度增大,离子浓度增大 ,平衡向电离方向移动。
(平衡常数增大)(2)浓度(越稀越电离))()()(33COOH CH c COO CH c H c K a -+∙=弱电解质的电离依靠水的作用,浓度越大,相对水的含量就少,促进电离的能力就越弱,电离程度就越小。
越稀越电离。
从电离平衡的角度:CH 3COOH ⇌ CH 3COO - + H +加水稀释,醋酸分子,醋酸根离子,以及氢离子浓度都在减小,右边是两种离子浓度减小,因此减小的程度更大,平衡正向移动, (越稀越电离)。
(3)同离子效应(抑制电离)加入与弱电解质具有相同离子的强电解质,使电离平衡逆向移动(4)化学反应(促进电离)加入与弱电解质电离产生的某种离子反应的物质时,使电离平衡正向移动。
例如:在醋酸溶液中加入少量金属钠,金属钠与H +反应置换出氢气,使得c (H +)减小,平衡醋酸的电离平衡正向移动。
例题:相同温度下,两种稀氨水A 和B ,浓度分别为0.2mol/L 和0.1mol/L ,则A 、B 的OH -浓度之比为( )A.大于2B. 小于2C. 等于2D. 不能肯定练习1:在25℃时,用蒸馏水稀释氨水,随溶液的稀释,下列各项中始终保持增大趋势的是( ) A. B. C. D. 练习2.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如下图所示,⑴O 点导电能力为0的理由是⑵a 、b 、c 三点溶液的c(H +)由小到大的顺序是⑶a 、b 、c 三点醋酸的电离程度最大的是⑷要使c 点c(Ac — )增大,c(H +)减少,可采取的措施是(至少写出三种方法)① ,② ,③ ,④ 。
练习3.某二元弱酸H 2A 溶液中,[A 2-]浓度最大的是( )A.0.01mol/L 的H 2A 溶液B.0.01mol/LNaHA 溶液C.0.02mol/L 的HCl 与0.04mol/LNaHA 溶液等体积混合的 溶液D. 0.02mol/L 的NaOH 与0.02mol/LNaHA 溶液等体积混合的溶液补充:多元弱酸是分步电离的,每步各有电离常数,通常用K a1K a2K a3表示.如:H 3PO 4的电离。
H 3PO 4 ⇌ H ++H 2PO 4- K a1=7.5×10-3H 2PO 4- ⇌ H ++HPO 42- K a2=6.2×10-8)()(23O H NH C OH C ⋅-)()(4-+OH C NH C )()(423+⋅NH C O H NH C )(-OH CHPO42- ⇌H++PO43-K a3=2.2×10-13从上可看出:K a1>K a2>K a3,K a1比K a2约大105倍,K a2比K a3约大105倍,多元弱酸的电离主要由第一步决定.几种常见的多元弱酸的电离常数.。
