乙醛 课件
乙醛PPT课件1 人教课标版
»
• • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • •
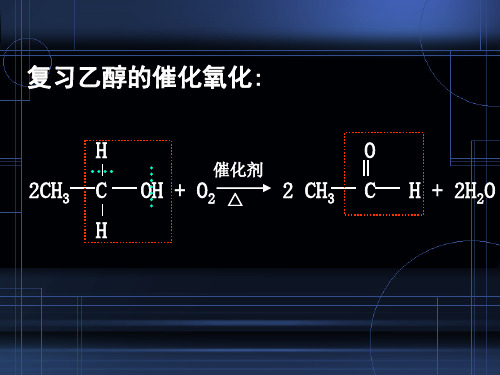
乙醛的制备
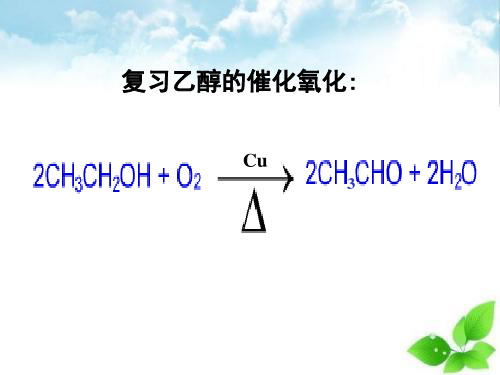
(1)乙醇氧化法:
Cu 2CH CHO+2H O 2CH3CH2OH+O2 △ 3 2
(2)乙炔水化法: CH CH + H2O (3)乙烯氧化法: 2CH2=CH2+O2
催化剂 催化剂
CH3CHO 2CH3CHO
加热、 加压
醛类中具有代表性的醛- 乙
乙醛的结构:
O
H O
醛
分子式:C2H4O 结构式: H C C H
一、我们因梦想而伟大,所有的成功者都是大梦想家:在冬夜的火堆旁,在阴天的雨雾中,梦想着未来。有些人让梦想悄然绝灭,有些人则细心培育维护,直到它安然度过困境,迎来光明和希望,而光明和希望 总是降临在那些真心相信梦想一定会成真的人身上。——威尔逊
二、梦想无论怎样模糊,总潜伏在我们心底,使我们的心境永远得不到宁静,直到这些梦想成为事实才止;像种子在地下一样,一定要萌芽滋长,伸出地面来,寻找阳光。——林语堂 三、多少事,从来急;天地转,光阴迫。一万年太久,只争朝夕。——毛泽东 四、拥有梦想的人是值得尊敬的,也让人羡慕。当大多数人碌碌而为为现实奔忙的时候,坚持下去,不用害怕与众不同,你该有怎么样的人生,是该你亲自去撰写的。加油!让我们一起捍卫最初的梦想。——柳岩 五、一个人要实现自己的梦想,最重要的是要具备以下两个条件:勇气和行动。——俞敏洪 六、将相本无主,男儿当自强。——汪洙 七、我们活着不能与草木同腐,不能醉生梦死,枉度人生,要有所作为。——方志敏 八、当我真心在追寻著我的梦想时,每一天都是缤纷的,因为我知道每一个小时都是在实现梦想的一部分。——佚名 九、很多时候,我们富了口袋,但穷了脑袋;我们有梦想,但缺少了思想。——佚名 十、你想成为幸福的人吗?但愿你首先学会吃得起苦。——屠格涅夫 十一、一个人的理想越崇高,生活越纯洁。——伏尼契 十二、世之初应该立即抓住第一次的战斗机会。——司汤达 十三、哪里有天才,我是把别人喝咖啡的工夫都用在工作上的。──鲁迅 十四、信仰,是人们所必须的。什麽也不信的人不会有幸福。——雨果 十五、对一个有毅力的人来说,无事不可为。——海伍德 十六、有梦者事竟成。——沃特 十七、梦想只要能持久,就能成为现实。我们不就是生活在梦想中的吗?——丁尼生 十八、梦想无论怎样模糊,总潜伏在我们心底,使我们的心境永远得不到宁静,直到这些梦想成为事实。——林语堂 十九、要想成就伟业,除了梦想,必须行动。——佚名 二十、忘掉今天的人将被明天忘掉。──歌德 二十一、梦境总是现实的反面。——伟格利 二十二、世界上最快乐的事,莫过于为理想而奋斗。——苏格拉底 二十三、“梦想”是一个多么“虚无缥缈不切实际”的词啊。在很多人的眼里,梦想只是白日做梦,可是,如果你不曾真切的拥有过梦想,你就不会理解梦想的珍贵。——柳岩 二十四、生命是以时间为单位的,浪费别人的时间等于谋财害命,浪费自己的时间,等于慢性自杀。——鲁迅 二十五、梦是心灵的思想,是我们的秘密真情。——杜鲁门· 卡波特 二十六、坚强的信念能赢得强者的心,并使他们变得更坚强。——白哲特 二十七、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 二十八、青少年是一个美好而又是一去不可再得的时期,是将来一切光明和幸福的开端。——加里宁 二十九、梦想家命长,实干家寿短。——约· 奥赖利 三十、青年时准备好材料,想造一座通向月亮的桥,或者在地上造二所宫殿或庙宇。活到中年,终于决定搭一个棚。——佚名 三十一、在这个并非尽善尽美的世界上,勤奋会得到报偿,而游手好闲则要受到惩罚。——毛姆 三十二、在科学上没有平坦的大道,只有不畏劳苦,沿着陡峭山路攀登的人,才有希望达到光辉的顶点。——马克思 三十三、在劳力上劳心,是一切发明之母。事事在劳力上劳心,变可得事物之真理。——陶行知 三十四、一年之计在于春,一日之计在于晨。——萧绛 三十五、没有一颗心会因为追求梦想而受伤,当你真心想要某样东西时,整个宇宙都会联合起来帮你完成。——佚名 三十六、梦想不抛弃苦心追求的人,只要不停止追求,你们会沐浴在梦想的光辉之中。——佚名 三十七、一块砖没有什么用,一堆砖也没有什么用,如果你心中没有一个造房子的梦想,拥有天下所有的砖头也是一堆废物;但如果只有造房子的梦想,而没有砖头,梦想也没法实现。——俞敏洪 三十八、如意算盘,不一定符合事实。——奥地利 三十九、志向不过是记忆的奴隶,生气勃勃地降生,但却很难成长。——莎士比亚 四十、如果失去梦想,人类将会怎样?——热豆腐 四十一、无论哪个时代,青年的特点总是怀抱着各种理想和幻想。这并不是什么毛病,而是一种宝贵的品质。——佚名 四十二、梦想绝不是梦,两者之间的差别通常都有一段非常值得人们深思的距离。——古龙 四十三、梦想家的缺点是害怕命运。——斯· 菲利普斯 四十四、从工作里爱了生命,就是通彻了生命最深的秘密。——纪伯伦 四十五、穷人并不是指身无分文的人,而是指没有梦想的人。——佚名 四十六、不要怀有渺小的梦想,它们无法打动人心。——歌德 四十七、人生最苦痛的是梦醒了无路可走。做梦的人是幸福的;倘没有看出可以走的路,最要紧的是不要去惊醒他。——鲁迅 四十八、浪费别人的时间是谋财害命,浪费自己的时间是慢性自杀。──列宁 四十九、意志薄弱的人不可能真诚。——拉罗什科 五十、梦想绝不是梦,两者之间的差别通常都有一段非常值得人们深思的距离。——古龙 五十一、得其志,虽死犹生,不得其志,虽生犹死。——无名氏 五十二、所虑时光疾,常怀紧迫情,蹒跚行步慢,落后最宜鞭。——董必武 五十三、梦想只要能持久,就能成为现实。我们不就是生活在梦想中的吗?——丁尼生 五十四、很难说什么是办不到的事情,因为昨天的梦想,可以是今天的希望,并且还可以成为明天的现实。——佚名 五十五、要用你的梦想引领你的一生,要用感恩真诚助人圆梦的心态引领你的一生,要用执著无惧乐观的态度来引领你的人生。——李开复 五十六、人类也需要梦想者,这种人醉心于一种事业的大公无私的发展,因而不能注意自身的物质利益。——居里夫人 五十七、一个人的理想越崇高,生活越纯洁。——伏尼契 五十八、梦想一旦被付诸行动,就会变得神圣。——阿· 安· 普罗克特 五十九、一个人追求的目标越高,他的才力就发展得越快,对社会就越有益。——高尔基 六十、青春是人生最快乐的时光,但这种快乐往往完全是因为它充满着希望,而不是因为得到了什么或逃避了什么。——佚名 六十一、生命里最重要的事情是要有个远大的目标,并借助才能与坚毅来完成它。——歌德 六十二、没有大胆的猜测就作不出伟大的发现。──牛顿 六十三、梦想,是一个目标,是让自己活下去的原动力,是让自己开心的原因。——佚名 六十四、人生太短,要干的事太多,我要争分夺秒。——爱迪生 六十五、一路上我都会发现从未想像过的东西,如果当初我没有勇气去尝试看来几乎不可能的事,如今我就还只是个牧羊人而已。——《牧羊少年的奇幻之旅》 六十六、一个人越敢于担当大任,他的意气就是越风发。——班生 六十七、贫穷是一切艺术职业的母亲。——托里安诺 六十八、莫道桑榆晚,为霞尚满天。——刘禹锡 六十九、一切活动家都是梦想家。——詹· 哈尼克 七十、如果一个人不知道他要驶向哪个码头,那么任何风都不会是顺风。——小塞涅卡 七十一、人性最可怜的就是:我们总是梦想着天边的一座奇妙的玫瑰园,而不去欣赏今天就开在我们窗口的玫瑰。——佚名 七十二、一个人如果已经把自己完全投入于权力和仇恨中,你怎么能期望他还有梦?——古龙 七十三、一个人有钱没钱不一定,但如果这个人没有了梦想,这个人穷定了。——佚名 七十四、平凡朴实的梦想,我们用那唯一的坚持信念去支撑那梦想。——佚名 七十五、最初所拥有的只是梦想,以及毫无根据的自信而已。但是,所有的一切就从这里出发。——孙正义 七十六、看见一个年轻人丧失了美好的希望和理想,看见那块他透过它来观察人们行为和感情的粉红色轻纱在他面前撕掉,那真是伤心啊!——莱蒙托夫 七十七、努力向上吧,星星就躲藏在你的灵魂深处;做一个悠远的梦吧,每个梦想都会超越你的目标。——佚名 七十八、正如心愿能够激发梦想,梦想也能够激发心愿。——佚名 七十九、梦想一旦被付诸行动,就会变得神圣。——阿· 安· 普罗克特 八十、对于学者获得的成就,是恭维还是挑战?我需要的是后者,因为前者只能使人陶醉而后者却是鞭策。——巴斯德 八十一、冬天已经到来,春天还会远吗?——雪莱 八十二、一个人想要成功,想要改变命运,有梦想是重要的。……我觉得每个人都应该心中有梦,有胸怀祖国的大志向,找到自己的梦想,认准了就去做,不跟风不动摇。同时,我们不仅仅要自己有梦想,你还应该用自己的梦想去感染和影响别人,因为成功者一定是用自
《乙醛》优质课课件

至最初产生的沉淀恰好溶解为止。
白色
AgOH +
2NH3·H2O =Ag(NH3)2OH
+
2H2O
沉淀 溶解
(氢氧化二氨合银)
△
CH3CHO + 2Ag(NH3)2OH → CH3COONH4 + 3NH3 + 2Ag↓+ H2O
注意:
a 、试管内壁必须洁净 b 、银氨溶液要现用现配 c 、水浴加热时,不能摇动试管 d、 碱性环境 ,氨水不能过量. (防止生成易爆物质) e 、关系式:—CHO~2Ag
(二)氧化反应
1、
O -C-H
CH3CHO
O
O
-C-O-H
KMnO4 溶液
褪色
2、银镜反应:
药品:
AgNO3 、氨水 、乙醛
制备银氨溶液:
在洁净的试管中加入1滴管(约为1mL)2%的AgNO3 溶液,然后边振荡试管边逐滴滴入2%的稀氨水。
白色 沉淀
Ag+ + NH3·H2O = AgOH↓ + NH4+
O H— C—H
作业:
1、《一线精炼》课时练习十三 2、总结能够使溴水褪色的物质有哪些? 原理分别是什么?
成功的关键: 1 、Cu(OH)2悬浊液要现用现配 2 、NaOH必须过量,反应在碱性条件下加热至沸 3 、加热煮沸时间不能过长,否则出现黑色沉淀
应用: (1)检验醛基的存在
(2)医学上检验病人是否患糖尿 (92()病医学上检验病人是否患糖尿病
思考: 还有哪些常见的氧化剂能氧化醛基呢?
氧气、酸性K2Cr2O7溶液 溴水等均可以氧化醛基。
郑口中学 解晓东
醛:
R 由烃基(或氢原子)
乙醛 PPT课件

⑦乙醛与新制银氨溶液或氢氧化铜悬浊液反应 ⑧乙炔与氯化氢反应生成氯乙烯 加成反应 氧化反应
⑨催化剂作用下,乙烯与氢气反应生成乙烷 ⑩一定条件下,乙醛与氢气反应生成乙醇 还原反应
[问题5]仔细观察以下实验,加热方式?实验现象? ①向盛有新制银氨溶液的试管中滴入3滴乙醛,将试管 放在热水浴中加热,观察实验现象? ②向盛有新制Cu(OH)2悬浊液的试管中滴入3滴乙醛, 将试管放在酒精灯上加热至沸腾,观察现象?
试管壁上有光亮的银镜生成 有砖红色沉淀生成
归纳小结
[问题7]判断下列变化属于何种反应类型? ①苯和浓硝酸反应生成硝基苯; 取代反应 ②乙烯与水反应生成乙醇; 加成反应 ③乙醇或苯的燃烧; 氧化反应 ④甲烷与溴蒸汽反应生成一溴甲烷; 取代反应
[问题2]分子式符合C2H4O的某有机物的比例模型和球 棍模型分别如下,写出该有机物的结构式和结构简式?
[问题3]你知道为什么新装修的房子以及劣质酒精中常 有刺鼻的气味吗?
乙醛的物理性质:有刺激性气味、易燃、易挥发的无色 液体(沸点:20.80C),可溶于水和乙醇等。
[问题4]乙醛是由乙基和醛基构成的,一定条件下,乙 醛与氢气可以发生反应,反应时醛基中的碳氧双键断 裂一个,然后碳原子与氧原子上各结合一个氢原子, 写出乙醛与氢气发生反应的化学方程式。反应类型?
化学必修2
专题3、有机化合物的获得与应用 第二单元 食品中的有机化合物
第二部分 乙醛
Байду номын сангаас
[问题1]4.4克某有机物在O2中完全燃烧,其产物(100 ℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管 全部被吸收后,洗气瓶的质量增加3.6克,干燥管的质 量增加8.8克。相同条件下,若该有机物蒸汽相对氢气 的密度为22,计算确定该有机物的分子式?
《乙醛》PPT课件(辽宁省市级优课)

乙烯在催化剂作用下被氧化成乙醛,反应过程中 涉及碳碳双键的断裂和氧原子的插入。
03
乙醛的反应与性质
乙醛的氧化反应
01 与氧气反应
乙醛在铜或银的催化下,可被氧气氧化为乙酸。
02 与高锰酸钾反应
乙醛能被酸性高锰酸钾溶液氧化,使高锰酸钾溶 液褪色。
03 与重铬酸钾反应
乙醛与重铬酸钾在酸性条件下反应,生成乙酸和 二氧化碳。
取少量乙醛,加入银氨溶液,水浴加热, 观察现象。
实验数据分析与结果讨论
乙醛的制备实验结果分析
计算产率,分析影响产率 的因素。
通过测定生成物的红外光 谱和核磁共振氢谱,确认 生成物为乙醛。
实验数据分析与结果讨论
乙醛的性质实验结果分析 酸性高锰酸钾溶液褪色,说明乙醛具有还原性。
新制的氢氧化铜悬浊液加热煮沸后生成砖红色沉淀,说明乙醛具有氧化性。
乙烯氧化法
乙烯在催化剂作用下与空气或氧 气反应,生成乙醛。这种方法也 是工业上生产乙醛的重要方法之 一。
乙醛合成过程中的反应机理
01 乙醇氧化法反应机理
乙醇在催化剂作用下被氧化成乙醛,反应过程中 涉及醇羟基的氧化和氢原子的转移。
02 乙炔水化法反应机理
乙炔在催化剂作用下与水反应生成乙醛,反应过 程中涉及碳碳三键的加成和水分子的裂解。
实验数据分析与结果讨论
银氨溶液水浴加热后生成
01 光亮的银镜,说明乙醛具
有还原性。
结果讨论与改进建议
03
分析实验过程中可能存在
02
的误差来源及改进措施。
讨论实验结果与理论预测
04
之间的差异及可能原因。
THANKS
感谢观看
《乙醛》PPT课件( 辽宁省市级优课)
高中化学《乙醛》课件ppt

乙醛是一种无色液体, 有刺激性气味,密度小于 水,可与水和乙醇等有机 物互溶,沸点低,易挥发
HO HC C H
H 醛基
烃基
乙醛的结构
官能团:
O
醛基
CH
结构决定性质
HO
HC C H
H 醛基
烃基 1.从醛基的结构特点出发,预测乙醛可 能会有什么化学性质? 2.分析醛基上C的化合价,预测醛基可 能会有什么化学性质?
乙醛
在日常生活中 我们都会有这样的 疑问,为什么有的 人喝酒“千杯万杯 都不醉”,而有的 人喝一点酒后就面 红耳赤,甚至酩酊 大醉?酒量的大小 到底与什么有关呢?
原来如 此啊!
研究发现,饮酒后乙醇进入人体内, 首先在乙醇脱氢酶的作用下氧化为乙醛, 然后又在乙醛脱氢酶的作用下将乙醛氧化 为乙酸,并进一步转化为CO2和H2O。如果 人体内缺少乙醛脱氢酶,饮酒后就会引起
氧化
CH3CH2OH
氧化
CH3CHO
CH3COOH
CH3CH2OH 还原(加成)CH3CHO 氧化 CH3COOH
生成的砖红色沉淀可 能是什么物质? CuO? CuOH是黄色
或淡黄色固体,
CuOH?不溶于水 ,非
常不稳定
Cu2O?C溶u于2O水是的红固色体难
问题解决:
试管内壁 的银镜如 何清洗?
小结: 乙醛能被酸性高锰酸钾溶液 氧化吗?
乙醛能使溴水褪色吗?
问题解决:已知柠檬醛的结构简式为:
CH3
CH3 O
|
|
‖
CH3–C=CH–CH2–CH2–C=CH–C–H
柠檬酸中含C=C和醛基两个官能团, 实验操作中,先检验哪一个官能团? 用什么检验试剂?
乙醛的教学课件ppt

乙醛可以发生加成反应 、氧化反应和还原反应
乙醛可以与羧酸发生酯 化反应
乙醛可以与醇发生酯化 反应
乙醛的用途
乙醛可以用于制造香料、医 药、农药等化工产品
乙醛可以用于合成树脂、橡 胶等高分子材料
乙醛可以用于制造醋酸、醋 酸盐等化学品
乙醛可以用于生产甲醛、乙 醇等其他有机化合物
02 乙醛的生产方法
乙炔水合法
在皮革加工中,乙醛也 被用作脱毛剂和鞣制剂 ,可以提高皮革的质量 和耐用性。
乙醛在科学Leabharlann 究中的应用在科学研究领域,乙醛作为一种重要 的有机化合物,被广泛用于合成和研 究各种复杂有机物和生物分子。
在生物学研究中,乙醛可以用于研究 生物分子的结构和功能,例如蛋白质 的修饰和基因的表达调控等。
乙醛可以作为反应中间体,用于研究 化学反应机理和合成方法学。
总结词
乙炔水合法是一种常用的生产乙醛的方法,通过将乙炔和水的反应来制备乙醛 。
详细描述
乙炔水合法通常在高温和催化剂的作用下进行,将乙炔气体和蒸气混合后通过 催化剂床层,反应生成乙醛和水。该方法具有较高的选择性,能够得到高纯度 的乙醛产品。
乙醇脱氢法
总结词
乙醇脱氢法是一种通过乙醇的脱氢反 应来制备乙醛的方法。
控制源头
加强生产过程中的密闭 和通风措施,减少乙醛 的逸散和排放。
定期检测
定期对工作环境进行乙 醛浓度检测,及时发现 和处理超标情况。
乙醛的未来发展
05
乙醛的生产技术的发展趋势
01
生物发酵技术
利用微生物发酵将糖类物质转化为乙醛,具有环保、高 效的特点,是未来发展的重要方向。
02
合成气直接转化技术
乙醛教学课件
苏教版-乙醛ppt课件

1
催化剂
2CH3CH2OH + O2
2CH3CHO + 2H2O
HH H—C—C—O—H
HH
-2H
乙醇
HH
H—C—C=O
H
乙醛
醛基 -CHO
R-CHO
烃基
2
醛类 O
H CH
甲醛
HH O
HO
由烃基与醛基相连而构成的 H C C H 有机化合物。简称RCHO
H
乙醛 R-CHO 或 O 醛基
R-C-H
因此乙醛能使高锰酸钾溶液溴水 褪色
21
O=
—C—H ,是既有氧化性,又有还原性,
其氧化还原关系为:
醇
氧化 还原
醛 氧化
羧酸
小
O=
结 ⑴ —C—H 氧化(得氧) ,断C—H键:
2CH3CHO + O2
Cu △
2CH3COOH
O= O=
⑵ —C—H 醛还原(加氢) ,断C=O键:
R—C—H + H2
Ni △
应用: a、检验醛基存在,确定醛基数目
b、医院里,利用这一反应原理
检查尿糖是否正常
(检查葡萄糖的醛基)
19
注意
1.Cu(OH)2应现配现用; 2.成功条件:碱性环境、加热.
20
思考
乙醛能被氧气、弱氧化剂银氨溶液、 氢氧化铜氧化,能否被强氧化剂溴水、 酸性高锰酸钾溶液氧化? 溴水、酸性高锰酸钾都O=
2. 氧化反应
(1)催化氧化
2CH3-C-H
+ O2
催化剂 △
乙酸 2CH3-C-OH
(2)燃烧
点燃
2CH3CHO+5O2
乙醛上课课件

为求延长保质期 不良奸商竟然给冰 鲜鱼浸甲醛保鲜
甲醛有毒,如果用它来浸 泡水产,可以固定海鲜、 河鲜形态,保持鱼类色泽, 但如果食用过量会休克和 致癌
儿童房甲醛超标易诱发儿童白血病
在日常生活中我们都会有这样的疑问, 为什么有的人喝酒“千杯万杯都不醉”,而有的 人一点喝酒就面红耳赤,情绪激动?酒量的大小 到底与什么有关呢?
Cu 2CH CHO+2H O 2CH3CH2OH+O2 △ 3 2
(2)乙炔水化法:
HC
C H +H2O
催化剂
CH3CHO
(3)乙烯氧化法: 2CH2=CH2+O2
催化剂
2CH CHO 3 加热、
加压
五、乙醛的用途 主要用于生产乙酸、丁醇、乙酸乙酯等, 是有机合成的重要原料。
六、醛类
1. 醛的定义:
O C H
发生在
O
C H上的加成反应
醛基
发生在 C H 上的氧化反应
三、乙醛的化学性质
1、乙醛的加成反应 H H Ni H—C—C=O + H2 △ H H O H C H C H H H H—C—C—OH H H H H
CH3CHO+H2
剂
CH3CH2OH
CH3CHO+H2
剂
CH3CH2OH
把有机物分子中加入氢原子或失去氧 原子的反应叫做还原反应。
△
CH3COOH + Cu2O + 2H2O
d 此反应可以检验醛基存在
说明: 1mol醛基 ~1mol Cu O
练习一
一个学生做乙醛的还原性实验时,取 1mol/L CuSO4溶液和0.5mol/L NaOH溶液各1ml,在一 支 洁 将 的 试 管 内 混 合 后, 向 其 中 又 加 入 5ml 40%的乙醛,结果无红色沉淀出现。实验失败 原因可能是( A、C ) A、未充分加热 B、加入乙醛太少
人教版化学选修五3.2.1乙醛 课件(共25张PPT)

②水浴加热生成银镜
在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管 放在热水浴中静置。
现象: 试管内壁附着一层光亮的银镜。
CH3CHO+2Ag(NH3)2OH
还原剂
氧化剂
CH3COONH4+2Ag↓+3NH3+H2O
银镜反应实验的注意事项:
1.试管内壁应洁净。 2.必须用水浴加热,不能用酒精灯加热。 3.加热时不能振荡试管和摇动试管。 4.配制银氨溶液时,氨水不能过多或过少 (只能加到最初的沉淀刚好消失)。 5.乙醛用量不可太多。 6.实验后,银镜用稀HNO3浸泡,再用水洗。
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月下午1时43分21.11.913:43November 9, 2021 ❖ 7、“教师必须懂得什么该讲,什么该留着不讲,不该讲的东西就好比是学生思维的器,马上使学生在思维中出现问题。”“观
察是思考和识记之母。”2021年11月9日星期二1时43分9秒13:43:099 November 2021 ❖ 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。下午1时43
原因是( B )
A、乙醛溶液太少
B、氢氧化钠不够用
C、硫酸铜不够用
D、加热时间不够.
4、甲醛、乙醛、丙醛组成的混合物里,氢元素的质量分
数是9%,则氧元素的质量分数是( B )
A、16% B、37%
C、48% D、无法计算
银镜反应有什么应用
应用: (1)检验醛基的存在 (2)测定醛基的数目(1mol乙醛发生银 镜反应时最多可生成2molAg) (3)工业上用来制瓶胆和镜子
Ⅱ、与新制的氢氧化铜反应
乙醛PPT课件(上课用)
O C OH
①银氨溶液作氧化剂 —— 银镜反应
银氨溶液的配制
在洁净的试管里加1mL2%(质量分数)的硝酸银溶 液,然后一边摇动试管,一边逐渐滴入2%(质量分 数)的稀氨水,直到最初产生的沉淀溶解为止。
Ag++NH3·H2O=AgOH+NH4+
AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O
请议一议:
弱氧化剂可将醛基 氧化,强氧化剂是 否可将醛基氧化
③与氧气反应
催化剂
2 C H 3 C H O + O 2
④与酸性高锰酸3 C H O + K M n O 4 + H 2 S O 4 C H 3 C O O H + K 2 S O 4 + M n S O 4 + H 2 O
B、加入乙醛太少
C、加入NaOH溶液的量不够
D、加入CuSO4溶液的量不够
练习二
已知:柠檬醛的结构为:
O
CH3 C CHCH2CH2C CH C H
CH3
CH3
如何证明存在碳碳双键?
4、乙醛的制备
(1)乙醇氧化法:
2CH3CH2OH+O2
Cu
△
2CH3CHO+2H2O
(2)乙炔水化法:
HC CH+H2O 催化剂 CH3CHO
(3)乙烯氧化法:
2CH2=CH2+O2
催化剂
加热、
2CH3CHO
乙醛教学课件

乙醛教学课件一、乙醛的定义及性质乙醛(Ethanal)是一种有机化合物,化学式为CH3CHO。
它是一种无色液体,具有刺激性气味。
乙醛分子由两个碳原子、四个氢原子和一个氧原子组成,其中氧原子与一个碳原子形成双键,与另一个碳原子形成单键。
乙醛是醛类化合物的一种,具有醛类化合物的通性。
二、乙醛的制备方法1.醇的氧化:将醇(如乙醇)在酸性条件下氧化,可以得到乙醛。
例如,将乙醇与浓硫酸混合,加热至一定温度,再加入铜丝作为催化剂,可以得到乙醛。
2.乙烯水合:将乙烯与水在催化剂的作用下反应,可以得到乙醛。
例如,将乙烯与水在磷酸催化剂的作用下反应,可以得到乙醛。
3.乙烷氧化:将乙烷在空气中燃烧,可以得到乙醛。
但是这种方法产生的乙醛含量较低,不适合大规模制备。
三、乙醛的化学反应乙醛是一种具有活泼化学性质的有机化合物,可以发生多种化学反应,如氧化、还原、加成、缩合等。
1.氧化反应:乙醛可以被氧化剂氧化为乙酸。
例如,将乙醛与酸性高锰酸钾溶液反应,可以得到乙酸。
2.还原反应:乙醛可以被还原剂还原为乙醇。
例如,将乙醛与氢气在催化剂的作用下反应,可以得到乙醇。
3.加成反应:乙醛可以与其他分子发生加成反应。
例如,将乙醛与氢气在催化剂的作用下反应,可以得到1-丙醇。
4.缩合反应:乙醛可以与其他分子发生缩合反应。
例如,将乙醛与苯甲醛在酸性条件下反应,可以得到苯甲酸。
四、乙醛的应用乙醛是一种重要的有机化工原料,广泛应用于化工、医药、农药、香料等行业。
1.化工领域:乙醛可以用于生产醋酸、醋酸乙烯、醋酸纤维等化学品。
2.医药领域:乙醛可以用于生产抗生素、维生素等药物。
3.农药领域:乙醛可以用于生产农药中间体,如乙醛肟、乙醛酰胺等。
4.香料领域:乙醛可以用于生产香料,如香草醛、橙花醛等。
五、乙醛的安全与环保1.避免直接接触乙醛,应佩戴防护手套、防护眼镜等个人防护装备。
2.在通风良好的环境中使用乙醛,避免吸入乙醛蒸气。
3.乙醛应储存于阴凉、通风、干燥的地方,远离火源和热源。
乙醛PPT课件(上课用)4

109.每个人皆有连自己都不清楚的 潜在能 力。无 论是谁 ,在千 钧一发 之际, 往往能 轻易解 决从前 认为极 不可能 解决的 事。― ―[戴尔·卡内基 ]
(2)化学性质 (与乙醛相似)
①还原反应
催化剂
R-CHO +H2 △
R-CH2 OH
②氧化反应
燃烧:
CnH2nO+
3
n 2
1
O2
点燃
nCO2+nH2O
催化氧化得羧酸:
催化剂
氧 化
镜2银R-反C应H:OR-+OCH2O△+2A2g(RN-H3C)2OOOH H△
反
R-COONH4+2Ag+3NH3+H2O
现有一化合物A,是由B、C两物质通过上述
物质的反应生成的。试根据A的结构式写出
B、C的结构式?
OH H
A:CH3-C-CH2-C=O
CH3
3、醛基的定量分析
—CHO~2Ag n : 2n
-CHO~2Cu(OH)2~Cu2O n : 2n : n
思考题
1、向乙醛溶液中滴入酸性KMnO4溶液,可观察到的现象是
104.我们最容易不吝惜的是时间, 而我们 应该最 担心的 也是时 间;因 为没有 时间的 话,我 们在世 界上什 么也不 能做。 ――[威 廉·彭]
105.人类的悲剧,就是想延长自己 的寿命 。我们 往往只 憧憬地 平线那 端的神 奇【违 禁词, 被屏蔽 】,而 忘了去 欣赏今 天窗外 正在盛 开的玫 瑰花。 ――[戴 尔·卡内 基]
《乙醛》公开课课件

THANKS
感谢观看
常用催化剂为汞盐,如乙 酸汞等。
反应条件
反应通常在常温常压下进 行,但需注意控制乙炔和 水的比例及反应时间。
乙烯直接氧化法
原理
乙烯在催化剂作用下,与 氧气发生直接氧化反应, 生成乙醛。
催化剂选择
常用催化剂包括钯、铂等 贵金属及其氧化物。
反应条件
反应通常在高温高压下进 行,同时需控制氧气浓度 和反应时间,以避免过度 氧化生成二氧化碳和水。
03
乙醛的制备与合成
乙醇氧化法
01 原理
乙醇在催化剂作用下,与氧气发生氧化反应,生 成乙醛和水。
02 催化剂选择
常用催化剂包括铜、银等金属及其氧化物。
03 反应条件
反应通常在高温高压下进行,以提高反应速率和 产率。
乙炔水化法
01
02
03
原理
乙炔在催化剂作用下,与 水发生加成反应,生成乙 醛。
催化剂选择
乙醛的工业重要性
乙醛是合成乙酸乙酯、乙酸丙酯等酯类的重要原 01 料,这些酯类在涂料、油漆、油墨等领域有广泛
应用。
乙醛可用于生产多聚乙醛,进而合成聚乙烯醇等 02 高分子化合物,这些高分子化合物在纺织、造纸、
皮革等领域有重要作用。
乙醛还可用于合成季戊四醇等多元醇,这些多元 03 醇是生产聚氨酯泡沫塑料等的重要原料。
04
乙醛的反应与应用
乙醛的氧化反应
燃烧反应
乙醛在氧气中完全燃烧,生成二 氧化碳和水。
催化氧化
乙醛在催化剂(如铜)的作用下, 与氧气发生氧化反应,生成乙酸。
银镜反应
乙醛与银氨溶液反应,生成乙酸铵、 银、氨气和水,此反应可用于检验 醛基。
乙醛的还原反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
催化剂
2CH3CHO + O2
△
2CH3COOH
氧化反应:有机物 去氢 或 得氧 的反应
还原反应:有机物加氢 或 失氧 的反应
(2)被弱氧化剂的氧化
①银镜反应
药品: AgNO3 、氨水 、乙醛
步骤: 除试管油污
配银氨溶液
水浴加热
加乙醛
Ag (银镜)
方程式: ①Ag+ + NH3·H2O = AgOH↓ + NH4+
请议一议:
弱氧化剂可将醛基 氧化,强氧化剂是 否可将醛基氧化
③与氧气反应
催化剂
2 CH3CHO +O2
④与酸性高锰酸钾反应
2CH3COOH
CH3CHO +KMnO4 +H2SO4
CH3COOH +K2SO4+MnSO4+H2O
乙醛能使高锰酸钾溶液褪色
练习一
一个学生做乙醛的还原性实验时 ,取1mol/L CuSO4溶液和0.5mol/L NaOH溶液各1ml,在一 支 洁 将 的 试 管 内 混 合 后 , 向 其 中 又 加 入 5ml 40%的乙醛,结果无红色沉淀出现。实验失败 原因可能是( A、C )
C2H4O
H—C—C—H
H
结构简式 CH3CHO
官能团
O
—C—H (醛基)
二、物理性质
无色、有刺激性气味的易挥发,易燃的液体,密度比水小; 与水、乙醇、乙醚、氯仿等互溶。(沸点:20.8℃)
三、化学性质
1、加成反应
催化剂
CH3CHO + H2 △
CH3CH2OH
2、氧化反应
(1)在催化剂作用下,被空气中的氧气氧化为乙酸
易挥发,沸点20.8℃,易燃烧。
2、分子结构:
HO
结构简式
O
HCC H
H
CH3 C H
CH3CHO 甲基+醛基=乙醛
3、乙醛的化学性质
(1)加成反应
O
Ni
CH3 C H +H2 △
OH CH H
去2H 得2H
OH
CH3 C H H
O 氧化反应 得氧失氢 C H 还原反应 均为氧化
反应
(2)氧化反应
O C H [O]
O C OH
①银氨溶液作氧化剂 —— 银镜反应
银氨溶液的配制
在洁净的试管里加1mL2%(质量分数)的硝酸银溶 液,然后一边摇动试管,一边逐渐滴入2%(质量分 数)的稀氨水,直到最初产生的沉淀溶解为止。
Ag++NH3·H2O=AgOH+NH4+
AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O
教学目的
1、了解乙醛的结构特点,熟悉有机物氧化反应和 还原反应的概念。 2、掌握乙醛的加成反应和氧化反应,了解乙醛的 用途 。
教学重点
乙醛的性质
一、乙醛的结构
1、醛的定义:分子里由烃基跟醛基相连而构成的化合物
O
2、醛类通式: R—C—H 饱和一元醛的通式为 CnH2nO
3、乙醛的结构
分子式
结构式
HO
A、未充分加热
B、加入乙醛太少
C、加入NaOH溶液的量不够
D、加入CuSO4溶液的量不够
练习二
已知:柠檬醛的结构为:
O
CH3 C CHCH2CH2C CH C H
CH3
CH3
如何证明存在碳碳双键?
4、乙醛的制备
(1)乙醇氧化法:
2CH3CH2OH+O2
Cu
△
2CH3CHO+2H2O
(2)乙炔水化法:
HC C H +H2O 催化剂 CH3CHO
(3)乙烯氧化法:
2CH2=CH2+O2
催化剂
加热、
2CH3CHO
加压
小结
在有机化学反应里,通常还可以从加氢或去氢 来分析氧化还原反应,即去氢就是氧化反应
氧化 -2H
氧化 +O
醇
醛
羧酸
还原 +H
还原 -O
CnH2n+2O
CnH2n O
CnH2nO2
第三节 乙醛
②AgOH + 2NH3·H2O = [Ag(NH3)2]+ + OH- + 2H2O
③CH3CHO + 2[Ag(NH3)2]+ + 2OH- → CH3COO - + NH4+ + 2Ag↓ + 3NH3 + H2O
注意:
①银氨溶液的配制:往AgNO3溶液中加氨水至沉淀恰好溶解; ②实验成功的条件:A、试管要洁净;B、要用水浴加热;C、 加热时不可振荡试管;D、碱性环境 ③生成银镜可用硝酸处理;
水浴
CH3CHO+2[Ag(NH3)2] OH
CH3COONH4
+2Ag↓+3NH3+H2O
银镜反应该注意的问题:
1、关注反应中试剂加入的先后顺序,可见, 反应在碱性条件下进行。
2、方程式的书写:CH3CH2CHO +A g(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O 3、每摩尔醛基可生成2摩尔银:-CHO~2Ag 4、AgOH不稳定,但可以短暂存在,加入氨 水可溶解。A gCl能否溶于氨水中?为什么? 5、此反应用途:制热水瓶瓶胆(用葡萄糖).
复习乙醇的催化氧化:
Cu
3
一、醛基和醛
: ::
1、醛基
结构式
O CH
O: 电子式 ·C :H
结构简式 CHO 不能写成
2、醛的定义:
COH
分子里由烃基跟醛基相连而构成的化合物。
①通式:R—CHO,官能团为—CHO ②nO ③甲醛由—H和—CHO构成,故上式中n≥1
②被新制的氢氧化铜氧化
氢氧化铜悬浊液的配制
在试管里加入10%(质量分数)的氢氧化钠溶液2mL。 滴入2%(质量分数)硫酸铜溶液4~8滴,振荡。
Cu 2+ +2OH—= Cu(OH)2 ↓
CH3CHO+2Cu(OH)2 △ CH3COOH+Cu2O↓+2H2O
注意:1、关注试剂加入的先后顺序,可见,反应在 碱性条件下进行。 2、 Cu(OH)2必须新制。因新制中存在[Cu(OH)4] 2— 3、每摩尔醛基需2摩尔新制Cu(OH)2
④此反应用于醛基的检验,醛基数目的测定
②被新制的Cu(OH)2氧化 药品: NaOH 、CuSO4、乙醛 步骤:配Cu(OH)2悬浊液
方程式:
加乙醛
加热煮沸
Cu2++2OH - = Cu(OH)2↓△ CH3CHO + 2Cu(OH)2
注意:
CH3COOH + Cu2O↓+ 2H2O
①新制Cu(OH)2悬浊液的配制
判断下列物质是否属于醛?
O
√ √ √ CH3CH2CHO H C H CH3
O
√ CH2 CH CH2 C H
O CH3C CH3
O CH
OCH3
√ CHO
O
O
√ √ H CCH3 CH3C CH2CHO
√O O
H CC H
二、乙醛
1、物性:
没有颜色、具有刺激性气味的液体,
比水轻,能跟水、乙醇等有机溶剂互溶,
②实验成功的条件: 碱性环境以保证悬浊液是Cu(OH)2; 加热 ③此反应也用于醛基的检验和测定
