质粒dna电泳鉴定
质粒DNA的提取与电泳鉴定_百替生物

质粒DNA的提取与电泳鉴定质粒DNA的提取是从事基因工程工作中的一项基本实验技术,但提取方法有很多种,以下介绍一种最常用的方法:碱裂解法:此方法适用于小量质粒DNA的提取,提取的质粒DNA可直接用于酶切、PCR扩增、银染序列分析。
方法如下:1、接1%含质粒的大肠杆菌细胞于2ml LB培养基。
2、37℃振荡培养过夜。
3、取1.5ml菌体于Ep管,以4000rpm离心3min,弃上清液。
4、加0.lml溶液I(1%葡萄糖,50mM/L EDTA pH8.0,25mM/L Tris-HCl pH8.0)充分混合。
5、加入0.2ml溶液II(0.2 mM/L NaOH,1%SDS),轻轻翻转混匀,置于冰浴5 min 。
6、加入0.15m1预冷溶液III(5 mol/L KAc,pH4.8),轻轻翻转混匀,置于冰浴5 min 。
7、以10,000rpm离心20min,取上清液于另一新Ep管8、加入等体积的异戊醇,混匀后于?0℃静置10min。
9、再以10,000rpm离心20min,弃上清。
10、用70%乙醇0.5ml洗涤一次,抽干所有液体。
11、待沉淀干燥后,溶于0.05mlTE缓冲液中煮沸法1、将1.5ml培养液倒入eppendorf管中,4℃下12000g离心30秒。
2、弃上清,将管倒置于卫生纸上几分钟,使液体流尽。
3、将菌体沉淀悬浮于120ml STET溶液中, 涡旋混匀。
4、加入10ml新配制的溶菌酶溶液(10mg/ml), 涡旋振荡3秒钟。
5、将eppendorf管放入沸水浴中,50秒后立即取出。
6、用微量离心机4℃下12000g离心10分钟。
7、用无菌牙签从eppendorf管中去除细菌碎片。
8、取20ml进行电泳检查。
质粒DNA的大量提取和纯化在制作酶谱、测定序列、制备探针等实验中需要高纯度、高浓度的质粒DNA,为此需要大量提取质粒DNA。
大量提取的质粒DNA一般需进一步纯化,常用柱层析法和氯化绝梯度离心法。
质粒dna提取及电泳检测实验报告

质粒dna提取及电泳检测实验报告质粒DNA提取及电泳检测实验报告引言质粒DNA提取及电泳检测是生物学实验中常用的技术手段,用于分离和检测质粒DNA样本中的目标序列。
本实验旨在通过提取质粒DNA并进行电泳检测,验证提取的质粒DNA的纯度和完整性。
材料与方法1. 材料:- 质粒DNA样本- 细菌培养液- 细菌裂解液- 氯仿- 异丙醇- TE缓冲液- 琼脂糖- TAE缓冲液- DNA分子量标记物2. 方法:1. 质粒DNA提取:a. 将细菌培养液中含有质粒DNA的细菌进行离心,收集细菌沉淀。
b. 加入适量的细菌裂解液,裂解细菌细胞,释放质粒DNA。
c. 加入氯仿,离心分离上清液和有机相。
d. 收集上清液,加入异丙醇,使DNA沉淀。
e. 用TE缓冲液溶解DNA,得到质粒DNA提取物。
2. 质粒DNA电泳检测:a. 准备琼脂糖凝胶,加入TAE缓冲液,制备电泳槽。
b. 加载质粒DNA提取物和DNA分子量标记物于琼脂糖凝胶孔中。
c. 连接电源,进行电泳分离。
d. 观察电泳结果,记录质粒DNA的迁移情况和分子量。
结果与讨论通过质粒DNA提取及电泳检测实验,我们成功地提取到质粒DNA,并进行了电泳分离和检测。
在电泳结果中,我们观察到质粒DNA 片段在凝胶中呈现出带状分布,且迁移距离与分子量呈正相关关系。
根据电泳结果,我们可以初步判断质粒DNA的纯度和完整性。
如果质粒DNA在电泳过程中呈现单一的清晰带状分布,且没有明显的附加杂带,说明质粒DNA的纯度较高,没有明显的污染物。
而如果质粒DNA呈现模糊或多条不清晰的带状分布,可能存在其他DNA片段或杂质的污染。
通过电泳结果中质粒DNA片段的迁移距离,我们可以估算出质粒DNA的大致分子量。
通过与DNA分子量标记物的比对,我们可以初步判断质粒DNA的大小和可能的构造。
这对于进一步的研究和应用具有重要意义。
结论通过质粒DNA提取及电泳检测实验,我们成功地提取到质粒DNA,并验证了其纯度和完整性。
质粒dna提取及电泳检测实验报告(一)

质粒dna提取及电泳检测实验报告(一)质粒DNA提取及电泳检测实验报告实验目的•提取质粒DNA并检测其纯度和浓度•进行电泳检测,分析质粒DNA的大小和完整性实验材料•培养基含有质粒DNA的细菌培养物•高纯度DNA提取试剂盒•离心管、移液器、显微镜等常规实验仪器设备实验步骤1.收取 mL培养基含有细菌的培养物样品,放入离心管中。
2.将离心管置于高速离心机中,以12000 rpm离心5分钟,使细菌沉淀于离心管底部。
3.弃掉上清液,轻轻地加入合适的缓冲溶液悬浮沉淀的细菌细胞。
4.加入适量的裂解液使细菌细胞裂解,使质粒DNA释放到溶液中。
5.加入蛋白酶K进行蛋白质降解,使DNA更易提取。
6.加入冷乙醇混合液,沉淀DNA。
7.使用离心机离心,将沉淀的DNA分离出来。
8.用缓冲液洗涤提取的DNA,去除杂质。
9.使用专门的仪器或试剂盒检测提取的质粒DNA的浓度和纯度。
10.备取质粒DNA样品,进行电泳检测。
结果与分析•通过电泳检测,可以观察到质粒DNA的带状图案。
•根据带状图案的迁移距离,可以初步判断质粒DNA的大小。
•如果带状图案清晰且没有模糊的杂带,说明质粒DNA的完整性良好。
•通过测量提取的质粒DNA的浓度和纯度,可以进一步评估实验结果的可靠性。
结论•本实验成功提取并检测了质粒DNA,并通过电泳检测初步分析了其大小和完整性。
•经测量,质粒DNA的浓度和纯度符合实验要求。
•本实验结果可应用于后续实验或研究中,为进一步分析质粒DNA 的功能提供了基础。
实验注意事项•操作过程需严格遵守实验室安全规范,避免接触有毒或有害物质。
•仪器设备使用前需检查并确保正常工作。
•实验室内要保持清洁,避免污染样品。
•测量和记录数据时,要仔细操作,确保准确性和可重复性。
参考文献(如果有的话,请列出相关参考资料)。
质粒DNA的提取纯化与电泳检测

法、羧基磷灰石柱层析法、质粒DNA释放
法、酸酚法等。
1 .碱裂解法提取质粒DNA
1.1原理
共价闭合环状质粒DNA与线性染色体DNA在拓
扑学上的差异来分离它们。
在pH值介于12.0~12.5这个狭窄的范围内,线
性的DNA双螺旋结构解开而被变性,共价闭合
接种含pUC-mT质粒的大肠杆菌到1.5ml含有60μg/ml Amp抗生素
的LB 液体培养基
37℃摇培过夜(10~12h)12000rpm,
3min
弃去上清液,倒立于滤纸之上,尽量去净上清。
加100μl Ⅰ液,涡旋震荡,充分混匀
配制适量的Ⅱ液
加200μl Ⅱ液,迅速轻轻混匀(以颠倒EP管5-10次为宜),
电泳介质相同(电泳液和凝胶):
• 分子在电场中迁移的速度主要取决于
分子本身的大小和形状。
• 形状相似的分子的迁移速度主要与分
子量相关: 分子量越大,移动越慢。
凝胶板
(二)琼脂糖凝胶电泳介绍
琼脂糖:
是一种线性多糖聚合物,从红色海藻产物
琼脂中提取而来。
琼脂糖凝胶:
琼脂糖在水里(或电泳液)中加热到沸点
电泳缓冲液的组成。
5.溴化乙锭染料
Biblioteka EB:溴化乙锭( 3,8-二氨基-5-乙基-6-苯基菲啶溴盐
Ethidium Bromide,EB),EB能插入DNA分子碱基
对之间,导致EB与DNA结合。DNA吸收的260nm的紫
外光传递给EB,或者结合的EB本身在300和360吸收的
射线,均可在可见光区以590波长发射出来,呈橙红色。
离子交换层析法
质粒dna的提取及电泳检测实验报告

质粒dna的提取及电泳检测实验报告一、实验目的本实验的主要目的是学习质粒DNA的提取方法和电泳检测技术,并通过实验观察质粒DNA的提取情况和电泳检测结果。
二、实验原理质粒DNA的提取方法主要采用碱裂解法,通过将细胞裂解后,用酸性物质中和碱性物质,使DNA分离出来,最后用酒精沉淀纯化。
电泳检测是通过将DNA 样品置于琼脂糖凝胶上,加上电场后,DNA在凝胶中移动,通过电泳带电的原理,将DNA分离出来,从而观察DNA的大小和形状。
三、实验步骤1.准备样品:将含有目标DNA的菌落挑出放入EP管中,加入100μl TE缓冲液(10mmol/L Tris-HCl,1.0mmol/L EDTA,pH8.0),用微量移液器均匀混合。
2.制备裂解液:取10μl 0.25mol/L NaOH加入菌液中,轻轻摇匀,并立即加入200μl 1%SDS(十二烷基硫酸钠)液,翻转混匀。
3.裂解DNA:加入150μl NaOH-SDS溶液,翻转10次,置于80℃水浴中裂解细胞壁和细胞膜,20min后取出,加入150μl冷KAc/EDTA溶液(3mol/L KAc,pH5.2,0.5mol/L EDTA),翻转混匀,冰上静置5min。
4.离心沉淀:10000r/min离心10min,将上清液移至新的96孔板中,加入0.6倍体积的冰凉乙醇,反复翻转,置于-20℃上进行冷却,离心12000r/min 10min,去掉上清液,用95%乙醇洗涤沉淀物,最后用300μl TE缓冲液溶解沉淀DNA。
5.电泳检测:取相同浓度的DNA样品,加入琼脂糖,混合后加入电泳槽中,通电检测10min。
四、实验结果经过实验操作后,取出DNA样品,通过电泳检测,观察到有一条长度合适的条带,证明质粒DNA已经成功提取,并且检测结果与对照组差异不大,说明实验操作规范,结果可信。
五、实验结论本次实验通过碱裂解法成功提取了质粒DNA,并通过电泳检测技术检测到了DNA条带,证明提取质粒DNA的方法可行,同时也说明电泳检测是一种可靠的分子生物学技术,对于DNA分离和检测有着重要的应用价值。
实验二 质粒DNA电泳鉴定 - 武汉大学药学院

实验仪器
微波炉
——溶胶用
凝胶电泳仪 及电泳槽
凝胶成像 系统
实验准备工作
配制TAE电泳缓冲液(50储存液,pH约8.5: Tris碱 242g,57.1ml冰乙酸,37.2g Na2EDTA.2H2O,dd water 定容至1L) 1000溴化乙锭储存液(0.5mg/ml:50mg溴化 乙锭溶于100mL dd water,4C避光储存) 10加样缓冲液(20% Ficoll 400,0.1mol/L Na2EDTA pH8.0,1.0% SDS,0.25%溴酚 蓝); 1.5ml离心管、移液器吸头灭菌。
思 考
影响本实验结果的因素有哪些? 画出电泳图谱,分析观察到的结果。
生物技术制药实验
实验二 质粒DNA电泳鉴定
主讲教师:刘永梅 刘永平
武汉大学药学院实验教学中心 生物技术实验室
实验目的
掌握琼脂糖凝胶电泳分离DNA的原理; 学习琼脂糖凝胶电泳的操作方法
实验原理及背景知识简介
电泳是分离和纯化DNA片段的最常用技术。如DNA制备、浓度测定、目的 DNA片段分离,重组子的酶切鉴定等均需要电泳完成。 根据分离的DNA大小及类型的不同,DNA电泳主要分两类: 聚丙烯酰胺凝胶电泳 适合分离1kb以下的片段,最高分辨率可达1bp,也用 于分离寡核苷酸,在引物的纯化中也常用此中凝胶进行纯化,也称PAGE纯 化。 琼脂糖凝胶电泳 可分离的DNA片段大小因胶浓度的不同而异,胶浓度为 0.5~0.6%的凝胶可以分离的DNA片段范围为20bp~50kb。电泳结果用 溴化乙锭(EB)染色后可直接在紫外下观察,并且可观察的DNA条带浓度 为纳克级,而且整个过程一般1小时即可完成。由于该方法操作的简便和快 速,在基因工程中较常用。
质粒DNA电泳鉴定

一 实验原理
DNA 双螺旋分子骨架两侧带有含负 电荷的磷酸根,在电场中会向正极 方向移动。不同长度的 DNA由于受 到凝胶介质的阻力不同,表现为不 同的迁移率而被分开。
二 实验试剂
pGEX-6p, TAE电泳缓冲液, 1000溴化乙锭储存液,电泳级琼脂糖 粉,10加样缓冲液(或6加样缓冲 液), DNA分子量标准(DNA HindIII: 23130, 9420,6560,4360,2320,2030,560, 130 bp)。
四 操作步骤
4 把梳子插到凝胶灌制模具的正确位置后缓 缓倒入胶溶液。胶溶液倒至与模具的矮边缘 相平即可,不要把胶溶液溢到外面。在桌面 上静置10-20分钟待胶完全凝固。(剩下的胶 溶液封口后留待以后再熔化使用)。 5 在水平电泳槽中加满1TAE电泳缓冲液。 根据电泳槽的长度把电泳仪的电压调至 170V(10V/cm),注意正负电极的位置连接正 确。
四 取0.5g琼脂糖粉,放入三角瓶,加入50ml TAE电泳缓冲液(1),放入微波炉中烧开 (1min)。50ml 正好倒两块小胶。 2 注意观察烧瓶中的琼脂糖粉末,待完全熔 化后停止微波炉(切不可让胶溶液溢出到微 波炉中!)。 3 戴上线手套,从微波炉中取出三角瓶,置 桌面上冷却致不烫手(约50-60C)。
四 操作步骤
10 当蓝色的溴酚蓝迁移到距凝胶边缘1cm时, 关闭电源。取出模具和凝胶。 11 把凝胶小心反扣放入盛有EB的搪瓷盒中。 放置约10分钟后,取出用自来冲洗两次。
12 清理垃圾。染有EB的凝胶要放到专用的垃 圾袋中作专门处理,以免污染环境。 13撰写实验报告。
五 思考题
质粒DNA提取,电泳鉴定

试剂中的主要成分和作用
重悬细菌
GTE缓冲液: Tris-HCl溶液:调节pH。 葡萄糖:使悬浮后的大肠杆菌不会快速沉积到管
子底部。 EDTA:二价金属离子螯合剂,抑制DNase活性。
变性
NaOH-SDS溶液: NaOH:溶解细胞,破坏核酸碱基配对使氢键断裂
从而让核酸变性。 SDS:裂解细胞,结合蛋白质,形成SDS-蛋白质
定要充分混匀!
6. 4℃,12000rpm离心5min,取上清300ul 转移 的EP管中。
至另一支新
7. 加180ul异丙醇,冰浴20min,12000rpm离心5min,弃上清液。
8. 缓慢加入70%乙醇0.5ml,轻轻上下颠倒, 12000rpm离心 1min,吸弃大部分上清,挥干剩余乙醇。
agrose gel电泳是分离鉴定和纯化DNA分子的常用方法,不同浓 度的琼脂糖胶可分离100bp-60kb的DNA片段,在琼脂糖电泳中, DNA迁移的速率不仅与其分子量的对数值成反比,即分子量越大, 移动速率越慢,而且还与分子构型有关如质粒开环DNA<线性DNA< 共价闭合环状DNA。
预期实验结果
RNase溶液:水解上清中小分子RNA。 异丙醇:快速沉淀质粒DNA,但难以挥发。 70%乙醇:去除异丙醇,且易于挥发除去。 TE缓冲液:溶解质粒DNA沉淀,含有EDTA能
够使DNA保存时间更长。
琼脂糖凝胶电泳
溴化乙锭(EB)能够嵌入 到DNA分子的碱基对中形成荧 光复合物,在紫外线激发下发 射荧光
基本原理
当菌体在NaOH-SDS溶液中裂解时,蛋白质与 DNA会发生变性。加入中和液(乙酸钾)后, 质粒DNA分子能够迅速复性,呈溶解状态,离 心时留在上清中;而染色体DNA、大分子RNA 以及蛋白质-SDS复合物等形成沉淀,可通过离 心去除。
质粒DNA的提取与电泳检测

2008
分 子实 生验
物 学
2。质粒DNA的提取:
已经提出过许多方法用于从细菌中提纯质粒 DNA, 这些方法都含有以下3个步骤:
◆ 细菌培养物的生长。 ◆ 细菌的收获和裂解 ◆ 质粒DNA的纯化。
2008
分 子实 生验
物 学
三. 仪器和试剂
试剂:
1、质粒快速提取试剂盒
溶液1(SET缓冲液)、溶液2(Lysis Buffer)、溶液3(3M NaAc,Ph4.8)、结合缓冲 液、漂洗液、洗脱缓冲液、吸附柱、废液收集 管
2008
分 子实 生验
物 学
(5)向吸附柱加入700ul漂洗液, 12000rpm离心 30秒。倒掉废液,装回吸附柱。
(6)重复(5),再次12000rpm离心2分钟以完全 去除漂洗液。
(7)回收质粒:将吸附柱移到一个新的1.5ml eppendorf管中,向吸附膜中央加入50ul 洗脱 缓冲液(水浴预热至70度),溶解提取物,室 温放置2分钟,12000rpm离心2分钟.
(8)琼脂糖凝胶电泳检测提取结果.
2008
分 子实 生验
物 学
五、试验结果 六、结果分析
2008
分 子实 生验
物 学
一. 实验目的
1.通过质粒DNA的提取和检测,掌握提取 质粒的方法以及用凝胶电泳分离鉴定质 粒DNA的方法。
2008
分 子实 生验
物 学
二. 实验原理
1.质粒概述:
质粒是染色体外能够进行自主复制的遗传单 位,现在习惯上用来专指细菌、酵母菌和放线 菌等生物中染色体以外的DNA分子。在基因工程 中质粒常被用做基因的载体。
(3)裂解:加入100ul溶液1(用完后4度保存),充分吹打 混匀后, 加入150ul溶液2(用完立即拧紧瓶盖),温和颠 倒5-10次,零下20度放置3分钟.加入150ul溶液3,温和颠倒 5-10次,放置5分钟. 12000rpm离心5分钟
质粒DNA提取+电泳+质粒酶切实验报告

实验一:质粒DNA提取+琼脂糖凝胶电泳*实验目的:1.掌握质粒DNA提取的基本原理和方法2.掌握琼脂糖凝胶电泳检测DNA的方法*实验原理:1.DNA提取原理1)DNA提取要求:①保证DNA一级结构的完整性;②排除其他分子的污染,使其纯度尽可能提高。
2)DNA样品来源:①培养细胞;②组织样本;③血液样本。
3)主要试剂和材料及仪器:试剂和材料:RNA酶A、细胞悬浮液(Buffer P1)、细菌裂解液(Buffer P2)、中和液(Buffer P3)、漂洗液PW1、漂洗液PW2、洗脱液、质粒DNA吸附柱、滤液收集管仪器:微量移液器、台式微量高速离心机、电泳仪、水平电泳槽、紫外透射仪或凝胶成像系统。
2.电泳原理:1)概念:电泳是指带电粒子在电场中向电势降低的方向移动的现象,移动速度与粒子大小及所带电荷多少有关。
在一定pH条件下,核酸及蛋白质等生物分子呈带电状态,可以进行电泳分析。
2)迁移方向:DNA由负极向正极迁移3)影响目标物迁移速率的因素:分子大小、构象、凝胶浓度、琼脂糖种类、电泳缓冲液、嵌入染料的存在和使用电压等。
4)荧光强度(得率):荧光的强度是同DNA片段的大小或数量成正比的。
5)琼脂糖凝胶电泳原理:(1)关于电泳技术:电泳常用于分离和纯化那些分子大小电荷性状或分个构象有所不同的生物大分子一尤其是蛋白质和核酸。
正因为如此,电泳已成为生物化学和分子生物学中应用最为广泛的技术之一,其中在分子生物学实验中最为常用的是琼脂糖凝胶电泳。
琼脂糖是一种海藻多糖,琼脂糖胶分离范围很大,但其分辨率却相对较低。
通过改变琼脂糖凝胶的浓度,应用标准的电泳技术可以分离200到50,000 bp大小的DNA片断。
一般琼脂糖胶浓度在0.5%到4%之间,琼脂糖凝胶浓度越大,凝胶就越硬。
较高浓度的琼脂糖胶有利于较小的DNA片断分离,而较低浓度的琼脂糖胶则可以分离较大的DNA片断。
(2)琼脂糖凝胶电泳条带的观察:通过观察示踪染料的迁移距离可以判断DNA的迁移距离。
质粒DNA酶切后电泳鉴定..ppt

H2O
Taq酶
1 l 0.5 l 0.5 l 0.5 l 2.5 l 1.5 l 18.2 l
0.3l
反应条件:
94℃预变性4min →90 ℃变性45s →60℃退火50s → 72 ℃ 延伸60s
∣_______________↑ 25 cycles
→72 ℃再延伸10min 4 ℃保存
PCR & 质粒DNA酶切后电泳鉴定
目的要求
掌握PCR的原理和操作步骤 熟悉限制性核酸内切酶 掌握DNA琼脂糖凝胶电泳操作方法
实验原理
PCR 原理 反应体系:模板、dNTP、引物、DNA聚合 酶、Mg2+ 反应条件:变性、退火、延伸
限制性内切酶 一类能够识别和切割DNA分子中特定碱基 序列的核酸水解酶。
限制性酶切位点:能够被限制性内切酶特 异识别、结合并切断的一段DNA序列。
DNA琼脂糖凝胶电泳
琼脂糖凝胶电泳是DNA分离、纯化、鉴定常用的 方法。在pH8.0的缓冲液中,核酸带负电荷,在 电场中向正极移动,按照分子的大小和构象不同 进行分离。
操作步骤
一、PCR扩增 反应体系:模板
dNTP 上游引物 下游引物 10×buffer
二、限制性内切酶酶切 酶切体系: 10×buffer
质粒DNA
ddH2O xholⅠ EcoRⅠ 混匀,37℃水浴1h
2l 4l 12l 1l 1l
三、电泳 1.制胶 2.点样 3.通电 4.溴乙锭(EB)染色 5.观察结果
质粒DNA酶切及琼脂糖电泳分析鉴定
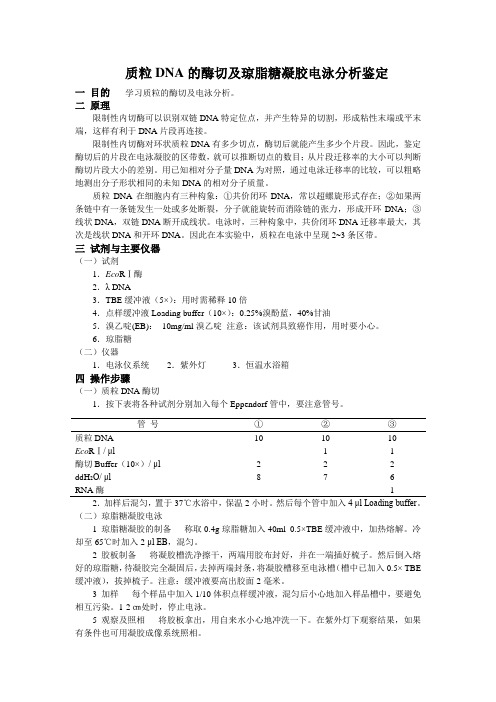
质粒DNA的酶切及琼脂糖凝胶电泳分析鉴定一目的学习质粒的酶切及电泳分析。
二原理限制性内切酶可以识别双链DNA特定位点,并产生特异的切割,形成粘性末端或平末端,这样有利于DNA片段再连接。
限制性内切酶对环状质粒DNA有多少切点,酶切后就能产生多少个片段。
因此,鉴定酶切后的片段在电泳凝胶的区带数,就可以推断切点的数目;从片段迁移率的大小可以判断酶切片段大小的差别。
用已知相对分子量DNA为对照,通过电泳迁移率的比较,可以粗略地测出分子形状相同的未知DNA的相对分子质量。
质粒DNA在细胞内有三种构象:①共价闭环DNA,常以超螺旋形式存在;②如果两条链中有一条链发生一处或多处断裂,分子就能旋转而消除链的张力,形成开环DNA;③线状DNA,双链DNA断开成线状。
电泳时,三种构象中,共价闭环DNA迁移率最大,其次是线状DNA和开环DNA。
因此在本实验中,质粒在电泳中呈现2~3条区带。
三试剂与主要仪器(一)试剂1.Eco RⅠ酶2.λ DNA3.TBE缓冲液(5×):用时需稀释10倍4.点样缓冲液Loading buffer(10×):0.25%溴酚蓝,40%甘油5.溴乙啶(EB):10mg/ml溴乙啶注意:该试剂具致癌作用,用时要小心。
6.琼脂糖(二)仪器1.电泳仪系统2.紫外灯3.恒温水浴箱四操作步骤(一)质粒DNA酶切1.按下表将各种试剂分别加入每个Eppendorf管中,要注意管号。
管号①②③质粒DNA 10 10 10Eco RⅠ/ μl 1 1酶切Buffer(10×)/ μl 2 2 2ddH2O/ μl8 7 6RNA酶 1 2.加样后混匀,置于37℃水浴中,保温2小时。
然后每个管中加入4 μl Loading buffer。
(二)琼脂糖凝胶电泳1 琼脂糖凝胶的制备称取0.4g琼脂糖加入40ml 0.5×TBE缓冲液中,加热熔解。
冷却至65℃时加入2μl EB,混匀。
质粒DNA的酶切和琼脂糖凝胶电泳鉴定

质粒DNA的酶切和琼脂糖凝胶电泳鉴定[实验原理]限制性内切酶识别短的DNA序列并在识别序列内或旁侧特异性切割双链DNA。
对环状DNA有多少切口,就能产生多少个酶解片段,因此鉴定酶切后的片段在电泳凝胶中的区带数,就可以推断酶切口的数目,从片段的迁移率可以大致判断酶切片段大小的差别。
DNA分子在琼脂糖凝胶中泳动时有电荷效应和分子筛效应。
DNA分子在高于等电点的pH溶液中带负电荷,在电场中向正极移动。
由于糖—磷酸骨架在结构上的重复性质,相同数量的双链DNA几乎具有等量的净电荷,因此它们能以同样的速度向正极方向移动。
在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应,即DNA分子本身的大小和构型。
具有不同的相对分子质量的DNA片段泳动速度不一样,可进行分离。
DNA分子的迁移速度与相对分子质量的对数值成反比关系。
凝胶电泳不仅可分离不同相对分子质量的DNA,也可以分离相对分子质量相同,但构型不同的DNA分子。
如上次实验提取的质粒,有3种构型:超螺旋的共价闭合环状质粒DNA(covalently closed circular DNA,简称CCCDNA),开环质粒DNA,即共价闭合环状质粒DNA 1条链断裂,(open circular DNA,简称OCDNA),线状质粒DNA,即共价闭合环状质粒DNA 2条链发生断裂(linear DNA,简称L DNA)。
这3种构型的质粒DNA分子在凝胶电泳中的迁移率不同。
因此电泳后呈3条带,超螺旋质粒DNA泳动最快,其次为线状DNA,最慢的为开环质粒DNA。
[仪器、材料与试剂](一)仪器与材料恒温水浴槽、电泳仪、电泳槽、紫外线透射仪、移液枪、质粒、HindI II酶、EcoRI酶(二) 试剂1 000 mL 5xTBE:Tris 54 g硼酸27.5 g 0.5 mol/L EDTA 20 mL(pH 8.0)凝胶加样缓冲液(6x):溴酚蓝0.25%蔗糖40%琼脂糖溴化乙锭溶液(EB) 0.5ug/mL[实验步骤](一) 酶切取5uLDNA溶液,加1uL酶切缓冲液,EcoRI酶1uL(2U),无菌水补至总体积10uL,37保温3h,加凝胶上样缓冲液(6X)2uL,准备下个实验进行电泳,分析质粒DNA的限制性酶切图谱。
基因工程实验2:质粒DNA的酶切及电泳鉴定

• 星号活力*
二、实验原理——琼脂糖凝胶电泳
• 1、琼脂糖凝胶
• 琼脂糖加热溶解后冷却,形成孔径结构,成为良好的电泳 介质。其孔径大小由琼脂糖的浓度决定。
• 浓度越高,孔隙越小,其分辨能力也就越强; • 琼脂糖凝胶分辨DNA片段的范围为0.2 kb~50 kb之间,常 用0.3%~2%浓度的琼脂糖凝胶,可分辨300 bp~5000 bp 的DNA片段。 • 低熔点(LMP)琼脂糖,熔点为62℃~65℃的琼脂衍生物, 一旦熔解,可在37℃下持续保持液体状态达数小时之久, 在25℃下也可持续保持液体状态约10分钟。LMP琼脂糖 可用来回收DNA分子,用于DNA片段的制备电泳。
四、实验步骤
• 1、质粒DNA的酶解(单酶切)
EcoR I 酶切位点:G’ AATTC
2、琼脂糖凝胶电泳
1、 0.8%琼脂糖凝胶的制备:称取0.16 g琼脂糖,置于锥形 瓶中,加入20 mL 0.5*TBE稀释液。(一个制胶板的量) 加热直至琼脂糖溶解。摇匀,冷却至60℃(不烫手),加 入溴化乙锭1μL (终浓度0.5 μg/mL)充分摇匀。 2、胶板的制备: 取有机玻璃内槽,洗净(注意保护电极丝)、晾干。 将有机玻璃内槽置于一水平位置,插好梳子。 将冷却至60℃左右的琼脂糖凝胶液,小心地倒在有机玻璃 内槽上,注意排气泡,使整个有机玻璃板表面形成均匀的胶 层。室温下静置,待凝固完全后,轻轻垂直拔出梳子。 用滴管将样品槽内注满TBE稀释液以防止干裂。制备好胶 板后将铺胶的有机玻璃内槽放在电泳槽中使用。 3、加样(见下表)
•(5)电泳缓冲液 •目前有3种缓冲液适用于天然双链DNA的电泳:TAE、TBE和 TPE •(6)EB
三、实验材料
• 1、仪器和材料 • 电泳仪,电泳槽,制胶板,锥形瓶(100 mL或 50 mL),紫外检测仪/凝胶成像系统,一次性 手套,Ep管,取液器及无菌吸头,水浴锅 • 2、试剂 • (1) 质粒pMD18-T DNA • (2) DL2000 Plus • (3) EcoRI酶 (EcoRI酶解反应缓冲液10×) • (4) 琼脂糖 • (5) 溴乙锭(10 mg/mL贮藏液) • (6) TBE缓冲液(0.5×) • (7) 酶反应终止液(10×)
质粒DNA凝胶电泳后识别和条带分析

质粒DNA凝胶电泳后识别和条带分析:超螺旋、切开的、环状结构的DNA当分离质粒DNA并在琼脂糖凝胶上电泳时,可以观察到2,3或甚至4个或更多条带。
这里包含了四种最常见的质粒DNA形式:最好的结果是大部分分离的DNA都是超螺旋DNA,但其他形式也可以出现。
这些形式如何出现在琼脂糖凝胶上(就相对迁移速度而言)如下图所示。
介绍一下每种形式的由来:1. 超螺旋质粒Supercoiled Plasmid超螺旋DNA是在体内发现的天然确认,并且当将额外的扭曲引入双螺旋链时发生。
人们经常将DNA的形式与橡皮筋或电话线进行比较,如果过度扭动橡皮筋或电话线,线圈会相互堆叠,引起紧张。
在质粒制备的情况下,由于质粒的末端连接在一起,因此不能缓解这种超螺旋张力。
由于其构象,超螺旋DNA的迁移速度比琼脂糖凝胶中预测的要快。
当分离质粒DNA时,超螺旋DNA 是所需的物种。
天然细菌中是以超螺旋形式存在的,而在提取过程中会由于断裂而形成开环和线性结构,因为这样它的分子两端可以自由转动而使分子内的紧张状态完全松弛,而断裂过程则是随机的DNA超螺旋结构(补充知识):双螺旋是DNA的二级结构,如果把双螺旋DNA看作一根绳子,再将其进一步扭曲,就称为超螺旋,即螺旋上的螺旋。
超螺旋就是DNA的三级结构,具体情况取决于二级结构。
绝大多数原核生物的DNA,不管是细菌还是古菌都是共价封闭环(covalently-closed circle,cccDNA)的形式存在。
这种双螺旋环状分子再度螺旋化,即成为超螺旋结构(supercoil)。
对于真核生物来说,虽然DNA多为线形分子,但在生理状态下DNA与蛋白质(如组蛋白)结合或相互作用的时候,特别在与骨架蛋白的结合点之间的DNA形成一个环结构,类似于cccDNA,同样也能形成超螺旋结构。
2. 带缺口的松弛环状质粒Nicked, Relaxed Circular Plasmid以超螺旋形式存在的DNA很难通过复制机制获得,所以在复制过程中,细胞拓扑异构酶会切割DNA螺旋的一条链,并释放超螺旋张力,从而使聚合酶能够接近DNA。
质粒dna的提取与鉴定实验报告

质粒dna的提取与鉴定实验报告一、实验目的本实验旨在了解质粒DNA的提取方法、鉴定方法及其应用,并掌握相应的实验操作技能。
二、实验原理质粒DNA是细胞内存在于细胞质中的一种环状双链DNA,通常具有自主复制和自主转录等特性。
提取质粒DNA主要采用碱裂解法,即通过加入碱性物质使细胞膜溶解,从而释放出细胞内的质粒DNA。
鉴定质粒DNA则需要使用凝胶电泳法,即将提取出的质粒DNA样品经过电泳分离,从而观察到不同大小和形态的质粒DNA带。
三、实验材料和设备1. 大肠杆菌菌株;2. 质粒抽提试剂盒;3. 1%琼脂糖凝胶;4. TAE缓冲液;5. DNA分子量标记物;6. UV透射仪;7. 手套、口罩等个人防护用品。
四、实验步骤1. 大肠杆菌培养:将大肠杆菌菌株接种于LB培养基中,在37℃下静置培养至菌液浑浊;2. 质粒DNA提取:按照试剂盒说明书进行操作,将培养好的大肠杆菌菌株经过离心分离出细胞沉淀,加入裂解缓冲液后进行碱裂解,最后使用洗涤缓冲液洗涤并提取质粒DNA;3. 凝胶电泳:将凝胶放置于电泳槽中,加入TAE缓冲液,将提取好的质粒DNA样品和分子量标记物混合后均匀加入凝胶孔中,进行电泳分离;4. 质粒DNA鉴定:在UV透射仪下观察凝胶板上的DNA带,并根据分子量标记物判断质粒DNA的大小。
五、实验结果通过实验我们成功地提取出了大肠杆菌中的质粒DNA,并通过凝胶电泳观察到了不同大小和形态的质粒DNA带。
根据分子量标记物我们可以初步估计出这些质粒DNA的大小范围。
六、实验总结本次实验掌握了质粒DNA的提取和鉴定方法,并成功地进行了实验操作。
同时也发现了实验中可能存在的问题和改进的空间,例如在质粒DNA提取过程中需要注意细胞沉淀的清洗和干燥等细节问题。
通过本次实验,我们对质粒DNA的应用和相关技术有了更深入的了解。
琼脂糖凝胶电泳检测质粒dna的原理

琼脂糖凝胶电泳检测质粒dna的原理
1.凝胶的制备:首先,需要制备琼脂糖凝胶。
琼脂糖是一种复合多糖,可以形成凝胶状的基质,用于分离DNA分子。
通常使用琼脂糖粉末加热溶
解在缓冲液中,然后在模具中凝固,形成凝胶板。
2.凝胶孔径选择:根据分析的DNA分子大小范围,选择凝胶孔径。
较
大的孔径适合分离较大的DNA片段,而较小的孔径适合分离较小的DNA片段。
3.样品预处理:将待检测的质粒DNA样品与DNA加载缓冲液混合,加
热处理使DNA样品变为单链结构,并添加胶载剂,以增加样品在凝胶中的
密度。
4.样品加载:将预处理的样品加载到凝胶的孔中。
通过电极引导,电
场会使DNA从阴极向阳极迁移。
5.电场应用:在凝胶板上施加电场,电场的方向是从阴极向阳极。
DNA负电荷使其朝阳极方向移动,在凝胶中形成DNA迁移带。
6.可视化:当DNA迁移到凝胶中一定距离时,可以通过染色剂(如溴
化乙锭)进一步可视化DNA条带。
溴化乙锭在UV光下发出荧光,使DNA
条带可看见。
7.电泳时间控制:电泳时间是控制DNA迁移的重要参数。
较长电泳时
间可以让DNA片段分离得更好,但也可能导致DNA过度迁移。
8.分析和测量:根据DNA迁移的距离和标准DNA片段的迁移距离,可
以确定每个条带对应的DNA片段大小。
质粒dna浓度和纯度测定的方法

质粒dna浓度和纯度测定的方法
质粒DNA浓度和纯度测定的方法主要有以下两种:
1.紫外分光光度计法:这种方法是通过测量DNA在260nm和280nm处的吸光度来测
定DNA的浓度和纯度。
在260nm处的吸光度反映了DNA的总量,而在280nm处
的吸光度反映了蛋白质的含量。
因此,可以通过比较这两个波长的吸光度来计算
DNA的浓度和纯度。
具体来说,OD260/OD280的比值应在1.7-1.9之间,偏低可能
是蛋白质污染,偏高则可能是DNA降解或RNA污染。
2.凝胶电泳法:这种方法是通过凝胶电泳来检测DNA的含量和纯度。
首先,取一定
量的DNA溶解液与适量的溴化乙锭混合,溴化乙锭可以迅速嵌入DNA双螺旋结构
中,嵌入的溴化乙锭受紫外光激发而发出荧光。
然后,将混合液通过凝胶电泳分离,
由于DNA分子的大小不同,它们在电场中的迁移率也不同,因此可以通过比较样
品与标准品的荧光强度来对样品中的DNA进行定量。
以上信息仅供参考,建议咨询专业人士获取更准确的信息。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四 操作步骤
4 把梳子插到凝胶灌制模具的正确位置后缓 缓倒入胶溶液。胶溶液倒至与模具的矮边缘 相平即可,不要把胶溶液溢到外面。在桌面 上静置10-20分钟待胶完全凝固。(剩下的胶 溶液封口后留待以后再熔化使用)。 5 在水平电泳槽中加满1TAE电泳缓冲液。 根据电泳槽的长度把电泳仪的电压调至 170V(10V/cm),注意正负电极的位置连接正 确。
三 实验准备
配制TAE电泳缓冲液(50储存液,pH约8.5: Tris碱 242g,57.1ml冰乙酸,37.2g Na2EDTA.2H2O,dd water 定容至1L), 1000溴化乙锭储存液(0.5mg/ml:50mg溴化 乙锭溶于100mL dd water,4C避光储存), 10加样缓冲液(20% Ficoll 400,0.1mol/L Na2EDTA pH8.0,1.0% SDS,0.25%溴酚蓝); 6加样缓冲液(0.25%溴酚蓝,40%蔗糖水溶 液);1.5ml离心管装入铝制饭盒(灭菌)、 移液器吸头装入相应的吸头盒(灭菌)。
实验二 质粒DNA电泳鉴定
一 实验原理
DNA 双螺旋分子骨架两侧带有含负 电荷的磷酸根,在电场中会向正极 方向移动。不同长度的 DNA由于受 到凝胶介质的阻力不同,表现为不 同的迁移率而被分开。
二 实验试剂
pGEX-6p, TAE电泳缓冲液, 1000溴化乙锭储存液,电泳级琼脂糖 粉,10加样缓冲液(或6加样缓冲 液), DNA分子量标准(DNA HindIII: 23130, 9420,6560,4360,2320,2030,560, 130 bp)。
四 作步骤
1 称取0.5g琼脂糖粉,放入三角瓶,加入50ml TAE电泳缓冲液(1),放入微波炉中烧开 (1min)。50ml 正好倒两块小胶。 2 注意观察烧瓶中的琼脂糖粉末,待完全熔 化后停止微波炉(切不可让胶溶液溢出到微 波炉中!)。 3 戴上线手套,从微波炉中取出三角瓶,置 桌面上冷却致不烫手(约50-60C)。
四 操作步骤
8 在凝胶上选择相邻的加样孔。用10l的吸液头分别 将管中的样品加入凝胶的加样孔中(如果需要时, 在相邻的加样孔中加入1.5-3l DNA分子量标准物)。 加样时持移液器的手以肘部固定在桌上,用另一只 手扶住这只手的手腕,以减少移液器的抖动。看到 蓝色的样品吸管尖头伸进加样孔后(不能伸得太深, 以免穿破凝胶的底部)缓缓将蓝色的样品压入加样 孔中。切不可使蓝色样品流到孔外。 9 打开电源开关,样品将形成一条蓝色的横带向前移 动(如果发现蓝色向后移动,立即关闭电源,调换 电极)。电泳将进行约30min。
四 操作步骤
6 待胶完全凝固后(15-20分钟),小心拔出 梳子。用手指捏住模具两侧的高边缘取出模 具和凝胶放入电泳槽中间的平台上,凝胶要 没入电泳液中。凝胶上有样品孔的一侧要朝 向电泳槽的负极。 7 剪1片光面纸(或封口膜),点6l蒸馏水、 1l 10加样缓冲液,再加入3l质粒DNA溶 液制成10l DNA样品。
四 操作步骤
10 当蓝色的溴酚蓝迁移到距凝胶边缘1cm时, 关闭电源。取出模具和凝胶。 11 把凝胶小心反扣放入盛有EB的搪瓷盒中。 放置约10分钟后,取出用自来冲洗两次。
12 清理垃圾。染有EB的凝胶要放到专用的垃 圾袋中作专门处理,以免污染环境。 13撰写实验报告。
五 思考题
1 泳道中的质粒DNA有几条带?为什么? 2 影响本实验结果的因素有哪些?
