关于常见的弱电解质课件
合集下载
弱电解质的电离强弱电解质课件人教版高中化学选修四

• (高考广东)下列说法正确的是 ( )
BD
• (A)硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
• (B)蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
• (C)Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
• (D)天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能 源
(其离子无 分子化倾向)。包括大多数盐类、 强酸、强碱。
弱电解质:部分电离成离子的电解质
(其离子有分子化倾向)包括弱酸(如HAc、 H2S)、弱碱(如NH3·H2O)、水。
下列电解质哪些是强电解质? 哪些是弱电解质呢?
H2SO4 NaOH
NaCl
NH3·H2O CH3COOH
a. Na b. Br2 c.CaO d.Al2O3
•
5.文本解读本文是一篇论述生物社会 行为的 文章。 作者选 取了独 特的视 角,将 一些群 居性生 物的行 为与人 类进行 比较, 描述了 它们在 集体行 动中所 表现出 的高度 组织性 、协调 性.
•
6.以及作为群体出现时所表现的巨大 力量和 智慧, 从而得 出这样 的结论 :人类 的社会 行为与 生物的 社会行 为有极 大的共 性,并 非水火 不容, 而是可 以互为 比照的 。
e. SO3 f. H2S g. H2SO4 h. HCl
i. HClO
j. HF
k. Ba(OH)2
l. NH3•H2O m. NaCl n. BaSO4
o. H2O
p. C2H5OH
(1) 属于电解质的有 c d f g h i j k l m n o (2) 属于非电解质的有 e p (3) 属于强电解质的有 c d g h k m n (4) 属于弱电解质的有
18常见的弱电解质

在常温下,0.1mol/L的盐酸溶液中C(H+ ) 和C(OH-)是多少?
水电离出的C(H+)和C(OH-)是多少?
水电离出的C(OH-)=1×10-14/0.1=1×10-13mol/L
=水电离出的C(H+)
在常温下, 0.1mol/L的NaOH溶液中水电离 出的C(H+)和C(OH-)是多少?
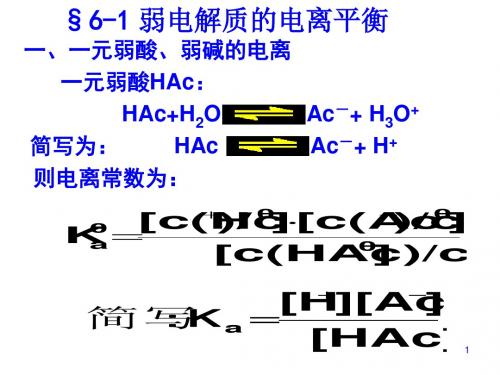
一、水的电离 1、水是一种极弱的电解质,能微弱的电离:
+ +
H2O+H2O ( H2O
H3O++OH- H++OH-)
c(H+) · c(OH-)
电离常数:K电离=
纯水和稀溶液中水的浓度可视为定值 所以c(H+) · c(OH-)=K电离· c(H2O)为一个新的常数。 精确实验表明: 25℃时,纯水中:c(H+)=c(OH-)=1×10-7 mol/L。
1. 0.2mol/L醋酸溶液中c(H+)=a,0.1mol/L醋酸 溶液中c(H+)=b,a= 2b吗?
2. 请从平衡移动的角度分析以下反应的微观过程: Fe+2CH3COOH = ( CH3COO)2Fe + H2↑ Fe+2CH3COOH = 2CH3COO-+Fe2++ H2↑
3.一定温度下cmol/L弱酸HX的溶液(电离常数 为Ka, Ka <10-4),估求H+浓度、HX的电离度。
结论:多元弱酸的酸性由第一步电离决定。
【课堂练习】
写出H3PO4在水溶液中的电离方程式。 【思考】在磷酸溶液中存在哪些微粒?
H3PO4
H2PO4 HPO 24
Hale Waihona Puke H+ +H2PO4 一(1) + 2 H + HPO 一(2)
强电解质和弱电解质 课件(共16张PPT)高中化学 人教版(2019)选择性必修1

电离方程的书写
②、弱电解质 “ ⇌ ”连接,注意多元
一元弱酸、一元弱碱 (一步电离)
CH3COOH: NH3·H2O:
CH3COOH NH3·H2O
CH3COO− + H+ NH+4 + OH−
多元弱酸 (分步电离、分步书写) H2CO3: H2CO3
H+
+
HCO
3
-
HCO 3
多元弱碱 (分步电离、一步书写) Fe(OH)3: Fe(OH)3
勒夏特列原理
电离平衡的移动
影响因素:温度、微粒浓度
移动原理:勒夏特列原理
①、温度
CH3COOH
CH3COO− + H+ ΔH>0
移动方向 溶液PH
温度升高
正移 降低
温度降低
逆移 增大
结论 电离过程均为吸热
“越热越电离”
电离平衡的移动
②、浓度
CH3COOH
CH3COO-+H+ 平衡体系回答问题
改变条件 加水稀释 滴入冰醋酸 加CH3COONa (s) 加NaOH(s) 加入镁粉
强碱: KOH、NaOH、Ca(OH)2、Ba(OH)2
几乎所有的盐: NaCl、Na2CO3、CaCO3、AgCl等
活泼金属氧化物: Na2O、CaO等
弱电解质
水溶液或熔融状态下能部分电离的电解质
弱酸: H2CO3、H2SiO3、H2SO3、CH3COOH、 HClO、HF、H3PO4等
弱碱: NH3·H2O;Cu(OH)2等难溶性的碱
6.在醋酸溶液中,CH3COOH电离达到平衡的标志是( D )。 A.溶液呈电中性 B.溶液中检测不出CH3COOH分子存在 C.CH3COOH分子电离的速率很快 D.CH3COO-浓度恒定不变
常见弱电解质 (12张)

答:可能是酸性也可能是碱性
实用文档
[练习] 1.某温度下纯水中C(H+) = 2×10-7 mol/L, 则此时溶液中的C(OH-) = _2_×_1_0_-_7_m_o_l_/L_。 若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = 8×10-9 mol/L 。
6、在常温下,由水电离产生的 C(H+)=1×10-13 mol/L的溶液,则该溶 液的酸碱性如何?
答:可能是酸性也可能是碱性
4、在常温下,0.1mol/L的盐酸溶液中水电 离出的C(H+ )和C(OH-)是多少?
水电离出的C(OH-)=1×10-14/0.1 =1×10-13mol/L= C(H+ )
5、在常温下, 0.1mol/L的NaOH溶液中水电 离出的C(H+)和C(OH-)是多少?
水电离出的C(H+ ) =1×10-14/0.1 =1×10-13mol/L= C(OH-)
专题3 溶液中的离子反应
常见的弱电解质
弱酸、弱碱、水
1、水是一种极弱的电解质,能微弱的电离:
H2O+H2O
H3O++OH-
( H2OH++OH-)电离平衡常数:K电离=
C(H+)×C(OH-)
C(H2O)
纯水和稀溶液中C(H2O)可视为一定值
K W= K 电离× C(H2O)= C(H+)×C(OH-) K W——水的离子积常数
4、不论是在中性溶液还是在酸、碱性溶液, 水电离出的C(H+)=C(OH-)
2、影响水电离平衡的外界因素
H2O
H++OH-
增大C(H+)
抑制水电离 增大C(OH-)
实用文档
[练习] 1.某温度下纯水中C(H+) = 2×10-7 mol/L, 则此时溶液中的C(OH-) = _2_×_1_0_-_7_m_o_l_/L_。 若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = 8×10-9 mol/L 。
6、在常温下,由水电离产生的 C(H+)=1×10-13 mol/L的溶液,则该溶 液的酸碱性如何?
答:可能是酸性也可能是碱性
4、在常温下,0.1mol/L的盐酸溶液中水电 离出的C(H+ )和C(OH-)是多少?
水电离出的C(OH-)=1×10-14/0.1 =1×10-13mol/L= C(H+ )
5、在常温下, 0.1mol/L的NaOH溶液中水电 离出的C(H+)和C(OH-)是多少?
水电离出的C(H+ ) =1×10-14/0.1 =1×10-13mol/L= C(OH-)
专题3 溶液中的离子反应
常见的弱电解质
弱酸、弱碱、水
1、水是一种极弱的电解质,能微弱的电离:
H2O+H2O
H3O++OH-
( H2OH++OH-)电离平衡常数:K电离=
C(H+)×C(OH-)
C(H2O)
纯水和稀溶液中C(H2O)可视为一定值
K W= K 电离× C(H2O)= C(H+)×C(OH-) K W——水的离子积常数
4、不论是在中性溶液还是在酸、碱性溶液, 水电离出的C(H+)=C(OH-)
2、影响水电离平衡的外界因素
H2O
H++OH-
增大C(H+)
抑制水电离 增大C(OH-)
常见的弱电解质ppt课件

专题3 溶液中的离子反应
第一单元 弱电解质的电离平衡 §3.1.3 常见的弱电解质
精选课件ppt
1
一、水的电离平衡 1、水是一种极弱的电解质,能微弱的电离:
+
+
H2O+H2O ( H2O
H3O++OH- H++OH-)
电离常数:K 电离=
C(H+)×C(OH-)
C(H2O)
精选课件ppt
2
【思考与交流】
精选课件ppt
8
思考
1. C(H+)= 1×10-7mol/L,溶液一定呈中 性吗?
2. 某温度下纯水中C(H+) = 2×10-7 mol/L,则 此时溶液中的C(OH-) = _2_×__1_0-_7_m_o_l_/L_。 若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-)_8_×__1_0_-9_m__o_l/_L 由水电离产生的C(H+) 8×10-9 mol/L 。
实验表明:25℃时,1升水中(密度为 1000g/L),有1× 10-7 mol的水分子发生 电离
1.你能算出平均每多少个水分子中有一
个发生电离吗?
5.56×108
2.根据此数据,你能否算出25℃时,
水的电离平衡常数?
1.8×10-16
精选课件ppt
3
二、影响水电离平衡的因素
(1)加入酸(碱),抑制水的电离 (2)升高温度,促进水的电离
精选课件ppt
12
思考
3. 在常温下,由水电离产生的C(H+)= 1×10-13 mol/L的溶液,则该溶液的酸碱性
如何? 可能是酸性也可能是碱性
第一单元 弱电解质的电离平衡 §3.1.3 常见的弱电解质
精选课件ppt
1
一、水的电离平衡 1、水是一种极弱的电解质,能微弱的电离:
+
+
H2O+H2O ( H2O
H3O++OH- H++OH-)
电离常数:K 电离=
C(H+)×C(OH-)
C(H2O)
精选课件ppt
2
【思考与交流】
精选课件ppt
8
思考
1. C(H+)= 1×10-7mol/L,溶液一定呈中 性吗?
2. 某温度下纯水中C(H+) = 2×10-7 mol/L,则 此时溶液中的C(OH-) = _2_×__1_0-_7_m_o_l_/L_。 若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-)_8_×__1_0_-9_m__o_l/_L 由水电离产生的C(H+) 8×10-9 mol/L 。
实验表明:25℃时,1升水中(密度为 1000g/L),有1× 10-7 mol的水分子发生 电离
1.你能算出平均每多少个水分子中有一
个发生电离吗?
5.56×108
2.根据此数据,你能否算出25℃时,
水的电离平衡常数?
1.8×10-16
精选课件ppt
3
二、影响水电离平衡的因素
(1)加入酸(碱),抑制水的电离 (2)升高温度,促进水的电离
精选课件ppt
12
思考
3. 在常温下,由水电离产生的C(H+)= 1×10-13 mol/L的溶液,则该溶液的酸碱性
如何? 可能是酸性也可能是碱性
第3课时 常见的弱电解质
9.一定温度下,冰醋酸加水稀释 的过程中,溶液导电能力(I)随加 水的体积(V)变化如图所示,
下列说法正确的是 ( D)
A.“O”点导电能力为0的理由是冰醋酸是固 体,内部的离子不能自由移动
B.a、b、c三点中,a点c(H+)最大,因为电解 质溶液浓度越大,离子浓度就越大 C.a、b、c三点中,b点水电离的程度最大 D.若使b点处溶液中c(H+)减小,可向溶液中 加水或加冰醋酸
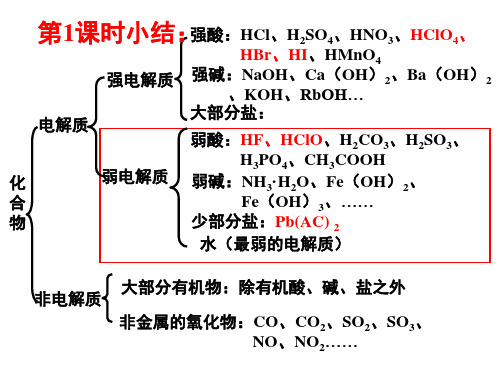
第1课时小结:强酸:HCl、H2SO4、HNO3、HClO4、
HBr、HI、HMnO4 强电解质 强碱:NaOH、Ca(OH)2、Ba(OH)2
、KOH、RbOH…
电解质
大部分盐:
弱酸:HF、HClO、H2CO3、H2SO3、
化
弱电解质
H3PO4、CH3COOH 弱碱:NH3·H2O、Fe(OH)2、
化合物类型
物质类别
阴、阳离子
电离方程式用等号
离子化合物、部分 共价化合物
强酸、强碱、绝大多 数盐、大多数活泼金 属氧化物等
阴、阳离子、弱 电解质分子 电离方程式用 可逆符号
部分共价化合物
弱酸、弱碱、少部分 盐、水
【温故】
在一定的条件下(如温度、
浓度一定),当 溶液中的弱电解
质分子电离成离子的速率与离
D.Mg2+ Cu2+ SO42- Cl-
8.已知一种c(H+)=1×10-3mol·L-1的酸和一 种c(OH-)=1×10-3mol·L-1的碱溶液等体
积混和后溶液呈酸性.其原因可能是 B
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应 C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
2、已知0.1mol・L-1的醋酸溶液中存在电离平 衡
常见弱电解质 (12张)ppt课件

(3)水电离出的 C水(OH-) 、 C水(H+)分别为多少?
C水(OH-) = C水(H+)= 10-13
【小结】 1、Kw取决于温度,不仅适用于纯水,还适 用于其他稀溶液。
2、常温下,任何稀的水溶液中 Kw= C(H+)×C(OH-) = 1×10-14
3、在水溶液中,Kw中的C(OH-) 、 C(H+)指溶 液中总的离子浓度.
A.c(H+)
B.c(OH-)
C.Kw
D.c(H+)/c(OH-)
3 、 某 温 度 下 纯 水 中 C(H+) = 2×10-7 mol/L , 则 此 时 溶 液 中 的 C(OH-) = _2_×__1_0_-7_m__o_l_/L_。 若 温 度 不 变 , 滴 入 稀 盐 酸 使 C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = 8_×__1_0_-_9_m__o_l/_L___。
25℃时C,(HK+w)==C1(×OH10-)-=14__1_×__1_0_-7__mol/L
【课堂练习】 写出H3PO4在水溶液中的电离方程式。 【思考】在磷酸溶液中存在哪些微粒?
H3PO4 H2PO4HPO42-
H+ + H2PO4- 一(1) H+ + HPO42- 一(2) H+ + PO43- 一(3)
6、在常温下,由水电离产生的 C(H+)=1×10-13 mol/L的溶液,则该溶 液的酸碱性如何?
答:可能是酸性也可能是碱性
答:可能是酸性也可能是碱性
精选ppt课件2021
7
[练习]
1.某温度下纯水中C(H+) = 2×10-7 mol/L, 则此时溶液中的C(OH-) = _2_×__10_-_7_m_o_l_/L_。 若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = 8×10-9 mol/L 。
强电解质和弱电解质课件

弱电解质的电离过程
弱电解质在水溶液中部分电离,存在电离平衡,其电离方 程式通常用可逆号表示。例如,CH3COOH在水溶液中的 电离方程式为CH3COOH ⇌ CH3COO- + H+。
弱电解质在溶解过程中存在电离平衡,随着溶解的进行, 离子浓度逐渐增大,当达到一定数值时,电离平衡被打破 ,离子浓度不再增大。因此,弱电解质的溶解度与溶液的 离子浓度不成正比。
感谢观看
THANKS
离子浓度
强电解质的电离程度高,水溶液中的离子浓度也高;弱电解质的电离程度低,水溶液中的离子浓度也 低。
电离度与离子浓度关系
在相同浓度条件下,强电解质的电离度较高,其水溶液中的离子浓度也较高;而弱电解质的电离度较 低,其水溶液中的离子浓度也较低。
06
强电解质和弱电解质的实际
应用
强电解质在日常生活中的应用
02
强电解质在水中能够完全电离成 离子,不会受到水分子影响,因 此具有较高的导电能力和传递速 度。
弱电解质定义
弱电解质是指在溶液中只能部分电离 的电解质,主要包括弱酸、弱碱和水 合离子等。
弱电解质在水中的电离程度较低,因 此导电能力和传递速度受到限制。
电解质的电离平衡
电离平衡是电解质在溶液中的一种动态平衡状态,主要受到电解质的性质、溶液 的浓度和温度等因素影响。
洗涤剂
强电解质如NaCl、NaOH等是洗 涤剂的主要成分,其溶解能力有
助于去除污渍。
食品加工
强电解质如NaCl(食盐)在食品 加工中起到调味和防腐的作用。
农业
强电解质如KNO3和NaCl等在农业 中用于促进植物生长和增加产量。
弱电解质在药物和生物化学中的应用
药物
许多药物如阿司匹林、布洛芬等 都是弱电解质,它们在人体内具 有特定的药理作用。
弱电解质的电离平衡讲义PPT课件( 20页)
悲心,饶益众生为他人。
•
14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。
•
15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
•
16、人生在世:可以缺钱,但不能缺德;可以失言,但不能失信;可以倒下,但不能跪下;可以求名,但不能盗名;可以低落,但不能堕落;可以放松,但不能放纵;可以虚荣,
H3O + + A-
0
0
X
X =α•c
α•ca α• ca
返回1
6
代入Ka式:K
c α c α
a
a
a
c c α
a
a
展
开得: K (c c α c )2α 2
aa
a
a
近似处理,忽略X对ca的影响, ca―ca•α≈ ca
则: Ka ca ca 2 2
对于碱 :
对弱碱:
[OH ]Kb Kb24Kbcb
2
4
条件: c/Kb <500
10
• 例5-1 计算0.10mol/LHAc 溶液的pH值。
•
已 知:Ka=1.8×10-5。
解:由c/ Ka=0.10/(1.8×10-5) >500,近似计
算
[H] caKa
0.11.81 501.3 4 1 30 mL o 1
•
7、生命的美丽,永远展现在她的进取之中;就像大树的美丽,是展现在它负势向上高耸入云的蓬勃生机中;像雄鹰的美丽,是展现在它搏风击雨如苍天之魂的翱翔中;像江
河的美丽,是展现在它波涛汹涌一泻千里的奔流中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1×10-13 mol/L 1×10-13 mol/L
3、影响水的电离平衡的因素:
讨论1:改变温度:
分析表中的数据,有何规律,并解释之
温 度
0℃
1.34×
Kw
10-15
结论:
20℃
6.81× 10-15
25℃
1.01× 10-14
1、温度越高,Kw越大。
50℃
5.47× 10-14
100℃
5.50× 10-13
固体是( AC)
A、NaOH
C、CH3COOK
B、NaHCO3 D、Mg
问题解决
1.25℃时,向纯水中加入少量氯化氢气体,仍 能保持不变的是 ( )
A.c(H+)
OH-)
2.已知100℃时,Kw =1×10-12,分别求出该温 度下,纯水、0.1mol/LHCl溶液、 0.1mol/L的 NaOH溶液中的c(H+) .
解:取1L 水或稀溶液
c(H2O)= n(H2O)/V(液) =m(H2O)/[M(H2O)V(液)] =[V(液)ρ(H2O)]/[M(H2O)V(液)] =1000/18=55.56 mol /L
水的浓度为常数, K 电离也是常数
所以 K W =K 电离× C(H2O)= C(H+)×C(OH-) 为一个新的常数。
-)是多少?
1×10-8 mol/L
例6﹑25℃时,某溶液中, c(OH-)=1×10-9 mol/L,问c(H+
)是多少? 1×10-5 mol/L
例7﹑常温下,0.1mol/L的NaOH溶液中水电离出的c(H +)和c(OH-)各是多少?
1×10-13 mol/L 1×10-13 mol/L
例8﹑常温下,0.1mol/L的盐酸溶液中水电离出的c(H +)和c(OH-)各是多少?
讨论3:直接增大C(OH-)
在H2 O H+ +OH-平衡中,加入 _碱___ ,增大C(OH-) ,则平衡向左__ 移动,α水_减__小_ ,水的电离被_抑__制_, Kw_不__变__,则C(H+)必然会减__小__。
【总结】 抑制水电离
促进水电离
增大C(H+)
增大C(OH-) 降低温度 减小C(H+) 减小C(OH-) 升高温度
1、水的离子积 在一定温度时: C(H+)×C(OH-)=Kw,叫水的离子积 25℃时,Kw=1×10-14
C(H+)=C(OH-)=1×10-7mol/L
提问:常数是否就不变呢?根据前面所学知识, 水的离子积会受什么外界条件影响?
【小结】 (1)Kw取决于温度,不仅适用于纯水,还适 用于其他溶液。 (2)在水溶液中,Kw中的C(OH-) 、 C(H+) 指溶液中总的离子浓度。 (3)常温下,任何稀的水溶液中,Kw= C(H+)×C(OH-)=1×10-14 (4)不论是在中性溶液还是在酸碱性溶液, 水电离出的C(H+)=C(OH-) (5)根据Kw=C(H+)×C(OH-) 在特定温度下 为定值,C(H+) 和C(OH-) 可以互求。
活动与探究
阅读P68 资料卡
多元弱酸,分步电离,第一步电离大于第二步电离,第 二步电离远大于第三步电离……,
如何用平衡移动原理来解释?
多元弱酸的分步电离
电离难的原因:
a、一级电离出H+后,剩下的酸根阴离 子带负电荷,增加了对H+的吸引力, 使第二个H+离子电离困难的多;
b、一级电离出的H+抑制了二级的电离。
[问题与讨论]
例1、在水中加入酸或碱后,水的离 子 积是否发生改变?
例2、在酸碱溶液中,水电离出来的 C(H+)和C(OH-)是否相等?
例3、100℃时,水的离子积为10-12, C(H+)为多少?
例4、求0.1mol/L盐酸中水电离出来 的C(H+)为多少?
问题解决
例5、25℃时,某溶液中,c(H+)=1×10-6 mol/L,问c(OH
关于常见的弱电解 质
一、水的电离 1、水是一种极弱的电解质,能微弱的电离:
+
+
H2O+H2O ( H2O
H3O++OH- H++OH-)
电离常数:K 电离=
C(H+)×C(OH-)
C(H2O)
【思考与交流】
【思考与交流】你能算出纯水或稀溶液 中的c(H2O)吗? 纯水或稀溶液的密度为 1g/cm3。
思考
如何判断弱酸弱碱的相对强弱?
在一定温度下,电离常数越大,则 弱酸和弱碱电离程度就大,弱酸弱碱就 相对的强一些。
思考
如何判断弱酸弱碱酸碱性的相对强弱?
在一定的温度下,当弱酸浓度相同时, 电离常数越大,弱酸的电离程度就越大, 溶液中的氢离子浓度也越大。因此,我 们常用电离常数来表示弱酸的相对强弱, 电离常数越大,弱酸的酸性越强。
2、水的电离是吸热过程。
讨论1:改变温度:
升高温度α水—增—大—,水的电离平衡 向_右___移动,且Kw_增__大__。 降低温度α水—减—小—,水的电离平衡 向_左___移动,并且Kw_减__小__。
讨论2:直接增大C(H+)
在H2 O H+ +OH-平衡中,加入 酸或强酸的酸式盐,则增大C(H+), 平衡向_左__移动,α水_减__小_,水的电 离被_抑__制_,Kw_不__变__,则C(OH-) 必然会_减__小__。
.相同温度下,两种稀氨水A和B,浓度
分别为0.2mol/L和0.1mol/L,则
A、B的OH-浓度之比为( B)
A.大于2
B. 小于2
C. 等于2
D. 不能肯定
结论:多元弱酸的酸性由第一步电离决定。
练习
醋酸溶液加水稀释,在稀释过程中 [ BD]
A. 溶液中CH3COO-的浓度增大 B. 溶液中H+个数增多,
H+离子的浓度减小 C. 溶液中H+个数减少,H+的浓度减小
D. 溶液中CH3COOH的分子数减少, CH3COOH的浓度也减小
练习
欲使醋酸溶液中的CH3COO-浓度增 大,且不放出气体,可加入的少量
3、影响水的电离平衡的因素:
讨论1:改变温度:
分析表中的数据,有何规律,并解释之
温 度
0℃
1.34×
Kw
10-15
结论:
20℃
6.81× 10-15
25℃
1.01× 10-14
1、温度越高,Kw越大。
50℃
5.47× 10-14
100℃
5.50× 10-13
固体是( AC)
A、NaOH
C、CH3COOK
B、NaHCO3 D、Mg
问题解决
1.25℃时,向纯水中加入少量氯化氢气体,仍 能保持不变的是 ( )
A.c(H+)
OH-)
2.已知100℃时,Kw =1×10-12,分别求出该温 度下,纯水、0.1mol/LHCl溶液、 0.1mol/L的 NaOH溶液中的c(H+) .
解:取1L 水或稀溶液
c(H2O)= n(H2O)/V(液) =m(H2O)/[M(H2O)V(液)] =[V(液)ρ(H2O)]/[M(H2O)V(液)] =1000/18=55.56 mol /L
水的浓度为常数, K 电离也是常数
所以 K W =K 电离× C(H2O)= C(H+)×C(OH-) 为一个新的常数。
-)是多少?
1×10-8 mol/L
例6﹑25℃时,某溶液中, c(OH-)=1×10-9 mol/L,问c(H+
)是多少? 1×10-5 mol/L
例7﹑常温下,0.1mol/L的NaOH溶液中水电离出的c(H +)和c(OH-)各是多少?
1×10-13 mol/L 1×10-13 mol/L
例8﹑常温下,0.1mol/L的盐酸溶液中水电离出的c(H +)和c(OH-)各是多少?
讨论3:直接增大C(OH-)
在H2 O H+ +OH-平衡中,加入 _碱___ ,增大C(OH-) ,则平衡向左__ 移动,α水_减__小_ ,水的电离被_抑__制_, Kw_不__变__,则C(H+)必然会减__小__。
【总结】 抑制水电离
促进水电离
增大C(H+)
增大C(OH-) 降低温度 减小C(H+) 减小C(OH-) 升高温度
1、水的离子积 在一定温度时: C(H+)×C(OH-)=Kw,叫水的离子积 25℃时,Kw=1×10-14
C(H+)=C(OH-)=1×10-7mol/L
提问:常数是否就不变呢?根据前面所学知识, 水的离子积会受什么外界条件影响?
【小结】 (1)Kw取决于温度,不仅适用于纯水,还适 用于其他溶液。 (2)在水溶液中,Kw中的C(OH-) 、 C(H+) 指溶液中总的离子浓度。 (3)常温下,任何稀的水溶液中,Kw= C(H+)×C(OH-)=1×10-14 (4)不论是在中性溶液还是在酸碱性溶液, 水电离出的C(H+)=C(OH-) (5)根据Kw=C(H+)×C(OH-) 在特定温度下 为定值,C(H+) 和C(OH-) 可以互求。
活动与探究
阅读P68 资料卡
多元弱酸,分步电离,第一步电离大于第二步电离,第 二步电离远大于第三步电离……,
如何用平衡移动原理来解释?
多元弱酸的分步电离
电离难的原因:
a、一级电离出H+后,剩下的酸根阴离 子带负电荷,增加了对H+的吸引力, 使第二个H+离子电离困难的多;
b、一级电离出的H+抑制了二级的电离。
[问题与讨论]
例1、在水中加入酸或碱后,水的离 子 积是否发生改变?
例2、在酸碱溶液中,水电离出来的 C(H+)和C(OH-)是否相等?
例3、100℃时,水的离子积为10-12, C(H+)为多少?
例4、求0.1mol/L盐酸中水电离出来 的C(H+)为多少?
问题解决
例5、25℃时,某溶液中,c(H+)=1×10-6 mol/L,问c(OH
关于常见的弱电解 质
一、水的电离 1、水是一种极弱的电解质,能微弱的电离:
+
+
H2O+H2O ( H2O
H3O++OH- H++OH-)
电离常数:K 电离=
C(H+)×C(OH-)
C(H2O)
【思考与交流】
【思考与交流】你能算出纯水或稀溶液 中的c(H2O)吗? 纯水或稀溶液的密度为 1g/cm3。
思考
如何判断弱酸弱碱的相对强弱?
在一定温度下,电离常数越大,则 弱酸和弱碱电离程度就大,弱酸弱碱就 相对的强一些。
思考
如何判断弱酸弱碱酸碱性的相对强弱?
在一定的温度下,当弱酸浓度相同时, 电离常数越大,弱酸的电离程度就越大, 溶液中的氢离子浓度也越大。因此,我 们常用电离常数来表示弱酸的相对强弱, 电离常数越大,弱酸的酸性越强。
2、水的电离是吸热过程。
讨论1:改变温度:
升高温度α水—增—大—,水的电离平衡 向_右___移动,且Kw_增__大__。 降低温度α水—减—小—,水的电离平衡 向_左___移动,并且Kw_减__小__。
讨论2:直接增大C(H+)
在H2 O H+ +OH-平衡中,加入 酸或强酸的酸式盐,则增大C(H+), 平衡向_左__移动,α水_减__小_,水的电 离被_抑__制_,Kw_不__变__,则C(OH-) 必然会_减__小__。
.相同温度下,两种稀氨水A和B,浓度
分别为0.2mol/L和0.1mol/L,则
A、B的OH-浓度之比为( B)
A.大于2
B. 小于2
C. 等于2
D. 不能肯定
结论:多元弱酸的酸性由第一步电离决定。
练习
醋酸溶液加水稀释,在稀释过程中 [ BD]
A. 溶液中CH3COO-的浓度增大 B. 溶液中H+个数增多,
H+离子的浓度减小 C. 溶液中H+个数减少,H+的浓度减小
D. 溶液中CH3COOH的分子数减少, CH3COOH的浓度也减小
练习
欲使醋酸溶液中的CH3COO-浓度增 大,且不放出气体,可加入的少量
