注射用硫酸头孢匹罗申报资料 第三部分:药理毒理研究资料 注射用硫酸头孢匹罗申报资料16号
硫酸头孢匹罗申报资料3号

化学药品3类第一部分综述资料资料编号3硫酸头孢匹罗立题目的与依据研究机构:**********药业股份有限公司研究机构地址:研究机构电话:试验负责人:资料整理人:完成日期:2003年12月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司硫酸头孢匹罗立题目的与依据1 立题目的与依据硫酸头孢匹罗(Cefpirome Sulfate)于1992年在墨西哥和瑞典上市,商品名Cefrom,我国于1999年进口,目前已在全球近20个国家上市,本品于2001年在我国申请行政保护获批准,于2004年4月中止。
头孢匹罗作为第四代头孢菌素,是已知第三和第四代头孢菌素中对革兰氏阳性菌抗菌活性最强的抗生素。
头孢匹罗是一个两性离子,头孢核带负电核,四价季铵离子基团带正电核,这一结构使它透过细菌外膜时有明显优势,由于与其他三代头孢相似的一位上连接的氨基噻唑基-甲氧亚氨基,头孢匹罗对β-内酰胺酶稳定,并增强对革兰氏阳性菌的活性。
与头孢他啶相比,头孢匹罗有更优越而全面的抗菌作用。
对多重耐药的肠杆菌属、枸橼酸菌以及产头孢他啶水解酶的克雷伯菌与大肠杆菌均有作用。
另外,硫酸头孢匹罗除有第三代头孢菌素的特征外,还具有如下特征:(1)可快速穿透革兰氏阴性细菌的外膜(常为头孢噻肟、头孢曲松5~7倍);(2)对位于胞浆周围的Ⅰ型β内酰胺酶稳定且亲合力低;(3)与青霉素结合蛋白(PBPS)亲合力高;(4)其内在抗菌活性强于第3代头孢菌素。
目前该药在体外及动物感染模型中头孢匹罗卓越的抗菌作用已为世界范围的大量临床试验报告所证实。
国内外已成功应用于:(1)获得性严重的下呼吸道感染;(2)白细胞减少病人感染;(3)重症监护病人的严重感染;(4)败血症/菌血症;(5)皮肤和软组织感染;(6)复杂性上尿道和下尿道感染。
头孢匹罗作为第四代头孢类抗生素,其抗菌作用更强,抗菌谱更广,并且维持有效血药浓度的时间更长,市场潜力巨大,开发本品市场前景乐观。
注射用硫酸头孢匹罗申报资料14号

化学药品6类第二部分药学研究资料资料编号14注射用硫酸头孢匹罗药物稳定性研究的试验资料及文献资料研究机构:**********药业股份有限公司研究机构地址:研究机构电话:试验负责人:试验参加者:试验日期:2004年3月~2004年10月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗药物稳定性研究的试验资料及文献资料根据新药申报要求,按照中国药典2000版二部附录XIXC药物稳定性试验指导原则对注射用硫酸头孢匹罗进行了光照、高温、高湿等影响因素试验,加速试验及长期留样考察。
考察方法按本资料编号11号所制定的《临床研究用样品质量标准草案》规定方法检查。
1. 仪器(1)调节式电热恒温干燥箱(2)岛津SCL-10AVP高效液相色谱仪2. 样品来源注射用硫酸头孢匹罗,自制,批号:20040312、20040313、20040314。
3. 考察项目及方法(1)外观:目测。
(2)含量测定:同质量标准(草案)含量测定方法。
(3)有关物质检查:同质量标准(草案)有关物质测定方法。
(自身对照法)(4)水分:同质量标准(草案)水分测定方法。
(5)PH值:同质量标准(草案)酸度测定方法。
4. 影响因素试验4.1 光照试验取样品(20040312批)适量,铺成≤5mm厚的薄层,置于照度4500Lx下光照十天,分别于第5、10天取样,考察样品的外观、水分、酸度、有关物质及含量变化。
结果表1。
表1 光照影响测定结果强光照射对本品稳定性有影响,故应遮光保存。
4.2 高温试验取样品(20040312批)适量,于称量瓶中,铺成≤5mm的薄层,再置于密封的干燥器中,置于60℃恒温箱中十天,分别于第5、10天取样,考察样品的外观、水分、酸度、有关物质及含量变化。
结果表2。
表2 高温影响测定结果结论:本品在高温下存放10天后,样品的外观、水份、有关物质、含量等各项指标有较明显变化,表明高温60℃对本品的稳定性有影响,宜存放于阴凉处。
硫酸头孢匹罗合成工艺的研究资料及文献资料(1
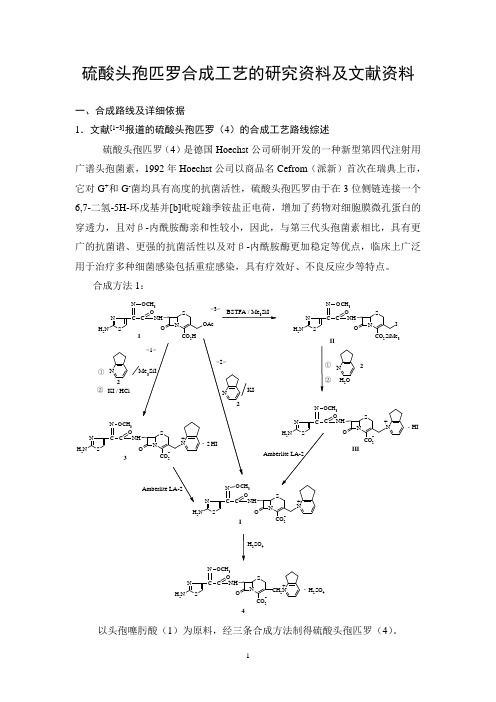
硫酸头孢匹罗合成工艺的研究资料及文献资料一、合成路线及详细依据1.文献[1~3]报道的硫酸头孢匹罗(4)的合成工艺路线综述硫酸头孢匹罗(4)是德国Hoechst 公司研制开发的一种新型第四代注射用广谱头孢菌素,1992年Hoechst 公司以商品名Cefrom (派新)首次在瑞典上市,它对G +和G -菌均具有高度的抗菌活性,硫酸头孢匹罗由于在3位侧链连接一个6,7-二氢-5H-环戊基并[b]吡啶鎓季铵盐正电荷,增加了药物对细胞膜微孔蛋白的穿透力,且对β-内酰胺酶亲和性较小,因此,与第三代头孢菌素相比,具有更广的抗菌谱、更强的抗菌活性以及对β-内酰胺酶更加稳定等优点,临床上广泛用于治疗多种细菌感染包括重症感染,具有疗效好、不良反应少等特点。
合成方法1:H 2SO 4CH 3S N O CO 2HNH CN SNH 2C NO O OAcCH 3SNOCO 2SiMe 3NHC N SNH 2C NOO IOH 2CH 3-S NOCO 2NH N SNH 2C N CO O NCH 3-CH 2NS NOCO 2NHN SNH 2C N C OO H 2SO 4CH 3-NS NOCO 2NH C N OO3N Me CH 32N SNH 2C NCOO N 1IIIII3+4KI / HCl+. 2+. H I①②I2以头孢噻肟酸(1)为原料,经三条合成方法制得硫酸头孢匹罗(4)。
<1>法:(1)在三甲基碘硅烷催化下,与6,7-二氢-5H-环戊基并[b]吡啶(2)反应生成季铵盐,再与KI/HCl 反应生成头孢匹罗二氢碘酸盐(3),3经阴离子交换树脂Amberlite LA-2中和得头孢匹罗(I ),I 与硫酸反应生成硫酸头孢匹罗(4)。
<2>法:(1)在碘化钾催化下,与6,7-二氢-5H-环戊基并[b]吡啶(2)反应生成头孢匹罗(I ),I 成盐得硫酸头孢匹罗(4)。
<3>法:(1)与BSTFA 、Me 3SiI 反应生成3-碘甲基-4-羧酸酯(II ),II 与6,7-二氢-5H-环戊基并[b]吡啶(2)反应生成季铵盐,再水解得头孢匹罗一氢碘酸盐(III ),III 经Amberlite LA-2中和、硫酸成盐得硫酸头孢匹罗(4)。
注射用硫酸头孢匹罗申报资料 第一部分:综述资料 注射用硫酸头孢匹罗申报资料4号

注射用硫酸头孢匹罗申报资料第一部分:综述资料注射用硫酸头孢匹罗申报资料4号化学药品6类第一部分综述资料资料编号4注射用硫酸头孢匹罗对主要研究结果的总结及评价研究机构:**********药业股份有限公司研究机构地址:研究机构电话:资料整理人:完成日期:2004年10月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗对主要研究结果的总结及评价一、药学研究总结1.处方及制备工艺1) 处方硫酸头孢匹罗1190g无水碳酸钠242g共制成1000支2) 制备工艺a、无菌无水碳酸钠的制备取无水碳酸钠,加30~40℃的注射用水,搅拌溶解得饱和溶液(1g无水碳酸钠,加水3ml),无菌条件下用0.22µm微孔滤膜除菌过滤,蒸去大部分水,析出大量的无水碳酸钠结晶,冷却后过滤,将所得到的固体于300℃干燥2小时,得无菌无水碳酸钠固体,无菌包装,经检验合格后备用。
b、分装硫酸头孢匹罗与无水碳酸钠的混合物在无菌配料间里,按处方配比称取无菌硫酸头孢匹罗、无水碳酸钠,过80~100目筛,混和均匀,分装,封口,即得。
经过处方筛选、工艺筛选及影响因素试验确定了处方与工艺,进行了工艺验证、工艺放大及初步质量评价,确认了处方及工艺是合理可行的。
2.质量研究研究了本品的鉴别(包括化学鉴别、高效液相色谱、硫酸盐、钠盐鉴别),检查(包括有关物质、pH值、干燥失重、溶液的颜色与澄清度、装量差异、无菌和细菌内毒素及异常毒素),含量测定等方法。
建立了本品的质量标准草案。
3.稳定性研究按照新药审批办法要求对本品进行了稳定性试验。
(1)对试制样品进行光照、高温、高湿等影响因素实验,结果表明:经光照10天后,外观明显变化,有关物质略有增加,含量略有下降,表明强光照射对本品稳定性有影响,故应遮光保存。
本品在高温下存放10天后,样品的外观、水份、有关物质、含量等各项指标有较明显变化,表明高温60℃对本品的稳定性有影响,宜存放于阴凉处。
注射用硫酸头孢匹罗申报资料第二部分:药学研究资料注射用硫酸头孢匹罗申报资料13号

化学药品6类第二部分药学研究资料资料编号13注射用硫酸头孢匹罗辅料来源与质量标准研究机构:**********药业股份XX研究机构地址:研究机构:试验负责人:试验参加者:试验日期:2004年1月至2004年3月原始资料保存处:联系人:__药品注册申请人名称:**********药业股份XX注射用硫酸头孢匹罗辅料来源与质量标准辅料来源:自制。
由分析纯无水碳酸钠经处理并按自拟定的质量标准检验符合规定后制得。
后附:质量标准、检验报告及参考资料。
质量标准(草案)无水碳酸钠TansuannaSodium carbonateNa2CO3106.0 本品含Na2CO3应为99.5—100.5%。
【性状】本品为白色或类白色细颗粒粉末;有吸湿性。
本品在水中易溶解,在乙醇中不溶。
【鉴别】本品的水溶液显钠盐与碳酸盐的鉴别反应(中国药典2000年版二部附录Ⅲ)。
【检查】溶液的澄清度与颜色取本品1.0 g,加水20m1溶解后,溶液应澄清;如显色,与黄色1号标准液(中国药典2000年版二部附录ⅥA第一法)比较,不得更深。
氢氧根碱和碳酸氢盐取本品0.4g,加水20 m1使溶解,加20 m1氯化钡试液,滤过,取滤液10 m1,加酚酞指示液1 m1,溶液不得变红;将上述滤液加热至沸2分钟,溶液应澄清。
氯化物取本品1.5g,加水溶解使成25 m1,滴加盐酸使成微酸性,置水浴中加热以除尽二氧化碳,放冷,依法检查(中国药典2000年版二部附录Ⅷ A),与标准氯化钠溶液3.0 ml制成的对照液比较,不得更浓(0.002%)。
硫酸盐取本品3.0g,加水溶解使成40 m1,滴加盐酸使成微酸性,置水浴中加热以除尽二氧化碳,放冷,依法检查(中国药典2000年版二部附录Ⅷ B),与标准硫酸钾溶液溶液1.5 ml制成的对照液比较,不得更浓(0.005%)。
铵盐取本品1.0g ,加氢氧化钠试液10m1,加热,发生的蒸气遇湿润的红色石蕊试纸不得变蓝色。
注射用硫酸头孢匹罗说明书--二叶罗

注射用硫酸头孢匹罗说明书【药品名称】通用名:注射用硫酸头孢匹罗英文名:Cefpirome Sulfate for Injection汉语拼音:Zhusheyong Liusuan Toubaopiluo商品名:二叶罗【成份】本品主要成份为:硫酸头孢匹罗化学名称:1-[[(6R,7R)-7-[2-(2-氨基-4-噻唑基)-2-(甲氧亚氨基乙酰氨基)-2-羧基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-3-基]甲基]-6,7-二氢-5H-1-环戊二烯并吡啶单硫酸盐。
化学结构式:分子式:C22H22N6O5S2·H2SO4分子量:612.66Cas No:98753-19-6【性状】本品为白色至淡黄色结晶性粉末。
【适应症】本品可适用于下述由未知病原菌或己知敏感菌造成的感染的治疗:下呼吸道感染(支气管肺炎及大叶性肺炎)。
合并上(肾盂肾炎)及下泌尿道感染。
皮肤及软组织感染(蜂窝织炎,皮肤脓肿及伤口感染)。
中性粒细胞减少患者的感染。
菌血症/败血症。
如上所列的严重感染。
【规格】0.5g(以C22H22N6O5S2计)【用法与用量】本品为胃肠外给药,其剂量、给药方法及疗程决定于感染的严重程度、病原菌的敏感性、患者状况及肾功能情况。
下列剂量推荐用于肾功能正常的中重度感染的患者。
对于很严重的泌尿系及皮肤、软组织感染病例其单位剂量可增至2.0克。
肾功能损害患者的剂量:头孢匹罗主要经肾脏排泄,因此在肾功能损害患者必须减少剂量以用法:静脉注射:将1小瓶1.0或2.0克头孢匹罗的药粉分别溶解于10毫升或20毫升灭菌注射用水,然后在3至5分钟内将药液直接注入静脉内或夹闭的输液管道的远端部分。
对于肾功能损害患者,则可将0.25或0.5克本品分别溶解于2或5毫升注射用水中。
短时静脉输注:将l.0或2.0克小瓶的头孢匹罗药粉溶于50毫升灭菌注射用水,在20-30分钟内输完。
下列输注溶液也可使用:0.9%氯化钠溶液,林格氏液,标准电解质输注液,5及10%葡萄糖溶液,5%果糖溶液,5%葡萄糖+0.9%氯化钠溶液。
注射用硫酸头孢匹罗申报资料 第二部分:药学研究资料 注射用硫酸头孢匹罗申报资料8号

注射用硫酸头孢匹罗申报资料第二部分:药学研究资料注射用硫酸头孢匹罗申报资料8号化学药品6类第二部分药学研究资料资料编号8注射用硫酸头孢匹罗制剂处方及生产工艺的研究资料及文献资料研究机构:**********药业股份有限公司研究机构地址:研究机构电话:试验负责人:试验参加者:试验日期:2004年1月至2004年4月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗制剂处方及生产工艺的研究资料及文献资料1.处方与制备工艺1.1 处方硫酸头孢匹罗 1190g无水碳酸钠 242g1000支1.2制备工艺1.2.1无菌无水碳酸钠的制备取无水碳酸钠,加30~40℃的注射用水,搅拌溶解得饱和溶液(1kg无水碳酸钠,加水3L),加入0.05%针用活性炭,升高温度至70-80℃并保温30分钟,脱炭;无菌条件下先用0.80µm微孔滤膜过滤,再用0.22µm微孔滤膜除菌过滤;蒸去大部分水,析出大量的碳酸钠结晶,冷却后过滤,将所得到的固体于300℃干燥2小时,得无菌无水碳酸钠固体,无菌包装,经检验合格后备用。
1.2.2分装硫酸头孢匹罗与无水碳酸钠的混合物在无菌配料间里,按处方配比称取无菌硫酸头孢匹罗、无水碳酸钠,过80~100目筛,混和均匀,分装,封口,即得。
2.处方依据、规格2.1规格依据本品参照日本藤沢药品工业株式会社的产品“Keiten®”而制定的,每瓶头孢匹罗0.5g、1.0g,本品为硫酸头孢匹罗和无水碳酸钠的无菌混合物。
由于本品成人通常用为每日1~2g,分二次静脉注射,所以本品暂确定申报1.0g规格,以后可根据临床需要增加规格。
2.2处方依据与筛选过程本品处方依据日本藤沢药品工业株式会社的产品“Keiten®”使用说明书中所提供的处方资料确定的。
由于本品为无菌分装产品,主要对无菌粉末进行物理化学性质测定,来制定合理的制备工艺。
注射用硫酸头孢匹罗申报资料10号

化学药品6类第二部分药学研究资料资料编号10注射用硫酸头孢匹罗质量研究工作的试验资料及文献资料研究机构:**********药业股份有限公司研究机构地址:研究机构电话:试验负责人:试验参加者:试验日期:2004年3月至2004年5月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗质量研究工作的试验资料及文献资料1 理化性质1.1 样品来源制剂来源:本公司制剂室1.2 制剂规格本品为硫酸头孢匹罗和无水碳酸钠的无菌混合物,含头孢匹罗1.0g。
1.3 性状所制得注射用硫酸头孢匹罗样品均为类白色结晶性粉末。
2 鉴别2.1 高效液相色谱法含量测定项下记录的色谱图中供试品主峰的保留时间与对照品主峰的保留时间一致。
试验结果:检验本品三批,色谱图见附图1~4,结果如下表所示。
从色谱图中可见,供试品主峰的保留时间与注射用硫酸头孢匹罗对照品主峰的保留时间一致,结果见表1。
表1 三批样品及对照品主峰的保留时间测定结果2.2 取本品20mg,加水20ml溶解加入盐酸羟胺(1→10)1ml及氢氧化钠试液2ml,放臵5分钟后,加入盐酸试液3ml及三氯化铁试液3滴,溶液呈红褐色。
2.3 取本品适量,加稀酸,即泡沸,发生二氧化碳,导入氢氧化钙试液中,即生成白色沉淀。
2.4 本品的水溶显硫酸盐的鉴别反应(《中国药典》2000年版二部附录Ⅲ)。
2.5 本品显钠盐的火焰反应(《中国药典》2000年版二部附录Ⅲ)。
3 检查3.1 有关物质采用HPLC法测定本品中的有关物质。
3.1.1 仪器系统色谱柱(250×4.6mm,5μm)。
岛津SCL-10AVP高效液相色谱仪,Diamonsil TM C183.1.2 试剂乙腈(色谱纯,Merck)磷酸(分析纯,天津市化学试剂三厂)三乙胺(分析纯,天津市化学试剂三厂)磷酸二氢铵(分析纯,北京化学试剂公司)3.1.3 色谱条件的确立3.1.3.1 流动相的选择参考本品原料的有关物质测定方法,以十八烷基硅烷键合硅胶为填充剂,磷酸二氢铵0.02mol/L溶液(用磷酸调节PH值为3.3)-乙腈(90:10),保留时间适合,峰型对称,分离度好,杂质得以充分分离,可用于有关物质测定。
注射用硫酸头孢匹罗申报资料7号

化学药品6类第二部分药学研究资料资料编号7注射用硫酸头孢匹罗药学研究资料综述研究机构:**********药业股份有限公司研究机构地址:研究机构电话:资料整理人:完成日期:2004年10月原始资料保存处:联系人:联系人电话:药品注册申请人名称:**********药业股份有限公司注射用硫酸头孢匹罗药学研究资料综述在本品的研究中,对制剂处方与工艺进行了研究,制定出较好的处方,合理的生产工艺;完成了质量研究工作,起草了药品标准草案;按照制定好的处方进行了放大试验,制备了3批样品,并按我们建立的药品标准进行了检验,结果3批样品均合格;进行了药物稳定性研究,初步稳定性试验表明,试验的3批样品在所采用储藏条件下性质稳定,进一步的试验仍在进行中。
另外,说明了原、辅料的合法来源及质量标准,选择直接接触药品的包装材料的依据及质量标准。
主要研究工作结果总结如下:1.处方硫酸头孢匹罗1190g无水碳酸钠242g共制成1000支2.制备工艺2.1 无菌无水碳酸钠的制备取无水碳酸钠,加30~40℃的注射用水,搅拌溶解得饱和溶液(1g无水碳酸钠,加水3ml),无菌条件下用0.22µm微孔滤膜除菌过滤,蒸去大部分水,析出大量的无水碳酸钠结晶,冷却后过滤,将所得到的固体于300℃干燥2小时,得无菌无水碳酸钠固体,无菌包装,经检验合格后备用。
2.2 分装硫酸头孢匹罗与无水碳酸钠的混合物在无菌配料间里,按处方配比称取无菌硫酸头孢匹罗、无水碳酸钠,过80~100目筛,混和均匀,分装,封口,即得。
2.3工艺流程图试制工艺流程图分装用玻璃瓶胶塞铝盖纸箱纸盒标签大方框内为:万级区,大方框外为:百万级区●:表示要求在百级区进行◆:表示质量检验点3.质量研究研究了本品的鉴别(包括化学鉴别、高效液相色谱、硫酸盐、钠盐鉴别),检查(包括有关物质、pH值、干燥失重、溶液的颜色与澄清度、装量差异、无菌和细菌内毒素及异常毒素),含量测定等方法。
注射用硫酸头孢匹罗

注射用硫酸头孢匹罗核准日期:2006年08月31日药品名称:【通用名称】注射用硫酸头孢匹罗【商标名称】罗邦【英文名称】 Cefpirome Sulfate for Injection【汉语拼音】 Zhu She Yong Liu Suan Tou Bao Pi Luo成份:本品主要成份为:硫酸头孢匹罗。
化学结构式:分子式:C22H22N6O5S2 ?H2SO4分子量:612.66辅料:无水碳酸钠。
所属类别:化药及生物制品 >> 抗微生物药 >> 抗细菌药 >> 抗生素类性状:本品为白色至微黄色结晶性粉末。
适应症:本品可适用于下述由未知病原菌或已知敏感菌造成的感染的治疗:下呼吸道感染(支气管肺炎及大叶性肺炎)。
合并上(肾盂肾炎)及下泌尿道感染。
皮肤及软组织感染(蜂窝织炎,皮肤脓肿及伤口感染)。
中性粒细胞减少患者的感染。
菌血症/败血症。
如上所列的严重感染。
规格:(1)按C22H22N6O5S2计 0.25g (2)按C22H22N6O5S2计 1.0g用法用量:本品为胃肠外给药,其剂量、给药方法及疗程决定于感染的严重程度、病原菌的敏感性、患者状况及肾功能情况。
下列剂量推荐用于肾功能正常的中重度感染的患者。
对于很严重的泌尿系及皮肤、软组织感染病例其单位剂量可增至2.0克。
肾功能损害患者的剂量:头孢匹罗主要经肾脏排泄,因此在肾功能损害患者必须减少剂量以与其较慢的排出保持平衡。
推荐剂量如下:用法:静脉注射:将1小瓶1.0或2.0克头孢匹罗的药粉分别溶解于10毫升或20毫升灭菌注射用水,然后在3至5分钟内将药液直接注入静脉内或夹闭的输液管道的远端部分。
对于肾功能损害患者,则可将0.25或0.5克本品分别溶解于2或5毫升注射用水中。
短时静脉输注:将1.0或2.0克小瓶的头孢匹罗药粉溶于50毫升灭菌注射用水,在20-30分钟内输完。
下列输注溶液也可使用:0.9%氯化钠溶液,林格氏液,标准电解质输注液,5及10%葡萄糖溶液,5%果糖溶液,5%葡萄糖+0.9%氯化钠溶液。
2023年注射用硫酸头孢匹罗行业市场研究报告

2023年注射用硫酸头孢匹罗行业市场研究报告注射用硫酸头孢匹罗是一种广泛用于快速治疗严重感染的抗生素药物。
它属于头孢菌素类抗生素,可以通过注射静脉输液给予患者。
市场概述:随着人口老龄化和慢性疾病的增加,全球感染性疾病的发病率在不断上升,推动了抗生素市场的增长。
注射用硫酸头孢匹罗作为一种高效、广谱的抗生素,受到了医疗机构和患者的青睐,市场需求较大。
市场规模:根据市场研究机构的数据,注射用硫酸头孢匹罗市场规模在过去几年持续增长。
预计到2025年,全球注射用硫酸头孢匹罗市场将达到xx亿美元。
市场主要驱动因素:1. 全球感染性疾病的增加:随着人口老龄化和慢性疾病的增加,感染性疾病的发病率也在逐年上升。
这推动了抗生素市场的需求,包括注射用硫酸头孢匹罗。
2. 多重耐药菌的出现:多重耐药菌是指对多种抗生素产生耐药性的细菌。
由于多重耐药菌对常规抗生素的治疗效果有限,医生们普遍采用更强效的抗生素,如注射用硫酸头孢匹罗来治疗。
因此,多重耐药菌的出现也推动了注射用硫酸头孢匹罗市场的增长。
3. 医疗设施的发展:随着全球医疗设施的不断发展,医生和患者对高效、快速治疗的需求也在增加。
注射用硫酸头孢匹罗作为一种有效的抗生素,得到了医生和患者的信赖和选择,进一步推动了市场的增长。
市场挑战和机遇:1. 市场竞争激烈:注射用硫酸头孢匹罗市场竞争激烈,主要由多家跨国药企以及一些国内厂商共同竞争。
在市场竞争中,产品质量、价格和品牌影响力都是影响消费者决策的重要因素。
2. 新药开发:随着医学科学的不断进步,新的抗生素药物不断涌现。
出现了一些可靠、有效的替代品,对注射用硫酸头孢匹罗市场造成一定的竞争压力。
3. 建立有效的销售和分销渠道:在市场竞争激烈的情况下,建立有效的销售和分销渠道十分重要。
与医疗机构的合作、开展营销活动和提供专业的技术支持都是成功的关键。
市场前景:尽管注射用硫酸头孢匹罗市场面临一些挑战,但由于其对感染性疾病的广谱有效性和快速治疗特性,市场前景依然广阔。
注射用硫酸头孢匹罗安全性实验研究

注射用硫酸头孢匹罗安全性实验研究
王艳春
【期刊名称】《中国现代药物应用》
【年(卷),期】2016(010)002
【摘要】目的探讨注射用硫酸头孢匹罗的安全性.方法配置不同浓度的盐酸头孢匹罗注射液,应用大鼠、大耳白兔等动物进行静脉血管刺激实验、变态反应试验、肌肉刺激实验及溶血实验.结果溶血性实验发现,无絮状沉淀.肌肉刺激性实验及静脉血管刺激性实验发现,无炎症及坏死等病变.经变态反应实验发现,硫酸头孢匹罗注射液对于实验动物均无变态反应影响.结论注射用硫酸头孢匹罗对于红细胞并无溶血性反应及变态反应,对静脉血管及肌肉组织并无刺激反应,值得临床进一步研究应用.
【总页数】2页(P288-289)
【作者】王艳春
【作者单位】114032 鞍山市双山医院药剂科
【正文语种】中文
【相关文献】
1.注射用硫酸头孢匹罗的安全性研究 [J], 张健翔;赵利枝;姚西玲
2.注射用硫酸头孢匹罗安全性实验研究 [J], 耿武洪
3.硫酸头孢匹罗及注射用硫酸头孢匹罗细菌内毒素检查法的研究 [J], 王丽萍;马辉;李庆忠
4.国产注射用硫酸头孢匹罗质量评价 [J], 李伟;曹晓云;郭福庆;杨倩;刘海玲
5.注射用硫酸头孢匹罗无菌检查法的确定 [J], 李娅男;李伟;曹晓云
因版权原因,仅展示原文概要,查看原文内容请购买。
注射用硫酸头孢匹罗安全性实验研究

注射用硫酸头孢匹罗安全性实验研究
耿武洪
【期刊名称】《医药导报》
【年(卷),期】2008(27)3
【摘要】目的评价注射用硫酸头孢匹罗的安全性.方法采用变态反应实验、静脉血管刺激实验、肌肉刺激实验、溶血实验进行毒理学研究.结果注射用硫酸头孢匹罗对动物无变态反应、无溶血现象,对静脉血管、肌肉无刺激性反应.结论注射用硫酸头孢匹罗在该实验条件下用于注射是安全的.
【总页数】2页(P278-279)
【作者】耿武洪
【作者单位】华中科技大学同济医学院附属同济医院药学部,武汉,430030
【正文语种】中文
【中图分类】R978.11;R965.3
【相关文献】
1.注射用硫酸头孢匹罗的安全性研究 [J], 张健翔;赵利枝;姚西玲
2.注射用硫酸头孢匹罗安全性实验研究 [J], 王艳春
3.硫酸头孢匹罗及注射用硫酸头孢匹罗细菌内毒素检查法的研究 [J], 王丽萍;马辉;李庆忠
4.国产注射用硫酸头孢匹罗质量评价 [J], 李伟;曹晓云;郭福庆;杨倩;刘海玲
5.注射用硫酸头孢匹罗无菌检查法的确定 [J], 李娅男;李伟;曹晓云
因版权原因,仅展示原文概要,查看原文内容请购买。
硫酸头孢匹罗及注射用硫酸头孢匹罗细菌内毒素检查法的研究

硫酸头孢匹罗及注射用硫酸头孢匹罗细菌内毒素检查法的研究王丽萍;马辉;李庆忠
【期刊名称】《中国药品标准》
【年(卷),期】2008(9)1
【摘要】目的:建立硫酸头孢匹罗及注射用硫酸头孢匹罗细茵内毒素检查法.方法:按<中国药典>2005年版二部附录XIE进行实验和结果判断.结果:硫酸头孢匹罗最大不干扰浓度为5 g·L-1;注射用硫酸头孢匹罗最大不干扰浓度为5 g·L-1.结论:可建立硫酸头孢匹罗及注射用硫酸头孢匹罗的细菌内毒素检查方法.
【总页数】4页(P30-33)
【作者】王丽萍;马辉;李庆忠
【作者单位】黑龙江省药品检验所,哈尔滨150001;黑龙江省药品检验所,哈尔滨150001;黑龙江省药品检验所,哈尔滨150001
【正文语种】中文
【中图分类】R921.2
【相关文献】
1.注射用硫酸头孢匹罗的细菌内毒素定量检测 [J], 丁水平;杜光;李永进
2.硫酸头孢匹罗细菌内毒素检查法的建立 [J], 李玉杰;张桂芳;徐晓洁
3.注射用硫酸头孢匹罗细菌内毒素检查的方法学研究 [J], 蔡伟;乔阳;李薇
4.利用碳酸钠溶液调节硫酸头孢匹罗的pH值以适应细菌内毒素检查法的研究 [J], 王玲;温海波
5.注射用硫酸头孢匹罗无菌检查法的确定 [J], 李娅男;李伟;曹晓云
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注射用硫酸头孢匹罗申报资料第三部分:药理毒理研究资料注射用硫酸头孢匹罗申报资料16号
化学药品6类
第三部分药理毒理资料资料编号16
注射用硫酸头孢匹罗
药理毒理研究资料综述
研究机构:**********药业股份有限公司
研究机构地址:
研究机构电话:
资料整理人:
完成日期:2004年10月
原始资料保存处:
联系人:
联系人电话:
药品注册申请人名称:**********药业股份有限公司
化学药品6类注射用硫酸头孢匹罗申报资料16号注射用硫酸头孢匹罗药理毒理研究资料综述
一、主要药效、一般药理、急性毒性、长期毒性等资料详见原料药16号资料。
二、注射用硫酸头孢匹罗局部毒理资料综述
1.溶血试验
注射用硫酸头孢匹罗与2%兔红细胞混悬液温育,对家兔红细胞无溶血及凝聚作用,符合静脉注射用安全性检查的要求。
2. 血管刺激试验
注射用硫酸头孢匹罗静脉多次推注本品对家兔血管无明显刺激反应,表明注射用硫酸头孢匹罗血管刺激试验符合规定。
3. 过敏试验
注射用硫酸头孢匹罗,对豚鼠致敏攻击后,阳性率为0,表明该药过敏试验符合规定。
1。
