疑似预防接种异常反应个案调查表
AEFI(疑似预防接种反应)个案调查表填表说明

AEFI个案调查表填表说明一、基本情况1.编码:县国标码6位+发生年份4位+流水号4位,系统自动生成。
2.姓名:填写病人真实姓名,尚未取名的儿童可填写父或母姓名+“子”或“女”。
3.性别:选填1-男 2-女。
4.出生日期:按年月日格式填写,日期指公历日期(下同)。
5.职业:选填01-幼托儿童 02-散居儿童 03-大学生 04-中学生 05-小学生06-教师 07-保育员及保姆 08-餐饮食品业 09-商业服务 10-医务人员 11-工人 12-民工 13-农民 14-牧民15-渔(船)民 16-干部职员 17-离退人员 18-家务及待业 19-其他。
6.现住址:填写病人当前的家庭住址,包括省、市、县、乡、村各级名称和门牌号。
7.联系电话:填写病人的联络电话,如为儿童,填写其监护人电话,号码内包括地区码。
8.监护人:如果病人为儿童,填写其监护人姓名。
二、既往史1.接种前患病史:接种前1个月内有无患过或现患某种疾病(如发热、感冒、传染病、遗传病、慢性病等),选填1-有 2-无 3-不详。
如有,疾病名称:填写所患全部疾病的名称。
2.接种前过敏史:选填1-有 2-无3-不详。
如有,过敏物名称:填写过敏物(如疫苗、血清、药物、花粉、食物等)的名称。
3.家族患病史:三代以内直系亲属成员中有无遗传病、传染病、精神病、癫痫、过敏或惊厥等病史,选填1-有 2-无 3-不详。
如有,疾病名称:填写所患全部疾病的名称。
4.既往异常反应史:在既往接种疫苗中有无发生异常反应,选填1-有 2-无3-不详。
如有,反应发生日期:按“年月日”格式填写。
接种疫苗名称:指发生异常反应的既往接种疫苗名称,按《儿童预防接种信息管理系统数据交换集成标准》(简称《集成标准》,中疾控信发[2007]154号)的“疫苗名称编码表”填写。
临床诊断:填写临床诊断的病名,按“AEFI临床诊断编码表”填写。
AEFI临床诊断编码表AEFI通常涉及一种疫苗/生物制品,但个别情况下病人可能同时或先后接种数种疫苗(一般最多3种)。
预防接种副反应个案调查表

附件2:预防接种副反应个案调查表调查单位(公章):调查人员(签字):_______调查日期:.一、基本情况1.姓名:________性别:1男/2女出生日期:年月日年龄:周岁月龄2.职业:___________□〔职业分:幼托儿童、散居儿童、大学生、中学生、小学生、教师、保育员及保姆、餐饮食品业、商业服务、医务人员、工人、民工、农民、牧民、渔(船)民、干部职员、离退人员、家务及待业、其他(请注明)、不详〕3.监护人姓名:______现住址:________________________联系电话:_____________二、报告情况1.发生时间:年月日时分□□□□□□□□□□□□2.报告时间:年月日时分□□□□□□□□□□□□3.报告单位:_____________________________报告人:________________三、现病史1.主要症状:2.体征:3.实验室及其它辅助检查结果:4.临床诊断:5.治疗经过:6.病例的转归:1治愈/2好转/3未愈/4死亡/5其它(请注明)7.如病例死亡:7.1 死亡时间:年月日时 7.2死亡原因:_______7.3是否病理解剖: 1是/2否□7.4解剖结论:____________________四、既往史和家族史1.接种前是否患有疾病:1无/2有□疾病名称_______________________2.接种前精神状况:1活泼/2萎靡/3忧郁/4紧张/5恐惧/6其它___ □3.有无过敏史:1无/2有□过敏物质______________________4.家族史:家族是否有下列疾病?4.1遗传病 1有/2无病名__________4.2精神病 1有/2无病名___________ 4.3癫痫 1有/2无病名__________4.4过敏 1有/2无病名__________4.5惊厥 1有/2无病名__________4.6其它 1有/2无病名___________五. 接种史1.以往接种疫苗名称_______________________________________________________2.接种疫苗反应史:1有/2无□如有,详细描述:六、疫苗情况注:接种疫苗名称应填写通用名;接种部位指1上臂三角肌、2臀部、3大腿前内侧、4其它部位;接种途径指:肌内、皮下、皮内、口服、其它(请说明);外观是指判断后:正常、不正常。
预防接种异常反应个案报卡和调查表

□□□□□□□□□□□□□□
□ □□□□/□□/□□
□□
疫苗 2
疫苗 2
□ □ □ □ □□□□/□□/□□
疫苗 3
疫苗 3
5. 有效日期
6. 稀释液外观是否正常
7. 保存容器
8. 保存温度(℃)
9. 送检日期
10. 检定结果是否合格
五、注射器情况
1. 注射器名称
2. 注射器类型
3. 规格(ml/支)
4. 生产企业
5. 注射器批号
6. 有效日期
7. 送检日期
8. 检定结果是否合格
六、接种实施情况
1. 接种日期*
2. 接种组织形式*
3. 接种剂次*
4. 接种剂量(ml 或粒)*
5. 接种途径*
6. 接种部位*
7. 接种单位
8. 接种地点
9. 接种人员
10. 有无预防接种培训合格证
11.接种实施是否正确
1. 编码
2. 姓名*
3. 性别*
4. 出生日期*
5. 职业
6. 现住址
7. 联系电话
8. 监护人
表 1 疑似预防接种异常反应(AEFI)个案报告卡
9. 可疑疫苗接种情况(按最可疑的疫苗顺序填写)
1
2
3
疫苗 名称
*
10. 反应发生日期*
11. 发现/就诊日期*
12. 就诊单位
13. 主要临床经过*
发热(腋温℃)*
三、可疑疫苗情况(按最可疑的疫苗顺序填写)
1. 疫苗名称*
2. 规格(剂/支或粒)
3. 生产企业*
4. 疫苗批号*
5. 有效日期
6. 有无批签发合格证书
疑似预防接种异常反应报告卡
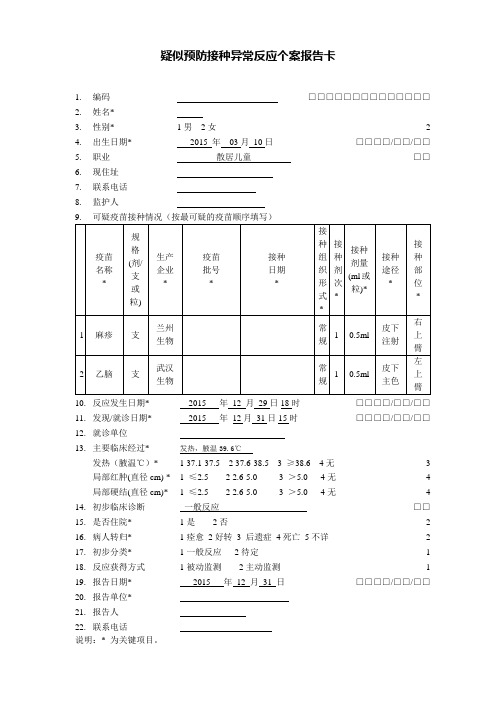
*
接种
组织形式
*
接种剂次
*
接种
剂量
(ml或粒)*
接种
途径
*
接种
部位
*
1
麻疹
支
兰州生物
常乙脑
支
武汉生物
常规
1
0.5ml
皮下主色
左上臂
10.反应发生日期*
2015年12月29日18时
□□□□/□□/□□
11.发现/就诊日期*
2015年12月31日15时
□□□□/□□/□□
一般反应
□□
15.是否住院*
1是2否
2
16.病人转归*
1痊愈2好转3后遗症4死亡5不详
2
17.初步分类*
1一般反应2待定
1
18.反应获得方式
1被动监测2主动监测
1
19.报告日期*
2015年12月31日
□□□□/□□/□□
20.报告单位*
21.报告人
22.联系电话
说明:*为关键项目。
12.就诊单位
13.主要临床经过*
发热,腋温39.6℃
发热(腋温℃)*
1 37.1-37.5 2 37.6-38.5 3≥38.6 4无
3
局部红肿(直径cm)*
1≤2.5 2 2.6-5.0 3>5.0 4无
4
局部硬结(直径cm)*
1≤2.5 2 2.6-5.0 3>5.0 4无
4
14.初步临床诊断
疑似预防接种异常反应个案报告卡
1.编码
□□□□□□□□□□□□□□
2.姓名*
3.性别*
1男2女
2
4.出生日期*
疑似预防接种异常反应个案调查表

疑似预防接种异常反应个案调查表一、基本情况1 县国标码□□□□□□2 发生年份□□□□3 编号□□□□4 姓名5 性别1男 2女□6 出生日期年月日□□/□□/□□7 年龄周岁月龄□□/□□8 职业□□9 现住址10 联系电话11 监护人姓名二、就诊与报告情况1 发生时间年月日时分□□/□□/□□□□/□□2 就诊时间年月日时分□□/□□/□□□□/□□3 就诊单位4 报告时间年月日时分□□/□□/□□□□/□□5 报告单位6 报告人三、临床资料1 临床经过(包括症状、体征、实验室检查、辅助检查和治疗等)2 初步临床诊断3 是否住院1是 2否□如果是,医院名称病历号住院日期年月日□□/□□/□□出院日期年月日□□/□□/□□4 病人转归1治愈 2好转 3后遗 4死亡5 不详□如死亡,死亡时间年月日时分□□/□□/□□□□/□□病理解剖1是 2否□解剖结论四、既往病史和家族病史1 接种前患病史1有 2无 3不详□如有,疾病名称2 接种前精神状况1活泼 2萎靡 3忧郁 4紧张□5恐惧 6其它3 接种前过敏史1有 2无□如有,过敏物名称4 家庭成员中有无遗传病/传染病/精神病/癫痫/过敏/惊厥等1有 2无 3不详□如有,疾病名称五、既往接种史和异常反应史1 既往接种疫苗名称2 既往发生异常反应1有 2无□3 如有异常反应,反应发生日期年月日□□/□□/□□接种疫苗名称临床诊断诊断单位六、可疑疫苗接种情况(按最可疑的疫苗顺序填写)(一) 可疑疫苗疫苗1 疫苗2 疫苗3 疫苗4(二) 稀释液疫苗1 疫苗2 疫苗3 疫苗4(三) 注射器疫苗1 疫苗2 疫苗3 疫苗4(四) 接种人员与操作疫苗1 疫苗2 疫苗3 疫苗4七、其它情况1 接种同批次疫苗其他人群的发病情况:2 当地类似症状疾病的发病情况:八、结论1 调查组结论建议2 异常反应诊断小组结论3 最终临床诊断□□4 反应分类1一般反应 2异常反应 3疫苗质量事故4 实施差错事故 5偶合症6 心因性反应 7不明原因 8待定□5 反应与可疑疫苗的因果关联程度1肯定 2极可能 3 很可能4 可能 5 不太可能 6 无关7 不能分类 8 待定6 是否为群体性反应1是 2否□群体性反应编码□□□□□□□□调查单位(公章)调查人员(签字)调查日期年月日□□/□□/□□疑似异常反应个案调查表填表说明一、基本情况1.县国标码:填写报告单位所在县(市、区)的6位国标码,例如“110101”。
疑似预防接种异常反应个案报告卡填写说明:

疑似预防接种异常反应AEFI个案报告卡填写说明(新版):加*为必填项1.编码:网络报告保存后系统自动生成,上报前不填。
2、3、4:姓名*、性别*、出生日期*为必填项!5.职业:为以下之一:幼托儿童、散居儿童、大学生、中学生、小学生、教师、保育员及保姆、餐饮食品业、商业服务、医务人员、工人、民工、农民、牧民、渔(船)民、干部职员、离退人员、家务及待业、孕妇、产妇、其他。
6.现住址7.联系电话8.监护人9.可疑疫苗接种情况*(按最可疑的疫苗顺序填写,最多填3种可疑疫苗)其中每一种疫苗登记项目的填写内容为以下选项之一:(1).接种组织形式:常规、强化、应急、不详(2)接种途径: 肌内、皮下、皮内、口服、其它。
(3)接种部位:上臂三角肌、臀部、大腿、其它部位。
10.反应发生日期*:按实际日期填写11.发现/就诊日期*:12.就诊单位:一般为村卫生室或乡镇卫生院13.主要临床经过*:请简要填写;以下每行均要填写,每行请选填其中一种发热(腋温℃)*局部红肿(直径cm) *局部硬结(直径cm) *14.初步临床诊断:共分为20大类,33种,除第19类外都要填写个案调查表:(1)无菌性脓肿、(2)热性惊厥、(3)过敏反应(分为:过敏性休克、过敏性皮疹、过敏性紫癜、血小板减少性紫癜、局部过敏坏死反应、血管性水肿、荨麻疹、麻疹猩红热样皮疹、斑丘疹、喉头水肿)、(4)多发性神经炎、(5)格林巴利综合征、(6)臂丛神经炎(7)癫痫、(8)脑病、(9)脑炎和脑膜炎、(10)疫苗相关麻痹型脊髓灰质炎、(11)卡介苗淋巴结炎、(12)卡介苗骨髓炎、(13)全身散播性卡介苗感染、(14)局部化脓性感染(分为:局部脓肿、淋巴管炎和淋巴结炎、蜂窝织炎)(15)全身化脓性感染(分为:毒血症、败血症、脓毒血症)、(16)晕厥、(17)癔症、(18)中毒性休克综合征、(19)发热/红肿/硬结、(20)其它15是否住院*:按实际情况填写:是或否16. 病人转归*:1痊愈2好转3 后遗症4死亡5不详17. 初步分类*:1一般反应2待定18. 反应获得方式:1被动监测2主动监测19. 报告日期*:一般与第11项发现就诊日期为同一天或不超48小时。
狂犬病群体性疑似预防接种异常反应登记表

局局
组反终
/
应
发 部 部结
姓性生苗种组种种种种发 否人 告查 热
编
就
获
腋
名别日批日织剂剂途部生
住转
日日
温 ℃
(
红 肿
直 径
硬 结
织应临
直论
径
级分床
码
诊
得
Байду номын сангаас
的
( cm)*
( cm)*
)*
* * 期号期形次量径位日 院归 期期
别类诊
日
方
组
* * * 式* * * * 期 * *
**
期
式
**断 织
*
*
*
*
*
附表 2
群体性疑似预防接种异常反应登记表
群体性疑似预防接种异常反应编码: 县国标码□□□□□□-首例发生年份□□□□-编
号□□
发生地区:
疫苗名称*:
生产企业*:
规格(剂/支或粒) :
有无批签发合格
证: 接种单位:
接种人数*:
反应发生人数*:
报告单位*:
报告人:
联
系电话:
发
作
接
反
现
反
最 出
出疫接种接接接接应 是病 报调
35
说明:* 为关键项目。
36
疑似预防接种异常反应调查表

疑似预防接种异常反应个案调查表一、基本情况1 县国标码□□□□□□2 发生年份 2010-8-20 □□□□3 编号□□□□4 姓名徐康5 性别1男 2女1□6 出生日期 2009 年 01 月 16 日□□/□□/□□7 年龄 1 周岁 7 月龄□□/□□8 职业□□9 现住址谯城区五马乔口乔西村10 联系电话 598371811 监护人姓名徐金荣二、就诊与报告情况1 发生时间 2010 年 08月 20 日 09 时 40分□□/□□/□□□□/□□2 就诊时间 2010 年 08 月 20日 09 时 10 分□□/□□/□□□□/□□3 就诊单位汤陵社区卫生服务中心4 报告时间 2010 年 08 月 20 日 11 时 20 分□□/□□/□□□□/□□5 报告单位汤陵社区卫生服务中心6 报告人孟静松三、临床资料1 临床经过(包括症状、体征、实验室检查、辅助检查和治疗等)患儿注射甲肝疫苗后观察30分钟后离院,10分钟后返回,寒战、口唇青紫、哭闹不停,及时给予地米5mg、扑尔敏1/2支、吸氧,观察30分钟后缓解,转入小儿科观察处理。
2 初步临床诊断甲肝疫苗过敏3 是否住院1是 2否 2如果是,医院名称病历号住院日期年月日□□/□□/□□出院日期年月日□□/□□/□□4 病人转归1治愈 2好转 3后遗 4死亡 5 不详 1 如死亡,死亡时间年月日时分□□/□□/□□□□/□□病理解剖1是 2否□解剖结论四、既往病史和家族病史1 接种前患病史1有 2无 3不详 2如有,疾病名称1 2 接种前精神状况1活泼 2萎靡 3忧郁 4紧张5恐惧 6其它3 接种前过敏史1有 2无 2如有,过敏物名称4 家庭成员中有无遗传病/传染病/精神病/癫痫/过敏/惊厥等1有 2无 3不详 1 如有,疾病名称五、既往接种史和异常反应史1 既往接种疫苗名称百白破2 既往发生异常反应1有 2无 23 如有异常反应,反应发生日期年月日□□/□□/□□接种疫苗名称临床诊断诊断单位六、可疑疫苗接种情况(按最可疑的疫苗顺序填写)(一) 可疑疫苗疫苗1 疫苗2 疫苗3 疫苗4(二) 稀释液疫苗1 疫苗2 疫苗3 疫苗4(三) 注射器疫苗1 疫苗2 疫苗3 疫苗4(四) 接种人员与操作疫苗1 疫苗2 疫苗3 疫苗4七、其它情况1 接种同批次疫苗其他人群的发病情况:2 当地类似症状疾病的发病情况:八、结论1 调查组结论建议2 异常反应诊断小组结论3 最终临床诊断□□4 反应分类1一般反应 2异常反应 3疫苗质量事故4 实施差错事故 5偶合症6 心因性反应 7不明原因 8待定□5 反应与可疑疫苗的因果关联程度1肯定 2极可能 3 很可能4 可能 5 不太可能 6 无关7 不能分类 8 待定6 是否为群体性反应1是 2否□群体性反应编码□□□□□□□□调查单位(公章)调查人员(签字)调查日期年月日□□/□□/□□疑似异常反应个案调查表填表说明一、基本情况1.县国标码:填写报告单位所在县(市、区)的6位国标码,例如“110101”。
疑似预防接种异常反应登记表
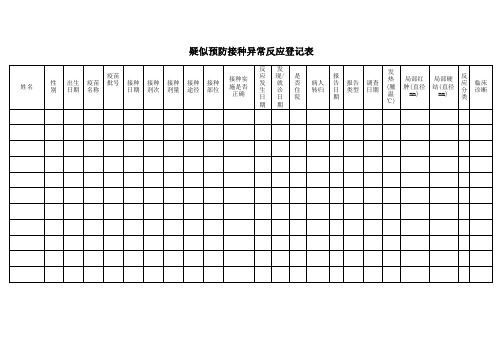
疑似预防接种异常反应登记表
姓名
性别
出生日期
疫苗名称
疫苗批号
接种日期
接种剂次
接种剂量
接种途径
接种部位
接种实施是否正确
反应发生日期
发现/就诊日期
是否住院
病人转归
报告日期
报告类型
调查日期
发热(腋温℃)
局部红肿(直径mm)
局部硬结(直径m似异常反应监测月报表
姓名
性别
出生日期
接种疫苗的名称
接种疫苗批号
针次
反应发生日期
发现/就诊日期
是否住院
局部红肿(直径)
局部硬结(直径)
发热
(腋温)
过敏性皮疹
其它反应(注明)
报告
日期
调查
日期
初步诊断
无菌性化脓
报告单位:报告人:报告时间:年月日
2012年疑似预防接种反应个案调查表

附表3疑似预防接种异常反应个案调查表一、基本情况1.编码* □□□□□□□□□□□□□□2.姓名* 侃振3.性别* 1男2女1□4.出生日期* 2006 年06 月19 日□□□□/□□/□□5.职业幼托儿童□□6.现住址段店明德小学7.联系电话8.监护人二、既往史1.接种前患病史1有2无3不详2□如有,疾病名称2.接种前过敏史1有2无3不详2□如有,过敏物名称3.家族患病史1有2无3不详2□如有,疾病名称4.既往异常反应史1有2无3不详2□如有,反应发生日期年月日□□□□/□□/□□接种疫苗名称临床诊断三、可疑疫苗情况(按最可疑的疫苗顺序填写)疫苗1 疫苗2 疫苗31.疫苗名称* 脊髓灰质炎2.规格(剂/支或粒) 1粒3.生产企业* 北京天坛4.疫苗批号* 20101148-65.有效日期2012.11.226.有无批签发合格证书有7.疫苗外观是否正常正常8.保存容器9.保存温度(℃) 410.送检日期11.检定结果是否合格四、稀释液情况疫苗1 疫苗2 疫苗31.稀释液名称2.规格(ml/支)3.生产企业4.稀释液批号5.有效日期6.稀释液外观是否正常7.保存容器8.保存温度(℃)9.送检日期10.检定结果是否合格五、注射器情况疫苗1 疫苗2 疫苗31.注射器名称2.注射器类型3.规格(ml/支)4.生产企业5.注射器批号6.有效日期7.送检日期8.检定结果是否合格六、接种实施情况疫苗1 疫苗2 疫苗31.接种日期* 2012.4.282.接种组织形式* 门诊日常接种3.接种剂次* 44.接种剂量(ml或粒)* 1粒5.接种途径* 口服6.接种部位*7.接种单位段店卫生院8.接种地点段店卫生院三楼9.接种人员汪双兰10.有无预防接种培训合格证有11.接种实施是否正确七、临床情况1.反应发生日期* 2012 年 4 月28 日□□□□/□□/□□2.发现/就诊日期* 2012 年4 月28 日□□□□/□□/□□3.就诊单位市一医院4.主要临床经过* 4月28日晚9时发热发热(腋温℃)* 1 37.1-37.5 2 37.6-38.5 3 ≥38.6 4无3□局部红肿(直径cm) * 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□局部硬结(直径cm)* 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□5.初步临床诊断疑似预防接种异常反应□□6.是否住院* 1是2否2□如是,医院名称病历号住院日期年月日□□□□/□□/□□出院日期年月日□□□□/□□/□□7.病人转归* 1痊愈2好转3 后遗症4死亡5不详2□如死亡,死亡日期年月日□□□□/□□/□□是否进行尸体解剖1是2否□尸体解剖结论八、其他有关情况1.疫苗流通情况及接种组织实施过程市疾控中心统一运转疫苗,到预防接种门诊接种2.同品种同批次疫苗接种剂次数及反应发生情况无异常3.当地类似疾病发生情况九、报告及调查情况1.反应获得方式1被动监测2主动监测2□2.报告日期* 2012 年 4 月29 日□□□□/□□/□□3.报告单位* 段店卫生院4.报告人高晓晴5.联系电话6.调查日期* 2012 年 4 月29 日□□□□/□□/□□7.调查单位段店卫生院8.调查人高晓晴十、结论1.做出结论的组织* 1医学会2调查诊断专家组3疾控机构4医疗机构5接种单位□组织级别* 1省级2市级3县级4乡级5村级□2.反应分类* 1一般反应2异常反应3疫苗质量事故4接种事故5偶合症6心因性反应7待定□如为异常反应,机体损害程度_____________(参照《医疗事故分级标准》)□3.最终临床诊断* □□4.是否严重疑似预防接种异常反应1是2否□是否群体性疑似预防接种异常反应1是2否□如是,群体性疑似预防接□□□□□□□□□□□□种异常反应编码说明:* 为关键项目。
山东省疑似预防接种异常反应调查笔录资料

山东省疑似预防接种异常反应调查表**市预防接种异常反应调查诊断专家组制2015年2月制山东省疑似预防接种异常反应调查表一、报告情况接种疫苗名称、剂次、接种时间、发生反应时间和人数、主要临床特征、初步诊断和诊断单位等。
山东省疑似预防接种异常反应调查表二、家属调查笔录(四)本次疫苗接种情况(五)受种者发病及治疗情况被调查人签字:调查人签字:附件:儿童预防接种证复印件;诊疗病历和各种辅助检查报告复印件山东省疑似预防接种异常反应调查表三、接种单位调查笔录山东省疑似预防接种异常反应调查表山东省疑似预防接种异常反应调查表调查时间:四、就诊单位调查笔录附件一:疑似预防接种异常反应调查告知书家长同志:您好!根据《疫苗流通和预防接种管理条例》、《预防接种工作规范》、《预防接种异常反应鉴定办法》和《山东省预防接种异常反应补偿办法(试行)》等免疫规划相关法律、法规和技术规范,现将预防接种异常反应知识政策及调查诊断相关事宜向您介绍如下:一、关于预防接种异常反应预防接种异常反应,是指合格的疫苗在实施规范接种过程中或者实施规范接种后造成受种者机体组织器官、功能损害,相关各方均无过错的药品不良反应。
以下情形不属于预防接种异常反应:(一)因疫苗本身特性引起的接种后一般反应;(二)因疫苗质量不合格给受种者造成的损害;(三)因接种单位违反预防接种工作规范、免疫程序、疫苗使用指导原则、接种方案给受种者造成的损害;(四)受种者在接种时正处于某种疾病的潜伏期或者前驱期,接种后偶合发病;(五)受种者有疫苗说明书规定的接种禁忌,在接种前受种者或者其监护人未如实提供受种者的健康状况和接种禁忌等情况,接种后受种者原有疾病急性复发或者病情加重;(六)因心理因素发生的个体或者群体的心因性反应。
二、关于预防接种异常反应诊断预防接种异常反应相关的诊断,由预防接种异常反应调查诊断专家组做出。
任何医疗单位或个人均不得做出预防接种异常反应诊断。
对预防接种异常反应调查诊断结论有争议时,可以在收到预防接种异常反应调查诊断结论之日起60日内,向市医学会申请进行预防接种异常反应鉴定,并提交鉴定所需的材料。
疑似预防接种异常反应个案调查表

疑似预防接种异常反应个案调查表一、基本情况1.编码*2.姓名*3.性别* 1男 2女4.是否孕妇或哺乳期妇女1孕妇 2哺乳期妇女 3均否5.出生日期* 年月日6.职业7.现住址8.联系电话9.监护人二、既往史1.接种前患病史1有 2无 3不详如有,疾病名称2.接种前过敏史1有 2无 3不详如有,过敏物名称3.家族患病史1有 2无 3不详如有,疾病名称4.既往异常反应史1有 2无 3不详如有,反应发生日期年月日接种疫苗名称临床诊断三、可疑疫苗情况(按最可疑的疫苗顺序填写)疫苗1 疫苗2 疫苗31.疫苗名称*2.规格(剂/支或粒)3.生产企业*4.疫苗批号*5.有效日期6.有无批签发合格证书7.疫苗外观是否正常8.保存容器9.保存温度(℃)10.送检日期11.检定结果是否合格四、稀释液情况疫苗1 疫苗2 疫苗31.稀释液名称2.规格(ml/支)3.生产企业4.稀释液批号5.有效日期6.稀释液外观是否正常7.保存容器8.保存温度(℃)9.送检日期10.检定结果是否合格五、注射器情况疫苗1 疫苗2 疫苗31.注射器名称2.注射器类型3.规格(ml/支)4.生产企业5.注射器批号6.有效日期7.送检日期8.检定结果是否合格六、接种实施情况疫苗1 疫苗2 疫苗31.接种日期*2.接种组织形式*3.疫苗类型4.接种剂次*5.接种剂量(ml或粒)*6.接种途径*7.接种部位*8.接种单位9.接种地点10.接种人员11.有无预防接种培训合格证11.接种实施是否正确七、临床情况1.反应发生日期* 年月日接种至出现症状的间隔天 . 小时2.发现/就诊日期* 年月日3.就诊单位4.主要临床经过*发热(腋温℃)* ℃ 1 37.1-37.5 2 37.6-38.5 3 ≥38.6 局部红肿(直径cm) * cm 1 ≤2.5 2 2.6-5.0 3 >5.0局部硬结(直径cm)* cm 1 ≤2.5 2 2.6-5.0 3 >5.0其它症状□哭闹□嗜睡□食欲不振□乏力□头痛□头晕□皮疹□肌痛□关节痛□出汗□瘙痒□麻木□胸闷□心悸□面色苍白□咳嗽□流涕□咽红□恶心□呕吐□腹痛□腹泻□其它5.初步临床诊断其它初步临床诊断6.是否住院治疗* 1是 2否如是,医院名称病历号住院日期年月日出院日期年月日7.病人转归* 1痊愈 2好转 6 加重 3 后遗症 4死亡 5不详如死亡,死亡日期年月日是否进行尸体解剖1是 2否尸体解剖结论八、其他有关情况1.疫苗流通情况及接种组织实施过程2.同品种同批次疫苗接种剂次数及反应发生情况3.当地类似疾病发生情况九、报告及调查情况1.反应获得方式1被动监测 2主动监测2.报告日期* 年月日3.报告单位*4.报告人5.联系电话6.调查日期* 年月日7.调查单位8.调查人十、结论1.做出结论的组织* 1医学会 2调查诊断专家组 3疾控机构组织级别* 1省级 2市级 3县级2.初步分类1一般反应 2待定3.反应分类* 1一般反应 2异常反应 3疫苗质量事故 4接种事故5偶合症 6心因性反应 7待定如为异常反应,机体损害程度* 参照《医疗事故分级标准》4.最终临床诊断主要临床诊断*其他临床诊断5.是否严重AEFI* 1是 2否是否群体性AEFI* 1是 2否如是,群体性AEFI编码6.是否给予异常反应补偿1是 2否如是,补偿金额(元) .补偿时间年月日7.是否给付其它费用1是 2否如是,给付金额(元) .给付日期年月日8.录入时间年月日9.最新修改时间年月日10.录入单位11.录入人说明: * 为关键项目。
预防接种疑似异常反应调查和诊断

调查
诊断 小结
谁报告? 报告什么? 向谁报告?
预防接种疑似异常反应调查和诊断
背景
报 告①
调查
诊断 小结
----各级各类医疗机构、疾病预防控制机 构和接种单位及其执行职务的人员 ----发现预防接种异常反应、疑似预防接 种异常反应或者接到相关报告, ----应当及时向所在地的县级卫生行政部 门、药品监督管理部门报告。
--预《防接预种防疑似接异常种反应异调常查和反诊断应鉴定办法》第十二条
背景
报告 调 查⑨
诊断 小结
现场调查和收集相关资料⑵
①疫苗:疫苗进货渠道、供货单位的资质证明、疫苗购销记 录;疫苗运输条件和过程,观察目前疫苗贮存条件和冰箱温度记 录、冰箱是否存放其他物品、疫苗送达基层接种单位前的贮存情 况;接种疫苗的种类、生产单位、批号、出厂日期、有效期、来 源、领取日期,同批号疫苗的感观性状。
②接种服务组织形式、接种现场情况、接种时间和地点、接 种单位和接种人员的资质。
③接种实施情况,接种部位、途径、剂次和剂量,打开的疫 苗何时用完;安全注射情况、注射器材的来源、注射操作是否规 范。
④接种同批次疫苗其他人员的反应情况,当地相关疾病的发
病情况等。
预防接种疑似异常反应调查-和-《诊断预防接种工作规范》
背景
报告 调 查⑤
诊断 小结
核实报告
根据报告内容,核实出现反应者的基本情 况、主要临床表现、初步诊断、疫苗接种情况、 发生反应的时间和人数等,完善相关资料,做 好深入调查的准备工作。
--《预防接种工作规范》
预防接种疑似异常反应调查和诊断
背景
报告 调 查⑧
诊断 小结
现场调查和收集相关资料⑴
访视病人与临床检查:现场访视病人,并进行深 入地调查和临床检查。主要了解病人的
疑似预防接种异常反应(AEFI)个案报告卡

表1 疑似预防接种异常反应(AEFI)个案报告卡
1.编码□□□□□□□□□□□□□□
2.姓名*
3.性别* 1男 2女□
4.出生日期* 年月日□□□□/□□/□□
5.职业□□
6.现住址
7.联系电话
8.监护人
10.反应发生日期* 年月日□□□□/□□/□□
11.发现/就诊日期* 年月日□□□□/□□/□□
12.就诊单位
13.主要临床经过*
发热(腋温℃)* 1 37.1-37.5 2 37.6-38.5 3 ≥38.6 4 无□局部红肿(直径cm)* 1 ≤2.5 2 2.6-5.0 3 >5.0 4 无□局部硬结(直径cm)* 1 ≤2.5 2 2.6-5.0 3 >5.0 4 无□
14.初步临床诊断□□
15.是否住院* 1是 2否□
16.病人转归* 1 痊愈 2 好转 3 后遗症 4 死亡 5 不详□
17.初步分类* 1 一般反应 2 待定□
18.反应获得方式1被动监测报告 2主动监测报告□
19.报告日期* 年月日□□□□/□□/□□
20.报告单位*
21.报告人
22.联系电话
说明:① * 为关键项目;②按照“AEFI个案调查表填表说明”的有关项目填写。
1
2。
预防接种副反应个案调查表

预防接种副反应个案调查表一、基本情况1.县国标码□□□□□□2.发生年度□□□□3.编码:□□□□4.姓名:___________5.性别:(1) 男 (2) 女□6.出生日期:年月日□□□□/□□/□□年龄:周岁月龄□□7.职业:___________ □□(1)幼托儿童;(2)散居儿童;(3)大学生;(4)中学生;(5)小学生;(6)教师(7)保育员及保姆;(8)餐饮食品业;(9)商业服务;(10)医务人员(11)工人(12)民工(13)农民;(14)牧民;(15)渔(船)民;(16)干部职员;(17)离退人员;(18)家务及待业;(19)不详;(20)其他(请注明)8.监护人姓名:___________9.现住址:_______________________________________10.联系电话:_____________二、报告情况1.发生时间:年月日时分□□□□/□□/□□/□□/□□2.报告时间:年月日时分□□□□/□□/□□/□□/□□3.报告单位:_____________________________________4.报告人:________________三、疫苗接种情况1.接种疫苗名称批号生产厂家失效期2.疫苗保存条件3.接种单位接种人姓名是否受过培训:是□否□4.接种时间接种针次接种剂量接种部位途径5.接种时操作情况(包括使用注射器材、安全注射、接种操作等)四、既往接种史1.最后一次接种该疫苗时间年月日□□□□/□□/□□2.有无反应(如有反应详细叙述如下)3.曾接种其他疫苗名称4.如有反应详细叙述如下五、既往病史和家族史1.既往曾患过何种疾病2.家庭中有何遗传、传染性疾病六、症状和体征1.病史(出现反应的时间和主要症状与休征)2.实验室结果3.曾在何处诊断和治疗,诊断和治疗结果4.接种该批号疫苗出现反应的人数和表现5.病例的转归:(1)治愈.(2)好转;(3)未愈;(4)死亡; □(5)其它(请注明)7.如病例死亡:7.1 死亡时间:年月日时分□□□□/□□/□□/□□/□□7.2死亡原因:__________7.3是否病理解剖: (1)是;(2)否□7.4解剖结论:_______________________________________8.调查者初步意见调查单位(公章):。
预防接种副反应个案调查表

附件2:预防接种副反应个案调查表调查单位(公章):调查人员(签字):_______调查日期:.一、基本情况1.姓名:________性别:1男/2女出生日期:年月日年龄:周岁月龄2.职业:___________□〔职业分:幼托儿童、散居儿童、大学生、中学生、小学生、教师、保育员及保姆、餐饮食品业、商业服务、医务人员、工人、民工、农民、牧民、渔(船)民、干部职员、离退人员、家务及待业、其他(请注明)、不详〕3.监护人姓名:______现住址:________________________联系电话:_____________二、报告情况1.发生时间:年月日时分□□□□□□□□□□□□2.报告时间:年月日时分□□□□□□□□□□□□3.报告单位:_____________________________报告人:________________三、现病史1.主要症状:2.体征:3.实验室及其它辅助检查结果:4.临床诊断:5.治疗经过:6.病例的转归:1治愈/2好转/3未愈/4死亡/5其它(请注明)7.如病例死亡:7.1 死亡时间:年月日时 7.2死亡原因:_______7.3是否病理解剖: 1是/2否□7.4解剖结论:____________________四、既往史和家族史1.接种前是否患有疾病:1无/2有□疾病名称_______________________2.接种前精神状况:1活泼/2萎靡/3忧郁/4紧张/5恐惧/6其它__ □3.有无过敏史:1无/2有□过敏物质______________________4.家族史:家族是否有下列疾病?4.1遗传病 1有/2无病名__________4.2精神病 1有/2无病名___________ 4.3癫痫 1有/2无病名__________4.4过敏 1有/2无病名__________4.5惊厥 1有/2无病名__________4.6其它 1有/2无病名___________五. 接种史1.以往接种疫苗名称_______________________________________________________2.接种疫苗反应史:1有/2无□如有,详细描述:六、疫苗情况生产企业批号有效日期来源名称规格(人份/支.粒)接种剂量(ml/粒)针次接种时间接种部位接种途径外观保存容器保存温度(°C)有无批签发合格证书疫苗是否送检送检时间检定单位检定结果注:接种疫苗名称应填写通用名;接种部位指1上臂三角肌、2臀部、3大腿前内侧、4其它部位;接种途径指:肌内、皮下、皮内、口服、其它(请说明);外观是指判断后:正常、不正常。
疑似预防接种异常反应(AEFI)报告记录表(各级通用)

二、群体性AEFI报告记录表
编码
发生
地区
接种疫苗名称
接种
单位
接种
人数
反应发生人数
首例接种日期
末例接种日期
首例发生日期
末例发生日期
主要临床经过
初步临床诊断
报告
日期
报告
单位
报告人
疑似预防接种异常反应(
一、AEFI个案报告记录表
姓名
性别
出生
日期
现住址
监护人
联系
电话
接种疫苗名称
接种
日期
反应发日期
发现/
就诊
日期
发现/就诊
单位
主要临床经过
初步临床诊断
报告
日期
报告
单位
报告人
填写说明:此表用于医疗机构、接种单位、疾病预防控制机构的AEFI登记与报告记录;较严重的AEFI个案还应填写AEFI个案调查表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
疑似预防接种异常反应个案调查表一、基本情况1 县国标码□□□□□□2 发生年份□□□□3 编号□□□□4 姓名5 性别1男 2女□6 出生日期年月日□□/□□/□□7 年龄周岁月龄□□/□□8 职业□□9 现住址10 联系电话11 监护人姓名二、就诊与报告情况1 发生时间年月日时分□□/□□/□□□□/□□2 就诊时间年月日时分□□/□□/□□□□/□□3 就诊单位4 报告时间年月日时分□□/□□/□□□□/□□5 报告单位6 报告人三、临床资料1 临床经过(包括症状、体征、实验室检查、辅助检查和治疗等)2 初步临床诊断3 是否住院1是 2否□如果是,医院名称病历号住院日期年月日□□/□□/□□出院日期年月日□□/□□/□□4 病人转归1治愈 2好转 3后遗 4死亡5 不详□如死亡,死亡时间年月日时分□□/□□/□□□□/□□病理解剖1是 2否□解剖结论四、既往病史和家族病史1 接种前患病史1有 2无 3不详□如有,疾病名称2 接种前精神状况1活泼 2萎靡 3忧郁 4紧张□5恐惧 6其它3 接种前过敏史1有 2无□如有,过敏物名称4 家庭成员中有无遗传病/传染病/精神病/癫痫/过敏/惊厥等1有 2无 3不详□如有,疾病名称五、既往接种史和异常反应史1 既往接种疫苗名称2 既往发生异常反应1有 2无□3 如有异常反应,反应发生日期年月日□□/□□/□□接种疫苗名称临床诊断诊断单位六、可疑疫苗接种情况(按最可疑的疫苗顺序填写)(一) 可疑疫苗疫苗1 疫苗2 疫苗3 疫苗4(二) 稀释液疫苗1 疫苗2 疫苗3 疫苗4(三) 注射器疫苗1 疫苗2 疫苗3 疫苗4(四) 接种人员与操作疫苗1 疫苗2 疫苗3 疫苗4七、其它情况1 接种同批次疫苗其他人群的发病情况:2 当地类似症状疾病的发病情况:八、结论1 调查组结论建议2 异常反应诊断小组结论3 最终临床诊断□□4 反应分类1一般反应 2异常反应 3疫苗质量事故4 实施差错事故 5偶合症6 心因性反应 7不明原因 8待定□5 反应与可疑疫苗的因果关联程度1肯定 2极可能 3 很可能4 可能 5 不太可能 6 无关7 不能分类 8 待定6 是否为群体性反应1是 2否□群体性反应编码□□□□□□□□调查单位(公章)调查人员(签字)调查日期年月日□□/□□/□□疑似异常反应个案调查表填表说明一、基本情况1.县国标码:填写报告单位所在县(市、区)的6位国标码,例如“110101”。
2.发生年份:填写疑似预防接种异常反应发生的4位年份,不是反应报告或调查年份。
“发生年份”应与“发生时间”的年份一致。
3.编号:填写反应的4位流水号,如0201。
“县国标码+发生年份+编号”可生成反应的唯一编码,即ID编码。
4.姓名:填写病人真实姓名,如果婴儿尚未取名,可填写父或母姓名+“子”或“女”。
5.性别:填写代码,1-男 2-女。
6.出生日期:按年月日格式填写病人的公历日期。
7.年龄:仅当出生日期不详时填写此项;填写病人的实足年龄和实足月龄。
8.职业:填写代码,01-幼托儿童 02-散居儿童 03-大学生 04-中学生 05-小学生06-教师 07-保育员及保姆 08-餐饮食品业 09-商业服务 10-医务人员 11-工人 12-民工 13-农民 14-牧民 15-渔(船)民16-干部职员 17-离退人员 18-家务及待业 19-其他。
如果为“19-其它”,需注明何种职业。
9.现住址:填写病人当前的家庭住址,包括省、市、县、乡、村各级名称和门牌号。
10.联系电话:填写病人的联络电话,如为儿童,填写其监护人电话,号码内包括地区码。
11.监护人姓名:如果病人为儿童,填写其监护人姓名。
二、就诊与报告情况1.发生时间:指反应的症状最早出现时间,按“年月日时分”格式填写,例如“2005年5月10日10时20分”。
2.就诊时间:指诊为疑似异常反应的最早就诊时间。
按“年月日时分”格式填写。
3.就诊单位:指在就诊时间就诊的医疗卫生机构名称。
4.报告时间:指反应最早上报的时间,按“年月日时分”格式填写。
5.报告单位:填写反应报告的医疗机构、卫生机构等名称,如“某某医院”等。
6.报告人:填写反应报告人的真实姓名。
三、临床资料1.临床经过:按时间顺序描述反应的发生经过,包括临床症状、阳性体征、实验室检查(如血液、尿液、粪便、脑脊液等)结果、辅助检查(如X线、心电图、超声波、CT等)结果以及反应的治疗手段和效果等情况。
2.初步临床诊断:必须是临床诊断病名或主要症状诊断。
按“八、结论”中的“最终临床诊断”所列代码填写。
如果为“其它”,需注明是何种临床诊断。
3.是否住院:填写代码,1-是 2-否。
如果是,还需填写以下项目:医院名称:填写住院医院名称。
病历号:填写住院医院的病历号。
住院日期:按“年月日”格式填写。
出院日期:按“年月日”格式填写。
4.病人转归:填写代码,1-治愈 2-好转 3-后遗症 4-死亡 5-不详。
如果病人死亡,还需填写以下项目:死亡时间:按“年月日时分”格式填写。
病理解剖:指是否对尸体进行病理解剖,填写代码,1-是 2-否。
解剖结论:按解剖诊断书上的死因诊断结论填写。
四、既往病史和家族病史1.接种前患病史:接种前1个月内有无患过或现患某种疾病(如发热、感冒、传染病、遗传病、慢性病等),填写代码,1-有 2-无 3-不详。
如果有,需填写所患全部疾病的名称。
2.接种前精神状况:填写代码,1-活泼 2-萎靡 3-忧郁 4-紧张 5-恐惧 6-其它。
如果为“6-其它”,需注明何种精神状况。
3.接种前过敏史:填写代码,1-有 2-无。
如果有,需填写过敏物(如疫苗、血清、药物、花粉、食物等)的名称。
4.家庭成员中有无遗传病/传染病/精神病/癫痫/过敏/惊厥等:指三代以内的直系亲属成员中有无这些疾病史,填写代码,1-有 2-无 3-不详。
如果有,需填写疾病名称。
五. 既往接种史和异常反应史1.既往接种疫苗名称:填写既往接种疫苗的常用英文缩写,如BCG、OPV、DPT、MV、HepB、DT、Hib、MMR等,如无英文缩写,用中文简称,如乙脑灭活、风腮二联等。
2.既往发生异常反应:在既往接种的疫苗中有无发生异常反应,填写代码,1-有 2-无。
3.如果既往接种疫苗中有异常反应,需填写:反应发生日期:按“年月日”格式填写。
接种疫苗名称:指发生异常反应的既往接种疫苗名称。
临床诊断:填写临床诊断的病名或主要症状诊断。
诊断单位:作出临床诊断的医疗、卫生等机构名称。
六、可疑疫苗接种情况疑似异常反应通常涉及一种疫苗,但个别情况下病人可能同时或先后接种数种疫苗(一般最多4种)。
因此,必须对所有的可疑疫苗进行调查,按最可疑的疫苗顺序填写此项内容,与反应根本无关的疫苗不必填写。
例如,同时接种了OPV(口服)、DPT(左臂)和HepB(右臂)后,在左臂注射部位出现无菌化脓,则可以完全排除系OPV和HepB引起,只填写DPT即可;但如果出现全身过敏性皮疹,则三种疫苗均有可能引起,都应填写。
(一) 可疑疫苗1.疫苗名称:按下列代码填写。
编码疫苗全称编码疫苗全称01 皮内注射用卡介苗36 口服轮状病毒活疫苗02 重组乙型肝炎疫苗(CHO细胞) 37 23价肺炎球菌多糖疫苗03 重组乙型肝炎疫苗(酵母) 38 气管炎疫苗04 脊髓灰质炎减毒活疫苗(人二倍体细胞) 39 兰菌净细菌溶解物05 脊髓灰质炎减毒活疫苗(猴肾细胞) 40 人用狂犬病疫苗(Vero细胞)06 脊髓灰质炎灭活疫苗41 冻干人用狂犬病疫苗(Vero细胞)07 吸附百白破联合疫苗42 人用狂犬病疫苗(地鼠肾细胞)08 吸附无细胞百白破联合疫苗43 Ⅰ价肾综合征出血热灭活疫苗09 吸附百日咳白喉联合疫苗44 Ⅱ价肾综合征出血热灭活疫苗10 吸附白喉破伤风联合疫苗45 双价肾综合征出血热灭活疫苗11 吸附白喉破伤风联合疫苗(成人及青少年用) 46 伤寒疫苗12 吸附白喉疫苗47 伤寒Vi多糖疫苗13 吸附白喉疫苗(成人及青少年用) 48 伤寒副伤寒甲联合疫苗14 吸附破伤风疫苗49 伤寒副伤寒甲乙联合疫苗15 麻疹减毒活疫苗50 口服福氏宋内痢疾双价活疫苗16 腮腺炎减毒活疫苗51 钩端螺旋体疫苗17 风疹减毒活疫苗(人二倍体细胞)52 皮肤划痕用鼠疫活疫苗18 风疹减毒活疫苗(兔肾细胞)53 皮肤划痕人用炭疽活疫苗19 麻疹腮腺炎风疹联合减毒活疫苗54 皮肤划痕人用布氏菌活疫苗20 麻疹腮腺炎联合减毒活疫苗55 霍乱疫苗21 麻疹风疹联合减毒活疫苗56 乙型肝炎人免疫球蛋白22 腮腺炎风疹联合减毒活疫苗57 冻干乙型肝炎人免疫球蛋白23 A群脑膜炎球菌多糖疫苗58 白喉抗毒素24 A+C群脑膜炎球菌多糖疫苗59 冻干白喉抗毒素25 乙型脑炎减毒活疫苗60 破伤风抗毒素26 乙型脑炎灭活疫苗61 冻干破伤风抗毒素27 甲型肝炎减毒活疫苗62 破伤风人免疫球蛋白28 冻干甲型肝炎减毒活疫苗63 冻干破伤风人免疫球蛋白29 甲型肝炎灭活疫苗64 抗狂犬病血清30 甲肝乙肝联合疫苗65 狂犬病人免疫球蛋白31 流行性感冒全病毒灭活疫苗66 冻干狂犬病人免疫球蛋白32 流行性感冒裂解疫苗67 结核菌素纯蛋白衍生物33 流行性感冒亚单位疫苗68 卡介菌纯蛋白衍生物34 冻干水痘减毒活疫苗69 锡克试验毒素35 b型流感嗜血杆菌多糖结合疫苗70 其它2.规格:按“剂/支(粒)”填写疫苗的规格,只填数字。
例如DPT为4剂/支,填写“4”即可, OPV为1剂/粒,填写“1”即可。
3.生产企业:按下列代码填写。
编码企业全称编码企业全称01 中国医学科学院医学生物学研究所24 大连汉信生物制药有限公司02 北京生物制品研究所25 大连金港安迪生物制品有限公司03 北京天坛生物制品股份有限公司26 吉林亚泰生物药业股份有限公司04 北京科兴生物制品有限公司27 山东省生物制品研究所05 北京高科生命科学技术开发公司28 常州药业延申生物技术有限公司06 北京祥瑞生物制品有限公司29 浙江普康生物技术股份有限公司07 北京华尔盾生物技术公司30 浙江天元生物药业股份有限公司08 上海生物制品研究所31 浙江卫信生物药业有限公司09 上海莱士血制品有限公司32 宁波荣安生物药业有限公司10 武汉生物制品研究所33 华北制药金坦生物技术股份有限公司11 成都生物制品研究所34 河南普新生物工程有限公司12 昆明中国医学科学院医学生物学研究所35 陕西省生物制品研究所13 兰州生物制品研究所36 深圳康泰生物制品股份有限公司14 长春生物制品研究所37 深圳市卫武光明生物制品有限公司15 长春长生生物科技股份有限公司38 海南省生物制品研究所16 辽宁生物技术公司39 (德国)凯龙-贝林公司17 辽宁成大生物技术有限公司40 (美国)默沙东公司18 辽宁依生生物技术有限公司41 (美国)葛兰素史克生物制品公司19 沈阳百奥生物技术有限责任公司42 (法国)赛诺菲-巴斯德公司20 沈阳安迪生物高科技公司43 (瑞士)博尔纳生物技术有限公司21 大连高新生物制药有限公司44 (意大利)贝斯迪大药厂22 大连经济技术开发区松辽生物制品厂45 其它23 大连昆阳制药有限公司4.批号:填写接种疫苗安瓿或包装上所标名的批号。
