优选化学工艺学烃类选择氧化
第7章 烃类选择性氧化 《化学工艺学(第二版)》米镇涛 主编

7.1.1.2 氧化剂的选择
要在烃类或其他化合物分子中引入氧,需采用氧化剂,比较常见的
有空气和纯氧、过氧化氢和其他过氧化物等,空气和纯氧使用最
为普遍。
7.1.2 烃类选择性氧化过程的分类
就反应类型而言,选择性氧化可分为以下三种。
① 碳链不发生断裂的氧化反应。如烷烃、烯烃、环烷烃和烷基
芳烃的饱和碳原子上的氢原子与氧进行氧化反应,生成新的官 能团,烯烃氧化生成二烯烃、环氧化物等。
7.2.2.2 乙烯配位催化氧化制乙醛
(1)反应原理
Wacker法乙烯氧化制乙醛是一个典型的配位催化
氧化反应,过程包括以下三个基本化学反应。
① 烯烃的羰化反应。烯烃在氯化钯水溶液中氧化成醛,并析出金
属钯。
CH2 CH2+PdCl2+H2O CH3CHO+Pd+2HCl(7-26)
在这个反应里,乙醛分子内的氧来自水分子。
(1)溶剂的影响
(2)杂质的影响 (3)温度和氧气分压的影响 (4)氧化剂
用量和空速的影响
7.2.1.4 对二甲苯氧化制备对苯二甲酸
(1)氧化过程
以对二甲苯(PX)为原料,用醋酸钴、醋酸锰做催化
剂,四溴乙烷作促进剂,在一定的压力和温度下,用空气于醋酸溶
剂中把对二甲苯连续地氧化成粗对苯二甲酸。反应方程式如下。
② 碳链发生断裂的氧化反应。包括产物碳原子数比原料少
的反应如异丁烷氧化生成乙醇的反应,以及产物碳原子数与
原料相同的开环反应如环己烷氧化生成己二醇等。 ③ 氧化缩合反应。在反应过程中,这类反应发生分子之间的 缩合,如丙烯氨氧化生成丙烯腈、苯和乙烯氧化缩合生成苯 乙烯等。
7.2 均相催化氧化
① 反应物与催化剂同相,不存在固体表面上活性中心性质及分
第七章烃类选择性氧化01

§单程转化率过低,循环气量大。同时部分循 环气排空时乙烯损失大。
乙烯环氧化制环氧乙烷
工艺流程
工艺流程包括反应部分和环氧乙 烷回收、精制部分
氧气法生产环氧乙烷的工艺流程
空 气 作 氧 化 剂
反应器的冷却介质 “尾烧” 现象
环氧乙烷生产工艺技术新进展
第七章 烃类选择性氧化过程
主要内容
氧化反应的特点 氧化剂的种类 氧化反应类型(均相、非均相) 氧化反应的典型产品和工艺
氧化反应
§化学工业中氧化反应是一大类重 要化学反应,它是生产大宗化工原 料和中间体的重要反应过程
§有机物氧化反应当数烃类的氧化 最有代表性
§烃类氧化反应可分为完全氧化和 部分氧化两大类型
丙烯氨氧化动力学
§丙烯脱氢生成烯丙基过程为控制步骤 §在体系中氨和氧浓度不低于丙烯氨氧
化反应的理论值时,丙烯氨氧化反应对 丙烯为一级反应,对氨和氧均为零级反 应,即:
r = k p丙烯
丙烯氨氧化制丙烯腈
氧化还原催化循环
Mo6+ → Mo5+ Mo5++Bi3+ → Mo6++Bi2+ 2Bi2++1/2O2 → 2Bi3++O2-
聚乙二醇
一乙醇胺
乙
二乙醇胺 氨 环氧乙烷 水 二
三乙醇胺
醇
CH2 CH2 +XY O
CH2 CH2 OX Y
乙烯环氧化制环氧乙烷
生产方法
氯醇法
空气氧化法 乙烯直接氧化法
氧气氧化法
乙烯直接氧化法制环氧乙烷
主反应与副反应
主反应:
C2H4+O2C2H4O 平行副反应:
选择性氧化
C2H4+3O22CO2+2H2O(g) 深
化工工艺学烃类选择性氧化过程

非均相催化氧化
工业上使用的有机原料:
➢ 具有π电子的化合物 烯烃 芳烃
➢ 不具有π电子的化合物 醇类 烷烃
低碳烷烃的选择性氧化: 丁烷代替苯氧化制顺酐 丙烷代替丙烯氨氧化制丙烯腈
化学工艺学
重要的非均相氧化反应
化学工艺学
催化自氧化
具有自由基链式反应特征,能自 动加速的氧化反应。使用催化剂 加速链的引发,称为催化自氧化
工业上生产有机酸、过氧化物
化学工艺学
催化自氧化催化剂
催化剂多为Co、Mn等过渡金属离子 的盐类,溶解在液态介质中形成均相
助催化剂,又称氧化促进剂
缩短反应诱导期,加速反应的中间过程
化学工艺学
第七章 烃类选择性氧化过程
化学工艺学
主要内容
氧化反应的特点 氧化剂的种类
氧化反应类型(均相、非均相) 氧化反应的典型产品和工艺
化学工艺学
氧化反应
化学工业中氧化反应是一大类重 要化学反应,它是生产大宗化工 原料和中间体的重要反应过程
有机物氧化反应当数烃类的氧化 最有代表性
烃类氧化反应可分为完全氧化和 部分氧化两大类型
过程易燃易爆
安全性Байду номын сангаас
化学工艺学
氧化剂的选择
空气 纯氧 过氧化氢 其它过氧化物 反应生成的烃类过氧化物
或过氧酸
化学工艺学
烃类选择性氧化过程的分类
反应类型: 碳链不发生断裂的氧化反应 碳链发生断裂的氧化反应 氧化缩合反应
化学工艺学
烃类选择性氧化过程的分类
反应相态
催化自氧化
均相催化氧化 络合催化氧化
化学工艺学
均相催化氧化
自氧化反应机理
化学工艺学
4.2烃类选择性氧化

提高
空速
3. 反应压力
加压 (1) 可以提高反应器的生产能力, (2)
有利于从反应气体产物中回收环氧乙烷(液体
吸收),故工业生产大多采用加压氧化。
操作压力(反应器入口压力)一般为
1.03.0MPa 。高于 2.5MPa 后产物聚合成大分
子覆盖催化剂,催化剂磨损严重。
4. 原料纯度和配比 ⑴原料气纯度
2. 空速(质量空速,体积空速)
缺点:转化率下降,循环气量增 大,分离工序的负荷和动力消耗 增加。 优点:选择性增强,迅速移走反应热。
目前,氧气氧化法空速一般采用 40006000 h-1 ,此时乙烯单程转化率约为 912% 。空气氧 化法的空速为 7000h-1 左右,乙烯单程转化率为 3035%。
4.2.2.3 环氧乙烷生产工艺条件
乙烯直接氧化法制环氧乙烷 反应温度 空速 反应压力 原料配比及致稳气 原料气纯度
4.2.2.3 环氧乙烷生产工艺条件
1. 温度(影响主副反应的主要因素) 当反应温度略高于 100℃时,氧化产物几乎全部 是环氧乙烷。但反应速率慢,随着温度升高,主反应 速率增加,副反应开始进行。反应温度超过 300℃时, 银催化剂几乎对生成环氧乙烷反应不起催化作用,反 应产物主要是二氧化碳和水(副反应活化能大)。 通常温度为 220260℃。当用空气作氧化剂时, 反应温度为 240270℃;若用氧气为氧化剂时,反应 温度以230250℃为宜。 操作初期,温度下限,操作终期,温度上限。
(5)含氯抑制剂的添加
O2+4Ag(邻近)=2O2-(吸附)+4Ag+(邻近)
(氧原子离子,催化平行副反应,燃烧反应)
O2+Ag=O2-(吸附)+ Ag+
有机工艺学第七章

◆氧空速 空速↑,有利气液接触,氧吸收↑,有利反应进行; 过高空速,氧停留时间短,氧利用率↓,尾气氧含量↑
应用举例一 对二甲苯氧化制对苯二甲酸
●对苯二甲酸性质
两个羧基分别与苯环中相对的两个碳原子相连接 而成的二元芳香羧酸。白色晶体或粉末,低毒,可 燃。若与空气混合,在一定的限度内遇火即燃烧甚 至发生爆炸。
◆溶剂的影响 不仅改变反应条件,对反应历程和产物产生影响 (对二甲苯氧化对苯二甲酸,醋酸溶剂选择性95%,无溶
剂20%,主要产物醇、醛、酮) ◆杂质的影响 杂质存在会导致体系自由基失活,破坏链引发和传递
阻化作用,阻化剂 ◆温度的影响 动力学控制;温度↑,有利反应,副产物↑,选择性↓
◆氧气分压的影响 氧分压不足,反应速率降低,氧分压影响选择性
工业上用于生产有机酸、过氧化物p224
●烃类自氧化反应机理—自由机链式反应机理
烃分子均裂生成自由基 决定性步骤
ROOH的生成是链传递反应的控制步骤
烃分子发生均裂的活化能 叔C-H<仲C-H<伯C-H
链传递受(7-3)控制,ROOH不稳定,可生成新自由基 产物组成中有:醇、醛、酮、酸,组成复杂
●催化自氧化催化剂p224
分子氧
PdCl2+烯烃 PdCl42-
烯烃氧化 Pd0 +CuCl2
PdCl2 CuCl
反应速率最慢,控制步骤
O2
催化剂:Pd2+、Pt2+、Rh3+、Ir4+、Ru3+和Ti3+
氧化剂:CuCl2、FeCl3、H2O2、MnO2、苯醌等 溶 剂:水、乙醇、环丁砜等
●烯烃配位催化氧化
《烃类选择性氧化》

第七章炷类选择性氧化7.5丙烯氨氧化制丙烯腊7. 5. 1丙烯腊的性质、用途及其工艺概况1. 轻类的氨氧化.是指用空气或氧气对轻类及氨进行共氧化生成腊或有机氮化物的过程。
2. 丙烯腊的性质和用途.在常温常压下丙烯腊是无色液体,味甜,微臭,沸点77. 3C。
丙烯腊有蠹,室内允许浓度为O. 002ra"L,在空气中爆炸极限(体积分数)为3. 05%〜17. 5%,与水、苯、四氯化碳、甲醇、异丙醇等可形成二元共沸物。
丙烯腊分子中含有C=C双键和袱基,化学性质活泼。
能发生聚合、加成、袱基和袱乙基等反应,制备出各种合成纤维、合成橡胶、塑料、涂料等。
7. 5. 2丙烯氨氧化制丙烯腊的化学反应丙烯氨氧化过程中,除生成主产物丙烯腊外,还有多种副产物生成。
主反应:3 A C3H6 + NH3 + O2 CH2=CH-CN(g) + 3H2O(g)(7-52)2副反应:(1) 生成腊化物NH3 +C3H6 + O2 * CH3CN(g) + 3H2O(g) (7-53)2 2C3H6 + 3 NH3 + 3 O2 3HCN(g) + 6H20(g) (7-54)(2) 生成有机含氧化合物C3H6 + 02 * CH2=CHCH0 + H 20(g)丙烯醛3C3H6 + —02 CH2=CHC00H + H20(g)2丙烯酸C3H6 + 02 ——CH3CH0 (g)+ HCH0(g)1C3H6 + —02 CH 3C00CH3 (g)2(3) 生成深度氧化物C3H6 + 302 3C0 + H20(g)C3H6 + O2 3 CO2 + 3H2O(g)2上述主副反应均是强放热反应,尤其是深度氧化,△G是很大的负值,因此, 反应已不受热力学平衡的限制,要获得主产物丙烯腊的高选择性,改进产品组成的分布,必须使主反应在反应动力学上占优势,研制高性能的催化剂非常重要。
7. 5. 3丙烯氨氧化催化剂7. 5. 3. 1 Mo系催化剂1. 四组分催化剂(P— Mo — Bi — O)2. 五组分催化剂.(P— Mo — Bi — FbCo— O)3. 七组分催化剂(P— Mo — Bi — Fe— Co— Ni — K—O/Si02)7. 5. 3. 2 Sb系催化剂1.Sb-Fe-O 催化齐ij.2. Mo-Te-O系催化剂.P346表7- 6给出了几种典型工业催化剂的技术指标。
烃类选择性氧化

第七章烃类选择性氧化7.6芳烃氧化制邻苯二甲酸酐7.6.1 邻苯二甲酸酐的性质、用途及工艺概况1.邻苯二甲酸酐的性质和用途.邻苯二甲酸酐简称苯酐,沸点284.5℃,凝固点(干燥空气中)131.11℃,有刺激性。
苯酐主要用来生产增塑剂邻苯二甲酸二辛酯和邻苯二甲酸二丁酯及其他酯类,还可用于制造不饱和聚酯树脂和染料、医药、农药等。
7·6·2 邻二甲苯和萘制苯酐反应机理7.6.2.1邻二甲苯氧化反应邻二甲苯气相催化氧化制苯酐,反应历程复杂,包括一系列平行和串联反应,反应均为不可逆放热过程。
主反应:3+ ╱> O + 3H2O-CH3-CO副反应:1 CH-CO3+ O2‖> O + 4CO2 + 4H2O-CH3 2 CH-CO-CH3+ O2+ 3H2O-CH3-CH3邻甲基苯甲醛-CH3+ 2O2> O + 2H2O-CH3-CO邻甲基苯甲酸-CH3 1 CH3-C -CO+ O2‖> O + 3CO2 + 3H2O -CH3 2 CH-CO甲基丁烯二酸酐-CH32 + O2-COOH + 3H2O-CH3苯甲酸:-CH3 1+ O28CO2 + 5H2O-CH3 27.6.2.2萘氧化反应主反应:1 + 2CO2 + 2H2O ∣‖∣+ O2╱╲╱╲╱ 2 -CO副反应:O‖╱╲╱╲ 1 ╱╲╱╲+ H2O∣‖∣+1 O2∣‖╲╱╲╱ 2 ╲╱╲╱‖O萘醌╱╲╱╲ 1 CHCO + H2O∣‖∣+ O2‖>O╲╱╲╱ 2 CHCO完全氧化反应╱╲╱╲∣‖∣+ 12 O210CO2 + 4 H2O╲╱╲╱萘氧化反应历程OH O∣萘酚(中间产物) ‖╱╲╱╲╱╲╱╲∣‖∣∣‖∣╲╱╲╱╲╱╲╱∣‖OH O╱╲╱╲∣‖∣>O CO, CO2 ,H2O ╲╱╲╱-COCHCO‖>OCHCO反应过程中,生成1,4-萘醌的速率很小,实际主要反应为萘氧化为苯酐和二氧化碳,副产顺酐.7.6.3邻苯二甲酸酐生产采用的催化剂1..催化剂比较典型的有BASF’公司V—Ti—O系表面涂层催化剂。
催化氧化(烃类选择性氧化)
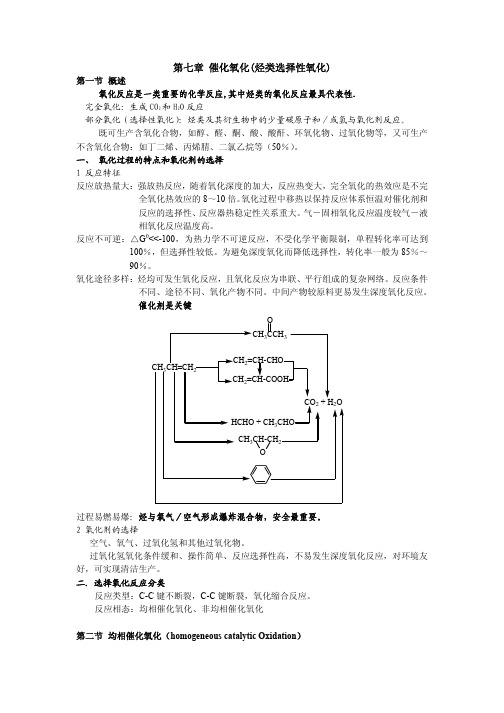
R +.H2O.
2R.OOH
.ROO + RO +H2O
RO.O . R'O + R'CHO (或酮)
.
R'O(或RO) + RH
R'OH(或ROH) + R
(5) E=167kJ/mol (6) (7)
(8) (9) (10)
分支反应生成不同碳原子数的醇和醛,进一步氧化为酮和酸,反应产物复杂。
2、催化剂体系 催化剂:Co、Mn 等过渡金属离子的醋酸盐和环烷酸盐;助催化剂
H3C
CH3
HOOC
COOH 反应产物为稳定的有机物,不易进一步氧化
CH3CHO
CH3COOH 高转化率和高选择性
而对于目的产物为中间产物的,由于中间产物较原料更易氧化,故应控制单程转化率,
通过循环操作实现高转化率。
OH
O
COOH
COOH 10%
O
C40
C-C-C-C
HAC 12%
反应产物分布与反应器物料返混程度相关
溴化物: NaBr, NH4Br,C2H2Br4,CBr4 3、反应影响因素
◇杂质:
以自由基为载链体的自氧化反应速度取决于链的传递速度,稳态时自由基的产生速度与
消失速度平衡,若体系中自由基浓度降低则反应速度急剧降低。自由基的再化合、自由基的
歧化、自由基与容器壁碰撞和反应体系中存在夺取自由基的杂质(阻化作用)
◇反应温度和氧分压 供氧能力大,反应由动力学控制
T 提高,k 增大,但不宜太高,否则 Q 吸〈Q 放,导致温度偏高,选择性降低,k 急
剧加速导致飞温。 T 降低,k 减小,Q 吸>Q 放,T 进一步降低,反应停止。
有机工艺学--烃类选择性氧化

7.2.2 配位催化氧化
催化剂由中心金属离子和配位体构成,金属离子 与反应物形成配位键并使其活化,反应物被氧化,金 属离子或配位体被还原,还原态的催化剂再被分子氧 氧化为初始态,完成循环。
●配位催化氧化过程
配位
初始态 催化剂
反应物 氧化
还原态 催化剂
产物
催化剂由中心金属 离子与配位体构成
k4反应速率最慢,对羧基苯甲醛氧化为对苯二甲酸
为控制步骤
◆副反应
◆氧化机理p227
催化剂能活化第一个甲基,但难以氧化第二个甲 基;溴化物活化第二个甲基。
●加氢精制
◆加氢精制 在高温、高压下使粗TPA溶于水,然后在钯催化剂
存在下对杂质进行加氢反应,使粗对苯二甲酸产品中 的杂质对羧基苯甲醛(4-CBA)还原为易溶于水的对甲 基苯甲酸(即PT酸),其他有色杂质也同时被分解。
★压力 由反应温度确定
●乙烯配位催化氧化制乙醛工艺
◆一段法----Hoeschst工艺 三个反应在同一反应器进行
◆二段法----Wacker-Chemie工艺 乙烯羰化和钯的氧化在一台反应器中, Cu+的氧化在另一反应器中。
调节温度,保证回流液中 乙醛含量尽可能少
65%乙烯和8%氧,排放防 止惰性气体积累
工业上用于生产有机酸、过氧化物p224
●烃类自氧化反应机理—自由机链式反应机理
烃分子均裂生成自由基 决定性步骤
ROOH的生成是链传递反应的控制步骤
烃分子发生均裂的活化能 叔C-H<仲C-H<伯C-H
链传递受(7-3)控制,ROOH不稳定,可生成新自由基 产物组成中有:醇、醛、酮、酸,组成复杂
●催化自氧化催化剂p224
进一步吸 收未冷凝 回收 的乙醛 乙醛 和催 化剂 雾沫
烃类选择性氧化

167℃,6MPa,醋酸作溶剂 147~177℃,5 MPa 117℃ 167℃ 147~157℃ 167~177℃ 90℃,醋酸作溶剂 147~157℃,303kPa 117℃,3MPa,醋酸作溶剂 217℃,3MPa,醋酸作溶剂
147℃ 107℃ 67℃,152~505kPa 45℃,醋酸乙酯 107~127℃,0.5~3 MPa
烯烃必须溶解在催化剂溶液中才能活化,常见溶剂: 水、乙醇、二甲基甲酰胺、环丁砜。
7.2.3 烯烃液相环氧化
除乙烯外,其他烯烃的气相环氧化转化率低, 选择性很低,故用液相环氧化生产。
C=C
+ ROOH
C-C O
+ ROH
氯醇法
生产环氧丙烷
氯醇法
优点
流程短 投资少 选择性好 收率高 生产安全
生产环氧丙烷
氧化反应
含氧:醇、醛、酮、酸、酸酐、环氧化物 、过氧化物等
不含氧:丁烯氧化脱氢制丁二烯
丙烯氨氧化制丙烯腈 乙烯氧氯化制二氯乙烷
醇类
乙二醇 高级醇 环己醇
醛类
甲醛 乙醛 丙烯 醛
表
酮类
丙酮
甲乙 酮
环己 酮
重要的氧化产品
酸类
酸酐和 酯
环氧 化合 物
醋酸
醋酐
环氧 乙烷
丙烯酸 苯酐
甲基丙 顺酐 烯酸
环氧 丙烷
均苯四 己二酸 酸二酐
对苯二 醋酸乙 甲酸 酯
有机过 有机腈 二
氧化合
烯
物
烃
过氧化 丙烯腈 丁
氢异丙
二
苯
苯二腈 烯
过氧化 氢乙苯
甲基丙 烯腈
过氧化 氢异丁
苯二腈
烷
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烃类选择 性氧化
碳链不发生断裂的氧化反 应
碳链发生断裂的氧化反应
氧化缩合反应 依据相态可分:均相催化氧化、非均相催化氧化
4
9.2 均相催化氧化
通常指气-液氧化反应,习惯上称为液相氧化反应。
均相催化特点:
✓活性高、选择性高
催化自氧化
✓反应条件温和
反应类型 配位催化氧化
✓设备简单、体积小
烯烃液相环氧化
CH3 C-O-O-H +116kJ/mol CH3
14
反应机理:
CH3
CH3
CH + O2
C-O-O-H +116kJ/mol
CH3
CH3
链的引发 链的传递 链的终止
•
•
ROOH R O H O
•
•
R O RH ROH R
•
•
H O RH H 2O R
•
•
R O2 RO O
•
ROO RH ROOH
另外,由于氧化反应的目的产物为氧化过程的中间产物,因此,
氧分压的改变,会影响反应的选择性,从而对产物的构成产生影
响。氧化剂空气或氧气用量的上限由反应排出的尾气中氧的爆炸
极限确定,应避开爆炸范围。氧化剂用量的下限为反应所需的理
论耗氧量,此时尾气中氧含量为零。在工业实践中,一般尾气中
氧含量控制在2%-6%,以3%-5%为佳。氧化剂的空速定义为:空
•
•
ROOH R O OH
•
•
R O RH ROH R
•
•
OH RH H 2O R
•
•
2ROOH ROO R O H 2O
•
•
ROO R O RCHO(或酮)
R
•
O
(或R
•
O
)
RH
ROH(或ROH)
•
R
产物分布十分复杂
8
➢自氧化反应过程的影响因素
(1)溶剂影响 (2)杂质影响 (水、硫化物、酚类等) (3)温度 (4)氧化剂用量和空速影响
6
催化自氧化反应-催化剂
催化剂:Co、Mn等过渡金属离子盐类,如醋酸盐和环烷酸盐 助催化剂:溴化物(溴化钠、溴化铵、四溴乙烷等)
有机含氧化合物(甲乙酮、乙醛、三聚乙醛等)
助催化剂能缩短反应诱导期或加速反应的中间过程,如对二甲苯氧化制对苯二 甲酸时,第一个甲基易氧化生成对甲基苯甲酸,但对甲基苯甲酸中的羰基的存 在,会阻碍第二个甲基的氧化,加入助催化剂三聚乙醛或溴化物可显著促进反 应的进行,缩短反应时间,降低反应温度。助催化剂的作用机理还不甚清楚。
10
➢自氧化反应过程的影响因素
(2) 杂质的影响 自氧化反应是自由基链式反应,体系中引发的自由基的 数量和链的传递过程,对反应的影响至关重要。杂质的 存在有可能使体系中的自由基失活,从而破坏了正常的 链的引发和传递,导致反应速率显著下降甚至终止反应。 由于自氧化反应体系的自由基浓度一般较小,因此,对 杂质的影响一般非常敏感,有时即使少量杂质也会产生 相当大的影响。杂质对自由基链锁反应的影响称为阻化 作用,杂质则为阻化剂。不同的反应体系阻化剂不尽相 同,常见的有水、硫化物、酚类等。
气或氧气的流量和反应器中液体体积之比,空速提高,有利于气
液相接触,加速氧的吸收,促进反应进行,但过高的空速会使气
体在反应器中停留时间缩短,氧的吸收不完全,利用率降低,导
致尾气中氧含量过高,对安全和经济性都有影响。空速的大小受
尾气中氧含量要求约束。
13
➢异丙苯自氧化制过氧化异丙苯CH来自 CH + O2 CH3
引发剂:常用异丁烷过氧化氢、偶氮二异丁腈
引发剂含量一般只需10-6数量级即可。
原料:烷基芳烃
7
➢自氧化反应机理
链的引发 链的传递
链的终止
分支反应:
•
•
RH O2 ki R H O2
•
•
R O2 k1 ROO
•
ROO RH k2 ROOH
•
•
R R kt R-R
•
R
决定性步骤 与结构有关
•
R
•
•
R R R-R
副产物:
•
•
ROO H ROOH
•
•
R H RH
CH3 C-OH CH3
O C CH3
CH3 CH3 C-O O C CH3 CH3
CH3
C CH2
甲醛、甲醇、甲酸
15
反应过程影响因素: ✓温度(由转化率、选择性和生产能力所决定) ✓PH值 ✓对原料纯度要求较严格(杂质、乙苯、丁苯) ✓控制转化率(通常过氧化物含量为25%) ✓空气通入量
优选化学工艺学烃类选择氧化
9.1.1 氧化过程特点和氧化剂的选择
➢氧化反应的特征 (1)反应放热量大 (2)反应不可逆 (3)氧化途径复杂多样 (4)过程易燃易爆
2
➢氧化剂的选择
氧化剂
空气或纯氧
烃类过氧化物或过氧酸(如过氧化氢乙苯 氧化丙烯制环氧丙烷)
过氧化氢
3
9.1.2 烃类选择氧化过程的分类
11
➢自氧化反应过程的影响因素
(3) 温度的影响 保持体系的放热和移出热量平衡非常重要。保持较高的 反应温度有利于反应的进行; 但也不宜过高,以免副产 物增多,选择性降低,甚至反应失去控制。
12
➢自氧化反应过程的影响因素
(4) 氧化剂用量和空速的影响 氧化反应需要氧源,在体系供氧能力足够时,反应自动力学控制, 当氧浓度较低,系统供氧能力不足时,反应由传质控制,此时增 大氧分压,可促进氧传递,提高反应速率,但也需要根据设备耐 压能力和经济核算而定。若供氧速度在两者之间时,传质和动力 学因素均有影响,应综合考虑。
9
➢自氧化反应过程的影响因素
(1)溶剂的影响 在均相催化氧化体系中,经常要使用溶剂。溶剂的选择 非常重要,它不仅能改变反应条件,还会对反应历程产 生一定的影响。 如烷基苯氧化时,常采用醋酸作溶剂。在对二甲苯氧化 制对苯二甲酸时,如不加入溶剂,对苯二甲酸生成量只 有20%左右,主要生成物为醇、醛和酮等。当加入溶剂 醋酸时,有利于特定自由基的生成,大大加快了氧化反 应速率,对苯二甲酸的选择性可达95%以上。但是,必 须注意溶剂效应是复杂多样的,它既可产生正效应促进 反应,也可产生负效应阻碍反应的进行。
CH3 CH + O2 CH3
CH3 C-O-O-H +116kJ/mol CH3
16
氧化工艺流程:
多塔串联(筛板式) 反应温度逐塔下降
✓反应热利用率较低
✓腐蚀性强
✓催化剂需分离回收
5
9.2.1 催化自氧化
➢催化自氧化反应
自氧化反应是指具有自由基链式反 应特征,能自动加速的氧化反应。
自氧化反应
链引发 链传递 链终止
存在较长诱导期
催化剂能加速链的引发,促进反应物引发生成自由基,缩短或 消除反应诱导期,因此可大大加速氧化反应,称为催化自氧化。
