烃类选择性氧化过程
化学工艺学复习资料

15.烃类氧化反应采用最为普遍的氧化剂是空气、纯氧16.化学工艺即化学生产技术,指将原料物质主要经过化学反应转变为产品的方法和过程,包括实现这种转变的全部化学的和物理的总和。
解: RC 1mol乙烯
产物
11mol乙烯
反应器分离器产物
FF MF RPKmol乙烯EO,水
设反应器中初始含有5kg乙烯,由乙烯单程转化率为25%,则可知反应掉的乙烯的量为5
5-(5-1.25-x)=1.25+x,由环氧乙烷的选择性为75%,则可设每次反应生成环氧乙烷为ykg。则:
所以环循环比应该为11.
A.①>③>②>④B.③>②>①>④C.②>①>③>④D.④>②>③>①5.脱甲烷塔的关键组分是:A. 与 B. C. D.
6.管式炉裂解石脑油所得裂解气含 很少,脱硫大多采用:A.碱洗法B.乙醇胺溶液吸收法C.N-甲基吡咯烷酮吸收法D.先乙醇胺法后碱洗法
7.冷箱在脱甲烷塔之前为:A.前加氢B.前冷C.后冷D.后加氢8.裂解气深冷分离过程中造成-100 低温一般采用的冷凝剂是:A.丙烯B.氨C.乙烯D.乙烷
7.反应达到平衡转化率所需要的反应时间为无限长。()8.反应过程中,某反应的-△ 值越大,达到平衡的转化率就越高,在相同的反应条件下,所达到的转化率要高。()
9.有机反应中,加氢反应一般是吸热反应。(×)10.可逆吸热反应的温度控制,通常是在最优温度线附近。(√)11.煤的高温干馏温度一般为900 1100 。(√)
四、、判断题
烃类选择性氧化

分子氧
2. 乙烯配位催化氧化制乙醛
——具有代表性的络合催化氧化反应
水溶液
1 PPddCl2-CCuuCCl l2H-HCCl l
CH2 CH2 + 2 O2
CH3CHO
Pd2+ +烯烃 配位 烯烃氧化物 + Pd0 Pd2+
PdCl2 催化剂 CuCl2 氧化剂
H+ O2
Cu2+ Cu+ Cu2+
烯烃分子中直接引进一个乙酰氧 O C CH3 ,而生成不
饱和醋酸酯。
O
乙烯和醋酸氧酰化生产 醋酸乙烯酯
丙烯和醋酸氧酰化生产 醋酸丙烯酯
丁二烯氧酰化生产
1,4-丁二醇乙酯
7. 氧氯化反应
乙烯氧氯化制二氯乙烷
C 2H 42H C 1 2O l2C2 u2/4 C C C 0la rrC ie2 rC Hl2CH H l2O C2C H C l 2C H l裂 解 C2H CH H CC l l
反应器轴向温
应 性;
度分布存在热点;
器
对催化剂的强度
对催化剂的耐
和耐磨性无特殊要求 热温度和最佳活性
。
温度影响大。
改进
原料气中加 微量抑制剂,部 分中毒,控制活 性;
入口装填惰 性载体稀释的或 老化的催化剂;
分段冷却法。
反应器内沿轴向温度 分布最高温度点。
Tmax
T出
轴向温度分布主要决定于沿轴向的放热速率
甲基丙 烯腈
过氧化 氢异丁
苯二腈
烷
高级脂 丙烯酸 肪酸 酯
7.1.1 氧化反应的特点与氧化剂的选择
1. 氧化反应的特点
强放热反应
热量的转移与回收
化学工艺学知识点总结

化学工艺学第一章绪论1、化学工业:运用化学工艺、化学工程及设备,通过各种化工单元操作,高效、节能、经济、环保和安全地将原料生产成化工产品的特定生产部门.2、化学工艺即化工生产技术,是指将各种原料主要经过化学反应转变为产品的方法和过程,包括实现这种转变的全部化学的和物理的措施.3、化学工艺学是根据化学、物理和其他科学的成就,研究综合利用各种原料生产化学产品的方法原理、操作条件、流程和设备,以创立技术先进、经济上合理、生产上安全的化工生产工艺的学科.4、21世纪,化学工业的发展趋势答:1产品结构精细化和功能化;2生产装置微型化和柔性化;3生产过程绿色化和高科技化;4市场经营国际化、信息化.5、绿色化工就是用先进的化工技术和方法减少或消除对人类健康、社区安全、生态环境有害的各种物质的一种技术手段.6、化学工业的基础原料指可以用来加工生产化工基本原料或产品的在自然界天然存在的资源.7、化工产品一般是指由原料经化学反应、化工单元操作等加工方法生产出来的新物料品.8.煤化工:以煤为原料,经过化学加工转化为气体、液体和固体燃料及化学品的工业.9.煤的干馏:是指在隔绝空气条件下将煤加热,使其分解生成焦炭、煤焦油、粗苯和焦炉气的过程.10.一次加工方法主要包括一次加工和二次加工,一次加工方法主要包括常压蒸馏和减压蒸馏.11.蒸馏是一种利用液体混合物中各组分挥发度的差别沸点不同进行分离的方法,是一种没有化学反应的传质、传热物理过程,主要设备是蒸馏塔.12.常用的二次加工方法主要有催化重整、催化裂化、催化加氢裂化和烃类热裂解四种.13.催化重整:是在铂催化剂作用下加热汽油馏分石脑油,使其中的烃类分子重新排列形成新分子的工艺过程.14.催化重整的原料是石脑油,以生产高辛烷值汽油为目的时一般采用80~180℃馏分.15.催化加氢裂化是在催化剂及高氢压下加热重质油,使其发生一系列加氢和裂化反应,转变成航空煤油、柴油、汽油和气体等产品的加工过程. 16.化工生产过程一般可概括为原料预处理、化学反应和产品分离与精制三大步骤.17.原料的预处理的主要目的是使初始原料达到反应所需要的状态和规格.18、化学反应是化工生产的核心.实现化学反应过程的设备称为反应器釜或塔.19、产品分离与精制目一是获取符合规格的产品,二是回收、利用副产物.20、组织工艺流程时应遵循的原则有哪些答:1工艺路线技术先进,生产运行安全可靠,经济指标先进合理;2原料和能量利用充分合理;3单元操作适宜,设备选型合理;4工艺流程连续化、自动化;5安全措施得当,“三”治理有效.21、工业催化剂的性能指标是活性、选择性和寿命.22、催化剂的失活原因一般分为中毒、结焦和堵塞、烧结和热失活三大类.22、固体催化剂在使用中应注意事项有哪些答:1要防止已还原或已活化好的催化剂与空气接触;2原料必须经过净化处理,使用过程中要避免毒物与催化剂接触;3要严格控制催化剂使用温度,使其在催化剂活性温度范围内使用,防止催化剂床层温度局部过热,以免烧坏催化剂.4要维持正常操作条件如温度、压力、反应物配比、流量等稳定,尽量减少波动.5开车时要保持缓慢的升温、升压速率,温度、压力的突然变化容易造成催化剂的粉粹,要尽量减少开车、停车的次数.第一章化学工艺基础1.化工原料根据物质来源可分为无机原料和有机原料两大类.2.煤化工包括煤的干馏包括炼焦和低温干馏,气化,液化和合成化学品等.3.原油:从油井中开采出来没有经过加工处理的石油叫原油,它是一种有气味的棕黑色或黄褐色粘稠液体.4.一次加工:一次加工方法主要包括常压蒸馏和减压蒸馏.5.二次加工:常用的二次加工方法主要有催化重整,催化裂化,催化加氢裂化和烃类热裂解.6.化工生产过程:一般可概括为原料预处理,化学反应和产品分离与精制三大步骤.7.选择性:是指体系中转化成目的产物的某反应物量与参加所有反应而转化的该反应物总量之比,用符号S表示.表达式为:转化为目的产物的某反应物的量该反应物的转化总量8.催化剂失活原因一般分为中毒,结焦和堵塞,烧结和热失活三大类.9.催化剂使用注意事项:(1)要防止已还原或已活化好的催化剂与空气接触;(2)原料必须经过净化处理,使用过程中要避免毒物与催化剂接触;(3)要严格控制操作温度,使其在催化剂活性温度范围内使用,防止催化剂床层温度局部过热,以免烧坏催化剂;(4)要维持正常操作条件的稳定,尽量减少波动;(5)开车时要保持缓慢的升温,升压速率,温度,压力的突然变化容易造成催化剂的粉碎,要尽量减少开,停车的次数.第四章烃类热裂解1.烃类热裂解:是指以石油系烃类为原料,利用石油烃在高温下的不稳定、易分解的性质,在隔绝空气和高温条件下使大分子的烃类发生断链和脱氢等反应,以制取低级烯烃的过程.2.烃类热裂解制乙烯的生产工艺主要由原料烃的热裂解和裂解产物的分离精制两部分组成.3.一般将复杂的裂解反应归纳为一次反应和二次反应.4.一次反应:是指原料烃主要是烃类和环烷烃经热裂解生成乙烯和丙烯等低级烯烃的反应.5. 二次反应:是指一次反应的产物乙烯、丙烯等低级分子烯烃进一步发生反应生成多种产物,直至最后生焦或炭.6.乙烷裂解的自由基反应包括链引发、链增长反应和链终止反应3个阶段.7.各类烃热裂解的难易顺序可归纳为:异构烷烃>正构烷烃>环烷烃C 6>C 5>芳烃8.从热力学角度分析,裂解是吸热反应,理论上烃类裂解制乙烯的最适宜温度一般在750~900℃.裂解的深度取决于裂解温度和停留时间.管式炉裂解技术的反应设备是裂解炉,它既是乙烯装置的核心,又是挖掘节能潜力的关键设备.9.石油烃类裂解的操作条件宜采用高温、短停留时间、低烃分压,产生的裂解气要迅速离开反应区.10.烃类的热裂解过程的特点:1烃类热裂解是吸热反应;2烃类热解需在高温下进行,反应温度一般在750℃以上;3为了避免烃类热裂解过程中二次反应,反应停留时间很短,一般在~1s ; 4热裂解反应是分子数增加的反应,烃分压低有利于原料分子向反应产物分子的反应平衡方向移动;5裂解反应产物是复杂的混合物,除了裂解气和液体烃之外,尚有固体产物焦生成.11.裂解气中含有少量的H2S 、CO 2、H 2O 、C 2H 2、CO 等气体杂质.分析其来源主要有三个方面:一是由原料带入;二是裂解反应过程生成;三是裂解气处理过程引入.12.热泵:是通过做功将低温热源的热量传送给高温热源的供热系统. 2.烃类热裂解的主要目的是生产乙烯,同时可得丙烯、丁二烯以及苯、甲苯、二甲苯等产品.3.乙烯装置生产能力的大小实际反映了一个国家有机化学工业的发展水平.4.烃类热裂解过程非常复杂,具体体现在一下几个方面:1原料复杂2反应复杂3产物复杂7.同碳原子数的烷烃,C-H键能大于C-C键能,故断键反应比脱氢反应容易发生.8.带支链烃的C-C键或C-H键的键能较直链烷烃的C-C键或C-H键的键能小,易断裂,所以,带支链的烃容易裂解或脱氢.9.带侧链的环烷烃首先经行脱烷基反应,脱烷基反应一般在长侧链的中部开始断裂,一直进行到侧链为甲基或乙基,然后再一步发生环烷烃脱氢生成芳烃的反应,环烷烃脱氢比开环生成烯烃容易.10.在较高的温度下,低分子的烷烃、烯烃有可能分解为碳和氢.11.正构烷烃在各族烃中最有利于生成乙烯、丙烯.12.异构烷烃的烯烃总收率低于同碳原子数的正构烷烃.13.烃类热裂解过程的特点:1吸热反应高温2体积增大低压3易发生二次反应14.裂解深度:指裂解反应进行的程度.15.裂解炉设计开发的根本思路是提高裂解过程的选择性和设备的生产能力.16.提高裂解过程选择性的主要途径:1提高反应温度2缩短停留时间3降低烃分压17.工业上一般采用蒸汽作为稀释剂,其优点有如下几点:1裂解反应后通过急冷即可实现稀释剂与裂解气的分离,不会增加裂解气的分离负荷和困难.2水蒸汽热容量大,使系统有较大的热惯性,当操作供热不平稳时可以起到稳定温度的作用,保护炉管防止过热.3抑制裂解原料所含硫对镍络合金炉管的腐蚀.4脱除结碳.18.裂解供热方式有直接供热和间接供热.19.急冷的方法有两种:一种是直接急冷,一种是间接急冷.20.裂解气的净化与分离目的是除去裂解气中的有害杂质.21.工业生产上采用的裂解气分离方法主要有:油吸收精馏分离法、深冷分离法、吸附分离法、络合物分离法.22.工业上脱水的方法有多种,如冷冻法、吸收法、吸附法.补充:第5章芳烃转化过程石油芳烃主要来源于石脑油重整生成的油及烃裂解生成乙烯副产的裂解汽油.工业上广泛应用的芳烃转化反应主要有:C8芳烃的异构化、甲苯的歧化和C9芳烃烷基的转移、芳烃的烷基化、烷基芳烃的脱烷基化等.芳烃歧化:是指两个相同的芳烃分子在酸性催化剂作用下一个芳烃分子上的侧链烷基转移到另一个芳烃分子上的反应.烷基转移是指两个不同的芳烃分子之间发生烷基转移的反应.芳烃的烷基化是芳烃分子中苯环上的一个或几个氢被烷基取代生成烷基芳烃的反应.第6章催化加氢与脱氢1、催化加氢:是指有机化合物中一个或几个不饱和官能团在催化剂作用下与氢气的加成反应.2.催化加氢反应在化学工业中一是用于合成有机产品,二是用于许多化工产品的加氢精制.3.骨架催化剂:将具有催化活性的金属和载体铝或硅制成合金,再用氢氧化钠溶液浸渍合金,溶解其中的铝或硅,得到活性金属构成的骨架状物质4.加氢催化剂按其形态主要可分为金属催化剂、骨架催化剂、金属氧化物催化剂、金属硫化物催化剂、金属络合物催化剂五大类.5.下列芳烃加氢的顺序正确的是CA C 6H 5CH 3>C 6H 6>C 6H 4CH 32>C 6H 3CH 33B C 6H 4CH 32>C 6H 6>C 6H 5CH 3>C 6H 3CH 33C C 6H 6>C 6H 5CH 3>C 6H 4CH 32>C 6H 3CH 33D C 6H 6>C 6H 5CH 3>C 6H 3CH 33 >C 6H 4CH 326炔烃、二烯烃、单烯烃、芳烃混合在一起加氢时,其反应速率顺序为DA. 二烯烃>炔烃>单烯烃>芳烃B. 炔烃>单烯烃>二烯烃>芳烃C. 二烯烃>单烯烃>芳烃>炔烃D. 炔烃>二烯烃>单烯烃>芳烃7.绝热式反应器乙苯脱氢工艺中,水蒸气和乙苯的摩尔比为AA. 14:1B. 13:1C. 12:1D. 10:18.金属催化剂:就是把活性组分如Ni 、Pd 、Pt 等金属分散于载体上,以提高催化剂活性组分的分散性和均匀性,增强催化剂的强度和耐热性.9.目前工业生产上采用的催化剂大致可分为锌铬系和铜锌或铝系即铜基催化剂两大类.10.低压法合成甲醇工艺流程主要由造气、压缩、合成和精制四大部分组成.第7章烃类选择性氧化1.烃类选择性氧化过程的特点答:1反应放热量大;2反应不可逆;3反应过程易燃易爆;4反应途径复杂多样.2.如何提高烃类选择性氧化安全性答:1原料配比一定要控制在爆炸极限之外;2在设计氧化反应器时,除考虑设计足够的传热面积及时移走热量外,还要在氧化设备上设上加设防爆口,装上安全阀或防爆膜;3反应温度最好采用自动控制,至少要有自动报警系统.4还可以采用惰性气体的办法稀释作用物,以减少反应的激烈程度,防止发生爆炸.3.非均相催化氧化主要是指气态有机原料在固体催化剂存在下以气态氧作为氧化剂氧化为有机产品的过程.4.气固相催化氧化反应都是强放热反应,工业上常用的反应器有两种:列管式固定床反应器和流化床反应器.5.流化床反应器是一种利用气体或液体通过固体层而使固体颗粒处于悬浮运动状态,并进行气固相反应过程或液固相反应过程的反应器.6.流化床反应器从其结构来看自下而上大致分为锥形体、反应段和扩大段三部分.7.简述液相均相催化氧化技术优缺点.主要优点:(1)反应物与催化剂同相,不存在固体表面上活性中心性质及分布不均匀的问题,作为活性中心的过渡金属活性高,选择性好;(2)反应条件不太苛刻,反应比较平稳,易于控制;(3)反应设备简单,容积小,生产能力高;不足之处:(1)反应温度通常不太高,因此反应热利用率较低;(2)在腐蚀性较强的体系中要采用特殊材质;(3)配位催化氧化反应体系需用贵金属盐作为催化剂,因此必须分离回收.8.工业上常用的非均相反应器有两种:列管式固定床反应器和流化床反应器.9.热点:列管式反应器轴向的温度分布主要取决于沿轴向各点的放热速率和管外载热体的除热速率,一般反应器内沿轴向温度分布都有一个最高温度.10.简述丙烯腈生产过程中加入水蒸汽的作用答:1水蒸汽可促使产物从催化剂表面解析出来,从而避免丙烯腈深度氧化;2加入水蒸气后可起到降低反应物浓度作用,从而对保证安全生产防范爆炸深度氧化;3水蒸汽的比热容较大,加入水蒸气可以带走大量的反应生成热,使反应温度易于控制;4加入水蒸气对催化剂表面的积炭有清楚作用.第8章羰基合成1.羰基化反应:在过渡金属配位化合物催化剂存在下一氧化碳参与有机合成、分子中引入羰基的反应.2.甲醇低压羰基化反应主反应方程式:COOH CH CO OH CH 33→+,使用催化剂:铑—碘催化体系,反应温度:130~180℃.第9章 氯化1.氯化是指在化合物分子中引入氯原子以生产氯的衍生物的反应过程.氯化过程的主要产物是氯代烃,氯代烃的主要应用领域有两个:一是作溶剂,二是用作合成大量有机产品及精细化工产品的中间体和聚合物的单体.2、取代氯化、加成氯化和氧氯化是氯代烃的主要生产方法.3.目前, 与其他方法相比,原料来源广且价格较低,生产工艺合理,生产成本较低,产量约占吕乙烯总产量的90%以上.A.平衡氧氯化法 B.乙炔法 C.乙烯法 D.烯炔法。
第6章_氧化反应

OCOCH3
OH
Pb3O4 / AcOH
NaOH
二氢苊
5
第一节 烃类的氧化
一. 苄位烃基的氧化
1. 氧化生成醇和酯 若苄位碳原子只有一个H, 则可以选择较强的 氧化剂, 在短时间内将苄位烃基氧化成醇.
O 30% H2O2, 10% NaOH 热C2H5OH, 3min CH3 10-甲基蒽酮 CH3 OH 67% O
CH3CH2CH2OH
O CH2OH Ac2O / py 50℃, 20h OH O OH O CrO3 / AcOH / Ac2O 65~70℃ OAc O OAc COOH OAc O OAc
CrO3 / H2SO4 / H2O
CH3CH2COOH
O CH2OAc
36
第二节 醇类的氧化
二. (伯)醇被氧化成羧酸
第一节烃类的氧化第二节醇类的氧化第三节醛酮的氧化第四节含烯键化合物的氧化第五节芳烃的氧化氧化生成醇和酯在有机酸的环境中采用硝酸铈铵四醋酸铅四氟醋酸铅等氧化剂可以将苄位烃基氧化成酯水解之后得到醇
第六章 氧化反应
第一节 第二节 第三节 第四节 第五节 烃类的氧化 醇类的氧化 醛、酮的氧化 含烯键化合物的氧化 芳烃的氧化
三. 烯丙基位烃基的氧化
二氧化硒: SeO2 CrO3-吡啶配合物(Collins试剂): CrO3(py)2 氧化剂 过氧酸酯: Ar-C-O-O-C(CH3)3 / CuBr
O O
二氯氧矾酯: Cl
V Cl
OC2H5
24
第一节 烃类的氧化
三. 烯丙基位烃基的氧化
用二氧化硒氧化 二氧化硒可以将烯丙位的烃基氧化成相 应的醇, 容易再继续氧化得到醛或酮. 在乙酸中进行氧化, 生成的醇得到乙酸 酯, 抑制进一步氧化, 再水解得到所需的醇.
化工工艺学题

化工工艺学练习题选择题1. 化学工艺与化学工程相配合,可以解决化工过程开发、装置设计、(A )、操作原理及方法等方面的问题;此外,解决化工生产实际中的问题也需要这两门学科的理论指导。
A. 流程组织B. 物料平衡C. 能量平衡D. 工艺计算2. 化工生产过程中由原料到化学产品的转化要通过以下哪一项来实现(B)A.分离方法B.化学工艺C.新技术D.新工艺3. 化学工业的发展方向包括以下哪几个方面(ABCDE )A. 积极开发高新技术,缩短新技术工业化的周期B. 最充分、最彻底地利用原料C. 大力发展绿色化工D. 化工过程要高效、节能和智能化E. 实施废物再生利用工程4. 从目标出发,寻找实现此目标的前提,将具有不同功能单元进行逻辑组合,形成一个具有整体功能的系统,这种化工生产工艺流程设计方法称为( C )A. 形态分析法B. 功能分析法C. 推论分析法D. 演绎分析法5. 催化剂的基本特征主要包括以下哪几部分(ABC )A. 催化剂参与反应,但反应终了时,催化剂本身未发生化学变化和数量的变化B. 催化剂只能缩短达到化学平衡的时间,但不能改变平衡C. 催化剂具有明显的选择性D. 催化剂具有一定的活性E. 催化剂具有一定的耐毒性6. 工业催化剂的使用性能指标包括以下哪几项(ABCDE )A. 选择性B. 活性C. 热稳定性D. 化学稳定性E. 耐毒性7. 在裂解气中氢气未分离出来之前,利用裂解气中的氢对炔烃进行选择性加氢,以脱除其中炔烃,这个工艺过程称为( B )A. 前脱氢过程B. 前加氢过程C. 后脱氢过程D. 后加氢过程8. 一般裂解气干燥脱水采用的吸附剂包括(B )A.活性氧化铝B.3A 分子筛C.变色硅胶D.活性炭9. 裂解气分离出C2馏分和C3馏分后,再分别对C2和C3馏分进行催化加氢,以脱除乙炔、甲基乙炔和丙二烯的工艺过程称为(B)A.前加氢过程B.后加氢过程C.前脱氢过程D.后脱氢过程10. 在烃类热裂解过程中采用水蒸气作为稀释剂的原因包括以下哪几部分(ABDE )A. 不会增加裂解气的分离负荷B. 抑制裂解原料所含硫对镍铬合金炉管的腐蚀C. 水蒸气热容量小D. 脱除积碳E. 降低烃分压11. 下列可用来评价裂解原料性质的指标有(CE )A.选择性B.裂解炉出口温度C.原料氢含量D.原料转化率E.原料族组成12. .下列哪一种烃类是首选的烃类热裂解的原料(A)A.烷烃B.环烷烃C. 芳烃D.烯烃13. 裂解气预分馏过程的主要作用包括以下哪几部分(ACDE )A. 降低裂解气温度B. 分离出裂解气中的炔烃C. 将裂解气中的稀释蒸气以冷凝水的形式回收D. 回收低温位能量E. 分离出裂解气中的重组分,减少进入压缩分离系统的负荷14. 各种来源的C8 芳烃指的是(C )A. 邻二甲苯、间二甲苯、对二甲苯B. 邻二甲苯、对二甲苯、乙苯C. 邻二甲苯、间二甲苯、对二甲苯、乙苯D. 邻二甲苯、间二甲苯、对二甲苯、异丙苯15. 芳烃的脱烷基化方法包括(ABCE )A. 烷基芳烃的催化脱烷基B. 烷基芳烃的催化氧化脱烷基C. 烷基芳烃的加氢脱烷基D. 烷基芳烃的直接氧化脱烷基E. 烷基苯的水蒸气脱烷基16. 芳烃分子中苯环上的一个或几个氢被烷基所取代而生成烷基芳烃的反应称为( C )A.芳烃歧化B.烷基转移C.芳烃烷基化D.C8 芳烃异构化17. C8 芳烃异构化采用的催化剂包括(AC)A. 无定型SiO2-Al2O3B. 金属氧化物催化剂C. 负载型铂催化剂D. 金属硫化物催化剂E. 金属配位催化剂18. 芳烃主要来自以下哪几部分(ABE )A. 煤焦油分馏B. 石脑油重整生成油C. 催化裂化汽油馏分D. 加氢裂化汽油馏分E. 烃裂解生产乙烯副产的裂解汽油19. 在芳烃烷基化过程中,工业上常采用的烷基化剂有(D )A.烷烃和环烷烃B.烷烃和芳烃C.烯烃和芳烃D.烯烃和卤代烷烃20. 当烯烃、炔烃、二烯烃和芳烃在同一催化剂上单独加氢时,其加氢反应速率快慢大致为(ABE )。
第五章 氧化反应

(反式)
OAc B: + H O C C O Pb OAc OAc BH + 2 C O + Pb(OAc)2 + OAc
2. 高碘酸为氧化剂
C OH + H5IO6 C OH C C O O I O OH OH OH 2 C O + HIO3 + H2O
(反式不被氧化) 如:抗呕吐药甲磺酸多拉司琼中间体二醛的合成
(二) 锰的化合物作为氧化剂 1 KMnO4在强酸性、碱性和中性条件都可以将伯醇氧 化成酸,仲醇氧化成酮。
H C OH
N
C O
N
α-位无H,酮 收 率 高
H2 OHH2 R C C C R ' OH H α-位有H
OHH 2 R C C C R' H
被MnO4氧化断裂,使产物复杂。避免方法:加Mg2+、Al3+
EtO O EtO O OH OH EtO O CHO CHO
OsO4
NaIO4
第三节
醛酮的氧化反应
CHCH3
+ CH3CH
CHCH2 OCOR
(90%)
(10%)
原因:
RCHCH CH2 Cu
>
RCH
CH CH2 Cu
(稳定性)
第二节
醇的氧化反应
一 伯、仲醇被氧化成醛、酮 (一) 铬的化合物作为氧化剂
1 铬酸为氧化剂 ,脂肪或酯环的仲醇被氧化成酮,收率好。
R R' R R'
[O]
C O
CH OH
CH3 NO2 Cl 1)KMnO ,NaOH HOOC 4
2)HCl
Cl NO2
高锰酸钾特点:不管多长侧链均被氧化成-COOH
第六章氧化反应

第四节 醛、酮的氧化
• 一、醛的氧化 • 1.反应通式
• 2.应用特点 • (1)醛氧化制备羧酸
新制Ag2O、CuO氧化
(2)Dakin反应
当醛基的邻、对位有-OH等供电子基时,则 经过酸氧化,甲酸酯中间体生成羟基
当-CHO邻、对位有供电子基时,芳环电子云密度较 丰富,有利于“b式”重排;若无取代基或供电子 基在间位以及存在吸电子基时,则按“a式”重排, 形成酸。
• O3/H2O2; O3/Zn/H+; O3/DMS; O3/Ph3P
• NaIO4/KMnO4; NaIO4/OsO4替代方法
第六节 芳烃的氧化反应 一 芳环的氧化开裂 1. KMnO4氧化
即:芳环上有供电子基的优先被氧化
2. RuO4氧化
3 CuCl+Py氧化
二、氧化成醌 1.铬酸氧化剂
• M-CPBA
• OsO4 • Bromohydrin
• Prevost • Woodward
5. Asymmetric Dihydroxylation Reaction
Sharpless Catalytic Asymmetric Dihydroxylation (AD) Reaction
三、烯烃的氧化性断裂及还原性断裂
• 二、酮的氧化
• Baeyer-Villiger oxidation
反应机理
迁移能力:3>2>环己基>苄基>苯基>1>H 越富电子烷基越先迁移
第五节 含烯键化合物的氧化
一、烯键的环氧化 1.a、b-不饱和羰基化合物的环氧化
环氧化机理:
此键可旋转,最终生成比较稳定的E型环氧 化合物
如:
两个较大基团在环的两侧
第7章化学工艺学

原料气纯度
乙烯含量≥99.5% 氧气纯度≥99.5% 其中乙炔含量<30ppm 硫化氢含量< 3ppm
乙炔和亚铜离子反应生成乙炔铜 乙炔钯盐反应生成钯炔化合物并析出金属钯 在酸性介质下,硫化氢与的PdCl2反应生成硫化钯沉淀从溶
液中析出
改变了催化剂溶液的组成,使催化剂活性下降。
转化率及反应器进气组成
7.2.1 催化自氧化
具有自由基链式反应特征,能自动加速的 氧化反应称为自氧化反应
使用催化剂加速链的引发,称为催化自氧 化
工业上生产有机酸、过氧化物
催化剂多为Co、Mn等过渡金属离子的盐 类,溶解在液态介质中形成均相
助催化剂,又称氧化促进剂,缩短反应诱 导期,加速反应的中间过程 溴化物 有机含氧化合物
(7 36) (7 37)
甲烷氧氯化制氯甲烷 二氯乙烷氧氯化制三氯乙烯、四氯乙烯已工业化
8C 2 H 4 Cl 2 6 Cl 2 7 O 2 CuCl 2 KCl/Carrier 4 C 2 HCl 3 4 C 2 Cl 4 14 H 2 O (7 38)
420 C
流程短,设备少,建厂投资可减少15%~30% 纯氧作氧化剂可提高进料浓度和选择性,生产成本大
约为空气氧化法的90% 反应温度低,有利于延长催化剂的使用寿命 适宜大规模生产,生产成本低,产品纯度可达99.99%
7.4.3 乙烯直接氧化法制环氧乙烷的反应
主反应:
C2H4+O2C2H4O DH0298K= -103.4KJ/mol 平行副反应:
7.3.3 非均相催化氧化催化剂
(1) 催化剂
活性组分主要有可变价的过渡金属钼、铋、钒、钛 、钴、锑等的氧化物
有机工艺学--烃类选择性氧化

7.2.2 配位催化氧化
催化剂由中心金属离子和配位体构成,金属离子 与反应物形成配位键并使其活化,反应物被氧化,金 属离子或配位体被还原,还原态的催化剂再被分子氧 氧化为初始态,完成循环。
●配位催化氧化过程
配位
初始态 催化剂
反应物 氧化
还原态 催化剂
产物
催化剂由中心金属 离子与配位体构成
k4反应速率最慢,对羧基苯甲醛氧化为对苯二甲酸
为控制步骤
◆副反应
◆氧化机理p227
催化剂能活化第一个甲基,但难以氧化第二个甲 基;溴化物活化第二个甲基。
●加氢精制
◆加氢精制 在高温、高压下使粗TPA溶于水,然后在钯催化剂
存在下对杂质进行加氢反应,使粗对苯二甲酸产品中 的杂质对羧基苯甲醛(4-CBA)还原为易溶于水的对甲 基苯甲酸(即PT酸),其他有色杂质也同时被分解。
★压力 由反应温度确定
●乙烯配位催化氧化制乙醛工艺
◆一段法----Hoeschst工艺 三个反应在同一反应器进行
◆二段法----Wacker-Chemie工艺 乙烯羰化和钯的氧化在一台反应器中, Cu+的氧化在另一反应器中。
调节温度,保证回流液中 乙醛含量尽可能少
65%乙烯和8%氧,排放防 止惰性气体积累
工业上用于生产有机酸、过氧化物p224
●烃类自氧化反应机理—自由机链式反应机理
烃分子均裂生成自由基 决定性步骤
ROOH的生成是链传递反应的控制步骤
烃分子发生均裂的活化能 叔C-H<仲C-H<伯C-H
链传递受(7-3)控制,ROOH不稳定,可生成新自由基 产物组成中有:醇、醛、酮、酸,组成复杂
●催化自氧化催化剂p224
进一步吸 收未冷凝 回收 的乙醛 乙醛 和催 化剂 雾沫
催化氧化(烃类选择性氧化)
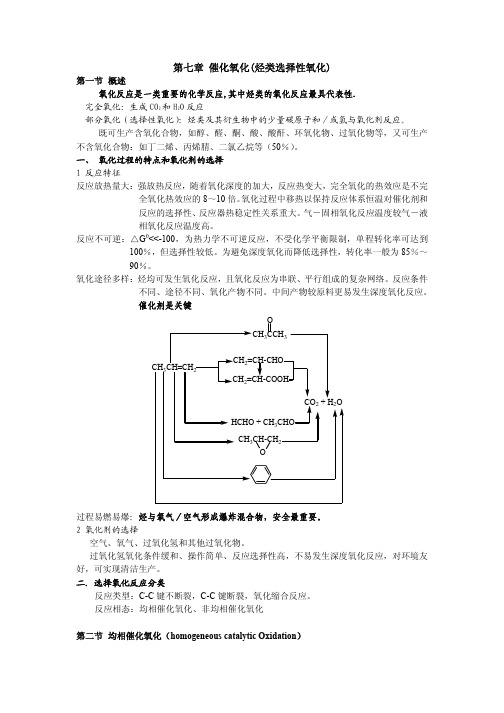
催化自氧化、络合催化氧化、烯烃的液相环氧化
一.催化自氧化 1 反应特征
O2 + CH3CHO(l)
CH3COOH 诱导期长,开始慢,迅速完成反应
O2 + CH3CHO(l) Mn(Ac)2 CH3COOH
O
CH3CCH3
CH3CH=CH2
CH2=CH-CHO CH2=CH-COOH
CO2 + H2O HCHO + CH3CHO
CH3CH-CH2 O
过程易燃易爆:烃与氧气/空气形成爆炸混合物,安全最重要。 2 氧化剂的选择
空气、氧气、过氧化氢和其他过氧化物。 过氧化氢氧化条件缓和、操作简单、反应选择性高,不易发生深度氧化反应,对环境友 好,可实现清洁生产。 二.选择氧化反应分类
CH2=CH2 + 1/2O2 H2O
CH3CHO
烯烃与亲核试剂不反应,当与高价金属离子配位后,电子云密度降低,方与亲核试剂
反应,氧化最容易在最缺氢原子的碳原子上进行。由于空间位阻效应和钯催化异构化的影响,
氧化反应速度随碳原子数的增多而递减,选择性降低。
2、 Wacker 反应的作用
乙烯均相络合催化氧化工艺的选择性高,促进了过渡金属络合物催化剂对烯烃液相氧
在下才能使丙烯环氧化。
CH3 CH3-C-H + O2
CH3
H3C
CH3
HOOC
COOH 反应产物为稳定的有机物,不易进一步氧化
CH3CHO
CH3COOH 高转化率和高选择性
而对于目的产物为中间产物的,由于中间产物较原料更易氧化,故应控制单程转化率,
第五章氧化反应

H2 OHH2 CCC
R' OH
H
α-位有H
R
C
OHH2 CC
R'
H
被MnO4氧化断裂,使产物复杂。避免方法:加Mg2+、Al3+
OH CH CH3
CH CH3 OH
KMnO4 Mg(NO3)2
O C CH3
C CH3 O
66%
2 活性MnO2:新鲜制备的MnO2,能选择性氧化α,β不饱和醇(如烯丙位、苄位、炔基等)为相应的羰基化 合物。
第五章 氧化反应
氧化反应:使底物增加氧或失去氢的反应
第一节 烃类的氧化反应
苄位、烯丙位及羰基 α-活性位重要,有实际意义,其 他位置则无实际意义,因氧化产物复杂。
一、 苄位烃基的氧化
形成醛 形成酮 形成酸
(一) 形成醛
(1) CrO3/Ac2O/H2SO4试剂,先生成二磺酸酯,再
水解成醛
O
CH3
OCH3
CH3O
CHO
(二)铬酸为氧化剂
CH3O
KMnO4
H2O
CH3O
OCH3 COOH
O
CHO
H2CrO4
O
O
O
胡椒醛
COOH
(三)有机过氧酸为氧化剂
有机过氧酸为强氧化剂,可将芳醛氧化成羧酸,但 选择性差,在将芳醛氧化成羧酸同时,也能把分子中易 被氧化的氨基、酚羟基等副产物。
OH CO
I OH
CO
OH
O
(反式不被氧化)
2 C O + HIO3 + H2O
如:抗呕吐药甲磺酸多拉司琼中间体二醛的合成
EtO
EtO
OsO4
7烃类选择性氧化过程全解

环氧化的主、副反应
主反应:过氧化氢有机物对烯烃的环氧化
r1 = k1[烯烃][ROOH][催化剂]
副反应:过氧化氢有机物自身分解
r2= k2[ROOH]
收率YR =
化学工艺学
烯烃环氧化的影响因素
丙烯浓度和温度对收率有影响
提高丙烯浓度,有利于提高收率
温度在100℃左右,收率可大于90%-95%
反应条件对乙烯环氧化的影响
反应温度 空速 反应压力 原料配比及致稳气 原料气纯度 乙烯转化率
化学工艺学
反应温度的影响
反应温度是影响选择性的主要因素 100℃时产物几乎全是环氧乙烷,300℃ 时 产物几乎全是二氧化碳和水 工业上一般选择反应温度在220~260℃
权衡转化率和选择性,使EO收率最高
化学工艺学
乙烯直接氧化法制环氧乙烷
反应机理
原子态吸附氧是乙烯银催化氧化的关键氧种。 原子态吸附氧与底层氧共同作用生成环氧乙烷或 二氧化碳,分子氧的作用是间接的。 乙烯与被吸附的氧原子之间的距离不同,反应生 成的产物也不同 减弱吸附态氧与银表面键能,可提高反应选择性
化学工艺学
乙烯直接氧化法制环氧乙烷
甲烷氧氯化制氯甲烷 二氯乙烷氧氯化制三氯乙烯、四氯乙烯已工业化
8 C 2 H 4 Cl 2 6 Cl 2 7 O 2
CuCl 2 KCl/Carrier 420 C
4 C 2 HCl 3 4 C 2 Cl 4 14 H 2 O (7 38)
化学工艺学
非均相催化氧化反应机理
化学工艺学
非均相催化氧化
工业上使用的有机原料:
具有π电子的化合物
烃类选择性氧化

劣势
轴向返混严重 ,串联副反应严重 ,不利于提高X; 磨损严重,要求 催化剂强度好,旋 风器分离效果好; 气-固接触不 良,X下降,空速受 限因素多(催化剂 密度、反应器高度 、分离器回收催化 剂的能力);
改进
反应(提升管 )、再生在两个 不同区域进行; 在反应区催化 剂晶格氧(V-PO)氧化原料,无 爆炸之忧,可提 高处理量; 被还原的催化 剂在再生区吸氧 再生;
CH2 O
乙 二 环氧乙烷 水 醇
CH2
OX CH2 Y
CH2 +XY
7.4.2 环氧乙烷的生产方法
氯醇法
C 5 0°
C H 2 = C H 2 + C l2 + H 2 O
C H 2-C H 2 + H C l OH Cl
2 C H 2 C H 2 + C a (O H ) 2 OH Cl
-
1 0 0° C
活性组分主要有可变价的过渡金属钼、铋、钒、钛 、钴、锑等的氧化物+助催化剂+载体 。 工业催化剂采用两种或两种以上的金属氧化物构成 ,克服了单一过渡金属氧化物活性和选择性不协调 变化的现象。 常用载体:氧化铝、硅胶、刚玉、活性炭
非均相催化氧化反应器
固定床反应器:列管式换热反应器
流化床反应器
有垂直管束内构件的流化床反应器
1-烃类原料气入口; 2-空气入口; 3-气体分布器; 4-旋风分离器; 5-垂直管束; 6,7-载热体出入口
反应器特点比较
列 管 式 反 应 器 优势 气体在床层内流 动性接近平推流,返 混较小; 适用于副反应为 串联反应,提高选择 性; 对催化剂的强度 和耐磨性无特殊要求 。 劣势 结构复杂, 催化剂装卸困难; 空速较小,生 产能力不大; 反应器轴向温 度分布存在热点; 对催化剂的耐 热温度和最佳活性 温度影响大。 改进 原料气中加 微量抑制剂,部 分中毒,控制活 性; 入口装填惰 性载体稀释的或 老化的催化剂; 分段冷却法。
人教版(2019)选择性必修三有机化学方程式总结-烃类物质

烃类物质的方程式总结一、烷烃(CH 4)(1)氧化反应 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 二、烯烃1.乙烯的性质(1)氧化反应 ①可燃:H 2C=CH 2+3O 2 2CO 2+2H 2O ②乙烯可以使酸性高锰酸钾溶液褪色。
(2)加成反应 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)加聚反应 生成聚乙烯:n H 2C=CH 2 n 2.共轭二烯烃的加成反应①1,2-加成 CH 2===CH —CH===CH 2+Cl 2―→; ②1,4-加成 CH 2===CH —CH===CH 2+Cl 2―→。
3.烯烃被酸性高锰酸钾氧化所得产物的判断烯烃被氧化的部位 CH 2= RCH= 氧化产物 CO 2 RCOOH三、乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH↑+Ca(OH )2 (1)氧化反应①乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O ②使酸性高锰酸钾溶液褪色。
(2)加成反应 与溴水加成:HC ≡CH+Br 2 CHBr=CHBr CHBr=CHBr+Br 2 CHBr 2—CHBr 2 与氢气加成:HC ≡CH+H 2H 2C=CH 2 与氯化氢加成:HC ≡CH+HClCH 2=CHCl 与水加成反应:HC ≡CH+H 2OCH 3CHO (3)聚合反应 点燃 光照 光照 光照 点燃 催化剂 △ 一定条件 CH 2-CH 2 点燃CH=CH催化剂 △ 催化剂 △ 光照乙炔加聚,得到聚乙炔:n HC CH n 四、芳香烃1.苯 (1)氧化反应: 苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能因加成使溴水褪色,不能使酸性高锰酸钾溶液褪色。
烃类氧化反应机理的研究与应用

烃类氧化反应机理的研究与应用烃类氧化反应是生命起源、能源转化以及环境污染等方面的重要反应。
其反应机理的研究和应用是化学、生物、物理、工程等多学科交叉的领域。
本文就烃类氧化反应机理的研究和应用进行探讨。
一、烃类氧化反应机理的研究1、基础理论烃类氧化反应可分为三个步骤:链发生反应、支链反应和氧化反应。
其中,链发生反应是烃类氧化反应的关键。
它包括氢的脱除、自由基的产生、自由基的重组和自由基的转移等过程。
而支链反应是在链发生反应基础上,由分子中的自由基引发链传递反应,从而影响反应速率的过程。
氧化反应是烃类氧化反应的最终步骤,它由氧分子与形成的自由基反应而产生。
了解这些反应步骤,可以通过实验和计算方法探究烃类氧化反应的机理。
例如,实验可以使用光解激发或热解激发,并分析样品的反应产物。
而计算方法包括密度泛函理论、分子轨道方法等,这些方法可以用来计算反应中的能量变化、键合情况和反应产物等信息。
2、催化剂催化剂是烃类氧化反应中的重要角色,它们可以提高反应速率和选择性,同时降低反应温度和压力。
常用的催化剂包括金属催化剂、酸碱催化剂、过渡金属催化剂等。
这些催化剂可以通过改变反应活性中心、吸附反应物和产物等方式来提高反应速率。
催化剂的选择需要结合反应的特点和产物的需要进行,例如,甲基苯和氧气可以通过金属氧化物催化剂反应得到过氧乙酸和苯甲醛。
而丙烷可以通过ZSM-5等酸性分子筛催化剂反应得到丙烯和丙烷醛。
二、烃类氧化反应在实际应用中的应用1、生命起源烃类氧化反应在生命起源中发挥着重要作用。
生命中的有机化合物多数来源于自然界中的无机物,如水、氨、二氧化碳等。
但是这些物质往往不是生物所需的,因此需要通过烃类氧化反应来转化为生物所需的有机物。
例如,植物的光合作用就是一种烃类氧化反应。
在光合作用中,植物利用太阳能将二氧化碳和水转化为有机物质,如葡萄糖和蛋白质等,从而实现生物体的生长和代谢活动。
2、能源转化现代社会对能源的需求越来越大,烃类氧化反应在能源转化中发挥着重要的作用。
co和烃类氧化反应

co和烃类氧化反应Co和烃类氧化反应一、引言Co和烃类氧化反应是化学领域的一个重要研究方向。
Co是指钴元素,而烃类则是指由碳和氢组成的化合物。
在氧化反应中,Co起到催化剂的作用,促使烃类与氧气发生反应,产生相应的氧化产物。
本文将对Co和烃类氧化反应进行详细介绍。
二、Co和烃类氧化反应的机理Co和烃类氧化反应的机理可以概括为以下几个步骤:1. Co的活化:在反应体系中,Co首先与氧气发生反应,形成活性的Co氧化物。
这个步骤通常需要提供适当的温度和压力条件,以促进反应的进行。
2. 烃类的吸附:活性的Co氧化物会吸附烃类分子,通过化学键的形成,将烃类分子固定在Co表面。
3. 氧气的吸附:同时,氧气分子也会吸附在Co表面,与吸附在Co 上的烃类分子发生反应。
4. 氧化反应:吸附在Co表面的烃类分子与吸附的氧气分子发生氧化反应,生成相应的氧化产物。
这个过程中,Co起到催化剂的作用,促使反应的进行。
5. 产物的解吸:氧化产物在反应体系中逐渐解吸,从而脱离Co表面。
三、Co和烃类氧化反应的应用Co和烃类氧化反应在工业生产中有着广泛的应用。
以下是其中几个重要的应用领域:1. 化工工业:Co和烃类氧化反应被广泛应用于化工工业中,用于合成各种有机化合物。
例如,乙烯可以通过Co和烃类氧化反应制备乙醛、乙酸和乙二醇等化合物。
2. 药物工业:Co和烃类氧化反应在药物工业中也有重要应用。
许多药物的合成过程中需要使用到氧化反应来引入氧原子,改变分子结构。
通过Co和烃类氧化反应,可以有效地合成各种药物前体和中间体。
3. 环境保护:Co和烃类氧化反应也可以用于环境保护领域。
一些有机废水中的有害物质,如苯、甲苯等烃类化合物,可以通过Co 和烃类氧化反应进行降解,从而减少对环境的污染。
四、Co和烃类氧化反应的优势和挑战Co和烃类氧化反应具有以下优势:1. 高效性:Co作为催化剂,可以大大提高反应速率和产物收率,使得反应更加高效。
2. 可选择性:Co和烃类氧化反应可以选择性地将特定的烃类氧化为目标产物,避免了不必要的副产物的生成。
β氧化的四个步骤

β氧化的四个步骤
β氧化的四个步骤为脱氢、加水、再脱氢、硫解。
其具体过程如下:
1. 脱氢:脂酰CoA在脂酰基CoA脱氢酶的催化下,其烃链的α、β位碳上各脱去一个氢原子,生成α、β烯脂酰CoA(trans-y-enoyl CoA),脱下的两个氢原子由该酶的辅酶FAD接受生成FAD.2H;
2. 加水:α、β烯脂酰CoA在烯酰CoA水合酶的催化下,加水生成β-羟脂酰CoA(β-hydroxyacyl CoA);
3. 再脱氢:β-羟脂酰CoA在β-羟脂酰CoA脱氢酶催化下,脱去β碳上的2个氢原子生成β-酮脂酰CoA,脱下的氢由该酶的辅酶NAD+接受,生成NADH+H+;
4. 硫解:β-酮脂酰CoA在β-酮脂酰CoA硫解酶催化下,加一分子CoASH使碳链断裂,产生乙酰CoA和一个比原来少两个碳原子的脂酰CoA。
以上四步反应均可逆行,但全过程趋向分解,尚无明确的调控位点。
1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学工艺学
温度和氧气分压的影响
氧气浓度高时,反应由动力学控制, 较高温度有利
氧气浓度低时,反应由传质控制,增 大氧分压有利
氧气分压改变对反应的选择性有影响
化学工艺学
氧化剂用量和空速的影响
氧化剂用量应避开爆炸范围 空速的大小受尾气中氧含量约束
化学工艺学
催化自氧化
具有自由基链式反应特征,能自 动加速的氧化反应。使用催化剂 加速链的引发,称为催化自氧化
工业上生产有机酸、过氧化物
化学工艺学
催化自氧化催化剂
催化剂多为Co、Mn等过渡金属离子 的盐类,溶解在液态介质中形成均相
助催化剂,又称氧化促进剂
缩短反应诱导期,加速反应的中间过程
化学工艺学
化学工艺学
均相催化氧化
烯烃液相环氧化
❖ 丙烯环氧化联产苯乙烯的工艺流程
选 用 乙 苯 作 溶 剂 , 反 应 温 度 115℃ , 压 力 3.74MPa
催化剂为可溶性钼盐,过氧化氢乙苯的转化 率可达99%,丙烯转化率10%左右,丙烯转 化为环氧丙烷的选择性为95% 化学工艺学
化学工艺学
均相催化氧化过程反应器的类型
第七章 烃类选择性氧化过程
化学工艺学
主要内均相、非均相) 氧化反应的典型产品和工艺
化学工艺学
氧化反应
化学工业中氧化反应是一大类重 要化学反应,它是生产大宗化工 原料和中间体的重要反应过程
有机物氧化反应当数烃类的氧化 最有代表性
烃类氧化反应可分为完全氧化和 部分氧化两大类型
配位
Pd2+ +烯烃
烯烃氧化物 + Pd0
Pd2+
H+ O2
Cu
PdCl2 催化剂 CuCl2 氧化剂
Cu2+ Cu+
化学工艺学
烯烃的液相配位催化氧化
烯烃中双键打开形成羰基是反应的控制 步骤
烯烃必须溶解在催化剂溶液中才能活化 常见溶剂
水、乙醇、二甲基甲酰胺、环丁砜
化学工艺学
典型的瓦克法反应
副反应:过氧化氢有机物自身分解
r2= k2[ROOH]
收率YR =
化学工艺学
烯烃环氧化的影响因素
丙烯浓度和温度对收率有影响 提高丙烯浓度,有利于提高收率 温度在100℃左右,收率可大于90%-95% 烯烃与ROOH的配比 2:1~10:1 ROOH的空间位阻和电子效应 溶剂性质对主反应有影响
联产物量大
生产环氧丙烷
α-
过
氧 化 氢 乙
丙烯
环
甲
氧 丙 烷
+
基 苯 甲 醇
苯
苯乙烯
脱水
化学工艺学
环氧化反应催化剂
能溶于反应介质的过渡金属的有机 酸盐类或配合物 环烷酸钼、乙酰丙酮钼、六羰基钼 氧化还原电位低、L酸酸度高
化学工艺学
环氧化的主、副反应
主反应:过氧化氢有机物对烯烃的环氧化
r1 = k1[烯烃][ROOH][催化剂]
化学工艺学
均相催化氧化
自氧化反应机理
化学工艺学
均相催化氧化
自氧化反应过程的影响因素
溶剂的影响 杂质的影响 温度和氧气分压的影响 氧化剂用量和空速的影响
化学工艺学
溶剂的影响
溶剂能改变反应条件 溶剂对反应历程有影响 溶剂可产生正效应促进反应 可产生负效应阻碍反应
化学工艺学
杂质的影响
过程易燃易爆
安全性
化学工艺学
氧化剂的选择
空气 纯氧 过氧化氢 其它过氧化物 反应生成的烃类过氧化物
或过氧酸
化学工艺学
烃类选择性氧化过程的分类
反应类型: 碳链不发生断裂的氧化反应 碳链发生断裂的氧化反应 氧化缩合反应
化学工艺学
烃类选择性氧化过程的分类
反应相态
催化自氧化
均相催化氧化 络合催化氧化
烯烃氧化为羰基化合物
烯烃氧化为乙二醇酯
烯烃的醋酸化
氧羰基化
氧化偶联
化学工艺学
均相催化氧化
烯烃液相环氧化
氯醇法
生产环氧丙烷
化学工艺学
均相催化氧化
优点
缺点
流程短 投资少 选择性好 收率高 生产安全
设备腐蚀性大 废水量大
需要充足氯源 污染严重
化学工艺学
均相催化氧化
烯烃液相环氧化
共氧化法
空气或氧气氧化 乙苯
化学工艺学
非均相催化氧化
工业上使用的有机原料:
➢ 具有π电子的化合物 烯烃 芳烃
➢ 不具有π电子的化合物 醇类 烷烃
低碳烷烃的选择性氧化: 丁烷代替苯氧化制顺酐 丙烷代替丙烯氨氧化制丙烯腈
化学工艺学
重要的非均相氧化反应
烯烃的液相环氧化
非均相催化氧化
化学工艺学
均相催化氧化的特点
活性高、选择性好 反应条件不太苛刻,反应比较平稳 设备简单,容积较小,生产能力较高 反应温度通常不太高,反应热利用率较低 在腐蚀性较强的体系时要采用特殊材质 催化剂多为贵金属,必须分离回收
化学工艺学
均相催化氧化的类型
催化自氧化反应 配位催化氧化反应 烯烃液相环氧化
化学工艺学
初始态 催化剂
配位催化氧化反应
配 位
反应物 氧化
产物
还原态 催化剂
催化剂由中心金 属离子与配位体 构成
分子氧 化学工艺学
络合(配位)催化氧化
烯烃的液相氧化 瓦克法 (Wacker) 氧化最容易在烯烃中最缺氢原子的碳上进行 氧化反应速率随碳原子数的增多而递减
化学工艺学
烯烃催化自氧化的催化循环
化学工艺学
氧化反应
主要化学品中50%以上和氧化反应有关 含氧:醇、醛、酮、酸、酸酐、环氧化
物、过氧化物等 不含氧:丁烯氧化脱氢制丁二烯
丙烯氨氧化制丙烯腈 乙烯氧氯化制二氯乙烷
化学工艺学
氧化反应的特点
反应放热量大
热量的转移与回收
反应不可逆
目的产物为中间氧化物
氧化途径复杂多样 催化剂 反应条件
催化自氧化反应的助催化剂
溴化物
溴化钠、溴化铵、四溴乙烷、四溴化碳
有机含氧化合物 甲乙酮、乙醛、三聚乙醛
化学工艺学
自氧化反应引发剂
产物为烃类过氧化氢,不需要催 化剂,用少量引发剂引发反应
异丁烷过氧化氢 偶氮二异丁腈
化学工艺学
均相催化氧化
自氧化反应机理
烃分子均裂生成自由基 决定性步骤
ROOH的生成是链传递反应的控制步骤
搅拌鼓泡釜式反应器 均相反应 连续鼓泡床塔式反应器
内冷却管 外循环冷却器 循环导流筒
移热方式
化学工艺学
非均相催化氧化
反应温度较高,有利于能量的回收和节能 单位体积反应器的生产能力高,适于大规
模连续生产 反应过程的影响因素较多 反应物料与空气或氧的混合物存在爆炸极
限问题,必须特别关注生产安全。
