最新化学第九章醇和醚
有机化学-第九章

甲醇(球棒模型) CH3OH 甲醇(球棒模型)
乙醇(比例模型) C2H5OH 乙醇(比例模型)
9.1 醇的结构和分类
由于氧原子的强吸电子作用,使醇羟基上的氢有一定的酸 酸 性,而氧原子上的未共用电子对则有一定的碱性和亲核性 碱性和亲核性 。 受羟基的影响,醇的α-碳和该碳上的氢(α-H)容易发 生氧化或脱氢反应 氧化或脱氢反应,而β-碳上的氢则可参与分子内的脱 氧化或脱氢反应 分子内的脱 水反应。 水反应
醇一般有如下酸性强弱次序: CH3OH > 1o ROH > 2o ROH > 3o ROH
9.2 醇的化学性质
醇的酸性虽然很弱,但也足以使Grignard试剂发生分解。 Grignard试剂 Grignard试剂
9.2 醇的化学性质
醇羟基中的氢可被活泼的金属单质置换,放出氢气并生成 醇金属。
9.2 醇的化学性质
9.2 醇的化学性质
醇氧化与脱氢反应
一、醇的氧化
1.伯醇的氧化 1.伯醇的氧化 由于羟基的影响,醇的α-氢原子比较活泼,容易被氧 化。伯醇被氧化剂(如K2Cr2O7、KMnO4、浓HNO3等)氧化时, 先是生成醛,然后进一步被氧化,生成羧酸。
9.2 醇的化学性质
采用一种称为 PCC 的氧化剂,用于氧化伯醇制取醛是比 较好的氧化方法之一。PCC(pyridinium chlorochromate) PCC( chlorochromate) PCC 在盐酸溶液中的络合盐,又称Sarrett试 Sarrett试 是吡啶和 CrO3 在盐酸溶液中的络合盐 Sarrett 剂,是橙红色晶体,它溶于 CH2Cl2,在室温下便可将伯醇 氧化为醛。
9.3 酚的结构分类以及化学性质
酚羟基上的反应
有机化学醇和醚
3. 溶解性 醚一般微溶于水,能与水分子形成氢键;易溶于有机溶剂。 由于 醚的化学性质不活泼,是良好的溶剂。
§10.9 醚的化学性质
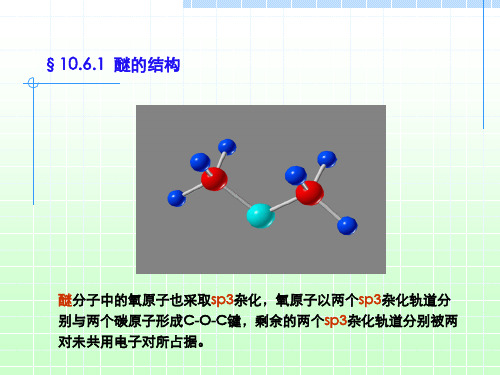
醚键(C-O-C)的极性很小,比较稳定。
对碱、氧化剂、还原剂都很稳定; 在常温下醚也不与金属钠作用; 但是在一定条件下,醚也能发生某些化学反应。
§10.9 醚的化学性质
+ CH3CH2I
CH 3CH 2I
+ H2O
混醚与氢碘酸作用时,一般是较小的烃基生成碘代烷,较大的烃基
生成醇或酚。
CH 57%HI O C H 2 5 3 △ O C H 2 5 HI △ C H OH 2 5 OH + C H I 2 5 +
CH I 3
§10.9.2 络合物的生成 醚可以将氧上的未共用电子对与缺电子的试剂(如BF3、AlCl3、 RMgX等)形成相应的络合物。
HOCl
HOCH2 CH2 Cl
§10.10 重要的醚
环氧乙烷
b. 化学反应
在酸或碱催化下可以与许多含活泼氢的试剂(如水、氢卤酸、醇、氨
等)发生化学反应。
CH2 O
CH2
+
HA
CH2 OH
CH2 A
式中:A代表-OH,-X,-OR,-NH2等。
§10.10 重要的醚
环氧乙烷
b. 化学反应
① 与水反应
用,形成佯盐,而溶于强酸体系(如浓硫酸、浓盐酸)。
金 羊盐不稳定,遇水很快分解为原来的醚。
§10.9.1 佯盐的形成和醚键的断裂
醚键的断裂
醚与浓氢卤酸(一般用氢碘酸)共热,醚键可以断裂生成卤代烷 和醇。如果氢卤酸过量,生成的醇进一步反应生成卤代烷。
醇和醚的介绍

丁、汞化-脱汞
trans-2-methylcyclopentanol
丁、 羟汞化-脱汞反应
RCH
O 羟汞化
CH2 + H2O + Hg (OCCH3)2
RCH
OH
O CH2 O + CH3COH Hg -OCCH3
RCH CH2 + OH + NaBH4 OH Hg -OCCH3 O
脱汞
O
RCH CH2 + Hg + CH3CO
4、 醛、酮、羧酸和酯的还原
CHO H2
Pd C
CHO H2, 压力
Pd C
① LiAlH4,乙醚 ② H+,H2O
CH2OH
CH2OH
① LiAlH4,乙醚
(CH3)3CCOOH ② H+,H2O
(CH3)3CCH2OH
H5C2OOC(CH2)8COOC2H5 Na,C2H5OH HOCCH2(CH2)8CH2OH
5-甲基二环[2.2.1]-2-庚烯-7-醇
5-methylbicyclo[2.2.1]-2-hepten-7-ol
二、醇的结构
H 0.1095nm C
H
109°
O 0.096nm
H
0.143nm
H
醇可以给出质子,也可以接受质子,是Bronsted 酸碱
醇可以给出电子,也是Lewis碱
三、 醇的制备:
第二节 醚( )
一. 醚的命名( ) 二. 醚的制备( ) 三. 醚的化学性质( ) 四. 环氧化合物的性质 ( )
Do you know alcohol?
If you drink 5 mL of methanol, you will be blinded!
第九章 醇酚醚

酚与羧酸直接酯化困难
二、芳环上的反应
1. 卤代 芳卤的生成往往需在FeX3的催化下完成,但 苯酚的卤代不需催化即可立即与溴水作用,生 成 2,4,6 – 三溴苯酚.
OH + Br2
H2O
OH Br Br Br + (白 色) 3 HBr
该反应可用于酚的定性鉴定
9-3
9-3-1 醚的分类和命名
R
O H
Z n C l2 H C l
R C l + H
2
O
3o 醇 、烯丙醇、苄醇 2o 醇 1o 醇
室温下反应液立即混浊、分层 2 ~ 5 min.反应液混浊、分层 加热后反应液混浊、分层
§9-1-5
重要的醇
乙二醇制备:环氧乙烷水合法
9-2
酚
酚系指羟基(―OH)与苯环直接相连的化合物。
9-2-1 分类、命名和结构 酚的分类 — 按照酚类分子中所含羟基的 数目多少,分为一元酚和多 元酚。
。 3 RO H
SN2, 一般不重排 SN1, 有重排
C H3 H3C C C H3 H
+
C H3 C H2O H + HBr H3C C C H3 C H3 H3C C C H2+ H3C C H3 C
+
C H3 C H2Br + H3C C Br Br C H2C H3 C H2C H3
C H3
饱和醇
醇的异构与命名 醇的构造异构包括碳链异构和官能团异构。
碳链异构
CH3(CH2)2CH2OH正丁醇C来自3—CH—CH2OHCH3
异丁醇(2-甲基-1-丙醇)
• 官能团位置异构
CH3CH2CH2OH
高等教育有机化学 第九章

RCOOH
2CH3CH2OH + Cr2O7
橙红
+ Cr3+ 绿色 K2Cr2O7 CH3COOH
仲醇氧化生成酮
RCH 2OH OH
[O]
RCHO K2 Cr2 O7 - 稀H2 SO4
[O]
ROOH =O (85%)
——叔醇无α﹣氢原子,在碱性条件下不易被 氧化,在酸性(例:硝酸)条件下脱水生成烯 烃,然后氧化断链生成小分子化合物(无实用 价值)
CH3OH>RCH2OH>R2CHOH>R3COH
RCH2O-溶剂化作用大、稳定,因此RCH2OH中的
质子易于离解,酸性大;R3CO-溶剂化作用小, 不如RCH2O-稳定,因此R3COH中质子不易离解
醇金属
醇与金属钠反应发生氢氧键的断裂,放出氢
气,生成醇钠
ROH + M → ROM + H2↑ M = K、Na、Mg、Al
命名
酚的物理性质
纯净的苯酚是没有颜色的晶体,具有特殊气
味,熔点是 43℃。常温时,苯酚在水里溶解 度不大,当温度高于70℃时,能跟水以任意 比互溶。 苯酚易溶于乙醇、乙醚等有机溶剂。苯酚有 毒,它的浓溶液对皮肤有强烈的腐蚀性
一元酚的反应
1.弱酸性:
苯酚羟基上氢原子可有少量电离 而呈现弱酸性,其pKa=9.98。 a. 若苯环邻、对位有强吸电子基降低氧原 子电子云密度,酸性增强。 如:邻硝基酚pKa=7.23;2,4—二硝基苯的 pKa为4.0;2,4,6—三硝基苯酚pKa为 0.71,已属于有机强酸了。
CH3CH2OH + Na → CH3CH2ONa + H2↑ (CH3)3COH + K → (CH3)3COK + H2↑ CH3CH(OH)CH3 + Al → ((CH3)2CHO)3Al + H2↑
第9章醇酚醚的最新用途讲解

第九章醇、酚、醚本章知识要点1. 理解醇、酚和醚的结构;2. 理解醇、酚和醚的物理性质和光谱性质;3. 掌握醇、酚和醚的命名、化学性质及合成方法;4. 了解醇、酚和醚的来源及用途;5. 掌握β-消除。
【背景问题】(1) 酚和醇的结构中都含有羟基(-OH),他们的性质是否一致?(2) 生命体代谢过程中会产生琥珀酸,羟基酸,酮酸,氨基酸等有机酸及取代羧酸。
这些化合物的羧基在生命体中起的作用是什么?苯酚也称为“石碳酸”,它真的有酸性吗?如果有的话,跟碳酸、羧酸相比,哪个酸性更强?醚是由一个氧原子连接两个烃基而成。
常用于有机溶剂与医用麻醉剂。
醚类化合物的应用常见于有机化学和生物化学,它们还可作为糖类和木质素的连接片段。
(1) 醚分子中也有氧,同组分的醇和醚相比较,哪个沸点更高?(2) 从结构上看,醚的化学性质是否稳定?醇、酚、醚可以看作是水分子中的氢原子被烃基取代的衍生物。
水分子中的一个氢原子被脂肪烃基取代的是醇(R-OH),被芳香烃基取代的叫酚(Ar-OH),如果两个氢原子都被烃基取代的衍生物就是醚(R-O-Rˊ,Ar-O-R或Ar-O-Arˊ)。
9.1醇9.1.1 醇的结构、分类和命名1.结构醇(alcohol)中-OH叫羟基,是醇的官能团。
在醇分子中,碳原子和氧原子均处于sp3杂化状态,氧原子中两对未共用电子对分别占据一个sp3杂化轨道,剩下的两个未占满的sp3杂化轨道分别与C及H结合,形成碳氧σ键和氢氧σ键,由于氧原子的两个sp3杂化轨道上有未共用电子对,两对未共用电子对之间产生斥力,使得C-O-H 键角约为109°(见图9-1)。
醇分子中氧原子的电负性比碳原子强,所以氧原子上的电子云密度较高,使分子具有较强的极性。
CH°sp 3原子为sp 3杂化O 由于在杂化轨道上有未共用电子对,∠两对之间产生斥力,使得C-O-H 小于109.5sp 3图9-1 醇的结构2.分类1)根据醇分子中所含羟基的数目分为:一元醇、二元醇和多元醇。
第九章 醇和醚

B2H6 H2 O2 OH-
CH3-CH-CH2OH CH3
硼氢化-氧化反应的特点是具有高度的选择性, 硼氢化 氧化反应的特点是具有高度的选择性,是反马氏 氧化反应的特点是具有高度的选择性 规律加成取向,立体化学为顺式加成,且无重排产物生成。 规律加成取向,立体化学为顺式加成,且无重排产物生成。 是制备伯醇的好方法。 是制备伯醇的好方法。
亲核试剂 碱性试剂
1 2C2H5OH + 2Na C2H5OH + NaOH
2C2H5ONa + H2 C2H5ONa +H2O
2 2(CH3)3COH + 2K
2(CH3)3COK + H2
强碱性试剂 亲核性相对弱一些
醇的酸性强弱的分析
液相测定酸性强弱
H2O > CH3OH > RCH2OH > R2CHOH > R3COH > HC≡CH > NH3 > RH ≡
甲醇的结构
C-H 0.110nm O-H 0.096nm C-O 0.143nm ∠HCH=109◦ ∠HCO=110◦ ∠COH=109◦
2、醇的分类 、
根据羟基所连的C的性质分为伯醇、仲醇、叔醇。 根据羟基所连的 的性质分为伯醇、仲醇、叔醇。称为一级 的性质分为伯醇 二级醇…..,分别记为1° ° ° 醇,二级醇 ,分别记为 °,2°,3°等。如: RCH2OH R2CHOH R3COH
2、利用格利雅试剂合成 、
(1)与甲醛合成增加一个碳的伯醇 与甲醛合成增加一个碳的伯醇 与甲醛合成增加一个碳的
干醚 H2 O
RMgBr + HCHO
R-CH2-OMgBr
有机化学Chapter醇和醚

X-
RX
1。醇:SN 2
差的离去基团 好的离去基团
R-OH H+ R-O+H2 -H2O R+ X- RX
正碳离子
3。、2。醇:SN 1
醇与HX反应时,常伴有重排现象
CH3 CH3-C-CH 2OH
HBr
CH3
CH3
CH3-C-CH2CH3 + CH3-C-CH2Br
CH3
Br
CH3
(主要产物) (次要产物)
R
R
R
H-O H-O H-O H-O H-O
思考:乙二醇和甘油的沸点高低?
答案: 乙二醇 197℃ 丙三醇 290 ℃
② 溶解度:
醇在水中有一定的溶解度。C3以下醇与水混溶, C4以上随C数↑,溶解度↓。
原因:
a. 醇与水可形成分子间氢键:
R
H
R
H
R
H-O H-O H-O H-O H-O
b. 随C数↑,R在ROH中比例↑,而R一般是疏水的。
H2
CC2l3HC5COHH2O+HNa>OCHlCH2CH2OHC2>HC5OHN3CaH+2HC2HO2OH
碱性 碱性:ROH + H
ROH2 钅羊离子
低级醇能与氯化钙形成络合物—结晶醇(CaCl2·4C2H5OH)
不能用氯化钙干燥醇 可用氯化钙去除少量杂质醇
2、与无机酸的作用
醇与酸失水生成酯。
较低温度
CH3CCHH22OOH-H+ 浓H2SO4 CHO H + 3HO-N
140oC
O
170oC
CH2O-H
O
CH3CHC2HO2COHN2OCH2 3 CH2=CCHH2 ONO 2 + 3H2O
有机化学第9章醇-酚-醚

C H 3 C H 2 C H 2 C H 2 O HC u - C r O 2 C H 3 C H 2 C H 2 C H O + H 2 O 3 5 0 ℃
OH
R'
❖ 羟基连在同一碳原子上的化合物
RCH2C O R'
OH H
H
R C O -H2O R C O
醛
H
OH H R C O -H2O
R'
RC O 酮 R'
OH H R C O -H2O
OH
R C O 羧酸 OH
9.1.2 醇的结构
醇的氧原子为sp3杂化。其中两个sp3杂化轨道分别含有一个电子,与碳 原子的sp3杂化轨道和氢原子的1s轨道重叠。另外二个sp3杂化轨道分别 含有一对未共用电子对,交叉构象为优势构象。
CH3CH2CH2OH 丙醇
(CH3)2CHOH 异丙醇
(CH3)3COH 叔丁醇
OH
OH
C
环已醇
三苯甲醇
系统命名法
即选择含有羟基的最长碳链作为主链,把支链看作取代基,从离 羟基最近的一端开始编号,按照主链所含的碳原子数目称为“某 醇”,羟基在1位的醇,可省去羟基的位次。
例如:
2-丁烯醇(巴豆醇) 3-苯基-2-丙烯醇(肉桂醇) 3 ,4-二甲基-2-戊醇
R O H + S O C l 2 R C l + S O 2 + H C l
反应实际上是先形成氯代亚硫酸酯,再与Cl-进行亲核取 代反应
RCH2OH+SOCl2 -HCl
O CH2O S Cl
《有机化学》第9章 醇 酚 醚

2023/6/13
1
第一节 醇
醇分子可以看成是水分子中氢原子被烃基取代的产物或烃分子中氢原子被羟 基(﹣OH)取代的产物,它的官能团是羟基。由于该官能团颇具化学活性,使醇 类化合物成为制药和有机合成的重要原料。
一、醇的分类和命名 1. 醇的分类
⑴ 根据和羟基相连的碳原子的类型,可以分为伯醇(1°醇,一级醇)、仲醇( 2°醇,二级醇)和叔醇(3°醇,三级醇)。例如:
2023/6/13
26
二、醚的物理性质
在常温下除了甲醚和甲乙醚为气体外,大多数醚为有香味的液体。醚分 子中没有与强电负性原子相连的氢,因此分子间不能形成氢键。醚的沸点显 著低于相对分子质量的醇,如甲醚和乙醇的沸点分别为–24.9℃和78.5℃。 醚分子能与水分子形成氢键,使它在水中的溶解度与相对分子质量的醇相近, 如甲醚能与水混溶,乙醚和正丁醇在水中溶解度都约为8 g / 100 g水。1,4二氧六环分子中四个碳原子连有两个醚键氧原子,与水生成的氢键足以使它 与水混溶。四氢呋喃分子中,虽然四个碳原子仅连有一个醚键氧原子,但因 氧原子在环上,使孤对电子暴露在外,与乙醚相比较,它更易与水形成氢键, 故也可以与水混溶。环醚的水溶液既能溶解离子化合物,又能溶解非离子化 合物,为常用的优良溶剂。
2023/6/13
13
5. 氧化反应
在有机物分子中加入氧或脱去氢都属于氧化反应。醇可以被多种氧化剂所氧化。 醇的结构不同,使用的氧化剂不同,其产物也各异。
⑴ 氧化剂氧化
伯醇氧化先生成醛,醛再进一步氧化生成羧酸,要想得到醛,须把生成的醛立即 蒸出,否则会被继续氧化。仲醇氧化生成酮,叔醇在一般条件下不被氧化,只有在 剧烈的条件下,如与K2Cr2O7和H2SO4一起加热回流,则断裂成小分子产物。
《有机化学》第九章醇、酚、醚的结构与性质

第九章醇、酚、醚的结构与性质前言(1) 醇的结构与性质醇分子可以看成是水分子中氢原子被烃基取代的产物或烃分子中氢原子被羟基(﹣OH)取代的产物。
和水分子一样,醇分子中氧原子也是sp3杂化的,sp3杂化的氧原子分别与烃基和氢形成2个σ键,还有两对孤电子对,在两个sp3杂化轨道上,因此醇分子不是直线型,而是角型的,所以醇分子是极性分子。
由于醇中含有羟基,分子间可以形成氢键,因此低级醇的熔点和沸点比分子量相近的碳氢化合物的熔点和沸点高得多。
随着分子量的增加,羟基在醇分子中比例减小,羟基对醇的影响减小,从而使高级醇的物理性质与烷烃近似。
低分子量的醇可以与水形成氢键而互溶。
羟基是醇的官能团,醇的化学性质也是由羟基引起的,主要是羟基的活性;羟基被取代的反应;羟基的氧化反应以及β﹣H的活性等。
(2) 酚的结构与性质酚羟基与芳羟基直接相连,羟基氧原子是sp2杂化的,还有一对孤电子在未杂化的p轨道上,p电子云正好能与苯环的大π键电子云发生侧面重叠,形成p-π共轭效应,其结果p电子云向苯环转移,而羟基氧氢之间的电子云向氧原子转移,使氢容易以离子形式离去,具有部分双键的性质,难以被取代,当氧原子电子云向苯环转移,使苯环电子云密度升高,因此苯环上发生亲电取代反应速度加快。
(3) 醚的结构与性质醚可以看作是水的两个氢原子被烃基取代所得的化合物。
氧原子也是 sp 3 杂化的,因此醚不是直线型结构,而是角形结构,醚是极性分子。
与醇相比,醚分子间不能形成氢键,沸点比同组分醇的沸点低得多,如乙醚沸点是34.6℃ ,而丁醇的沸点为117.8℃ 。
但是醚比分子量相近的烷烃分子的沸点高。
醚分子中的氧可与水形成氢键,所以醚在水中有一定溶解度,乙醚在水中溶解度为 8g/100ml ,对于环状醚,由于成环缘故,氧原子外突,形成氢键的能力较强,因此四氢呋喃, 1,4 ﹣二氧六环与水能混溶。
醚是一类相当不活泼的化合物(环醚除外),醚链对于碱,氧化物,还原剂都是十分稳定。
课件有机化学第9章 醇酚醚

第九章醇酚醚
Alcohols,Phenols
and Ethers
2
醇的分类、结构、命名和物理性质醇的制备和来源醇的化学性质
酚的结构、命名、来源和物理性质(自学)CONTENT
1234酚的化学性质醚
56
1) 普通命名
中文:将相应烷烃名称中的烷→醇
CH3CH2CH2CH2OH(CH3)2CHCH2OH(CH3)3C OH 正丁醇异丁醇叔丁醇
8
9.2 醇的制备和来源
•由烯烃制备——水合,硼氢化-氧化•由羰基化合物制备——Grignard 反应,与炔化物反应,还原
•由卤代烃水解
强酸
9.4 酚的结构、命名、来源
和物理性质(自学)
•分类:根据分子中羟基的数目分为一元酚,二元酚和多元酚
•命名:一般以苯酚为母体命名
•物理性质:具有特殊气味,能形成分子间氢键,沸点较高,水中有一定溶解度。
第9章 醇、酚、醚

[总结 有机物的系统命名法的总原则 总结] 有机物的系统命名法的总原则: 总结
1.按官能团的优先次序排列, 选择最优先的官能团作为母 体官能团, 其它的官能团则作为取代基. 2.选择含有母体官能团的最长碳链作为主链, 主链的编号 首先应使母体官能团的编号最小, 其次是使取代基的编 号之和最小(即最低系列原则). [附] 常见官能团的优先次序: –COOH、–SO3H > –COOR、–CONH2 > –CHO、–CO– > –OH、–SH > –NH2 > C≡C、C=C > –Ph > –R > –OR、–X、–NO2 (见 刘庄编《普通有机化学》P167)
(HO)3P=O : 甘油三硝酸酯 (硝酸甘油)
O RO–P–OR + 3H2O OR
(RO)3P=O
有机酸酯: (见 P256) ROH + R′ COOH
R′ OH + H–X
• 反应活性(了解): HI > HBr > HCl •
H+ OH–
R–X + H2O
2. 醇的分类
• 根据羟基所连接的饱和碳原子的类型, 可分为 伯醇(1°)、 • •
仲醇(2°) 和 叔醇(3°). 根据所含羟基的数目, 可分为 一元醇 和 多元醇. 根据羟基所连的烃基结构, 可分为 饱和醇、不饱和醇 和 芳香醇.
3. 醇的命名法
① 普通命名法: 根据羟基所连的烃基 命名为 某(基)醇. 只适用于碳数不多、结构简单的醇. (例子见书) ② 系统命名法: 命名原则(见书): 选主链、主链的编号 例: CH3CHCH2CHCH3 CH3 OH 4–甲基–2–戊醇 • 不饱和醇的命名: 根据其不饱和键称为 某烯醇或某炔醇. 例: CH3CH=CHCH2OH 2–丁烯醇 (羟基位置为1时可省略) • 多元醇的命名: CH3CHCH2CHCH3 OH OH 2,4–戊二醇 • 脂环醇的命名: 根据脂环烃基 命名为 环某醇. 如 环己醇 • 芳香醇的命名: 把苯环看作取代基. 如 2–苯基乙醇 • 常见俗名: 酒精(乙醇)、甘油(丙三醇)、肌醇(环己六醇)
有机化学醇和醚

* 同分异构 由于烃基的异构和官能团位置的
不同,可引起同分异构现象,另外相 同碳原子的醇和醚也互为构造异构体 ,这种异构体是属于官能团不同的构 造异构体。
2024/6/22
二、 醚的制法 * 醇分子间脱水(详见醇的性质)
此法适合于制取单醚 * 卤烷与醇金属作用(威廉森合成) ● 这是一个双分子亲核取代反应,叫做威廉森 合成法,可用于合成单醚或混醚,但主要用来 合成混醚。
2024/6/22
2024/6/22
* 醇的分类 ● 按羟基所连的碳原子类型: 伯醇(1°醇)
仲醇(2°醇) 叔醇(3°醇)
● 按羟基所连的烃基不同:饱和醇 不饱和醇 芳醇
● 按羟基数目: 一元醇 二元醇 多元醇
2024/6/22
* 异构和命名 ● 异构:醇的构造异构包括碳链异和官能团位
置异构。
2024/6/22
甘油三硝酸酯是一种炸药;磷酸三丁酯用 作萃取剂和增塑剂。
2024/6/22
* 氧化和脱氢(α—H的氧化)
叔醇无α—H,一般氧化剂不能氧化,上述反应 氧化剂可为KMnO4 + H2O、K2Cr2O7 + H2SO4。
由于伯、仲、叔醇氧化后所生成的产物不同,因 此根据氧化产物的结构,可以区别它们。
2024/6/22
* 化学性质 醚的化学性质比较不活泼,在常温下不与
金属钠发生作用,对碱、氧化剂和还原剂都十 分稳定,但能发生下列反应:
● 盐的生成 醚 R-O-R 的氧原子上有未共用电子对,它是
一个路易斯碱,在常温时能溶于强酸,形成 盐, 但醚的碱性很弱,所以生成的 盐遇水很快分解为 原来的醚。此反应可用于醚的提纯和分离。
2024/6/22
2024/6/22
第九章 醇 酚 醚

第九章醇酚醚醇,酚,醚都是烃的含氧衍生物。
醇和酚是烃的羟基衍生物,而醚通常是有醇或酚制得的。
酚与醇在结构上的区别就在于它所含的羟基直接与芳环相联。
醇分子间能形成氢键,醇也能跟水形成氢键。
醇通常以下法制备:1.烯烃加水。
2.烯烃经羟汞化—脱汞反应。
3.烯烃经硼氢化—氧化反应。
4.Grignard反应。
一级醇:二级醇:三级醇:5.羰基化合物的还原。
6.卤代烷的水解。
醚可以通过一级卤代烷跟醇钠或酚钠的反应来制备(Williamson合成法)。
醇跟氢卤酸发生取代反应(1°ROH,S N2; 2°ROH和3°ROH,S N1)。
在硫酸或其他强酸存在下,醇能发生消除反应,这时醇的反应活性顺序是3°>2° >1°。
当醚跟HBr 或HI 共热时可发生取代反应。
醇可以跟有机酸或无机酸反应生成酯。
一级醇可以被氧化成羧酸(或醛),而二级醇被氧化成酮,三级醇在碱性条件下是抗氧化的。
环氧化物比其他醚更活泼,在酸性和碱性溶液中可以跟亲核试剂发生开环反应。
醇的酸性比水还弱,与醇显著不同,酚是具有相当酸性的化合物,它可以溶于氢氧化钠水溶液而变成它的盐。
酚的最突出的化学性质是它的环对亲电取代反应有极高的反应活性:1.卤代。
白色,可用于酚的鉴别2.硝化。
3.磺化。
4.酰基化反应,Fries重排:5.跟甲醛反应。
习题一、按系统命名法命名下列化合物:5. 醇、酚、醚(1) (2)3-乙基-2-甲氧基己烷 5-甲基-4-己烯-3-醇(3)(4)3-甲基-2-环己烯-1-醇 2-甲基-4-甲氧基苯酚(5) (6)4-烯丙基-2-甲氧基苯酚 6-甲基-3-乙基-5-溴-1-庚醇1. 2.3. 4.5. 6. 1、3-E-3-甲基-3-戊烯-2-醇; 2、R-3-甲基-2-丁醇; 3、(2S ,3S )-3-甲氧基-2-戊醇; 4、2-异丙氧基丁烷; 5、4-甲氧基苯酚; 6、5-溴-1-苯酚OH C CH 3HO 3)2OCH 3CH 3HO H H C 2H 5OOH OCH 3OH Br CH(CH CHCH-OCHCH CH CH 322233)CH CH CH 3233C=CHCHCH OH CH 3OHCH 33OHOCH 223OH OCH CH=CH CH CH CH CH 322233OHCHCHCH CHCH 2CH二、完成下列反应,写出反应的主要产物:1.2.3. 4.5. 6.7. 8.9.10.11.12.13. 14.1、CH 2CH 2CH CH 3=;2、CH 3CHCH 3=C ()2;3、CH 3CH 2CH 3O C ()3; 4、OCH 3CH 2CH 2CH 2OH + NaBr H 2SO 4(CH 3)3CCH 2OH CH 3CH 2Br + NaOC(CH 3)3OH +K 2CrO 7dil.H 2SO 4CH 3CH 2CH 2MgBr +CH 2-CH 2OEt 2OH 2O 3)2OH H 2SO 4CH 2CH 2OHOH SOCl 2[ ]CH 2CH 3O + HI CH=CHCHCH 3OH + CH 3CCH 3OAl[OCH(CH 3)2]3CH 3CH=CHCH 2OH +HBr OH +CH 3COCH 3H 2SO 4CH 3CH=CHCH 2OH + CrO 3(C 5H 5N)2.CH 2Cl 2CH 3( )CH 2Cl ( )( )CH 2CH=CH 2( )2CH5、CH 2CH 2CH 2OH CH 3; 633; 7CH 2CH 2CH 3OHNH 3;82CH 2Cl9、CH2CH 3I ; 10CH 3=OC =CH 、CH 3CH 3OH;11、CH 3Br CH 2CH =CH ; 12、313、CH 3CH =CH CHO ;14、Cl 2CCH、Lindlar 、、H 3+O 2CH 2CH 3OH三、选择正确答案,并说明理由:1. 具有下列结构的醇类化合物,可以稳定存在的是( )。
有机化学第9章 醇、酚和醚

OCH3 + H2 O
硫酸和乙醇作用,也可以得到硫酸氢乙酯和硫酸二乙酯。硫酸二 甲酯和硫酸二乙酯是烷基化试剂,可以用在有机物分子中导入甲基和乙 基的试剂,但是它们的蒸气有剧毒,使用时要特别注意。
( 2) 多元醇与一元酸的反应
CH2OH CHOH + 3 HONO2 ( HNO3 ) CH OH
2
CH2ONO2 CHONO2 CH2ONO2
H H H
烃基的供电子作用使氧 氢键极性下降。 氢原子既不供电子,也不吸电 子,氧氢键极性不变。 孤对电子占据的 P 轨道与苯环间存 在 P-π共轭体系,氧上电子云向苯 环转移,使氧氢键极性增强。
取代酚的酸性:(pKa值)
OH OH OH
吸电子基 酸性增加 斥电子基 酸性下降
OH
OH
OC H 3
C H3
分子间脱水 (伯醇 亲核取代 SN2机理):
总结:醇的分子内脱水和分子间脱水是两种互相竞争的反应。 高温有利于发生分子内脱水生成烯烃,较低温度则有利于分子间脱 水生成醚。 伯醇能进行分子内脱水和分子间脱水;仲醇和叔醇在酸催化作 用下主要是进行分子内脱水,产物是烯烃 。
5) 多元醇的特性 (1) 与氢氧化铜的反应(邻二醇结构)
(CH3)2CHCH2CH2OH + HONO
(CH3)2CHCH2CH2ONO + H2O 亚硝酸异戊酯
亚硝酸异戊酯用作血管舒张药,可缓解心绞痛,但副作用大。
O CH3OH + HOSO3H ( H2SO4 )
O CH3OH + CH3O S O OH CH3O
CH3O
S O
OH
O S O
+ H2 O
OH
有机化学第9章(醇、酚、醚)重、难点提示和辅导

有机化学第9章(醇、酚、醚)重、难点提示和辅导一.命名1.醇普通命名是在醇分子中烃基的名称后面加上“醇”字即可。
系统命名是选择含有羟基的最长碳链为主链,从靠近羟基的一端开始编号,根据主链碳原子数叫做“某醇”,再把取代基的位次和名称及羟基的位次放在醇的名称前面。
2.酚酚的命名是在芳环(苯、萘等)名称后面加上“酚”字,若芳环上有取代基,将取代基的位次和名称写再前面。
3.醚简单醚根据烃基命名单醚:称(二)某烃(基)醚,如甲醚、二苯醚。
混合醚:按照“次序规则”,较小基团放在前面,如甲乙醚;有芳基时,将芳基放在前面,如苯甲醚。
结构复杂的醚当作烃的烷氧基衍生物命名,即复杂的烃基为母体,简单的烃基与氧组成的烷氧基作为取代基。
如:叫3-甲氧基戊烷。
二.化学性质三.鉴别1.醇(1)用金属钠,有气泡产生,(鉴别六个碳原子以下的醇)。
注意排除水、酸、末端炔烃剂低级醛、酮中活泼氢的干扰。
(2)用卢卡斯试剂鉴别伯、仲、叔醇。
在伯、仲、叔醇的试管仲分别加入卢卡斯试剂,很快变浑浊的是伯醇,放置后变浑浊的是仲醇,加热才变浑浊的是叔醇,(此法适于鉴别六个碳原子以下的醇)。
2.酚(1)三氯化铁显色,鉴别酚类化合物。
(2)加溴水,生成白色沉淀,鉴别苯酚。
四.制备方法:(本章没有讲到,根据前面讲过的内容可以总结)1.醇(1)烯烃在酸催化下与水加成,不对称烯烃与水加成符合马氏规则。
(教材39页)(2)卤代烃的碱性水解(教材101页)(3)环氧乙烷与格氏试剂反应,可制备增加两个碳原子的伯醇(教材129页)(4)醛酮与格氏试剂加成后再酸性水解(教材142页)(5)醛酮还原(教材148页)2.醚卤代烃的醇解(教材101页)五.重要的名词、规则卢卡斯试剂:浓盐酸和无水氯化锌的混合液。
查依采夫规则(见8章辅导)六.练习题教材133页:习题二、134页:习题四、五、七、八。
第九章醇和醚

醇、醚可看成是水分子中的氢原子被烃基所取代的 产物,属烃的含氧衍生物。
通式:R-OH 脂肪醇;Ar-R-OH 芳香醇;
R-O-R` 脂肪醚、Ar-O-Ar 芳醚。
如果硫化氢分子中的氢原子被烃基取代,则得到硫 醇、硫酚、硫醚。R-SH、 Ar-SH、 R-S-R`
第一节
醇
醇可以看成是烃分子中的氢原子被羟基(OH)取代后 生成的衍生物(R-OH)。
环氧乙烷化学性质活泼,在酸或碱催化下能与多种试剂 反应,形成一系列重要工业原料。
A. 在酸催化下,环氧乙烷可与水、醇、卤化氢等含活泼氢的 化合物反应,生成双官能团化合物。
这些产物同时有醇和醚的性质,是很好的溶剂,常称溶 纤素,广泛用于纤维素酯和油漆工业。
B. 在碱催化下,环氧乙烷可与RO-,NH3,RMgX等反应生成 相应的开环化合物。
发。大于6个碳的醇(苄醇除外)不溶于卢卡斯试剂,易混淆实
验现象。
2) 醇与HX的反应为亲核取代反应,伯醇为SN2历程,叔醇、烯 丙醇为SN1历程,仲醇多为 SN1历程。 A. SN1: 烯丙醇、苄醇、叔醇、仲醇。
这是因为按SN1机理进行反应时,可能发生分子重排的结果。
B. SN2:大多数伯醇,且没有重排反应。
硫醇的分解:氢解和热解两种,用于脱硫。
氢解:H2,CoMnO4 340℃-400℃
RH + H2S 烯烃 + H2S
R-SH
热解:340℃-400℃
硫醚的C-S键较弱,反应活性大于醇。 硫醚的氧化:生成亚砜和砜类。
二甲亚砜的溶解能力和穿透能力极强,在实验室中应避 免与人体皮肤接触。 锍盐的生成:
3.醇的命名 1)俗名 如乙醇俗称酒精,丙三醇称为甘油等。 2)简单的一元醇用普通命名法命名。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MgCl2• 6CH3OH
CaCl2 • 4C2H5OH
注意
许多无机盐 不能作为醇 的干燥剂。
结晶醇不溶于有机 溶剂而溶于水。利 用这一性质,可以 使醇和其它有机溶 剂分开,或从反应 物中除去醇类。
工业乙醚常杂有 少量乙醇,加入 CaCl2可使醇从 乙醚中沉淀下来。
9.4 醇的化学性质
一 醇反应性的总分析 二 醇羟基中氢的反应 三 碳氧键的断裂,羟基的亲核取代反应 四 成酯反应 五 氧化反应 六 脱氢反应 七 醇的脱水-消除反应
-CH=CHCHO
-CH=CHCH2OH
肉桂醛
肉桂醇
还原机理:
O R-C-R’
OAlH3Li
LiAlH4,干醚
R-CH-R’
OAlH3Li
H2O
R-CH-R’
OH R-CH-R’ + LiAlH3OH
4、卤代烃水解
由易得的卤代烃水解制备醇,如:
CH2=CHCH2Cl + H2O Na2CO3 CH2=CHCH2OH + HCl
一 醇反应性的总分析
③氧化反应
RC H
④ 脱 水 反 应
⑤形成氢键 形成佯盐
H
②与金属反应 酸性
CO
① 碱取
代 反 性应
H
R拉电子,酸性增强,与金属 反应活性增强.
R
① RMgBr,干醚 ② H2O
OH R`-C-R
R
(5)与环氧乙烷合成增加两个碳的伯醇
CH2-CH2 RMgBr干醚 R-CH2CH2-OMgBr H2O R-CH2CH2-OH O
说明:
1、有机锂、二烷基铜锂等也可进行上述反应。 2、金属炔化物也可进行上述反应,可合成炔醇
=O + HCCNa ① NH3(l),干醚
O2N
O2N -CHO NaBH4 ,CH3OH
-CH2OH
CH3
O
① LiAlH4,干醚
CH3
OH
CH3C=CHCH2CH2CCH3
CH3C=CHCH2CH2CHCH3
② H2O
CH3CH=CHCHO 巴豆醛
Al[OCH(CH3)2]3 (CH3)2CHOH
CH3CH=CHCH2-OH 巴豆醇
NaBH4,H+
-CH2Cl Na2CO3
H2O
-CH2OH
9.3 醇的物理性质、光谱特征
一 物理性质
醇分子之间能形成氢键,沸点较相应分子量的烷烃高。 由于醇分子与水分子之间能形成氢键,三个碳的醇和叔丁醇 能与水混溶。 随着碳原子数的增大氢键减弱,沸点向相应的烷烃靠近;在 水中的溶解性也下降,甚至不溶,高级脂肪醇是表面活性剂。 由于醇分子间能形成氢键,固态缔合较为牢固。液态形成氢 键和氢键的解离均存在。气态或在非极性溶剂的稀溶液中, 醇分子可以单独存在。
羰基:
O R-C-H
O R-C-R’
O R-C-OR’
O R-C-OH
[H] [H] [H] [H]
R-CH2-OH R’
R-CH-OH
R-CH2-OH
R-CH2-OH
还原剂:
Pt + H2: 强还原剂还原所有的双键,包括C=C.
LiAlH4 (乙醚为溶剂) 较强还原剂,
Na+C2H5OH
可还原醛、酮Biblioteka 酸、酯等。化学第九章醇和醚
目录
第一部分、醇 第二部分、醚
CH3 CH3-C-OH
CH3CHCHCH2CH3 OHOH
CH2CH3
H
OH
C6H5
2-苯基-2-丙醇 2,3-戊二醇 (s)-1-苯基-1-丙醇
H3C 反-4-甲基环己醇
OH
9.2 醇的制法
1、烯烃的加成(水合) 2、利用格利雅试剂合成 3、羰基的还原 4、卤代烃水解
二 光谱特征(参见相关章节)
红外光谱特征峰:
O-H的伸缩振动峰 3650-3590cm-1 (弱、尖峰) O-H的氢键缔合峰 3400-3200cm-1 (强、宽峰) C-O的伸缩振动峰 1200-1050cm-1 (伯,仲,叔略有
不同)
三 醇化物(结晶醇)
低级醇与一些无机盐形成的结晶状分子化合物称之为结晶 醇,也称之为醇化物。
② H2O,H+
OH CCH
① RMgBr,干醚
CH3(CH2)3CCMgBr + HCHO
CH3(CH2)3CCCH2OH
② H2O
3、羰基的还原
有机化学中的还原就是增加分子中的H,催化加氢 是还原的一种形式。 因此有机化学中的还原包含了两个要素,
供氢体 供电子体 有时候供氢体和供电子体是同一元素。 羰基通常还原成羟基,是制备醇的一条重要途径, 不同的羰基,不同的还原剂将得到不同的产物。常 见的羰基和还原剂的类型如下:
Hg+OAc
NaBH4 HgOAc
CH3CH2CH-CH2
CH3CH2CHCH3 OH
反应符合马氏规则,高度选择,无重排,反式加成。
2、利用格利雅试剂合成
(1)与甲醛合成增加一个碳的伯醇
RMgBr + HCHO 干醚 R-CH2-OMgBr H2O R-CH2-OH
(2) 与其它醛合成仲醇
O
OMgBr
R1-CH + RMgBr 干醚 R1-CH-R H2O R1-CH-R
(3)与酮合成叔醇
O R`-C-R”
① RMgBr,干醚 ② H2O
OH R`-C-R”
R
(4)与酯合成叔醇(甲酸甲酯为仲醇)
O
OMgBr
RMgBr,干醚
R`-C-OR”
R`-C-OR”
O R`-C-R + R” OMgBr
O R`-C-R
1、烯烃的加成(水合)
(1)直接水合法
CH3CH=CH2 + H2O
(2)间接水合法
H3PO4-硅藻土 195 ◦C,2MPa
CH3-CH-CH3 OH
CH2=CH2 浓H2SO4 CH3CH2OSO3 H2O CH3CH2OH
(3)硼氢化-氧化反应
CH3-C=CH2 B2H6 CH3
H2O2 OH-
NaBH4 (甲醇,乙醇,水都可为溶剂): Al[OCH(CH3)2]3+ (CH3)2CH-OH
较弱还原剂,只还 原醛、酮。
注意:Al[OCH(CH3)2]3+ (CH3)2C=O是氧化剂
例如:
-CHO H2, Pd/C
-CH2-OH
CH3CH2O-CO-(CH2)8-CO-CH2CH3 Na,C2H5OH HO-(CH2)10-OH
CH3-CH-CH2OH CH3
硼氢化-氧化反应的特点是具有高度的选择性,是 反马氏规律加成取向,立体化学为顺式加成,且 无重排产物生成。是制备伯醇的好方法。
CH3
B2H6
H2O2 OH-
OH H H CH3
(4)羟汞化-脱汞反应
OH
CH3CH2CH=CH2 Hg(OAc)2,H2O,THF CH3CH2CHCH2
