日本药典JP17电子版JP17e_4-3
第十七次修订版日本药典第二增补本

・稠度试验法 透度计(稠度计) →测定软硬度
15
新收录试验法④
6.17 蛋白质药品针剂的不溶性微粒子试验法
“6.07 针剂的不溶性微粒子试验法” 第1法 利用光遮蔽粒子计数法测定蛋白质药品时的课题
• 在许多情况下容量较少 →试验时需混合许多容器内的溶液后进行试验
分类
概要
将药品各条中的制剂有效期作为参考
修订 明确了实时发布试验的定位
删除有关有效期的最终有效年月的标示规定
参考信息《确保药品原药和制剂质量的基本思路》
10
制剂总则(修订方案)
3.1.
项目 针剂
3.1.4. 核糖体针剂
分类
备注
修订 引用一般试验法(新的核糖体针剂)
新制定 增加有关DDS的形状
DDS:Drug Delivery system
6
日本药典的构成
基于法第41条的公布内容
・通则 ・生药总则 ・制剂总则 ・一般试验法 ・药品各条 ・药品各条 生药等 ・参考紫外可见吸收光谱 ・参考红外吸收光谱
参考信息 附录 etc
8
第二增补本概略
通则 生药总则 制剂总则:[1]制剂总则
:[2]制剂包装总则 :[3]制剂各条 :[4]生药相关制剂各条 一般试验法 药品各条
○英文版网页
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000066597.ht ml
6
第十八次修订版日本药典制作基本方针
1.全面收录重要的医疗保健药物 2.积极引进最新的学术和技术 3.推进国际化 4.根据需要及时进行部分修订并通过行政部门顺利执行 5.确保透明性并推进日本药典的普及
中文翻译(JP药典17)-羧甲基淀粉钠

羧甲基淀粉钠本篇所述内容与欧洲药典和美国药典一致,文中标记为(◆◆)部分与上述两药典不同。
羧甲基淀粉钠是羧甲基醚化淀粉或交联的羧甲基醚化淀粉的钠盐。
羧甲基淀粉钠有两种中立的状态,A型和B型,以上两种状态皆不溶于乙醇(99.5)和水(8:2)的混合溶液;按照干品计算,A型羧甲基淀粉钠含钠(Na:22.99)不少于2.8%且不多于4.2%,B型羧甲基淀粉钠含钠(Na:22.99)不少于2.0%且不多于3.4%。
◆标签必须注明羧甲基淀粉钠所属的中立状态。
◆◆性状羧甲基淀粉钠为白色粉末,有特征性的咸味。
本品几乎不溶于乙醇(99.5)。
本品在水中膨胀,变成苍白色的黏性液体。
本品具有吸湿性。
◆鉴别(1)取5mL使用盐酸酸化的羧甲基淀粉钠溶液(1→500),加入一滴碘试液,然后搅拌:溶液呈蓝色至蓝紫色。
◆(2)照溴化钾片红外分光光度测量<2.25>的方法测定羧甲基淀粉钠的红外吸收光谱,将所得的吸收光谱与标准光谱进行比较:相同波长下,两者呈现相似的吸收强度。
◆(3)取纯度(2)项下的羧甲基淀粉钠样品溶液显钠盐的定性试验<1.09>。
进行此项试验使用2mL的样品溶液和4mL的六羟基锑酸钾试液。
pH<2.54>取1g羧甲基淀粉钠,加30mL的水搅匀:得到悬浮液的pH值为,A型的pH值在5.5-7.5之间,B型的pH值在3.0-5.0之间。
纯度◆(1)重金属<1.07>——取1.0g的羧甲基淀粉钠按照方法2进行试验,使用2.0mL的标准铅溶液(不多于20ppm)配制对照溶液。
◆(2)铁(ⅰ)样品溶液取2.5g羧甲基淀粉钠置于二氧化硅或者铂坩埚中,加入2mL浓度为5mol/L的硫酸试液,水浴加热,以600 ± 25℃温度的煤气火焰或更好的电子设备小心地灼烧,直至其完全烧成灰烬。
放凉,加几滴浓度为1mol/L的硫酸试液,按照上面的方法水浴蒸发和灼烧。
放凉,加几滴碳酸铵试液,水浴蒸干,按照上面的方法水浴加热和灼烧。
国外药典介绍

Volume Ⅳ 总目录 通则目录 通则 草药、草药制剂 医疗产品 血液制品 免疫制品 放射性药剂 手术材料 侧面标示索引
2014-11-3
欧洲药典增补版
•
欧洲药典第8版包括两个基本卷,于2013年7月出版发行,以后在每次欧洲 药典委员会全会做出决定后,通过非累积增补本更新,每年出3个增补本。第 8版累计共有8个非累积增补本(8.1~8.8)。 各增补版的出版日期及执行的日期。·
欧洲各册内容ห้องสมุดไป่ตู้绍
第一卷
各论举例、前言、介绍、总目录、第8版内容简介(包括新增内容、 修订内容和更正内容) Genaral Notice(凡例)、分析方法通论、包装材料及包装、试剂、 Genaral Text(通则) 各论通则、剂型各论、人用疫苗各论、兽用疫苗各论、人用免疫血 清各论、兽用免疫血清各论、放射制剂及放射制剂起始物各论、人 用手术缝合线各论、兽用手术缝合线各论、草药及草药制剂各论、 顺势疗法制剂各论
包括欧盟在内共有37个成员。最新加入的成员:波兰(2006)。
包括世界卫生组织在内,加上7个欧洲国家(阿尔巴尼亚、亚美尼亚、 白俄罗斯、格鲁吉亚、哈萨克斯坦共和国、摩尔多瓦、俄罗斯联邦和乌 克兰)和16个非欧国家(阿尔及利亚、澳大利亚、巴西、加拿大、中国、 以色列、马达加斯加、马来西亚、摩洛哥、塞内加尔、叙利亚、突尼斯、 美国),共24个观察员。 最新加入的观察员:新加坡(HSA)(2012)、阿根廷、亚美尼亚和 摩尔多瓦(2008)、白俄罗斯共和国(2007)、俄罗斯联邦和乌克兰 (2006)。
日本药典JP17-2.61溶液澄清度检查规范及解决方案探讨

日本药典JP17-2.61溶液澄清度检查规范及解决方案探讨日本药典JP17在<2.61> Turbidity Measurement 章节中对溶液的澄清度测量提出了以下说明:浊度测量用于确定浊度(乳光度),以决定待检查的物品是否符合纯度中规定的透明度要求。
作为一项规则,目视法是针对个别专论中的要求指定的。
日本药典JP17-2.61溶液澄清度检查规范中对溶液的澄清度提出了两种检测方法,分别是目视法和光电光度法,下面就分开进行介绍.1.目视法这是用来确定乳白色(或淡色)细颗粒的乳光程度。
因此,有色样品的乳光度容易被测定得较低,因此,如果不使用类似颜色的参考悬浮液,就很难正确地比较其乳光度。
1.1.参考悬浮液用移液管分别吸取5 mL、10 mL、30 mL、50 mL福尔马肼标准液,用水分别稀释至100 mL,分别作为参比悬液I、II、III、IV。
在使用前摇晃。
参考悬浮液I、II、III和IV的乳光度分别相当于3 NTU、6 NTU、18 NTU和30 NTU。
1.2.步骤取足够的待测溶液、水或溶剂,以准备测试溶液,必要时,将新制备的参考悬浮液置于独立的平底试管中,试管内径15 - 25mm,无色透明,深度40 mm。
然后在一个黑色的背景下通过漫射光下垂直于管轴进行观察,比较管内的内容。
漫射光必须能使参考悬浮体I容易与水区分开来,参考悬浮体II容易与参考悬浮体I区分开来。
在此测试中,当测试溶液的透明度模糊不清,并且不容易确定其乳光度与水或与用于制备测试溶液的溶剂是否相似时,使用参考悬浮液。
1.3.注释当液体的澄清度与水或与用于制备液体的溶剂的澄清度相同或其浊度不比参比悬浮液I 更明显时,该液体被视为“澄清”。
如果液体的浊度大于参考悬浮液I,考虑如下:当浊度大于参考悬浮液I但不超过参考悬浮液II时,表示“不超过参考悬浮液II”。
同理,当浊度大于参比悬浊液Ⅱ但不大于参比悬浊液Ⅲ时,表示“不大于参比悬浊液Ⅲ”,当浊度大于参比悬浊液Ⅲ时但不超过参考悬浮液IV,表示“不超过参考悬浮液IV”。
多西他赛日本药典JP16
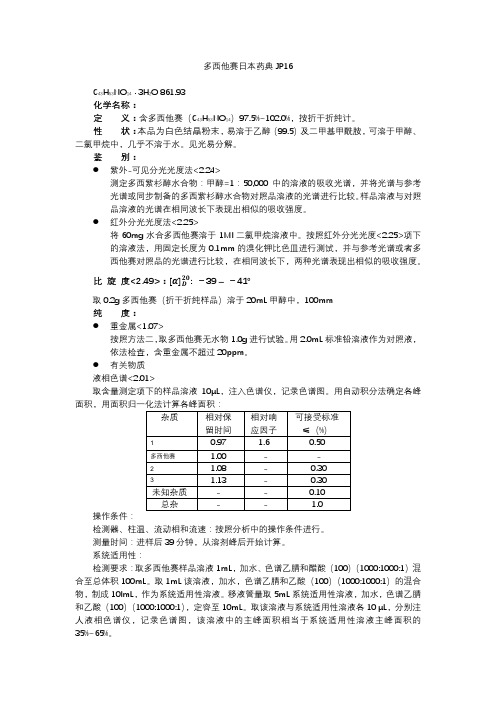
多西他赛日本药典JP16C43H53NO14· 3H2O 861.93化学名称:定义:含多西他赛(C43H53NO14)97.5%~102.0%,按折干折纯计。
性状:本品为白色结晶粉末,易溶于乙醇(99.5)及二甲基甲酰胺,可溶于甲醇、二氯甲烷中,几乎不溶于水。
见光易分解。
鉴别:●紫外-可见分光光度法<2.24>测定多西紫杉醇水合物:甲醇=1:50,000中的溶液的吸收光谱,并将光谱与参考光谱或同步制备的多西紫杉醇水合物对照品溶液的光谱进行比较。
样品溶液与对照品溶液的光谱在相同波长下表现出相似的吸收强度。
●红外分光光度法<2.25>将60mg水合多西他赛溶于1Ml二氯甲烷溶液中。
按照红外分光光度<2.25>项下的溶液法,用固定长度为0.1mm的溴化钾比色皿进行测试,并与参考光谱或者多西他赛对照品的光谱进行比较,在相同波长下,两种光谱表现出相似的吸收强度。
比旋度<2.49>:: -39 –-41°取0.2g多西他赛(折干折纯样品)溶于20mL甲醇中,100mm纯度:●重金属<1.07>按照方法二,取多西他赛无水物1.0g进行试验。
用2.0mL标准铅溶液作为对照液,依法检查,含重金属不超过20ppm。
●有关物质液相色谱<2.01>取含量测定项下的样品溶液10μL,注入色谱仪,记录色谱图。
用自动积分法确定各峰面积,用面积归一化法计算各峰面积:操作条件:检测器、柱温、流动相和流速:按照分析中的操作条件进行。
测量时间:进样后39分钟,从溶剂峰后开始计算。
系统适用性:检测要求:取多西他赛样品溶液1mL,加水、色谱乙腈和醋酸(100)(1000:1000:1)混合至总体积100mL。
取1mL该溶液,加水,色谱乙腈和乙酸(100)(1000:1000:1)的混合物,制成10lmL,作为系统适用性溶液。
移液管量取5mL系统适用性溶液,加水,色谱乙腈和乙酸(100)(1000:1000:1),定容至10mL。
中文翻译(JP药典17)-微晶纤维素

微晶纤维素)为不一致的部分。
此各论与USP与EP药典是一致的,标(◆◆本品为含纤维素植物的纤维浆制得的α-纤维素,在无机酸的作用下部分解聚,纯化而得。
◆标签上的平均聚合度、干燥失重和表观密度值是一个范围。
◆◆【性状】本品为白色结晶性粉末,具有流动性。
本品几乎不溶于水、乙醇(95)和乙醚。
本品在加热的条件下与氢氧化钠试液溶胀。
◆【鉴别】(1)取氯化锌20g和碘化钾6.5g,加入10.5mL的水,然后加0.5g碘,用力振摇15min。
取本品10mg,置于玻璃表面皿上,加上述试液2mL,即显蓝紫色。
◆(2)在装有具有38μm开口筛网(No.391,200mm内径)的空气喷射筛上筛选20g 微晶纤维素5分钟。
如果筛网上截流量大于5%,取30g微晶纤维素与270mL水混合;如筛网上截流量不大于5%,取40g微晶纤维素225mL水。
取混合物在高速动力搅拌机(18000转每分钟或更高公转数)上搅拌5分钟。
将100mL分散体转移至100ml量筒中,放置3小时:可见白色,不透明,无气泡的分散体,且在溶液的表面不形成沉清液体◆(3)取本品约1.3g,精密称定,置125mL具塞锥形瓶中,精密加水和1moL/mL 双氢氧化乙二胺铜试液各25mL。
立即用氮气吹扫溶液,盖上塞子,并在合适的机械振荡器上摇动以溶解。
精密量取溶液适量,按照黏度测定<2.53>方法1,移至粘度常数(K)约0.03的毛细管粘度计,在水浴25℃±0.1℃条件下测定运动黏度,ν。
另外,精密加水和1moL/mL双氢氧化乙二胺铜试液各25mL,按照上述处理方式,精密量取溶液适量,按照黏度测定法<2.53>方法1,移至粘度常数(K)约0.01的毛细管粘度计,在水浴25℃±0.1℃条件下测定运动黏度,νo。
按以下公式计算微晶纤维素的相对黏度:ηrel = ν / νo根据计算所得的相对粘度值ηrel,查附表,得[η]C值(特性黏度[η]mL/g)和浓度C (g/100ml)的乘积),按以下公式计算聚合度(P),应不得过350◆且在标签。
JP日本药典(药局方)标准品汇总信息-2016-update

23541-50-6
65
他唑巴坦酸标准品及杂质对照品
Tazobactam
89786-04-9
66
酞氨西林盐酸盐标准品及杂质对照品
TalampicillinHydrochloride
39878-70-1
67
Teicoplanin标准品及杂质对照品
Teicoplanin(混合物)
3
阿扑西林标准品及杂质对照品
Aspoxicillin
63358-49-6
4
硫酸阿米卡星标准品及杂质对照品
AmikacinSulfate
39831-55-5
5
阿莫西林标准品及杂质对照品
日本药典(药局方)标准品咨询中心
何工136-o9o9-2o29
Amoxicillin
61336-70-7
6
硫酸阿贝卡星标准品及杂质对照品
53
头孢妥仑匹酯标准品及杂质对照品
CefditorenPivoxil
117467-28-4
54
头孢地尼标准品及杂质对照品
Cefdinir
91832-40-5
55
头孢磺啶钠标准品及杂质对照品
CefsulodinSodium
52152-93-9
56
头孢他啶标准品及杂质对照品
Ceftazidime
72558-82-8
13614-98-7
94
美罗培南标准品及杂质对照品
Meropenem
119478-56-7
95
利福平标准品及杂质对照品
Rifampicin
13292-46-1
96
硫酸核糖霉素标准品及杂质对照品
中文翻译(JP药典17)-交联羧甲基纤维素钠

交联羧甲基纤维素钠本篇所述内容与欧洲药典和美国药典一致,文中标记为(◆◆)部分与上述两部药典不同。
交联羧甲基纤维素钠是交联的、部分羧甲基化的纤维素钠盐。
◆性状交联羧甲基纤维素钠为白色至微黄色的白色粉末。
本品几乎不溶于乙醇(99.5)和乙醚。
本品在水中溶胀后形成悬浮液。
本品具有吸湿性。
◆鉴别(1)取1g的交联羧甲基纤维素钠,加100mL的亚甲蓝(1→250000)溶液,搅拌均匀后放置:生成蓝色絮状沉淀。
(2)取1g的交联羧甲基纤维素钠,加入50mL的水,搅拌后使其成为悬浮液。
取1mL 的交联羧甲基纤维素钠悬浮液加入1mL的水和5滴新配置的α-萘酚甲醇(1→25)溶液,沿试管壁缓缓加入2mL的硫酸:在液面接触的地方出现紫红色。
(3)取鉴别(2)项下的交联羧甲基纤维素钠悬浮液显钠盐的定性试验<1.09>。
pH<2.54>取1.0g的交联羧甲基纤维素钠加入100mL的水,振摇5分钟:浮在表面液体的pH值介于5.0到7.0之间。
纯度◆(1)重金属<1.07>——称取2.0g的交联羧甲基纤维素钠,按照方法2进行测定。
对照溶液的配制使用2.0mL的标准铅溶液(不多于10ppm)。
◆◆(2)氯化钠和乙醇酸钠—按干品计算,氯化钠和乙醇酸钠不多于0.5%。
(i)氯化钠:准确称取5g的交联羧甲基纤维素钠,加入50mL的水和5mL的过氧化氢(30),水浴加热20min并伴随偶尔的搅动。
放冷,加入100mL的水和10mL的硝酸,用0.1mol/L的硝酸银滴定液(电位滴定)滴定<2.50>。
如果有需要进行校准的话,使用相同的操作步骤平行滴定一份空白溶液。
每mL浓度为0.1mol/L的硝酸银滴定液= 5.844mg的NaCl(ii)乙醇酸钠:准确称取0.5g交联羧甲基纤维素钠,加2mL的乙酸(100)和5mL的水,搅拌15min。
缓缓加入50mL的丙酮并不断搅拌,再加入1g的氯化钠,搅拌3min,然后用丙酮润湿过的滤纸过滤。
Contents-日本药典目录英文版

CONTENTSPreface (i)The Japanese Pharmacopoeia,Sixteenth Edition (1)General Notices (1)General Rules for Crude Drugs (5)General Rules for Preparations (7)General Tests,Processes and Apparatus (25)1.Chemical Methods1.01Alcohol Number Determination (25)1.02Ammonium Limit Test (27)1.03Chloride Limit Test (28)1.04Flame Coloration Test (28)1.05Mineral Oil Test (28)1.06Oxygen Flask Combustion Method (28)1.07Heavy Metals Limit Test (29)1.08Nitrogen Determination(Semimicro-Kjeldahl Method) (30)1.09Qualitative Tests (31)1.10Iron Limit Test (37)1.11Arsenic Limit Test (37)1.12Methanol Test (39)1.13Fats and Fatty Oils Test (39)1.14Sulfate Limit Test (41)1.15Readily Carbonizable Substances Test (41)2.Physical MethodsChromatography2.01Liquid Chromatography (42)2.02Gas Chromatography (45)2.03Thin-layer Chromatography (47)2.04Amino Acid Analysis of Proteins (47)Spectroscopic Methods2.21Nuclear Magnetic ResonanceSpectroscopy (48)2.22Fluorometry (50)2.23Atomic AbsorptionSpectrophotometry (51)2.24Ultraviolet-visible Spectrophotometry (52)2.25Infrared Spectrophotometry (53)Other Physical Methods2.41Loss on Drying Test (55)2.42Congealing Point Determination (55)2.43Loss on Ignition Test (56)2.44Residue on Ignition Test (56)2.45Refractive Index Determination (56)2.46Residual Solvents Test (57)2.47Osmolarity Determination (57)2.48Water Determination(Karl FischerMethod) (58)2.49Optical Rotation Determination (61)2.50Endpoint Detection Methods inTitrimetry (62)2.51Conductivity Measurement (63)2.52Thermal Analysis (65)2.53Viscosity Determination (67)2.54pH Determination (69)2.55Vitamin A Assay (71)2.56Determination of Specific Gravity andDensity (72)2.57Boiling Point and Distilling RangeTest (74)2.58X-Ray Powder Diffraction Method (75)2.59Test for Total Organic Carbon (79)2.60Melting Point Determination (80)3.Powder Property Determinations3.01Determination of Bulk and TappedDensities (82)3.02Specific Surface Area by GasAdsorption (84)3.03Powder Particle DensityDetermination (86)3.04Particle Size Determination (87)4.Biological Tests/Biochemical Tests/Microbial Tests4.01Bacterial Endotoxins Test (92)4.02Microbial Assay for Antibiotics (96)4.03Digestion Test (100)4.04Pyrogen Test (103)4.05Microbial Limit Test (103)4.06Sterility Test (114)5.Tests for Crude Drugs5.01Crude Drugs Test (117)5.02Microbial Limit Test for Crude Drugs (120)6.Tests for Preparations6.01Test for Metal Particles in OphthalmicOintments (126)6.02Uniformity of Dosage Units (127)6.03Particle Size Distribution Test forPreparations (129)6.04Test for Acid-neutralizing Capacity ofGastrointestinal Medicines (129)6.05Test for Extractable Volume ofParenteral Preparations (130)6.06Foreign Insoluble Matter Test forInjections (131)6.07Insoluble Particulate Matter Test forInjections (131)6.08Insoluble Particulate Matter Test forOphthalmic Solutions (134)6.09Disintegration Test (135)6.10Dissolution Test (137)JP XVI Contents6.11Foreign Insoluble Matter Test forOphthalmic Solutions (141)7.Tests for Containers and Packing Materials7.01Test for Glass Containers for Injections..1417.02Test Methods for Plastic Containers (142)7.03Test for Rubber Closure for AqueousInfusions (148)8.Other Methods8.01Sterilization and Aseptic Manipulation (149)9.Reference Standards;Standard Solutions;Reagents,Test Solutions;MeasuringInstruments,Appliances,etc.Reference Standards9.01Reference Standards (150)Standard Solutions9.21Standard Solutions for VolumetricAnalysis (153)9.22Standard Solutions (164)9.23Matching Fluids for Color (166)Reagents,Test Solutions,etc.9.41Reagents,Test Solutions (167)9.42Solid Supports/Column Packings forChromatography (306)9.43Filter Papers,Filters for filtration,Test Papers,Crucibles,etc (308)9.44Standard Particles,etc (308)Measuring Instruments and Appliances,Thermometers,etc.9.61Optical Filters for Wavelength andTransmission Rate Calibration (309)9.62Measuring Instruments,Appliances (309)9.63Thermometers (310)Official Monographs (313)Crude Drugs (1593)Infrared Reference Spectra.....................1775–1961 Ultraviolet-visible Reference Spectra.........1965–2131General InformationG1Physics and ChemistryGuideline for Residual Solvents and Models for the Residual Solvents Test (2135)Inductively Coupled Plasma Atomic Emission Spectrometry (2136)Near Infrared Spectrometry (2141)pH Test for Gastrointestinal Medicine (2144)System Suitability (2145)Test for Trace Amounts of Aluminum inTrans Parenteral Nutrition(TPN)Solutions (2146)Validation of Analytical Procedures (2148)G2Solid-state PropertiesLaser Diffraction Measurement ofParticle Size (2151)Powder Fineness (2154)Powder Flow (2155)Solid and Particle Densities (2158)G3Biotechnological/Biological Products Amino Acid Analysis (2159)Basic Requirements for Viral Safety ofBiotechnological/Biological Productslisted in Japanese Pharmacopoeia (2166)Capillary Electrophoresis (2179)Isoelectric Focusing (2184)Mass Spectrometry of Peptides andProteins (2186)Mycoplasma Testing for Cell Substrates used for the Production of Biotechnological/Biological Products (2188)Peptide Mapping (2191)Qualification of Animals as Origin ofAnimal-derived Medicinal Productsprovided in the General Notices ofJapanese Pharmacopoeia and OtherStandards (2194)SDS-Polyacrylamide Gel Electrophoresis (2196)Total Protein Assay (2201)G4MicroorganismsDecision of Limit for BacterialEndotoxins (2205)Disinfection and Sterilization Methods (2205)Media Fill Test(Process Simulation) (2206)Microbial Attributes of Non-sterilePharmaceutical Products (2209)Microbiological Evaluation of Processing Areas for Sterile PharmaceuticalProducts (2211)Preservatives-Effectiveness Tests (2215)Rapid Counting of Microbes usingFluorescent Staining (2217)Rapid Identification of MicroorganismsBased on Molecular Biological Method (2220)Sterility Assurance for Terminally Sterilized Pharmaceutical Products (2221)Terminal Sterilization and SterilizationIndicators (2225)G5Crude DrugsAristolochic Acid (2227)Purity Tests on Crude Drugs Using Genetic Information (2228)On the Scientific Names of Crude DrugsListed in the JP (2231)G6Drug FormulationTablet Friability Test (2244)G7Containers and PackagePlastic Containers for PharmaceuticalJP XVI ContentsProducts (2244)G8WaterQuality Control of Water for PharmaceuticalUse (2246)Water to be used in the Tests of Drugs (2253)G9OthersInternational Harmonization Implementedin the Japanese Pharmacopoeia SixteenthEdition (2253)AppendixAtomic Weight Table(2010) (2287)Standard Atomic Weights2010 (2288)Index (2291)Index in Latin name (2307)Index in Japanese (2309)PREFACEThe15th Edition of the Japanese Pharmacopoeia (JP)was promulgated by Ministerial Notification No. 285of the Ministry of Health,Labour and Welfare (MHLW)on March31,2006.In July2006,the Committee on JP established the basic principles for the preparation of the JP16th Edi-tion,setting out the roles and characteristics of the JP, the definite measures for the revision,and the date of the revision.At the Committee,the five basic principles of JP, which we refer to as the``five pillars'',were estab-lished as follows:1)Including all drugs which are im-portant from the viewpoint of health care and medical treatment;2)Making qualitative improvement by in-troducing the latest science and technology;3)Pro-moting internationalization;4)Making prompt partial revision as necessary and facilitating smooth adminis-trative operation;and5)Ensuring transparency regarding the revision,and disseminating the JP to the public.It was agreed that the Committee on JP should make efforts,on the basis of these principles,to en-sure that the JP is used more effectively in the fields of health care and medical treatment by taking appropri-ate measurements,including getting the understanding and cooperation of other parties concerned.It was agreed that the JP should provide an official standard,being required to assure the quality of medi-cines in Japan in response to the progress of science and technology and medical demands at the time.It should define the standards for specifications,as well as the methods of testing to assure overall quality of all drugs in principle,and it should have a role in clarifying the criteria for quality assurance of drugs that are recognized to be essential for public health and medical treatment.The JP has been prepared with the aid of the knowledge and experience of many professionals in the pharmaceutical field.Therefore,the JP should have the characteristics of an official standard,which might be widely used by all parties concerned.It should provide information and understanding about the quality of drugs to the public,and it should be conducive to smooth and effective regulatory control of the quality of drugs,as well as promoting and maintaining international consistency and harmoniza-tion of technical requirements.It was also agreed that JP articles should cover drugs,which are important from the viewpoint of health care and medical treatment,clinical results and frequency of use,as soon as possible after they reach the market.The target date for the publication of JP16th Edi-tion(the Japanese edition)was set as April2011.JP Expert Committees are organized with the fol-lowing panels:Panel on the Principles of Revisions; Sub-committee on the Principles of Revisions;Panel on Medicinal Chemicals;Panel on Antibiotics;Panel on Biologicals;Panel on Crude Drugs;Panel on Phar-maceutical Excipients;Panel on Physico-Chemical Methods;Panel on Preparations;Panel on Physical Methods;Panel on Biological Tests;Panel on Nomen-clature;Panel on International Harmonization;Panel on Pharmaceutical Water;and Panel on Reference Standards.Furthermore,working groups are estab-lished under the Panel on Physico-Chemical Methods, Panel on Preparations and Panel on Biological Tests to expedite discussion on revision drafts.In the Committee on JP,Takao Hayakawa took the role of chairman from July2003to December2010, and Mitsuru Hashida from January2011to March 2011.In addition to the regular revision every five years in line with the basic principles for the preparation of the JP it was agreed that partial revision should be done as necessary to take account of recent progress of science and in the interests of international harmonization.In accordance with the above principles,the panels initiated deliberations on selection of articles,and on revisions for General Notices,General Rules for Crude Drugs,General Rules for Preparations,General Tests, Monographs and so on.Draft revisions covering subjects in General Notices, General Rules for Crude Drugs,General Rules for Preparations,General Tests and Monographs,for which discussions were finished between September 2005and March2007,were prepared for a supplement to the JP15.They were examined by the Committee on JP in April2007,followed by the Pharmaceutical Affairs and Food Sanitation Council(PAFSC)in June 2007,and then submitted to the Minister of Health, Labour and Welfare.The supplement was named ``Supplement I to the JP15th Edition'',promulgated on September28,2007by Ministerial Notification No. 316of MHLW,and became effective on October1,i。
日本药品(PMDA数据库、IF文件、药典(JP))网址信息

日本药品(PMDA数据库、IF文件、药典(JP))网址信息日本的医药学在世界医药学中是重要的组成部分,在某些方面甚至走在了世界的前端,日本医药学和中国的传统医药学有着紧密的联系。
特别是日本的医药化工在全球的地位举足轻重,是传统的制药强国,生产的药品也占有重要地位。
2016年,国家局CFDA发布关于仿制药一致性评价技术指导原则的通告中,将“在欧盟、美国、日本获准上市并获得参比制剂地位的仿制药”定义为国际公认的同种药物,并将与原研药并列作为国内一致性评价的参比制剂,都在说明日本新药具有非常重要的地位。
相较于其它国家不同,日本对上市药品公开信息程度非常高,研究和利用日本医药网站,将有利于了解日本医药领域的研究状况,研发人员引用或借鉴文献资料等。
药融云医药数据库V4.0包含了日本PMDA、日本药典(JP)、日本医药情、原料药、说明书、药品体外溶出试验信息、日本MF注册、日本橙皮书等数据。
一、日本PMDA:PMDA全称为Pharmaceuticals and Medical Devices Agency,其日语名称翻译过来就是独立行政法人医药品医疗器械综合机构,PMDA的一个最重要的职能就是技术审评。
PMDA所行使的职责相当于我国的国家食品药品监督管理局下所属单位国家药典委员会,药品审评中心,审核查验中心里的药品和医疗器械业务,药品评价中心,医疗器械技术审评中心所涵盖的业务内容。
PMDA数据库主要公布了日本上市药品的IF文件、说明书以及相关注册资料。
其中,IF 文件对于仿制药研发者来说,是非常重要的一份资料,其内容主要是公布药品的处方基本信息,药代动力学,临床相关信息等。
IF是Interview form,相当于比较详细的说明书。
日本lF文件查询步骤如下:1.登录PMDA/2.点击“医療用医藻品”(医疗药品)。
3.在“一般名·販壳名(医藻品の名称)”栏输入药品名称(药品名称用日文输入,可先把中文翻译为英文,再英文翻译日文,更容易搜索)。
日本上市药品信息的免费网络网站及检索查询方法

日本上市药品信息的免费网络网站及检索查询方法1 日本的药事法规简介日本的主要药事法规包括《药事法》(The pharmaceutical affairs law)、《药师法》(pharmacists law)、《毒剧药控制法》(poisonous and deleterious substances control law)等。
其中《药事法》的法律地位最高。
有关日本药事法规的大致情况可参考由日本制药工业协会编写、英日双语出版的《日本の药事行政》,2009 年3月发行版本日文版下载地址为http:// www.jpma.or.jp/about /issue/gratis/pdf/09yakuji.pdf,英文版下载地址为http://www.jpma.or.jp /english/parj/pdf/2009.pdf。
2 日本上市药品信息检索2.1 查找已上市药物信息的基本思路在日本上市的每个药物一般都包含如下几个名称: 治验番号,即研发单位给早期研发化合物取的代号,如日本上市的抗真菌药物利拉萘酯( INN: liranaftate) 的治验番号为M-732; 一般名,即日文通用名,亦称为Japanese Accepted Names for Pharmaceuticals(JAN) ,以区别于INN,如利拉萘酯的一般名为リラナフタ-ト; 販壳名,即商品名,分英文( 洋名)、日文( 和名) 两种,如利拉萘酯乳膏的販壳名分别为ZEFNART CREAM 2% ,ゼフナ-トクリ-ム2% 。
查找日本已上市药物信息的基本思路可参考:治验番号--一般名、販壳名--药品说明书;新药批准资料合集;厂商提供的药品IF。
2.2 販壳名的检索TOXNET 网站( /)可通过治验番号检索到药物的英文通用名(INN) 。
仍以利拉萘酯为例,输入“m-732”检索,再点击CHEMIDplus 右边的链接,即可得到m-732 的英文通用名liranaftate、CAS 号、结构式等其他信息。
HPLC法测定清洁验证中残留物孟鲁司特钠的含量

39 Journal of China Prescription Drug Vol.19 No.4·实验研究·孟鲁司特钠是一种口服的白三烯受体拮抗剂,能特异性抑制气道中的半胱氨酰白三烯(CysLT1)受体,从而改善气道炎症,有效控制哮喘症状[1]。
原研药为默沙东公司研发、生产的咀嚼片,1999年获得中国国家食品药品监督管理局批准正式上市。
在生产孟鲁司特钠咀嚼片时,其生产线通常还用于其他产品,为了防止孟鲁司特钠残留对下一产品的污染,生产结束后需要对生产设备进行有效清洁并进行清洁验证。
而建立可靠的残留物分析方法并对分析方法进行验证是清洁验证的重要保障[2]。
本研究参考GMP验证要求,通过计算确定孟鲁司特钠清洁验证设备残留限度为0.034 μg/cm2。
参照《美国药典》和《日本药典》中孟鲁司特钠的有关物质测定方法[3],依据清洁验证的特殊要求,对色谱条件进行优化,建立了一种可快速检验生产设备表面孟鲁司特钠残留量的方法。
1 仪器与试药Agilent1260高效液相色谱仪(美国安捷伦);XPE205DR电子分析天平(美国梅特勒);水为超纯水;乙腈为Merck色谱纯;甲醇为Merck色谱纯;三氟乙酸为Tedia色谱纯;CIP100为奥星衡迅生命科技(上海)有限公司;其他试剂均为分析纯。
对照品孟鲁司特二环己胺对照品(USP,批号:R035A0,含量为99.3%)。
2 方法与结果2.1 孟鲁司特浓度计算孟鲁司特钠咀嚼片的清洁残留限度为0.034 μg/cm2,擦拭面积为100 cm2,所以擦拭用棉签的理论浓度为3.4 μg/块。
每块棉签的擦拭物溶解于10 ml溶剂中,最后擦拭供试液浓度理论值为0.34 μg/ml,作为分析方法验证中孟鲁司特的100%水平浓度。
2.2 色谱条件参照在USP41和JP17孟鲁司特钠片下有关物质[2]测定方法,经验证后,色谱条件如下:色谱柱为Agilent SB-Phenyl 4.6×75 mm,3.5 μm;以0.2%三氟乙酸水溶液(V/V)-0.2%三氟乙酸乙腈(V/V)(50∶50)为流动相;检测波长为389 nm;进样盘:10℃;流速:0.9 ml/min;柱温:50℃;进样量:50 μl;稀释剂:甲醇-水(3∶1)。
日本药典 (JP)和日本的辅料标准

内容:
・ 一般通告
・ 天然药品的一般规定 ・ 制剂的一般规定 ・ 通用测试、流程和设备 (69) ・ 官方专论 (1483) -化学物、抗生素、生物制品等 -辅料 -天然药品(包括日本汉方提取物) ・ 一般性信息 (30)
日本药品和医疗器械局的组织机构
日常事务、规划和协调办 公室 产品评估中心
-检查:
救济金办公室
新药、医疗器械、生物制剂、 非注册药和OTC -审查: GLP、 GCP 等
PMDA
-健康危害影响的救济服
务
顺从性和标准办 公室
安全办公室
-审查和相关的操作/售后安全性
-审查:药物GMP和MD质量
系统
标准区分: 日本药典草稿的准备
3. 推动国际协调的进程 (1)
通过药典讨论小组(PDG)与欧洲药典和美国药典合作 → 带来了日本药典第15版中的各种协调最终文本 20个一般章节中有19个 35个辅料专论中有24个
3. 推动国际协调的进程 (2)
在每个协调一般测试方法和辅料中均包括了协调 现状陈述 未说明的区别和当地要求均采用了通用符号(黑色 菱形 ◆ ) 一般信息中的信息补遗 -日本药典中实施的国际协调
结束 9月2日 9月2日 11月5日 11月5日 11月5日 11月5日 7月3日 10月1日 2月3日 10月1日 5月5日 5月5日 11月3日 11月3日 2月2日 11月3日 6月6日
采用和发表 3月6日 3月6日 3月6日 9月7日 9月7日 12月4日 3月6日 12月4日 3月6日 3月6日 3月6日 3月6日 3月6日 9月7日
日本药典第15版
日本药典第15版的主要政策
《美国药典》《欧洲药典》《日本药典》与《中国药典》中中药饮片微生物限度检查及标准的比较研究

《美国药典》《欧洲药典》《日本药典》与《中国药典》中中药饮片微生物限度检查及标准的比较研究作者:范一灵李琼琼秦峰刘浩杨美成来源:《中国药房》2020年第22期摘要目的:比較《美国药典》43版(USP43)、《欧洲药典》10.0版(EP10.0)、《日本药典》17版(JP17)与《中国药典》2020年版(ChP2020)中中药饮片微生物限度检查方法及标准的差异,为我国中药饮片相关微生物标准的修订和完善提供参考。
方法:比较USP43、EP10.0、JP17和ChP2020在中药饮片的微生物计数法(包括抽样与取样、菌种和培养基选择、微生物和耐热菌计数等)、控制菌检查(包括样品前处理、增菌、分离、鉴定等)、微生物相关限度标准等方面的差异。
结果与结论:在中药饮片微生物的检查方法上,USP43、EP10.0、JP17都有各自独立的规定,ChP2020则新增了“通则1108”。
在检验项目上,除需氧菌总数、霉菌和酵母菌总数外,ChP2020与EP10.0规定了3种控制菌(耐胆盐革兰阴性菌、大肠埃希菌、沙门菌)的检查方法;在此基础上,JP17补充了金黄色葡萄球菌的检查方法;USP43增加了梭菌的检查方法,并最早提出不可接受微生物风险评估理念;ChP2020还新增了耐热菌计数方法。
在微生物限度标准上,USP 43对中药饮片的分类最为细致,要求较为严格且高于EP10.0、JP17;ChP2020仍未对中药饮片控制菌检查设立统一的限度标准。
虽然,ChP2020对“中药提取物及中药饮片的微生物限度标准”进行了修订,但相较于美国、欧洲和日本药典的规定还不完善。
建议根据我国中药饮片微生物污染和控制现状,逐步完善药典对中药相关产品的微生物检验和限度标准,合理细化相应产品的微生物限度水平。
关键词中药饮片;药典;微生物检查;限度标准;比较研究中图分类号 R921;R927.1 文献标志码 A 文章编号 1001-0408(2020)22-2695-06DOI 10.6039/j.issn.1001-0408.2020.22.02ABSTRACT; ;OBJECTIVE: To compare the difference of microbiological limit test and criteria of TCM decoction pieces among 43 edition of United States Pharmacopeia; (USP43),10.0 edition of European Pharmacopeia; (EP10.0), 17 edition of Japanese Pharmacopeia;(JP17) and 2020 edition of Chinese Pharmacopeia (ChP2020), and to provide refernce for the revision and improvement of microbiological standards for TCM decoction pieces in China. METHODS: The differences in the microbial enumeration tests method (including sampling and sample preparation, selection of bacteria and culture medium, count of microorganisms and heat-resistant bacteria, etc.), tests for specified microorganisms (including sample pretreatment,enrichment, separation and identification, etc.) and microbial related limit criteria were compared among USP43, EP10.0, JP17 and ChP2020. RESULTS & CONCLUSIONS: In terms of microbiological examination of TCM decoction pieces, USP43, EP10.0, JP17 had their own independent provisions. Chp2020 added “general rule 1108”. In terms of inspection items, in addition to the total aerobic bacteria count and total combined yeasts and molds count, ChP2020 and EP10.0 provided three methods for the inspection of control bacteria (bile-resistant Gram-negative bacteria, Escherichia coli, Salmonella). On the basis, JP17 supplemented Staphylococcus aureus test; However, USP43 added Clostridium test method and put forward the concept of objectionable microorganisms risk assessment; ChP2020 also added a new method for counting heat-resistant bacteria. In terms of microbial limit criteria, USP43 was the most detailed in the classification of TCM decoction pieces, which was more strict than EP10.0 and JP17; ChP2020 had not set up a unified limit for the inspection of control bacteria of TCM decoction pieces. ChP2020 revised the “microbial limit standard for TCM extracts and TCM decoction pieces”, but it was notperfect compared with the Pharmacopoeia of the United States, Europe and Japan. It is suggested that according to the current situation of microbial contamination and control of TCM decoction pieces, the microbial limit test and criteria of TCM related products in Pharmacopoeia should be gradually improved, and the microbial limit level of corresponding products should be reasonably refined.KEYWORDS; ;TCM decoction piece; Pharmacopeia; Microbial limit test; Limit criteria; Comparative study中药饮片是由中药材通过炮制加工而成的可直接用于中医临床的产品,其大多源自天然植物、动物或矿物,通常携带有大量微生物[1-2]。
国外药典介绍

包括欧盟在内共有37个成员。最新加入的成员:波兰(2006)。
包括世界卫生组织在内,加上7个欧洲国家(阿尔巴尼亚、亚美尼亚、 白俄罗斯、格鲁吉亚、哈萨克斯坦共和国、摩尔多瓦、俄罗斯联邦和乌 克兰)和16个非欧国家(阿尔及利亚、澳大利亚、巴西、加拿大、中国、 以色列、马达加斯加、马来西亚、摩洛哥、塞内加尔、叙利亚、突尼斯、 美国),共24个观察员。 最新加入的观察员:新加坡(HSA)(2012)、阿根廷、亚美尼亚和 摩尔多瓦(2008)、白俄罗斯共和国(2007)、俄罗斯联邦和乌克兰 (2006)。
第二卷
各论举例、各论、按字母的索引页 总索引 每卷均有侧面黑色索引标示
2014-11-3
欧洲各册内容介绍
增补举例:
目录、凡例、分析方法通论、试剂、通则、制剂各论、中草药及其 制剂各论、顺势疗法制剂各论、各论、增补内容简介(包括新增内 容、修订内容和更正内容)
索引:可以帮助用户索引到包含在最新增补本中的内容。
查看
在通则、附录及各论中,凡是和欧洲药典完全一致的, 均加入 标志,并在名称项下用斜体字标示出了
欧洲药典中的索引页码。
2014-11-3
欧洲药典简介
欧洲药典简介
《欧洲药典》由欧洲药品质量委员会(EDQM)编辑出版,有英文和法 文两种法定文本。其全称为European Pharmacopoeia,缩写为Ph.Eur.。
历史及版 本
USP于1820年出第一版,1950年以后每5年出一次修订版。年成立药典修订委员会, 并对第一版药典进行了修订,1906年,FDA将药典指定为官方标准,经过多次版 本的升级,到2014年已出版至第37版。从2002年(USP25-NF20)起每年一版。 NF1883年第一版,1980年15版起并入USP,但仍分两部分,前面为USP,后面为 NF。每一版本的《美国药典》包含4卷及2个增补版。美国药典最新版为USP 37NF 32;2013年12月出版;2014年5月1日生效。
日本药典:现状和将来(中文)

PMDA 产业草案 *PAFSC:
药事食品卫生委员会
需求
草案提交
秘书处草案 专家委员会修订
日本药典公开征求意见稿 日本药典最终草案 提问 回答 医药行业 &
公众咨询
其它利益相关 者
MHLW, JP Committee/ PAFSC* - 通过和颁布日本药典 - 发行日本药典 (英文翻译)
- 药品制造商协会的代表(东京、大阪)和其他感兴趣的各方
频率
- 每一个专家委员会 每两月一次会面。 原始质量控制实验室: 无
17
Pharmaceuticals and Medical Devices Agency (PMDA)
日本药典专家委员会组织
Update; October 1, 2013
Com. on 化学 (1) and (2) Com. on 抗生素 Com. on 生物 Com. on 原料药(B) - Com. on 原料药 (A) Com. on 辅料 - WG (Alchoholimetric Tables)
Pharmaceuticals and Medical Devices Agency (PMDA)
// 2013 ChP Scientific Symposium (November 13, 2013) //
10
今天的主题
1. 什么是日本药典? 2. 怎么建立日本药典 ? 3. 什么是国际和谐? 4. 日本药典将来的展望。
2
Pharmaceuticals and Medical Devices Agency (PMDA)
日本药典的历史和法定地位
日本药典JP17电子版JP17e_4-3

JP XVII
Infrared Reference Spectra
2093
Emedastine Fumarate
Emorfazone
Enalapril Maleate
2094
Infrared Reference Spectra
JP XVII
Enflurane
JP XVII
Infrared Reference Spectra
2115
Concentrated Glycerin
Glycine
Gonadorelin Acetate
2116
Infrared Reference Spectra
JP XVII
Guaifenesin
Guanabenz Acetate
Hydroxypropylcellulose
Hymecromone
2122
Infrared Reference Spectra
JP XVII
Hypromellose Phthalate (200731)
Hypromellose Phthalate (220824)
Ibudilast
JP XVII
Glibenclamide
JP XVII
Infrared Reference Spectra
2113
Gliclazide
Glimepiride
L-Glutamic
Байду номын сангаасAcid
2114
Infrared Reference Spectra
L-Glutamine
JP XVII
Glutathione
