专题三 考点一 氧化还原反应
氧化还原反应

化学复习专题 氧化还原反应考点1:氧化还原反应的基本概念1.结合实例理解氧化还原反应的相关概念实例:在Fe 2O 3+3CO=====高温2Fe +3CO 2的反应中 是氧化剂, 是还原剂; 元素被氧化, 元素被还原;Fe 2O 3具有氧化性,CO 具有还原性; 是氧化产物, 是还原产物。
2.归纳总结氧化还原反应的概念(1)氧化还原反应的特征及本质①特征:有元素的化合价变化 ②本质:有电子的转移(得失或偏移)(2)氧化剂:在氧化还原反应中得到电子(或电子对偏向)的反应物(即所含元素的化合价降低)(3)还原剂:在氧化还原反应中失去电子(或电子对偏离)的反应物(即所含元素的化合价升高)(4)还原产物:氧化剂得到电子后生成的对应产物。
(5)氧化产物:还原剂失去电子后生成的对应产物。
3.基于双线桥理解氧化还原反应的概念之间的关系:概括为升失氧、降得还,剂性一致、其他相反4. 四种基本反应类型和氧化还原反应的关系可用下图表示:题组训练:1.三氟化氮(NF 3)是微电子工业中一种优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF 3+5H 2O===2NO +HNO 3+9HF ,下列有关该反应的说法正确的是( )A .NF 3是氧化剂,H 2O 是还原剂B .HF 是还原产物C .还原剂和氧化剂的物质的量之比是2∶1D .NF 3在潮湿的空气中泄漏会产生红棕色气体2.被称为万能还原剂的NaBH 4溶于水并和水反应:NaBH 4+2H 2O===NaBO 2+4H 2↑,下列说法中正确的是(NaBH 4中H 为-1价)( )A .NaBH 4既是氧化剂又是还原剂B .NaBH 4是氧化剂,H 2O 是还原剂C .硼元素被氧化,氢元素被还原D .被氧化的元素与被还原的元素质量之比为1∶13.ClO 2是一种杀菌消毒效率高、二次污染小的水处理剂。
实验室中可通过以下反应制得:2KClO 3+H 2C 2O 4+H 2SO 4=====△2ClO 2↑+K 2SO 4+2CO 2↑+2H 2O 。
年一轮复习化学教案课件:氧化还原反应

(6)金属阳离子被还原不一定得到金属单质( √ ) (7)具有还原性的物质与具有氧化性的物质不一定都能发生氧化还原反应
(√) (8)氧化还原反应中有一种元素被氧化,则一定有另一种元素被还原( × ) (9)同种元素的高价态的物质一定比低价态物质的氧化性强( × )
•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
√A.G、Y、Q、Z、X
C.X、Z、Q、Y、G
B.X、Z、Q、G、Y D.G、Q、Y、Z、X
12345 6
解析 答案
考点三 氧化还原反应“守恒律”的应用
1 核心精讲
(1)内容 ①质量守恒:反应前后元素的种类、原子的数目和质量不变。 ②电子守恒:氧化还原反应中,氧化剂得到的电子总数等于还原剂失去的 电子总数,表现为化合价升高的总数等于化合价降低的总数。 ③电荷守恒:离子方程式中反应物中各离子的电荷总数与产物中各离子的 电荷总数相等。 (2)应用:运用“守恒规律”可进行氧化还原反应方程式的配平和相关计算。
√ A.2 4 3 2 2 6 B.0 2 1 0 1 2
C.2 0 1 2 0 2 D.2 2 2 2 1 4
12345 6
解析 答案
4.向含有 SO23-、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2, 通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
√
12345 6
题组一 理解氧化还原反应相关概念
氧化还原反应典型例题解析

考点一:氧化还原反应考点二:常见的氧化剂和还原剂考点三:氧化还原反应中电子转移的表示方法专题氧化还原反应题型一:基本概念的考查【例1】下列化工生产过程所发生的反应不属于...氧化还原反应的是()A.用油脂制肥皂B.用铝土矿制金属铝C .用氯气和消石灰制漂白粉D .用氢气和氮气合成氨【点拨】判断氧化还原反应的最基本的方法是看反应前后有无化合价的变化。
题型二:氧化性、还原性强弱的判断【例2】氰(CN)2、硫氰(SCN)2的化学性质和卤素(X 2)很相似,化学上称为拟卤素[如:(SCN )2+H 2O HSCN +HSCNO]。
它们阴离子所谓还原性强弱为:Cl -<Br -<CN -<SCN -<I -.试写出:①(CN)2与KOH 溶液反应的化学方程式②NaBr 和KSCN 的混合溶液中加入(CN)2,反应的离子方程式【点拨】①(CN)2与KOH 溶液反应,相当于Cl 2与KOH 溶液反应。
②由于阴离子还原性顺序为Cl -<Br -<CN -<SCN -<I -,所以单质氧化性顺序Br 2>(CN)2>(SCN)2。
【规律总结】氧化还原反应的方向:由强到弱强氧化剂+强还原剂——→氧化产物(弱氧化性)+还原产物(弱还原性)氧化性:氧化剂>氧化产物还原性:还原剂>还原产物由此可判断反应能否进行;比较氧化性或还原性的强弱【强调1】已知反应:①Cl 2+2KBr=2KCl+Br 2, ②KClO 3 +6HCl=3Cl 2+KCl +3H 2O ,③2KBrO 3 +Cl 2=Br 2 + 2KClO 3,下列说法正确的是()A .上述三个反应都有单质生成,所以都是置换反应B .氧化性由强到弱顺序为 KBrO 3>KClO 3>Cl 2>Br 2C .反应②中还原剂与氧化剂的物质的量之比为6:1D .③中lmol 还原剂反应则氧化剂得到电子的物质的量为2mol【点拨】该题主要考查氧化还原反应的规律、氧化剂和还原剂的判断、对化学计量数的理解以及得失电子守恒的简单应用)题型三:氧化还原反应方程式配平的常见题型【例3】配平以下氧化还原反应方程式:KMnO 4+H 2C 2O 4+H 2SO 4——CO 2+K 2SO 4+MnSO 4+H 2O当KMnO 4消耗0.05mol 时,产生的CO 2的体积为________L(标准状况)。
考点1 氧化还原反应概念

•(3)并非价态越高氧化性越强,在HClO中氯元素的化
合价为+1价,在HClO4中氯元素的化合价为+7价,事 实上HClO的氧化性比HClO4强,HClO有强氧化性;再 如浓硫酸和Na2SO4溶液中,硫元素均为+6价,但浓硫 酸具有强氧化性,而Na2SO4溶液无氧化性;再如HNO3、 KNO3溶液中,氮元素均为+5价,但HNO3溶液有强氧 化性,而KNO3溶液无氧化性。
第四节 氧化还原反应
考点1 氧化还原反应的相关概念及表示方法
一、氧化还原反应的本质和特征:
1、氧化还原反应的概念:
在反应中有元素化合价变化的化学反应
(1)实质:有电子的转移(得失或偏移) (2)特征:有元素化合价升降 (3)判断:
凡是有化合价这升是降的概化念学反判应断就是的氧根化还本原反应 依据
12
提醒:①一定属于氧化还原反应的是置换反应。 ②一定不属于氧化还原反应的是复分解反应。 ③属于氧化还原反应的常见化合反应的共同点是有单质参 加。 ④属于氧化还原反应的常见分解反应的共同点是有单质生 成。
二、知电识梳子理转移数目的分析方法
1.有关电子转移数目的计算 关键是明确反应中元素的化合价变化,找出氧化剂或还 原剂的物质的量,以及 1 mol 氧化剂得电子的物质的量 或者 1 mol 还原剂失电子的物质的量。例如: 2 mol
• • _________________________________________
3.电子转移数目的确定方法 (1)双线桥法中的电子转移数目
氧化剂得电子数=氧化剂中变价原子个数×元素化合 价降低值。
还原剂失电子数=还原剂中变价原子个数×元素化合 价升高值。
(2)单线桥法中电子转移数目 氧化剂1得电子数+氧化剂2得电子数+…… 或还原剂1失电子数+还原剂2失电子数+……
1. 氧化还原反应

【专题一】氧化还原反应【考点突破】考点1氧化还原反应的基本概念及其关系例如:方法点击为了方便记忆、快速解题可采用如下口诀:升失氧、降得还;剂性一致、其他相反。
(“升失氧、降得还”即反应后化合价升高的物质失电子被氧化,发生氧化反应;反应后化合价降低的物质得电子被还原,发生还原反应。
“剂性一致”即氧化剂具有氧化性,还原剂具有还原性。
“其他相反”即氧化剂被还原,发生还原反应,得还原产物;还原剂被氧化,发生氧化反应,得氧化产物。
>考点2常见的氧化剂和还原剂(1>常见的氧化剂①非金属单质:如Cl2、O2、Br2等。
②含有高价态元素的化合物:浓H2SO4、HNO3、KMnO4、MnO2、KClO3、K2Cr2O7等。
③某些金属性较弱的高价态离子:Fe3+、Ag+、Pb4+、Cu2+等。
④过氧化物:Na2O2、H2O2等。
(2>常见的还原剂①活泼金属:K、Na、Mg、Al等。
②非金属离子及低价态化合物:S2-、H2S、I-、SO2、H2SO3、Na2SO3等。
③低价阳离子:Fe2+、Cu+等。
④非金属单质及其氢化物:H2、C、CO、NH3等。
方法点击强氧化剂与强还原剂相遇时,一般都会发生氧化还原反应。
如:H2SO4(浓>与金属、H2S、S2-、HI、I-、HBr、Br、Fe2+、P等。
Cl2与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、H2、SO2、、H2SO3等。
HNO3与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、P、SO2、、H2SO3等。
O2与金属、H2S、S2-、HI、I-、Fe2+、P、Si、H2等。
考点3氧化性或还原性强弱的比较规律1.依据反应式来判断氧化剂+还原剂氧化产物+还原产物氧化性:氧化剂>氧化产物还原性:还原剂>还原产物口诀:比什么“性”找什么剂,“产物”之“性”小于“剂”。
2.依据反应条件来判断当不同的氧化剂作用于同一还原剂时,如氧化产物价态相同,可依据反应条件的难易程度来判断。
高考氧化还原反应的常考点

高考氧化还原反应的常考点一、氧化还原反应的基本概念氧化还原反应是指在化学反应中,物质所含的电子数发生变化的反应。
通常,一个物质失去电子的过程称为氧化反应,而得到电子的过程则称为还原反应。
二、氧化数的表示方法氧化数是一个描述原子或分子电子分布的数值,常用来表示原子或分子的氧化状态。
在化合物中,正负化合价之和为零,单质化合价为零。
三、常见氧化还原反应类型及其实例1.置换反应:一种单质替代另一种单质的反应,如铁与稀硫酸反应生成硫酸亚铁和氢气。
2.分解反应:一种化合物分解成两种或多种单质的反应,如水分解为氢气和氧气。
3.歧化反应:一种物质中的同一种元素发生氧化和还原反应,如氯气与水反应生成盐酸和次氯酸。
4.归中反应:一种物质中的元素从高价变为低价或从低价变为高价的反应,如硫在氧气中燃烧生成二氧化硫。
四、氧化还原反应中的电子转移数计算在氧化还原反应中,电子转移数的计算是重要的考点。
电子转移数等于化合价变化数乘以参与反应的原子个数。
五、氧化还原反应在生活和工业领域的应用案例分析1.工业制硫酸:利用二氧化硫、氧气和水在高温下反应生成硫酸。
2.汽车尾气处理:汽车尾气中的一氧化碳和氮氧化物通过催化转化器转化为二氧化碳和水。
3.金属的冶炼:金属可以通过氧化还原反应从其化合物中被还原出来,如铁的冶炼。
六、歧化与归中反应特点及实例分析1.歧化反应:一种物质中的同一种元素发生氧化和还原反应,如氯气与水反应生成盐酸和次氯酸。
特点是在一个分子内部发生氧化还原反应。
2.归中反应:一种物质中的元素从高价变为低价或从低价变为高价的反应,如硫在氧气中燃烧生成二氧化硫。
特点是电子转移发生在同一元素之间。
七、酸碱条件对氧化还原反应的影响酸碱条件可以影响氧化还原反应的方向和速率。
在酸性条件下,氧化剂的氧化性通常增强,还原剂的还原性减弱;在碱性条件下则相反。
此外,酸碱条件还可能影响中间产物和最终产物的生成。
八、配平技巧和策略在配平氧化还原反应时,可以采用多种技巧和策略,如化合价升降守恒法、电子得失守恒法等。
高考化学考前专题3 氧化还原反应复习课件

MnO
-
4
>
Fe3+
>
Cu2+。
(3)①碱式滴定管(乙)下端有一段橡胶管,能被酸性高锰酸钾
溶液氧化,因此应该使用酸式滴定管(甲)装酸性高锰酸钾溶
液。终点时,溶液的颜色变为紫色或紫红色。②n(KMnO4) =0.100 mol·L-1×0.100 L=0.010 mol。根据关系式 Cu2O~ 2Fe3+~2Fe2+~2/5KMnO4,可得 n(Cu2O)=0.010 mol×5/2= 2.5×10-2 mol,而 m(Cu2O)=2.5×10-2 mol×144 g·mol-1= 3.6 g,w(Cu2O)=3.6 g/5 g×100%=72%。
命题猜想 2 向盛有 KI 溶液的试管中加入少许 CCl4 后滴加 氯水,振荡,静置,CCl4 层变成紫色。如果继续向试管中 滴加氯水,振荡,CCl4 层会逐渐变浅,最后变成无色,生 成物之一为 HIO3。则有关该过程的说法不正确的是( ) A.CCl4 层由紫色变成无色的化学反应方程式为 I2+5Cl2 +6H2O===2HIO3+10HCl B.整个过程中每生成 1 mol HIO3 共转移 6NA 个电子 C.整个过程中的还原剂有 KI、I2 D.若把 KI 换成 KBr,则 CCl4 层变为橙红色,继续滴加 氯水,CCl4 层的颜色没有变化,则 Cl2、HIO3、HBrO3 的氧化性由强到弱的顺序是 Cl2>HBrO3>HIO3
H2===LiNH2+LiH,下列有关说法正确的是
()
A.Li2NH 中 N 被氧化
B.该反应中 H2 既是氧化剂又是还原剂
C.在标准状况下,11.2 L H2 参加反应,转移的电子为 1 mol
D.在反应中被氧化的元素原子与被还原的元素原子个数
氧化还原反应知识点

高三备考氧化还原反应的基本概念一.氧化还原反应的基本概念1.概念(1)氧化还原反应是指反应。
(2)氧化反应是指物质的反应,还原反应是指物质的反应。
(3)氧化剂是指所含元素化合价 (或电子)的反应物;还原剂是指所含元素化合价 (或电子)的反应物。
(4)氧化产物是指被得到的生成物;还原产物是指被得到的生成物。
(5)氧化性是指物质电子的性质,还原性是指物质电子的性质;氧化剂具有,还原剂具有。
2.特征氧化还原反应的特征是的反应,这是判断一个反应是否是氧化还原反应的依据。
3.氧化还原反应的实质是。
4.氧化还原反应与四种基本类型的关系注意:(1)对于氧化还原反应可以归结记忆为“高原低氧”,即:化合价升高为还原剂,还原剂失去电子的反应为氧化反应;化合价降低为氧化剂,氧化剂得到电子的反应为还原反应。
(2)有单质参加或生成的化学反应不一定是氧化还原反应,如同素异形体之间的相互转化。
二.氧化还原反应中电子转移的表示方法1.双线桥法表示元素的原子在化学反应前后电子得失的情况和数目。
注意:①线桥的箭尾必须指在反应物中发生变化的元素上,箭头指向生成物中的该元素上。
②在线上标出得到或失去电子的数目,数目后面写上电子的标识e-。
2.单线桥法表示反应物中元素原子发生电子转移的数目和情况。
如:注意:①线桥的箭尾指向失电子元素的原子,箭头指向得电子元素的原子。
②在线上只需标出电子转移总数及电子的标识e-,不需注明“得到”或“失去”的字样。
三.常见的氧化剂、还原剂1.对立统一关系氧化反应和还原反应虽是两个不同的过程,但在同一反应中同时发生,它们既对立又统一。
2.两条主线关系升(化合价升高)―→失(失去电子)―→氧(被氧化);降(化合价降低)―→得(得到电子)―→还(被还原)。
3.相关概念间的转化关系或。
注意:①氧化还原反应的有关概念较多,因对概念的内涵理解不透,外延掌握不全面,很容易发生错误判断。
应注意加深对概念的理解。
②在氧化还原反应中,氧化剂和还原剂可以是不同反应物,也可以是同一反应物,氧化产物、还原产物可以是不同产物,也可以是同一种产物。
专升本化学氧化还原反应考点解析

专升本化学氧化还原反应考点解析氧化还原反应是化学学科中的一个重要概念,在专升本考试中也是重点考点之一。
理解和掌握氧化还原反应对于学好化学具有关键意义。
一、氧化还原反应的基本概念氧化还原反应的本质是电子的转移,表现为元素化合价的升降。
在氧化还原反应中,化合价升高的物质被氧化,发生氧化反应;化合价降低的物质被还原,发生还原反应。
氧化剂具有氧化性,在反应中得到电子,化合价降低;还原剂具有还原性,在反应中失去电子,化合价升高。
例如,在反应 2H₂+ O₂= 2H₂O 中,氢气(H₂)中的氢元素化合价从 0 升高到+1,氢气被氧化,是还原剂;氧气(O₂)中的氧元素化合价从 0 降低到-2,氧气被还原,是氧化剂。
二、氧化还原反应的电子转移表示方法1、双线桥法用双线桥法表示电子转移时,要分别从反应物中化合价发生变化的元素指向生成物中相应的元素,并在桥上注明电子得失的数目和化合价的升降情况。
以 2KClO₃= 2KCl + 3O₂↑为例,从氯酸钾(KClO₃)中氯元素指向氯化钾(KCl)中的氯元素,桥上标明“得到 6e⁻,化合价降低”;从氯酸钾中的氧元素指向氧气(O₂)中的氧元素,桥上标明“失去6e⁻,化合价升高”。
2、单线桥法单线桥法是从还原剂中失去电子的元素指向氧化剂中得到电子的元素,桥上只标明电子转移的总数目。
比如在 Fe + 2HCl = FeCl₂+ H₂↑中,从铁(Fe)指向盐酸(HCl)中的氢元素,桥上写“2e⁻”。
三、氧化还原反应的强弱规律氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
这意味着在一个氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性。
例如,在反应2FeCl₃+ Cu = 2FeCl₂+ CuCl₂中,氧化性:Fe³⁺>Fe²⁺;还原性:Cu>Fe²⁺。
四、常见的氧化剂和还原剂常见的氧化剂有:高锰酸钾(KMnO₄)、过氧化氢(H₂O₂)、氯气(Cl₂)、氧气(O₂)等。
高三化学总复习 氧化还原反应的基本概念和规律

第4讲氧化还原反应的基本概念和规律复习目标知识建构1.掌握氧化还原反应的基本概念及相互关系;会用“单、双线桥”表示电子转移的方向和数目。
2.理解氧化还原反应的基本规律,了解氧化还原反应在生产、生活中的应用。
一、氧化还原反应1.氧化还原反应的本质和特征2.氧化还原反应概念之间的关系记为:升失氧、降得还,剂性一致、其他相反。
3.氧化还原反应与四种基本反应类型的关系4.氧化还原反应中电子转移的表示方法(1)双线桥法氧化剂+还原剂===还原得到n e-产物+氧化失去n e-产物请写出Cu与稀硝酸反应的化学方程式并用双线桥标出电子转移的方向和数目:(2)单线桥法请写出Cu与稀硝酸反应的化学方程式并用单线桥标出电子转移的方向和数目:。
【判一判】判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)金属阳离子一定只具有氧化性()(2)NO2溶于水发生氧化还原反应()(3)某元素从游离态变为化合态,该元素可能被氧化也可能被还原()(4)置换反应一定是氧化还原反应,化合反应、分解反应不一定是氧化还原反应()(5)NaHCO3+H2===HCOONa+H2O的反应中,NaHCO3被氧化()(6)Na2O2与水的反应中,水是还原剂()答案(1)×(2)√(3)√(4)√(5)×(6)×二、氧化剂和还原剂1.常见氧化剂和还原剂(1)常见氧化剂及还原产物常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。
如:(2)常见还原剂及氧化产物常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。
如:(3)元素化合价处于中间价态的物质既可作氧化剂,又可作还原剂。
2.氧化性和还原性(1)氧化性是指得电子的性质(或能力);还原性是指失电子的性质(或能力)。
(2)最高价态微粒只有氧化性,最低价态微粒只有还原性,中间价态微粒既有氧化性又有还原性。
知识讲解_氧化还原反应的基本概念和规律(提高)
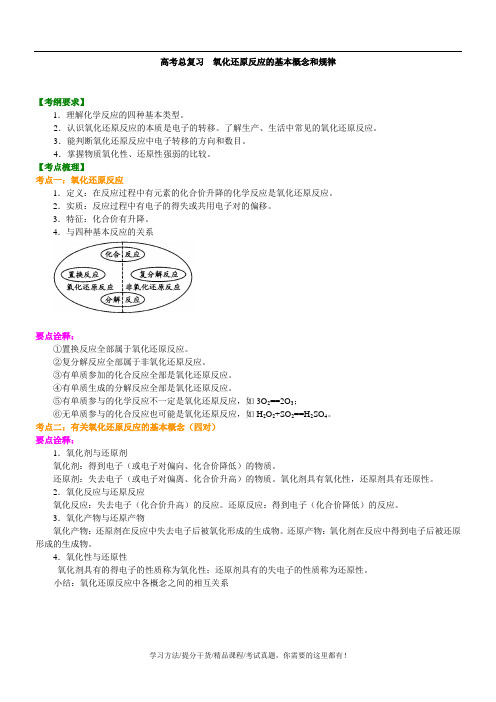
高考总复习氧化还原反应的基本概念和规律【考纲要求】1.理解化学反应的四种基本类型。
2.认识氧化还原反应的本质是电子的转移。
了解生产、生活中常见的氧化还原反应。
3.能判断氧化还原反应中电子转移的方向和数目。
4.掌握物质氧化性、还原性强弱的比较。
【考点梳理】考点一:氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
2.实质:反应过程中有电子的得失或共用电子对的偏移。
3.特征:化合价有升降。
4.与四种基本反应的关系要点诠释:①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2==2O3;⑥无单质参与的化合反应也可能是氧化还原反应,如H2O2+SO2==H2SO4。
考点二:有关氧化还原反应的基本概念(四对)要点诠释:1.氧化剂与还原剂氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。
氧化剂具有氧化性,还原剂具有还原性。
2.氧化反应与还原反应氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
3.氧化产物与还原产物氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
4.氧化性与还原性氧化剂具有的得电子的性质称为氧化性;还原剂具有的失电子的性质称为还原性。
小结:氧化还原反应中各概念之间的相互关系上述关系可简记为:升(化合价升高)、失(电子)、氧(氧化反应)、还(还原剂)降(化合价降低)、得(电子)、还(还原反应)、氧(氧化剂)例如,对于反应:MnO2+4HCl (浓)△MnCl2+Cl2↑+2H2O①该反应的氧化剂是MnO2,还原剂是HCl,氧化产物是Cl2,还原产物是MnCl2,氧化剂与还原剂的物质的量之比为1∶2。
高考化学专题复习氧化还原反应

二轮专题复习
解析:选 B。CrO2(ClO4)2 中 O 元素的化合价为-2 价、Cl 元素的化合价为 +7 价,根据化合物中各元素正负化合价代数和等于 0 可知,该物质中 Cr 元素的化合价为+6 价,A 错误;Cl 元素的非金属性较强,HClO4 属于强酸, HClO4 将 CrCl3 氧化为棕色的烟 [CrO2(ClO4)2],部分 HClO4 被还原生成 HCl,HCl 也属于强酸,B 正确;该反应的离子方程式为 19ClO-4 +8Cr3+ +4H2O===8CrO2(ClO4)2+3Cl-+8H+,19 mol ClO-4 中有 3 mol ClO-4 作为 氧化剂,被还原为 3 mol Cl-,8 mol Cr3+全部作为还原剂,被氧化为 8 mol CrO2(ClO4)2,故氧化剂与氧化产物的物质的量之比为 3∶8,C、D 错误。
高 专题三 氧化还原反应 离子反应 考
必
胜
考点一 氧化还原反应
二轮专题复习
一、真题重现
1.(2023·高考全国乙卷)下列应用中涉及氧化还原反应的是(
)
A.使用明矾对水进行净化
B.雪天道路上撒盐融雪
√C.暖贴中的铁粉遇空气放热
D.荧光指示牌被照发光
二轮专题复习
√
二轮专题复习
二轮专题复习
√
二轮专题复习
二轮专题复习
√
二轮专题复习
二轮专题复习
二轮专题复习
二轮专题复习
√
二轮专题复习
二轮专题复习
二轮专题复习
考点一 氧化还原反应基础概念(解析版)

【基础知识】氧化还原反应考点一氧化还原反应及相关概念【必备知识】1、本质:电子转移(得失或偏移)。
2、特征:反应前后有元素的化合价发生变化。
3、口诀: 失升氧,氧化还原剂:得降还,还原氧化剂。
4、表达方式①双线桥:①标变价,①画箭头(反应物指向生成物),①算数目,①说变化。
①单线桥:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。
5、与四大基本反应类型的关系①置换反应、有单质参加化合反应、有单质生成的分解反应一定是氧化还原反应。
①复分解反应一定是非氧化还原反应。
例、2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
上述反应中,氧化剂是______,还原剂是________,氧化产物是__________,还原产物是________,KMnO4发生__________反应,HCl发生________反应,盐酸表现的性质是________性和________性;生成1 mol Cl2时转移电子数目为________,被氧化的HCl的物质的量是________ mol。
【答案】KMnO4HCl Cl2MnCl2还原氧化还原酸2×6.02×1023(或1.204×1024)2例、用双线桥法标出MnO2与浓盐酸加热反应的电子转移的方向和数目:【答案】。
例、用双线桥标出反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O中电子转移的方向和数目。
【答案】+8H2O例、用单线桥法标出铜和浓硝酸反应的电子转移的方向和数目:【答案】(浓)===Cu(NO3)2+2NO2↑+2H2O。
例、已知NaBH4与水反应的化学方程式为NaBH4+2H2O===NaBO2+4H2↑,用“单线桥”标出电子转移的方向和数目。
【答案】===NaBO2+4H2↑例、氢化钠(NaH)广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为_________________________________________。
【步步高】高考化学(通用版)二轮:专题3 氧化还原反应考点1基于“双线桥”辨析概念(含解析)

考点一基于“双线桥”辨析概念理清知识线索题组一氧化还原反应相关概念理解1.正误判断,正确的划“√”,错误的划“×”。
(1)Cl2+2Br-===2Cl-+Br2、Zn+Cu2+===Zn2++Cu均为单质被还原的置换反应() (2014·山东理综,7C)(2)2Na2O2+2H2O===4NaOH+O2↑、Cl2+H2O===HCl+HClO均为水作还原剂的氧化还原反应()(2014·山东理综,7D)(3)因为Fe3+具有氧化性,所以用KSCN溶液可以鉴别Fe3+()(2013·广东理综,10B)(4)化合反应均为氧化还原反应()(2012·山东理综,7A)(5)工业上利用合成氨实现人工固氮不涉及氧化还原反应()(2012·广东理综,10C)(6)Na2O2用作呼吸面具的供氧剂不涉及氧化还原反应()(2012·广东理综,10A)2.(2015·黑龙江省哈师大附中高三第一次月考)已知X和Y是两种单质,X+Y―→X2++Y2-,下列叙述正确的是()①X被氧化②X是氧化剂③Y2-是还原产物④X2+具有氧化性⑤Y2-具有还原性⑥Y单质氧化性比X2+氧化性强A.①②③B.①②⑥C.①③④⑤⑥D.①③④⑤题组二基于“双线桥”分析陌生反应3.高铁酸钠(Na2FeO4)对河水、湖水消毒是城市饮水处理的新技术。
已知反应为Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是()A.Na2O2既是氧化剂又是还原剂B.Na2FeO4既是氧化产物又是还原产物C.3 mol Na2O2发生反应,有12 mol电子转移D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌4.(2015·上海,21改编)工业上将Na2CO3和Na2S以1∶2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。
