化学方程式之醛酮
原创——醛、酮化学反应归纳

原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。
有机化学方程式汇总醛和酮的还原反应

有机化学方程式汇总醛和酮的还原反应在有机化学中,醛和酮是两类非常重要的化合物。
它们在许多化学反应中扮演着重要的角色。
其中,还原反应是一类常见的反应类型。
本文将汇总一些常见的有机化学方程式,以展示醛和酮的还原反应。
1. 氢气还原氢气还原是一类常见的还原醛和酮的方法。
通常,常用还原剂如氢气(H2)、铝烷类化合物(如LiAlH4)或氢化合物(如NaBH4)会和醛或酮在适宜的条件下反应,生成相应的醇化合物。
例如,对于醛的氢气还原反应,可以写作:RCHO + H2 → RCH2OH (其中,R为有机基团)对于酮的氢气还原反应,可以写作:RCOR' + H2 → RCH2OR' (其中,R和R'为有机基团)2. 硼酸盐还原硼酸盐还原是一种常用于酮的还原反应的方法。
常见的硼酸盐还原剂是NaBH4(氢化硼酸钠)或LiAlH4(氢化铝烷)。
硼酸盐还原对酮的选择性比较高,较少发生与醛的反应。
例如,对于酮的硼酸盐还原反应,可以写作:RCOR' + NaBH4 → RCH2OH (其中,R和R'为有机基团)3. 其他还原反应除了氢气还原和硼酸盐还原,还有其他一些反应可以还原醛和酮。
例如,选择性邻位还原(Clemmensen反应)、烯醇盐还原(Wolff-Kishner反应)和醛或酮在碱性条件下的水解反应等。
这些反应都需要适宜的条件和特定的试剂。
总结:有机化学中,醛和酮的还原反应是一类重要的反应类型。
利用氢气、硼酸盐或其他还原试剂可以还原醛和酮,生成相应的醇化合物。
这些反应在有机合成和制药等领域具有广泛的应用。
了解有机化学方程式对于学习和理解这些反应的机理和应用非常有帮助。
注意:文章中所提到的化学反应式仅为示例,实际化学反应需要具体的实验条件和试剂选择。
在进行有机化学实验时,应严格遵守实验室的安全规范,并在有经验的人员指导下进行操作。
高中有机化学酮醛方程式总结

高中有机化学酮醛方程式总结
有机化学是高中化学的重要分支,其中酮醛是有机化学中常见
的一类化合物。
在研究有机化学酮醛时,我们需要研究酮醛的化学式、结构、性质以及反应方程式等知识。
本文旨在对高中有机化学
酮醛方程式进行总结和归纳。
酮和醛的化学式和结构
先来了解一下酮和醛的化学式和结构。
酮的通式为R1-CO-R2,其中 R1 和 R2 可以是任意有机基团或氢原子;醛的通式为 R-CHO,其中 R 为一个有机基团或氢原子。
酮和醛都是羰基化合物,都包含羰基 [-C(=O)-] 结构。
酮醛的化学性质
酮和醛在结构上有所不同,因此其化学性质也有所不同。
其中,酮具有惰性较高的性质,不容易被还原剂还原;而醛则是一类比较
活泼的物质,容易发生氧化还原反应。
酮和醛都可以发生缩合反应,形成羟酮、醛缩和异构化等反应。
酮醛的反应方程式总结
氧化还原反应
醛可以被氧化为羧酸:
RCHO+O2→RCOOH
醛可以被还原为醇:
RCHO+2H→RCH2OH
酮不易被还原。
缩合反应
酮和醛可以发生缩合反应,形成羟酮:RCHO+RR'C=O → RCH(OH)CRR'
酮缩反应:
2R'C=O → R'C(=O)-C(-OH)=CR'-R'C(=O)OH
异构化
酮和醛可以发生互变异构反应:
RCH(OH)CRR' ⇋ RR'C(OH)CHR
上述反应方程式仅是高中阶段有机化学酮醛反应的简单总结,实际上酮醛有很多种反应,需要在深入学习有机化学的基础上更好的了解其反应性质。
醛酮的化学性质及应用

醛酮的化学性质及应用醛酮是一类重要的有机化合物,它们的化学性质和应用非常广泛。
下面我将分别介绍醛和酮的化学性质和应用。
醛是含有羰基(C=O)官能团的有机化合物,通式为RCHO。
它们具有以下几个重要的化学性质:1. 氧化还原性:醛能够与氧气或氧化剂反应,发生氧化反应生成相应的酸。
例如,乙醛(CH3CHO)在空气中容易被氧化为醋酸(CH3COOH)。
2. 缩合反应:醛能够与众多化合物发生缩合反应,生成相应的缩合产物。
其中最常见的是与胺类化合物反应生成相应的胺缩合物。
3. 加成反应:醛能够与众多化合物发生加成反应,生成相应的加成产物。
其中最重要的是与氨、水、醇等发生加成反应生成相应的加成产物。
4. 氧化反应:醛在适当条件下可以发生氧化反应生成相应的羧酸。
例如,乙醛可以经过氧化反应生成醋酸。
酮则是含有羰基(C=O)官能团的有机化合物,通式为R2CO。
它们具有以下几个重要的化学性质:1. 氢化还原性:酮与氢气或还原剂反应,发生氢化还原反应生成相应的醇。
例如,丙酮(CH3COCH3)在适当条件下可以被氢气还原为异丙醇(CH3CH(OH)CH3)。
2. 缩合反应:酮也可以与众多化合物发生缩合反应,生成相应的缩合产物。
例如,在肟反应中,酮与氢氧胺可以发生缩合反应生成肟。
3. 亲核加成反应:由于酮分子中的羰基上没有可供亲核试剂进攻的活性氢原子,因此酮分子不容易发生亲核取代反应。
但在碱性条件下,酮的α-碳上的酸性氢可以被碱取代,形成相应的加成产物。
4. 氧化反应:酮在适当条件下可以发生氧化反应生成相应的酮酸。
例如,丙酮可以经过氧化反应生成丙二酸。
醛酮化合物具有广泛的应用领域,以下是其中几个重要的应用:1. 工业化学:醛酮化合物可以作为重要的合成原料,广泛用于合成有机合成试剂、药物、染料、香料等。
例如,乙醛被广泛用于合成乙醇、醋酸、醋酸乙酯等化合物。
2. 生物化学:醛酮化合物在生物化学中具有重要的作用,如醛酮化合物是糖的代谢中间产物,在糖的酵解和糖新生中起着关键作用。
人教版高中化学《醛酮》完整版PPT1

苦杏仁气味
性 状态 气体 14.【解答】解:A.氧化还原反应的实质是电子的转移,故A正确;
【解析】
液体
C. 充电时,阳极附近溶液的酸性减弱
B【. 分物析质质】的状态溶、解焓变性均注明,书写合理,故B正确;易溶于水
—
用途
合成多种有机化合物;福尔马林(甲醛水 制造染料、香料及
溶液)可用于消毒和制作生物标本
在食品工业上都有着广泛的应用
加入新制的Cu(OH)2
产生砖红色沉淀
不反应
检验醛基
。
②与新制的Cu(OH)2反应【实验3-8】
实验操 作
实验现
象 A中溶液出现 蓝色絮状沉淀 ,C中有砖红色沉淀 产生。
化学方 程式
A中:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4。 C中:CH3CHO+2Cu(OH)2+NaOH――△→CH3COONa+Cu2O↓+3H2O 。
总结
1.醛类的两个特征反应及—CHO的检验
特征 反应
银镜反应
与新制的Cu(OH)2 反应
现象
产生光亮的银镜
产生砖红色沉淀
(1)试管内壁必须洁净。
(1)新制的Cu(OH)2要随
(2)银氨溶液随用随配,不可久置。
用随配,不可久置。
注意
(3)水浴加热,不可用酒精灯直接加热。 事项
(2)配制新制的Cu(OH)2
第三章 烃的衍生物 第三节 醛 酮
1.醛的定义与通式
(1)定义:由 烃基(或氢原子) 与 醛基 相连 而构成的化合物,其官能团的结构简式
为
,简写为—CHO 。
(2)通式:饱和一元醛的通式为 CnH2nO 。
(1)结构:分子式为 C2H4O ,结构式为
醛的氧化还原方程式汇总醛类的氧化与还原反应全面梳理

醛的氧化还原方程式汇总醛类的氧化与还原反应全面梳理醛是有机化合物中常见的一类官能团,它们具有氧化还原性质。
本文将对醛的氧化与还原反应进行全面梳理,对相关方程式进行汇总和总结。
一、醛的氧化反应1. 醛的氧化为酮:醛在氧化剂的作用下发生氧化反应,生成相应的酮。
常见的氧化剂有氧气、过氧化氢、氧化性金属离子等。
下面是几个常见的醛氧化为酮的方程式:(1)乙醛氧化为丙酮:CH3CHO + [O] → CH3COCH3(2)丁醛氧化为戊酮:CH3(CH2)2CHO + [O] → CH3(CH2)2COCH32. 醛的氧化生成羧酸:部分醛在氧化反应中能进一步氧化生成相应的羧酸。
常见的氧化剂有高价氧、高价氧化物等。
下面是几个常见的醛氧化生成羧酸的方程式:(1)甲醛氧化为甲酸:HCHO + [O] → HCOOH(2)丙醛氧化为丙酸:CH3CHO + [O] → CH3COOH二、醛的还原反应1. 醛的还原为醇:醛可以通过还原反应生成相应的醇。
常见的还原剂有氢气、水合金属离子、金属碱等。
下面是几个常见的醛还原为醇的方程式:(1)甲醛还原为甲醇:HCHO + H2 → CH3OH(2)乙醛还原为乙醇:CH3CHO + H2 → CH3CH2OH2. 醛的还原生成饱和脂肪酸:醛还可以通过进一步的还原反应生成相应的饱和脂肪酸。
常见的还原剂有金属碱、氢气等。
下面是几个常见的醛还原生成饱和脂肪酸的方程式:(1)丙醛还原为丙酸:CH3CHO + 2[H] → CH3CH2COOH(2)戊醛还原为戊酸:CH3(CH2)3CHO + 4[H] → CH3(CH2)3COOH三、其他醛的氧化还原反应除了醛的一般氧化还原反应外,还存在其他一些特殊的反应。
比如:1. 醛的缩合反应:醛能够与另一个分子发生缩合反应,生成酮类化合物。
一些醛类化合物在酸性条件下与自身或其他醛缩合,形成糖化合物。
例如:(1)葡萄糖生成果糖:C6H12O6 → C6H10O5 + H2O2. 醛的氧化裂解反应:部分醛在特定条件下可发生氧化裂解反应,生成相应的酸和低碳醇。
大学有机化学反应方程式总结醛酮的还原与氧化反应

大学有机化学反应方程式总结醛酮的还原与氧化反应醛酮是一类重要的有机化合物,其在有机合成和药物合成等领域扮演着重要角色。
了解和掌握醛酮的还原与氧化反应是有机化学学习的基础知识之一。
本文将总结大学有机化学中常见的醛酮还原与氧化反应的方程式和反应条件。
一、醛酮的还原反应醛酮的还原反应是指其被还原剂还原为相应的醇。
常见的醛酮还原反应的反应剂有金属氢化物和还原性金属,如氢气(H2)、亚磷酸(H3PO2)、亚硫酸氢钠(NaHSO3)等。
1. 醛的还原反应:醛在还原反应中可以被还原为一级醇。
常见的反应剂有氢气(H2)和催化剂(如铂、钯)。
下面是醛的还原反应方程式示例:RCHO + H2 -> RCH2OH其中,R为有机基团。
2. 酮的还原反应:酮在还原反应中可以被还原为二级醇。
常用的还原剂是亚磷酸(H3PO2)、亚硫酸氢钠(NaHSO3)等。
下面是酮的还原反应方程式示例:RCOR' + 2H3PO2 -> RCH(OH)R' + 2H3PO3其中,R和R'为有机基团。
3. α,β-不饱和醛酮的还原反应:α,β-不饱和醛酮在还原反应中会被还原为相应的醇。
常见的还原剂有亚磷酸(H3PO2)、亚硫酸氢钠(NaHSO3)等。
下面是α,β-不饱和醛酮的还原反应方程式示例:RCOCH=CHR' + H3PO2 -> RCH2CH(OH)R' + H3PO3其中,R和R'为有机基团。
二、醛酮的氧化反应醛酮的氧化反应是指其被氧化剂氧化为相应的羧酸。
常见的醛酮氧化反应的反应剂有氧气(O2)、過氧化氫(H2O2)和过氧化苯甲酰(PhCOOOH)等。
1. 醛的氧化反应:醛在氧化反应中可以被氧化为相应的羧酸。
常见反应剂是氧气(O2)和过氧化氢(H2O2)。
下面是醛的氧化反应方程式示例:RCHO + O2 -> RCOOH其中,R为有机基团。
2. 酮的氧化反应:酮在氧化反应中可以被氧化为相应的羧酸。
酮醛的氧化还原反应方程式总结

酮醛的氧化还原反应方程式总结在有机化学中,酮和醛是两种非常常见的官能团。
它们可以通过氧化还原反应进行转化,产生各种有机化合物。
在本文中,我们将总结酮醛的氧化还原反应方程式,介绍它们的反应条件和产物。
一、酮的氧化反应酮可以被氧化为羧酸。
常见的酮氧化剂有酸性高锰酸钾(KMnO4)、酸性过氧化铬(CrO5)等。
下面是一些典型的酮氧化反应方程式:1. 丙酮氧化反应:CH3COCH3 + [O] → CH3COOH2. 异戊酮氧化反应:CH3CH2COCH3 + [O] → CH3CH2COOH需要注意的是,酮氧化反应通常需要在酸性条件下进行。
二、酮的还原反应酮可以被还原为相应的醇。
常见的还原剂有金属氢化物(如氢化铝锂,LiAlH4)等。
下面是一些典型的酮还原反应方程式:1. 丙酮还原反应:CH3COCH3 + 2H2 → CH3CH2CH2OH2. 戊酮还原反应:CH3CH2COCH2CH3 + 2H2 → CH3CH2CH2CH2CH3OH需要注意的是,酮还原反应通常需要在干燥的非水溶剂中进行。
三、醛的氧化反应醛可以被氧化为相应的羧酸。
常见的氧化剂有酸性高锰酸钾(KMnO4)、酸性过氧化铬(CrO5)等。
下面是一些典型的醛氧化反应方程式:1. 甲醛氧化反应:HCHO + [O] → HCOOH2. 丁醛氧化反应:CH3CH2CH2CHO + [O] → CH3CH2CH2COOH四、醛的还原反应醛可以被还原为相应的醇。
常见的还原剂有金属氢化物(如氢化铝锂,LiAlH4)等。
下面是一些典型的醛还原反应方程式:1. 甲醛还原反应:HCHO + 2H2 → CH3CH2OH2. 乙醛还原反应:CH3CHO + 2H2 → CH3CH2CH2OH需要注意的是,醛还原反应通常需要在干燥的非水溶剂中进行。
总结:酮和醛的氧化还原反应能够产生各种有机化合物。
在氧化条件下,酮可以转化为羧酸,而醛也可以转化为羧酸。
而在还原条件下,酮可以转化为相应的醇,醛也可以转化为相应的醇。
醛和酮的氧化还原反应方程式总结

醛和酮的氧化还原反应方程式总结在有机化学领域中,醛和酮是常见的有机化合物。
它们在化学反应中经常参与氧化还原反应。
在本文中,我将总结醛和酮的氧化还原反应方程式,并探讨这些反应对有机合成的重要性。
一、醛的氧化反应醛是含有羰基(C=O)官能团的化合物,通过氧化反应可将羰基上的氢原子氧化为羰基上的氧。
以下是一些常见的醛的氧化反应方程式:1. 向硄酸的氧化反应:醛+ [O] → 酸 + H2O其中,[O]表示氧化剂,如氧气(O2)或氧化性化合物。
2. 碳酸的氧化反应:醛+ [O] → 碳酸 + H2O这种反应通常由氧化性氧化剂催化,如过氧化氢(H2O2)或高锰酸钾(KMnO4)。
二、酮的氧化反应酮是含有两个有机基团通过碳原子连接的化合物,其氧化反应相对于醛来说比较困难。
以下是酮的氧化反应方程式的示例:1. 向羧酸的氧化反应:酮+ [O] → 羧酸 + H2O这种反应通常需要较强的氧化剂,如酸性高碘酸铵(NH4IO4)或高碘酸钾(KIO4)。
三、醛和酮的还原反应相对于氧化反应,醛和酮的还原反应则是将羰基上的氧还原为氢。
以下是一些常见的醛和酮的还原反应方程式:1. 醛的还原反应:醛+ 2H → 醇在还原反应中,氢气(H2)是常见的还原剂。
2. 酮的还原反应:酮+ 2H → 醇与醛的还原反应类似,酮的还原反应也需要氢气作为还原剂。
四、醛和酮的氧化还原反应机制醛和酮的氧化还原反应涉及一个重要的步骤,即羰基上的氢迁移。
在这一过程中,氧化剂接受羰基上的氢原子,产生醇或羧酸,同时还原剂提供氢原子,将羰基上的氧还原为氢。
这种氧化还原反应机制在有机化学的涉及到许多重要的合成反应,如制备醇、醛和酮的方法。
综上所述,醛和酮作为常见的有机化合物,在氧化还原反应中表现出一系列重要的反应。
醛可通过氧化反应形成酸或碳酸,而酮则通过氧化反应形成羧酸。
相反地,醛和酮也可以通过还原反应将羰基上的氧还原为氢,生成相应的醇。
理解和掌握醛和酮的氧化还原反应方程式及其机制对于有机化学的研究和应用具有重要意义。
醛和酮相关的化学反应

醛和酮相关的化学反应醛和酮相关的化学反应是一个有趣而又复杂的话题。
它涉及到一系列与醛和酮相关的有机化学反应,它们在生物体和工业制造过程中都扮演着重要的角色。
本文旨在介绍醛和酮的基本特性,以及它们之间的一些相关化学反应。
醛和酮是有机化学中的重要类别,它们具有一定的共性。
醛是一类有机化合物,它们拥有一个或两个酰基,底物有C=O,通常有气味。
它们可以是由脂肪酸和醇衍生出来的醛类,也可以是脂类的消化产物,如乳酸醛。
酮是有机化合物的一类,以C=O与-OH结尾,通常有酯、醇、羧酸等多种形式,它们一般有液体或固体的形态,可用于合成产物的制造过程。
醛和酮之间的重要化学反应有很多,它们具有重要的经济价值。
醛变酮反应是最常见的一种反应,它利用了酶(通常为酒石酸酶或乙醇酸酶)来将醛转化为酮。
此外,还有其他几种反应,如三磷酸根取代反应、醇氧化反应、醛氧化反应等,它们有助于合成有用的化合物。
除了上述反应外,醛和酮还有其他复杂的反应模式。
在有机合成中,醛类化合物可以经由酯化、羧化、醇化、偶联等反应而变化。
另一方面,酮也可以和醛类化合物发生反应,如加成反应、醚化反应等。
与此同时,醛和酮也可以经由氧化反应而产生不同的结果,如氧化醇变成醛,或者氧化酮变成醛,而氧化醛则可以变成酮或者其他类似的化合物。
醛和酮是生物体和工业制造过程中的重要成分。
它们在生物体中的作用大都是用于代谢的过程,有助于提供能量或代谢产物,此外,它们还可以用于制造药物、染料、农药等。
在工业制造过程中,醛和酮也有着重要的用处,如润滑剂、燃料添加剂、染料等,它们的化学特性是这些产品的关键因素。
从上述分析可以看出,醛和酮是有机化学中的重要类别,它们之间的化学反应具有重要的经济价值和实用价值,因而有必要综合这些反应模式以及它们的化学特性,以便更深入地了解有机化学的来龙去脉。
综上所述,醛和酮是有机化学中重要的一部分,它们之间有着丰富而复杂的反应模式,既有经济价值,也有实用价值。
大学有机化学反应方程式总结醛与酮的还原与氧化反应

大学有机化学反应方程式总结醛与酮的还原与氧化反应在有机化学领域中,醛与酮是常见的有机化合物。
它们的化学性质非常重要,尤其是它们的还原与氧化反应。
本文将对醛与酮的还原与氧化反应进行总结,并给出相关的反应方程式。
一、醛的还原反应1. 醛的还原为醇:醛可以通过还原反应转化为相应的醇。
常用的还原剂有金属氢化物(如锂铝氢化物,LiAlH4)和氢气。
反应方程式:醛 + 2H2 -> 醇举例:甲醛 + 2H2 -> 甲醇2. 醛的催化还原为醇:除了金属氢化物和氢气,醛还可以通过催化剂的作用发生还原反应。
常用的催化剂有铂、钯等。
反应方程式:醛 + 2H2 -> 醇举例:醛 + 2H2 (催化剂Pt) -> 醇二、酮的还原反应1. 酮的还原为二醇:酮可以通过还原反应转化为相应的二醇。
常用的还原剂有金属氢化物(如锂铝氢化物,LiAlH4)和氢气。
反应方程式:酮 + 2H2 -> 二醇举例:丙酮 + 2H2 -> 2-丙醇2. 酮的催化还原为醇:除了金属氢化物和氢气,酮还可以通过催化剂的作用发生还原反应。
常用的催化剂有铂、钯等。
反应方程式:酮 + 2H2 -> 二醇举例:酮 + 2H2 (催化剂Pt) -> 二醇三、醛的氧化反应1. 醛的氧化为羧酸:醛可以通过氧化反应转化为相应的羧酸。
常用的氧化剂有酸性高锰酸钾(KMnO4)和过氧化氢(H2O2)等。
反应方程式:醛 + [O] -> 羧酸举例:乙醛 + [O] -> 醋酸2. 醛的催化氧化为酸酐:除了常规的氧化剂,醛还可以通过催化剂的作用发生氧化反应,形成相应的酸酐。
常用的催化剂有银剂。
反应方程式:醛 + O2 -> 酸酐举例:甲醛 + O2 (催化剂Ag) -> 甲酸酐四、酮的氧化反应1. 酮的氧化为酮酸:酮可以通过氧化反应转化为相应的酮酸。
常用的氧化剂有酸性高锰酸钾(KMnO4)和过氧化氢(H2O2)等。
第10章 醛和酮
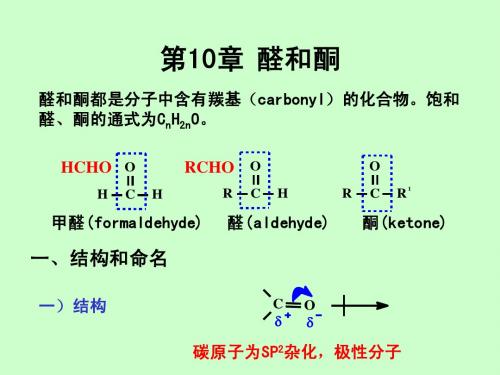
o
[(CH3)3C]3COH
81% 醛、酮还可与炔化钠加成
O CH 3 CCH 3 + NaC C H
+
CH 3 CH 3 C OH C C
(3)与魏悌希(Witting)试剂加成 与魏悌希(Witting)试剂加成 (Witting) 魏悌希试剂( 魏悌希试剂(磷叶立德
R1 C O H
R
1
R1 R C OH H
R1 C O R C OH R2 叔醇
仲醇
R2
醛、大多数酮都有此反应。烃基较大的酮,产量降低或不 大多数酮都有此反应。烃基较大的酮, O 能反应。 不与格氏试剂反应。 能反应。如: 不与格氏试剂反应。 (CH3)3CCC(CH3)3 但二叔丁基甲酮可以与有机锂试剂反应 二叔丁基甲酮可以与有机锂试剂反应
OH C SO3Na
O C
H O S O
O-Na+ C
O-Na+ SO3H
*** 醛、脂肪族甲基酮、≤C8的环酮可以发生这个反应,其 脂肪族甲基酮、 的环酮可以发生这个反应, 它的酮包括芳香族甲基酮不发生反应。 它的酮包括芳香族甲基酮不发生反应。
该反应受空间位阻影响较大, 该反应受空间位阻影响较大,如:在反应一个小时的情况 产率:丙酮56.2 %,丁酮36.4 %, 戊酮2 下,产率:丙酮56.2 %,丁酮36.4 %, 3-戊酮2 % 苯基的影响也较大,与芳香酮几乎不反映, 苯基的影响也较大,与芳香酮几乎不反映,如:苯乙酮1% 苯乙酮1% 加成产物a 羟基磺酸钠与氰化钠作用生成a 羟腈。 *** 加成产物a-羟基磺酸钠与氰化钠作用生成a-羟腈。 这样可避免直接使用剧毒的HCN HCN。 这样可避免直接使用剧毒的HCN。
有机化学方程式汇总醛和酮的酸催化加成反应

有机化学方程式汇总醛和酮的酸催化加成反应在有机化学中,醛和酮是两种常见的官能团。
它们参与了许多重要的反应,其中一种是酸催化加成反应。
本文将介绍醛和酮的酸催化加成反应,并对常见的方程式进行汇总。
醛和酮的酸催化加成反应是一种通过酸催化来使醛和酮与其他化学物质发生加成反应的方法。
这种反应通常在强酸的催化下进行,可以使用多种强酸,包括硫酸、氢氯酸和甲酸等。
下面是几个常见的酸催化加成反应方程式:1. 醇的加成反应:醛或酮可以与醇反应,生成缩醛或缩酮。
方程式如下:RCHO + ROH → RCH(OR)OH2. 胺的加成反应:醛或酮可以与胺反应,生成胺加成产物。
方程式如下:RCHO + NH3 → RCH=NH23. 腈的加成反应:醛或酮可以与腈反应,生成氯腈或酮腈。
方程式如下:RCHO + HCN → RCH(CN)OH4. 胺的缩合反应:醛或酮可以与胺反应,生成胺缩合产物。
方程式如下:RCHO + NH2-R' → RCH=NR'5. 第二次加成反应:醛或酮可以先与一种化合物反应生成中间产物,再与另一种化合物进行第二次加成反应。
方程式如下:RCHO + X → R CH(X)OHRCH(X)OH + Y → RCH(X)Y以上只是醛和酮的酸催化加成反应中的一部分方程式,还有许多其他反应也可以通过酸催化实现。
在实际应用中,根据具体的实验条件和需求,可以选择不同的酸催化剂和反应条件。
需要注意的是,酸催化加成反应通常需要在适当的溶剂中进行,常用的溶剂包括二甲基亚砜(DMSO)、氯仿和醇等。
此外,反应温度和反应时间也是影响反应结果的重要因素,需要根据实验要求进行优化。
总结起来,醛和酮的酸催化加成反应是有机化学中常见的反应类型之一。
通过酸催化,醛和酮可以与其他化合物进行加成反应,生成各种有机产物。
在实际应用中,需要根据具体要求选择合适的酸催化剂、反应条件和溶剂,以获得理想的反应产物。
参考文献:1. Clayden J, Greeves N, Warren S. Organic chemistry. 2nd ed. Oxford: Oxford University Press; 2012.2. Mohrig JR, Hammond CN, Schatz PF. Techniques in organic chemistry. 4th ed. New York: W.H. Freeman and Company; 2017.。
大学有机化学反应方程式总结醛和酮的还原和氧化反应

大学有机化学反应方程式总结醛和酮的还原和氧化反应在大学有机化学中,醛和酮是两类重要的官能团,它们在许多有机合成和反应中起着至关重要的作用。
了解醛和酮的还原和氧化反应对于掌握有机化学的基本知识和实践技巧具有重要意义。
本文将对醛和酮的还原和氧化反应方程式进行总结,以帮助理解和记忆这些反应。
一、醛和酮的还原反应方程式还原反应是指分子中某个原子的氧化态数减小,而另一些原子的氧化态数增加的化学反应。
醛和酮可以通过多种还原试剂被还原为相应的醇。
下面是几种常用的醛和酮的还原反应方程式:1. 锂铝氢化物(LiAlH4)还原醛和酮可以通过与锂铝氢化物(LiAlH4)反应被还原为相应的醇。
例如,丙酮(ketone)可以被锂铝氢化物(LiAlH4)还原为丙醇(alcohol):CH3COCH3 + LiAlH4 → CH3CH2CH2OH同样地,乙醛(aldehyde)可以被锂铝氢化物(LiAlH4)还原为乙醇(ethanol):CH3CHO + LiAlH4 → CH3CH2OH2. 氢气和催化剂的还原醛和酮也可以通过在氢气和催化剂的存在下被还原为相应的醇。
例如,乙酮(ketone)可以通过在氢气和铂催化剂的存在下还原为乙醇(alcohol):CH3COCH3 + H2 (催化剂) → CH3CH2OH二、醛和酮的氧化反应方程式氧化反应是指分子中某个原子的氧化态数增加,而另一些原子的氧化态数减小的化学反应。
醛和酮可以通过多种氧化试剂被氧化为相应的羧酸或者羰基酸。
下面是几种常用的醛和酮的氧化反应方程式:1. 高锰酸钾(KMnO4)氧化醛和酮可以通过与高锰酸钾(KMnO4)反应被氧化为相应的羧酸。
例如,乙醛(aldehyde)可以被高锰酸钾(KMnO4)氧化为乙酸(carboxylic acid):CH3CHO + KMnO4 → CH3COOH2. 酸性高锰酸钾(H+ / KMnO4)氧化醛和酮也可以通过与酸性高锰酸钾(H+ / KMnO4)反应被氧化为相应的羧酸。
大学有机化学反应方程式总结醛和酮的加成反应

大学有机化学反应方程式总结醛和酮的加成反应醛和酮是有机化合物中常见的官能团,其加成反应在有机合成中具有重要的地位。
本文将对醛和酮的加成反应进行总结,包括反应方程式和反应机理的介绍,以便于读者更好地理解和掌握这些反应。
一、醛的加成反应1. 醛的加成反应概述醛分子中的羰基碳上带有一个氧原子和一个氢原子,因此醛具有较强的亲电性。
醛的加成反应是指醛分子中的羰基碳与亲核试剂发生反应,生成加成产物。
常见的醛的加成反应有醛的加成氢化反应、醛的加成生成醇反应等。
2. 醛的加成氢化反应醛的加成氢化反应是一种重要的醛的还原反应,常用还原剂有氢气(H2)、铝酸铵(NH4AlH4)等。
具体反应方程式如下:醛+ H2 → 醇例如,乙醛(CH3CHO)与氢气反应生成乙醇(CH3CH2OH)。
3. 醛的加成生成醇反应醛的加成生成醇反应是醛与亲核试剂(如水、醇等)反应生成醇的反应。
具体反应方程式如下:醛+ H2O → 醇例如,甲醛(HCHO)与水反应生成甲醇(CH3OH)。
二、酮的加成反应1. 酮的加成反应概述酮分子中的羰基碳上带有两个碳原子,因此酮的亲电性较弱。
酮的加成反应是指酮分子中的羰基碳与亲核试剂发生反应,生成加成产物。
常见的酮的加成反应有酮的加成生成醇反应、酮的加成生成伯胺反应等。
2. 酮的加成生成醇反应酮的加成生成醇反应是酮与亲核试剂(如水、醇等)反应生成醇的反应。
具体反应方程式如下:酮+ H2O → 醇例如,丙酮(CH3COCH3)与水反应生成丙醇(CH3CH2OH)。
3. 酮的加成生成伯胺反应酮的加成生成伯胺反应是酮与含有活化氢的亲核试剂(如胺)反应生成伯胺的反应。
具体反应方程式如下:酮 + R-NH2 → 伯胺其中,R为有机基团。
例如,丙酮与甲胺反应生成丙基胺。
总结:醛和酮作为有机化合物中重要的官能团,在有机合成中经常参与加成反应。
醛的加成反应包括醛的加成氢化反应和醛的加成生成醇反应;酮的加成反应包括酮的加成生成醇反应和酮的加成生成伯胺反应。
醛酮的化学反应及检验
若有黃綠色沉澱,此化合物具有甲基酮官能基; 若無黃綠色沉澱,再加熱 15 分鐘,若仍無黃綠色沉澱則表示此化合 物具有無甲基酮官能基。
Iodoform Samples Structures
O H3C C
Silver mirror +
2,4-DNP test
Ethanal Acetone Benzaldehyde
乙醇
CH3CH2OH
Acetone
無色微香液體,易著火,比重 0.788 ,沸點 56.5 ℃。與水、乙醇、乙醚、氯仿、DMF、油類 互溶。蒸氣能與空氣形成爆炸性混合物,化 學性質活潑,廣泛用作工業溶劑。
丙酮
CH3COCH3 Benzaldehyde
無色油狀液體,有杏仁香味,密度 1.046,沸 點 179℃。稍溶於水,能與乙醇、乙醚或氯仿
_ _ OH ,I2,OH,I2
_ ቤተ መጻሕፍቲ ባይዱ C CI3 + OH
CHI3(碘仿,黃色固體)
三、實驗原理:
1、醛的通式
O R C H
酮的通式
O R C R1
1具有極性的羰基
2醛較酮易進行碳氧雙鍵的親核性加成反應(立體障礙及電子因素) 3沸點較相似分子量的碳氫化合物高(可與水產生氫鍵) ,但較相似 分子量的醇低(不能形成分子間氫鍵) 。 2、醛的製備: 11。醇的氧化(PCC:CrO3.Pyr.HCl;將醇類氧化成醛類最常用的試 劑)
O2N R R' C O O2N R NO2 R' C N N H NO2
+ H2N N
H
2、碘仿反應
O R C O R C CI3 CH3 O I2 R O C CH2I OHI2 OHI2
+ OH
有机化学-醛和酮

O R CH2 C CH CHO
HR
O
H2O
R CH2 C CH CHO
HR
OH
R CH2
C
α
CH CHO
+ OH-
HR (-羟基醛)
Problem: 完成下列反应式:
稀碱
H3C CH2 CH2 CHO 4~5oC
OH O H3C CH2 CH2 CH CH C H
H2C CH2CH3
干燥HCl
R C H+ R’- OH
R C H + H2O
OR'
OR' 缩醛
例:
O
HCl
C H + 2 CH3CH2OH
CH OCH2CH3 OCH2CH3
苯甲醛缩 二乙醇
◆ 酮不易生成缩酮,但环状缩酮较易生成。
R
C=O + CH2OH 干燥HCl
R
O C
CH2
R
CH2OH
R O CH2
应用: 缩醛和缩酮对碱、氧化剂稳定,常用 于有机合成中保护醛(酮)基。缩醛(酮) 在酸性条件下水解回原来的醛(酮)和醇。
沉淀。
通常
R
为橙黄色
C NNH
NO2
的沉淀
R' NO2
(二) - 碳和 -氢的反应
-H,有弱酸性
HO
R-CH2-CH-C-H βα
p- 共轭,使碳 负离子稳定
R-CH2-CHO
NaOH
O R CH- C H
碳负离子
1. 醇醛缩合
在稀碱溶液中, 含α-H的醛的α-碳可以与另一 醛的羰基碳加成形成新的碳碳键,生成β-羟基醛 类化合物,该反应称为醇醛缩合。
化学反应中的醛酮反应

化学反应中的醛酮反应醛酮反应是一类重要的有机化学反应,指的是醛与酮之间进行氧化还原反应,生成相应的醇和酸酐的过程。
该反应在有机合成、医药化学等领域具有广泛的应用。
本文将介绍醛酮反应的机理、分类以及其在实际应用中的一些例子。
一、醛酮反应的机理醛酮反应通常是通过氧化还原的方式进行,其中醛或酮被氧化为酸酐或醇。
该反应是在酸性或碱性条件下进行的。
在酸性条件下,醛酮反应首先发生质子化,形成醇醛离子或酮离子。
接着,醇醛离子或酮离子会接受电子,生成相应的酸酐或醇产物。
在碱性条件下,醛酮反应开始于亲核试剂的加成。
亲核试剂攻击醛或酮中的部分正电荷,形成一个中间体。
然后,中间体经历质子化或负离子迁移等步骤,最终生成酸酐或醇产物。
二、醛酮反应的分类根据反应条件和产物类型的不同,醛酮反应可以分为多种类型,如氧化、还原、氧气插入和杂原子插入等。
下面将介绍其中的几种典型反应。
1. 氧化反应氧化反应是指醛或酮被氧化为酸酐的反应。
常见的氧化剂有氧气、过氧化氢、高锰酸钾等。
例如,乙醛可以通过氧气氧化为乙酸的反应:CH3CHO + O2 -> CH3COOH2. 还原反应还原反应是指醛或酮被还原为醇的反应。
典型的还原剂有金属钠、锂铝烷等。
例如,丙酮可以通过锂铝烷还原为异丙醇的反应:(CH3)2CO + LiAlH4 -> (CH3)2CHOH3. 氧气插入反应氧气插入反应是指氧气直接参与醛酮反应,生成酸酐的反应。
例如,甲醛可以通过氧气插入反应生成甲酸的反应:CH3CHO + 1/2 O2 -> CH3COOH4. 杂原子插入反应杂原子插入反应是指醛酮反应中,醛或酮分子中的氧原子被其他原子或基团所取代的反应。
例如,乙醛可以经过羟胺的插入反应生成乙酰肼:CH3CHO + H2NNH2 -> CH3C(NHNH2)O三、醛酮反应的应用举例醛酮反应在有机合成和医药化学中具有广泛的应用。
下面介绍两个具有代表性的例子。
化学方程式之醛酮

化学⽅程式之醛酮P379 习题11.1 命名下列化合物:(1) HOCH 2CH 2CHO (2)CH 3CHBrCOCHBrCH 33-羟基丙醛2,4-⼆溴-3-戊酮(3) CH 3COCH=CHCOCH 3(4) OCH 33-⼰烯-2,5-⼆酮4-甲基环⼰酮(5) CHOBr(6) C CH 3CH 3O4-溴苯甲醛对甲氧基苯⼄酮(7)CHOC CH 3O(8)CHOHOOCH 34-⼄酰基苯甲醛 4-羟基-3-甲氧基苯甲醛 (9) C O 环⼰基苯基甲酮习题11.2 写出下列化合物的构造式:(1) 甲基异丁基酮 (2)丁⼆醛CH 32CH(CH 3)2OCH 2CH 2H HO O(3) 三甲基⼄醛(4)β-环⼰⼆酮(CH 3)3CCHOOO(5) β-羟基丁醛 (6)对羟基苯丙酮CH 3CHCH 2CHOOHHOC CH 2CH 3OP336 习题11.3 选择合适的原料及条件合成下列羰基化合物:(1) 2-⼰酮解:CH 3(CH 2)3OH CH 3CH 2CH 2CH 2MgBr Mgdry etherCH 3(CH 2)3Br3dry etherH O +CH 3CH 2CH 2CH 23OMgBrCH 3CH 2CH 2CH 23OHCH 3CH 2CH 2CH 23OK Cr O H 2SO 4或者:HCCNa + BrCH 2CH 2CH 2CH 3HCC CH 2CH 2CH 2CH 3CH 32CH 2CH 2CH 3O H O244(2) 丁醛解:CH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO [(CH )CHO]Al , (CH )C=O 66或者:CH 3CH 2CH 2CH 2OHCH 3CH 2CH 2CHO CrO Pyridine (3)O解:OH BrOHH OO OH[(CH )CHO]Al , (CH )C=O66或者:OOBrONaOH/ C 2H 5OH23(4)CHO ClCl 解:CH 3CH 3SO 3H CH 3ClClCH 33HClCl242Fe , ?H 2O/H +180 CoCHOCl ClCrO + (CH CO)O (5)O 2NO 2NO解:COOHO 2NO 2N23H 2SO 44COOHCH 3O 2NO 2NO O 2NO2NO Cl3(6)2CH 2COOH O 解:C CO O+32CH 2COOH O (7) CH 3O CHOor : (CH 3)2CO 3CH 3INaOHCH 3OCHO CO + HCl AlCl 3-Cu 2Cl 2习题11.4 完成下列转变:(1) 间⼆甲苯→CHOCH 3解:CHOCH 3CH 3CH 32(1) CrO Cl(2)COClCH 3CH 3CH 3CHOCH 3CH 3CH 3解:COClCH 33CH 3CHOCH 3CH 3CH 32Pd/BaSO 4CH 33CH 3CHOCH 3CH 3CH 3(1) LiAl(OBu-t)H , Et O, -78 C(2) H 2O/H +P398 习题11.5 完成下列反应式:(1)2C 2H 5OH + OOC 2H 5OC 2H 5不反应(2)O N 2OH 2NNH NH 2O+(3) HOCH 2CH 2CH 2CH2CHO OOH(4)CHO NO 2NO 2H 2NNH+CHNO 2NO 2NNH(5)MgBr + CH 3CHO (1) ether (2) H 2O 3OH(6)饱和CHOOHCHOHSO 3NaOHNaHSO (7) CHOCHO+Ph 3P=CH Ph 3P=CH(8)CH=PPh 3O+CH习题11.6 给下列反应⼀个可能的机理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
P379 习题11.1 命名下列化合物:(1) HOCH 2CH 2CHO (2)CH 3CHBrCOCHBrCH 33-羟基丙醛2,4-二溴-3-戊酮(3) CH 3COCH=CHCOCH 3(4) OCH 33-己烯-2,5-二酮4-甲基环己酮(5) CHOBr(6) C CH 3CH 3O4-溴苯甲醛对甲氧基苯乙酮(7)CHOC CH 3O(8)CHOHOOCH 34-乙酰基苯甲醛 4-羟基-3-甲氧基苯甲醛 (9) C O环己基苯基甲酮习题11.2 写出下列化合物的构造式:(1) 甲基异丁基酮 (2)丁二醛CH 32CH(CH 3)2OCH 2CH 2H HO O(3) 三甲基乙醛(4)β-环己二酮(CH 3)3CCHOOO(5) β-羟基丁醛 (6)对羟基苯丙酮CH 3CHCH 2CHOOHHOC CH 2CH 3OP336 习题11.3 选择合适的原料及条件合成下列羰基化合物:(1) 2-己酮解:CH 3(CH 2)3OH CH 3CH 2CH 2CH 2MgBr Mgdry etherCH 3(CH 2)3Br3dry etherH O +CH 3CH 2CH 2CH 23OMgBrCH 3CH 2CH 2CH 23OHCH 3CH 2CH 2CH 23OK Cr O H 2SO 4或者:HCCNa + BrCH 2CH 2CH 2CH 3HCC CH 2CH 2CH 2CH 3CH 32CH 2CH 2CH 3O H O244(2) 丁醛解:CH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO [(CH )CHO]Al , (CH )C=O66或者:CH 3CH 2CH 2CH 2OHCH 3CH 2CH 2CHO CrO Pyridine(3)O解:OH BrOHH O∆O OH[(CH )CHO]Al , (CH )C=O66或者:OOBrONaOH/ C 2H 5OH23(4)CHO ClCl 解:CH 3CH 3SO 3H CH 3ClClCH 33HClCl242Fe , ∆H 2O/H +180 CoCHOCl ClCrO + (CH CO)O(5)O 2NO 2NO解:COOHO 2NO 2N23H 2SO 44COOHCH 3O 2NO 2NO O 2NO2NO Cl3(6)2CH 2COOH O解:C CO O+32CH 2COOH O(7) CH 3OCHO解:HOCH 3Oor : (CH 3)2CO 3CH 3INaOHCH 3OCHO CO + HCl AlCl 3-Cu 2Cl 2习题11.4 完成下列转变:(1) 间二甲苯 →CHOCH 3解:CHOCH 3CH 3CH 32(1) CrO Cl(2)COClCH 3CH 3CH 3CHOCH 3CH 3CH 3解:COClCH 33CH 3CHOCH 3CH 3CH 32Pd/BaSO 4或者:COClCH 33CH 3CHOCH 3CH 3CH 3(1) LiAl(OBu-t)H , Et O, -78 C(2) H 2O/H +P398 习题11.5 完成下列反应式:(1)2C 2H 5OH + OOC 2H 5OC 2H 5?不反应?(2)O N 2OH 2NNH NH 2O+(3) HOCH 2CH 2CH 2CH2CHO OOH(4)CHO NO 2NO 2H 2NNH+CHNO 2NO 2NNH(5)MgBr + CH 3CHO(1) ether (2) H 2O3OH(6)饱和CHOOHCHOHSO 3NaOHNaHSO (7)CHOCHO+Ph 3P=CH Ph 3P=CH(8)CH=PPh 3O+CH习题11.6 给下列反应一个可能的机理。
HCCH=CHCH OO+ 2CH 3OH H +OOCH 3CH 3O解:HCCH=CHCHO OO OH3H +HCCH=CHCHOO OHH CH 3HCCH=CHCHOOCH 3OH 2- H OHCCH=CHCH OCH 3OOCH 3H3OOCH 3CH 3OH+OOCH 3CH 3O习题11.7 完成下列转变:(1) CH 3COCH 3 + CHCHCH 2=C CH=CH 2CH 3解:CH CH CH CMgI+ CH 3MgI C CH C CH 3CH 3OMgI CH COCH C CH C CH 33OH C CH C CH 23CHCH 2C CH 2CH 32+24∆2lindlar或者:CH CH CCH C CH 3CH 3ONaCH COCH + Na液NH CH CNaH OC C 3CH 3OH H 2CH CH 2C CH 3CH 3OH CH CH 2C CH 23H PO 或H 2SO 4∆(2)OOCOCH 3解:N H +2NOOCOCH 33NCOCH 32(3)OOCH 2CH 2CN解:N H +2NONCH 2CH 2CNCH =CH CN2OCH 2CH 2CNP404 习题11.8 指出下列化合物中,哪个可以进行自身的羟醛缩合。
(1)CHO (2) HCHO(3) (CH 3CH 2)2CHCHO (4) (CH 3)3CCHO 解:(3)可以进行自身羟醛缩合。
习题11.9 指出下列化合物中,哪个能发生碘仿反应。
(1) ICH 2CHO (2) CH 3CH 2CHO (3)CH 3CH 2CHCH 3(4)COCH 3解:(1)、(3)、(4) 能发生碘仿反应。
习题11.10 完成下列反应式:(1) CH 3CH 2CHOCH 3CH2CH=C CHOCH 3dil OH -∆(羟醛缩合)(2) dil OH -∆OHCCH 2CH 2CH 2CH 2CHOCHO(分子内羟醛缩合)(3)+ HCHO +COCH 3NH+COCH 2CH 2N(Mannich reaction)(4)CHO CH3OCH OCH 3H 2O ,∆+ (羟醛缩合)(5)CHO OHC+ 2(CH 3CO)2O3∆CH=CHCOONaNaOOCCH=CH(Perkin reaction)P409 习题11.11 下列化合物哪些能进行银镜反应?(1) CH 3COCH 2CH 3 (2) CHO(3) CH 3CHCHO 3(4) OOH H(5)O 3H(6)CHO解:(2)、(3)、(4)、(6)能发生银镜反应。
习题11.12 完成下列反应式:(1) CH 3CH=CHCH 2CH 2CHO2∆CH 3CH 2CH 2CH 2CH 2CH 2OH (C=C 比C=O 更容易被还原,如果只和1mol H 2反应,双键首先被还原)(2) CH 3CH=CHCH 2CH 2CHO4CH 3CH=CHCH 2CH 2CH 2OH(NaBH 4、LiAlH 4等只还原羰基,不还原双键)(3) 2CH 3CH=CHCH 2CH 2CHOCH 3CH 2CH 2CH 2CH 2CH 2OH(Pd 催化活性很强)(只和1mol H 2反应时,双键首先被还原;氢过量时可将双键和羰基同时还原)(4) 32CH 3CH=CHCH 2CH 2CHOCH 3CH=CHCH 2CH 2COOH(银氨溶液不氧化双键) (5) 4CH 3CH=CHCH 2CH 2CHOCH 3COOH + HOOCCH 2CH 2COOH 浓 ,热(浓的KMnO 4热溶液氧化双键)(6) COCH 2CH 2COOH CH2CH 2CH 2COOH(Clemmensen还原) (7)乙二醇 ,∆OH NNH H O , KOH(Wolf-Kishner-黄鸣龙还原)(8)CHO + HCHO浓 NaOHCH 2OH + HCOONa(Cannizzsro reaction , 岐化反应)P412 习题11.13 完成下列反应式:(1) OBr+ HBrδ-δ+δ-δ+O(亲电加成。
1,4-加成的机理,1,2-加成的产物)(2)O(1) CH 3MgI 3HOCH3(强碱性亲核试剂进攻羰基。
格氏试剂的碱性很强,遇活泼氢分解!)(3)O+O(双烯合成反应。
亲双烯体上有吸电子基取代时,更有利。
) (4)O4OH(NaBH 4、LiAlH 4等只还原羰基,不还原双键。
因为AlH 4-的碱性很强,只进攻羰基。
)(5) NaCN HOAcOPhCHCH 2CNO(弱碱性亲核试剂进攻双键。
CN -的碱性与亲核性相比,亲核性更突出。
)(6)CH 3OCH 32CHPhON(弱碱性亲核试剂进攻双键。
六氢吡啶的碱性与亲核性相比,亲核性更突出。
)(7)CH=C Pr CHOCH 3i 2Pd-CCH 2CH PriCHOCH 3(C=C 双键比C=O 双键更容易催化加氢!)P415 习题11.14 命名下列下列化合物:(1)O Cl(2)O OFFFOH2-氯对苯醌 2-羟基-3,5,6-三氯对苯醌(3) O OClCl(4)O O1,5-二氯-9,10-蒽醌4,4’-联苯醌。
