共轭效应
共轭效应介绍.

2、P-π共轭
如氯乙烯,当氯原子的p轨道的对称轴与
键中的p轨道对称轴平行时,电子发生离域。
3、超共轭(σ-π共轭)
超共轭效应是由一个烷基的C-
H键的σ键电子与相邻的半满 或全空的p轨道互相重叠而产 生的一种共轭现象。
效应(推电子),但两者均较弱,因此既不能 进行阴离子聚合,也不能进行阳离子聚合,只 能进行自由基聚合。如氯乙烯、氟乙烯、四氟 乙烯均只能按自由基聚合机理进行。
13
凡共轭体系上的取代基能降低体系的π电
子云密度,则这些基团有吸电子共轭效应, 用-C表示,如-COOH,-CHO,-COR;凡共 轭体系上的取代基能增高共轭体系的π电子云 密度,则这些基团有给电子共轭效应,用+C 表示,如-NH2,-OH,-R。
电子离域
如1,3-丁二烯,四个π电子不是
两两分别固定在两个双键碳原子之 间,而是扩展到了四个碳原子之间, 象这种现象称为电子离域。它体现 了分子内原子之间的相互影响。
二、分类:
共轭效应大致分为三类: 1、π-π共轭 2、P- π共轭
3、超共轭(σ-π共轭)
1、π-π共轭
非饱和键(双键或三键)与单键交替分 布,形成π键的P轨道在同一平面上相互重 叠而成共轭体系,称之为π-π共轭
如:1,3-丁二烯, CH2=CH-CH=CH2中,可以 看作两个孤立的双键重合在 一起,π电子的运动范围不 再局限在两个碳原子之间, 而是扩充到四个碳原子之间。
共轭效应的结果
ⁿ ⑴键长相对缩短,电子云重叠得越多,电子云密度 越大,两个原子结合得就越牢固,键长也就越短,单双 键产生了平均化
共轭效应

共轭效应又称离域效应,是指共轭体系中由于原子间的相互影响而使体系内的π电子(或p电子)分布发生变化的一种电子效应称为共轭效应。
共轭体系能降低体系π电子云密度的基团有吸电子的共轭效应,能增高共轭体系π电子云密度的基团有给电子的共轭效应。
单双建交替出现的体系或双键碳的相邻原子上有p轨道的体系均为共轭体系。
在共轭体系中,π电子(或p电子)的运动范围已经扩展到整个共轭体系,这种现象称为电子离域。
π电子的离域会降低体系的能量,降低的能量称为离域能。
共轭体系越大,离域能越大。
共轭效应方向判断,取代基的共轭效应和诱导效应方向有的一致,有的不一致。
氨基的共轭效应是给电子的,其诱导效应是吸电子的,其共轭效应大于诱导效应,总的电子效应是给电子的,而氯原子的共轭效应是给电子的。
其诱导效应是吸电子的,其共轭效应小于诱导效应,总的电子效应是吸电子的。
共轭效应的特点,只能在共轭体系中传递,无论共轭体系有多大,共轭效应能贯穿于整个共轭体系中。
举例说明共轭效应对反应过程中反应中间体的稳定作用

共轭效应是有机化学中一种重要的分子内稳定效应,对于反应过程中的反应中间体来说,共轭效应能够起到一定的稳定作用。
下面我们将通过举例说明来详细解释共轭效应对反应中间体的稳定作用。
1. 什么是共轭效应?在有机化学中,共轭效应是指分子中含有共轭结构的化合物,通过共轭π电子体系的共享能够影响化合物的稳定性和反应性。
共轭结构通常指的是相邻的两个双键或者一个双键和一个孤对电子的相互作用。
共轭效应可以影响分子的光学性质、电子结构以及化学反应。
2. 共轭效应对反应中间体的稳定作用在有机化学反应中,反应中间体是指在反应过程中形成的、并不立即参与反应的中间物质。
共轭效应对反应中间体的稳定作用主要体现在以下几个方面:2.1 共轭效应对碳离子中间体的稳定作用当反应过程中生成了碳离子中间体时,共轭效应可以通过共轭π电子体系的电子云分布来稳定碳离子,使其形成共轭结构,减少电子孤对的紧张,降低中间体的能量,从而增加反应的速率和选择性。
1,3-丁二烯在发生负离子加成反应时,产生的负离子中间体比较稳定,主要是由于共轭效应的存在。
2.2 共轭效应对自由基中间体的稳定作用同样地,共轭效应也能够对自由基中间体的稳定起到一定作用。
通过共轭结构中π电子的共享,可以减少自由基的不稳定性,增加其稳定性。
这种稳定性不仅能够帮助中间体保存更长时间,也能影响反应的产率和选择性。
苯的自由基取代反应中,共轭效应使得苯环上生成的自由基更加稳定,也更容易与其他分子发生反应。
3. 共轭效应的应用举例在有机合成和药物化学领域,共轭效应的稳定作用得到了广泛的应用。
药物分子中的共轭结构可以增加化合物的稳定性,提高其在体内的代谢稳定性,延长其药效持续时间。
共轭效应还可以影响有机合成反应的产率和产物选择性,为有机合成化学提供了重要的理论基础和实际指导。
通过以上例子我们可以看出,共轭效应在有机化学反应中对于稳定反应中间体起到了重要的作用。
研究共轭效应对于理解有机化学反应的机理、提高合成效率以及设计合成新药物等方面具有重要意义。
共轭效应

离域现象H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
共轭效应CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
共轭效应这种分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
这种电子通过共轭体系的传递方式,叫做共轭效应。
特点沿共轭体系传递不受距离的限制。
共轭效应,由于形成共轭π键而引起的分子性质的改变叫做共轭效应。
共轭效应主要表现在两个方面。
电子效应的一种。
组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、稳定性高、键长趋于平均化,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化,这些变化通常称为共轭效应。
共共轭效应轭效应是指在共轭体系中电子离域的一种效应是有机化学中一种重要的电子效应.它能使分子中电子云密度的分布发生改变(共平面化),内能减少,键长趋于平均化,折射率升高,整个分子更趋稳定。
编辑本段基本介绍“共轭效应是稳定的”是有机化学的最最基本原理之一.但是,自30年代起,键长平均化,4N+2芳香性理论,苯共轭效应环D6h构架的起因,分子的构象和共轭效应的因果关系,π-电子离域的结构效应等已经受到了广泛的质疑.其中,最引人注目的是Vollhardt等合成了中心苯环具有环己三烯几何特征的亚苯类化合物,Stanger等合成了键长平均化,但长度在0.143~0.148nm的苯并类衍生物.最近(1999年),Stanger又获得了在苯环中具有单键键长的苯并类化合物.在理论计算领域,争论主要表现在计算方法上,集中在如何将作用能分解成π和σ两部分.随着论战的发展,作用能分解法在有机化学中的应用不断地发展和完善,Hückel理论在有机化学中的绝对权威也受到了挑战.为此,简要地介绍了能量分解法的发展史,对Kollma法的合理性提出了质疑.此外特别介绍了我们新的能量分解法,及在共轭效应和芳香性的研究中的新观点和新的思维模式。
共轭效应
4
04-06 共轭效应
三. 共轭效应在有机化学中的应用
判断或解释有机反应活性中间体的稳定性
碳正离子、碳负离子、自由基、不同取代的烯烃
例如:比较下列烯烃的稳定性
>
12个σ-π 超共轭 9个σ-π 超共轭
>
6个σ-π 超共轭Βιβλιοθήκη 504-06 共轭效应
例如:比较下列碳正离子的稳定性
>
p-π共轭
>
σ-p超共轭 6个C-H
04-06 共轭效应
二. 超共轭效应
1. 含义及分类
含义:一种特殊的共轭(-、-p) -超共轭效应: 键与C-H 键共轭产生的电子离域效应。
-p超共轭效应:C-H 键与p轨道共轭产生的电子离域效应。
-超共轭效应
-p超共轭效应
04-06 共轭效应
2. 产生的原因 原因:H原子体积小,C—H键电子云的形状及大小与碳原子的p轨 道相差不大,且近似平行,易与邻位的或p电子发生相互作用,形 成-、-p共轭体系。 3. 超共轭效应的特征 超共轭效应比共轭效应弱得多; 在超共轭效应中, 键一般是给电子的, C-H键越多超共轭效应越大。 -CH3 > -CH2R > - CHR2 > -CR3
>
σ-p超共轭 3个C-H
>
无共轭
σ-p超共轭 9个C-H
6
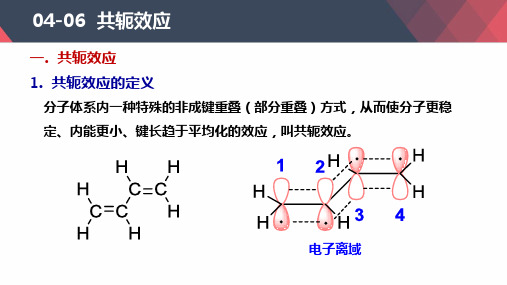
04-06 共轭效应
一. 共轭效应
1. 共轭效应的定义
分子体系内一种特殊的非成键重叠(部分重叠)方式,从而使分子更稳
定、内能更小、键长趋于平均化的效应,叫共轭效应。
电子离域
04-06 共轭效应
2. 共轭效应的分类 π- π p- π
共轭效应的特点

共轭效应的特点共轭效应是指当两个或多个相邻的π键中的一个键被攻击或受到其他化学反应的影响时,另一个键也会受到影响的现象。
这种影响可以是键长的改变、键能的变化、电子密度的重新分布等。
共轭效应是有机化学中一个重要的概念,它对于分子的稳定性、反应性以及光学、电子等性质的理解具有重要意义。
它在有机分子的结构与性质之间建立了联系,为有机化学的研究提供了理论基础。
共轭效应的特点主要包括以下几个方面:1. 共轭效应可以改变π键的键长。
共轭体系中,由于π电子的共享,使得相邻的π键中的电子云变得不对称,导致键长的改变。
共轭效应可以使π键变得更加紧凑,减小键长,增强了键的紧密性。
2. 共轭效应可以改变π键的键能。
共轭体系中,由于电子云的重叠,使得键能降低。
共轭效应可以使π键的共轭体系中的π电子云更加稳定,增强键的稳定性。
3. 共轭效应可以改变π键的电子密度。
共轭体系中,由于π电子的共享,使得电子密度的分布发生变化。
共轭效应可以使π电子云在共轭体系中重新分布,使得电子密度在分子中的不同位置发生变化,从而改变了分子的性质。
4. 共轭效应可以影响分子的光学性质。
共轭体系中,由于π电子的共享,使得分子能够吸收较长波长的光,从而呈现颜色。
共轭效应可以影响分子的吸收光谱,改变分子的颜色。
5. 共轭效应可以影响分子的反应性。
共轭体系中,由于π电子的共享,使得分子的反应活性增强。
共轭效应可以使分子更易受到攻击,发生化学反应,增加反应的速率。
共轭效应在有机化学中具有广泛的应用。
例如,共轭效应可以用来解释分子的稳定性、反应性以及光学性质。
在有机合成中,共轭效应可以用来设计和合成具有特定性质的分子。
在药物设计中,共轭效应可以用来改变药物分子的性质,增强药物的活性。
在材料科学中,共轭效应可以用来改变材料的光学、电子等性质,设计新型的功能材料。
共轭效应是有机化学中一个重要的概念,它对于分子的结构与性质之间的关系具有重要意义。
共轭效应可以改变π键的键长、键能、电子密度等性质,影响分子的光学、电子等性质。
共轭效应

共轭效应共轭效应(conjugated effect) ,又称离域效应,是指共轭体系中由于原子间的相互影响而使体系内的π电子(或p电子)分布发生变化的一种电子效应。
凡共轭体系上的取代基能降低体系的π电子云密度,则这些基团有吸电子共轭效应,用-C表示,如-COOH,-CHO,-COR;凡共轭体系上的取代基能增高共轭体系的π电子云密度,则这些基团有给电子共轭效应,用+C表示,如-NH2,-OH,-R。
1离域现象共轭效应H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
如图,这种分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
这种电子通过共轭体系的传递方式,叫做共轭效应。
2特点沿共轭体系传递不受距离的限制。
共轭效应,由于形成共轭π键而引起的分子性质的改变叫做共轭效应。
共轭效应主要表现在两个方面。
①共轭能:形成共轭π键的结果使体系的能量降低,分子稳定。
例如CH2=CH—CH=CH2共轭分子,由于π键与π键的相互作用,使分子的总能量降低了,也就是说, CH2=CH—CH=CH2分子的能量比两个不共轭的CH2=CH2分子的能量总和要低。
所低的数值叫做共轭能。
②键长:从电子云的观点来看,在给定的原子间,电子云重叠得越多,电子云密度越大,两个原子结合得就越牢固,键长也就越短,共轭π键的生成使得电子云的分布趋向平均化,导致共轭分子中单键的键长缩短,双键的键长加长。
共轭效应共轭效应是电子效应的一种。
组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、稳定性高、键长趋于平均化,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化,这些变化通常称为共轭效应。
共轭效应又称离域效应

共轭效应又称离域效应(delocalization effect)。
存在于共轭体系中的一种极性(静态)和极化(动态的)现象。
是一个分子在“静止”状态以及在微扰状态(例如在反应过程中)的特性。
在单双键交替出现的共轭分子中,可以看做两个孤立的双键用一个单键联合在一起,π电子的运动范围由两个碳原子之间扩充到四个碳原子之间,因此称为离域现象。
在外界的影响下,共轭效应能使电子分布移并在化学特性上有所反映。
例如(1)电性:离域π键的形成增加了物质的电导。
(2)颜色:离域π键的形成扩大了π电子的活动范围,使体系能量降低,能级间隔变小,由σ键的紫外光区移至离域π键的可见光区。
含离域π键的化合物往往是染料、生色剂和指示剂等。
酚酞在碱性溶液中变红就是因为扩大了π电子的离域范围。
(3)酸碱性:苯酚呈酸性,苯胺呈碱性。
前者是因为电离掉H+后离域范围稳定存在;后者是因为本来分子中就有离域π键,不易电离,可接受H+。
(4)化学反应性能:芳香化合物的芳香性、游离基的稳定性,丁二烯类的1,4加成等都和离域π键的生成有关。
共轭效应在共轭体系分子中,由于原子间的相互影响和π电子云的离域,引起分子内能降低、体系趋向稳定、键长趋于平均化,以及某些性质的变化等效应,称为共轭效应。
产生共轭效应的必要条件是,组成共轭体系的各个原子必须处在同一平面上。
这样才能使参加共轭的每个原子的p轨道相互平行而发生侧面重叠。
反之,会减弱、甚至使共轭效应完全消失。
例如,1,3-丁二烯分子具有共轭效应,而环辛四烯由于组成环的八个碳原子不在同一平面上,因而使共轭效应受到影响。
红外光谱基团频率分析及应用基团频率和特征吸收峰物质的红外光谱是其分子结构的反映,谱图中的吸收峰与分子中各基团的振动形式相对应。
多原子分子的红外光谱与其结构的关系,一般是通过实验手段得到。
这就是通过比较大量已知化合物的红外光谱,从中总结出各种基团的吸收规律。
C等,都有自己的特定的红外吸收区域,分子的其它部分对其吸收位置影响较小。
共轭效应

共轭效应共轭效应(conjugated effect) ,又称离域效应,是指共轭体系中由于原子间的相互影响而使体系内的π电子(或p电子)分布发生变化的一种电子效应。
凡共轭体系上的取代基能降低体系的π电子云密度,则这些基团有吸电子共轭效应,用-C表示,如-COOH,-CHO,-COR;凡共轭体系上的取代基能增高共轭体系的π电子云密度,则这些基团有给电子共轭效应,用+C表示,如-NH2,-OH,-R。
H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
共轭效应这种分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
这种电子通过共轭体系的传递方式,叫做共轭效应。
特点沿共轭体系传递不受距离的限制。
共轭效应,由于形成共轭π键而引起的分子性质的改变叫做共轭效应。
共轭效应主要表现在两个方面。
①共轭能:形成共轭π键的结果使体系的能量降低,分子稳定。
例如CH2=CH-CH=CH2共轭分子,由于π键与π键的相互作用,使分子的总能量降低了,也就是说, CH2=CH-CH=CH2分子的能量比两个不共轭的CH2=CH2分子的能量总和要低。
所低的数值叫做共轭能。
②键长:从电子云的观点来看,在给定的原子间,电子云重叠得越多,电子云密度越大,两个原子结合得就越牢固,键长也就越短,共轭π键的生成使得电子云的分布趋向平均化,导致共轭分子中单键的键长缩短,双键的键长加长。
共轭效应是电子效应的一种。
组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、稳定性高、键长趋于平均化,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化,这些变化通常称为共轭效应。
092共轭效应PPT

CH2-CH-CH-CH2
2、P-∏共轭效应 定义:单键的一侧有一∏键,另一侧有未共用电子 对的原子,或有一平行的p轨道,称之为p-∏共 轭。 如: H2C=CH-Cl
H2C-CH-Cl
3、超共轭效应 定义:∏键与C-Hσ键共轭则称为σ-∏共轭,若 C-Hσ键与p轨道共轭则称为σ-p共轭。 如: σ-∏共轭: CH2=CH-CH3
CH 2
四*、静态p-∏共轭效应和静态∏-∏共轭效应的相对强度 1、p-∏共轭p电子朝着双键方向转移,呈推电子效应(+C)。
X C C
其共轭的强度次序对同族元素来说,随着原子序数的增加原子 半径增长,形成p-∏共轭的能力变弱:
OR>
SR>
SeR>
TeR
对于同周期的元素,p轨道的大小相接近,但由于元素的负 电性变大,使电子对不易参加共轭:
H
CH2-CH-CH2
σ-p共轭:
CH 3 -CH-CH 3
H H
CH 2 -CH-CH 2
CH3-CH=C=CH-CH3 (2,3-戊二烯 ) 是否具有共轭结构?
二 、共轭效应的特征 1)键长趋于平均化 2)共轭体系的内能低,分子 较稳定(CH2=CH-CH=CH2 ) 3)折射率较高
三、共轭效应的传递 共轭效应通过共轭键传递。当共轭 体系一端受电场的影响时,就能沿着 共轭链传递得很远,同时在共轭链上 的原子将依次出现电子云密度正、负 交替变化现象(与诱导效应不同)。
F>
Cl>
Br>
I
2、∏-∏共轭 ∏键电子云转移的方向偏向电负 性强的元素,呈拉电子效应(-C)。
C C C O
对于同族元 素来说,原 子序数越大, -C效应越小
有机共轭效应

有机共轭效应
有机化学中的共轭效应是指共轭双键或环中的π电子可以被相邻的单键或其他π电子所影响,从而改变化合物的结构和性质。
共轭效应包括共轭体系的稳定性、反应性和吸收光谱的变化等方面。
共轭体系的稳定性可以通过判断反应热和共轭体系中电子排布的方式来确定。
共轭体系的反应性也受到共轭效应的制约。
吸收光谱的变化可以通过共轭体系的大小、取代基的影响和电子密度的变化来解释。
共轭效应在化学合成、材料科学和生物化学等领域中都有重要应用。
- 1 -。
共轭效应与诱导效应

共轭效应与诱导效应一.共轭效应1、概念:共轭效应(conjugated effect) ,又称离域效应,是指由于共轭π键的形成而引起分子性质的改变的效应。
何为离域效应呢?对于H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
而CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
这种发生离域现象的分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
2、特点:共轭效应相对于诱导效应最特殊的特点是共轭效应沿共轭体系传递不受距离的限制,而诱导效应一般超过三个c原子之后就可以忽略不计了!其主要表现电子效应:组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、键长趋于平均化、折射率升高,整个分子更趋稳定,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化。
3、共轭效应的形式:(1)正常共轭效应:1、π-π共轭。
是指两个以上双键(或叁键)以单键相联结时所发生的π电子的离位作用。
具有共平面性、键长趋于平均化、共轭体系能量降低等特点!C.K.英戈尔德称这种效应为中介效应,并且认为,共轭体系中这种电子的位移是由有关各原子的电负性和p轨道的大小(或主量子数)决定的。
例如:--A=B-X=Y--,原子的电负性和它的p轨道半径愈大,则它吸引π电子的能力也愈大,愈有利于基团-X =Y-从基准双键A=B-吸引π电子的共轭效应。
与此相反,如果A原子的电负性和它的p轨道半径愈大,则它释放π电子使其向Y原子移动的能力愈小,愈不利于向-X=Y基团方向给电子的共轭效应。
中间原子B和X的特性也与共轭效应直接相关。
2、p-π,又称共轭多电子共轭效应。
在简单的多电子共轭体系中,Z为一个带有p电子对(或称n电子)的原子或基团。
共轭效应

C C F
C C Cl C C Br C C I
同族元素:电负性越大的电子,+C 效应越小
C C NR2 > C C OH > C C F
与杂原子相连的正碳离子p- π共轭结构:
氧上未共有电子对所 占 p 轨道 与中心碳原子上的空的 p轨道 侧面交盖,得到p- π共轭
CH3 O
CH2
CH3O
CH2
B对醌、循环式极化
在对子吸收光谱的分析后,在芳香族化合 物中,有循环式和对醌两种共轭极化式。
N O Me O
N OMe
O
Me2 N
N
O
Me2 N
N
O
多联苯系列直来联苯系列
...
...
间位和邻位多苯系列
...
...
C、并苯式极化
• 直链多并苯系列与直多并苯系列由对醌式共轭 极化产生的 • 并苯式极化是指各苯环的对醌式极化可以通过 侧并的苯环而传递,不限与直并的苯环。
类似地,羰基正离子:
R C O
R C
O
2.2.3 应用实例
a.苯酚分子中氧原子上的孤对电子与 苯环上的π电子形成 p- π共轭。 结果: 使羟基的邻、对位的碳原子 带有部分的负电荷。
δ
OH
δ δ
O R C OH
O R C O+ H
C C C Y
(I)
C C X
(II)
π电子转移用弧形 箭头表示
Y为吸电子基团时-吸电子共轭效应 (-C), X为供电子基团时-供电子共轭效应 (+C).
b动态:暂时的,被动的受外界因素的影响
-
+
CH2
CH
CH
共轭效应详解

分子轨道理论认为共轭效应是轨道或电子 离域于整个共轭体系乃至整个分子所产生的一种 效应。
一
电子离域与共轭效应
[现象1] • 在CH2=CH—CH=CH2中的键长不是简单的单键 和双键的键长,存在着平均化的趋势。 • 普通: C—C单键键长 0.154nm C==C双键键长 0.134nm • 1,3-丁二烯:C—C单键键长 0.147nm C==C双键键长 0.137nm • 体系能量降低,化合物趋于稳定。
主量子数相同元素的p 轨道大小相近,可以更 充分地重迭,离域程度也较大。如果取代基中心原 子的主量子数与碳的主量子数不同,则轨道重迭程 度相对较小,离域程度相应减弱,而且主量子数差 值越大影响越明显。因此,一般讲,+C效应在同族 中随中心原子的原子序数增大而降低。
• 带负电荷的元素将具有相对更强的+C效应: —O– > —OR > —O+R2
CH2 CH Cl
-C效应: CH2
CH
CH
O
(1)+C效应
• 在同一周期中: 随原子序数的增大而减弱。 如: —NR2 > —OR > —F • 在同一族中: 随原子序数的增加而减小。 如: —F > —Cl > —Br > —I ; —OR > —SR > —SeR > TeR ; —O– > —S– > —Se– > —Te –
分子中各能级之间能量差减小,分子中电子激发能 低,以致使共轭体系分子的吸收光谱向长波方向移动。 随着共轭链增长,吸收光谱的波长移向波长更长的区 域,进入可见光区,这就是有颜色的有机化合物分子绝 大多数具有复杂的共轭体系的原因。 颜色 丁二烯 无 己三烯 无 二甲辛四烯 淡黄 蕃茄红素 红色 最大吸收峰波长(nm) 217 258 298 470
《共轭效应》

《共轭效应》共轭效应是有机化学中的一个重要概念,是指烯烃及其相关化合物的π电子系统内的多个共轭双键之间相互作用产生的影响。
在化学中,化学键的形成是由电子相互作用而形成的。
这种电子相互作用可以产生各种效应,其中共轭效应就是一种关于π电子体系的效应。
共轭系统是由一系列相互平行的双键构成的,这种共轭体系中电子的运动受到限制,而且能量分布更加均匀,这被视为共轭效应的一种体现。
共轭效应的ASPECTS共轭效应主要包括四个方面:1.电子推拉效应(Electronic Push-Pull Effect): 这个效应是由不饱和含氧或氮原子的基团引起的。
比如,酰基或硝基。
这些基团会在π电子纷乱的共轭体系内移动电子密度,因此推或拉π电子体系,产生一个电子富集或贫化的区域。
2.电荷分布改变(Change of Charge Distribution): 共轭体系通常会导致π电子体系成为一种不同于孤对电子和单键的新体系。
这种新体系有一个更加稳定的电荷分布。
当共轭体系中间增加一个电子密度较高的原子时,其原子轨道上的电子将向共轭体系中移动,使得单键周围的电子密度减少。
同样地,当共轭体系中间增加一个电子密度较低的原子时,其原子轨道上的空穴会从共轭体系中吸取π电子,使得单键周围的电子密度增加。
3.共振现象(Resonance Effect): 当共轭体系中存在一个解离或附加的基团时,其空间中π电子体系可以贡献到解离或附加反应中。
通过传递电子的方式,共轭体系中π电子体系可以在整个分子中进行共振。
比如,若在苯环上引入一个另一个含有π电子体系的基团,它们之间就会产生一种相互作用,共振现象在这种情况下就是非常明显的。
4.空间效应(Steric Effect): 共轭效应也涉及与π电子体系有关的空间效应。
有些基团可能会影响周围原子的空间取向,这样能影响π电子体系的大小和形状。
因此,共轭效应是有机化学中不可或缺的概念,对于理解各种有机分子的性质有着重要的作用。
共轭效应又称离域效应

共轭效应又称离域效应(delocalization effect)。
存在于共轭体系中的一种极性(静态)和极化(动态的)现象。
是一个分子在“静止”状态以及在微扰状态(例如在反应过程中)的特性。
在单双键交替出现的共轭分子中,可以看做两个孤立的双键用一个单键联合在一起,π电子的运动范围由两个碳原子之间扩充到四个碳原子之间,因此称为离域现象。
在外界的影响下,共轭效应能使电子分布移并在化学特性上有所反映。
例如(1)电性:离域π键的形成增加了物质的电导。
(2)颜色:离域π键的形成扩大了π电子的活动范围,使体系能量降低,能级间隔变小,由σ键的紫外光区移至离域π键的可见光区。
含离域π键的化合物往往是染料、生色剂和指示剂等。
酚酞在碱性溶液中变红就是因为扩大了π电子的离域范围。
(3)酸碱性:苯酚呈酸性,苯胺呈碱性。
前者是因为电离掉H+后离域范围稳定存在;后者是因为本来分子中就有离域π键,不易电离,可接受H+。
(4)化学反应性能:芳香化合物的芳香性、游离基的稳定性,丁二烯类的1,4加成等都和离域π键的生成有关。
共轭效应在共轭体系分子中,由于原子间的相互影响和π电子云的离域,引起分子内能降低、体系趋向稳定、键长趋于平均化,以及某些性质的变化等效应,称为共轭效应。
产生共轭效应的必要条件是,组成共轭体系的各个原子必须处在同一平面上。
这样才能使参加共轭的每个原子的p轨道相互平行而发生侧面重叠。
反之,会减弱、甚至使共轭效应完全消失。
例如,1,3-丁二烯分子具有共轭效应,而环辛四烯由于组成环的八个碳原子不在同一平面上,因而使共轭效应受到影响。
红外光谱基团频率分析及应用基团频率和特征吸收峰物质的红外光谱是其分子结构的反映,谱图中的吸收峰与分子中各基团的振动形式相对应。
多原子分子的红外光谱与其结构的关系,一般是通过实验手段得到。
这就是通过比较大量已知化合物的红外光谱,从中总结出各种基团的吸收规律。
C等,都有自己的特定的红外吸收区域,分子的其它部分对其吸收位置影响较小。
共轭效应与诱导效应

共轭效应与诱导效应一.共轭效应1、概念:共轭效应(conjugated effect) ,又称离域效应,是指由于共轭π键的形成而引起分子性质的改变的效应。
何为离域效应呢?对于H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
而CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
这种发生离域现象的分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
2、特点:共轭效应相对于诱导效应最特殊的特点是共轭效应沿共轭体系传递不受距离的限制,而诱导效应一般超过三个c原子之后就可以忽略不计了!其主要表现电子效应:组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、键长趋于平均化、折射率升高,整个分子更趋稳定,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化。
3、共轭效应的形式:(1)正常共轭效应:1、π-π共轭。
是指两个以上双键(或叁键)以单键相联结时所发生的π电子的离位作用。
具有共平面性、键长趋于平均化、共轭体系能量降低等特点!C.K.英戈尔德称这种效应为中介效应,并且认为,共轭体系中这种电子的位移是由有关各原子的电负性和p轨道的大小(或主量子数)决定的。
例如:--A=B-X=Y--,原子的电负性和它的p轨道半径愈大,则它吸引π电子的能力也愈大,愈有利于基团-X =Y-从基准双键A=B-吸引π电子的共轭效应。
与此相反,如果A原子的电负性和它的p轨道半径愈大,则它释放π电子使其向Y原子移动的能力愈小,愈不利于向-X=Y基团方向给电子的共轭效应。
中间原子B和X的特性也与共轭效应直接相关。
2、p-π,又称共轭多电子共轭效应。
在简单的多电子共轭体系中,Z为一个带有p电子对(或称n电子)的原子或基团。
共轭效应

0.133
0.154
H
H
??:nm
双键与乙烯相比,变长了;单键与乙烷相比,变短了。总的说 来,是键长趋于平均化了。
10
氢化热
孤立和共轭体系的氢化热:
C H 2 C HC H 2 C HC H 2+ 2H 2 C H 3 C H C HC HC H 2+ 2H 2 所 以 1 , 3 - 戊 二 烯 的 共 轭 能 是 2 8 K J / m o l
分子中,每个碳原子都以sp2轨 道相互重叠或与氢原子的1s轨 道重叠,形成三个C-Cσ键和六 个C-Hσ键。这些σ键都处在同 一个平面上,它们之间的夹角 都接近120°,此外每个碳原子 还剩下一个来参加杂化的与这 个平面垂直的p轨道。四个p轨 道的对称轴互相平行侧面互相 重叠,形成了包含四个碳原子 的四个电子的共轭体系。 更多…..
8
1,3-丁二烯特点
ⁿ ⑴碳碳单键键长相对缩短,单双键产生了平均化 ⁿ 随构造式CH2=CH-CH=CH2,但单双键的键长已相当
接近,同样体现在环状共轭体系中。如,苯环C-C键 长是完全相等的。 ⑵化合物的能量显著降低,稳定性明显增加。决定内 能大小方法之一就是测量氢化热,氢化热越低,分子 内能越低。
C 5 H 1 2 C 5 H 1 2
H = -2 5 4K J /m o l H = -2 2 6K J /m o l
从能量图可以看出,共轭 二烯烃比孤立二烯烃能量 低了254-226=28KJ/mol 这部分低出来的能量叫共轭 能或离域能。1,3-丁二烯 的共轭能为15kJ/mol。
共轭效应
(conjugative effect )
1
共轭效应的产生 共轭效应的类型
2
共轭效应的产生
共轭效应又称离域效应

共轭效应又称离域效应(delocalization effect)。
存在于共轭体系中的一种极性(静态)和极化(动态的)现象。
是一个分子在“静止”状态以及在微扰状态(例如在反应过程中)的特性。
在单双键交替出现的共轭分子中,可以看做两个孤立的双键用一个单键联合在一起,π电子的运动范围由两个碳原子之间扩充到四个碳原子之间,因此称为离域现象。
在外界的影响下,共轭效应能使电子分布移并在化学特性上有所反映。
例如(1)电性:离域π键的形成增加了物质的电导。
(2)颜色:离域π键的形成扩大了π电子的活动范围,使体系能量降低,能级间隔变小,由σ键的紫外光区移至离域π键的可见光区。
含离域π键的化合物往往是染料、生色剂和指示剂等。
酚酞在碱性溶液中变红就是因为扩大了π电子的离域范围。
(3)酸碱性:苯酚呈酸性,苯胺呈碱性。
前者是因为电离掉H+后离域范围稳定存在;后者是因为本来分子中就有离域π键,不易电离,可接受H+。
(4)化学反应性能:芳香化合物的芳香性、游离基的稳定性,丁二烯类的1,4加成等都和离域π键的生成有关。
共轭效应在共轭体系分子中,由于原子间的相互影响和π电子云的离域,引起分子内能降低、体系趋向稳定、键长趋于平均化,以及某些性质的变化等效应,称为共轭效应。
产生共轭效应的必要条件是,组成共轭体系的各个原子必须处在同一平面上。
这样才能使参加共轭的每个原子的p轨道相互平行而发生侧面重叠。
反之,会减弱、甚至使共轭效应完全消失。
例如,1,3-丁二烯分子具有共轭效应,而环辛四烯由于组成环的八个碳原子不在同一平面上,因而使共轭效应受到影响。
红外光谱基团频率分析及应用基团频率和特征吸收峰物质的红外光谱是其分子结构的反映,谱图中的吸收峰与分子中各基团的振动形式相对应。
多原子分子的红外光谱与其结构的关系,一般是通过实验手段得到。
这就是通过比较大量已知化合物的红外光谱,从中总结出各种基团的吸收规律。
C等,都有自己的特定的红外吸收区域,分子的其它部分对其吸收位置影响较小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-
对称性相同即位相相同,才能 在热作用下:相互交盖成键。
ψ2
顺旋
+ + - + + - + - - -
对称允许
图4.11 1,3-丁二烯热作用关环
-
ψ2
对旋
对称禁阻
+
在光作用下: ψ3
- - + +
+
- + -
+ -
+
HOMO(基态)
-
ψ3 ψ3
+ -
-
+ -
对旋
-
图4.12 1,3-丁二烯光作用关环
4.5.5 周环反应的理论解释 Woodward R. B. 和 Hoffmann R. 提出: 分子轨道对称守恒原理。
反应物与产物的分子轨道对称性保持不变。
前线轨道法:
前线(分子)轨道 HOMO(能量最高的电子 占有轨道)
1,3-丁二烯:
LUMO(能量最低的电子 未占有轨道)
- - +
ψ2
+
-
HOMO(基态)
主链:两个双键在内。命名为“某二烯”
H3C CH3 CH2 C C CH2
2,3-二甲基-1,3-丁二烯 二烯烃的顺反异构体的命名:
H H3C H C C C H C H CH3
H
H3C H
C H
C
CH3 H
C
C
顺,顺-2,4-己二烯 (2Z,4Z)- 2,4-己二烯
顺,反-2,4-己二烯 (2Z,4E)-2,4-己二烯
CH2 CH CH CH2 Br Br
(62%) (37%)
(38%) (63%)
1,2-加成产物 + 1,4-加成来自物氯仿极性溶剂利于1,4-加成反应
• 温度
H2C CH CH CH2 + HBr
H2C
CH CH Br
CH3 + CH2 CH Br
CH CH3
-80℃
H2C
(80%)
CH CH Br Br
1,4-戊二烯
离域能或共振能: 28 kJ· mol-1
254
共轭效应(Conjugated effects): 在共轭体系中电子离域的作用。
π-π共轭效应:由于π电子离域的共轭效应。
O CH2
δ
δ
O
δ
δ
CH C H 或 CH2 CH C H
δ
δ
• 所有原子共平面; • 正、负电荷交替; • 共轭效应的传递不受传递距离的影响。
(20%)
CH3 + CH2 CH CH CH3
40℃
低温利于1,2-加成,温度升高,利于1,4-加成 4.5.2 1,4-加成的理论解释 反应机理
H2C
(20%)
(80%)
第一步:
CH
CH
CH2
HBr
H2C CH
(I)
CH
CH3
H2C CH
CH
CH3
CH2 CH
烯丙基型正离子的生成
(II)
CH CH3
C > C C >C H H H
C > CH2 CH
> 烯丙基 > 2°> 1° > 乙烯型 烯丙型 > 3°
p-π共轭体系:
CH2 CH CH2
δ
烯丙基正离子
CH2 CH CH2
δ
CH2 CH CH2
CH2 CH Cl
烯丙基自由基
氯乙烯
4.3.3 超共轭(Hyperconjugation) σ- π超共轭:
H H C CH H CH2
丙烯
图4.6 丙烯分子中的超共轭
当C-Hσ键与π键相邻时,两者进行侧面 交盖,σ电子离域—σ- π超共轭效应 其作用的结果是增加了π键的电子云密度 参与超共轭的C-Hσ键越多,超共轭效应 越强 :
H R C CH R
δ
H R
H
CH2
δ
<
H C CH
δ
CH2 < H C CH H
4.3.2 p-π共轭体系 烯丙基正离子(Allylic Carbocation):
H2C CH CH2
+
图 4.5 烯丙基正离子 的p-π共轭
带有正电荷的C原子: sp2杂化,空的p 轨道 与π轨道在侧面进行 相互交盖,电子发生 离域。
C C > H2C CH CH2 C
碳正离子的稳定性:
CH3CH CH CHCH3 > C
δ
δ
CH2
δ
σ-p 超共轭: 当C-Hσ键与带有正电荷的 H C原子相邻时, σ-p 轨道进 行侧面交盖,σ电子离域 H C CH2 —σ- p超共轭效应 R
超共轭效应依次增大
R R'
+
sp2杂化
120 °
C
R"
+ 图4.8 σ- p超共轭效应
参与超共轭的C-Hσ键越多, 碳正离子 越稳定:
图4.7 碳正离子的结构
(III)
(I)
(II)
极限结构
• 任何一个极限结构都不能代表真实的 分子。 • 一个分子所具有的结构式越多,分子 越稳定。 • 不同极限结构对共振杂化体的贡献大小 的规则: (a) 共价键数目相等的,贡献相同:
CH2 CH CH2 CH2 CH CH2
(b) 共价键多的比共价键少的稳定:
CH2 CH CH CH2 CH2 CH CH CH2
乙烯基乙醛
丙烯腈
π-π共轭体系的特点 • 电子离域:π电子不是固定在双键的2个 C原子之间,而是分布在共轭 体系中的几个C原子上。 • 键长趋于平均化 • 降低了分子的能量,提高了体系的稳定性 二烯烃 氢化热(kJ· mol-1)
CH3 CH CH CH CH2
226
1,3-戊二烯
CH2 CH CH2 CH CH2
光或热
=
反应特点:高度的立体选择性 H
h ν CH3 H H H CH 3 CH3
△
s-顺-1,3-丁二烯
环状过渡态
环丁烯
H H CH3 CH3
顺-3,4-二甲基环丁烯
CH3
△
CH3
反,反-2,4-己二烯
H H CH3
h ν
顺,反-2,4-己二烯
反-3,4-二甲基环丁烯
4.5.4 双烯合成 共轭二烯、含C C, C C化合物 Diels-Alder 反应 1,4-加成 关环 双烯合成 O
(I): 仲碳正离子; (II): 伯碳正离子 稳定性: (I) > (II) 第二步: 正负离子的结合
1,2-加成
H2C
CH CH
CH2
H2C CH
δ+
CH
δ+
CH3 + Br
1,4-加成
CH2 Br
Br H CH CH CH2
H
ΔG1,4
ΔG1,2
CH2 CH CH CH3
H2C CH CH CH3
合成橡胶:Ziegler-Natta 催化剂
n CH2 CH CH CH2 TiCl4-AlEt3
CH3 n CH2 C CH CH2
1,2-加成聚合物
顺-1,4-加成聚合物 反-1,4-加成聚合物
O CH2 HC HC CH2 + HC HC C O 100 ° C C O
benzene
马来酐
甲苯
△
C CH O CH C O
CHO +
A + X Y X B A B Y
CHO
双烯体 亲双烯体 加成物
(Diene) (Dienophile) (Adduct)
(Pericyclic reaction)
(HOMO, highest occupied mole. orbital);
4.3 电子离域与共轭体系
4.3.1 π-π共轭体系 π-π共轭体系结构特征:重键、单键、 重键交替。 例如:1,3-丁二烯
CH2 CH C CH
乙烯基乙炔
O CH2 CH C H
1,3,5-己三 烯
CH2 CH C N
CH2 CH CH
CH2
5个共价键
4个共价键
(c) 含有电荷分离的比没有电荷分离的 贡献小:
CH2 CH CH CH2 CH CH O O CH2 CH CH O CH2 CH CH CH2 CH CH O O
贡献很小
贡献最大
贡献较小
(d) 键角和键长变形较大的,贡献小: 共振论的应用 烯丙基自由基稳定的原因:共振杂化体为 两个共价键数目相等的极限结构的叠加:
第四章 二烯烃 共轭体系 共振论
4.1 二烯烃的分类与命名 4.1.1 二烯烃的分类 4.1.2 二烯烃的命名 4.2 二烯烃的结构 4.2.1 丙二烯的结构 4.2.2 1,3-丁二烯的结构 4.3 电子离域与共轭体系 4.3.1 π-π共轭体系 4.3.2 p-π共轭体系 4.3.3 超共轭 4.4 共振论 4.5 共轭二烯烃的化学性质 4.5.1 1,4-加成反应
CH2 CH CH2 CH2 CH CH2
4.5 共轭二烯烃的化学性质
4.5.1 1,4-加成反应
1,2-加成
CH2 CH CH CH2 Br Br
CH2 CH CH CH2 + Br2
共轭加成 影响加成方式的因素: • 溶剂 正己烷
CH2 CH CH CH2 + Br2 -15 C
°
1,4-加成
稳定性依次减弱
4.4 共振论(Resonance theory)
Pauling L. 1931-1933年 共振论。 基本观点: 当一个分子、离子或自由基不能用 一个经典结构表示时,可用几个经典结 构式的叠加—共振杂化体描述。
