63抗体药表达系统(来源:药渡)
61抗体药统计(来源:药渡)
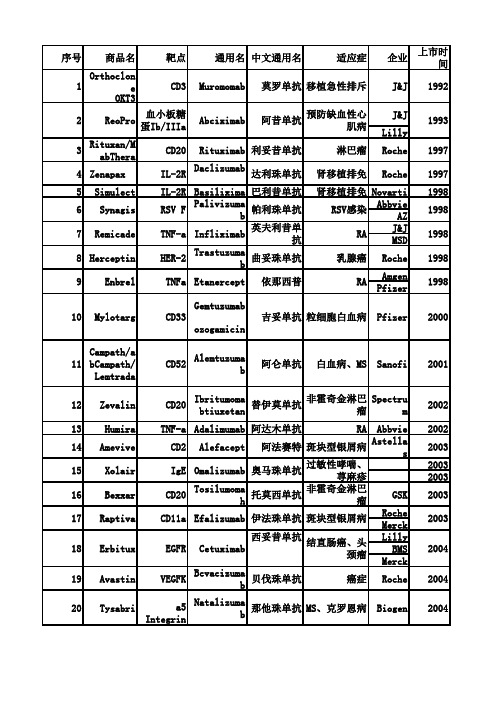
Orthoclon eOKT3J&J Lilly 3Rituxan/M abThera CD20Rituximab 利妥昔单抗淋巴瘤Roche 19974Zenapax IL-2R Daclizumab 达利珠单抗肾移植排免Roche19975Simulect IL-2R Basilixima 巴利昔单抗肾移植排免Novarti1998AbbvieAZ J&JMSD8Herceptin HER-2Trastuzumab 曲妥珠单抗乳腺癌Roche 1998Amgen Pfizer Gemtuzumabozogamicin11Campath/a bCampath/Lemtrada CD52Alemtuzumab阿仑单抗白血病、MS Sanofi 200112Zevalin CD20Ibritumoma btiuxetan 替伊莫单抗非霍奇金淋巴瘤Spectrum200213Humira TNF-a Adalimumab 阿达木单抗RAAbbvie200214Amevive CD2Alefacept阿法赛特斑块型银屑病Astellas20032003200316Bexxar CD20Tosilumomah 托莫西单抗非霍奇金淋巴瘤GSK2003RocheMerck Lilly BMSMerck19Avastin VEGFKBcvacizumab贝伐珠单抗癌症Roche200420Tysabri a5Integrin Natalizumab 那他珠单抗MS、克罗恩病Biogen 200421Actemra/R o AclemraIL-6RTocilizumab 脱利珠单抗卡斯尔曼病、RARoche 2005115Xolair IgE Omalizumab 奥马珠单抗过敏性哮喘、荨麻疹吉妥单抗粒细胞白血病Pfizer2000上市时间RA19989EnbrelTNFa Etanercept依那西普RA19987RemicadeTNF-a Infliximab英夫利昔单抗2ReoPro 血小板糖蛋Ib/IIIaAbciximab阿昔单抗预防缺血性心肌病1993序号商品名靶点通用名中文通用名6Synagis 10Mylotarg CD33RSV F Palivizumab帕利珠单抗RSV感染1998CD3Muromomab 莫罗单抗移植急性排斥J&J 1992适应症企业斑块型银屑病200318Erbitux EGFR Cetuximab 西妥昔单抗结直肠癌、头颈瘤200417Raptiva CD11a Efalizumab 伊法珠单抗22Orencia CD 80/CD60Abatacept 阿西巴普RA BMS 200523泰欣生EGFR Nimotuzumab 尼妥珠单抗头颈癌百泰生物2005RocheNovartisAmgenTakeda26Soliris 补体C5Eculizumab 艾库组单抗PNH, aHUS Alexion200727Arcalyst IL-I Rilonacept 利洛纳赛CAPS R egeneron200828Cimzia TNF-aCertolizum ab Pegol赛妥珠单抗RA UCB 200829StelaraIL-12,IL-23Ustekinumab 优特克单抗RAJ&J200930Removab EpCAM/CD3/Fe receptorsCatumaxomab 卡妥索单抗恶性腹水Frencius2009J&J MSD 32Haris IL-l βCanakunumab 康纳单抗CAPS、SJLA Novartis2009慢淋GSK2009MS Novartis三期Prolia RANK Denosumab 狄诺塞麦骨质疏松Amgen Xgeva RANK Denosumab 狄诺塞麦癌症AmgenPralia RANK Denosumab 狄诺塞麦骨质疏松第一三共Ranmark RANK Denosumab 狄诺塞麦癌症第一三共35Yervoy CTLA-4Ipilimumab 伊匹单抗癌症BMS201136Benlysta BLyS Belimumab 贝利取单抗系统性红斑狼疮GSK201137Nulojix CD80、CD86Belatacept 贝拉西普肾移植排免BMS2011Seattle Takeda RegeneronBayer 40Potcligco CCR4Mogamulizumab淋巴瘤Kyowa Kirin201241Perjeta HER2Pertuzumab 帕妥珠单抗乳腺癌Roche201242Abthrax PA Raxibacumab 炭疽热GSK201243ZaltrapVEGF、PIGF Ziv-Aflibercep t 阿柏西普转移性结肠癌Sanofi 201244KadcylaHER2Ado-trastuzumabemtansine珠单抗-美登素乳腺癌Roche 2013AMD、DME200625Vectibix EGFR Panitumumab 帕尼单抗结直肠癌200624Lucentis VEGKRRanibizumab 雷珠单抗RA200933Arzerra CD20Ofatumuniab 奥法木单抗31Simponi/Si mponiTNF-a Golimumab 戈利木单抗34201038Adcetris CD30Brentuximabvedotin淋巴瘤2011VHGFA,IMGF Aflibercept Eylea 39阿柏西普AMD. DME201145Gazyva/CazyvavroCD20Obinutuzumab慢性淋巴痛Roche201346郎沐VEGF、PIGFConhercept康柏西普AMD、DMH成都康弘201347Cyramza VEGFR2Ramucirumab雷莫芦单抗NSCLC Lilly2014 48Sylvant IL-6R Siltuximab西妥昔单抗卡斯尔曼病J&J2014 49Entyvioα4β7Vedolizumab维多珠单抗肠癌、克罗恩病Takeda2014 50Opdivo PD-1Nivolumab纳武单抗癌症BMS201451Keytruda PD-1Pembrolizumab帕母单抗癌症MSD201452Blincyto CD3、CD19Blinatumomab白血病Amgen201453Cosentyx IL-I7Secukiinnnah苏金单抗RANovartis201554Unituxin GD2Dinutuximab神经母细胞瘤United Therapeti cs201555Darzalex CD38Daratumumab多发性骨髓瘤J&J2015 56Praluent PCSK9Alirocumab调血脂Sanofi2015 57Repatha PCSK9Evolocumab调血脂Amgen2015 58Portrazza EGFR Necitumumab NSCLX Lilly2015BMS2015Abbvic2015 60Nucala IL-5Mcpolizumah美泊利申抗GSK201561Praxbind DabigatranIdarucizumab达比加群酯抑制剂BI2015多发性骨髓瘤合汁59Empliciti SLAMF7Elotuzumab销售额/亿美元201420151.110.986970.458.357.49 6.62 68.6865.38 23.7217.94 62.7565.38 64.1766.8438.533.320.45 2.730.220.18 125.43140.12退市3.734.857.23 5.01 12.0110.10 64.1766.8419.618.86 12 2414 3216.5218.850.80O.8O 17.0115.2 24.4120.605.05 5.491.56 1.58 21.4625.900.140.14 10.5912.1720.7224.740.000.0011.8713.286.89 6.901.992.360.7210.3013.12 12.2114.050.560 930.840.98 13.0811.262.06 2.591.782.261.922.42 17.3626.76 10.0913.80.120.169.1814.45 0.920.87 5.367.690.490150.450.76 3.841.80 6.52 0.059.42 0.55 5.660.03上市 2.610.20O.110.030 837.239O5.95。
第六章抗体的表达

常用的原核表达载体分类及特征
转录载体:用以表达本身带有原核核糖体结合位 点和AUG起始密码子的目的基因T-24(+)和pET-23(+)
体
翻译载体:包括来自T7噬菌体主要衣壳蛋白的高效
核糖体结合位点,用于表达一些不带有核糖体结合
位点的目的基因
pET载体系统为满足不同的需求,生产了带有His·Tag、 T7·Tag、S·Tag、GST·Tag、ompT、CBD S·Tag、 Thioredoxin、DsbA·Tag 、Trx·Tag等标签的融合蛋白,其中带 有S·Tag、His·Tag、T7·Tag的蛋白易于通过蛋白质杂交检测。
11
一种表达体系的核心是表达载体及宿主菌,而表达方法的进步也 主要体现在载体元件的优化和宿主菌基因型的改造上。 理想的原核表达载体应具有以下特征:
(1)稳定的遗传复制和传代能力;
(2)具有显性的转化筛选标记; (3)启动子的转录是可调控的,抑制时本底转录水平较低; (4)启动子转录的mRNA能够在适当的位置终止,转录过程 中不影响表达载体的复制; (5)具备适用于外源基因插入的酶切位点,以确保目的基因 按一定方向与载体正确衔接表达产物的分离、纯化。
第六章抗体的表达
第一节 概述
目前抗体的主要类型: 1、多克隆抗体:通过免疫手段制备。 2、单克隆抗体:通过杂交瘤技术制备。 3、基因工程抗体:包括嵌合抗体、改型抗体等,通过 基因工程手段制备,涉及设计、构建与表达等。
2
3
要想获得全长的抗体分子,就必须选择恰当的抗体表 达系统,而要使所表达的蛋白质结构不具有免疫原性 或避免半衰期过短,就需要使用一个标准的抗体工程 技术生产全人抗体。
大肠杆菌表达系统昆虫细胞表达系统哺乳动物表达系统酵母表达系统存在一些蛋白不能有效地折叠发酵周期较长容易污染需要考虑表达产物的卫生安全性筛选产物价格昂贵有时表达产物没有生物活性等问题都为临床生产和应用带来了不便也存在产物低表达或不表达的问题产物纯化问题依然存外源基因不能持久稳定地表达而且表达成本很高技术背景复杂存在不正确的糖基化修饰且表达量低原核表达系统具有吸引力的原因在于它的成本低生产率高和能够大规模快速的生产等优点第二节原核表达系统原核表达是指通过基因克隆技术将外源目的基因通过构建表达载体并导入表达菌株的方法使其在特定原核生物或细胞内表达
制备生物技术药物的几种表达系统

制备生物技术药物的几种表达系统(一)细菌:优点是基因了解清楚;本身价格便宜且易于培养;培养基便宜;表达水平高;生长快及易于鉴别。
缺点是不能分泌蛋白质;含有内毒素;无转译后修饰;可能有非正规的蛋白质交迭。
产品有利用大肠杆菌表达的胰岛素,重组人生长激素,白介素-2、干扰素、淋巴生长因子、白介素及细胞活素。
(二)酵母:优点是使用安全;使用的期限较长;基因了解清楚;无内毒素;高表达水平;分泌出蛋白质且易收获;生长快;培养基便宜;蛋白质一般正规交迭;转译后修饰。
缺点是产糖量过多因而损坏蛋白质的生物活性、安全性、活性及活力等;可能含有免疫物质或抗原。
产品有重组蛋白质、疫苗如乙肝疫苗、胰岛素、较大的重组蛋白如链激酶、人血清蛋白、组织坏死因子及干扰素。
(三)昆虫细胞:优点是具有转移后修饰;正规的交迭蛋白质;能分泌出产物;较好的表达率;棒状病毒对人无损害。
缺点是使用期限较短;生长慢;培养基昂贵;含有免疫宿主蛋白;有些非正规的糖化反应;哺乳类病毒可以感染此类细胞。
产品有疫苗、治疗药物、临床检验试剂以及做病毒治疗药物释放系统。
(四)哺乳动物细胞:优点是一般交迭蛋白质正规;正规的转移后修饰;能分泌蛋白质;良好的正规使用纪录;对大的、复杂的蛋白质的生产是唯一的选择。
缺点是培养基昂贵、生长缓慢;含有过敏物质;需要深入的鉴别;精制手续复杂;产品昂贵。
或品有组织血纤维溶酶原活化剂(TPA),因子Ⅷ及单克隆抗体的生产。
(五)转基因动物:优点是可表达复杂、巨大的蛋白质;高表达水平;蛋白质交迭正规;后转移修饰正规;易于放大;费用低廉。
缺点是正规使用的经验很少;是否易于被病毒感染尚为未知数;表达水平不稳定;周转期限长;精制方法尚需研究;生产周期不能确定;有关农场的eGMP生长尚存在问题。
产品有利用羊及兔子生产α-1抗胰蛋白酶,胆盐刺激生产的脂肪酶,超氧化物岐化酶、胶原、因子Ⅷ及Ⅸ及一些小肽。
(六)转基因植物:优点是开发周期较动物短;种子易于保存;易于放大;表达量高;基因结构清楚;无植物病毒影响人类;生产费用低。
CHO细胞表达抗体

表达载体结构组成 ◆ 骨架序列 ◆ 选择性标志基因 ◆ 表达盒 ◆ 特殊的调控序列
7
选择标志基因
共扩增基因
( DFHR和GS)
当环境中存在高浓度
(MTX 、MSX)时,标记
基因可自发在染色体上扩 增拷贝数 ,连带其上下游 的序列一起扩增 ,共扩增 序列可达上千个bp ,拷贝 数可增加几百到几千倍。
THE END
THANK YOU ! 22
将右图质粒共转染CHO(DHFR- )
◆ 宿主菌须在含有GHT(甘氨酸、次黄 嘌呤、胸腺嘧啶) 的培养基中生长
◆ 重组质粒Poptivec-target整合到宿 主菌染色体组上后的阳性菌可在不含 GHT的培养基中生长。
◆ 进一步用G418和MTX筛选 , 在MTX浓度 选择压力下 , dhfr基因与其共转染的 目的基因一起扩增 , 提高目的蛋白表 达。 11
3
CHOClassificat ion
补充: 1980年CHO-K1经化学突变得到CHO- DXB11 ( 一个等位基因缺失) 1983年的电离辐射经诱变株CHO-DG44 (两个等位基因缺失) 由于CHO-DXB11 DHFR缺陷不彻底 ,很快被完全无DHFR活性 的CHO-DG44取代 注释: ATCC (American Type Culture Collection) 美国菌种保藏中心 ECACC(European Collection of Authenticated Cell Cultures) 欧洲细胞株/微生物保藏中心
4
DHFR缺陷型
宿主细胞
DG44 DUXB11
PcDNA3.3/Poptivec 载体系统 Life Technology公司
宿主细胞: DG44 质粒: 共转染PcDNA3.3(Neo抗 性基因 , ¥2000) 和Poptivec 筛选试剂: G418(遗传霉素)/MTX (氨甲喋呤)
抗体药物研究进展

抗体药物研究进展抗体药物,顾名思义,是指通过人体免疫系统产生的抗体分子为基础所研制的药物。
简单来说,抗体是一种能够识别与结合特定分子(抗原)的免疫蛋白质,因而称为免疫球蛋白(Ig),而抗体药物则是一种利用人体免疫系统自身能力来对抗多种疾病的新型药物。
近年来,随着生物技术的飞速发展,抗体药物也取得了长足进展,不仅取得了在包括癌症、自身免疫疾病、感染病等许多领域的重大临床突破,且已成为制药行业全球最快增长领域之一。
抗体药物的分类抗体药物可分为两大类:一类是由人免疫系统自然产生的抗体,如引入的针对抗原的抗体、单克隆抗体等;另一类是基于对人免疫系统反应进行精细设计的合成药物,如半重链抗体、载体融合蛋白、人源化抗体等。
抗体药物的优点相较于传统药物,抗体药物具有以下优势:1、高选择性:由于抗体可以特异性识别和结合特定分子,所以相较于传统药物会更具有选择性。
2、高亲和力:抗体与抗原结合产生复杂的分子互作用,使得抗体对于靶分子的亲和力比传统小分子药物更高,因而有效性更佳。
3、安全性高:抗体药物是由人体天然免疫系统产生和使用的蛋白质,且与人体的主要组织和器官具有较高的相似度,因此毒副作用少。
4、可调节性:抗体药物可以在分子结构上进行调节,改变抗体的组成部分和位置,从而获得更佳的性质和效果。
抗体药物在肿瘤治疗中的应用肿瘤是目前困扰全球人们健康的重大疾病之一。
抗体药物在肿瘤治疗中的应用占到了抗体药物总量的75%左右。
其中最主要的应用就是肿瘤靶向治疗,使得治疗中的有害结果得到明显的消减。
靶向抗体药物对于癌细胞的治疗作用是通过结合其表面抗原,识别破坏癌细胞。
在癌症治疗中,经常使用的靶向抗体药物有美罗华(Herceptin)、基因吉莲(Erbitux)、帕博西刚(Avastin)等。
这些靶向抗体药物大多数适用于局部或晚期癌症的治疗。
与化疗相比较,抗体药物治疗更为精确,而且它能够带来更好的生存质量。
抗体药物也可用于抑制与肿瘤有关联的细胞增殖因子,在治疗中的效果显著。
ADC药物发展史看核心四要素的变迁

ADC药物发展史看核心四要素的变迁肿瘤药物的开发可追溯至二十世纪中期,人们发现氮芥通过靶向快速分裂的癌细胞来破坏个体的骨髓和淋巴组织。
这类药物包括叶酸和嘌呤类似物(甲氨蝶呤和6-巯基嘌呤),微管聚合抑制剂/促进剂(长春花生物碱和紫杉烷类)和DNA破坏剂(蒽环类和氮芥类)[2]。
由于早期的肿瘤治疗药物不仅靶向癌细胞而且对体内所有的分裂细胞都具有杀伤作用,导致患者发生严重的副作用,这大大限制了给药剂量,药物的治疗指数(最大耐受剂量/最小有效剂量)很低,疗窗口狭窄。
ADC药物可能实现选择性地将有毒化合物递送至特异性的癌细胞。
2.1 第一代ADC药物在第一代ADC药物中,丝裂霉素C,伊达比星,蒽环类,N-乙酰马法兰,阿霉素,长春花生物碱和甲氨蝶呤等抗肿瘤药物主要通过不可裂解的连接物(酰胺或琥珀酰亚胺)与鼠单抗偶联。
2000年美国FDA批准首款抗体偶联药物Gemtuzumab Ozogamicin(商品名Mylotarg,惠氏,辉瑞子公司),靶点为CD33,Gemtuzumab Ozogamicin由三部分构成:1)重组人源化IgG4 kappa型单抗Gemtuzumab;2)具有细胞毒性的N-乙酰基γ卡奇霉素;3)由4-(4-acetylphenoxy)-butanoic acid (AcBut) 和3-methyl-3-mercaptobutane hydrazide(dimethylhydrazide) 组成的酸裂解型双功能Linker分子。
Linker分子将卡奇霉素共价连接到单抗,药物抗体比率ADR平均为2~3。
该药物被靶细胞内吞后,通过水解linker释放卡奇霉素,诱导双链DNA断裂,致使细胞周期停滞并凋亡。
该药用于治疗CD33阳性的急性骨髓性白血病。
图4 Gemtuzumab Ozogamicin结构式,来源:药渡数据库随后发现,与其它抗癌药物比较Gemtuzumab Ozogamicin没有显著的临床优势,而且具有严重的肝毒性。
4.抗体制药

围从150,000到950,000道尔顿。分五类:
• IgG在血清中含量最高,达75~80%,是抗感染
的主要抗体;
• IgM是五类免疫球蛋白中分子量最大的,为
五聚体,是对一个抗原作出反应时产生的
第一个抗体;
• IgA在黏膜表面、乳腺、泪腺形成,主要参
与局部的免疫反应;
免疫球蛋白
• IgD在血清中含量很低;
2、杂瘤细胞的选择性培养
常用的选择培养基为HAT培养基。 次黄嘌呤(H)、氨基喋呤(A能阻断DNA合成)、
胸腺嘧啶(T)。 脾细胞具有次黄嘌呤鸟嘌呤磷酸核糖转移酶
(HGPRT),因此脾-瘤融合的杂交瘤细胞可利用 HGPRT酶,用次黄嘌呤(H)和胸腺嘧啶(T)合成 DNA,使杂交瘤细胞得以生长。
抗体药物市场销售额
160 140 120 100
80 60 40 20
0
年份 2002 2003 2004 2005 2006 2007 2008 2011
全球有超过200家上市或未上市公司正在研发
用于临床诊断和治疗的单克隆抗体
正在进行临床试验的抗体公司(38家):
Abgenix Alexion Pharm Altarex Applied Molecular Evolution BASF Biogen BioTransplant CAT(Cambridge Ab Tech) Celltech Centeon Centocor (Johnson & Johnson)
纯化单克隆抗体流程(大鼠)
三.单克隆抗体药物的现状
250多种抗体类药物在临床试验中
-1/3已进入三期临床 -1/4已通过临床III期试验
美国市场上有13种治疗用的抗体药物 抗体药物的销售额
生物技术制药复习题

生物技术制药复习题第一章绪论第一节生物技术的发展史1、生物技术:以生命科学为基础,利用生物体的特性和功能,设计构建具有与其性状的新物种或新品系,并与工程结合,利用这样的新物种进行加工生产,为社会提供商品服务的一个综合性技术体系。
它的范畴:基因工程、细胞工程、酶工程、发酵工程、生化工程。
基因工程是生物技术的核心。
P12、蛋白质工程----第二代基因工程;海洋生物技术-----第三代生物技术P13、生物技术发展史:传统、近代(抗生素、发酵罐)、现代(DNA重组)P31974年,Boyer和Cohen建立了DNA重组技术1975年,Koher 和Milstein 建立了单克隆抗体技术1982年,第一个基因工程药物重组人胰岛素被批准上市1989年,我国第一个基因工程药物干扰素批准上市2003年,中国的重组腺病毒-p53注射液成为石阶上第一个正式批准的基因治疗药物。
第二节生物技术药物1、生物技术制药:生物技术制药:采用现代生物技术人为地创造一些条件,借助某些微生物、植物或动物来生产所需的医药品。
P42、生物技术药物:采用DNA重组技术活其他生物技术研制的蛋白质或核酸类药物。
它与天然生化药物、微生物药物、海洋药物和生物制品共同归为生物药物。
3、现代生物药物分为4类:重组DNA技术制造的基因重组多肽、蛋白质类治疗剂;基因药物;天然药物;合成与部分合成药物。
4、生物药物按用途分为:治疗药物;预防药物;诊断药物。
5、生物技术药物的特征:(1)分子结构复杂;(2)具有种属特异性;(3)治疗针对性强、疗效高;(4)稳定性差(5)基因稳定性;(6)免疫原性;(7)体内半衰期短;(8)受体效应;(9)多效性和网络性效应;(10)检验的特殊性。
第三节生物技术制药1、生物技术制药的特征:高技术、高投入、长周期、高风险、高收益。
P52、生物技术在制药中的应用有哪些?P7(1)基因工程制药:① 开发基因工程药物,如干扰素(IFN)、红细胞生成素(EPO)等②基因工程疫苗,如乙肝基因工程疫苗③基因工程抗体,它可以作为导向药物的载体④基因诊断与基因治疗⑤应用基因工程技术建立新药的筛选模型⑥应用极影工程激活素改良菌种,产生新的微生物药物⑦改进药物生产工艺⑧利用转基因动、植物生产蛋白质类药物。
重组抗体的表达

3 总结
重组抗体的高效表达
2.1 表达宿主的选择 2.2 表达载体的结构排列 2.3 高效表达载体的构建 2.4 抗体基因序列的优化 2.5 信号肽的选择 2.6 抗体表达系统及其筛选的策略 2.7 细胞培养工艺优化
谢谢大家
RNA 聚合酶识别、结合和开始转录的DNA 序列。 与转录调节因子协同促进转录。
hCMV、 CHEF-1a、 hEF-1a 、UBC
增强启动子的活性和功能,能够使基因转录频率明显增加的DNA Human CMV
序列。
Immediate early enhancer
能阻止临近调控元件对其所界定的基因启动 子起增强和抑制作用。
信号肽将加速此过程的完成,从而提高抗体的表达水平。
● 信号肽选择策略:①与表达蛋白质同源的分泌信号肽;
②与宿主表达细胞同源的分泌信号肽; ③机体内表达的分泌蛋白的分泌信号肽; ④替换高效表达蛋白质的信号肽序列作为重组抗体的信号肽; ⑤对原有抗体信号肽序列进行一级结构改造; ⑥替换某些病毒的蛋白质信号肽序列。
重组抗体的表达
1 抗体发展历程 2 重组抗体的高效表达
2.1 表达宿主的选择 2.2 表达载体的结构排列 2.3 高效表达载体的构建 2.4 抗体基因序列的优化 2.5 信号肽的选择 2.6 抗体表达系统及其筛选的策略 2.7 细胞培养工艺优化
1 抗体发展历程
重 组 抗 体:又叫基因工程抗体, 是利用DNA和蛋白质工程技术, 在基因水平上对免疫球蛋白分子进行适当加
抗体药物

抗 原 ( antigen ) —— 是 任何可诱发免疫反 应的物质。 ※与抗体结合的部位为抗原决定簇或表位。 ※根据抗原性质分类: ①完全抗原:具备免疫原性和反应原性两种 能力; ② 半抗原:只具有反应原性而没有免疫原 性的物质。
抗原-抗体反应 ※是抗体的 V区互补决定区形成的三维构象与抗原高级结构 表面的决定簇之间的反应,为非共价键结合,包括静电引力、 氢键、范德华力、疏水作用力等; ※包括抗原抗体特异性结合和非特异性促凝聚两个阶段; ※反应特点:特异性(主要特征)、比例性、可逆性。
“Y”字形对称结构,经二硫键共价结合
特异性结合相关抗原
选择性杀伤 肿瘤靶细胞
抗体药物 特异性
临床使用疗 效确切
动物体内 靶向性分布
特定肿瘤疗效更佳
抗体药物多样性的主要表现:
抗体药物的重要特点之一是可以定向制造( tailored
making),可以根据需要,制备具有不同治疗作用的抗体
药物。 ※针对特定的靶分子定向制备抗体药物; ※根据需要选择抗体药物的“效应分子”。
2
1)特异性识别HER2调控的细胞表面 蛋白,抑制其介导 信号转导,而治疗 肿瘤; 2)HER-2过表达的 乳腺癌化疗联用显 著提高完全缓解率。
3
1)与带CD52的靶细 胞结合,通过宿主 效应的CDC、ADCC 和细胞凋亡等机制 导致细胞死亡; 2)作用机制独特, 对源于B和T细胞的 各种恶性肿瘤具有 很好的治疗作用。
基 因
※通过基因工程技术的改造,可以降低甚至消除人 体对抗体的排斥反应; ※基因工程抗体的分子量较小,可以部分降低抗体 的鼠源性,更有利于穿透血管壁,进入病灶的核心 部件; ※根据治疗的需要,制备新型抗体; ※可以采用原核细胞、真核细胞和植物等多种表达 方式,大量表达抗体分子,大大降低生产成本。
meds标准

meds标准
"Meds" 是一个缩写,通常用于指代药物(Medications)的标准。
在医疗领域,存在一些用于标准化药物信息和管理的标准和分类系统,可以帮助医生、药师和其他医疗专业人员更好地理解和交流有关药物的信息。
以下是一些常见的药物标准和分类系统:
1. ATC(Anatomical Therapeutic Chemical Classification System):这是一个国际通用的药物分类系统,按照药物的解剖、治疗和化学属性将药物划分为不同的组别和子组别。
2. RxNorm:这是一个用于标准化药物名称和标识符的系统,用于统一不同医疗信息系统中对药物的命名和表示。
3. NDC(National Drug Code):这是由美国食品药品监督管理局(FDA)分配的药物识别码,用于唯一标识和追踪药物。
4. SNOMED CT(Systematized Nomenclature of Medicine - Clinical Terms):这是一个医学临床术语系统,其中包括了广泛的医学概念和术语,包括药物方面的信息。
5. LOINC(Logical Observation Identifiers Names and Codes):这是一个用于标识和交换医学检验和观察结果的系统,其中包括药物相关的观测项目。
这些标准和分类系统旨在提供统一的药物信息和命名规范,以促进医疗领域的协作、数据交换和研究。
具体在使用药物信息方面,可以根据具体的需求和应用场景选择合适的药物标准进行使用。
欧盟新版《药物警戒实践指南》(GVP):第二单元- 药物警戒系统主文件(第2版)

2017年3月28日EMA /药物警戒管理规范指南(GVP)模块II - 药物警戒系统主文件(Rev 2)* 注:修订2包含以下内容:- 删除II.A中的文字指过渡期,因为这不再适用;- 在II.B中澄清PSMF的内容应反映欧盟授权的药品安全信息的全球可用性,提供全球,地区和地方级应用的药物警戒系统信息;- 删除II.A中的文字不适用,并重新安排第II.B.2.1,II.B.2.2,II.B.2.3节的内容。
和II.C.1.1。
要强调申请人药物警戒系统在初始上市许可申请时提交摘要的要求,要求通过第57条数据库(PSMF位置)初次电子提交QPPV /联系方式和PSMF位置信息注册),并只更新第57条数据库,而不需要提交I AIN类型变体(QPPV和PSMF位置信息维护);- 在II.B.4.7中作出澄清。
列入尚未就特定审计或PSMF所要求的说明中的发现商定的纠正性和预防性行动计划,以解决公众询问;- 另外在II.B.4.8。
对产品清单中关于药品销售状况的信息的法律参考。
查看网站的联系方式欧洲药品管理局www.ema.europa.eu 药品代理商www.hma.eu欧洲药品管理局是欧盟的一个机构©欧洲药品管理局和药品代理处负责人,2017。
复制是经过授权的,只要来源得到承认。
该模块的修订不需要征询公众的意见,因为它只涉及更新和澄清而不涉及内容。
目录II.A。
介绍 (4)II B. 结构和流程 (4)II.B.1。
目标 (4)II.B.2。
注册和维护 (5)II.B.2.1。
申请人的药物警戒系统概述 (5)II.B.2.2。
位置,注册和维护 (6)II.B.2.3。
药物警戒系统主文件的职责转移 (7)II.B.3。
药物警戒系统的代表 (7)II.B.4。
包含在药物警戒系统主文件中的信息 (8)II.B.4.1。
PSMF关于负责药物警戒的合格人员(QPPV)部分 (9)II.B.4.2。
PSMF关于上市授权持有者组织结构的部分 (9)II.B.4.3。
利用N 糖苷酶F 对单克隆抗体N 糖酶解条件的优化

生物技术进展2021年㊀第11卷㊀第2期㊀214~222CurrentBiotechnology㊀ISSN2095 ̄2341研究论文Articles㊀收稿日期:2021 ̄01 ̄14ꎻ接受日期:2021 ̄01 ̄27㊀基金项目:上海市浦东新区科技发展基金(PKX2019 ̄S09)ꎮ㊀联系方式:张博慧E ̄mail:yaoyaozhd@163.comꎻ∗通信作者许俊彦E ̄mail:junyan.xu@dragonboatbio.com利用N糖苷酶F对单克隆抗体N糖酶解条件的优化张博慧ꎬ㊀贾戴辉ꎬ㊀程倩ꎬ㊀许俊彦∗ꎬ㊀邵喆ꎬ㊀黄应峰宝船生物医药科技(上海)有限公司药物分析部门ꎬ上海201203摘㊀要:为了优化利用N糖苷酶F(PNGaseF)酶解单克隆抗体中N糖的方法ꎬ应用本公司生产的单抗对PNGaseF酶的酶解条件进行优化ꎬ包括缓冲液pH㊁酶种类㊁仪器㊁酶解程度㊁变性缓冲液及酶加入量等ꎬ总结酶解条件对N糖谱结果的影响ꎮ结果显示ꎬ置换缓冲液至1ˑPBS中可以避免某些单抗在低pH酶解时G0F转化为G0F ̄GN并可改善峰型ꎻ快速PNGaseF和加入变性缓冲液能有效提高酶解效率ꎻUPLC和1.7μm粒径色谱柱能提高分离度ꎻ不完全酶解影响N糖含量结果ꎮ研究结果表明ꎬ采用优化的酶解条件可快速㊁有效的酶解单抗上的N糖ꎬ使N糖谱结果准确可靠ꎬ为细胞株筛选和单抗药物质量控制提供有效手段ꎮ关键词:单克隆抗体ꎻN糖ꎻPNGaseF酶DOI:10.19586/j.2095 ̄2341.2021.0005中图分类号:Q819ꎬR97㊀㊀㊀文献标识码:AOptimizationofHydrolysisConditionsofN ̄glycanfromMonoclonalAntibodiesbyPNGaseF㊀ZHANGBohuiꎬJIADaihuiꎬCHENGQianꎬXUJunyan∗ꎬSHAOZheꎬHUANGYingfengDrugAnalysisDepartmentꎬDragonboatBiopharmaceuticalCo.ꎬLtdꎬShanghai201203ꎬChinaAbstract:InordertodevelopandoptimizeamethodofhydrolyzingN ̄glycanfrommonoclonalantibodiesbyusingPNGaseFꎬaseriesofexperimentalconditionsꎬincludingbufferpHꎬenzymetypeꎬinstrumentsꎬdegreeofenzymatichydrolysisꎬdenaturingbuffersolutionandenzymedosagewereoptimizedbyusingseveralmonoclonalantibodies.Resultsshowedthatꎬbufferexchanginginto1ˑPBScouldavoidtheconversionofsomemAbsfromG0FtoG0F ̄GNatlowpHandimprovethepeakshape.RapidPNGaseFanddenaturebuffercouldeffectivelyimprovetheefficiencyofenzymatichydrolysis.CombinationofUPLCandchromatographiccolumnwith1.7μmparticlesizecouldimprovetheresolution.IncompleteenzymatichydrolysiscouldaffecttheresultsofN ̄glycancontent.ResultsindicatedthattheoptimizedhydrolyzingconditionsofPNGaseFcanquicklyandeffectivelyhydrolyzetheN ̄glycanfromthemonoclonalantibodyꎬwhichcanprovideaneffectivemethodforcontrollingN ̄glycancontentincelllinescreeningandqualitycontrolofmonoclonalantibodydrugs.Keywords:monoclonalantibodyꎻN ̄glycanꎻpeptideNglycosidaseF(PNGaseF)㊀㊀N糖基化修饰是单克隆抗体药物普遍存在的翻译后修饰现象ꎮ目前研究表明ꎬ糖基化修饰与单克隆抗体药物的功能㊁药物代谢㊁免疫原性等关系密切[1 ̄3]ꎬ如核心岩藻糖缺失能显著增强ADCC效应[4]ꎬ半乳糖能够增强CDC活性[5]ꎻ末端N ̄乙酰葡萄糖影响抗体药物半衰期[6 ̄7]ꎻ唾液酸化糖型具有抗炎症功能[8]ꎻα(1 ̄3)半乳糖和NGNA型唾液酸易引起免疫原性[9]等ꎮN糖对抗体结构也具有重要作用ꎬ能稳定CH2结构域ꎬ去糖抗体稳定性会变差ꎬ更易发生去折叠和聚集[10]ꎮN糖类型和含量受细胞株㊁培养条件㊁纯化和储存[11 ̄13]等过程的影响ꎬ因此在单抗药物细胞筛选㊁工艺优化㊁纯化㊁产品放行和稳定性考察中控制和监测N糖含量ꎬ保证单抗药物安全性㊁有效性等尤为重要ꎮ目前检测N糖的方法主要有亲水色谱-荧光法[14]㊁CE ̄LIF法[15 ̄16]和质谱法[17 ̄18]. All Rights Reserved.等ꎮ其中亲水色谱-荧光法是目前应用最为广泛的方法ꎬ该方法通常需要用糖苷酶水解糖蛋白上的N糖链ꎬ再用标记试剂进行衍生化ꎬ采用亲水色谱柱分离ꎬ荧光检测器检测ꎮ由于PNGaseF几乎能水解所有哺乳动物细胞产生的N糖ꎬ因此得到广泛应用[19]ꎮ传统的N糖谱检测方法一般耗时较长ꎬ目前快速N糖样品制备的试剂盒已经商品化ꎬ大幅提高了N糖的检测效率ꎬ但是通常价格昂贵ꎮ而应用快速PNGaseF酶与传统制备过程相组合成为提高检测效率和降低检测成本的一种选择ꎮ本研究基于亲水色谱-荧光法ꎬ针对PNGaseF水解条件进行了优化ꎬ发现和解决了酶解过程中易对结果产生影响的一些因素ꎬ建立了高效准确的N糖检测方法ꎬ以期为N糖的检测研究提供参考ꎮ1㊀材料与方法1.1㊀实验材料1.1.1㊀供试品㊀本研究所用mAb1㊁mAb2和mAb2 ̄F均为宝船生物医药科技(上海)有限公司生产的IgG1型单克隆抗体ꎮ1.1.2㊀试剂和耗材㊀N糖苷酶F(PNGaseF)㊁快速PNGaseF酶(rapidPNGaseF)及变性缓冲液(5ˑ)均购自NewEnglandBioLabs公司ꎻ无水乙醇㊁甲酸铵㊁乙酸㊁二甲基亚砜(DMSO)㊁2 ̄氨基苯甲酰胺(2 ̄AB)㊁氰基硼氢化钠㊁β ̄巯基乙醇等均购自Sigma公司ꎻ甲酸和乙腈购自Fisher公司ꎻPBSBuffer(1ˑ)购自上海生工ꎻ10kD超滤离心管购自Merck公司ꎻ100mmol L-1Tris ̄HCl(含1%SDSꎬpH9.0)溶液和非涂层-熔融石英毛细管购自Beckman公司ꎻ纯化柱(GlycoCleanTMSCartridges)购自Prozyme公司ꎻ色谱柱ACQUITYUPLCGlycanBEHAmideColumn(1.7μmꎬ2.1mmˑ150mm)购自Waters公司ꎻ色谱柱AdvanceBioGlycanMappingColumn(2.7μmꎬ4.6mmˑ150mm)购自Agilent公司ꎮ1.1.3㊀主要仪器设备㊀高效液相系统(HPLCꎬ1260)购自Agilent公司ꎻ超高效液相系统(UPLCꎬH ̄ClassPlus)购自美国Waters公司ꎻ液质联用系统(LC ̄MSꎬQExactive)和数据处理软件(BiopharmaFinder)均购自美国Thermo公司ꎻ毛细管电泳仪(CEꎬPA800Plus)购自Beckman公司ꎻ真空离心浓缩干燥仪(RVC2 ̄25)购自德国Christ公司ꎮ1.2㊀实验方法1.2.1㊀蛋白沉淀和N糖衍生化㊀向酶解后的样品中加入3倍体积的冰乙醇ꎬ-15~-25ħ放置约1hꎬ高速离心10minꎬ取上清干燥ꎮ加入10μL2 ̄AB衍生化试剂ꎬ65ħ避光孵育3hꎮ用纯化柱纯化后干燥ꎬ50%乙腈复溶ꎬ准备上机分析ꎮ1.2.2㊀HPLC色谱条件㊀仪器采用高效液相系统(Agilentꎬ1260)ꎻ色谱柱采用AdvanceBioGlycanMappingColumnꎻ流动相A为100mmol L-1甲酸铵(pH4.5)ꎬ流动相B为100%乙腈ꎻ进样量2μLꎻ流速0.5mL min-1ꎻ荧光检测器激发波长260nmꎬ发射波长430nmꎻ色谱柱温度55ħꎻ梯度洗脱ꎮ1.2.3㊀UPLC色谱条件㊀仪器采用超高效液相系统(WatersꎬH ̄classplus)ꎬ色谱柱采用ACQUITYUPLCGlycanBEHAmideColumnꎮ流动相A为100mmol L-1甲酸铵(pH4.5)ꎬ流动相B为100%乙腈ꎬ进样量2μLꎬ流速0.5mL min-1ꎬ荧光检测器激发波长330nmꎬ发射波长420nmꎬ色谱柱温度60ħꎬ梯度洗脱ꎮ1.2.4㊀质谱参数㊀应用液质联用系统(LC ̄MSꎬQExactive)的HESI正离子模式(HESI+)ꎬ离子源的温度和电压分别为320ħ和3.8kVꎬ离子传输管温度为200ħꎬ其他仪器参数设置均经过优化以获得最佳信号响应ꎻ母离子扫描范围700~3000m z-1ꎬ分离度15000ꎬ分析时长60minꎻ数据处理软件采用BiopharmaFinderꎮ1.2.5㊀还原毛细管凝胶电泳(RCE ̄SDS)㊀将蛋白沉淀用100mmol L-1Tris ̄HCl(含1%SDSꎬpH9.0)溶液复溶ꎬ加入β ̄巯基乙醇还原ꎮ仪器采用毛细管电泳仪(BeckmanꎬPA800plus)ꎬ毛细管采用非涂层-熔融石英毛细管ꎬPDA检测器ꎬ波长220nmꎬ电动进样(-5kV)20sꎬ电压分离(-15kV)40minꎮ2㊀结果与分析2.1㊀缓冲液pH对结果的影响分别将mAb1和mAb2样品调pH至4㊁5㊁6和7ꎬ取200μg进行PNGaseF酶解24hꎬ检测N糖含量ꎮ实验结果如表1和图1所示ꎬmAb2在不512张博慧ꎬ等:利用N糖苷酶F对单克隆抗体N糖酶解条件的优化. All Rights Reserved.同pH缓冲液酶解的N糖含量高度一致ꎬ说明pH对该样品N糖水解无影响ꎻ而mAb1中N糖含量随pH的变化出现明显差异ꎬ其中缓冲液pH为4时ꎬ峰2(p2)含量出现大幅度升高ꎬ相应的峰3(p3)含量明显下降ꎬpH6和7条件下N糖含量基本一致ꎮ表1㊀mAb1和mAb2在不同pH缓冲液中酶解的N糖含量Table1㊀N ̄glycancontentofmAb1andmAb2hydrolyzedindifferentpHbuffer样品名称pHN糖含量/%p1p2p3p4p5p6p7mAb142.023.457.66.23.41.60.453.74.276.65.14.22.20.463.91.379.84.84.32.20.473.91.080.24.74.42.30.4mAb24/7.446.05.324.18.24.85/7.645.85.423.98.24.86/7.645.75.424.08.24.97/7.445.75.424.08.24.9图1㊀mAb1和mAb2在不同pH缓冲液中酶解的N糖色谱图Fig.1㊀N ̄glycanchromatogramofmAb1andmAb2hydrolyzedindifferentpHbuffer612生物技术进展CurrentBiotechnology. All Rights Reserved.㊀㊀将mAb1不同pH酶解后的蛋白进行还原CE ̄SDS检测ꎬ结果(图2)显示含N糖重链(HC)基本已被酶解成非糖基化重链(NGHC)ꎬ说明不同pH缓冲液下PNGaseF酶解N糖24h后均酶解完全ꎬN糖含量的变化并非不完全酶解造成ꎮ利用液质联用鉴定各N糖的种类ꎬp2和p3分别为G0F ̄GN(A1F)和G0F(A2F)ꎮ通过比较不同时间(1㊁8和24h)酶解结果(表2)ꎬ发现缓冲液pH为4和5时ꎬp2和p3含量的变化随着酶解时间的增加而呈梯度变化ꎬpH4时尤为明显ꎻpH为6和7时ꎬ变化不明显ꎮ因此推测在某些单抗分子上ꎬG0F上的N ̄乙酰氨基葡萄糖在低pH条件下易从N糖链上脱落ꎬ使G0F形成G0F ̄GNꎬ从而引起G0F ̄GN和G0F含量的变化ꎮ因此在进行PNGaseF酶解时ꎬ应避免酶解体系中pH过低ꎮ图2㊀mAb1不同pH酶解蛋白RCE ̄SDS电泳图Fig.2㊀ReducedCE ̄SDSofdeglycoproteinfrommAb1hydrolyzedindifferentpHbuffer表2㊀mAb1在不同pH缓冲液中酶解不同时间的N糖含量Table2㊀N ̄glycancontentofmAb1hydrolyzedindifferentpHbufferatdifferenttimespH时间/hN糖含量/%p1p2p3p4p5p6p7Man4G0F ̄GNG0FMan5G1FaG1FbG2F419.31.070.78.04.51.90.883.47.373.05.84.32.00.4242.023.457.66.23.41.60.4514.50.878.66.04.62.20.483.82.378.55.24.42.30.4243.74.276.65.14.22.20.4614.50.779.15.74.52.20.483.91.080.44.94.42.40.3243.91.379.84.84.32.20.4714.40.779.75.44.52.20.483.90.880.44.84.42.40.3243.91.080.24.74.42.30.4712张博慧ꎬ等:利用N糖苷酶F对单克隆抗体N糖酶解条件的优化. All Rights Reserved.2.2㊀置换缓冲液的选择为避免样品缓冲液pH及成分对PNGaseF酶解的影响ꎬ用超滤离心管将样品换液至合适的溶液中再进行PNGaseF酶解ꎮ本研究选择了1ˑPBS溶液(pH7.4)和超纯水分别置换mAb1和mAb2的样品缓冲液ꎬ以未置换缓冲液(pH7)为对照ꎬPNGaseF酶解24hꎬ进行N糖谱检测ꎮN糖色谱图和含量分别见表3和图3ꎬ结果表明1ˑPBS溶液㊁超纯水和样品缓冲液(pH7)的N糖谱结果一致ꎮ因为蛋白在超纯水中稳定性较差ꎬ所以本研究选用1ˑPBS溶液(pH7.4)置换样品的缓冲液ꎮ表3㊀mAb1和mAb2在样品缓冲液㊁1ˑPBS和超纯水中的N糖含量Table3㊀N ̄glycancontentofmAb1andmAb2hydrolyzedinsamplebufferꎬ1ˑPBSandwater样品名称缓冲液N糖含量/%p1p2p3p4p5p6p7mAb1样品缓冲液(pH7)3.91.080.24.74.42.30.41ˑPBS3.90.880.44.84.42.40.3超纯水3.91.080.44.94.42.40.3mAb2样品缓冲液(pH7)/7.445.75.424.08.24.91ˑPBS/7.645.95.424.08.24.8超纯水/7.745.85.424.08.24.8图3㊀mAb1和mAb2在样品缓冲液㊁1ˑPBS和超纯水中的N糖色谱图Fig.3㊀N ̄glycanprofilesofmAb1andmAb2hydrolyzedinsamplebufferꎬ1ˑPBSandwater2.3㊀不同PNGaseF酶对N糖结果的影响直接取200μg样品ꎬ分别加入快速PNGaseF酶(rapidPNGaseF)和PNGaseF进行酶解ꎬN糖谱如图4所示ꎮ结果显示用rapidPNGaseF进行酶解时ꎬ若选择用UPLC和1.7μm粒径的ACQUITYUPLCGlycanBEHAmideColumn色谱柱ꎬ则由于分离度的提高ꎬmAb2的N糖色谱图(图4B)中G0F和G1Fa出现肩峰ꎬ而HPLC结果812生物技术进展CurrentBiotechnology. All Rights Reserved.A:mAb2未置换缓冲液HPLC检测ꎻB:mAb2未置换缓冲液UPLC检测ꎻC:mAb2置换缓冲液UPLC检测ꎮ图4㊀不同PNGaseF的N糖谱结果Fig.4㊀N ̄glycanprofilesofmAb2hydrolyzedbydifferentPNGaseF(图4A)由于分离度较差ꎬ此峰未得到有效分离ꎮ当将mAb2样品缓冲液置换至1ˑPBS中时(图4C)ꎬ该肩峰消失ꎮ综合2.1~2.3部分的研究结果可知ꎬ将样品置换缓冲液至合适的溶液中再进行PNGaseF酶解ꎬ对改善N糖谱峰形和结果准确度至关重要ꎬ本研究采用了1ˑPBS溶液ꎬ效果良好ꎮ另外ꎬ在置换缓冲液的基础上使用快速PNGaseF能将酶解时间缩短为数十分钟ꎬ有效提高了检测效率ꎮ选择UPLC能有效提高分辨率ꎮ2.4㊀蛋白变性对酶解效率的影响本研究发现ꎬ在非变性条件下利用快速PNGaseF酶解不同单抗所需酶解时间差异明显ꎬ从数分钟至数小时不等ꎮ为了有效提高酶解效率ꎬ选择所需酶解时间最长的mAb2 ̄F置换缓冲液至1ˑPBS中ꎬ加入变性缓冲液(5ˑ)和1μLrapidPNGaseF酶ꎬ50ħ孵育10min后进行N糖谱检测处理ꎬ将沉淀的蛋白进行还原CE ̄SDS检测ꎬ以未加变性缓冲液(5ˑ)样品为对照ꎮ由图5还原CE ̄SDS结果可知ꎬ相同的酶解时间条件下ꎬ蛋白变性后由于高级结构被破坏ꎬN糖充分暴露与酶接触ꎬ所以其酶解效果更好ꎮ2.5㊀酶解程度对N糖结果的影响在非变性条件下加入不同体积的rapidPNGaseF酶对mAb2 ̄F进行N糖谱检测处理ꎬ将沉淀的蛋白进行还原CE ̄SDS检测ꎬ以加入变性缓冲液(5ˑ)和1μLrapidPNGaseF酶的样品为对照ꎬ酶解条件均选择50ħ㊁10minꎮ由图6(左)912张博慧ꎬ等:利用N糖苷酶F对单克隆抗体N糖酶解条件的优化. All Rights Reserved.可知ꎬ在非变性条件下酶解相同时间ꎬ酶量的增加使非糖基化组分增多ꎬ但酶量增加至2μL时酶解效果仍较差ꎬ而变性条件下用1μLrapidPNGaseF酶解ꎬ糖基化组分基本被转换成非糖基化组分ꎮN糖水解的程度不同ꎬN糖含量(表4)明显成梯度变化ꎬ说明PNGaseF对不同类型的N糖水解效率不同ꎬ因此为了获得样品中真实的N糖含量水平ꎬ应将N糖尽量酶解完全ꎮ图5㊀mAb2 ̄F在变性和非变性条件下切糖后还原CE ̄SDS图谱Fig.5㊀RCE ̄SDSprofilesofmAb2 ̄Fdeglycatedinnatureanddenatureconditions表4㊀不同体积rapidPNGaseF酶解mAb2 ̄F的N糖含量Table4㊀N ̄glycancontentofmAb2 ̄FdeglycatedbydifferentrapidPNGaseFamountRapidPNGaseF/μLN糖含量/%G0Man5G1aG1bG20.543.418.418.45.52.61.048.012.920.16.42.92.054.57.921.27.33.11+变性55.27.520.08.03.13㊀讨论N糖检测结果的准确性受多种因素的影响ꎮ在缓冲液pH对PNGaseF酶解的影响研究中发现ꎬ低pH能使某些单抗在酶解过程中G0F逐渐转化为G0F ̄GNꎬ造成检测结果的严重偏差ꎬ这种情况通常出现在ProteinA亲和纯化后的样本ꎬ在低pH洗脱后直接进行酶解ꎬ若先将样品缓冲液pH调至中性或进行换液处理ꎬ能够避免pH的影响ꎮ对照mAb2置换和未置换样品缓冲液酶解结果ꎬ置换缓冲液能有效消除G0F和G1Fa的肩峰ꎬ消除样品缓冲液成分对检测结果的影响ꎮ另外ꎬ本研究对多种单抗的研究发现ꎬ酶解程度不同的N糖检测结果存在明显差异ꎬ说明N糖苷酶F对不同类型的N糖水解效率不同ꎬ这与已有文献报道[20]一致ꎮ因此为了获得样品中真实的N糖含量水平ꎬ应将N糖尽量酶解完全ꎮ酶解程度可采用将蛋白沉淀进行还原CE ̄SDS检测ꎬ观察非糖基化组分含量的变化情况ꎮ在细胞株筛选和工艺优化阶段ꎬ快速㊁准确的N糖检测结果能够有效推进开发进度ꎬ而该阶段022生物技术进展CurrentBiotechnology. All Rights Reserved.图6㊀不同体积rapidPNGaseF酶解mAb2 ̄F的RCE ̄SDS和N糖谱图Fig.6㊀N ̄glycanandRCE ̄SDSprofilesofmAb2 ̄FdeglycatedbydifferentrapidPNGaseFamount巨大的样本量又对成本控制提出更高的要求ꎬ因此建立一种高效㊁准确且低成本的N糖检测方法尤为重要ꎮ本研究确定了较为通用的PNGaseF酶对单克隆抗体的酶解条件ꎬ即为将样品置换缓冲液至1ˑPBSꎬ取适量样品加入变性缓冲液(5ˑ)和1μLRapidPNGaseF酶ꎬ50ħ孵育10minꎬ进行后续除蛋白㊁干燥等处理ꎬ快速PNGaseF酶和变性处理的应用ꎬ将酶解时间大幅缩短ꎬ提高了检测效率ꎻ同时采用传统的UPLC和ACQUITYUPLCGlycanBEHAmideColumn色谱柱ꎬ有效提高了分离度ꎬ并控制了检测成本ꎮ参㊀考㊀文㊀献[1]㊀FRIESSWꎬSEIDLAꎬSOERGELFꎬetal..N ̄glycosylationheterogeneityandtheinfluenceonstructureꎬfunctionandphar ̄macokineticsofmonoclonalantibodiesandFcfusionproteins[J].Eur.J.Pharm.Biopharm.ꎬ2016ꎬ100:94-100. [2]㊀刘晓宇.单克隆抗体糖基化修饰的研究现状和进展[J].中国生物制品学杂志ꎬ2020ꎬ33(2):216-221. [3]㊀LIUL.Antibodyglycosylationanditsimpactonthepharmaco ̄kineticsandpharmacodynamicsofmonoclonalantibodiesandFc ̄fusionproteins[J].J.Pharm.Sci.ꎬ2015ꎬ104(6):1866-1884.[4]㊀SHIELDSRLꎬLAIJꎬKECKRꎬetal..Lackoffucoseonhu ̄manIgG1N ̄linkedoligosaccharideimprovesbindingtohumanFcgammaRIIIandantibody ̄dependentcellulartoxicity[J].J.Biol.Chem.ꎬ2002ꎬ277:26733-26740.[5]㊀BOYDPNꎬLINESACꎬPATELAK.Theeffectofthere ̄movalofsialicacidꎬgalactoseandtotalcarbohydrateonthefunctionalactivityofCampath ̄1H[J].Mol.Immunol.ꎬ1995ꎬ32:1311-1318.[6]㊀JONESAJꎬPAPACDIꎬCHINEHꎬetal..Selectiveclear ̄122张博慧ꎬ等:利用N糖苷酶F对单克隆抗体N糖酶解条件的优化. All Rights Reserved.anceofglycoformsofacomplexglycoproteinpharmaceuticalcausedbyterminalN ̄acetylglucosamineissimilarinhumansandcynomolgusmonkeys[J].Glycobiologyꎬ2007ꎬ17:529-540.[7]㊀KECKRꎬNAYAKNꎬLERNERLꎬetal..CharacterizationofacomplexglycoproteinwhosevariablemetabolicclearanceinhumanisdependentonterminalN ̄acetylglucosaminecontent[J].Biologicalsꎬ2008ꎬ36:49-60.[8]㊀NIMMERJAHNFꎬRAVETCHJV.Theanti ̄inflammatoryac ̄tivityofIgG:theintravenousIgGparadox[J].J.Exp.Med.ꎬ2007ꎬ204:11-15.[9]㊀王冲ꎬ郭怀祖.不同细胞系表达的抗EGFR单抗糖基化结构对比分析[J].生物工程学报ꎬ2017ꎬ33(6):1018-1027. [10]㊀ZHENGKꎬBANTOGCꎬBAYERR.Theimpactofglycosyla ̄tiononmonoclonalantibodyconformationandstability[J].MAbsꎬ2011ꎬ3:568-576.[11]㊀KILDEGAARDHFꎬFANYZꎬSENJWꎬetal..Glycoprofil ̄ingeffectsofmediaadditivesonIgGproducedbyCHOcellsinfed ̄batchbioreactors[J].Biotechnol.Bioengin.ꎬ2016ꎬ113(2):359-366.[12]㊀BENJAMINDꎬNEHAMꎬMICHAELB.Alowredoxpotentialaffectsmonoclonalantibodyassemblyandglycosylationincellculture[J].J.Biotechnol.ꎬ2017ꎬ246:71-80.[13]㊀STEFANFꎬJOERGHꎬHANNS ̄CHRISTIANM.Glycationduringstorageandadministrationofmonoclonalantibodyformu ̄lations[J].Eur.J.Pharm.Biopharm.ꎬ2008ꎬ70:42-50. [14]㊀丛宇婷ꎬ胡良海.单克隆抗体药物糖基化修饰分析研究进展[J].色谱ꎬ2016ꎬ34(12):1186-1191.[15]㊀MELISSAHꎬYANGWꎬRICHARDR.CharacterizationofN ̄linkedglycosylationinamonoclonalantibodyproducedinNS0cellsusingcapillaryelectrophoresiswithlaser ̄inducedfluores ̄cencedetection[J].Pharmaceuticalsꎬ2013ꎬ6:393-406. [16]㊀GENNAROLAꎬSALAS ̄SOLANOO.On ̄lineCE ̄LIF ̄MStechnologyforthedirectcharacterizationofN ̄linkedglycansfromtherapeuticantibodies[J].Analyt.Chem.ꎬ2008ꎬ80:3838-3845.[17]㊀李媛ꎬ邱建华ꎬ陈家琪ꎬ等.液相色谱-质谱技术对利妥昔单抗及其类似药结构表征和相似性的研究[J].国际生物制品学杂志ꎬ2016ꎬ39(3):116-121.[18]㊀CHENXꎬFLYNNGC.AnalysisofN ̄glycansfromrecombinantimmunoglobulinGbyon ̄linereversed ̄phasehigh ̄performanceliquidchromatography/massspectrometry[J].An ̄alyt.Biochem.ꎬ2007ꎬ370:147-161.[19]㊀TARENTINOALꎬGÓMEZCMꎬPLUMMERTHJ.Deglyco ̄sylationofasparagine ̄linkedglycansbypeptide:N ̄glycosidaseF[J].Bio ̄chemistryꎬ1985ꎬ24:4665-4671.[20]㊀HUANGYNꎬRONO.KineticsofN ̄glycanreleasefromhumanimmunoglobulinG(IgG)byPNGaseF:allglycansarenotcreatedequal[J].J.Biomol.Techn.ꎬ2017ꎬ28:150-157.222生物技术进展CurrentBiotechnology. All Rights Reserved.。
抗体药物的名词解释

抗体药物的名词解释抗体药物,是指利用生物技术手段从动物或人体中提取、通过进一步研究与改造得到的一类重要药物。
抗体是免疫系统中的一种蛋白质,能够与特定的抗原结合,并识别并中和病原体,起到免疫防御的作用。
抗体药物的出现给很多难以治疗的疾病带来了新的希望。
一、抗体药物的历史和发展抗体药物的历史可以追溯到19世纪末。
当时,法国微生物学家Emil von Behring首次发现了人的血浆中含有一种可以抵抗破伤风病毒的物质,他将其命名为“抗体”。
这是人类首次对抗体的认识,也为抗体药物的研究启示了一道闪光之光。
随着科技的进步,人们发现利用抗体作为治疗药物具有巨大的潜力。
20世纪,随着生物技术的飞速发展,抗体药物的研究进入了新的时代。
1986年,第一种人源化单克隆抗体药物Orthoclone OKT3在美国获得批准上市,这标志着抗体药物正式进入临床应用阶段。
此后,抗体药物的研究蓬勃发展,不断涌现出一大批重要的抗体药物,为许多疾病的治疗提供了全新的选择。
二、抗体药物的类型根据制备方式和来源,抗体药物主要分为四类:小分子抗体、完全人源抗体、人源化抗体和单克隆抗体。
1. 小分子抗体:小分子抗体是指分子量较小、结构较简单的抗体,通常由1-5个单克隆抗体片段组成。
相对于其他抗体药物,小分子抗体有很好的渗透性和稳定性,能够更容易通过细胞膜,在组织间穿梭,因此对一些具有细胞内靶点的疾病具有独特的药理学优势。
2. 完全人源抗体:完全人源抗体是指完全由人源的抗原决定区(Fab)构成的抗体。
由于与人体自身免疫系统具有较高的相似性,完全人源抗体通常具有较好的稳定性和生物相容性,在潜在的免疫系统相关问题上风险较小。
3. 人源化抗体:人源化抗体是指将小鼠或其他动物源的抗体框架与人类Fc区域结合的抗体。
人源化抗体的结构介于完全人源抗体和小鼠抗体之间,既保留了小鼠源抗体的抗原识别能力,又减小了免疫反应的发生。
4. 单克隆抗体:单克隆抗体是指由具有相同抗原特异性的单个抗体细胞克隆而获得的抗体。
生物制药中的表达系统选择和使用注意事项

生物制药中的表达系统选择和使用注意事项生物制药是一项利用生物学原理和技术来生产药物的领域,其中表达系统的选择和使用是至关重要的步骤。
表达系统是指将目标基因转录成mRNA并翻译成蛋白质的系统,它直接关系到生物制药中药物产量、质量和效力等方面。
在选择和使用表达系统时,需要考虑多种因素,包括目标蛋白的性质、产量要求、系统稳定性和成本效益等。
首先,选择表达系统时需要考虑目标蛋白的性质。
不同的蛋白质具有不同的结构和功能,因此需要根据目标蛋白是否是酶、激素、抗体等来选择合适的表达系统。
例如,如果目标蛋白是细胞内酶,可以考虑使用大肠杆菌表达系统,因为大肠杆菌对这类蛋白的表达效果较好。
而如果目标蛋白是复杂的膜蛋白,可以考虑使用哺乳动物细胞表达系统,因为哺乳动物细胞具有更接近人体细胞的表达环境。
其次,生物制药中的表达系统选择还需考虑产量要求。
不同的表达系统对蛋白质的表达能力有所差异,选择合适的表达系统可以提高蛋白质的产量。
例如,选择细胞系表达系统时,可以选择具有高复制和表达能力的细胞系,如CHO细胞。
此外,一些表达系统还可以通过基因工程技术增加蛋白质的产量。
例如,可以通过插入多个目标基因拷贝、优化启动子序列和信使RNA的稳定性等方式来提高表达系统的产量。
同时,选择表达系统还需要考虑系统的稳定性。
所谓稳定性指的是表达系统能否持续稳定地表达目标蛋白。
在生物制药中,长时间和稳定的表达对于大规模生产药物至关重要。
因此,选择具有稳定表达能力的表达系统非常重要。
例如,大肠杆菌表达系统常常因为由于毒力基因的表达而导致大规模突变,从而降低了系统的稳定性。
而哺乳动物细胞表达系统,虽然表达系统稳定性较高,但细胞系的稳定性会受到外界环境的影响。
此外,成本效益也是选择表达系统时需要考虑的因素。
不同的表达系统所需的设备、耗材和操作成本都不同。
因此,在选择表达系统时,需要综合考虑产量要求和成本效益。
对于小规模生产或科研用途而言,大肠杆菌表达系统通常是较为经济的选择;而对于大规模生产企业而言,哺乳动物细胞表达系统可能更具成本效益。
重组蛋白的表达系统(详细版)

• 融合标签: • 融合标签是与目的蛋白共表达的一段多肽,方便重组蛋白的纯化、固定和检测,表3给出了常用的重组
标签。如果不需要对重组蛋白进行纯化,尽量不要引入融合标签,以免影响蛋白性质;如果重组蛋白本 身能够结合某种亲和柱,如某些金属结合蛋白可以结合Ni-NTA,某些糖结合蛋白能够特异识别糖类,也 不必引入标签。 • 融合标签的引入能够大大简化重组蛋白的纯化流程,并提高蛋白溶解度。商业化表达质粒,如pET、 pGEX等提供了各种纯化标签和融合蛋白供选,应根据蛋白具体情况进行选择。 • His-tag是最常用的纯化标签,它具有很多优点:标签较短(10-20个氨基酸残基),不带电(pH8.0), 免疫原性差,通常不影响重组蛋白的结构和功能,Ni2+亲和力高,能够通过一步纯化达到60%-90%的纯 度。 • 如果蛋白质溶解度不高,导致折叠困难、表达量低,可以选择较大的融合标签(GST、MBP、Trx等)帮 助重组蛋白表达和折叠,提高重组蛋白溶解度,从而提高表达量。较大的融合标签有时也会导致翻译困 难甚至提前中止,纯化后发现大部分都是标签蛋白也是常见现象。翻译的提前中止会大大影响重组蛋白 产率和后续纯化,所以在短标签能够达到目的的时候,尽量不要选择大的融合标签。 • 标签位置的选择也很重要:N端标签(短的或长的)自身带有启动子和适应宿主偏好的密码子,可以帮 助目的蛋白表达,提高表达量,但是提前中止翻译的蛋白片段也会被一并纯化出来,降低重组蛋白纯度, 对蛋白酶敏感的、自身容易降解的以及一级序列中有集中的疏水残基区的蛋白尤其要避免使用N端标签; C端标签则可以保证只有完整蛋白得到纯化。另外,如果蛋白的近N端或近C端有重要功能区,如酶活中 心、配体结合位点、二硫键、多聚体稳定界面、相互作用界面等,则要避免纯化标签位于该末端,以免 影响重组蛋白的结构和功能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Brand Name Target中文名分子形式表达体系Orthoclone OKT3CD3英罗单抗鼠源小鼠骨髓瘤细胞
ReoPro 血小板糖蛋Ib/IIIa
阿昔单抗嵌合
小鼠骨髓瘤细胞
Rituxan/MabThera CD20利妥昔单抗嵌合CHO
Zenapax IL-2R达利珠单抗人源化NS0
Simulect IL-2R巴利昔单抗嵌合小鼠骨髓瘤细胞Synagis RSVF帕利珠单抗人源化小鼠骨髓瘤细胞Remicade TNF-a英夫利昔单抗嵌合Sp2/0 Herceptin HER2曲妥珠单抗人源化CHO
Enbrel TNF-a依那西普融合蛋白CHO
Mylotarg CD33吉妥单抗ADC NS0 Campath/abCampath
/Lemtrada CD52阿仑单抗人源化CHO
Zevalin CD20替伊莫单抗鼠源CHO
Humira TNF-a阿达木单抗全人源CHO
Amevive CD2阿法赛特融合蛋白CHO
Xolair IgE奥马珠单抗人源化CHO
Bexxar CD20托莫西单抗鼠源小鼠骨髓瘤细胞Raptiva CDlla伊法珠单抗人源化CHO
Erbitux EGFR西妥昔单抗嵌合小鼠骨髓瘤细胞Avastin VEGFK贝伐珠单抗人源化CHO
Tysabriα4β7 Integrin那他珠单抗人源化小鼠骨髓瘤细胞
Actemra/Ro Aclemra IL-6R脱利珠单抗人源化
mammalian cell
line
Orencia CD80.CD60阿西巴普融合蛋白mammalian cell
line
Lucentis VEGFR雷珠单抗人源化 E.coli Vectibix EGFR帕尼单抗全人源CHO Soliris补体C5艾库组单抗人源化小鼠骨髓瘤细胞Arcalysl IL-1利洛纳赛融合蛋白CHO
Cimzia TNF-a赛妥珠单抗人源化 E.coli
Stelara IL-12, IL-23优特克单抗全人源Sp2/0
Removab EpCAM/CD 3/Fc
receptors
卡妥索单抗双特异性抗体杂交瘤细胞
Simponi/Simponi
aria
TNF-a戈利木单抗全人源Sp2/0 Haris IL-lβ康纳单抗全人源Sp2/0 Arzerra CD20奥法木单抗全人源NSO Prolia RANK狄诺塞麦全人源CHO Yervoy CTLA-4伊匹单抗全人源CHO Benlysta BLyS贝利单抗全人源NSO Nulojix CD80, CD86贝拉西普融合蛋白CHO Adcetris CD30ADC CHO Eylea VEGFA、 PIGF阿柏西普融合蛋白CHO Poteligeo CCR4人源化CHO Perjeta HER2帕妥珠单抗人源化CHO Abthrax PA瑞西巴库单抗全人源
Zaltrap VEGF、 PIGF阿柏西普融合蛋白CHO
Kadcyla HER2曲妥珠单抗- 美
登素
ADC CHO
Gazyva/Gazyvaro CD20人源化CHO
63抗体药表达系统
郎沐VEGF、 PIGF康柏西普融合蛋白CHO Cyramza VEGFR2雷莫芦单抗全人源NSO Sylvant IL-6R西妥昔单抗嵌合抗体CHO Entyvioα4β7维多珠单抗人源化CHO Opdivo PD-I纳武单抗全人源CHO Keytruda PD-I帕母单抗人源化
Blincyto CD3、CD19双特异性抗体CHO Cosentyx IL-17苏金单抗全人源CHO Unituxin GD2融合蛋白Sp2/0 Darzalex CD38全人源CHO Praluent PCSK9全人源CHO Repatha PCSK9全人源CHO Portrazza EGFR全人源NSO Empliciti SLAMF7人源化NSO Nucala IL-5芙泊利单抗人源化CHO Praxbind Dabigatran人源化CHO Cinqair IL-5人源化NSO
Taltz IL-17人源化mammalian ceil
1 ine
注:动物细胞是未明确种类的细跑系,空白部分是缺失
结构分子量剂甩
注射剂Fab47615注射剂
IgG1145kDa注射剂
IgG1注射剂
IgG1l44kDa冻干粉针
IgG1148kDa注射剂
IgG1149kDa冻干粉针
IgG1185kDa冻干粉针TNFR ligand-IgG1
Fc
150kDa冻下粉计/注射剂IgG4151-153kDa冻干粉针
IgG1150kDa注射剂
IgG1148kDa注射剂
IgG1148kDa注射剂LFA3-IgG1 Fc91.4kDa冻干粉针IgG1149kDa冻干粉针
IgG2150kDa注射剂
IgG1150kDa冻干粉针
IgG1152kDa注射剂
IgG1149kDa注射剂
IgG4149kDa注射剂
IgG1148kDa注射剂
IgG192kDa
冻干粉针IgGl Fab48kDa注射剂IgG2147kDa注射剂
IgG2/4148kDa注射剂
IgG1251kDa冻干粉针
PEG-Fab 90kDa Fab+40kDa
PEG
冻干粉针/注射剂
IgG1148-l49kDa注射剂
IgG1150-l5lkDa注射剂
IgG1145kDa注射剂
IgG1149kDa注射剂
IgG2147kDa注射剂
IgG1注射剂
IgG1147kDa冻干粉针CTLA-4-IgG1 Fc90kDa冻干粉针mAb- MMAE153kDa注射剂VEGF1/2-IgGl Fc115kDa注射剂IgG1149kDa注射剂
IgG1l48kDa注射剂VEGF1/2-IgGl Fc115kDa注射剂
(IgGl)T- DM1冻干粉针IgG1150kDa注射剂
VEGF1/2-IgGl Fc注射剂IgG1147kDa注射剂
IgGl冻干粉针
IgGl147kDa冻干粉针
IgG4146kDa注射剂
IgG4149kDa冻干粉针
54kDa冻干粉针IgGl15lkDa注射剂
IgGl注射剂
IgGl l48kDa注射剂
IgGl146kDa注射剂
IgG2144kDa注射剂
IgGl I45kDa注射剂
IgGl l48kDa冻干粉针
IgGl149kDa冻干粉针IgGl Fab47766注射剂IgG4147kDa注射剂
IgG4146kDa注射剂是缺失的数据。
