026-盐酸林可霉素原料药工艺规程
盐酸林可霉素发酵生产工艺流程

盐酸林可霉素发酵生产工艺流程盐酸林可霉素又称为盐酸林可霉素,是一种广谱抗生素,对大多数革兰氏阳性菌和阴性菌都有显著的抑制作用。
因其药效广泛,用途广泛,被广泛用于临床治疗。
林可霉素是通过微生物发酵生产的,下面将介绍盐酸林可霉素的发酵生产工艺流程。
一、菌种培养及活化盐酸林可霉素的生产是通过枯草芽孢杆菌进行发酵的,所以首先需要介绍枯草芽孢杆菌的培养及活化的过程。
首先取出冰冻保存的枯草芽孢杆菌菌种,并在无菌条件下接种到含有适量营养成分的琼脂培养基上,将琼脂培养基培养在37℃、180r/min的条件下培养24-48小时,进行悬浮液接种。
二、发酵罐发酵将经过活化的枯草芽孢杆菌接种到发酵罐中,同时加入适量的发酵培养基,使其处于最佳的生长条件。
根据菌株的特性和不同的发酵工艺,可以控制发酵条件,如温度、pH值、通气量、搅拌速度等,一般来说,控制在不同的阶段有不同的参数要求。
发酵时间一般为48-72小时。
三、枯草芽孢杆菌的收获和提取经过一定时间的发酵后,枯草芽孢杆菌代谢产生的林可霉素逐渐积累在发酵液中。
此时需要进行分离和提取工作。
首先需要分离细菌体和发酵液,目的是得到发酵液中的林可霉素。
然后采用萃取、挥发、结晶等步骤对林可霉素进行提取和纯化。
四、产品精制和成品制备通过提取和纯化后,获得的林可霉素是粗品,还需要进行进一步的精制。
精制工艺主要包括结晶、干燥、粉碎等步骤,最终得到符合规范要求的林可霉素成品。
五、产品包装和贮存经过精制和成品制备后的林可霉素需要进行包装和贮存。
一般来说,林可霉素成品需要进行分装并进行氮气充填,以保持其稳定性。
同时,对产品的贮存条件也有严格的要求,例如要求存放在干燥、阴凉、避光的条件下。
综上所述,盐酸林可霉素的发酵生产工艺流程包括菌种培养和活化、发酵罐发酵、枯草芽孢杆菌的收获和提取、产品精制和成品制备、产品包装和贮存。
通过这一系列工艺步骤,可以成功地完成盐酸林可霉素的生产,满足市场上对该产品的需求。
盐酸林可霉素、硫酸大观霉素可溶性粉生产工艺规程

盐酸林可霉素、硫酸大观霉素可溶性粉生产工艺规程目录1 产品概述2 处方和依据3 工艺流程图4 制剂工艺过程及工艺条件5 原辅材料的预处理6 原辅材料质量标准和检查方法7 中间产品质量标准和检查方法8 成品质量标准和检查方法9 包装规格、包装材料质量标准10 说明书、产品文字说明和标志11 工艺要求12 设备一览表和主要设备生产能力13 技术安全与劳动保护14 劳动组织15 原辅料消耗定额16 包装材料消耗定额17 动力消耗定额18 综合利用与环境保护目的:制定本标准的目的是规范盐酸林可霉素、硫酸大观霉素可溶性粉生产过程,对一定数量的成品所需的起始原辅料和包装材料,以及工艺、加工说明、技术参数、注意事项等进一步标准化。
适用范围:适用于盐酸林可霉素、硫酸大观霉素可溶性粉生产全过程。
责任人:质量部部长、生产部部长、车间主任。
内容:1 产品概述:本品为盐酸林可霉素、硫酸大观霉素可溶性粉。
1.1 产品特点:1.1.1性状:本品为白色或类白色粉末。
1.1.6 贮藏:密闭,在干燥处保存。
1.1.7有效期:二年1.1.8批准文号:2.处方和依据2.1处方:30g盐酸林可霉素: 6.7g (林可霉素)硫酸大观霉素: 13.3g(大观霉素)无水葡萄糖:加至30g2.2处方依据:3生产工艺流程图及环境区域划分示意图4 制剂工艺过程及工艺条件4.1总述:按生产指令领取盐酸林可霉素原料药、硫酸大观霉素原料药和预处理过的无水葡萄糖,将盐酸林可霉素原料药、硫酸大观霉素原料药和预处理过的无水葡萄糖用等量递增法混合均匀,定量分装即可。
4.2分述:4.2.1投料量:为处方量的整数倍。
5 原辅材料的预处理5.1 按生产指令单领取无水葡萄糖粉的预处理按粉碎机操作规程操作,粉碎,使完全通过80目筛。
过筛结束后,检查合格将粉碎好的药粉装入洁净容器,称量、记录,挂上标签,注明品名、批号、数量、日期等,填写中间产品交接单,转入下工序。
进行物料平衡计算,收率97.0%~99.9%。
盐酸林可霉素注射液生产工艺

8
GMS-1A远红外隧道烘箱(PM1-05)
用途 本机广泛用于各种安瓿瓶、易拉瓶、西林瓶 及其它玻璃容器的干燥灭菌,也可供化工、 电子、食品等行业烘烤之用。
9
300L保温加热配液罐(PM1-10)
采用电热管水平插入夹套下部,夹套 内注入加热介质(导热油或水)用电
热管对导热油或水进行加热,产生热
能对罐内物料进行间接加热,配液罐 可用于中药、食品、化工等行业的液
6
主要生产设备:
QCA型超声波洗瓶机(PM1-02)
用途:本机用于水针安瓿瓶、口服液易拉瓶、片剂用黄元瓶的清
洗,也可供其他行业中的玻璃器具,机械零件的清洗。
7
安瓿甩水机
主要用途:该机采用高速旋转离心力来实现 甩干功能供制药厂清洗后的安瓿瓶、易拉瓶 脱水之用,将机注满的玻璃容器甩干,以便 进行烘干灭菌,是口服液,西林瓶安瓿瓶生 产的必备设备。
4
配制罐内,并用少量注射用水洗涤不锈钢桶,洗涤 液一并倒入罐内,搅拌均匀,测pH值后加入配制用 量的活性碳搅拌脱色5分钟,准备过滤。 2、粗滤:钛棒过滤器的滤芯孔径为1.0μm,检查 过滤器的完好性。将配制好的溶液经过过滤器进行 粗滤。过滤时应注意过滤器压力变化,过滤前后注 意滤芯的完整性,滤液泵入500L储液罐内。接到浓 配岗位过滤完成的通知后,加入注射用水至200L用 盐酸或氢氧化钠调PH应在5.0~5.5之间。继续在配 液罐内搅拌30分钟。
5
3、中间品检验:由QA取样送化验室进行中间产品 的检查。操作人员挂上黄色的待检标志,经质量部 出示中间产品合格报告单后,配液罐挂放绿色的合 格标志。 4、精滤:接到灌装通知后,将药液用过滤器进行 精滤,滤芯孔径为0.45μm、0.22μm。精滤好的药 液泵入高位罐,经高位罐输送至灌装间。盐酸林可 霉素注射液的配制、过滤时间应在4小时内完成。
盐酸林可霉素发酵生产工艺流程

盐酸林可霉素发酵生产工艺流程下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!盐酸林可霉素是一种广泛应用于医药领域的抗生素,其发酵生产工艺是通过微生物发酵制备得到的。
A 盐酸林可霉素工艺规程

盐酸林可霉素(无菌粉)工艺规程起草人:日期:年月日审核人:日期:年月日批准人:日期:年月日有效日期:药业有限公司盐酸林可霉素(无菌粉)工艺规程目录1.主题内容 (3)2.适用范围 (3)3.职责 (3)4.产品概述 (4)5.工艺流程图 (4)6.依据 (5)7.操作过程及工艺条件 (5)8.工艺卫生................................................................................................... 错误!未定义书签。
10.原辅料、中间体、包装材料、成品以及工艺用水的质量标准和检验操作规程编码。
(10)11.物料平衡 (10)12.技术经济指标的计算及原料、辅料、包装材料消耗定额 (11)13.技术安全及劳动保护 (11)14.劳动组织与单位劳动定额、产品生产周期 (12)15.设备 (13)16.综合利用和环境保护 (13)17.附录 (14)1.主题内容本标准规定了原料药××××生产全过程的工艺技术、质量、物耗、安全、工艺卫生等内容,符合GMP规范要求。
本工艺规程具有技术法规作用。
2.适用范围本标准适用于原料药××××生产全过程,是各部门共同遵循的技术准则。
3.职责起草:原料车间主任审核:生产工程部经理、质量部经理批准:质量副总执行批准:QA主任执行:各级生产质量管理人员及操作人员监督管理:生产质量管理人员4.产品概述4.1.产品名称4.1.1.通用名:××××4.1.2.汉语拼音名:Yansuan Linkemeisu英文名:Lincomycin Hydrochloride4.1.3.产品概述4.1.4.主要成份:本品为****。
分子式:C18H34N2O6S2·HCl·H2O,分子量:461.02;分子结构式:按干燥品计算,含×××不得少于98.5%。
009.盐酸林可霉素片工艺规程
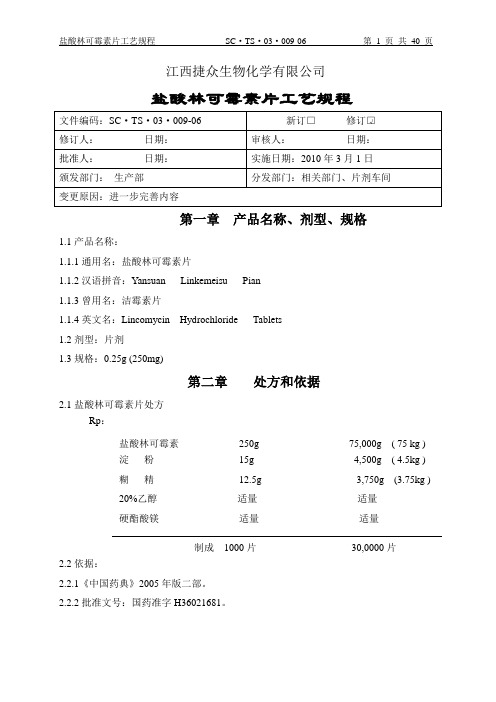
江西捷众生物化学有限公司盐酸林可霉素片工艺规程第一章产品名称、剂型、规格1.1产品名称:1.1.1通用名:盐酸林可霉素片1.1.2汉语拼音:Yansuan Linkemeisu Pian1.1.3曾用名:洁霉素片1.1.4英文名:Lincomycin Hydrochloride Tablets1.2剂型:片剂1.3规格:0.25g (250mg)第二章处方和依据2.1盐酸林可霉素片处方Rp:盐酸林可霉素250g 75,000g ( 75 kg )淀粉15g 4,500g ( 4.5kg )糊精12.5g 3,750g (3.75kg )20%乙醇适量适量硬酯酸镁适量适量制成1000片30,0000片2.2依据:2.2.1《中国药典》2005年版二部。
2.2.2批准文号:国药准字H36021681。
第三章工艺流程3.1片剂车间工艺流程图及区域图第四章操作过程与工艺条件4.1原辅料处理4.1.1操作过程4.1.1.1物料脱外包装经缓冲间,发现内包装有污物时用75%乙醇擦试,并贴上物料状态标示卡,方能进原辅料物暂存间。
4.1.1.2需粉碎的原辅料应进行粉碎、过筛。
4.1.1.3不需粉碎的原辅料用100~120目过筛。
4.1.2工艺条件4.1.2.1粉碎和过筛前核对品名、物料编号、批号、规格、重量、日期和操作者。
4.1.2.2粉碎和过筛应先开启除尘装置。
4.1.2.3料袋、筛网在每次使用前后,检查磨损和破裂情况,发现问题查明原因并及时更换。
4.1.2.4粉碎和过筛后原辅料细粉应在100~120目。
4.2称量4.2.1操作过程4.2.1.1按生产指令和要求分别核对原辅料品名、物料编号、规格、批号、生产厂家。
4.2.1.2按生产指令(配制指令)分别称取原辅料。
4.2.2工艺条件4.2.2.1处方(投料)量计算,称量及投料必须双人复核,操作者及复核者均应在记录上签名。
4.2.2.2称好的物料及时送配制间进行配制。
盐酸林可霉素注射液生产工艺

体物料贮存,配液罐节能、浓缩、生
产能力强、清洗方便、结构简单等优 点。储罐可作储料罐、混料罐、暂存
罐、调配罐。
300L保温加热配液罐(PM1-10)
10
AY系列安瓿印字机
该机是药厂水针包装流水线用于印字 的主要设备,并带调速.本机主要用于 制剂厂针剂安培管形瓶的印字、包装。
11
AAG6/1-2型安瓿拉丝灌封机(PM1-07)
8
GMS-1A远红外隧道烘箱(PM1-05)
用途 本机广泛用于各种安瓿瓶、易拉瓶、西林瓶 及其它玻璃容器的干燥灭菌,也可供化工、 电子、食品等行业烘烤之用。
9
300L保温加热配液罐(PM1-10)
采用电热管水平插入夹套下部,夹套 内注入加热介质(导热油或水)用电
热管对导热油或水进行加热,产生热
能对罐内物料进行间接加热,配液罐 可用于中药、食品、化工等行业的液
6
主要生产设备:
QCA型超声波洗瓶机(PM1-02)
用途:本机用于水针安瓿瓶、口服液易拉瓶、片剂用黄元瓶的清
洗,也可供其他行业中的玻璃器具,机械零件的清洗。
7
安瓿甩水机
主要用途:该机采用高速旋转离心力来实现 甩干功能供制药厂清洗后的安瓿瓶、易拉瓶 脱水之用,将机注满的玻璃容器甩干,以便 进行烘干灭菌,是口服液,西林瓶安瓿瓶生 产的必备设备。
4
配制罐内,并用少量注射用水洗涤不锈钢桶,洗涤 液一并倒入罐内,搅拌均匀,测pH值后加入配制用 量的活性碳搅拌脱色5分钟,准备过滤。 2、粗滤:钛棒Байду номын сангаас滤器的滤芯孔径为1.0μm,检查 过滤器的完好性。将配制好的溶液经过过滤器进行 粗滤。过滤时应注意过滤器压力变化,过滤前后注 意滤芯的完整性,滤液泵入500L储液罐内。接到浓 配岗位过滤完成的通知后,加入注射用水至200L用 盐酸或氢氧化钠调PH应在5.0~5.5之间。继续在配 液罐内搅拌30分钟。
盐酸林可霉素结晶新工艺

序 号 / $ ’ 3 1 % ; 2 9 / ( / / / $ 平均 脱色液 浓度 色级 万 )* 号# -# +, $ % 0 1 1 $ 2 0 2 1 ’ ( 0 / 1 ’ / 0 3 ’ $ ; 0 1 % $ % 0 1 ( $ 2 0 9 ( $ 9 0 2 ( $ 2 0 ; % $ 2 0 ; 9 $ % 0 9 2 ’ / 0 1 ( < 8’ 8$ 83 8’ 8$ 83 8’ 8/ 8/ 0 1 8$ 0 1 8’ 8$ < 丙酮结晶工艺 成品色级 号# 8/ 0 1 8/ 8$ 8$ :( 0 1 8/ 0 1 8$ 8( 0 1 8/ 8/ 8/ 0 1 8/ 收率 # 79 1 0 ( 9 ’ 0 ( 9 ’ 0 1 9 1 0 1 9 3 0 ( 9 ( 0 / 9 % 0 ( 9 1 0 2 9 3 0 1 9 ’ 0 2 9 3 0 ( 9 3 0 % 共沸结晶工艺 成品色级 号# 8( 0 1 8( 0 1 :( 0 1 8( 0 1 8( 0 1 8( 0 1 8( 0 1 8( 0 1 8( 0 1 8( 0 1 8( 0 1 8( 0 1 8( 0 1 收率 # 79 2 0 1 9 9 0 / 9 ; 0 2 9 2 0 / 9 2 0 ’ 9 ; 0 % 9 2 0 ( 9 2 0 9 9 9 0 ’ 9 ; 0 2 9 2 0 3 9 ; 0 9 9 2 0 ’
盐酸克林霉素合成工艺说明书

克林霉素的合成工艺设计设计题目:克林霉素的合成工艺设计(十二)组员:徐文涛王严磊吕功勋峰颖盟专业班级:制药10-2班指导老师:日升、王淮老师设计时间:2012.02.23-2012.03.08克林霉素合成工艺说明书0前言0.1 克林霉素简介抗生素类药物。
为林可霉素的衍生物,自1970年在我国上市。
其用途主要用来对抗引起的各种感染性疾病。
在应用中最常见的不良反应:过敏反应,注射局部刺激和肝功能异常,最严重的是伪膜性肠炎(PMC)。
其结构式为通用名称:克林霉素英文名称:Clindamycin英文别名:Chlorodeoxylincomycin Hydrochloride、Cleocin、Clindamycin Hydrochloride汉语拼音:Kelinmeisu Linsuanzhi Zhusheye中文别名:林大霉素、氯洁霉素、氯林可霉素、氯林肯霉素、氯林霉素、盐酸克林霉素、盐酸氯洁霉素CAS NO. 18323-44-9EINECS 242-209-1分子式C18H33CLN2O5S分子量424.98适应症1.本品适用于革兰氏阳性菌引起的下列各种感染性疾病:(1)扁桃体炎、 克林霉素氯化钠注射液化脓性中耳炎、鼻窦炎等。
(2)急性支气管炎、慢性支气管炎急性发作、肺炎、肺脓肿和支气管扩合并感染等。
(3)皮肤和软组织感染:疖、痈、脓肿、蜂窝组织炎、创伤和手术后感染等。
(4)泌尿系统感染:急性尿道炎、急性肾盂肾炎、前列腺炎等。
(5)其它:骨髓炎、败血症、腹膜炎和口腔感染等。
2.本品适用于厌氧菌引起的各种感染性疾病:(1)脓胸、肺脓肿、厌氧菌引起的肺部感染。
(2)皮肤和软组织感染、败血症。
(3)腹感染:腹膜炎、腹腔脓肿。
(4)女性盆腔及生殖器感染:子宫膜炎、非淋球菌性输卵管及卵巢脓肿、盆腔蜂窝组织炎及妇科手术后感染等.1 工艺概述任务书中给定的合成路线是以林可霉素为起始原料,先后经过Vilsmeier 试剂合成和氯化/醇合成盐两步反应将林可霉素制成克林霉素,其反应方程式为: Vilsmeier 试剂合成DMF+Cl 3C O C OO CCl3N+CClH +Cl 3C O C OO COH Cl Cl氯化/醇合成盐N=CCl ++ DMF1,2-dichlorethane/BHTEt首先DMF 和三光气反应合成Vilsmeier 试剂,然后将得到的Vilsmeier 试剂与林可霉素、1,2—二氯乙烷反应生成克林霉素,产率为90%。
盐酸林可霉素注射液生产工艺规程

制药有限公司盐酸林可霉素注射液生产工艺规程颁发单位:GMP办公室工艺规程批准程目录1. 剂型、规格 (3)2. 生产工艺流程 (3)3. 操作过程及工艺条件 (4)4.质量控制要点 (7)5.设备一览表、主要设备生产能力 (8)6.工艺过程中的SOP (8)7.中间产品的控制 (9)8.验证工作要点 (9)9.工艺验证的具体要求 (10)10.工艺卫生和环境卫生 (10)11.劳动组织及岗位定员 (10)一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。
10ml:3g二、流程图:盐酸林可霉素注射液生产工艺流程图三、操作过程及工艺条件1 生产前的检查与确认1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。
1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。
1.3 所使用原辅料是否准备齐全。
是否有质量检验报告单,合格品才能使用。
1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。
1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。
1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在30%-65%)。
2 洗瓶、干燥灭菌2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。
在理瓶室将安瓶的合格品摆满瓶盘。
2.2清洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯化水洗安瓿瓶内外壁。
将安瓿瓶盘对称放置,固定在甩水机上,启动甩水机,甩水处理8分钟,至安瓶甩干。
重复上述操作。
2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的注射用水清洗安瓿瓶内外壁,重复粗洗步骤。
定时检查安瓿的清洁度:目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。
2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,消除热原。
2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。
盐酸林可霉素发酵生产工艺流程

盐酸林可霉素发酵生产工艺流程盐酸林可霉素发酵生产工艺流程是指在一定条件下利用林可霉菌进行盐酸林可霉素的生产。
The fermentation production process of lincomycin hydrochloride refers to the production of lincomycin hydrochloride using Streptomyces lincolnensis under certain conditions.首先是种子培养阶段,通过在培养基中添加合适的营养物质,促使林可霉菌的生长繁殖。
Firstly, there is the seed cultivation stage, where appropriate nutrients are added to the medium to promote the growth and reproduction of Streptomyces lincolnensis.接着是发酵阶段,将培养好的种子转移到发酵罐中,在适宜的温度、PH值和通气条件下进行发酵过程。
Next is the fermentation stage, where the cultured seeds are transferred to the fermenter, and the fermentation process is carried out at the appropriate temperature, pH, and aeration conditions.在发酵过程中,不断监测发酵液的温度、pH值、溶解氧、产酸量等参数,并及时调节。
During the fermentation process, the temperature, pH value, dissolved oxygen, acid production and other parameters of the fermentation broth are constantly monitored and adjusted in time.发酵过程通常分为初级发酵和后期发酵两个阶段,每个阶段需要控制不同的参数以获得理想的产酸效果。
盐酸克林霉素胶囊生产工艺规程

生产工艺规程XX 药业集团股份有限公司目录一、生产处方1、产品名称和产品代号 (3)2、产品剂型、规格、批量、有效期 (3)3、处方 (3)4、原辅料名称、代号、质量标准及用量 (3)5、产品质量标准 (4)6、工艺流程图 (5)二、生产操作1、生产场所一览表 (6)2、生产设备一览表 (6)3、生产流程 (6)4、中间控制方法及标准 (8)5、收率及物料平衡 (8)6、待包装产品贮存 (9)三、包装操作1、包装场所一览表 (9)2、包装设备一览表 (9)3、包装规格 (10)4、包装材料名称、规格、代号、理论用量及质量标准 (10)5、包装材料样品 (10)6、包装前准备 (10)7、包装流程 (10)8、收率及物料平衡 (11)四、定岗定编五、引用文件六、文件变更记录一、生产处方1、产品名称和产品代号产品名称:盐酸克林霉素胶囊产品代号:082013(×12粒/1板×1板/盒×400盒/件)082014(×12粒/1板×2板/盒×300盒/件)2、产品剂型、规格、批量、有效期剂型:胶囊剂规格:批量:110万粒有效期:24个月3、处方4、原辅料名称、代号、质量标准及用量注:盐酸克林霉素投料量应按原料含量、水分折算到100%,计算公式为: 盐酸克林霉素投料量(kg)=批量(万粒)×1.50kg/ [含量×(1-水分)]5、产品质量标准6、工艺流程图D 级区二、生产操作:1、生产场所一览表2、生产设备一览表3、生产流程配制工序:3.1 凭批生产指令单由班长或现场管理员监督到原辅料室领取合格的克林霉素、淀粉、硬脂酸镁、滑石粉,核对物料品名、代号、批号、规格、数量应与领料单一致,做好原辅料领发台账。
3.2 按批生产指令单称量原辅料(平分四料)和可利用物料。
3.3 领取称量好的原辅料及可利用物料,按称量表、物料标签逐一复核待用物料品名、代号、批号、数量,确认无误后在称量表上签字确认。
林可霉素利多卡因凝胶生产工艺规程

目的:建立林可霉素利多卡因凝胶的生产工艺规程。
范围:林可霉素利多卡因凝胶的生产。
职责:生产管理部、质量管理部、车间主任、班长、工艺员、操作工、QA。
规程:1.品名、剂型与处方依据1.1通用名称:林可霉素利多卡因凝胶汉语拼音:Linkemeisu Liduokayin Ningjiao英文名: Lincomycin Hydrochloride and Lidocaine Hydrochloride Gel 1.2 剂型:凝胶剂1.3 处方与处方依据项的说明1.3.1处方:(制成10000瓶量)盐酸林可霉素 5亿单位盐酸利多卡因 404g雷弗奴尔 20g羟苯乙酯 100g卡波姆 850g三乙醇胺 850g甘油 7500g乙醇 1000ml亮蓝 3 g柠檬黄 1.94 g香草香精 300ml纯化水加至 100kg1.3.2 处方依据项说明:药品的生产批文: 批准时间: 质量标准编号:2.工艺流程示意图:检验 →↓ →↓ ←中间产品检验→↓↓ ↓ ← 成品检验3.生产工艺操作要求、工艺技术参数: 3.1配制:3.1.1配料操作工按照“软膏剂、凝胶剂配制岗位标准操作规程”SOP-MN/Z-(R )-001-00规定,在油相缸中加入甘油和处方量1/10量的纯化水,搅拌溶解均匀,抽入到真空乳化机内,与已用纯化水搅拌后浸透24小时的卡波姆混匀。
3.1.2在水相缸中将纯化水加热(85℃以上)溶解处方量的盐酸林可霉素、盐酸利多卡因、雷弗奴尔,在搅拌条件下,加入用乙醇溶解的处方量的羟苯乙酯。
3.1.3将以上物料抽入到真空乳化机内混和,保持搅拌,另加纯化水至足量,开真空机抽真空,20分钟后,加入亮蓝和柠檬黄、香草香精,再过5分钟后加三乙醇胺,再开真空机抽真空,搅拌大约5分钟即得。
3.2 中间品检验:检验室按“中间产品取样操作规程”规定,抽取配制好的胶体进行中间产品的检验。
检验合格后,发放“中间产品合格证”。
3.3 分装:接到“中间产品合格证”后,车间按“凝胶剂灌装岗位标准操作规程” SOP-MN/Z-(R)-003-00的要求进行胶体灌装,随后进入拧盖工序。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
QA审核:
日期:年 月 日
颁发部门
GMP办公室
批准人:
日期:年 月 日
分发部门
生产技术部、质管部等相关部门
生效日期
年 月 日
变更记载:修订号 批准日期 执行日期
00
变更原因与目的:
【目的】建立盐酸林可霉素原料药的工艺规程,使生产规范化、标准化。
【范围】适用于生产技术部、质管部、物料部等相关部门。
盐酸林可霉素(无菌粉)原料药工艺规程
文件编码:TS-MF-026-00
5.4.9异常毒性取本品,加氯化钠注射液制成每1ml含5mg的溶液,照异常毒性检查法(SOP-QC-041-01)检查,按静脉注射法给药,应符合规定。
5.4.10降压物质 取本品,依法(SOP-QC-028-01)检查,剂量按猫体重每kg注射5mg,应符合规定。
盐酸林可霉素(无菌粉)原料药工艺规程
文件编码:TS-MF-026-00
5.3盐酸林可霉素成品质量检验方法
5.3.1性状
取少量于洁净的烧杯中在自然光下观察本品为白色结晶性粉末;有微臭或特殊臭;味苦。本品在水或甲醇中易溶,在乙醇中略溶。
5.3.2鉴别
5.3.2.1本品依法检查(SOP-QC-008-00)所得的红外光吸收图谱应与对照品图谱一致。
【责任】生产技术部、质管部、物料部等相关人员。
【内容】
一、药品概述
1.1 药品名称
中文名:盐酸林可霉素
汉语拼音:Yansuan Linkemeisu
英文名:LincomycinHydrochloride
化学名:6-(1- 甲基-反-4- 丙基-L-2- 吡咯烷甲酰氨基)-1-硫代-6,8-二脱氧-D-赤式-a-D-半乳辛吡喃糖苷盐酸盐一水合物。
5.4检查
5.4.1结晶性 取本品少许依法检查,应符合规定。
5.4.2酸度取本品0.10g,加水制成每1ml中含0.1g的溶液,依法测定(SOP-QC-011-01),pH值应为3.0~5.5。
5.4.3溶液的澄清度与颜色 取本品5份,各2g,分别加水5ml使溶解,溶液应澄清;如显浑浊,与1号浊度标准液(SOP-QC-019-00)比较,均不得更浓;如显色,与黄色或黄绿色1号标准比色液(SOP-QC-020-01)比较,均不得更深。
(C18H34N2O6S)不得少于82.5%。
5.5.4计算公式
含量(%)= ,式中:
:供试品峰面积; :对照品峰面积; :供试品称样量; :对照品称样量。
5.5.5相对误差范围:两份平行试验结果的相对偏差不得超过0.5%。
计算公式:
相对偏差(%)=
六、技术安全与防火(包括劳动保护、环境卫生)
6.1 技术安全
6.1.1必须坚持“安全第一、预防为主”的方针。原料药安全生产包括防火安全(因为原料药生产所用的溶剂均为易燃品)、设备安全、用电安全、药品生产安全、用气安全等。
盐酸林可霉素(无菌粉)原料药工艺规程
文件编码:TS-MF-026-00
6.1.2凡装有电器、电源开关、闸刀、插座等地方,不得用水冲洗,以防漏电事故的发
6.3.4各工序应按GMP要求,操作工每年应体检一次。
6.4 环境工艺卫生
6.4.1原料药生产区除一般生产区外,生产过程中门窗应关闭,每周应用药物喷洒灭菌或药物熏蒸灭菌一次。
6.4.2原料药生产车间,每周应将所药物管道及器具用洗液浸泡后,再用纯化水或注射用水清洗干净,外包装材料应彻底清洁后才能进入原料药生产车间。
盐酸林可霉素(无菌粉)原料药
工艺规程
二00六年三月
盐酸林可霉素(无菌粉)原料药工艺规程
一、药品概述
二、化学反应过程(包括副反应)及生产流程图(工艺及设备流程)
三、工艺过程
四、物料规格、质量标准
五、生产工艺和质量控制检查成品质量标准
六、技术安全与防火(包括劳动保护、环境卫生)
七、综合利用(包括辅助品回收的处理)与“三废”治理(包括“三废”排放标准)
5.4.4水分取本品,照水分测定法(SOP-QC-021-01)测定,含水分不得过6.0%。
5.4.5炽灼残渣 依法检查(SOP-QC-018-01),不得过0.5%。
5.4.6细菌内毒素取本品,依法检查(SOP-QC-026-01),每1mg盐酸林可霉素含内毒素的量应小于0.5EU。
5.4.7林可霉素B 照含量测定项下的方法测定,林可霉素B的峰面积不得过林可霉素与林可霉素B峰面积之和的5.0%。
6.3 劳动保护
6.3.1劳动保护是生产所必备的防护措施,操作人员不得留长发,进入工序前应穿戴好工鞋、工衣、工帽及手套。
6.3.2配制和使用清洁液时要穿戴好防护眼镜、耐酸手套,以免烧伤手、眼睛、皮肤及衣服。
6.3.3各工序操作人员均应认真仔细操作,接近运行中的机械设备应保持一定距离,以免伤手及身体其他部位。
(3)应呈正反应。
检查
结晶性
应符合规定
酸度
3.0~5.5
澄清度与颜色
应符合规定
水分
≤6.0%
炽灼残渣
≤0.5%
细菌内毒素
应小于0.5Eu/mg
林可霉素B
应符合规定
有关物质
应符合规定
异常毒性
应符合规定
降压物质
应符合规定
无菌
应符合规定
可见异物
应符合规定
含量测定
按无水物计,含林可霉素(C18H34N2O6S)不得少于82.5%
万级局部百级一般生产区
四、工艺过程
4.1 盐酸林可霉素的精制
投料:盐酸林可霉素 20kg
纯化水5kg
活性炭0.164kg
95%乙醇43kg
丙酮 70kg
在100L搪瓷反应罐中,按批生产指令的批量加入纯化水和95%乙醇,搅匀,升温至50~55℃,再加入盐酸林可霉素,搅拌、溶解(澄清),保温至50~55℃。然后加入0.82%(g/g)针用活性炭(盐酸林可霉素∶95﹪乙醇∶纯化水=1∶2.15∶0.25),搅拌吸附0.5h,先用滤纸然后用1.0μm钛棒、0.45μm微孔滤芯、0.22μm微孔滤芯滤过,滤液进入万级洁净区结晶罐中。
0.45μm≥0.25μm
0.22μm≥0.35μm
二次/批
脱炭粗滤
钛棒规格
1.0μm
一次/批
五、生产工艺和质量控制检查成品质量标准。
5.1成品质量标准
成品质量标准表
项目
标准规定
性状
本品为白色或类白色结晶性粉末;微臭,味苦。
鉴别
(1)本品的红外光吸收图谱应与盐酸林可霉素对照品的图谱一致(糊法);
(2)应与对照品溶液主峰的保留时间一致;
5.4.8有关物质 取本品,加流动相制成每1ml中含盐酸林可霉素12.5mg的溶液,作为供试品溶液;精密量取5ml置100ml量瓶中,用水稀释到至刻度,摇匀,作为对照液。
照含量测定项下的色谱条件,取对照溶液20µl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%~25%,再精密量取供试品溶液与对照溶液各20µl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。供试品溶液的色谱图中如有杂质峰,各杂质峰面积的和不得大于对照溶液主峰面积(5%)。
八、操作工时与生产周期
九、劳动组织与岗位定员
十、设备一览表及主要设备生产能力(包括仪表规格型号)
十一、原材料、动力消耗定额和技术经济指标
十二、物料平衡(包括原料利用率的计算)
海南豪创药业有限公司
产品工艺规程
标题:
盐酸林可霉素(无菌粉)原料药工艺规程
制定人:
日期:年 月 日
部门审核:
日期:年 月 日
文件编码
5.5.2测定法取本品约50mg,精密称定,置25ml量瓶中,用适量流动相溶解并稀释至刻度,摇匀,取10μl注入液相色谱仪,记录色谱图;另精密称取盐酸林可霉素对照品适量,同法测定。按外标法以峰面积计算供试品中C18H34N2O6S的含量。
5.5.3含量限度:本品为6-(1- 甲基-反-4- 丙基-L-2- 吡咯烷甲酰氨基)-1-硫代-6,8-二脱氧-D-赤式-a-D-半乳辛吡喃糖苷盐酸盐一水合物。按无水物计算,含林可可霉素
5.4.11无菌取本品适量,依法检查(SOP-QC-025-01),应符合规定。(无菌粉)
5.4.12可见异物取本品1g,加灭菌注射用水5ml,照(SOP-QC-084-01)检查,应符合规定。(无菌粉)
5.5 含量测定 照高效液相色谱法(SOP-QC-007-01)测定。
5.5.1色谱条件与系统适用性试验用十八烷基键合硅胶为填充剂;0.05mol/L硼砂溶液(用85%磷酸溶液调节pH值至6.0)-甲醇(4:6)为流动相;检测波长为214nm。理论板数按林可霉素峰计算应不低于1500,林可霉素峰与林可霉素B峰的分离度不小于2.6。林可霉素B峰为林可霉素峰的相对保留时间的0.5~0.7。
5.3.2.2 在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.3.2.3本品的水溶液显氯化物的鉴别反应。
5.3.2.3.1取试品溶液,加稀硝酸使成酸性后,滴加硝酸银试液,即生成白色凝乳状沉淀;分离,沉淀加氨试液即溶解,再加稀硝酸酸化后,沉淀复生成。
5.3.2.3.2取供试品少量,置试管中,加等量的二氧化锰,混匀,加硫酸湿润,缓缓加热,即发生氯气,能使湿润的碘化钾淀粉试纸显蓝色。
1.2 分子式:C18H34N2O6S2·HCl·H2O
分子量:461.02
1.3 理化性质
本品为白色结晶性粉末;有微臭或特殊臭;味苦。本品在水或甲醇中易溶,在乙醇中略溶。
1.4 简介
本品为链菌属链丝菌菌群生长时的产物,即一种林可胺类碱性抗生素。主要通过抵制细菌的蛋白质合成而起作用。
