酸碱平衡1
酸碱平衡1

肉类、禽蛋类、鱼类等动物性食物及面粉、
大米、花生等,一般为酸性;某些提炼很纯 的油脂、糖、淀粉等列为中性食物。
二、 碱性物质的来源
体内碱性物质的主要来源,这类物质产生的Na+和K +能 与体液中HCO3 -结合,冲 总之, 固定酸↑ 缓冲碱↓ _ 肺调节 [HCO3 ] ↓ 比值↓ [H2CO3] ↑ pH↓
[H2CO3]↓
_ [HCO3 ]
↓ [H2CO3] ↓
比值和pH恢复 缺陷 但肺不能直接 _ 或接近正常 调节[HCO3 ] 有赖于肾调节 _ 血浆[HCO3 ]绝 对量仍有改变
血液缓冲 相反, 固定碱↑ 缓冲酸↓ _ [HCO3 ] ↑ 比值↑ 肺调节 [H2CO3] ↓ pH↑ _ [HCO3 ] ↑ [H2CO3]↑ [H2CO3] ↑ 比值和pH恢复 缺陷 但肺不能直接 _ 或接近正常 调节[HCO3 ] 有赖于肾调节 _ 血浆[HCO3 ]绝 对量仍有改变
3.对碱性物质的缓冲作用 BOH+H2CO3 BHCO3 + H2O BNaHPO4 + H2O BOH+NaH2PO4 BOH+ HPr BPr + H2O 缓冲的结果: 强碱→ 弱碱,pH 无剧烈变化,
但缓冲酸↓, 缓冲碱↑ →比值↑→pH↑
说明:仅靠血液的缓冲不够,还须依赖其 他调节机制。
二、肺调节酸碱平衡的机制 肺主要通过调节CO 排出来控制血中 2 _ [H2CO3], 以调节[HCO3 ] /H2CO3比值, 而 达到调节机体酸碱平衡的作用
07-酸碱平衡(1)-4

第三节 水溶液的酸碱性及pH计算
一、水的质子自递反应 发生在同种溶剂分子之间的质子传递作用称 为质子自递反应. 在一定温度下水的质子自递反应达到平衡时, 有如下关系: (式中的H2O可看成是一常数,将它与K合并) H2O+ H2O H3O+ +OH-
H O OH K
H2OH2O
HAc
H++Ac-
在一定温度下,当弱电解质分子电离成离子
的速度与离子又结合成分子的速度相等时,电离
过程既达到动态平衡,称为电离平衡,这时未电
离分子浓度和已电离出来的各离子浓度不在改变
则 Ki =
H Ac
HAc
Ki 称为电离常数(Ka 表示弱酸电离常数;Kb 表 示弱碱电离常数) Ki 越大,电离程度越大, Ki 与 弱电解质的本性及温度有关,而与浓度无关。
3
二、共轭酸碱对Ka与Kb的关系 H3O+OH-=KH2O2=Kw 式中Kw称为水的离子积常数。 室温下(298K)Kw=1.0×10-14 298K,纯水中的
[H3O+]=[OH]=1.0 107mol/L
三、一元酸碱 (一) 强酸或强碱溶液
强酸或强碱属于强电解质,在水中完全解离。
HCl(气) NH 3 (气) NH 4Cl HCl NH 3 NH 4Cl
( 苯中)
为了克服电离理论的局限性,1923年 BrÖnsted和Lowry提出了一种较全面的酸碱理论, 称为酸碱质子理论。 一、酸碱的定义 凡给出质子(H+)的物质都是酸,凡能接受质 子的物质都是碱。
K a c 1.76 105 0.10
pH lg H 3O lg 1.3 10 3 2.89
质子酸碱平衡1

作图, 以x对pH作图 得形体分布图 对 作图
HAc的x-pH图 的 图
x 1.0 pKa HAc 4.76
Ac-
0.5
0.0
0
2
44.76 6
8
10
12
pH
HAc的优势区域图 的优势区域图
pKa±1.3
HAc 3.46 4.76
6.06
Ac-
pH
x 1.0 HF 0.5 F-
HF的x-pH图 的 图
1.物料平衡 物料平衡 各物种的平衡浓度之和等于其分析浓度. 各物种的平衡浓度之和等于其分析浓度
c mol·L-1 HAc溶液的物料平衡为: [HAc]+[Ac-]=c
c mol·L-1的Na2HPO4溶液 总钠:[Na+]=2c
− 总磷: [H 3 PO 4 ] + [H 2 PO 4 ] + [HPO 2− ] + [PO 3− ] = c 4 4
CKa + Kw
此为考虑水的离解时计算一元弱酸H 此为考虑水的离解时计算一元弱酸 +浓度的 近似公式。 近似公式。
0.0 0 2 3.17 pKa 3.17 FpH 4 6 8 10 12 pH
HF的优势区域图 的优势区域图
HF
HCN的x-pH图 的 图
x 1.0 HCN 0.5 CN-
0.0 0 2 4 HCN 6 8 9.31 pKa 9.31 CNpH 10 12 pH
HCN的优势区域图 的优势区域图
(2) 二元弱酸 2A的摩尔分数 二元弱酸H 的摩尔分数 C =[H2A]+[HA-]+[A-2]
+ 10
−3.5
)
临床医学酸碱平衡概论课件-课件(1)

renal tubule cavity
5
酸碱平衡调节机构及其调节作用和特点
缓冲系统
ቤተ መጻሕፍቲ ባይዱ
肺
调节机制 缓冲对两组 呼出CO2 分酸碱转化
调节作用
维持 H+ 浓度
维持 H2CO3 浓度
发生时间
立即
数分钟
肾
泌H+重吸 收HCO3维持 HCO3-
浓度
数小时
6
酸碱平衡紊乱 概念及类型
8
酸碱平衡紊乱的类型
代谢性碱中毒
脏来不及代偿,反映代谢性因素的指标(如SB、 BE、BB)可在正常范围或轻度升高; • 慢性呼吸性酸中毒时,由于肾脏参与了代偿则SB 、BB增高,BE正值增大,pH<7.35(机体失代偿 )或在正常范围(酸中毒得到机体的完全代偿)。
代谢性碱中毒
(metabolic alkalosis)
特征
血浆[ HCO-3 ] 原发性增高
正常型代谢性酸中毒:HCO3- 经肠液 以及经肾脏大量丢失,引起血浆 HCO3- 浓度原发性下降,不伴有其它 酸根阴离子异常积聚,但血清 Cl- 水平 升高。
Na+ =140
Cl=104
HCO-3 =24
AAGG
22
Cl-
Na+
HCO-3 AG
正常
Cl-
Na+
HCO-3
AG
AG增大型
Cl-
Na+
HCO-3 AG
39
原因
1. H+丢失 ❖ 呕吐 ❖ 应用利尿剂 ❖ 醛固酮过多 ❖ 低氯血症 ❖ 低钾血症
2. HCO-3 摄入过多 ❖碳酸氢盐摄入过多 ❖大量输注库存血
酸碱平衡名词解释

酸碱平衡名词解释酸碱平衡是指在生物体内,维持血液和细胞内外的酸碱度(pH)在一定范围内的能力。
酸碱平衡是体内各种代谢和生理功能顺利进行的基础,对于维持正常细胞活动至关重要。
酸碱平衡涉及到一系列生理过程和调节机制。
一方面,体内产生的代谢废物如二氧化碳、酮体等会产生酸性物质,而某些物质的代谢则会产生碱性物质,这些物质需要被及时调节以维持血液和细胞内外的pH值恒定。
另一方面,体内有多个重要的缓冲系统,如碳酸酐酶系统、血红蛋白系统和蛋白酸碱系统,它们能够吸收或释放H+离子以维持酸碱平衡。
此外,肺脏和肾脏也是关键的调节器官,它们能够通过调节呼吸和排泄代谢产物来维持酸碱平衡。
酸碱平衡对细胞的生理功能有重要影响。
细胞的酸碱平衡紊乱会导致细胞膜通透性的改变,影响离子通道的开闭,从而干扰细胞内外离子的分布和传递。
此外,酸碱平衡紊乱还会影响酶的活性、蛋白质的结构和功能,进而影响细胞的代谢和信号传导过程。
酸碱平衡紊乱可引起一系列疾病。
如果机体内部pH值偏酸或偏碱,就会影响酶的催化活性,破坏细胞内外离子平衡,从而引起许多生理和代谢障碍。
例如,酸中毒可导致肌肉无力、神经兴奋性增加、呼吸深快等症状,而碱中毒则可以引起神经系统的抑制、疲劳等问题。
为了保持酸碱平衡,人们需要保持健康的生活方式。
均衡饮食对于维持体内酸碱平衡至关重要,应摄入适量的碱性食物,如蔬菜和水果,以提供碱性物质。
此外,保持水分平衡、充足的休息和适度的运动也有助于维持酸碱平衡。
总之,酸碱平衡是机体内维持血液和细胞内外的酸碱度在一定范围内的能力,涉及到一系列生理过程和调节机制。
酸碱平衡紊乱会对细胞的生理功能造成影响,引起多种疾病。
保持健康的生活方式有助于维持酸碱平衡。
化学高考酸碱平衡

化学高考酸碱平衡在化学高考中,酸碱平衡是一个非常重要的概念。
酸碱平衡的理解是化学学习的关键之一,也是高考中常考的知识点。
本文将系统地介绍酸碱平衡的基本概念、计算方法以及相关实验。
一、酸碱平衡的基本概念在化学中,酸碱平衡是指涉及酸和碱之间质子(H+)转移的过程。
酸会释放质子,而碱则会接受质子。
这种质子转移的过程可以通过pH值来衡量,pH值越低,溶液越酸性;pH值越高,溶液越碱性。
酸碱反应一般以化学方程式表示。
例如,酸(如盐酸)与碱(如氢氧化钠)反应的方程式为:HCl + NaOH -> NaCl + H2O在这个反应中,盐酸释放出了一个质子,而氢氧化钠接受了这个质子,生成了水和盐。
这就是酸碱反应的基本原理。
二、酸碱计算方法在高考中,我们经常需要计算酸碱溶液的浓度、pH值等相关参数。
下面是几个常用的计算公式。
1. 计算酸碱溶液的浓度酸碱溶液的浓度可以通过酸碱滴定实验来测定。
滴定是一种通过溶液体积的比较来确定浓度的方法。
2. 计算溶液的pH值pH值可以通过溶液中质子浓度的对数来计算。
数学公式为:pH = -log[H+]3. 计算酸碱溶液的中和反应酸碱滴定实验中,我们可以通过计算滴定过程中酸和碱的反应来确定化学方程式。
通过方程式,我们还可以知道酸和碱的摩尔比例。
三、酸碱平衡相关实验为了更好地理解酸碱平衡的概念,我们可以进行一些相关实验来观察和验证。
1. pH试纸实验使用不同酸碱溶液,将pH试纸浸泡在溶液中,根据试纸变色来判断溶液的酸碱性质。
2. 酸碱滴定实验通过滴定法测定酸碱溶液的浓度,可以根据滴定过程中的化学反应求解酸碱溶液的摩尔比例等参数。
3. 强酸强碱中和实验将强酸与强碱按摩尔比例混合,观察其中和反应并记录pH值的变化过程。
通过这些实验,我们可以直观地了解酸碱平衡的变化规律,加深对酸碱平衡概念的理解。
总结:酸碱平衡是化学高考的重要知识点,需要我们掌握酸碱的基本概念、计算方法和相关实验。
通过学习酸碱平衡,我们可以更好地理解酸碱反应的原理,解答高考中相关题目。
第十四章 酸碱平衡(1)
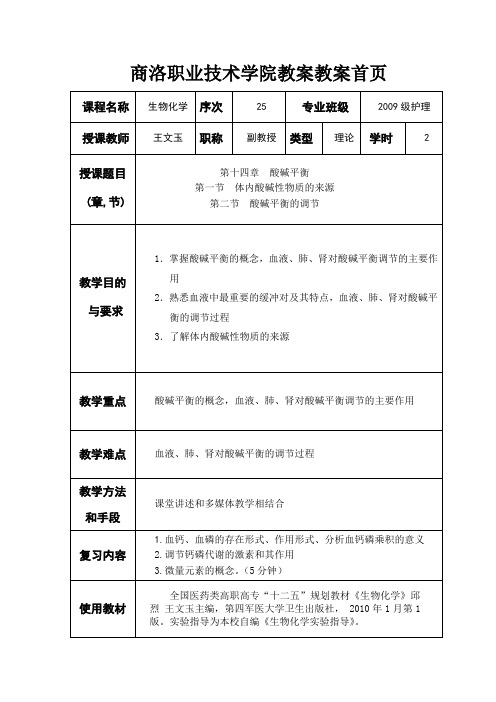
KHbO2→KHb + O2
KHb + H2CO3→HHb+ KHCO3
上述缓冲过程中,红细胞内HCO3-增加,并向血浆扩散,为维持体液电中性,血浆中等量的Cl-向红细胞转移。
当血液流经肺时,随着O2的吸入,CO2的呼出,肺泡中的O2扩散入血浆,并进入红细胞与HHb结合成HHbO2,而HHbO2的酸性较强,可释出H+,与红细胞内的HCO3-结合H2CO3,后者即由碳酸酐酶分解为CO2与H2O。CO2经血浆扩散入肺,随呼气排出,使H2CO3得以彻底调节。在此过程中,红细胞内HCO3-的减少,使血浆中HCO3-转入红细胞;为维持电中性,红细胞中的Cl-转入血浆。
PCO2延髓呼吸中枢肺排出
pH 的兴奋性CO2量
呼吸中枢可调节呼吸频率和深浅度,控制肺的通气率。
呼吸频率及深度受延髓呼吸中枢的控制,后者对血液PaCO2及pH非常敏感。当血液PaCO2升高、pH降低时,呼吸中枢兴奋,使呼吸加深加快,CO2排出增多,使血液中H2CO3的浓度降低;当PaCO2降低、pH升高时,呼吸变浅变慢,CO2排出减少,使血液中H2CO3含量增多。
K+-Na+交换排出多余的酸
(一)NaHCO3的重吸收
重吸收NaHCO3保证NaHCO3不再丢失
稳定了血浆[NaHCO3]
若没有NaHCO3重吸收“雪上加霜”
重吸收NaHCO3缺陷:未直接排酸未补充缓冲所消耗的NaHCO3。
(二)NaHCO3的再生
1.尿液的酸化
NaHCO3再生的作用:可直接排酸(以NaH2PO4形式)
血浆中的NaHCO3主要用来缓冲固定酸,在一定程度上它可代表血浆对固定酸的缓冲能力,故习惯上把血浆中的NaHCO3称为碱储。
酸碱平衡的知识点内容总结

酸碱平衡的知识点内容总结1. 酸碱平衡的定义酸碱平衡是指人体内液体的酸碱度维持在一定范围内的生理状态。
pH值是衡量酸碱度的指标,它是表示液体酸碱程度的数值。
在正常情况下,血液的pH值应该维持在7.35-7.45之间,这个范围被称为酸碱平衡的正常范围。
2. 酸碱平衡的重要性酸碱平衡对于维持机体内部环境的稳定以及细胞正常功能都是非常重要的。
如果体内液体的酸碱度发生偏离,会影响到各种生物化学反应的进行,导致细胞和器官功能异常,严重时还会威胁生命。
3. 生理调节机制酸碱平衡主要受到血液、肾脏和呼吸系统的调节。
血液通过缓冲系统可以快速调节酸碱度,而肾脏则可以通过排泄酸性物质和生成碱性物质来维持酸碱平衡。
呼吸系统则通过呼吸速度的调节来调节血液中二氧化碳的浓度,从而影响血液的酸碱度。
4. 酸碱失衡的原因酸碱失衡是指体内液体的酸碱度偏离正常范围,分为呼吸性酸碱失衡和代谢性酸碱失衡两种。
呼吸性酸碱失衡通常由呼吸系统功能异常引起,如肺部疾病或神经系统损伤。
代谢性酸碱失衡则主要与肾脏调节功能障碍有关,如代谢性酸中毒和代谢性碱中毒等。
5. 与健康和疾病的关系酸碱失衡与多种疾病的发生和发展密切相关,如糖尿病酮症酸中毒、肾功能不全导致的代谢性酸中毒等。
此外,一些生活方式和饮食习惯也会影响酸碱平衡,长期的饮食不平衡或过度运动都有可能导致酸碱失衡,对健康造成影响。
总之,酸碱平衡是一个复杂的生理调节过程,在保持人体内部环境稳定和细胞正常功能方面发挥着极其重要的作用。
对酸碱平衡的深入了解能够帮助我们更好地保持健康,预防疾病的发生。
因此,加强对酸碱平衡的学习和认识,对于每个人来说都是非常有意义的。
生理学课件酸碱平衡

肺部疾病对酸碱平衡影响
1 2
慢性阻塞性肺疾病(COPD)
COPD患者由于气道受阻和肺泡弹性降低,导致 肺泡通气量减少,CO2排出受阻,容易引发呼吸 性酸中毒。
支气管哮喘
支气管哮喘发作时,气道痉挛导致通气障碍, CO2排出减少,同样可能引发呼吸性酸中毒。
3
肺水肿
肺水肿时,肺泡内液体增多,影响肺泡通气量, 使CO2排出减少,可能导致酸碱失衡。
感谢观看
生理意义
磷酸盐缓冲系统在细胞内液和细胞外液中均存在,对于维 持细胞内外酸碱平衡具有重要作用。
蛋白质缓冲系统
要点一
组成
主要由血浆中的蛋白质,如白蛋白、 球蛋白等组成。
要点二
作用机制
蛋白质分子中含有许多可解离的酸性 或碱性基团,这些基团在不同pH值 下可发生解离或结合H+,从而起到 缓冲作用。当体内酸度增加时,蛋白 质分子中的碱性基团结合H+,当体 内碱度增加时,酸性基团则释放出 H+。
诊断与治疗原则和方法
诊断方法和步骤
病史采集
详细询问患者病史,包 括症状、体征、既往病
史等。
体格检查
全面检查患者身体状况 ,特别注意呼吸、心率
、血压等生命体征。
实验室检查
通过血液、尿液等样本 的化验分析,了解酸碱
平衡状况。
影像学检查
根据病情需要,选择适 当的影像学检查方法,
如X线、CT等。
治疗原则和方法
代谢性碱中毒
原发性增多
由于细胞外液中HCO3-增加或H+丢 失导致,常见原因有胃液丧失过多、 碱性物质摄入过多等。
继发性减少
临床表现
轻度代谢性碱中毒可无明显症状,重 症患者可出现躁动、兴奋、嗜睡、昏 迷等症状,严重者可出现呼吸浅慢、 手足搐搦、腱反射亢进等。
第四章-酸碱平衡和酸碱平衡紊乱PPT课件-1

[H+] K+
红细胞、肌组织、骨 组织均能发挥这种作 用。
2024/10/14
.
13
肾脏的调节
肾脏通过排酸(H+或固定酸)以及重吸收碱 (HCO3- )对酸碱平衡进行调节
调 节 方 式
2024/10/14
近曲小管泌H+ 重吸收HCO3-
NH4+的排出
.
远曲小管和集合 管泌H+ 重吸收HCO3-
14
实际碳酸氢盐(Actual bicarbonate,A.B.)是
指隔绝空气的血液标本,在保持其原有温度、
PaCO2和血氧饱和度不变的条件下测得的血浆 碳酸氢盐浓度。因此A.B.受代谢和呼吸两方面
因素的影响。 2024/10/14
.
27
标准碳酸氢盐和实际碳酸氢盐
标准碳酸氢盐 (standard bicarbonate,SB) 正常值:22-27mmol/L(24)
AG
UC UA
意义:✓反映代谢性酸中毒的
指标(AG增高型代酸,AG>16 mmol/L)
常见于固定酸增多的情况。如乳酸堆积,酮体过多等。
2024/10/14
.
32
第三节 单纯性酸碱平衡紊乱
一、代谢性酸中毒 代谢性酸中毒(Metabolic Acidosis)
的特征是血浆[HCO3-]原发性减少。
2024/10/14
总和。HCO3-, HPO42-, Hb-, HbO2-, Pr-
正常值: 45~52mmol/L(48mmol/L)
反映代谢性因素的指标
2024/10/14
.
30
碱剩余(base excess,BE)
在标准条件下,用酸或碱滴定全血标本至 pH7.40时所需的酸或碱的量
酸碱平衡名词解释

酸碱平衡名词解释酸碱平衡是有机体物理学、生物学、生理学和医学等多个学科和领域中一个关键性的术语。
一般而言,它指的是一个有机体体内的酸碱分布的平衡状态。
换句话说,它指的是有机体内的酸碱浓度在一定的范围内的稳定状态。
酸碱平衡的相关概念可以追溯到19世纪末的德国化学家阿尔伯特西尔夫豪夫斯坦的提出。
他称这种状态为“豪夫斯坦的平衡”,这是一种电离度的平衡。
酸碱平衡的基本原理是,所有有机体的体液系统都存在着一个极性差异,这是一种离子无机物和血液凝固物质的电离度差异。
它们在体内互相平衡,形成酸碱平衡。
酸碱平衡的正常范围是7.35-7.45,但也有少数情况存在偏高和偏低的情况。
身体如果长期处于酸中毒状态,就会出现症状,如头痛、乏力、胃部不适、呼吸困难等。
此外,由于酸碱平衡的重要性,科学家们们也在研究酸碱平衡与其他相关因素之间的联系。
研究表明,酸碱平衡对人体营养状况的一系列调节过程至关重要。
它不仅能够控制多种重要的水溶性维生素的吸收和抵抗,还可以帮助调节血液中糖分的含量,控制血液中的淀粉水解酶活性,从而控制血糖水平。
在医学上,维持健康的酸碱平衡也很重要。
医疗机构对许多病症会进行身体液体酸碱平衡的测试,包括血液的酸碱平衡检测,以确定治疗方案的选择。
为了增加酸碱平衡检测的准确性,除了标准测试外,还应进行其他额外的检测措施,比如,观察病人的症状、测量病人的体液酸碱指数和血液酸碱指数、进行血液检测、进行血液滤清等。
此外,科学家们也在研究饮食和气候等因素如何影响酸碱平衡。
据报道,正常人的体液酸碱指数会因季节、地域、饮食等因素而发生变化。
饮食中的食物对于维持酸碱平衡也至关重要,例如,可以通过合理的搭配食物,使食物中的酸碱成份相互抵消,以保持健康的酸碱水平。
总而言之,酸碱平衡是一个复杂又重要的话题。
它不仅与我们体内多种生理过程有关,还与我们环境中的有机物也有关。
因此,正确的了解和实施在生活中的正确的措施,可以有效地维持和调整酸碱平衡,保护我们的健康。
3.酸碱平衡1(40-56))

第3章酸碱平衡和沉淀平衡一.填空题1、0.20 mol·L-1 HAc 溶液中,c (H+) = ________mol·L-1,pH = _____________。
K(HAc) = 1.75 ×10-5 )(θa2、按质子酸碱理论,[Fe(H2O)5OH]2+的共轭酸是,共轭碱是。
3、浓度为0.010 mol·L-1的一元弱碱 (K b= 1.0 ×10-8 ) 溶液,其pH = ________,此碱溶液与水等体积混合后,pH = ________。
4、1.5 ×10-2mol·L-1NH3·H2O溶液中c (H+ ) = ____ mol·L-1,pH = ____ 。
(K b (NH3·H2O) = 1.8 ×10-5 )5、Fe(OH)3、Ca3(PO4)2的标准溶度积表达式分别为 ________、____________。
K( CuS)=6.3×10-36,则其溶解度为mol·L-1,在0.050 mol·L-1CuSO4溶6、已知θsp液中,CuS的溶解度为mol·L-1 。
7、0.10 mol·L-1HAc溶液中,浓度最大的物种是______,浓度最小的物种是________。
加入少量的NH4Ac(s)后,HAc的解离度将_______,溶液的pH将________,H+的浓度将_________。
8、某弱酸型碱指示剂 HIn的K In=1.0×10-6,HIn呈现红色,In-是黄色,加入三个不同溶液中,颜色分别是红色、橙、黄,这三个溶液的 pH范围分别是。
9、相同体积相同浓度的HAc和HCl溶液中,所含的[H+]________;若用相同浓度的溶液分别完全中和这两种酸溶液时,所消耗的NaOH溶液的体积 ________,恰好中和时两溶液的pH_______,前者的pH比后者的pH________。
酸碱平衡与体内代谢的关系

酸碱平衡与体内代谢的关系酸碱平衡是人体内一个极其重要的生命体征。
人体细胞需要维持一定的酸碱度,才能保持生命活动的正常水平。
酸碱平衡的失调会对机体造成不可逆转的危害,甚至危及生命。
什么是酸碱平衡呢?为什么酸碱平衡的失调会产生危害?这些问题是本文所讨论的内容。
一、什么是酸碱平衡正常情况下,人体细胞内的代谢产物会产生酸度,而组织中的碱度又会通过一系列的化学反应来中和酸度。
这个过程就叫做酸碱平衡。
酸度和碱度的平衡可以通过PH值来描述。
PH值是一种表示物质酸碱程度的单位。
在人体内,正常的PH值范围为7.35-7.45,若PH值偏低,则说明酸性过高;如PH值偏高则说明碱性过高。
连续的超出正常PH值的范围就会导致酸碱平衡失调,从而引起种种生理疾病。
二、酸碱平衡失调的原因酸碱平衡失调的原因有很多。
常见的原因包括呼吸系统、消化系统和肾脏功能异常等。
其中最主要的原因是呼吸系统异常。
人体内的呼吸作用会产生大量的二氧化碳。
如果肺部功能受损,二氧化碳的排出就会受到影响,从而导致酸碱平衡失调。
此外,身体里的糖类、脂类、蛋白质等也会对酸碱平衡产生影响。
有些药物和毒素也会导致酸碱平衡失调。
例如,乙醇会使血液成酸性,阿司匹林和草酸等化学物质也有类似的作用。
三、酸碱平衡失调的危害酸碱平衡失调会对机体产生重大危害。
如果PH值过低,则会出现酸中毒的症状。
症状通常包括呼吸急促、心跳加速、颅内压增高等。
重度的酸中毒会造成身体的某些组织器官损伤。
另外,PH值偏高也会对身体带来危害,这种情况下会出现碱中毒的症状。
碱中毒表现为呼吸抑制、出汗、腹泻等症状,有时还会引起心脏骤停等危险情况。
四、如何维护酸碱平衡维持人体的酸碱平衡需要科学合理的饮食和生活方式。
首先,合理膳食摄入可以调节身体的酸碱平衡。
饮食中应该注意富含果蔬、微量元素等。
其次,每天要喝足够的水。
人体内持续的正常水分摄入,可以保持体内代谢的正常运作,以及维持酸碱平衡。
另外,适当的运动也有益于维持人体酸碱平衡。
酸碱与酸碱平衡1

A-(碱)
conjugate base
+
H+
proton
酸
HAc H 2 PO HPO NH
− 4 2− 4 + 4 +
H+ +碱
+ Ac − H + + HPO 2 − H 4 H + PO
+ + + 3− 4 +
H + NH 3 H + CH 3 NH 2 H + [Fe(OH)(H 2 O) 5 ]
共轭酸碱对 HA—Aα H + α A − α HAα OH − K a Kb = × α HA α A− = α H + α OH − = K w
pK a + pK b = pK w
A − + H 2 O = OH - + HA
α HAα OH [OH − ][ HA] Kb = ≈ [ A− ] αA
解离度:对于酸或碱这类电解质,在水中 解离度 的解离程度还可以用解离度来表示,解离 度的大小也可以表示酸碱的相对强弱 解离度=解离部分的弱电解质浓度/未解离 前弱电质浓度 在水中,浓度、温度相同的条件下,解离 度大的酸(或碱),K 就大,该酸(或碱) 的酸性(或碱性)就相对越强。
例:HAc在25℃时,Ka=1.74×10-5,求 0.20mol/L HAc的解离度。
活度 α:溶液中某种离子的有效浓 度。
理论浓度c:溶液中某种离 子的总浓度。
离子的活度 α 与浓度c 通过活度系数γ 联系起来:
α = γc
活度系数γ :衡量电解质溶液中离子间相互牵制 作用的强弱 ⑴较稀弱电解质、极稀强电解质:离子间距离大, 作用小,认为γ≈1 γ ⑵中性分子: γ≈1 ⑶高浓度电解质溶液:情况复杂,还没有较好的 定量公式
酸碱平衡的生理与病理

酸碱平衡的生理与病理酸碱平衡是维持人体内环境平衡的基本生理过程之一。
它是指细胞及体液中酸性和碱性物质的浓度被维持在一定范围内的能力。
当这一平衡被打破时,人体就会出现各种病理现象。
生理酸碱平衡人体内部有许多酸性和碱性的体液,如血液、胃液、肠液、尿液等。
这些体液的酸碱平衡是由生理调节机制维持的。
首先是肺和肾的调节作用。
肺通过呼吸将二氧化碳排出体外,从而调节体内酸碱平衡,这被称为呼吸性酸中毒和碱中毒。
肾则通过调节尿液的酸碱性来调控体内的酸碱平衡,这被称为代谢性酸中毒和碱中毒。
其次是体内缓冲系统的作用。
当酸碱物质浓度发生变化时,体内的缓冲系统会立即进入作用,将这些物质转化为对立的物质来调节酸碱平衡。
最后是血液pH值的调节。
我们常说的“酸”和“碱”都是通过血液pH值来衡量的。
正常的血液pH值应该在7.35-7.45之间,当pH值偏高时我们称之为碱中毒,反之称为酸中毒。
病理酸碱平衡在一些特殊情况下,生理酸碱平衡调节机制失效,就会出现各种酸碱平衡紊乱的病理现象。
例如,代谢性酸中毒比较常见,它主要由以下原因引起:糖尿病的酮症酸中毒,呼吸功能不全引起的二氧化碳潴留,醇中毒以及肾功能损伤等。
代谢性酸中毒会导致乏力、呼吸急促、恶心、呕吐等症状。
碱中毒相对较少见,通常是由于人工梯压呼吸,导致肺呼吸性碱中毒,或由于误用药物和滥用碱性洗剂等环境因素引起的。
碱中毒的症状包括头晕、嗜睡、肌肉痉挛等。
尿液酸碱度的变化也会影响健康。
例如,长期食用富含酸性成分的食物,如高蛋白质食物等,会增加体内酸性物质产生,从而增加感染机会、加剧阴道炎等。
另外,缺钾性碱中毒也常常被忽视,它会导致虚弱、肌肉麻痹、心跳不齐等症状。
综上所述,酸碱平衡是人体内环境平衡的重要基础之一,它的失衡会引发各种难以预测的症状。
因此,在日常生活中,我们应该多注意保持身体内部的酸碱平衡,特别是调节饮食结构、保持运动锻炼等。
同时,及时向医生寻求帮助也是解决酸碱平衡失调问题的关键。
《大学分析化学教学课件》5-1酸碱平衡

THANKS
感谢观看
质量作用定律
质量作用定律是描述化学反应速率与反应物浓度关系的定律,在酸 碱平衡中,反应速率与反应物浓度之间也存在类似的关系。
电离平衡
电离平衡是描述弱电解质在水中离解程度的一种平衡状态,弱酸或 弱碱的电离平衡受到质子转移的影响。
缓冲溶液
缓冲溶液是一种能够抵抗外来少量强酸或强碱而保持自身pH值基本 不变的溶液,其原理是利用了酸碱对的缓冲作用。
3. 观察并记录酸碱反应过程 中的现象;
4. 根据实验数据计算酸碱反 应的平衡常数。
实验结果和实验结论
实验结果:通过实验测定不同条 件下的酸碱反应平衡常数,可以
得出以下结论
1. 酸碱反应的平衡常数与温度 有关,温度越高,平衡常数越大;
2. 酸碱反应的平衡常数与浓度 有关,浓度越大,平衡常数越大;
实验结果和实验结论
01
3. 在一定条件下,酸碱反应可以达到平衡状态,此 时反应物和生成物的浓度不再发生变化。
02
实验结论:通过本实验的研究,可以得出以下结论
03
1. 酸碱反应是一种可逆反应,存在平衡状态;
实验结果和实验结论
2. 酸碱反应的平衡常数与温度、浓度 等因素有关;
3. 通过实验测定不同条件下的酸碱反 应平衡常数,可以了解酸碱反应的规 律和特点。
《大学分析化学教学 课件》5-1酸碱平衡
目录
• 酸碱平衡的基本概念 • 酸碱平衡的移动 • 酸碱平衡的计算 • 酸碱平衡的应用 • 酸碱平衡的实验研究
01
酸碱平衡的基本概念
酸和碱的定义
酸
在水溶液中能电离出氢离子(H+) 的物质。酸具有给出质子的能力, 能与碱发生中和反应。
碱
3.酸碱平衡1

而当电解质溶液通电时,也由于离子之间的相互作用,使得离子不 能百分之百地发挥输送电荷的作用。其结果导致实验测得的离子的 数目少于电解质全部电离时应有的离子数目。
溶液中离子的浓度越大,或离子所带电荷数目越多,离子之间 的相互作用就越强。 离子的行动为什么不完全自由 ——— 离子氛形成的结果. 电解质溶液中实际发挥作用的浓度怎样计算: ———有效浓度(活度)和活度系数 离子的相互作用大小如何衡量——— 离子强度
碱
HSO4- + H+ NH3 + H+
[Fe(H2O)6]3+
[Fe(H2O)5OH]2+ + H+
HSO4- H2PO4-
HSO4- H2PO4-
SO42- + H+ HPO42- + H+
反应式中,左边的物质都是酸;这些酸在反应中给出 质子后,形成的物质都是碱。
酸
质子 + 碱
共轭酸碱
2. 酸碱反应的特性
它认为酸碱反应的实质是共价配键生成酸碱配合物的过 程。
酸
H+ Ag+ + +
碱
:OH2[:NH3]
酸碱配合物
H:OH
3HN:Ag:NH3
3.1.5 软硬酸碱理论
Lewis酸碱:软酸,硬酸,交界酸和软碱,硬碱,交界碱
软硬酸碱规则:硬酸与硬碱,软 变形的正离子,如B , Al , Fe 等; 软酸:电荷较少,半径较大,外层电子被原子核束缚得较松而容易 酸与软碱结合,易形成稳定配合 变形的正离子,Cu ,Ag ,Cd 等; 交界酸 物 :Fe ,Cu 等;
对于任一可逆反应 a A + b B ⇌ d D + eE
第6章 酸碱平衡 (1)

另一个半反应是作为碱的NH3 分子接受质子生成它 的共轭酸NH4+ NH3 + H+
• 酸碱反应指质子由给予体向接受体的转移过程。 • 酸给出质子的能力越强,生成的共轭碱越弱,反 之亦然;碱接受质子的能力越强,生成的共轭酸 越弱, 反之亦然。 • 酸碱反应的本质是二个共轭酸碱对之间(半反应) 的质子传递反应,强碱夺取强酸中的质子,生成 更弱的酸及碱的反应
11
酸碱理论发展历程的启示
• 科学研究循序渐进、不断深入 电离理论 →质子理论 →电子理论 →软硬酸碱理论 → …… • 针对现象的主要特征采用不同的视角剖析 酸碱平衡——质子理论 配位平衡——电子理论
12
酸碱质子理论的几点说明
• 在一定条件下,既有给出质子能力的又有结合质 子能力的称为两性物质。 • H2O是典型的两性物质,在不同的半反应中表现 出不同的酸碱性 H2O H+ + OHH2O + H+ H3O+ • 酸碱可以是中性分子、阴离子或阳离子。
27
例:NH4HCO3在水溶液中的质子平衡式
NH4+ + H2O HCO3- + H2O HCO3- + H2O H2O + H2O H3O+ + NH3 H3O+ + CO32H2CO3 + OHH3O+ + OH-
得 失 [H3O+ ] + [H2CO3] = [NH3] + [CO32-] + [OH-]
14 5
1 .8 1 0
5 .6 1 0
10
500 K a cr
6
[ H ]r
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HB+H2O
H3O++B-
通常简定为:HB HF HAc H++FH++AcNH4
+
H++B[ H + ][ F − ] = Ka [ HF ] [ H + ][ Ac − ] = Ka [ HAc]
[ H + ][ B − ] = Ka [ HB]
共扼碱 ClAc-
HB 共扼酸
H+ + B质子 共扼碱
1.共扼酸碱对之间只相差一个质子
+ HCO3-
2.两性物质
H+ + CO32H+ + H2O H+ + H+ + OHNH3
共扼酸 HCl HAc H2CO3 HCO3H3O+ H2O NH4+ H+ + H+ H+ +
共扼碱 ClAc-
HB 共扼酸 3、酸碱反应
OH-+HF
接受质子 给出质子
HA + B = A + HB
接受质子 给出质子
HCl+H2O=Cl- +H3O+
接受质子 给出质子
H2O+NH3
OH-+NH4+
NH4++H2O
NH3+H3O+
接受质子
接受质子
二、酸碱强度的表示
1、一元弱酸、碱强度表示法
二、酸碱强度的表示
1、一元弱酸、碱强度表示法 弱酸的强度是指其将质子交给溶剂的能力,用反应的平衡常数表示
-14 -13 -12 -11 -11 -11 -10 -5 -5 -5
pKb 13.36 12.7 11.14 10.82 10.71 10.26 9.26 4.79 4.78 4.76
共扼酸 HCl HAc H2CO3 HCO3H3O+ H2O NH4+ H+ + H+ H+ +
共扼碱 ClAc-
HF+OH-
[ HF ][OH − ] Kb = [F ]
2、多元弱酸、碱强度表示法
HnB Hn-1 B-
H++Hn-1BH++Hn-2B2H++Hn-3B3-
[ H + ][ H n −1 B − ] = K a1 [ H n B]
[ H + ][ H n − 2 B 2− ] = Ka2 − [ H n −1 B ]
1963年R.G.Pearson 等人又把酸和碱各分 为软、硬两类
HB 酸
2、酸碱质子理论的要点
H+ + B质子 碱
凡能给出质子(H+)的分子或离子称为酸;凡是能接受质子(H+)的分子 或离子称为碱。
酸
HCl -----→ H+ HAc -----→ H+ H2CO3 ---→ H+ HCO3- ---→ H+ H3O+ -----→ H+ H2O -----→ H+ NH4+ -----→ H+
K w 1.00 × 10 −14 Kb = = = 5.71 × 10 −10 Ka 1.75 × 10 −5
弱酸 三氯乙酸 二氯乙酸 一氯乙酸 氢氟酸 亚硝酸 甲酸 乙酸 氢氰酸 亚砷酸 硼酸
分 子式 CCl3COOH CHCl2COOH CH2ClCOOH HF HNO2 HCOOH CH3COOH HCN HAsO2 H3BO3
[ H + ][ H n −3 B 3− ] = K a3 2− [ H n −2 B ]
Hn-2B2-
……
2、多元弱酸、碱强度表示法
H2S HS多元碱:
H++HSH+++OHH2S+OH-
[ H + ][ HS − ] = K a1 [H 2S ]
[ H + ][ S 2− ] = Ka2 − [ HS ]
Ka 0.23 5.0×10-2 1.4×10-3 6.6×10-4 5.1×10-4 1.8×10-4 1.8×10-5 6.2×10-10 6.0×10-10 5.8×10-10
pKa 0.64 1.3 2.86 3.18 3.29 3.74 4.74 9.21 9.22 9.24
共扼碱Kb 4.3×10 2.0×10 7.1×10 1.5×10 1.9×10 5.4×10 5.4×10 1.6×10 1.6×10 1.7×10
[ HB ][OH − ] Kb = [B− ]
上述两式相加,平衡常数相乘 H2O+H2O H3 O++OH[ H 3O + ][OH − ] = K a K b
共扼酸碱对:KaKb=Kw pKa+pKb=pKw
三、共扼酸碱强度的关系
共扼酸碱对:KaKb=Kw 已知HAc的Ka=1.75×10-5,求A c-的Kb pKa+pKb=pKw
+ + + + + + +
ClAcHCO3CO32H2O OHNH3
碱
←H+ + ClHAc ← H+ + AcH2CO3 ← H+ + HCO3HCO3- ← H+ + CO32H3O+ ← H+ + H2O H2O ← H+ + OHNH4+ ← H+ + NH3
HCl
共扼酸 HCl HAc H2CO3 HCO3H3O+ H2O NH4+ H+ + H+ H+ +
[ HS − ][OH − ] K b1 = [ S 2− ] Kb2 [ H 2 S ][OH − ] = [ HS − ]
S2-+H2O HS-+H2O
二、酸碱强度的表示
附录:弱酸弱碱的离解常数
K越大、越强 但K通常较小,所以用pK表示。 pK越大,表明越弱
三、共扼酸碱强度的关系
HB+H2O B-+H2O H3O++BHB+OH[ H 3O + ][ B − ] = Ka [ HB ]
给出质子
H+ + B质子 共扼碱
+ HCO3-
HCl+NH3=Cl-+NH4+
接受质子
H+ + CO32H+ + H2O H+ + H+ + OHNH3
3、酸碱反应
给出质子 给出质子
HA + B = A + HB
接受质子
HCl+H2O=Cl- +H3O+
接受质子
给出质子
3、酸碱反应
给出质子
H2O+F-
K w 1.00 × 10 −14 K b1 = = = Ka? ???
pKa+pKb=pKw
K w 1.00 ×10 −14 Kb = = = 1.8 ×10 − 4 K a 2 5.6 ×10 −11
求CO32-的Kb2,即HCO3-的Kb
Kb2 K w 1.00 × 10 −14 = = = 2.2 ×10 −8 K a1 4.3 ×10 −7
酸碱平衡与酸碱滴定法
§3—1酸碱质子理论
一、酸碱的定义
1、酸碱理论发展简介 拉瓦锡酸理论 戴维的酸理论 1883年瑞典化学家 Arrhenius:电离学说 最初从物质的一些性质来认识酸碱
1923年丹麦化学家 J.N.Bronsted和英国化学 家T.M.Lowry :质子理论
1923年美国化学家 G.N.Lewis提出广义 的酸碱电子理论
H2CO3 碳酸 HCO3-
共扼酸碱对:KaKb=Kw
(Ka1)4.3×10-7 (Ka2)5.6×10-11 6.37 10.25
pKa+pKb=pKw
多元酸、碱之间,要正确认识共扼酸碱的关系
Ka1Kbn=kw
H++NH3
[ H + ][ NH 3 ] = Ka + [ NH 4 ]
1、一元弱酸、碱强度表示法
弱碱的强度是指其从溶剂中获得质子的能力,用反应的平衡常数表示
B+H2O NH3+H2O F-+H2O
HB++OH-
[ HB][OH − ] Kb = [B]
+
[ NH 4 ][OH − ] NH4++OH- K b = [ NH ] 3
共扼酸碱对:KaKb=Kw pKa+pKb=pKw
共扼酸越强,对应共扼碱越弱
+ HCO3-
H+ + CO32H+ + H2O H+ + H+ + OHNH3
H2CO3 碳酸 HCO3-
共扼酸碱对:KaKb=Kw
(Ka1)4.3×10-7 (Ka2)5.6×10-11 6.37 10.25
求CO32-的Kb1
