生长素调控种子的休眠与萌发_帅海威
植物激素对种子发育和萌发的调节作用研究

植物激素对种子发育和萌发的调节作用研究植物激素是植物生长和发育的重要因素之一。
它发挥着调节植物生理过程和生长发育的重要作用。
植物激素能够促进或抑制植物生长的不同阶段,特别是对种子生长和萌发起到了至关重要的作用。
本文将主要着重于研究植物激素对种子发育和萌发的调节作用。
首先,植物激素在种子发育过程中起到了重要的调节作用。
其主要表现为:1)在胚珠形成和胚珠发育过程中,激素能够调控花药和子房的形成和发育;2)在胚乳生长发育过程中,激素能够促进种子的发育,从而增加种子的产量和质量。
其次,激素对种子萌发过程的调节也非常重要。
种子萌发是种子生长发育过程中的关键环节,决定了植物后续的生长和发育。
植物激素能够促进种子发芽,加快种子萌发过程,同时也能抑制种子萌发,起到调节的作用。
在种子生长发育过程中,不同类型的激素对种子发育和萌发都发挥着不同的调节作用。
主要包括以下几种:1.赤霉素:赤霉素对种子发育和萌发有促进作用,能够促进种子的胚乳生长和发育,从而增加种子产量和质量。
同时,赤霉素还能刺激种子发芽,加快种子的萌发过程。
2.生长素:生长素在种子发育过程中能够促进种子壳的生长和发育,增加种子的机械强度,同时也能促进种子的萌发。
但是,生长素过量会导致种子某些器官的异常生长,影响种子的生长发育和萌发。
3.脱落酸:脱落酸是一种天然的植物激素,在种子发育和萌发过程中起到重要的调节作用。
它能够促进种子颜色的转变,同时还能促进种子的萌发,同时也能抑制种子的生长发育。
4.乙烯:乙烯参与调节种子生长和发育的多种生理过程。
在种子萌发过程中,乙烯能够促进细胞壁的脱分解,加速种子的萌发。
同时,乙烯还能够抑制胚乳在种子发芽过程中的分解,促进种子的生长发育。
总之,植物激素对于种子的生长发育和萌发有着重要的调节作用。
在种子发育和萌发过程中,激素的种类和浓度决定了植物生长发育的方向和过程。
因此,研究和探究植物激素对种子的调节作用,对于促进植物种子的生长和发育具有重要的意义。
高二生物植物激素调节相关知识点

高二生物植物激素调节相关知识点植物激素是植物内部产生和调节生理过程的化学物质。
它们在植物的生长、发育、代谢和响应环境胁迫等方面起着重要的作用。
本文将介绍高二生物中与植物激素调节相关的几个重要知识点。
一、种子休眠和发芽的调节在植物生命周期中,种子休眠和发芽是关键的生理过程。
植物激素参与了控制种子休眠和促进种子发芽的调节过程。
种子休眠是指种子在一定条件下处于不发芽状态的现象。
激素赤霉素和乙烯在种子休眠和发芽中发挥着重要的作用。
赤霉素是促进种子发芽的激素,而乙烯则可以抑制种子发芽。
种子萌发时,水分和光照的作用可以促进赤霉素的合成,从而促进种子发芽。
二、植物生长的方向调节植物的生长方向受到多种因素的调节,其中包括植物激素的作用。
赤霉素、生长素和植物胚素是常见的影响植物生长方向的激素。
赤霉素和生长素可以促进细胞的伸长和生长,从而影响植物器官的形态。
植物胚素则可以调节根的生长方向,使其向重力方向生长。
这些激素的相互作用和平衡控制了植物的生长方向。
三、植物开花的调节开花是植物生命周期的重要阶段,也是植物繁殖的方式之一。
植物激素参与了调节植物开花的过程。
植物中的类胰岛素生长因子、乙烯和植物胚素等激素在不同的生长阶段起着不同的作用。
类胰岛素生长因子可以促进植物的生长和开花,而乙烯和植物胚素则可以抑制花蕾的形成和开放。
四、光信号和激素信号的相互作用光信号和激素信号在植物的生长和发育中相互作用,共同调节植物的生理过程。
光信号可以影响激素的合成和转运,从而调节植物的生长和发育。
赤霉素在光信号调节中起到了重要的作用。
当植物处于光照条件下,光信号可以促进赤霉素的合成,从而促进植物的生长和开花。
五、植物对环境胁迫的适应植物激素在植物对环境胁迫的适应中起着重要的作用。
例如,脱落酸可以促进植物在干旱条件下关闭气孔,减少水分流失;赤霉素和乙烯可以促使植物在逆境条件下产生防御酶和蛋白,以抵抗外界的压力。
植物激素的调节作用使植物能够更好地适应环境胁迫,维持生长与发育的平衡。
激素对草本植物种子休眠_萌发的影响_于晓丹

150-16001/2014草 业 科 学PRATACULTURAL SCIENCE31卷01期Vol.31,No.01DOI:DOI:10.11829\j.issn.1001-0629.2013-0006激素对草本植物种子休眠、萌发的影响于晓丹,毛培胜(中国农业大学草业科学系,北京100193)摘要:随着我国草产业的快速发展和草种子需求量的不断增加,草种子的品质差和产量低已成为我国草业发展的瓶颈。
研究植物种子休眠和萌发规律是提高种子品质和产量的前提之一,对于保障草种业的健康发展具有重要意义。
植物激素是调节种子休眠、萌发的关键因子,其与种子休眠、萌发的关系一直是种子生理生化研究的热点。
本文旨在综合激素对草本植物种子休眠、萌发影响的研究结果,为进一步分析各种激素间相互作用的机理、揭示植物种子休眠与萌发的生理机制奠定基础。
关键词:激素;赤霉素;生长素;脱落酸;萌发;休眠中图分类号:Q945.3 文献标识码:A 文章编号:1001-0629(2014)01-0150-11*Effects of Hormone on grass seeds’dormancy and germinationYU Xiao-dan,MAO Pei-sheng(China Agricultural University,Department of Grassland Science,Beijing 100193,China)Abstract:With the rapid development of the grassland industry in China and the increasing demands forgrass seeds,the improving of quality and yield of grass seeds have become bottleneck during grass industrydevelopment.It is much important to lucubrate the rules of the grass seeds’dormancy and germinationwhich is one of the premises for quality and yield of grass seed improvement and grassland industry devel-opment.Hormone is one of the key factor for regulating seeds’dormancy and germination which is alwaysa hot topic in seed physiology and biochemistry studies.This paper explore the hormone roles in grassseeds’dormancy and germination to further analysis the interaction and physiological mechanism of differ-ent hormones and grass seeds’dormancy and germination.Key words:hormone;GA;IAA;ABA;germination;dormancyCorresponding author:MAO Pei-sheng E-mail:maops@cau.edu.cn 近年来,随着人民生活水平的提高和我国畜牧业的迅速发展,截至2010年,栽培草地面积达1 181万hm2,改良种草855万hm2[1]。
种子休眠与萌发调控的研究进展

种子休眠与萌发调控的研究进展宋松泉;唐翠芳;雷华平;姜孝成;王伟青;程红焱【期刊名称】《作物学报》【年(卷),期】2024(50)1【摘要】休眠使植物种子能够为萌发安排时间,直到环境条件变得有利于幼苗的存活与生长。
种子的休眠特性具有重要的生态适应性意义和显著的农业价值。
植物激素脱落酸(ABA)和赤霉素(GA)是种子休眠与萌发的关键因素,处于休眠状态的成熟种子含有高水平的ABA和低水平的GA;ABA诱导和维持种子休眠,而GA拮抗ABA的作用和促进种子萌发。
萌发延迟-1 (DOG1)是种子休眠的主要调控因子,与ABA协同作用延迟萌发。
DOG1通过与PP2C ABA过敏感萌发(AHG1/AHG3)结合以增强ABA的信号转导,以及抑制AHG1的作用以增加ABA的敏感性和强加种子休眠。
印记基因在受精前后受到表观遗传机制的调控,与种子休眠的建立与释放密切相关。
近年来,种子休眠的调控研究取得了显著的进展。
本文综述了植物激素ABA和GA对种子休眠与萌发的控制, DOG1调控种子休眠的作用机制,以及种子休眠与萌发的表观遗传调控,并提出了在本领域需要进一步研究的科学问题,以期为深入理解种子休眠与萌发的分子机制、抗穗萌发育种以及促进休眠种子的萌发提供参考。
【总页数】15页(P1-15)【作者】宋松泉;唐翠芳;雷华平;姜孝成;王伟青;程红焱【作者单位】中国科学院植物研究所;湖南师范大学生命科学学院;湘南学院南岭现代种业研究院【正文语种】中文【中图分类】Q94【相关文献】1.植物种子休眠与萌发调控机制研究进展2.一氧化氮调控种子休眠与萌发的研究进展3.植物激素对种子休眠和萌发调控机理的研究进展4.杂草种子休眠与萌发调控的研究进展5.激素调控种子休眠与萌发分子机制研究进展因版权原因,仅展示原文概要,查看原文内容请购买。
第一节 植物的休眠与种子的萌发

植物激素在种子休眠与萌发中的调控机制

植物激素在种子休眠与萌发中的调控机制植物激素在种子休眠与萌发中起着重要的调控作用。
种子休眠是指种子在特殊环境下无法发芽的一种状态,而种子萌发则是种子释放休眠状态并开始生长的过程。
种子休眠与萌发涉及多种植物激素的调节,包括赤霉素、脱落酸、脱落酸酯酶、激动素、乙烯以及腺苷酸等。
赤霉素是一种非常重要的激素,它对种子的休眠与萌发具有双重调节作用。
赤霉素能够促使种子胚轴的伸长和根的形成,从而促进种子的萌发。
在种子休眠期间,赤霉素的含量较低,而在种子开始萌发后,赤霉素含量会随着胚轴和根的伸长而增加。
另外,赤霉素还能激活种子内部的酶的活性,从而加速种子的发芽过程。
在种子休眠中,赤霉素的合成和降解都在起作用。
种子休眠期间,赤霉素的合成受到抑制,导致其含量较低。
在种子发芽的早期阶段,由于赤霉素的降解速度较慢,赤霉素的含量会上升。
随着种子的萌发过程的进行,赤霉素的降解速度会增加,从而促使种子休眠的解除。
脱落酸是一种类似生长素的植物激素,可以促进种子萌发。
在种子休眠的阶段,脱落酸的合成和降解都受到调控。
种子休眠期间,脱落酸的含量较低,但随着种子开始萌发,脱落酸的含量会逐渐上升。
脱落酸通过促进胚乳消化酶的合成和胚乳组织的水解,促进种子的萌发。
此外,脱落酸还可以通过调节种子的AUX/IAA基因家族的表达,从而参与种子的休眠与萌发的调节。
脱落酸酯酶是脱落酸降解的关键酶,它能够催化脱落酸的转化为脱落酸酯。
在种子休眠期间,脱落酸酯酶的活性较低,导致脱落酸的含量较高。
当种子开始萌发时,脱落酸酯酶的活性会上升,从而促使脱落酸的降解。
激动素是一类植物激素,它们能够抑制种子的胚轴伸长和根的形成,从而促进种子的休眠。
激动素的合成和降解在种子休眠与萌发过程中发挥重要作用。
在种子休眠期间,激动素的合成活性较高,同时激动素降解酶的活性较低,导致激动素的含量较高。
在种子开始萌发后,激动素降解酶的活性会增加,从而促使激动素的降解,进一步促进种子的萌发。
植物激素对种子休眠和萌发调控机理的研究进展

(1)知识创新能力:衡量一个国家或地区在科技创新方面的能力,包括研发 投入、科研论文发表量、专利申请与授权等。
(2)技术转化能力:反映一个国家或地区将科技成果转化为现实生产力的能 力,包括技术市场交易额、高新技术产业增加值等。
(3)劳动生产率:衡量一个国家或地区的生产效率,包括人均GDP、工业增加 值率等。
未来,植物激素对种子休眠和萌发调控机理的研究将进一步深入到以下几个方 向:一是发掘更多的功能基因;二是研究基因表达的调控机制;三是探索植物 激素与其他环境因素相互作用对种子休眠和萌发的影响;四是利用基因编辑技 术进行抗逆性和增产性状改良的作物育种实践。这些研究将为农业生产提供新 的理论依据和技术手段,有助于提高作物的产量和质量。
一、植物激素对种子休眠的调控
பைடு நூலகம்
种子休眠是指种子在适宜的萌发条件下,仍不能萌发的现象。它是一种自然的 防御机制,使种子能够在不利的环境条件下保持生存。植物激素在种子休眠过 程中的作用复杂而精细。
1、赤霉素(GA):赤霉素是促进种子萌发的主要激素之一,它可以打破种子 的休眠,促进种子的萌发。赤霉素的作用主要表现在以下几个方面:一是诱导 胚乳的分解,提供胚发育的营养;二是促进细胞伸长和分裂,增加胚的体积; 三是诱导α-淀粉酶的合成,促进淀粉的水解。
赤霉素(Gibberellin,GA)是另一种重要的植物激素,在烟草种子萌发中也 起着关键作用。赤霉素的主要功能是促进细胞的伸长和分裂,以及解除休眠。 研究发现,赤霉素可以刺激细胞伸长和分裂,促进种子的萌发。此外,赤霉素 还可以抑制脱落酸的合成,解除种子的休眠状态。
然而,外源生长素和赤霉素并不是单独发挥作用的。它们通过一种复杂的信号 网络相互影响,共同调控烟草种子的休眠与萌发。一方面,外源生长素可以促 进赤霉素的合成,加强其信号传导途径;另一方面,赤霉素可以增强外源生长 素的细胞伸长和分裂效果。这种相互作用的网络使得烟草种子在面对不同的环 境条件时,能够做出适应性的反应。
植物生长调节剂对种子萌发和插条生根的影响-13生科

实验项目: 植物生长调节剂对种子萌发和插条生根的影响实验学时: 6 学时实验类型:(综合性)每组人数:10 人/组一、实验目的采用培养皿萌发技术和无土栽培技术,用不同种类及浓度植物生长调节剂处理植物种子和插条,使学生了解常见植物生长调节剂的种类及其作用,掌握植物无土栽培技术的操作要领;通过学生全程参与,使其具备初步地实验设计能力;在实验实施过程中培养学生钻研和团结协作精神。
二、实验原理植物生长调节剂(生长素类、生长延缓剂等)是人工合成的、具有激素活性的、能调节植物生长发育的物质。
其中,赤霉素类能打破种子休眠从而促进种子萌发;脱落酸类能促使种子休眠从而抑制种子萌发;生长素类可以促进细胞的生长分裂能力,诱导根原基,促进不定根的生长。
芹菜种子休眠比较明显,通过植物生长调节剂的处理可以调控其萌发速度。
扦插繁殖是剪取植物的根、茎、叶、芽等营养器官的一部分,插入基质中,在一定条件下培养,待其生根后再另行栽植成为完整新植株的方法。
插条经植物生长素类处理后,发根提早,成活率提高。
三、实验试材和试剂1、试材:芹菜种子、虎皮兰插条2、试剂:赤霉素(GA3)、脱落酸(ABA)、α-萘乙酸(NAA)3、器具:培养皿、移液管、吸耳球四、实验方案(一)植物生长调节剂对种子萌发的影响1、植物生长调节剂工作液配制:配制植物生长调节剂(GA3、ABA)溶液工作液(1000mg/L)。
2、将培养皿分组,铺上滤纸,分别加入0、100、200、250、400mg/LGA3和ABA,加入体积为10ml。
全班分为四组,每组做一套处理。
3、选取发育良好且一致的芹菜种子,水选,然后用3%过氧化氢溶液消毒30min。
将培养底部铺上滤纸,将消毒过的种子均匀摆放于滤纸上,盖好上盖,贴好标签。
4、12h后将培养液换为蒸馏水,每皿液体总体积以浸没种子一半为宜(仍然铺上滤纸)。
5、将培养皿放于光照培养箱中,于25℃下进行恒温培养,每天光照时间为8小时,每天补充水2ml,两天更换一次培养液。
探讨生长素调控种子的休眠与萌发
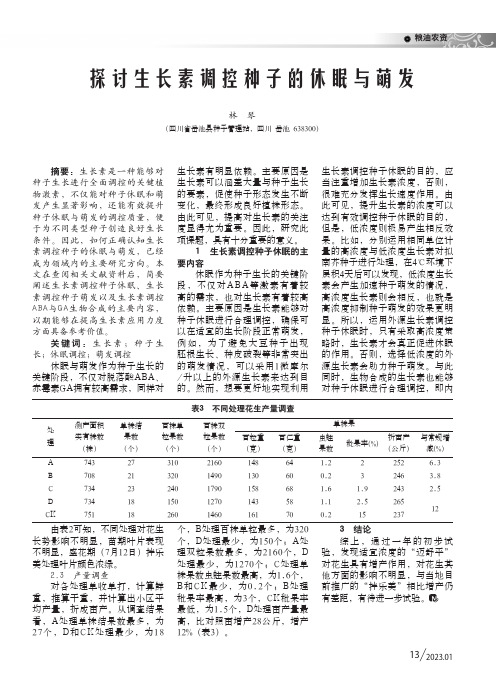
粮油农资 132023.01表3 不同处理花生产量调查处理测产面积实有株数(株)单株结果数(个)百株单粒果数(个)百株双粒果数(个)单株果百粒重(克)百仁重(克)虫蛀果数秕果率(%)折亩产(公斤)与常规增减(%)A 74327310216014864 1.22252 6.3B 708213201490130600.23246 3.8C 73423240179015868 1.6 1.9243 2.5D 73418150127014358 1.1 2.526512CK751182601460161700.215237由表2可知,不同处理对花生长势影响不明显,苗期叶片表现不明显,盛花期(7月12日)拌乐美处理叶片颜色浓绿。
2.3 产量调查对各处理单收单打,计算鲜重,推算干重,并计算出小区平均产量,折成亩产。
从调查结果看,A处理单株结果数最多,为27个,D和CK处理最少,为18个,B处理百株单粒最多,为320个,D处理最少,为150个;A处理双粒果数最多,为2160个,D 处理最少,为1270个;C处理单株果数虫蛀果数最高,为1.6个,B和CK最少,为0.2个;B处理秕果率最高,为3个,CK秕果率最低,为1.5个,D处理亩产量最高,比对照亩增产28公斤,增产12%(表3)。
3 结论综上,通过一年的初步试验,发现适宜浓度的“迈舒平”对花生具有增产作用,对花生其他方面的影响不明显,与当地目前推广的“拌乐美”相比增产仍有差距,有待进一步试验。
摘要:生长素是一种能够对种子生长进行全面调控的关键植物激素,不仅能对种子休眠和萌发产生显著影响,还能有效提升种子休眠与萌发的调控质量,便于为不同类型种子创造良好生长条件。
因此,如何正确认知生长素调控种子的休眠与萌发,已经成为领域内的主要研究方向。
本文在查阅相关文献资料后,简要阐述生长素调控种子休眠、生长素调控种子萌发以及生长素调控ABA与GA生物合成的主要内容,以期能够在提高生长素应用力度方面具备参考价值。
种子休眠与萌发的分子调控

种子休眠与萌发的分子调控种子休眠是指在一定自然条件下,种子内部的生理活动处于低水平,种子不能马上萌发生长的一种状态。
随着休眠的时间增加,种子的生长能力逐渐下降。
种子萌发的分子调控始终是研究者们的热点话题,进一步研究种子萌发的分子机制有助于促进种子萌发和提高农业生产效益。
1. 种子休眠的形成和释放一颗种子只有在适合的环境下才能萌发生长,但是种子在自然界中是不断处于变化的环境中,没有及时的生长,容易被竞争对手抢占、被外部环境破坏。
因此,在种子成熟后,必须进行休眠,以保持种子物质的完整性和维持种子数量的平稳。
种子休眠主要是由营养物质在种子内部的分配和物理化学因素的调节造成的。
种子休眠的过程还涉及到信号转导、基因表达等一系列细胞与分子层面的调控机制。
种子休眠的形成与释放的机制历经多年研究,已经被破解,但是仍然有待于更深入的解析。
2. 种子萌发的制约因素种子在萌发的过程中很容易受到环境条件、化学物质等外界因素的影响,导致种子不能顺利萌发生长。
种子萌发的制约因素主要包括内源因素和外源因素两类。
内源因素包括种子中的抗氧化剂、酶类、蛋白质等物质,这些物质的含量、比例等直接影响到种子的萌发。
外源因素包括温度、湿度、光照等环境因素,这些因素会直接或间接地影响到种子的各种生理生化过程,从而影响到种子的萌发。
3. 种子萌发的分子调控随着科学技术的发展和生物学研究的深入,人们对种子萌发的分子调控越来越了解。
许多基因在种子发育和萌发中发挥了重要的作用。
在此过程中,激素和其他信号分子的作用发挥了最为重要的作用。
主要的激素包括赤霉素、脱落酸、乙烯和脱水素等,以及一些荷尔蒙调节作用的蛋白质。
钙离子能够诱发种子萌发,影响到萌发与非萌发型亚种的符合子身体内交易的信息传递,进而影响种子萌发功能。
转录因子也起着重要的作用。
它们能够促进或抑制基因表达,从而参与种子萌发的调控。
4. 种子萌发的应用种子萌发的研究不仅仅是在学术界表现出其价值,实务界也可以将其应用于农业生产。
种子萌发和休眠的调控

种子萌发和休眠的调控
宋松泉;傅家瑞
【期刊名称】《植物学通报》
【年(卷),期】1993(010)004
【摘要】种子的萌发和休眠受外界因子和种子本身的特征如种子的结构、植物激素的含量以及种子所携带的遗传信息等的影响。
在种子发育后期,种子成熟脱水,处于发育停滞(develop-mental arrest)。
在这个阶段,种子可能是休眠(初生休眠)或者是非休眠(图1)。
休眠种子不可能被完全适合的萌发条件诱导萌发。
【总页数】10页(P1-10)
【作者】宋松泉;傅家瑞
【作者单位】不详;不详
【正文语种】中文
【中图分类】Q945.65
【相关文献】
1.外源激素对蒺藜状苜蓿种子萌发、休眠的调控 [J], 刘建利;曹君迈;任贤
2.外源激素对大葱种子萌发、休眠的调控效应 [J], 尹燕枰;张琳;高荣岐;吴承来;李圣福
3.种子水分对小麦种子萌发与休眠调控的研究 [J], 赵笃乐;王志敏;吴中波
4.外源激素对一串红种子萌发及休眠的调控效应 [J], 张彬;杜芳
5.乙烯的生物合成与信号及其对种子萌发和休眠的调控 [J], 宋松泉;刘军;徐恒恒;张琪;黄荟;伍贤进
因版权原因,仅展示原文概要,查看原文内容请购买。
生长素促进植物生长的原理

生长素促进植物生长的原理生长素是一种天然存在于植物中的激素,它可以促进植物生长和发育,并且对植物的形态、结构、生理和代谢等方面都有影响。
生长素具有很强的生长调节作用,能够控制细胞分裂和分化、促进细胞伸长和增殖、调节叶片生长和落叶、促进根系生长和发育等。
生长素的生理作用主要是通过调节细胞壁松弛和伸长来实现的。
具体来说,生长素可以促进细胞壁松弛酶的活性,使细胞壁的纤维素和半纤维素变得松弛,从而使细胞伸长和增大。
此外,生长素还可以促进细胞分裂和分化,增加细胞数量,进一步促进植物的生长和发育。
生长素的合成和分布受到多种因素的影响,如光照、温度、水分、养分等。
一般来说,生长素主要在植物的顶端和生长点处合成,并通过植物体内的导管系统向下输送。
另外,一些植物组织也可以自行合成生长素,如根、茎、叶、果实等。
生长素在植物生长和发育中的作用非常广泛,具体表现为以下几个方面:1.促进种子萌发:生长素可以促进种子的萌发和生长,从而使植物更快地生长和发育。
2.促进细胞分裂和分化:生长素可以促进细胞的分裂和分化,增加细胞数量,进一步促进植物的生长和发育。
3.促进细胞伸长和增大:生长素可以促进细胞壁的松弛和伸长,使细胞增大,从而促进植物体的生长和发育。
4.调节根系生长和发育:生长素可以促进根系的生长和发育,增加根系的吸收面积,提高植物对养分和水分的吸收能力。
5.调节叶片生长和落叶:生长素可以促进叶片的生长和发育,调节叶片的大小和形状,同时也可以控制叶片的落叶时间和数量。
6.调节植物光合作用:生长素可以影响植物的光合作用,调节叶绿素的合成和光合酶的活性,从而影响植物的生长和发育。
生长素是一种非常重要的植物生长调节激素,它可以影响植物的生长和发育的各个方面,从而使植物更健康、更强壮。
因此,在农业生产中,可以通过施用生长素来促进植物的生长和发育,提高产量和质量,增加农民的收益。
但是,在使用生长素时,也需要注意剂量和使用方法,以避免对植物和环境造成负面影响。
植物生长调节剂促进种子萌发

植物生长调节剂促进种子萌发
种子正常储存下会进入休眠状态,不会萌发,这是植物长期进化过程中形成的。不过,在花卉生产中,为了更好地满足生 产要求和市场需要,可以运用植 物 生 长 调 节 剂 处理可使种子提早结束休眠状态,促进种子萌发,并改善萌发质量。 调节剂种类 以赤霉素处理为最多。赤霉素可以使一些需经低温贮藏的种子发芽,甚至用低温处理也难以打破休眠的一些种子,用赤霉 素溶液处理能有效打破休眠,促进萌发。赤霉素还能使一些喜光的种子在暗环境中发芽。另外,生长素类和细 胞 分 裂 素 等生 长调节剂处理对部分花卉种子的萌发也有促进作用,它们与赤霉素一起使用时往往效果更好。 处理方法 1.种子浸泡法 用植物生长调节剂溶液浸种处理是目前最常用的方法,它是用单一或几种植物生长调节剂溶液直接浸泡种子一定时间以促 进花卉种子萌发。一般说来,所用生长调节剂的浓度高,处理时间就短,反之亦然。 2.溶剂渗入法 用有机溶剂渗入法处理花卉种子的具体做法是:先将赤霉素等植物生长调节剂用纯丙酮或酒精配制成一定浓度的溶液,然 后用它浸泡种子,待种子摊晾至溶剂散尽后再播种。 应用实例 山茶花山茶花种子在收获后播种,萌发极慢,并通常先形成1条主根,过了一段时间后,地上部分才发育。用100毫克/升 的赤霉素溶液浸种24小时,可有效促进种子萌发和幼苗生长。 金丝桃对金丝桃种子采用人工湿润低温处理的方法,可打破休眠,促进萌发。赤霉素溶液处理对金丝桃种子萌发有极明显 的促进作用。可将种子撒在浸有500毫克/升赤霉素的滤纸、砂布上,置于1~4℃下放20天再进行播种,在气温达15~25℃范 围内,可以得到理想的出苗效果。 樱草用100毫克/升赤霉素浸种24小时,可以代替低温处理打破樱草种子休眠,促进萌发。 牡丹牡丹种子有上胚轴休眠现象,层积(5℃)可以打破休眠。用100~300毫克/升赤霉素浸种12~24小时能代替低温处理 促进种子萌发。 蔷薇用150毫克/升赤霉素与10毫克/升6-苄基氨基嘌呤的混合溶液浸蔷薇种子可解除休眠,提早播种,提高发芽率。 大岩桐用10~300毫克/升赤霉素浸种12~24小时,可促进大岩桐种子萌发。 洋桔梗用50毫克/升赤霉素溶液浸泡洋桔梗种子24小时,可以打破休眠,促进萌发。 凤仙花用50~200毫克/升赤霉素溶液浸泡凤仙花种子12~24小时,可促进萌发。 杜鹃用100毫克/升赤霉素浸种24小时,可打破杜鹃(喜光的)种子休眠。 铃兰、紫花地丁用250~500毫克/升赤霉素溶液浸泡铃兰和紫花地丁种子12小时可打破休眠,并提高发芽率。 矮牵牛、报春花用100毫克/升赤霉素溶液浸泡矮牵牛、报春花的种子24小时,可提早发芽并使出芽整齐。 柳叶铁线莲、落地新妇用500毫克/升赤霉素丙酮溶液渗入法处理柳叶铁线莲、落地新妇等花卉种子16小时,可显著提高 发芽率。 植 物 生 长 调 节 剂 生 产 厂 家 青岛百禾源提供植物生长调节剂,叶面肥,细胞分裂素,氯吡脲,膨 大 剂 等。
植物种子休眠和萌发机制的研究

植物种子休眠和萌发机制的研究植物生长的过程看似简单,但是背后涉及的机制却异常复杂。
其中,种子休眠和萌发机制是植物生长过程中最为关键的环节之一。
通过深入研究种子休眠和萌发机制,可以更好地了解植物生长背后的那些精妙机理。
一、什么是种子休眠种子休眠是指种子在成熟后进入到一种沉眠状态,以便等待最佳的发芽条件。
实际上,种子休眠是一种自我保护的机制。
当种子处于不确定的环境中时,它会进入休眠状态,以避免过早萌发,从而影响其生存。
除此之外,种子休眠还有助于控制种子的数量和时机。
通过控制休眠和萌发时机,植物种群可以更加适应环境,从而更好地生存下来。
二、种子休眠的原因种子休眠的原因很多。
其中,最重要的原因是种子需要满足一系列条件才能够萌发。
这些条件包括氧气、水分、温度、光照等多种因素。
如果缺少这些条件中的任何一个,种子就不能够萌发。
因此,种子休眠就成了一种自我保护的机制。
种子休眠的期间可以让种子等待到最佳发芽条件的到来,从而保证植物能够顺利地生长。
三、种子萌发的机制随着种子萌发,植物的生长启动了。
在萌发过程中,种子中的激素起到了很大的作用。
激素是一种化学物质,可以影响植物生长和发育。
在种子休眠期间,激素的含量会积累。
当种子的萌发条件得到满足,激素的含量开始下降,从而促进种子的萌发。
此时,种子开始进行光合作用和呼吸作用,进一步促进了植物的生长。
除了激素之外,种子萌发还受到温度、光照等因素的影响。
当温度和光照等条件符合植物的需要时,种子就会进入萌发状态。
这也是为什么种子一般需要在特定的季节才能够萌发的原因。
四、种子休眠和萌发的应用种子休眠和萌发机制的研究不仅可以增加我们对植物生长的了解,还可以为种植业和园艺业提供很多有益的启示。
首先,通过研究种子休眠和萌发机制,可以帮助人们更好地选择种子,从而获得更好的生长结果。
例如,在特定的季节选择种子,可以确保种子能够更好地生长。
此外,研究种子休眠和萌发机制还可以帮助开发更好的育种方法,从而培育出更适应各种环境条件的植物品种,提高植物的生长效率和产量。
植物种子休眠与萌发的分子机制

植物种子休眠与萌发的分子机制植物种子休眠与萌发是植物生命周期中至关重要的两个阶段。
种子休眠是指种子在一定条件下进入休眠状态,阻止其在不适宜的环境中过早发芽。
而种子萌发则是指种子重新开始生长,并发芽出嫩苗。
这两个阶段在植物生长过程中起到了重要的调节作用。
本文将介绍植物种子休眠与萌发的分子机制。
一、种子休眠的分子机制种子休眠是由一系列复杂的分子调控网络控制的。
在种子休眠过程中,许多信号分子以及相关基因的表达发生了改变。
以下是一些常见的种子休眠的分子机制:1. 激素调节植物生长中的激素在种子休眠过程中起到了关键的作用。
激素类似于动物体内的荷尔蒙,可以通过调节基因表达来控制植物的生长和发育。
在种子休眠中,激素如赤霉素、脱落酸、乙烯等发挥了重要的调节作用。
这些激素的不同浓度可以影响种子休眠的释放和解除,从而调控种子休眠与萌发的转换。
2. 渗透物质种子休眠与渗透物质有着密切的关系。
渗透物质指的是种子中的溶质,如蛋白质、糖类等,它们能够调节种子的水分吸收和释放。
在种子休眠过程中,渗透物质的含量和组成发生改变,从而控制种子的水分平衡。
一旦种子吸水量和渗透物质的含量达到一定程度,种子休眠就会被打破,种子开始进入萌发状态。
3. 细胞周期调控种子休眠与细胞周期的调控密切相关。
细胞周期指的是细胞生长和分裂的周期,包括G1期、S期、G2期和M期。
在种子休眠中,细胞周期呈现出非常缓慢的状态。
这是因为在种子休眠过程中,细胞的生长和分裂被抑制,从而使种子处于休眠状态。
而一旦种子休眠解除,细胞周期加速,种子开始进入萌发状态。
二、种子萌发的分子机制种子萌发是种子从休眠状态回到生长状态的过程。
种子萌发是由一系列复杂的分子调控网络控制的。
以下是一些常见的种子萌发的分子机制:1. 激素调节激素在种子萌发中起着关键的作用。
不同类型的激素可以通过启动或抑制一系列基因表达来促进或抑制种子萌发。
赤霉素是种子萌发过程中最重要的激素之一,它可以促进种子的萌发和幼苗的生长。
中科院植物所科研人员揭示光调控种子休眠和萌发的新机制

菜产业可持续发展综合配套技术服务。
采取专题 培训、现场指导、问题咨询等灵活、多样的全方 位技术服务,加强高山蔬菜基地选择、生产茬口 安排、蔬菜种类与品种选择、土壤培育、有害生 物绿色防控等方面的系统性培训指导,全面提升 菜农的标准化生产意识,树立蔬菜产业的可持续 发展理念,提高菜农的生产技术水平,充分挖掘 高山蔬菜产业的发展潜力,推动当地蔬菜产业的 可持续发展。
3.2逐步改善、培育土壤针对秦巴地区菜田的土壤劣变情况(如十 字花科蔬菜土壤重茬问题),结合当地的小气候 特点,利用高山避雨、高山聚雨、微灌等水资源 利用技术,分析菜田肥料、农药等化学品的投入 现状,积极推广菜田土壤培育技术[34],优化菜田 土壤结构、提高土壤肥力,逐步恢复并全面改善 菜田土壤质量,促进蔬菜生产基地土壤的全面提升。
3.3倡导菜田有害生物的绿色防控根据秦巴地区菜田的主要病虫害发生情况, 引导菜农树立病虫草害的综合防控理念,倡导 “预防为主、绿色防控”的植保意识,杜绝菜田 禁用农药的使用,尽可能避免或减少菜田外源化 学品的投入,确保蔬菜产品的生态、健康与安 全,降低蔬菜生产的成本。
3.4借山地地利优势,推进蔬菜标准化安全生产 在高山蔬菜特色产业升级的目标引领下,借 助秦巴地区自然环境的独特优势,以生产生态、文献综迷___________Vegetables 2019.11健康的高品质蔬菜产品为目标,从蔬菜生产基 地、生产茬口、品种选择及田间管理技术等方 面,推广高山生态、健康蔬菜的配套综合生产技 术,积极推进蔬菜标准化安全生产[5],促进产品 的提质增效,推动当地蔬菜产业的高效发展。
3.5依托专业合作社,充分发挥绿色品牌优势 依托蔬菜专业合作社,引导菜农牢固树立蔬 菜产品质量观念,强化品牌意识,引导人们认 知、认同和参与,增强全民的绿色生产意识和绿色消费意识;利用蔬菜产品的绿色品牌,充实和完善商标使用制度,推行贴标制度和编码制度, 做好蔬菜质量可追溯制度的配套工作,建立蔬菜 质量安全可追溯査询系统。
种子形成、休眠、萌发过程中激素变化的试题

种子形成、休眠、萌发过程中激素变化的试题
在种子形成、休眠和萌发过程中,植物激素起着至关重要的作用。
以下是一系列关于这些过程中激素变化的试题:
一、选择题
在种子形成过程中,哪种植物激素起着关键作用?
A. 赤霉素
B. 细胞分裂素
C. 生长素
D. 脱落酸
休眠种子中的哪种激素含量较高,有助于维持休眠状态?
A. 赤霉素
B. 细胞分裂素
C. 脱落酸
D. 生长素
在种子萌发过程中,哪种激素首先被激活以启动种子萌发?
A. 赤霉素
B. 细胞分裂素
C. 脱落酸
D. 乙烯
二、填空题
在种子形成过程中,__________和__________激素共同促进种子的发育和成熟。
休眠种子中,__________激素的含量较高,以维持种子的休眠状态。
种子萌发时,__________激素首先被激活,打破种子的休眠状态,促进种子的萌发。
三、简答题
描述在种子形成过程中,植物激素如何协同作用以促进种子的发育和成熟。
解释为什么休眠种子中的某些激素含量会升高,并维持种子的休眠状态。
说明在种子萌发过程中,首先被激活的激素是如何打破种子休眠状态并促进种子萌发的。
这些试题旨在考察学生对种子形成、休眠和萌发过程中植物激素变化的理解。
通过回答这些试题,学生可以加深对植物激素在种子生物学中作用的理解。
植物生长和生长素的调控

植物生长和生长素的调控随着人类的发展,我们不断地探索植物的生长规律和生长素的作用机制,以此来促进植物生长,提高农业生产。
植物生长及其生长素调控机制的研究已经成为生物学研究的重要领域之一,具有广泛的应用前景。
一、植物生长植物是一类复杂的生物体,其生长过程非常复杂,受到种种因素的影响。
对于植物的生长过程,不同的环境因素对于不同的植物有着不同的影响。
1.1 光照条件对植物生长的影响一些植物需要光合作用来生存,从而光照对于这些植物的生长有极大的影响。
在光照下照射的光量越长,植物所领受到的光合作用就越高,植物就越快成长。
根据不同的光照条件,不同的植物在生长速度上也有区别。
有些植物需要强光才能成长得更好,而有些植物则需要弱光。
1.2 水分和营养元素的供应水分和营养元素的供应对于植物的生长至关重要。
如果受到干旱、缺水的影响,植物就会生长缓慢、发黄,最终甚至会引起萎蔫死亡。
相同的,如果植物缺乏营养元素,也会导致植物的生长缓慢,叶片发黄等情况。
1.3 温度和病虫害的影响温度过高或过低都可能对植物的生长造成影响。
一些植物需要相对较低的温度环境,而有些植物则喜欢温暖湿润的气候。
病虫害也会对植物的生长和发展产生巨大影响。
一些病虫害会直接破坏植物的生长结构,从而导致植物的生长缓慢,造成植物疾病的发生。
二、生长素的作用生长素是一种重要的植物激素,它在植物的发育、生长和成熟过程中起着重要的作用。
生长素既可以刺激植物的生长、也可以抑制植物的生长。
以下是详细介绍:2.1 种子萌发生长素对于种子萌发来说至关重要。
它能够缩短种子萌发的时间,并促进种子发芽。
同时,生长素也可以以一种特殊的方式影响根的生长、茎的伸展和叶的生长。
因此,生长素不仅对种子的萌发有着重要的作用,同时也能够对于植物的发育产生影响。
2.2 细胞分裂生长素是促进细胞分裂、增生的最重要激素之一。
它能够促进细胞的分裂,从而促进植物的生长。
同时,生长素也能够影响细胞的大小和造型,从而对植物的形态有着重要的影响。
种子(拟南芥)休眠与萌发的调控机制

种子(拟南芥)休眠与萌发的调控机制
钟理;张莉;杨春燕;李辰琼;吴佳海
【期刊名称】《种子》
【年(卷),期】2014(33)9
【摘要】种子萌发是大多数开花植物生长发育的起始阶段,受种子本身的激素水平调控,同时也受外部光照、温度等环境影响,是外部环境与种子自身代谢交互影响的一个复杂的过程.介于其在生产生活上的重要意义,种子萌发一直是植物学研究的热点.本文从激素、光照、细胞修复、组蛋白修饰对种子萌发的调控,同时结合盐胁迫对种子萌发的影响,针对这些热点问题,综述最新的一些研究结果,以期为人们从事相关研究提供参考.
【总页数】5页(P51-55)
【作者】钟理;张莉;杨春燕;李辰琼;吴佳海
【作者单位】贵州省草业研究所,贵阳 558200;贵州省草业研究所,贵阳 558200;贵州省草业研究所,贵阳 558200;贵州省草业研究所,贵阳 558200;贵州省草业研究所,贵阳 558200
【正文语种】中文
【中图分类】Q943
【相关文献】
1.植物种子休眠与萌发调控机制研究进展 [J], 程鹏;王平;孙吉康;费明亮;杨辉
2.基于ARF10转录因子功能验证及其对拟南芥种子休眠和萌发的影响 [J], 李继洋;
代培红;杨洁;刘晓东
3.脱落酸代谢与信号传递及其调控种子休眠与萌发的分子机制 [J], 宋松泉; 刘军; 徐恒恒; 刘旭; 黄荟
4.种子休眠与萌发的表观遗传调控机制 [J],
5.中科院植物所科研人员揭示光调控种子休眠和萌发的新机制 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生长素调控种子的休眠与萌发11 帅海威,孟永杰,罗晓峰,陈锋,戚颖,杨文钰,舒凯2 四川农业大学农学院 生态农业研究所,农业部西南作物生理生态与耕作重点实验室,成都 6111303 摘要:植物种子的休眠与萌发,是植物生长发育过程中的关键阶段,也是生命科学领域的研究热点。
种子4 从休眠向萌发的转换是极为复杂的生物学过程,由外界环境因子、体内激素含量及信号传导和若干关键基5 因协同调控。
大量研究表明,植物激素脱落酸(Abscisic acid, ABA )和赤霉素(Gibberellin acid, GA )是调6 控种子休眠水平,决定种子从休眠转向萌发的主要内源因子。
ABA 与GA 在含量和信号传导两个层次上的7 精确平衡,确保了植物种子能以休眠状态在逆境中存活,并在适宜的时间启动萌发程序。
生长素(Auxin)是8 经典植物激素之一,其对向性生长和组织分化等生物学过程的调控已有大量研究。
但最近有研究证实,生9 长素对种子休眠有正向调控作用,这表明生长素是继ABA 之后的第二个促进种子休眠的植物激素。
本文在10 回顾生长素的发现历程、阐释生长素体内合成途径及信号传导通路的基础上,重点综述了生长素通过与11 ABA 的协同作用调控种子休眠的分子机制,并对未来的研究热点进行了讨论和展望。
12 关键词:生长素;ABA ;GA ;种子休眠;萌发13 The roles of auxin in seed dormancy and germination14 Haiwei Shuai, Yongjie Meng, Xiaofeng Luo, Feng Chen, Ying Qi, Wenyu Yang, Kai 15 Shu16 Key Laboratory of Crop Ecophysiology and Farming System in Southwest China Ministry of China, Institute of 17 Ecological Agriculture, College of Agronomy, Sichuan Agricultural University, Chengdu 611130, China18 Abstract :Seed dormancy and germination are attractive topics in the fields of plant molecular biology as they are 19 key stages during plant growth and development. Seed dormancy is intricately regulated by complex networks of 20 phytohormones and numerous key genes, combined with diverse environmental cues. The transition from 21 dormancy to germination is a very important biological process, and extensive studies have demonstrated that 22 phytohormones abscisic acid (ABA) and gibberellin acid (GA) are major determinants. Consequently, the precise 23 balance between ABA and GA can ensure that the seeds remain dormant under stress conditions and germinate at24收稿日期:2015-11-11;修回日期:2015-12-30基金项目:国家重点基础研究发展计划(973计划)(编号:2011CB100402)和中国博士后科学基金项目(编号:2014M552377)资助[Supported by the National Basic Research Program of China (No. 2011CB100402) and China Postdoctoral Science Foundation (No. 2014M552377)]作者简介:帅海威,在读硕士研究生,专业方向:植物分子生物学。
E-mail: shuaihaiwei@ 通讯作者:舒凯,博士,副研究员,硕士生导师,研究方向:植物遗传学、分子生物学。
E-mail: kshu@杨文钰,教授,博士生导师,研究方向:大豆栽培生理。
E-mail: mssiyangwy@网络出版时间:2016-03-02 15:05:07网络出版地址:/kcms/detail/11.1913.R.20160302.1505.004.html25optimal times.Here we review the role of auxin in seed dormancy and germination. Auxin is one of the classic 26phytohormones effective during tropism growth and tissue differentiation. Recent studies, however, show that 27auxin possesses positive effects on seed dormancy, which suggests that auxin is the second phytohormone that 28induces seed dormancy, besides ABA.We will focus on the synthetic effects in detail between auxin and ABA 29pathways on seed dormancy and propose future research directions.30Keywords: auxin; ABA; GA; seed dormancy; germination3132种子的休眠(Dormancy)和萌发(Germination)是种子的两种发育状态,两者既彼此33联系又相互区别。
休眠是指具有生命活力的种子,在适宜的环境条件(温度、湿度、光照、34氧气供应等)下,不能萌发或无法完成萌发的一种生理状态[1]。
休眠能够提高种子防御逆境35的能力,保障自身遗传信息的延续性。
依据休眠发生时间的不同,种子休眠又可分为初级休36眠和次级休眠。
种子在成熟过程中,由于脱落酸(Abscisic acid, ABA)含量增加而诱发的休37眠称为初级休眠;而次级休眠则是指种子在萌发期间,因外界环境条件突然变化(如温度降38低等),萌发程序暂时中止而进入休眠状态[2]。
萌发是指种子吸胀后,代谢作用增强,与种39子萌发相关的关键基因开始表达,胚根逐渐伸长最终突破种皮的过程[3]。
在农业生产中,调40控种子休眠与萌发具有重大生产意义:一方面,如果种子萌发率不高,造成作物出苗率低或41出苗不整齐,将导致作物大幅度减产;另一方面,如果种子休眠水平过低,易导致穗发芽,42严重影响种子的产量与品质,以上两方面均不利于农业生产[4, 5]。
因此,深入研究植物种子43的休眠与萌发,调控种子在适宜的时间和地点萌发,对农业生产的发展具有重要推动作用。
44种子的休眠与萌发受到内部基因和外界环境因子的共同调控,植物在感受环境因素的变45化后会相应的调整相关基因表达,进而影响植物中激素水平的变化。
而激素含量的变化,以46及不同激素之间的相互作用,在很大程度上影响种子的休眠与萌发。
经典的植物激素包括生47长素(Auxin)、赤霉素(Gibberellin, GA)、细胞分裂素(Cytokinin, CTK)、脱落酸(Abscisic 48acid, ABA)、乙烯(Ethyne, ETH)和油菜素甾醇(Brassinosteroid, BR),以上激素精细而49准确地调控着植物生长发育的整个过程[6]。
大量研究表明,经典植物激素中的ABA和GA 50在种子的休眠与萌发过程中具有决定性的作用[7],其中ABA能够促进种子或芽的休眠[8];51而GA则有助于打破休眠,促进萌发[9]。
在调控种子休眠和萌发的过程中,ABA与GA含量52的动态平衡决定种子的休眠与否。
在ABA合成基因突变体,如nced3、nced5、nced9、aba2 53和aao3等种子中,ABA的合成受到抑制,其萌发速率明显快于野生型种子[10, 11];而在ABA 54合成过量的基因型,如ABA2、ABI4、NCED6和NCED9等过表达植株的种子中,其休眠程55度加深[12~14]。
相反,在GA合成受阻的突变体如ga1中,其种子中GA含量极低,在正常情56况下无法完成萌发,需施加外源GA后才能帮助其启动萌发[15]。
因此ABA和GA含量之间57的动态平衡,对种子正常的休眠与萌发至关重要[16]。
58生长素是经典植物激素之一,其对向性生长、组织分化等过程的调控已有大量深入的研59究。
最近研究证实,生长素对种子的休眠有正向调控作用,表明生长素是继ABA之后第二60类促进种子休眠的激素[17]。
本文在回顾生长素的发现历程、阐释生长素体内合成途径及信61号传导通路的基础上,重点综述了生长素通过与ABA的协同作用正向调控种子休眠的分子62机制,并对将来研究的重点进行了讨论和展望。
631 生长素简介641.1 生长素的发现65生长素是最早被应用于植物科学研究的激素之一。
早在19世纪80年代,在对植物的66向地性和向光性进行研究时,科学家们便发现这是因为某种物质分布不均所导致。
然而直到671931年,人们才在人尿液中分离出这一物质,并将其描述为一种可移动的、调控向性生长68的物质,且将其命名为3-吲哚乙酸(IAA)。
随着研究的深入,其他3种天然的生长素陆续69被发现,分别是4-氯-3-吲哚乙酸(4-CI-IAA)、苯乙酸(PAA)和3-吲哚丁酸(IBA)。
其70共同点是都含有一个芳香环和一个羧酸基,这也是决定其生理功能的活性功能团[18]。
植物71体内同时含有这4种不同形式的生长素,其中IAA的生物活性最强[19]。
72除调节向性生长外,后续的研究发现生长素还能调控植物生长发育的其他多个方面,73如调控组织分化[20]、器官发生和形态建成[21]、顶端优势[22]和花期[23]等。
