硫酸亚铁铵滴定液
硫酸亚铁铵滴定液配制和标定标准操作规程

3.配制取硫酸亚铁铵40g,溶于预先冷却的40ml硫酸和200ml水的混合液中,加水适量使成1000ml,摇匀。
4.标定精密量取本液25ml,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。根据硫酸铈滴定液(0.01mol/L)的消耗量,算出本液的浓度,即得。
5.结果计算。
式中:FFe(NN4)2(SO4)2表示硫酸亚铁铵滴定液的校正因子。
Fce(SO4)2表示硫酸铈滴定液的校正因子。
VFe(NN4)2(SO4)2表示硫酸亚铁铵滴定液的取样量。
V·ce(SO4)2表示消耗硫酸铈滴定液的体积。
6.注意事项
6.1本液临用前标定浓度。
6.2标定中采用邻二氮菲指示液,以硫酸铈滴定液直接标定,由于指示液中含有一定
量的硫酸亚铁,会消耗微量硫酸铈滴定液,故不宜多加。
7.技术要求
7.1贮藏:置玻璃塞的棕色玻璃瓶中,密闭,在凉处保存。
7.2复标规定:即标即用。
文件名称
硫酸亚铁铵滴定液配制和标定标准操作规程
编码
页数
1
实施日期
制订人
Hale Waihona Puke 审核人批准人制订日期
审核日期
批准日期
制订部门
质管部
分发部门
检验室
目 的:制定硫酸亚铁铵滴定液配制和标定标准操作规程。
适用范围:硫酸亚铁铵滴定液的配制和标定。
责 任:检验室人员按本规程操作,检验室主任监督本规程的实施。
程 序:
1.仪器用具十万分之一分析天平、容量瓶、移液管、锥形瓶、量筒、滴定管等。
硫酸亚铁铵滴定法测定六价铬 -回复

硫酸亚铁铵滴定法测定六价铬-回复硫酸亚铁铵滴定法是一种常用于测定六价铬含量的分析方法。
本文将详细介绍硫酸亚铁铵滴定法的原理、步骤以及数据处理方法,以帮助读者更好地了解和掌握这一分析方法。
一、原理介绍硫酸亚铁铵滴定法是一种氧化还原反应,其原理基于硫酸亚铁铵(NH4Fe(SO4)2)与六价铬(Cr(VI))之间的反应。
在酸性条件下,六价铬会与硫酸亚铁铵反应生成三价铬(Cr(III))和硫酸铵(NH4SO4)。
该反应可以用如下方程式表示:6 NH4Fe(SO4)2 + 14 H2SO4 + K2Cr2O7 →2 Cr2(SO4)3 + K2SO4 + 6 Fe2(SO4)3 +14 NH4HSO4 + 7 H2O在滴定过程中,我们需要使用硫酸亚铁铵溶液作为滴定剂。
滴定剂的浓度根据样品中六价铬的含量进行调整。
二、实验步骤1. 样品准备:将待测样品溶解于适量的盐酸中,使得样品中的六价铬完全转化为三价铬。
在溶解过程中,可以加热加快反应速率。
稍凉后,使用定容瓶将体积补至标线。
2. 酸性化处理:取一定体积的样品溶液放入滴定瓶中,加入适量的稀硫酸和硫酸铵,调节溶液的酸性,通常使用酸性介于1-2之间的溶液来实现适当的酸性化。
3. 滴定:用制备好的硫酸亚铁铵滴定溶液滴定样品溶液。
在滴定过程中,加入亚铁铵滴定溶液要缓慢,避免溶液蒸发过快。
滴定至反应终点,即观察到溶液从橙黄色变成浅绿色。
此时滴定剂与样品中的六价铬完全反应,样品中不应再有剩余的六价铬。
滴定过程中可以使用玻璃棒搅拌溶液,使反应更加均匀。
4. 数据处理:根据滴定剂的浓度和滴定所消耗的体积计算样品中六价铬的含量。
滴定终点的判断通常使用外加指示剂进行,如二苯基卡宾(DPC)或硫代硫酸盐。
将滴定所用滴定剂的体积与滴定剂浓度的乘积除以样品体积,即可得到六价铬的含量。
三、注意事项1. 在样品的酸性化处理过程中,要注意避免产生气泡,否则可能影响滴定结果。
2. 操作过程中要注意实验室安全,避免接触皮肤和眼睛,并避免吸入滴定剂中释放的有毒气体。
硫酸亚铁铵滴定法

硫酸亚铁铵滴定法
采用磷酸及高氯酸溶样,氧化至高价态,然后用硫酸亚铁铵滴定就可以了。
试样用磷酸分解后,以硝酸银作催化剂,用过硫酸铵将二价锰氧化至七价锰,以硫酸亚铁铵标准溶液滴定。
其反应式如下:
2Mn2+ + 5S2O82- + 8H2O =AgNO3= 2MnO4- + 10SO4 + 16H+
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
铬、钒、铈定量干扰。
本法适用于1%以上锰的测定。
【分析步骤】
称取0.2000g试样于300mL锥形瓶中,加15mL磷酸,3~5mL硝酸,置于高温电炉上(360℃)加热溶解,在溶解过程中不断摇动,使试样分解,一直加热至瓶内液面平静无气泡,取下,冷至70℃左右,加100mL水溶解稠状物,加入1mL 10g/L硝酸银,10~15mL 200g/L过硫酸铵溶液,4粒玻璃珠,加热煮沸7min,取下,在流水中冷却至室温,用硫酸亚铁铵标准溶液滴定至浅红色,加入3~4滴苯代邻氨基苯甲酸指示剂,继续滴定至亮黄绿色,即为终点。
【注意事项】
加热煮沸的时间应严格控制,如煮沸时间太短,过剩的氧化剂未完全破坏,使结果偏高,煮沸时间太长,形成的高锰酸易分解,使结果偏低。
因此,煮沸时间以出现大气泡后开始计算,再保持7min为宜。
【计算】
Mn(%)=100TV/G
式中
T—滴定度,与1mL硫酸亚铁铵标准溶液相当的以克表示的锰的质量,g;
V—滴定时消耗硫酸亚铁铵标准溶液的体积,mL;
G—称取试样量,g。
硫酸亚铁铵标准溶液标定的原理

硫酸亚铁铵标准溶液标定原理一、亚铁离子还原性硫酸亚铁铵中的亚铁离子具有还原性,可以与氧化剂发生反应。
在标定过程中,使用高锰酸钾等强氧化剂与亚铁离子发生氧化还原反应,通过滴定法测定反应消耗的氧化剂量,从而确定亚铁离子的含量。
二、滴定反应原理在标定硫酸亚铁铵溶液时,通常使用高锰酸钾作为氧化剂。
高锰酸钾与亚铁离子反应生成锰离子和铁离子,其反应方程式为:KMnO4 + 5Fe2+ + 4H+ → Mn2+ + 5Fe3+ + K+ + 2H2O通过加入合适的还原剂(如草酸),将高锰酸钾还原为锰离子,当所有的高锰酸钾都被还原后,滴定即到达终点。
三、浓度准确性为了确保标定结果的准确性,必须使用准确浓度的试剂进行标定。
在实验过程中,可以采用已知准确浓度的标准溶液进行标定,或通过其他方法(如称重法)确定试剂的准确浓度。
同时,标定过程中应进行空白实验,以消除试剂误差。
四、实验操作规范在标定过程中,应遵循正确的实验操作规范,包括准确称量试剂、控制滴定速度、选择合适的指示剂等。
实验操作应保持一致,以减小误差。
五、试剂选择与质量标定硫酸亚铁铵溶液所使用的试剂应符合质量要求,以保证实验结果的准确性。
对于试剂的选择,应选用纯度高、稳定性好的化学试剂,并确保试剂在有效期内使用。
同时,应定期对试剂进行质量检查,以确保其质量可靠。
六、溶液配制与保存硫酸亚铁铵标准溶液的配制和保存应注意以下几点:1. 按照规定的浓度和体积准确称量硫酸亚铁铵固体,并使用去离子水配制成标准溶液。
2. 配制好的标准溶液应保存在干燥、避光的地方,避免受潮和污染。
3. 对于长期保存的标准溶液,应定期进行浓度复核,以确保其有效性。
4. 在使用标准溶液前,应将其充分摇匀,以确保浓度均匀。
七、误差分析与处理在标定过程中,误差的产生是不可避免的。
为了减小误差,可以采用合适的实验方法和技术手段,如平行实验、控制变量法等。
同时,应对实验结果进行误差分析,找出误差产生的原因,并采取相应的措施进行处理和纠正。
硫酸亚铁铵标准溶液标定

硫酸亚铁铵标准溶液标定
硫酸亚铁铵标准溶液是化学实验室中常用的一种溶液,用于分析化学中的定量
分析。
标定硫酸亚铁铵标准溶液是为了确定其准确浓度的过程,是实验室中非常重要的一步。
本文将介绍硫酸亚铁铵标准溶液的标定方法及步骤。
首先,准备好所需的试剂和设备,包括硫酸亚铁铵标准溶液、硝基甲酚指示剂、稀硫酸、标定瓶、容量瓶、移液管等。
其次,进行标定操作。
首先,取一定体积的硫酸亚铁铵标准溶液,加入标定瓶中。
然后,加入适量的稀硫酸,并滴加硝基甲酚指示剂。
用标定瓶摇匀混合溶液,使之充分反应。
接着,用稀硫酸溶液对硫酸亚铁铵标准溶液进行滴定,直至溶液由无色变为微红色。
记录下滴定所需的稀硫酸溶液的体积。
最后,计算出硫酸亚铁铵标准溶液的准确浓度。
根据滴定所需的稀硫酸溶液的
体积,结合反应的化学方程式,可以计算出硫酸亚铁铵标准溶液的浓度。
需要注意的是,在进行硫酸亚铁铵标准溶液标定的过程中,应当严格按照操作
规程进行,避免操作失误。
另外,在使用试剂和设备时,要注意安全,避免发生意外。
总之,硫酸亚铁铵标准溶液的标定是化学实验室中的重要操作,需要严格按照
标定方法和步骤进行操作,以确保标定结果的准确性。
希望本文所介绍的硫酸亚铁铵标准溶液标定方法能对大家有所帮助。
硫酸亚铁铵滴定液标定记录单

名称
硫酸亚铁铵滴定液
配制浓度
0.1mol/L
标定温度
℃
标定浓度
mol/L
相对湿度
%
配制量
ml
配制日期
年月日标定人标定来自期年月日依据《中国药典》2010年版二部
标定:
精密量取本液25ml,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。根据硫酸铈滴定液(0.01mol/L)的消耗量,算出本液的浓度。即得。
消耗硫酸铈滴定液(0.1mol/l)的毫升数:
⑴ml;⑵ml;⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应
%。标定结果。
标定人:
硫酸亚铁铵标准溶液

硫酸亚铁铵标准溶液
硫酸亚铁铵标准溶液是一种常用的化学试剂,通常用于分析化学和环境监测等领域。
它具有稳定性好、溶解度高、易于保存等特点,因此在实验室和工业生产中被广泛应用。
本文将对硫酸亚铁铵标准溶液的制备方法、性质及应用进行介绍。
首先,硫酸亚铁铵标准溶液的制备方法。
通常情况下,制备硫酸亚铁铵标准溶液需要准备硫酸亚铁铵、蒸馏水和标准溶液瓶等材料。
具体操作步骤为,先称取一定质量的硫酸亚铁铵,然后加入适量的蒸馏水,搅拌溶解至均匀,最后定容至标准溶液瓶的刻度线。
制备好的硫酸亚铁铵标准溶液应密封保存,避免阳光直射和高温。
其次,硫酸亚铁铵标准溶液的性质。
硫酸亚铁铵是一种无机化合物,化学式为Fe(NH4)2(SO4)2,它呈现出白色结晶或粉末状。
硫酸亚铁铵在水中溶解度较高,可以溶解于水形成澄清的溶液。
在制备标准溶液时,需要根据实际需要选择合适的浓度和体积比例,以确保溶液的准确度和稳定性。
最后,硫酸亚铁铵标准溶液的应用。
硫酸亚铁铵标准溶液常用于分析化学中的还原滴定、络合滴定和氧化滴定等实验中。
此外,
它还可以作为环境监测中的水质分析和废水处理等方面的重要试剂。
在应用过程中,需要严格按照操作规程进行,以确保实验结果的准
确性和可靠性。
综上所述,硫酸亚铁铵标准溶液作为一种重要的化学试剂,在
化学分析和环境监测领域具有广泛的应用前景。
通过本文对其制备
方法、性质及应用的介绍,相信读者对硫酸亚铁铵标准溶液有了更
深入的了解,也能更加准确地应用于实际工作中。
希望本文能对相
关领域的科研工作者和实验人员有所帮助。
2020版《中国药典》硫酸亚铁铵滴定液配制与标定操作规程
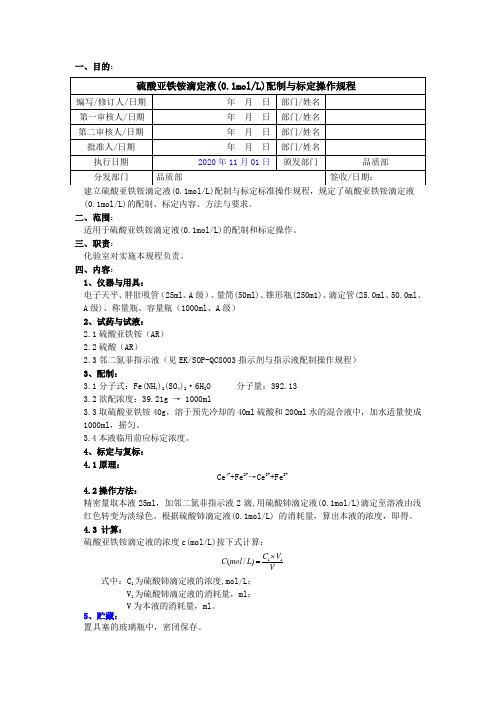
一、目的:(0.1mol/L)的配制、标定内容、方法与要求。
二、范围:适用于硫酸亚铁铵滴定液(0.1mol/L)的配制和标定操作。
三、职责:化验室对实施本规程负责。
四、内容:1、仪器与用具:电子天平、胖肚吸管(25ml 、A 级)、量筒(50ml)、锥形瓶(250m1)、滴定管(25.0ml 、50.0ml 、A 级)、称量瓶、容量瓶(1000ml 、A 级)2、试药与试液:2.1硫酸亚铁铵(AR )2.2硫酸(AR )2.3邻二氮菲指示液(见EK/SOP-QC8003指示剂与指示液配制操作规程)3、配制:3.1分子式:Fe(NH 4)2(SO 4)2·6H 2O 分子量:392.133.2欲配浓度:39.21g → 1000ml3.3取硫酸亚铁铵40g ,溶于预先冷却的40ml 硫酸和200ml 水的混合液中,加水适量使成1000ml ,摇匀。
3.4本液临用前应标定浓度。
4、标定与复标:4.1原理:Ce 4++Fe 2+→Ce 3++Fe 3+4.2操作方法:精密量取本液25ml ,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。
根据硫酸铈滴定液(0.1mol/L) 的消耗量,算出本液的浓度,即得。
4.3 计算:硫酸亚铁铵滴定液的浓度c(mol/L)按下式计算:VV C L mol C 11)/(⨯=式中:C 1为硫酸铈滴定液的浓度,mol/L ;V 1为硫酸铈滴定液的消耗量,ml ;V 为本液的消耗量,ml 。
5、贮藏:置具塞的玻璃瓶中,密闭保存。
五、参考文献:《中国药典》2020年版四部通则8006 P431 六、相关文件:EK/SOP-QC8003指示剂与指示液配制操作规程七、相关记录:N/A八、变更记录及原因:。
矿石中钒的测定:硫酸亚铁铵滴定法测

矿石中钒的测定:硫酸亚铁铵滴定法测试样经硫磷混酸溶解后以硫酸亚铁铵溶液还原铬酸及其它氧化性物质,此时钒也同时被还原,再用高锰酸钾溶液将钒氧化成高价,过量高锰酸钾溶液用尿素-亚硝酸钠还原除去,以苯代邻氨基苯甲酸作指示剂,用硫酸亚铁铵标准溶液滴定。
其反应如下:V2O2(SO4)2+2KMnO4+22H2O=10H3VO4+K2SO4+7H2SO4+2MnSO45NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+3H2O+K2SO4(NH4)2CO+2NaNO2+H2SO4=CO2+2N2+NaSO4+3H2O2FeSO4+2HVO3+3H2SO4=Fe2(SO4)3+2(VO)SO4+4H2O大量铀与钼的存在使测定结果偏高,低含铀钼对测定的干扰不显著。
钨的影响可被磷酸络合而掩蔽,在不含磷酸的酸介质中氧化钒(Ⅳ)时,铈(Ⅲ)不干扰。
如用高氯酸冒烟氧化钒(Ⅳ)时,也只能氧化钒(Ⅳ)而不氧化铈(Ⅲ)。
本法适用于矿中0.05%以上五氧化二钒的测定。
试剂配制:硫酸亚铁铵溶液(49g/L):称取40克硫酸亚铁铵溶于1000mL硫酸(1+19)中。
苯代邻氨基苯甲酸指示剂(2g/L):0.2克指示剂溶于100mL2g/L碳酸钠溶液中。
硫磷混酸:在500mL水中加入150mL硫酸,冷却后加入150mL磷酸,以水稀释至1000mL重铬酸钾标准溶液[c (1/6K2CrO7)=0.002500mol/L]:称取0.1226克重结晶并于150℃烘过1h的重铬酸钾,加少量水溶解后移入1000mL容量瓶中,以水定容。
硫酸亚铁铵标准滴定溶液(0.0025 mol/L):称取1克六水硫酸亚铁铵溶于1000mL硫酸(1+19)中混匀。
标定:移取50.00mL硫酸亚铁铵标准滴定溶液于250mL三角瓶中加入50mL水,加入10mL盐酸及15 mL硫磷混酸,加入3滴5g/L二苯胺磺酸钠指示剂,用重铬酸钾标准溶液[c(1/6K2CrO7)=0.002500mol/L]滴定至微紫色即为终点。
重铬酸钾电位滴定硫酸亚铁铵溶液实验报告(华南师范大学)

实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级班级 课程名称 仪器分析实验 实验项目 重铬酸钾电位滴定硫酸亚铁铵溶液 实验类型 □验证 □设计 □综合 实验时间 2020 年 10 月 11 日 指导老师 郭慢丽 实验评分一、 实验目的1. 学习电位滴定的基本原理和实验操作2. 熟悉酸度计的使用方法二、 实验原理用重铬酸钾(K 2Cr 2O 7)滴定 Fe 2+,反应式为:反应式中氧化态和还原态都是离子,可用惰性金属铂电极作指示电极,饱和甘汞电极(SCE ,ESCE = 0.244 V )为参比电极组成原电池。
电池的电动势(E )表达式如下:滴定过程中, 随着 K 2Cr 2O 7 的加入,E 值逐渐增大,在计量点附近产生突跃。
因此测量 E 的变化,可确定滴定终点。
化学计量点时,在本实验条件下,φθ’Cr 2O 72-/Cr 3+ ≈ 1.02 V ,φθ’Fe3+/Fe 2+ ≈ 0.68 V ,[Cr 3+] ≈0.002 mol/L ,[H+]≈0.5 mol/L ,计算得出 φsp ≈ 0.91 V 。
可选用邻苯胺基苯甲酸(φln V 89.0'ln =θϕ=)做指示剂,其氧化态为紫红色,还原态为无色。
邻苯胺基苯甲酸的结构式如下:三、仪器和试剂1.仪器:酸度计、磁力搅拌器、铁架台、酸式滴定管、铂电极、饱和甘汞电极、移液管、吸耳球、洗瓶2.试剂:0.0100 mol/L K2Cr2O7标准溶液、0.2%邻苯胺基苯甲酸溶液、3 mol/L H2SO4溶液四、实验内容与步骤1.用指示剂法确定终点准确移取10.00 mL 硫酸亚铁铵溶液于150 mL 烧杯中,加入3 mol/L H2SO4溶液8~10 mL,加水至约50 mL,加8滴邻苯胺基苯甲酸指示剂,用0.0100 mol/L K2Cr2O7滴定。
随着滴定的进行,溶液中逐渐出现浅绿色(Cr3+),当浅绿色变为紫色,即为终点,记录K2Cr2O7的消耗体积V1 mL。
重铬酸钾电位滴定硫酸亚铁铵溶液操作指导书.

操作练习三重铬酸钾电位滴定硫酸亚铁铵溶液一、目的要求1、学习利用离子计(酸度计)进行电位滴定的方法和操作技术。
2、掌握电位滴定分析确定滴定终点得计算方法3、进一步熟悉离子计(酸度计)得使用方法。
二、基本原理电位滴定法是一种用电位法来确定终点的容量分析法。
进行电位测量时,用指示电极和参比电极插入待测溶液中组成一个工作电池。
随着滴定剂的不断加入,由于滴定反应,待测离子或与之有关的离子浓度不断变化,指示电极电位也发生相应的变化,在化学计量点附近,由于离子浓度的突跃,而产生电位的突跃,因此测量电池电动势的变化,就能确定滴定终点。
用K2Cr2O7溶液滴定Fe2+的反应为:Cr2O72-+ 6Fe2++14H+=2Cr3++ 6Fe3++7H2O两个电对的氧化型和还原型都是离子,这类氧化还原滴定可用惰性金属铂电极作指示电极,饱和甘汞电极作参比电极组成原电池。
在滴定过程中,由于滴定剂(Cr2O72-)的加入,待测离子氧化态(Fe3+)和还原态(Fe2+)的活度(或浓度)比值发生变化,铂电极的电位亦发生变化,在等当点附近产生电位突跃,可用作图法和二阶微商计算法确定终点。
三、仪器与试剂1、仪器PXD-2型(或其他型号)离子计或精密酸度计 1台电磁搅拌器 1台2213型(或其它型号)铂电极 1支232型甘汞电极 1支常量酸式滴定管 1支移液管 25mL 1支烧杯 150mL 1只2、试剂0.0167mol/L K 2Cr 2O 7溶液准确称取4.9032g 在120℃干燥过的K 2Cr 2O 7,溶于水中,转移到1000mL 容量瓶中, 稀释到刻度。
H 2SO 4, H 3PO 4混合酸(1+1)氧化还原指示剂 0.2%邻苯氨基苯甲酸或0.5%邻二氮菲—硫酸亚铁溶液。
四、操作步骤1、铂电极处理。
将铂电极浸入10%HNO 3溶液中煮沸5min ,必要时可用氧化焰燃烧铂片数分钟,再用10%HNO 3浸沸。
使用前用HCI 溶液浸泡片刻后洗涤干净。
硫酸亚铁铵标准溶液 用途

硫酸亚铁铵标准溶液用途
硫酸亚铁铵标准溶液一般用于化学实验室中的定量分析,主要用途有以下几个方面:
1. 作为滴定试剂:硫酸亚铁铵可与氧气反应生成氧气化亚铁离子,可以用于滴定测定氧含量。
2. 作为还原剂:硫酸亚铁铵可以作为还原剂还原其他物质,例如还原三氟化硼、还原过氧化氢等。
3. 作为缓冲液:硫酸亚铁铵可以与硫酸一起组成一个缓冲液,用于调节溶液的酸碱性。
4. 作为电镀剂:硫酸亚铁铵可用于金属的电镀,例如使用硫酸亚铁铵电镀铜。
5. 作为计量溶液:硫酸亚铁铵标准溶液可以用于一些化学试剂的浓度测定、pH值调节等等。
需注意的是,硫酸亚铁铵标准溶液在储存和使用中应避免与空气接触,以免发生氧化反应,导致溶液浓度偏高或不准确。
锰的测定(硫酸亚铁铵滴定法)

锰的测定-硫酸亚铁铵滴定法一、硝酸铵作为氧化剂原理:本法以磷酸为溶解剂和络合剂,在浓的热磷酸介质中,在硝酸铵或高氯酸将锰(II )氧化到锰(III )的络合物,以苯代邻氨基苯甲酸为指示剂,亚铁标准溶液滴定锰(III )。
其反应式如下:2 Mn 2+ + NO 3- + 4 PO 3-4 + 2 H+ = 2[Mn (PO 4)2]3- + NO 2- + H 2O NO 2- +NH 4+ = N 2 + 2 H 2O或14 Mn 2+ + 2ClO 4- + 28 PO 3-4 +16 H + =14[Mn (PO 4)2]3- + Cl 2 + 8 H 2O2 mg 钛、0.2 mg 铈、0.1 mg 五氧化二钒、铬(III )对锰的干扰不显著,但其量高时,需加以校正。
试剂配制:苯代邻氨基苯甲酸指示剂:0.2g 指示剂溶于100 mL 2g /L 碳酸钠溶液中。
硫酸亚铁铵标准溶液:c ( Fe 2+ ) ≈ 0.02 mol /L ,称取8 g 硫酸亚铁铵[Fe(NH 4)2 (SO 4)2·6 H 2O]溶于1 L5%(V/V )硫酸中(如混浊须过滤),储存于棕色瓶中。
标定:量取30.00 mL 硫酸亚铁铵标准溶液于300 mL 锥形瓶中,加水50 mL ,20 mL 硫-磷混酸,5 mL 盐酸,3滴5 g/L 二苯胺磺酸钠指示剂,用0.02 mol/L 1/6 K 2Cr 2O 7 标准溶液滴定至稳定的紫色,即为终点。
分析步骤:称取0.2000 g 试样于300 mL 锥形瓶中,加15 mL 磷酸,3~5 mL 硝酸,置于高温电炉上(360℃)加热溶解,在溶解过程中不断摇动,使试样分散,一直加热至瓶内液面平静无气泡,取下,稍冷2~3 min (此时瓶内尚冒微烟,温度约230℃),加入2g 硝酸铵,并充分摇动使锰(III )生成完全,用洗耳球吹风驱尽黄色气体,冷至70℃左右,加入50 m L 5%(V/V )硫酸,摇动使稠状物溶解,流水冷却至室温,用硫酸亚铁铵标准溶液滴定至浅红色,滴加3~4滴苯代邻氨基苯甲酸指示剂,继续滴定至亮黄绿色,即为终点。
硫酸亚铁铵滴定法测定锰

硫酸亚铁铵滴定法测定锰Determination of Manganese by Ammonium FerrousSulfate Titration一、方法原理以磷酸为络合剂和溶解剂,在硫磷混酸中滴加硝酸助溶,样品分解完全后添加氧化剂硝酸铵将Mn2+氧化到Mn3+的磷酸络合物,再用硫酸亚铁铵标准溶液滴定Mn3+,其反应式如下:2mg钛,0.2mg铈,0.1mg五氧化二钒、铬(III)对锰的干扰不明显,但其量高时需加以校正。
本方法适合于矿石中1%以上锰的测定。
二、试剂配制1、苯代邻氨基苯甲酸指示剂(2g/L):0.2g溶于100ml2g/L的碳酸钠溶液中。
2、重铬酸钾标准溶液(C(1/6K2Cr2O7)=0.02000mol/L):准确称取0.9806g重铬酸钾(150℃干燥2hour)基准试剂,加水溶解定容至1000ml。
3、硫酸亚铁铵标准溶液(CFe2+=0.02mol/L):称取8g硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]溶于1000ml硫酸(1+19)中(混浊时需过滤),储存于棕色瓶中。
4、标定:吸取0.02mol/L的K2Cr2O7标准液20.00ml于250ml三角瓶中,加水50ml,H3PO420ml,1+1H2SO410ml,用待标定溶液滴定至浅黄色,滴加2滴N-苯代邻氨基苯甲酸作指示剂,逐滴滴至亮绿色为终点。
三、分析步骤称取0.2000g样品于250ml三角瓶中,加少量水润湿,加入20ml磷酸、10ml 硫酸(1+1)、3-5ml硝酸,置于电热板上加热,待冒白烟时可沿着烧瓶壁滴加硝酸助溶(若样品难容),直至黑色退去、液体平静无气泡。
待硝酸黄烟冒尽,开始冒硫酸白烟时煮沸2-3min,至白烟冒到瓶颈,取下稍冷2-3min(溶液约230℃),加入3.0gNH4NO3,充分摇荡使Mn3+生成完全,用洗耳球吹尽黄烟,冷却至70℃左右,沿着瓶壁加入50ml水(加水时溶液温度不能太低,尽量加水时冒气泡),摇动使稠状物溶解,流水冷却至室温,用硫酸亚铁铵标准溶液滴定至淡红色,滴加2滴N-苯代邻氨基苯甲酸,继续滴定至亮绿色即为终点。
用重铬酸钾标定硫酸亚铁铵滴定液

y = 0.999 9 x + 4 E-06 R = 1用重铬酸钾标定硫酸亚铁铵滴定液张 涛!张 静!耿可聪(华北制药康欣有限公司,河北 石家庄 050015)[ 摘 要] 以重铬酸钾为基准物标定硫酸亚铁铵滴定液,将标定结果与法定标准(硫酸铈法)做对照,通过相关分析表明,两种方法完全一致。
该方法具有简便、快速、准确的特点。
[ 关键词] 重铬酸钾;硫酸亚铁铵滴定液;相关系数 [ 中图分类号] O 655.2[ 文献标识码] B[ 文章编号] 1003-5095(2008)08-0076-02中国药典 2005 年版规定硫酸亚铁铵滴定液的标定方法为硫酸铈法[1]。
该法为间接标定,硫酸铈滴定 液还需用基准物三氧化二砷(俗称砒霜)来标定。
药典 的方法不仅复杂、难操作,而且用到剧毒品,对人对环 境有较大危害。
本文用重铬酸钾标定硫酸亚铁铵滴定 液,并将滴定结果与硫酸铈法做了对照。
化二砷为基准物[1]。
2 结果与分析取硫酸亚铁铵滴定液高、中、低共 5 个浓度点,分别用重铬酸钾法和硫酸铈法标定(表 1)。
表 1 两种方法标定硫酸亚铁铵滴定液的浓度(单位:mol/L ) 浓度点1 2 3 4 5 0.104 7 0.104 7 0.104 6 0.103 8 0.103 7 0.103 6 0.102 1 0.102 0 0.102 2 0.100 2 0.100 1 0.100 3 0.0771 7 0.0771 50.0771 61 1. 1 实验原理重铬酸钾法 4 次平行 6 Fe(NH 4)2(SO 4)2+K 2Cr 2O 7+7 H 2SO 4=3 Fe 2(SO 4)3+Cr 2(SO 4)3+K 2SO 4+6 (NH 4)2SO 4+7 H 2O实验材料重铬酸钾:基准物质,天津市化学试剂研究所;硫0.104 70.103 6 0.102 1 0.100 2 0.0771 5 重铬酸钾 法平均值 0.104 7 0.103 7 0.102 1 0.100 2 0.0771 61. 2 硫酸铈法 平均值0.104 6 0.103 7 0.102 1 0.100 3 0.0771 42. 1 直观分析由表 1 可知,每个浓度点 4 次平行的相对偏差均不大于 0.1%,这符合中国药典对平行实验精密度的 要求。
硫酸亚铁铵滴定液的配制与标定

硫酸亚铁铵标准滴定液C[(N H4)2F e2(SO4) 2]= 0.1 mol/L
1.1配制:
称取40克硫酸亚铁铵[(NH4)2Fe2(SO4) 2·6H2O],溶于300毫升硫酸溶液(20%)中,加700毫升水,摇均。
1.2 标定:
量取35.00毫升~40.00毫升配制好的硫酸亚铁铵溶液,加25毫升无氧的水,用高锰酸钾标准滴定液 [C(1/5KMnO4)=0.1 mol/L]滴定至溶液呈粉红色,并保持30秒,临用前标定。
硫酸亚铁铵标准滴定液的浓度{C[(NH4)2Fe2(SO4) 2]},数值以摩尔每升(mol/L)表示,按式(16)计算:
C[(NH4)2Fe2(SO4) 2]= V1 c1/V (16)
式中:
c1----高锰酸钾标准滴定液的浓度的准确数值,单位为摩尔每升(mol/L);
V1---高锰酸钾标准滴定液的体积的数值,单位为毫升(ml);
V---硫酸亚铁铵溶液的体积的准确数值,单位为毫升(ml);
操作步骤:
2g样品200ml容量瓶250ml锥形瓶,加0.4mol/L的重铬酸钾50ml,加
15ml浓硫酸于沸水浴中加热氧化30min冷却,稀释至约100ml,加3滴邻菲罗林指示剂3滴滴定(由橙色经绿色变为砖红色为终点):同时做空白。
计算公式:。
硫酸亚铁铵标准溶液的标定

硫酸亚铁铵标准溶液的标定硫酸亚铁铵是一种常用的化学试剂,它在实验室中被广泛应用于分析化学和环境监测等领域。
为了确保实验结果的准确性,我们需要对硫酸亚铁铵标准溶液进行标定。
本文将介绍硫酸亚铁铵标准溶液的标定方法及实验步骤。
首先,准备所需试剂和设备。
我们需要准备一定浓度的硫酸亚铁铵溶液、稀硫酸、氢氧化钠溶液、氯化铁溶液、二氧化硫气体、滴定管、烧杯、酸碱指示剂等。
其次,进行硫酸亚铁铵标准溶液的标定。
首先,取一定体积的硫酸亚铁铵溶液放入烧杯中,加入适量稀硫酸和氢氧化钠溶液,使其达到中性。
然后,加入氯化铁溶液作为指示剂,滴定二氧化硫气体至溶液中出现浅黄色为止。
记录滴定所需的二氧化硫气体体积V1。
接下来,取一定体积的硫酸亚铁铵溶液放入烧杯中,加入适量稀硫酸和氢氧化钠溶液,使其达到中性。
然后,加入氯化铁溶液作为指示剂,滴定二氧化硫气体至溶液中出现浅黄色为止。
记录滴定所需的二氧化硫气体体积V2。
最后,计算硫酸亚铁铵标准溶液的浓度。
根据滴定所需的二氧化硫气体体积V1和V2,可以利用滴定反应的化学方程式计算出硫酸亚铁铵的浓度。
在实验中,需要注意以下几点。
首先,实验操作要准确无误,尽量避免误差的产生。
其次,实验过程中要注意安全,避免发生意外。
最后,实验结束后要及时清理实验台和设备,保持实验环境的整洁。
总之,硫酸亚铁铵标准溶液的标定是一项重要的实验工作,它直接关系到实验结果的准确性。
只有通过严格的实验操作和准确的计算,才能得到准确的硫酸亚铁铵标准溶液浓度,为后续实验工作奠定基础。
希望通过本文的介绍,能够对硫酸亚铁铵标准溶液的标定有所帮助。
硫酸亚铁铵滴定重铬酸钠反应方程式

硫酸亚铁铵滴定重铬酸钠反应方程式硫酸亚铁铵滴定重铬酸钠反应方程式1. 硫酸亚铁铵滴定重铬酸钠是化学分析实验中常见的一种滴定反应。
在这个实验中,硫酸亚铁铵(Fe(NH4)2(SO4)2·6H2O)用作滴定试剂,而重铬酸钠(Na2Cr2O7)则是被滴定物质。
这个反应是通过观察滴定终点,从而确定被滴定物质的含量或浓度。
2. 在这个实验中,硫酸亚铁铵与重铬酸钠发生的化学反应可以用方程式来表示:Fe(NH4)2(SO4)2·6H2O + K2Cr2O7 + H2SO4 → Fe2(SO4)3 +Cr2(SO4)3 + Cr2O3 + H2O + K2SO4 + (NH4)2SO43. 从这个方程式可以看出,硫酸亚铁铵和重铬酸钠在酸性条件下发生反应,生成了硫酸铁和铬(III)盐,同时还生成了一些氧化铬和水,以及一些盐类。
4. 通过观察滴定的终点,可以确定被滴定物质的浓度。
在实验中,一般会使用铁离子指示剂来观察滴定终点的变化。
当被滴定液中的重铬酸钠被滴定完毕时,反应液的颜色会发生显著的变化,这时就可以确定滴定的终点。
5. 这个实验不仅可以用于确定重铬酸钠的浓度,还可以用于分析含铁物质的成分。
在实际应用中,硫酸亚铁铵滴定重铬酸钠的方法被广泛应用于工业生产和科学研究中。
6. 个人观点:硫酸亚铁铵滴定重铬酸钠是一种非常重要的化学分析方法,通过这种方法可以准确地确定被滴定物质的含量和浓度,对于科学研究和工业生产具有非常重要的意义。
总结:通过本文的介绍,我们了解了硫酸亚铁铵滴定重铬酸钠的反应方程式和实验原理,以及其在化学分析中的应用。
这种滴定方法不仅可以确定重铬酸钠的含量,还可以用于分析含铁物质的成分。
希望本文能够帮助大家更深入地理解这一化学分析方法的原理和应用。
在化学分析领域中,滴定是一种常见的实验方法,可以用于确定溶液中特定物质的浓度或含量。
硫酸亚铁铵滴定重铬酸钠是其中一种重要的滴定方法,广泛应用于工业生产和科学研究领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本液临用前应标定浓度。
标
定
基准试剂名称:硫酸铈滴定液(0.1mol/L)
步骤:
精密量取本液25ml,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。根据硫酸铈滴定液(0.1mol/L)的消耗量,算出本液的浓度,即得。
要求:1.校正因子:0.95~1.05 2.精密度:相对平均偏差(D)≤0.1%
标
化
称量记录
溶液与浓度
起始
读数
终止
读数
实耗体积(ml)
计算
F值
D
结论
该滴定液浓度为
mol/L
复核Βιβλιοθήκη 标化员复核员复
标
该滴定液浓度为
mol/L
复
核
标化员
复核员
备注
滴定液配制及标化记录
编号:011
滴定液名称:硫酸亚铁铵配制数量:配制日期:年月日
基准试剂名称:硫酸铈滴定液(0.1mol/L)标化温度:标化日期:年月日
标化指示剂名称:邻二氮菲复标温度:复标日期:年月日
配
制
方法依据:《中国药典2005版》二部附录
步骤:取硫酸亚铁铵g,溶于预先冷却的ml硫酸和ml水的混合液中,加水适量使成
