硫酸亚铁铵滴定法
硫酸亚铁铵滴定重铬酸钾颜色变化原理

硫酸亚铁铵滴定重铬酸钾颜色变化原理一、引言硫酸亚铁铵滴定重铬酸钾是一种常用的化学分析方法,常用于测定含有氧化剂的物质的浓度。
在此过程中,颜色变化是非常重要的指示剂。
本文将详细介绍硫酸亚铁铵滴定重铬酸钾颜色变化原理。
二、实验原理1. 氧化还原反应硫酸亚铁铵与重铬酸钾反应是一种氧化还原反应。
其中,硫酸亚铁铵为还原剂,可以将六价铬离子还原为三价铬离子;而重铬酸钾则是氧化剂,在反应中被还原为三价钒离子。
2. 颜色变化在滴定过程中,当所有的六价铬离子被还原为三价离子后,溶液会发生颜色变化。
这是因为三价离子和六价离子具有不同的吸收光谱。
在六价离子存在时,溶液呈现出橙红色;而当所有的六价离子被还原成三价离子后,溶液呈现出绿色。
三、实验步骤1. 准备溶液将重铬酸钾溶解在水中,加入硫酸亚铁铵,并用水稀释至一定浓度。
2. 滴定过程将待测物质加入滴定瓶中,并加入适量的硝酸。
然后,使用硫酸亚铁铵溶液滴定,直到溶液颜色变为绿色。
3. 计算结果根据滴定过程中使用的硫酸亚铁铵溶液的体积和浓度,可以计算出待测物质中氧化剂的浓度。
四、实验注意事项1. 实验操作应谨慎,避免发生意外事故。
2. 滴定过程应当仔细观察颜色变化,并在颜色变化后立即停止滴定。
3. 滴定过程中使用的所有试剂均应为纯净试剂,以保证实验结果的准确性。
4. 实验室应该保持良好的通风环境,避免有毒气体对人体造成危害。
五、总结通过本文的介绍,我们了解了硫酸亚铁铵滴定重铬酸钾颜色变化的原理和实验步骤。
在实验中,我们需要注意操作细节,以确保实验结果的准确性和安全性。
该方法可以用于测定含有氧化剂的物质的浓度,是一种常用的化学分析方法。
硫酸亚铁铵滴定液

本液临用前应标定浓度。
标
定
基准试剂名称:硫酸铈滴定液(0.1mol/L)
步骤:
精密量取本液25ml,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。根据硫酸铈滴定液(0.1mol/L)的消耗量,算出本液的浓度,即得。
要求:1.校正因子:0.95~1.05 2.精密度:相对平均偏差(D)≤0.1%
标
化
称量记录
溶液与浓度
起始
读数
终止
读数
实耗体积(ml)
计算
F值
D
结论
该滴定液浓度为
mol/L
复核Βιβλιοθήκη 标化员复核员复
标
该滴定液浓度为
mol/L
复
核
标化员
复核员
备注
滴定液配制及标化记录
编号:011
滴定液名称:硫酸亚铁铵配制数量:配制日期:年月日
基准试剂名称:硫酸铈滴定液(0.1mol/L)标化温度:标化日期:年月日
标化指示剂名称:邻二氮菲复标温度:复标日期:年月日
配
制
方法依据:《中国药典2005版》二部附录
步骤:取硫酸亚铁铵g,溶于预先冷却的ml硫酸和ml水的混合液中,加水适量使成
硫酸亚铁铵滴定法

硫酸亚铁铵滴定法
采用磷酸及高氯酸溶样,氧化至高价态,然后用硫酸亚铁铵滴定就可以了。
试样用磷酸分解后,以硝酸银作催化剂,用过硫酸铵将二价锰氧化至七价锰,以硫酸亚铁铵标准溶液滴定。
其反应式如下:
2Mn2+ + 5S2O82- + 8H2O =AgNO3= 2MnO4- + 10SO4 + 16H+
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
铬、钒、铈定量干扰。
本法适用于1%以上锰的测定。
【分析步骤】
称取0.2000g试样于300mL锥形瓶中,加15mL磷酸,3~5mL硝酸,置于高温电炉上(360℃)加热溶解,在溶解过程中不断摇动,使试样分解,一直加热至瓶内液面平静无气泡,取下,冷至70℃左右,加100mL水溶解稠状物,加入1mL 10g/L硝酸银,10~15mL 200g/L过硫酸铵溶液,4粒玻璃珠,加热煮沸7min,取下,在流水中冷却至室温,用硫酸亚铁铵标准溶液滴定至浅红色,加入3~4滴苯代邻氨基苯甲酸指示剂,继续滴定至亮黄绿色,即为终点。
【注意事项】
加热煮沸的时间应严格控制,如煮沸时间太短,过剩的氧化剂未完全破坏,使结果偏高,煮沸时间太长,形成的高锰酸易分解,使结果偏低。
因此,煮沸时间以出现大气泡后开始计算,再保持7min为宜。
【计算】
Mn(%)=100TV/G
式中
T—滴定度,与1mL硫酸亚铁铵标准溶液相当的以克表示的锰的质量,g;
V—滴定时消耗硫酸亚铁铵标准溶液的体积,mL;
G—称取试样量,g。
硫酸亚铁铵滴定法测定铬铁矿中全铬含量

硫酸亚铁铵滴定法测定铬铁矿中全铬含量李丹;常文林【摘要】摘要研究了硫酸亚铁铵滴定法测定铬铁矿中全铬含量的主要影响因素.采用过氧化钠碱融法分解试样,控制铬铁矿试样粒度在0.12 mm以下,将试样置于600℃熔融12 min,在试样的硫磷混酸介质中,选择加入5 mL过硫酸铵溶液(200 g/L)作为氧化剂,实验中选择不加入催化剂硝酸银.采用硫酸亚铁铵滴定法测定不同品位铬铁矿的全铬含量,测定结果的相对标准偏差(RSD,n=8)在0.30%~0.53%,且与标准样品值相符.方法操作流程简单,精密度和准确度均能够满足铬铁矿中全铬含量的分析要求.【期刊名称】《中国无机分析化学》【年(卷),期】2018(008)006【总页数】5页(P50-54)【关键词】铬铁矿;硫酸亚铁铵;全铬;滴定法【作者】李丹;常文林【作者单位】瑞木镍钴管理(中冶)有限公司,北京100013;瑞木镍钴管理(中冶)有限公司,北京100013【正文语种】中文【中图分类】O655.2前言金属铬因其优越的耐热性、热强性、耐磨性等物化性质,作为合金剂在工业中得到广泛的应用。
铬铁矿是冶炼铬铁合金的主要原料[1],按照铬铁矿质量等级的不同,其工业用途可以划分为冶金级、化工级、耐火级和铸石级[2]。
铬含量是衡量铬铁矿质量等级的一项重要的指标,决定了其实际用途。
位于南北回归线范围内的巴布亚新几内亚Ramu矿区,由于特殊的地质因素,以及特有的气候及地形地貌,形成了储量上亿吨的大型氧化型红土型镍矿矿石[3],其矿床中就伴生有铬[4],伴生的铬以粗粒铬铁矿的状态嵌布在矿石中,达到回收要求。
项目通过把来矿送至选矿厂进行重选分离和磁选分离,形成了12万t/a的铬精矿产品的生产能力。
铬铁矿各组分含量的快速准确测定,对生产工艺及产品的贸易销售具有重要的现实意义。
铬矿中杂质元素的测定方法有很多[5-7],但其重要质量指标,铬含量的测定通常采用硫酸亚铁铵容量法[8],本实验在有关文献报道的基础上[9],结合现场铬铁矿的实际情况,研究了铬铁矿的粒度控制、分解方法、熔样温度和时间、过硫酸铵的用量、硝酸银的用量、共存元素的干扰等因素对硫酸亚铁铵容量法测定铬铁矿中全铬含量的影响。
铬含量的测定方法有哪些

铬含量的测定方法有哪些,各自的原理是什么硫酸亚铁铵滴定法)在硫酸溶液中,以硝酸银作催化剂,用过硫酸铵将3价铬氧化为6价铬,锰同时被氧化为高锰酸。
溶液中出现紫红色时表示铬已氧化完全。
然后加入少量的氯化钠,煮沸破坏高锰酸,再用硫酸亚铁铵标准溶液滴定。
其反应式如下:2Cr3++3S2O82-+7H2O AgNO3 Cr2O72-+6SO42-+14H+Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O铈、钒对测定有干扰,钒在0.5%以上的,可用高锰酸钾反滴定的方法消除。
铈可采用校正数的办法予以扣除(1.00%的铈相当于0.124%铬)。
在氧化前应避免氯离子的引入。
本法适用于0.1%以上铬的测定。
【试剂配制】苯代邻氨基苯甲酸指示剂 0.2g指示剂溶于100mL 2g/L碳酸钠溶液中。
硫酸亚铁铵标准溶液 c(Fe2+)≈0.02mol/L称取8g硫酸亚铁铵(FeSO4(NH4)2SO4·6H2O)溶于1L5%(V/V)硫酸中(如混浊须过滤),贮于棕色瓶中。
标定:量取30.00mL硫酸亚铁铵标准溶液于300mL锥形瓶中,加水50mL,20mL 硫-磷混酸,5mL盐酸,3滴5g/L二苯胺磺酸钠指示剂,用0.02mol/L 1/6K2Cr2O7标准溶液滴定至稳定的紫色,即为终点。
【分析步骤】(1)碱熔。
称取0.5000~1.0000g试样于铁坩埚(银、镍或高铝坩埚)中,加入6~8g过氧化钠,混匀,放入650℃左右的高温炉上,加热熔融,待熔融物呈透明状态后保持1~2min。
取下冷却,移入盛有150mL水的400mL烧杯中(应迅速盖上表皿,防止溅出)。
待熔融物浸出后,用水洗出坩埚,滴加硫酸(1+1)中和至沉淀完全溶解后,再过量10~15mL,加入5mL磷酸,加热煮沸,将留下的铁皮溶解后取下,用水稀释至250mL左右。
加入1mL10g/L硝酸银溶液,15~20mL新鲜配制的200g/L过硫酸铵溶液,加热煮沸至高锰酸紫红色出现后再煮沸10~15min,以驱尽氯气,取下。
二氧化化氯 dpd-硫酸亚铁铵滴定法反应方程式

二氧化化氯dpd-硫酸亚铁铵滴定法反应方程式随着我国水质处理技术的不断提高,二氧化氯(ClO2)作为一种高效、安全的消毒剂,已在我国得到了广泛应用。
然而,如何准确测定水中二氧化氯的浓度成为了一个关键技术问题。
DPD-硫酸亚铁铵滴定法作为一种灵敏、可靠的测定方法,已在我国水质监测领域取得了良好的应用效果。
本篇文章将对DPD-硫酸亚铁铵滴定法反应方程式及实验操作步骤进行详细阐述,以期为水质监测工作者提供有益参考。
1.二氧化氯简介二氧化氯,化学式为ClO2,是一种黄绿色、具有强烈氧化性的气体。
在水处理领域,二氧化氯具有消毒、灭藻、去除有机物等多种功能,已成为取代氯气的理想消毒剂。
2.DPD-硫酸亚铁铵滴定法原理DPD-硫酸亚铁铵滴定法是基于二氧化氯与硫酸亚铁铵反应生成硫酸铁铵的原理进行测定。
在酸性条件下,二氧化氯将硫酸亚铁铵氧化为硫酸铁铵,同时自身被还原为氯离子。
反应过程中,溶液颜色发生变化,通过观察颜色变化,可判断二氧化氯浓度。
3.反应方程式2ClO2 + 5Fe2+ + 5H+ → 2Cl- + 5Fe3+ + 2H2O4.实验操作步骤(1)配制标准溶液:精确称取一定量的二氧化氯粉末,加入水中溶解,制备成已知浓度的标准溶液。
(2)准备试剂:称取适量的DPD试剂和硫酸亚铁铵试剂,分别配制成溶液。
(3)滴定:将标准溶液置于滴定瓶中,开启滴定泵,以硫酸亚铁铵溶液为滴定剂,进行滴定。
(4)观察颜色变化:在滴定过程中,观察溶液颜色的变化,当溶液由黄色变为浅红色,且半分钟内颜色不再发生变化,视为滴定终点。
(5)计算浓度:根据滴定过程中消耗的硫酸亚铁铵溶液量,计算出二氧化氯的浓度。
5.注意事项(1)实验过程中应严格控制滴定条件,确保测定结果的准确性。
(2)配制标准溶液时,注意称取二氧化氯粉末的精度,以免影响溶液浓度。
(3)在滴定过程中,应充分振摇滴定瓶,确保反应充分进行。
(4)实验结束后,对所用仪器和试剂进行妥善处理,防止污染环境。
二氧化化氯 dpd-硫酸亚铁铵滴定法反应方程式

二氧化化氯dpd-硫酸亚铁铵滴定法反应方程式摘要:I.引言A.二氧化氯的简介B.DPD-硫酸亚铁铵滴定法的简介II.反应方程式A.反应物和生成物的化学式B.反应的化学方程式III.滴定过程中的反应A.滴定反应的步骤B.滴定终点的判断IV.结论A.滴定法在二氧化氯分析中的应用B.滴定法的优点和局限性正文:I.引言二氧化氯是一种广泛应用于水处理、消毒和漂白等领域的化学物质。
为了确保其质量和效果,需要对二氧化氯进行精确的分析。
DPD-硫酸亚铁铵滴定法是一种常用的分析方法,它能够准确地测量二氧化氯的含量。
II.反应方程式A.反应物和生成物的化学式二氧化氯(ClO2)与亚铁离子(Fe2+)和氢氧根离子(OH-)发生反应,生成铁离子(Fe3+)和水(H2O)。
ClO2 + 2Fe2+ + 2OH- = 2Fe3+ + Cl- + H2OB.反应的化学方程式根据反应物和生成物的化学式,可以得到反应的化学方程式为:1 ClO2 + 2 FeSO4 + 2 NaOH = 2 Fe2(SO4)3 + Na2SO4 + H2O其中,FeSO4 是硫酸亚铁铵,NaOH 是氢氧化钠。
III.滴定过程中的反应A.滴定反应的步骤1.取一定量的二氧化氯样品,加入适量的硫酸亚铁铵和氢氧化钠,使其充分反应。
2.用标准盐酸溶液滴定反应液,直到滴定终点。
B.滴定终点的判断滴定终点的判断依据是颜色变化。
当滴加盐酸溶液后,反应液的颜色由黄色变为橙红色,并在半分钟内不褪色,即可判断为滴定终点。
IV.结论DPD-硫酸亚铁铵滴定法是一种准确、灵敏的分析方法,广泛应用于二氧化氯的含量测定。
然而,该方法也存在一些局限性,如对反应条件的要求较高,需要严格控制滴定过程中的pH 值、温度等因素。
硫酸亚铁铵滴定法测定钛铝钒合金中钒

硫酸亚铁铵滴定法测定钛铝钒合金中钒周礼仙【摘要】应用硫酸亚铁铵滴定法测定钛铝钒合金中钒时,存在试样较难溶解且试样中较高含量钛易水解干扰终点颜色判断的问题.实验采用硝酸-氢氟酸-硫酸体系溶解试样,通过加入氢氧化钠使其与基体钛发生反应生成三钛酸钠沉淀的方法实现了钛与钒的分离,于硫-磷混酸介质中,用高锰酸钾将滤液中的钒全部氧化为五价钒,以亚硝酸钠还原过量的高锰酸钾,再用尿素分解多余的亚硝酸钠,以N-苯代邻氨基苯甲酸为指示剂,用硫酸亚铁铵标准溶液滴定钒,建立了硫酸亚铁铵滴定法测定钛铝钒合金中钒的方法.共存元素干扰试验说明试样中的共存元素不干扰测定.将实验方法应用于测定两个钛铝钒合金试样中的钒(质量分数在3% ~6% 之间) ,结果的相对标准偏差(RSD,n=6)为0. 20% 和0. 25%.按照实验方法测定6个钛铝钒合金试样中钒,结果与火焰原子吸收光谱法(FAAS)测定值相一致.%There were some problems during determination of vanadium in titanium-aluminum-vanadium al-loy by ammonium ferrous sulfate titrimetry .For example ,the sample was hardly dissolved .Moreover ,the high-content titanium in sample was easily hydrolyzed ,which would interfere with the judgment of color at titration endpoint .After the sample was dissolved in nitric acid-hydrofluoric acid-sulfuric acid system ,so-dium hydroxide was added to react with matrix titanium to form sodium trititanate precipitate ,realizing the separation of titanium and vanadium .In mixed sulfuric acid-phosphoric acidmedium ,vanadium in fil-trate was fully oxidized to pentavalent vanadium with potassium permanganate .The excessive potassium permanganate was reduced with sodium nitrite ,and then the excessive sodium nitrite wasdecomposed with urea .The content of vanadium was titrated with ammonium ferrous sulfate standard solution with N-phe-nylanthranilic acid as indicator .Consequently ,a determination method of vanadium in titanium-aluminum-vanadium alloy was established by ammonium ferrous sulfate titrametry .The interference tests of coexis-ting elements indicated that the coexisting elements in the sample did not interfere with the determination . The content of vanadium with mass fraction in range of 3%-6% in two titanium-aluminum-vanadium alloy samples was determined according to the experimental method .The relative standard deviation (RSD,n=6) was 0.20% and 0.25%,respectively .The proposed method was applied for determination of vanadium in six titanium-aluminum-vanadium alloy samples ,and the results were consistent with those obtained by flame atomic absorption spectrometry (FAAS).【期刊名称】《冶金分析》【年(卷),期】2018(038)006【总页数】5页(P70-74)【关键词】钛铝钒合金;钒;硫酸亚铁铵;滴定法【作者】周礼仙【作者单位】攀钢集团研究院有限公司,钒钛资源综合利用国家重点实验室,四川攀枝花 617000【正文语种】中文钛铝钒合金是银白色的金属,无毒,具有优良的耐蚀性、小的密度、高的比强度及较好的韧性和焊接性等一系列优点,常用在医疗、航空、石化等高端领域。
硫酸亚铁铵容量法测定矿石中的钒

硫酸亚铁铵滴定法测定钒The Determination of Vanadium by Ferrous Ammonium Sulfate Titration Method一、方法原理在硫磷混酸分解样品后,以硫酸亚铁铵还原铬酸及其他氧化性物质,此时钒也同时被还原,再用高锰酸钾将钒氧化成五价。
在尿素存在下,过量的高锰酸钾用亚硝酸钠还原除去,以N-苯基邻氨基苯甲酸为指示剂,用硫酸亚铁铵标准滴定至亮绿色即为终点。
根据硫酸亚铁铵标准溶液的消耗量,换算出钒的含量。
其反应式如下:5V2O2(SO4)2+2KMnO4+22H2O10H3VO4+K2SO4+2MnO4+7H2O5NaNO2+2KMnO4+3H2SO45N3+2MnSO4+3H2O(NH2)2CO+2NaNO2+H2SO4CO2+2N2+NaSO4+3H2O2FeSO4+2HVO3+3H2SO4Fe3(SO4)3+2(VO)SO4+4H2O大量铀和钼的存在使测定结果偏高,低含量铀和钼对测定的干扰不显著。
钨的影响可被磷酸络合而掩蔽。
在不含磷酸的硫酸介质中氧化钒(IV)时,铈(III)不干扰。
如用高氯酸冒烟氧化钒(IV),也只能氧化钒(IV)而不能氧化铈(III)。
本方法适用于含钒量在0.05%以上的五氧化二钒测定。
二、试剂配制硝酸、磷酸、硫酸。
高锰酸钾:0.5%水溶液。
尿素:10%水溶液。
亚硝酸钠:1%水溶液。
N-苯基邻氨基苯甲酸指示剂(0.2%):称取N-苯基邻氨基苯甲酸0.2g,置于0.2%碳酸钠溶液100ml中,加热溶解,过滤后使用。
重铬酸钾标准溶液(C1/6K2Cr2O7=0.002500mol/L):称取已烘干(150℃干燥2hour)的基准重铬酸钾0.1226g,溶于少量水中,移入1000ml容量瓶中,稀释至刻度,摇匀使用。
硫酸亚铁铵标准溶液(C Fe2+=0.002500mol/L):称取6水硫酸亚铁铵1.0000g,溶于300ml水中,加硫酸(1+1)100ml,用水稀释至1000ml容量瓶中,摇匀后使用。
2020版《中国药典》硫酸亚铁铵滴定液配制与标定操作规程
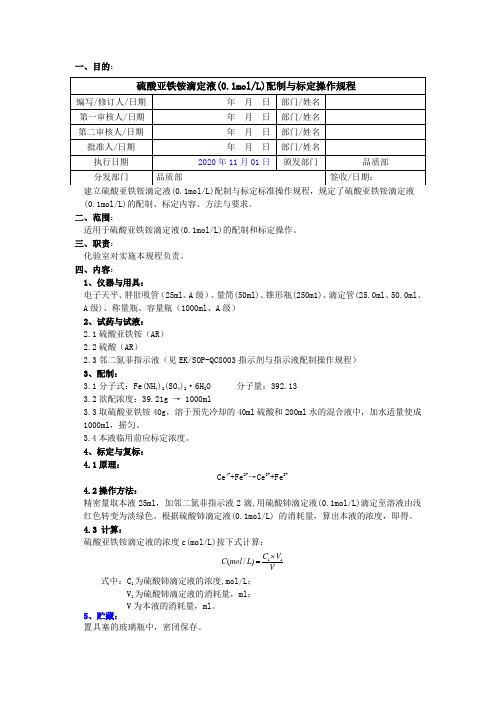
一、目的:(0.1mol/L)的配制、标定内容、方法与要求。
二、范围:适用于硫酸亚铁铵滴定液(0.1mol/L)的配制和标定操作。
三、职责:化验室对实施本规程负责。
四、内容:1、仪器与用具:电子天平、胖肚吸管(25ml 、A 级)、量筒(50ml)、锥形瓶(250m1)、滴定管(25.0ml 、50.0ml 、A 级)、称量瓶、容量瓶(1000ml 、A 级)2、试药与试液:2.1硫酸亚铁铵(AR )2.2硫酸(AR )2.3邻二氮菲指示液(见EK/SOP-QC8003指示剂与指示液配制操作规程)3、配制:3.1分子式:Fe(NH 4)2(SO 4)2·6H 2O 分子量:392.133.2欲配浓度:39.21g → 1000ml3.3取硫酸亚铁铵40g ,溶于预先冷却的40ml 硫酸和200ml 水的混合液中,加水适量使成1000ml ,摇匀。
3.4本液临用前应标定浓度。
4、标定与复标:4.1原理:Ce 4++Fe 2+→Ce 3++Fe 3+4.2操作方法:精密量取本液25ml ,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。
根据硫酸铈滴定液(0.1mol/L) 的消耗量,算出本液的浓度,即得。
4.3 计算:硫酸亚铁铵滴定液的浓度c(mol/L)按下式计算:VV C L mol C 11)/(⨯=式中:C 1为硫酸铈滴定液的浓度,mol/L ;V 1为硫酸铈滴定液的消耗量,ml ;V 为本液的消耗量,ml 。
5、贮藏:置具塞的玻璃瓶中,密闭保存。
五、参考文献:《中国药典》2020年版四部通则8006 P431 六、相关文件:EK/SOP-QC8003指示剂与指示液配制操作规程七、相关记录:N/A八、变更记录及原因:。
矿石中钒的测定:硫酸亚铁铵滴定法测

矿石中钒的测定:硫酸亚铁铵滴定法测试样经硫磷混酸溶解后以硫酸亚铁铵溶液还原铬酸及其它氧化性物质,此时钒也同时被还原,再用高锰酸钾溶液将钒氧化成高价,过量高锰酸钾溶液用尿素-亚硝酸钠还原除去,以苯代邻氨基苯甲酸作指示剂,用硫酸亚铁铵标准溶液滴定。
其反应如下:V2O2(SO4)2+2KMnO4+22H2O=10H3VO4+K2SO4+7H2SO4+2MnSO45NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+3H2O+K2SO4(NH4)2CO+2NaNO2+H2SO4=CO2+2N2+NaSO4+3H2O2FeSO4+2HVO3+3H2SO4=Fe2(SO4)3+2(VO)SO4+4H2O大量铀与钼的存在使测定结果偏高,低含铀钼对测定的干扰不显著。
钨的影响可被磷酸络合而掩蔽,在不含磷酸的酸介质中氧化钒(Ⅳ)时,铈(Ⅲ)不干扰。
如用高氯酸冒烟氧化钒(Ⅳ)时,也只能氧化钒(Ⅳ)而不氧化铈(Ⅲ)。
本法适用于矿中0.05%以上五氧化二钒的测定。
试剂配制:硫酸亚铁铵溶液(49g/L):称取40克硫酸亚铁铵溶于1000mL硫酸(1+19)中。
苯代邻氨基苯甲酸指示剂(2g/L):0.2克指示剂溶于100mL2g/L碳酸钠溶液中。
硫磷混酸:在500mL水中加入150mL硫酸,冷却后加入150mL磷酸,以水稀释至1000mL重铬酸钾标准溶液[c (1/6K2CrO7)=0.002500mol/L]:称取0.1226克重结晶并于150℃烘过1h的重铬酸钾,加少量水溶解后移入1000mL容量瓶中,以水定容。
硫酸亚铁铵标准滴定溶液(0.0025 mol/L):称取1克六水硫酸亚铁铵溶于1000mL硫酸(1+19)中混匀。
标定:移取50.00mL硫酸亚铁铵标准滴定溶液于250mL三角瓶中加入50mL水,加入10mL盐酸及15 mL硫磷混酸,加入3滴5g/L二苯胺磺酸钠指示剂,用重铬酸钾标准溶液[c(1/6K2CrO7)=0.002500mol/L]滴定至微紫色即为终点。
锰的测定(硫酸亚铁铵滴定法)

锰的测定-硫酸亚铁铵滴定法一、硝酸铵作为氧化剂原理:本法以磷酸为溶解剂和络合剂,在浓的热磷酸介质中,在硝酸铵或高氯酸将锰(II )氧化到锰(III )的络合物,以苯代邻氨基苯甲酸为指示剂,亚铁标准溶液滴定锰(III )。
其反应式如下:2 Mn 2+ + NO 3- + 4 PO 3-4 + 2 H+ = 2[Mn (PO 4)2]3- + NO 2- + H 2O NO 2- +NH 4+ = N 2 + 2 H 2O或14 Mn 2+ + 2ClO 4- + 28 PO 3-4 +16 H + =14[Mn (PO 4)2]3- + Cl 2 + 8 H 2O2 mg 钛、0.2 mg 铈、0.1 mg 五氧化二钒、铬(III )对锰的干扰不显著,但其量高时,需加以校正。
试剂配制:苯代邻氨基苯甲酸指示剂:0.2g 指示剂溶于100 mL 2g /L 碳酸钠溶液中。
硫酸亚铁铵标准溶液:c ( Fe 2+ ) ≈ 0.02 mol /L ,称取8 g 硫酸亚铁铵[Fe(NH 4)2 (SO 4)2·6 H 2O]溶于1 L5%(V/V )硫酸中(如混浊须过滤),储存于棕色瓶中。
标定:量取30.00 mL 硫酸亚铁铵标准溶液于300 mL 锥形瓶中,加水50 mL ,20 mL 硫-磷混酸,5 mL 盐酸,3滴5 g/L 二苯胺磺酸钠指示剂,用0.02 mol/L 1/6 K 2Cr 2O 7 标准溶液滴定至稳定的紫色,即为终点。
分析步骤:称取0.2000 g 试样于300 mL 锥形瓶中,加15 mL 磷酸,3~5 mL 硝酸,置于高温电炉上(360℃)加热溶解,在溶解过程中不断摇动,使试样分散,一直加热至瓶内液面平静无气泡,取下,稍冷2~3 min (此时瓶内尚冒微烟,温度约230℃),加入2g 硝酸铵,并充分摇动使锰(III )生成完全,用洗耳球吹风驱尽黄色气体,冷至70℃左右,加入50 m L 5%(V/V )硫酸,摇动使稠状物溶解,流水冷却至室温,用硫酸亚铁铵标准溶液滴定至浅红色,滴加3~4滴苯代邻氨基苯甲酸指示剂,继续滴定至亮黄绿色,即为终点。
硫酸亚铁铵滴定法测定锰

硫酸亚铁铵滴定法测定锰Determination of Manganese by Ammonium FerrousSulfate Titration一、方法原理以磷酸为络合剂和溶解剂,在硫磷混酸中滴加硝酸助溶,样品分解完全后添加氧化剂硝酸铵将Mn2+氧化到Mn3+的磷酸络合物,再用硫酸亚铁铵标准溶液滴定Mn3+,其反应式如下:2mg钛,0.2mg铈,0.1mg五氧化二钒、铬(III)对锰的干扰不明显,但其量高时需加以校正。
本方法适合于矿石中1%以上锰的测定。
二、试剂配制1、苯代邻氨基苯甲酸指示剂(2g/L):0.2g溶于100ml2g/L的碳酸钠溶液中。
2、重铬酸钾标准溶液(C(1/6K2Cr2O7)=0.02000mol/L):准确称取0.9806g重铬酸钾(150℃干燥2hour)基准试剂,加水溶解定容至1000ml。
3、硫酸亚铁铵标准溶液(CFe2+=0.02mol/L):称取8g硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]溶于1000ml硫酸(1+19)中(混浊时需过滤),储存于棕色瓶中。
4、标定:吸取0.02mol/L的K2Cr2O7标准液20.00ml于250ml三角瓶中,加水50ml,H3PO420ml,1+1H2SO410ml,用待标定溶液滴定至浅黄色,滴加2滴N-苯代邻氨基苯甲酸作指示剂,逐滴滴至亮绿色为终点。
三、分析步骤称取0.2000g样品于250ml三角瓶中,加少量水润湿,加入20ml磷酸、10ml 硫酸(1+1)、3-5ml硝酸,置于电热板上加热,待冒白烟时可沿着烧瓶壁滴加硝酸助溶(若样品难容),直至黑色退去、液体平静无气泡。
待硝酸黄烟冒尽,开始冒硫酸白烟时煮沸2-3min,至白烟冒到瓶颈,取下稍冷2-3min(溶液约230℃),加入3.0gNH4NO3,充分摇荡使Mn3+生成完全,用洗耳球吹尽黄烟,冷却至70℃左右,沿着瓶壁加入50ml水(加水时溶液温度不能太低,尽量加水时冒气泡),摇动使稠状物溶解,流水冷却至室温,用硫酸亚铁铵标准溶液滴定至淡红色,滴加2滴N-苯代邻氨基苯甲酸,继续滴定至亮绿色即为终点。
硫酸亚铁铵滴定法快速测定不锈钢原料铬铁合金中铬含量

143管理及其他M anagement and other硫酸亚铁铵滴定法快速测定不锈钢原料铬铁合金中铬含量陈 瑶,李 轩,伍 换,李孟宽(阳江海关综合技术服务中心,广东 阳江 529500)摘 要:为研究硫酸亚铁铵滴定法快速测定不锈钢原料铬铁合金中铬含量,本文采用过氧化钠碱熔融法熔化高碳铬铁标样,置于660℃熔融9min,在硫磷酸介质条件下,用硫酸亚铁铵滴定法测定其铬的含量,结果与标准样品值相符。
方法操作流程简单,精密度和准确度均能够满足铬铁合金中铬含量的分析要求。
关键词:铬铁合金;硫酸亚铁铵;铬;滴定法中图分类号:X781.1 文献标识码:A 文章编号:11-5004(2021)07-0143-2 收稿日期:2021-04作者简介:陈瑶,女,生于1990年,汉族,广东人,本科,化学工程与工艺助理工程师,研究方向:化学检验。
铬铁合金按其含碳量可分为高碳铬铁、中碳铬铁、低碳铬铁、微碳铬铁和超微碳铬铁,而高碳铬铁是生产不锈钢的重要原料。
在炼钢工艺中,铬能改善钢的抗氧化性、耐蚀性,200系不锈钢含铬量约在16%,300系不锈钢含铬量约在25%,400系不锈钢含铬量约在14%[1]。
因此,铬含量是衡量不锈钢质量的一项重要指标,决定其实际用途。
本文采用过氧化钠碱熔融法分解高碳铬铁标样,用硫酸亚铁铵滴定法测定其铬的含量,也对影响铬铁合金中快速测定铬的各种因素进行了选择试验,该方法反应现象明显,操作条件易掌握。
1 实验部分1.1 仪器和试剂过氧化钠;磷酸;硫酸(1+1);高锰酸钾溶液(1g/L);氯化钠溶液(100g/L);N-苯基邻氨基苯甲酸指示剂(2g/L,溶于2g/L 无水碳酸钠溶液);硫酸亚铁铵标准滴定溶液(0.1000mol/L)。
上述溶液所用试剂均为分析纯,试验用水为超纯水。
普兰德 AS 级滴定管(50mL)。
硫酸亚铁铵标准滴定溶液(0.1000mol/L)按GB/T601-2016[2]方法标定。
固体废物 六价铬的测定 硫酸亚铁铵滴定法验证报告

固体废物六价铬的测定硫酸亚铁铵滴定法验证报告《固体废物六价铬的测定硫酸亚铁铵滴定法验证报告》一、引言固体废物是当前社会普遍存在的环境问题,其中六价铬作为一种有害物质,对环境和人体健康造成了严重威胁。
对固体废物中六价铬的准确测定显得至关重要。
本文将深入探讨硫酸亚铁铵滴定法在六价铬测定中的应用,并根据实际验证报告进行详细分析和总结。
二、硫酸亚铁铵滴定法的原理和操作步骤硫酸亚铁铵滴定法是一种常用的测定六价铬的方法。
其原理是利用硫酸亚铁铵与六价铬在酸性条件下反应生成三价铬,然后用助滴定剂硝基丁酸去氧剂进行滴定。
操作步骤主要包括样品的预处理、硫酸亚铁铵滴定和助滴定剂的使用等。
通过多次实验验证,这种方法被证实能够准确、快速地对固体废物中的六价铬进行测定。
三、实验验证报告我们在实验室中进行了多次固体废物样品中六价铬的测定实验。
首先对样品进行了预处理,包括样品的溶解和配制标准溶液等。
然后按照硫酸亚铁铵滴定法的步骤进行了滴定,并记录下了每次实验的滴定体积和滴定终点。
通过计算和分析数据,最终得出了固体废物中六价铬的浓度,同时也验证了硫酸亚铁铵滴定法的准确性和可靠性。
四、总结与回顾在本次实验中,我们深入探讨了固体废物中六价铬的测定方法,并进行了实验验证。
通过实验数据的分析,我们可以得出结论:硫酸亚铁铵滴定法是一种适用于固体废物中六价铬测定的可靠方法,具有准确度高、操作简便等优点。
我们也意识到在实际操作中需要严格控制实验条件,以确保测定结果的准确性。
五、个人观点与理解从本次实验中,我对固体废物六价铬的测定硫酸亚铁铵滴定法有了更深刻的理解。
通过探讨和实验验证,我认识到了这种测定方法的重要性和实用性,同时也意识到了环境保护和资源利用的重要性。
在未来的工作和学习中,我将更加重视环境问题,并努力探索更多对固体废物进行准确测定的方法,为环境保护作出更大的贡献。
六、结语本文深入探讨了固体废物中六价铬的测定方法,并根据实验验证报告进行了详细分析和总结。
nn二乙基对苯二胺硫酸亚铁铵滴定法

nn二乙基对苯二胺硫酸亚铁铵滴定法
二乙基对苯二胺硫酸亚铁铵滴定法是一种常用的测定有机物中酮和醛的分析方法。
其原理是通过二乙基对苯二胺与酮或醛反应生成有色化合物,然后使用硫酸亚铁铵溶液滴定解离,使有色化合物发生颜色变化,从而确定酮或醛含量。
具体步骤如下:
1. 将待测物溶解在适量的无水醚溶剂中,得到待测物溶液。
2. 取一定量的二乙基对苯二胺溶液,加入到已知量的硫酸亚铁铵溶液中,制备二乙基对苯二胺-硫酸亚铁铵试剂。
3. 将待测物溶液逐滴加入二乙基对苯二胺-硫酸亚铁铵试剂中,使之发生反应,生成有色化合物。
颜色的变化是由于酮和醛与二乙基对苯二胺反应生成吸收特定波长的化合物,从而导致溶液的颜色变化。
4. 当溶液颜色变化明显,且持续不变时,停止滴定。
5. 硫酸亚铁铵滴定试剂的用量根据需要测定物质的浓度而定,通过二乙基对苯二胺-硫酸亚铁铵试剂消耗量来推算待测物中
酮或醛的含量。
需要注意的是,该方法对于含有烯丙基或芳环结构的醛和酮,可能会产生干扰或不适用。
因此,在具体的实际应用中,需要根据待测物的特性和目的选择合适的分析方法。
二氧化化氯 dpd-硫酸亚铁铵滴定法反应方程式

二氧化化氯 dpd-硫酸亚铁铵滴定法反应方程式一、引言在水处理行业中,二氧化氯 dpd-硫酸亚铁铵滴定法反应方程式是一个重要的研究领域。
这种反应方程式对水质测量和水处理过程有着至关重要的作用。
本文将从深度和广度两方面对这一主题进行全面评估,并撰写一篇有价值的文章,以便读者能够更深入地理解这一反应方程式的原理和应用。
二、二氧化氯 dpd-硫酸亚铁铵滴定法反应方程式的基本原理二氧化氯 dpd-硫酸亚铁铵滴定法反应方程式是通过一系列化学反应来测量水中二氧化氯的浓度。
该反应方程式包括了二氧化氯与dpd指示剂、硫酸亚铁铵等物质之间的化学反应过程。
通过此反应方程式,可以准确地测量二氧化氯的含量,为水质监测和水处理提供了重要的数据支持。
三、二氧化氯 dpd-硫酸亚铁铵滴定法反应方程式的操作步骤1. 准备好所需的化学试剂和仪器设备;2. 将水样加入反应瓶中,并加入适量的dpd指示剂;3. 在适当的条件下,加入硫酸亚铁铵试剂;4. 观察并记录反应的颜色变化;5. 通过比色计或其他仪器设备,测量反应液的吸光度,并计算出二氧化氯的浓度。
四、二氧化氯 dpd-硫酸亚铁铵滴定法反应方程式的应用领域二氧化氯 dpd-硫酸亚铁铵滴定法反应方程式在水处理厂、游泳池、饮用水生产等领域有着广泛的应用。
通过该反应方程式,可以准确测量水中二氧化氯的含量,及时采取相应的水处理措施,保障水质安全。
五、个人观点和理解在我看来,二氧化氯 dpd-硫酸亚铁铵滴定法反应方程式在水质监测中起着至关重要的作用。
它不仅可以准确测量二氧化氯的含量,还可以为水质治理和改善提供重要的数据支持。
深入研究和理解这一反应方程式对于水处理行业的发展至关重要。
六、总结通过本文的全面评估,我们对二氧化氯 dpd-硫酸亚铁铵滴定法反应方程式有了更深入的理解。
该反应方程式在水质监测和水处理过程中具有重要的应用价值,需要我们更加重视和深入研究。
在知识的文章格式中,本文将以序号标注,多次提及二氧化氯 dpd-硫酸亚铁铵滴定法反应方程式,以便读者能够更全面、深刻和灵活地理解这一主题。
二氧化化氯 dpd-硫酸亚铁铵滴定法反应方程式

二氧化化氯dpd-硫酸亚铁铵滴定法反应方程式
摘要:
1.二氧化氯的介绍和用途
2.DPD-硫酸亚铁铵滴定法的原理
3.反应方程式的书写规则
4.二氧化氯与DPD-硫酸亚铁铵滴定法的反应方程式
正文:
1.二氧化氯的介绍和用途
二氧化氯(ClO2)是一种无色至淡黄色的气体,具有较强的氧化性。
它广泛应用于自来水消毒、纸浆漂白、水质净化等领域,是一种高效、环保的消毒剂。
2.DPD-硫酸亚铁铵滴定法的原理
DPD(4-氯-3-硝基苯酚)是一种常用的氧化还原指示剂,硫酸亚铁铵滴定法则是一种常用的氧化还原滴定方法。
该方法通过添加硫酸亚铁铵溶液,与待测物质发生氧化还原反应,从而实现对物质的含量测定。
3.反应方程式的书写规则
在书写反应方程式时,需要遵循质量守恒定律、电荷守恒定律和得失电子相等原则。
同时,要注意标注反应条件、物质的聚集状态以及反应物和生成物的化学式。
4.二氧化氯与DPD-硫酸亚铁铵滴定法的反应方程式
根据氧化还原反应的原理,二氧化氯与DPD-硫酸亚铁铵滴定法可以发生如下反应:
ClO2 + 2DPD + 4H+ →2Cl- + 2DOPA + 2H2O
其中,ClO2 为二氧化氯,DPD 为4-氯-3-硝基苯酚,H+为氢离子,Cl-为氯离子,DOPA 为对苯二酚。
硫酸亚铁铵滴定法

硫酸亚铁铵滴定法9 适用范围本标准适用于不和废水中高浓度(大于1mg/L )总络的测定。
10 原理在酸性溶液中:以银盐作崔化剂,用过硫酸铵将三价铬氧化成六价铬。
加入少量氯化钠并煮沸,除了过量的过硫酸铵及反应中产生的氯气。
以苯基代邻氨基苯甲酸做指示剂,用硫酸亚铁铵溶液滴定,使六价铬还原为三价铬,溶液呈绿色为终点。
根据硫酸亚铁铵溶液的用量,计算出样品中总铬的含量。
钒对测定有干扰,但在一般含铬废水中钒的含量在允许限以下。
11 试剂在测定过程中,除非另有说明,均使用符合国家标准或专业标准的分析纯试剂和蒸馏水或同等纯度的水。
11.1 5%(V/V )硫酸溶液。
取硫酸(4.2)100ml 缓慢加入到2L 水中,混匀。
11.2 磷酸(H3PO4,ρ=1.69g/ml)。
11.3 硫酸--磷酸混合液:取150ml 硫酸(4.2)缓慢加入到700ml 水中,冷却后,加入150ml 磷酸(11.2)混匀。
11.4 过硫酸铵〔(NH 4)2S 2O 8〕:250g/L 溶液。
11.5 铬标准溶液:称取于110︒C 干燥2h 的重铬酸钾(K 2Cr 2O 7,优级纯)0.5658±0.0001g,用水溶解后,移入1000ml 溶量瓶中,加入稀释至标线,摇匀。
此溶液lml 含0.2mg 铬。
11.6硫酸亚铁铵溶液。
称取硫酸亚铁铵〔(NH4)2Fe(SO4)2·6H2O〕3.95 0.01g,用500ml硫酸溶液(11.1)溶解,过滤至2000ml溶量瓶中,用硫酸溶液(11.1)稀释至标线。
临用时,用铬标准溶液(11.5)标定。
标定:吸取三份各25.0ml铬标准溶液(11.5)置500ml锥形瓶中,用水稀释至200ml左右。
加入20ml硫酸--磷酸混合液(11.3),用硫酸亚铁铵溶液(11.6)滴定至淡黄色。
加入3滴苯基代邻氨基苯甲酸指标剂(11.12),继续滴定至溶液由线色突变为亮绿色为终点,记录用量V。
硫酸亚铁铵滴定法测定氮化铬铁中铬

硫酸亚铁铵滴定法测定氮化铬铁中铬曹晨;焦凤菊;郭英英;张卫平【摘要】将氮化铬铁样品的粒度研磨至75 μm,称样量为0.05 g,依次用15 mL磷酸、1 mL氢氟酸和10 mL硫酸消解样品后,在冒硫酸烟时滴加5~6 mL硝酸重复氧化充分破坏氮化物,硝酸银催化,20 mL过硫酸铵溶液氧化,氯化钠溶液还原,煮沸至溶液的红色消失;为使滴定终点颜色突变更明显,在控制溶液酸度在2.0~2.5 mol/L的情况下,加入N-苯代邻氨基苯甲酸指示剂,用硫酸亚铁铵标准溶液滴定铬;从而建立了酸溶-硫酸亚铁铵滴定法测定氮化铬铁中铬的方法.实验方法用于测定4种氮化铬铁标准样品中铬,结果的相对标准偏差(RSD,n=6)为0.26%~0.55%,测定值与认定值相吻合.按照实验方法测定4个氮化铬铁样品中铬,并与过氧化钠碱熔-滴定法的测定结果进行比对,两种方法的测定结果相一致.【期刊名称】《冶金分析》【年(卷),期】2016(036)006【总页数】5页(P77-81)【关键词】硫酸亚铁铵滴定法;氮化铬铁;铬;酸溶【作者】曹晨;焦凤菊;郭英英;张卫平【作者单位】第一拖拉机股份有限公司工艺材料研究所,河南洛阳471004;第一拖拉机股份有限公司工艺材料研究所,河南洛阳471004;第一拖拉机股份有限公司工艺材料研究所,河南洛阳471004;第一拖拉机股份有限公司工艺材料研究所,河南洛阳471004【正文语种】中文铬是合金钢及合金铸铁中最重要的合金元素之一,同时也是非合金钢中常见的残余元素。
钢中添加铬元素,能改善钢的机械性能和耐磨性,提高其硬度、弹性、抗磁性和抗张力[1]。
氮化铬铁中铬主要以氮化铬的形式存在,其化学性质特别稳定,因此很不容易分解。
在以往测定铬铁中铬的方法中,一般采用过氧化钠高温熔融法[2-5]处理样品。
采用此方法,样品前处理时间较长,所用的镍坩埚容易受到过氧化钠的腐蚀,成本较高,而且在洗出熔块过程中易引进许多杂质元素,在测定过程中有元素干扰,测定较复杂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸亚铁铵滴定法
9 适用范围
本标准适用于不和废水中高浓度(大于1mg/L )总络的测定。
10 原理
在酸性溶液中:以银盐作崔化剂,用过硫酸铵将三价铬氧化成六价铬。
加入少量氯化钠并煮沸,除了过量的过硫酸铵及反应中产生的氯气。
以苯基代邻氨基苯甲酸做指示剂,用硫酸亚铁铵溶液滴定,使六价铬还原为三价铬,溶液呈绿色为终点。
根据硫酸亚铁铵溶液的用量,计算出样品中总铬的含量。
钒对测定有干扰,但在一般含铬废水中钒的含量在允许限以下。
11 试剂
在测定过程中,除非另有说明,均使用符合国家标准或专业标准的分析纯试剂和蒸馏水或同等纯度的水。
11.1 5%(V/V )硫酸溶液。
取硫酸(4.2)100ml 缓慢加入到2L 水中,混匀。
11.2 磷酸(H3PO4,ρ=1.69g/ml)。
11.3 硫酸--磷酸混合液:取150ml 硫酸(4.2)缓慢加入到700ml 水中,冷却后,加入150ml 磷酸(11.2)混匀。
11.4 过硫酸铵〔(NH 4)2S 2O 8〕:250g/L 溶液。
11.5 铬标准溶液:称取于110︒C 干燥2h 的重铬酸钾(K 2Cr 2O 7,优级纯)
0.5658±0.0001g,用水溶解后,移入1000ml 溶量瓶中,加入稀释至标线,摇匀。
此溶液lml 含0.2mg 铬。
11.6硫酸亚铁铵溶液。
称取硫酸亚铁铵〔(NH
4)
2
Fe(SO
4
)
2
·6H
2
O〕3.95 0.01g,用500ml硫酸溶液
(11.1)溶解,过滤至2000ml溶量瓶中,用硫酸溶液(11.1)稀释至标线。
临用时,用铬标准溶液(11.5)标定。
标定:吸取三份各25.0ml铬标准溶液(11.5)置500ml锥形瓶中,用水稀释至200ml左右。
加入20ml硫酸--磷酸混合液(11.3),用硫酸亚铁铵溶液(11.6)滴定至淡黄色。
加入3滴苯基代邻氨基苯甲酸指标剂(11.12),继续滴定至溶液由线色突变为亮绿色为终点,记录用量V。
三份铬标准溶液所消耗硫酸亚铁铵溶液的毫升数的极差值不应超过0.05ml,取其平均值。
按式(2)计算:
T == (2)
式中: T––––硫酸亚铁铵溶液对铬的滴定度,mg/ml。
11.7硫酸锰:10g/L溶液。
将硫酸锰(MnSO
4·2H
2
O)1g溶于水并稀释至100ml。
11.8硝酸银:5g/L溶液。
将硝酸银(AgNO
3
)0.5g溶于水并稀释至100ml。
11.9无水碳酸钠:50g/L溶液。
将无水碳酸钠(Na
2CO
3
)5g溶于水并稀释至100ml。
11.10氢氧化铵:1+1溶液。
取氨水(ρ=0.90g/ml)加入等体积水中,混匀。
11.11氯化钠:10g/L溶液。
将氯化钠(NaCl)1g溶于水并稀释至100ml。
11.12苯基代邻氨基苯甲酸指示剂。
称取苯基代邻氨基苯甲酸(Phenylan thranilic acid)0.27g溶于5ml碳酸钠溶液(11.9)中,用水稀释至250ml。
12步骤
12.1测定
吸取适量样品于150ml烧杯中,按7.1.2步骤消解后转移至500ml锥形瓶中,(如果样品清澈、无色,可直接取适量样品于500ml锥形瓶中)。
用氢氧化铵溶液(11.10)中和至溶液pH为1~2。
加入20ml硫酸--磷酸混合液(11.3)、1~3滴硝酸银溶液(11.8)、0.5ml硫酸锰溶液(11.7)、25ml过硫酸铵溶液(11.4),摇匀,加入几粒玻璃珠。
加热至出现高锰酸盐的紫红色,煮沸10min。
取下稍冷,加入5ml氯化钠溶液(11.11),加热微沸10~15min,除尽氯气。
取下迅速冷却,用水洗涤瓶壁并稀释至220ml左右。
加入3滴苯基代邻氨基苯甲酸指示剂(11.12),用硫酸亚铁按溶液(11.6)滴定至溶液由红色突变为绿。
色即为终点,记下用量V
1
注:←应注意掌握加热煮沸时间,若加热煮沸时间不够,过量的过硫酸铵及氯气未除尽,会使结果偏高;若煮沸时间太长,溶液体积小,酸度高,可能使六价铬还原为三价铬,使结果偏低。
↑苯基代邻氨基苯甲酸指示剂,仅用和样品积相同的水代替样品。
12.2空白试验
按12.1步骤进行空白试验,仅用和样品体积相同的水代替样品。
13结果表示
13.1 计算方法
总铬含量C
(mg/L)按式(3)计算:
2
c
= (3)
2
式中:––––滴定样品时,硫酸亚铁铵溶液(11.6)用量,ml;
––––空白试验时,硫酸亚铁铵溶液(11.6)用量,ml;
–––––硫酸亚铁铵溶液(11.6)对铬的滴定度,mg/ml;
–––––样品的体积,ml。
